Contents
Precision and Personalized Medicine: How Genomic Approach Improves the Management of Cardiovascular and Neurodegenerative Disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC7397223/
Published online 2020 Jul 6
オリアーナ・ストリアーネーゼ1,2 フランチェスカ・リッツォ2 ミケーレ・チッカレッリ3 ジェンナーロ・ガラッソ3 イレーニア・ダゴスティーノ2 アンナマリア・サルバーティ2 カルマイン・デル・ジュディーチェ1 パオラ・テソリオ4 マリア・ロザリア・ルスチアーノ1,3,*
要旨
平均寿命はこの100年で徐々に伸びていた。このことは、高齢化の進展と慢性疾患の負担増との相関関係があるため、医療費に大きな影響を与えている。このため、医療予算を改善するためには、慢性疾患を持つ患者をどのように管理するかが重要な課題となっている。効果的な一次予防は、有望なルートであると考えられる。この目的のためには、個別化医療とともに、臨床症状が現れる前に病理学的プロセスを調査し、患者を管理するための標的治療を選択するための医師の指針とするために、精密さが有用な手段となる。心血管疾患や神経変性疾患は、疾患発生のあらゆる段階に適用される精密医療技術を最大限に活用するのに適したモデルである。人工知能を組み込んだハイテク技術の利用可能性と生物医学研究の分野での進歩は、遺伝子、エピジェネティック修飾、加齢、栄養、薬剤、マイクロバイオームおよびその他の環境因子が健康や慢性疾患にどのように影響を与えうるかを理解する上で実質的なものとなっている。本レビューの目的は、高死亡率と莫大な医療費を伴うこれらのタイプの障害の臨床的・生物学的複雑性を、精密医療と個別化医療がどのようにしてより明確にすることができるのかを、適用可能な方法を詳細に記述することによって取り上げることである。これは、予防戦略のための貴重なツールや疾患の進化に関する手がかりを提供し、罹患率や死亡率を予測したり、疾患の経過のずっと早い段階で慢性疾患の指標を検出したりするのに役立つかもしれない。これはもちろん、患者さんのケアの質と生活の質を向上させ、時間的な努力と医療費を削減することに大きな効果があると考えられる。
キーワード:精密医療、個別化医療、臨床応用、ゲノミクス
1. はじめに
過去100年の間に、平均寿命は徐々に伸びていた[1]。
今日では、歴史上初めて、ほとんどの人が60代以降まで生きることが期待できるようになった。人口高齢化は世界的に最も重要な人口動態の特徴の一つであり[2]、社会のあらゆる側面に影響を与えなが et al 21世紀の最も重要な社会変革の一つとなる準備ができている[3,4]。急速に高齢化する人口の主要な結果の1つは [5] 、加齢に伴う慢性疾患の負担の増加と関連する医療費の増加である [6]。高齢化社会に関連する最も一般的な慢性疾患は、心血管疾患、糖尿病、神経変性疾患、ほとんどの癌である[7]。複雑な慢性疾患の管理は、世界の高齢者人口にとって深刻な社会的・経済的問題となっており、国内外の医療予算にとって大きな課題となっている[8]。
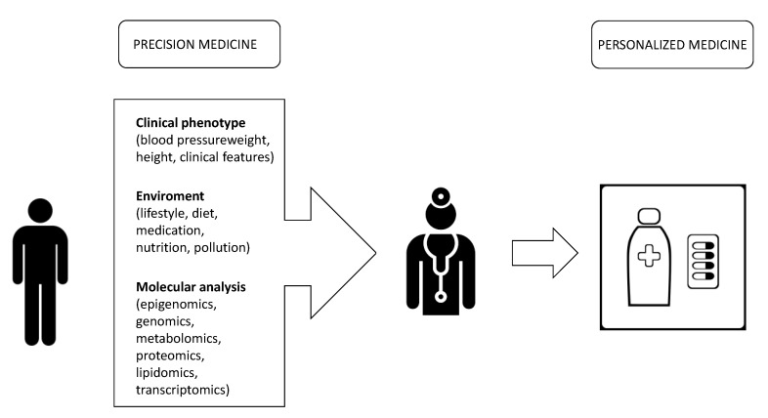
一般的なコンセンサスは、これらのタイプの疾患は、臨床症状が現れる何年も前から病理学的プロセスが始まっていることを実証している効果的な一次予防によって取り組むのが最善であるというものである。効果的な一次予防は困難である。ゲノム研究への投資が拡大していることから、がんやその他の慢性疾患への感受性を研究し、新たな予防的介入を促進するための生物医学への効果に大きな期待が寄せられている[9]。医療にとっての野心的な課題は、より個別化されたアプローチから始まるターゲットを絞ったケアパスを保証することである。この目標を達成するために、ゲノム時代には、ゲノム、バイオインフォマティクス、新しい分子技術の融合により、図1に示すように、多くの疾患の遺伝的基盤に関する理解が向上することが約束されている。この理解が深まれば、より高い分解能で疾患メカニズムを再定義することが可能になり、それに伴い、より正確な治療法による標的化が可能になる[10](例えば、発症を予防して早期発見を可能にし、患者の特性に合わせた治療法を提供することが可能になる[11])。
図1
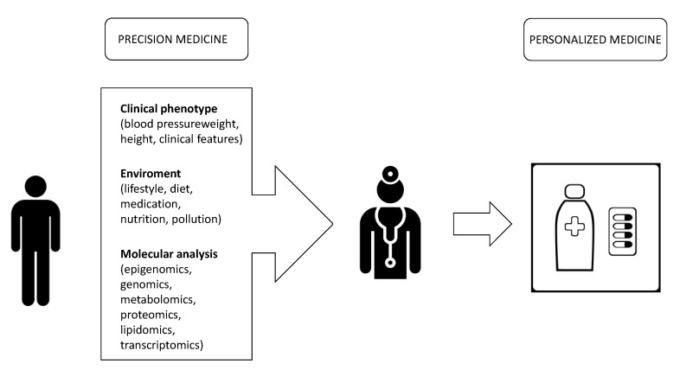
医療にとっての野心的な課題は、より個別化されたアプローチから始まり、ターゲットを絞ったケアパスを保証することである。この目標を達成するためには、患者に対するマルチレベルのアプローチが必要である。分子レベルでは、マルチオミックスアプローチ(トランスクリプトノミクス、メタボロミクス、ゲノム、プロテオミクス、エピゴノミクス)により、疾患の元の原因から機能的な結果まで、患者の状態をより深く理解することができる。この情報は、「エクスポソーム」の研究と統合されるべきであり、個人が生活の中で経験した曝露の全体像とそれらの曝露が健康に与える影響と定義される(Wild CP. ゲノムを「エクスポソーム」で補完する。分子疫学における環境曝露測定の卓越した挑戦。Cancer Epidemiol Biomarkers Prev. 2005; 14(8):1847–1850). 患者の臨床的特徴の研究と合わせて、医師は個々の患者に合わせた個別化された治療法を考案することができる。
加齢に伴う変性疾患の中でも、心血管疾患と神経変性疾患は、世界的に入院、医療費、死亡率の大部分を占めている。これらの疾患の影響を受ける可能性がある人の数が多いため、医療システムに圧力がかかり、これらの非伝染性疾患の予防と治療のためのケア、サービス、および技術に対する需要が高まっている[12]。
これらの疾患に共通しているのは、何十年にもわたって発生する比較的ゆっくりとした発症であるということである。このため、これらの疾患は、必要な薬剤や機器へのアクセスが可能なさまざまな医療専門家によって調整された長期的かつ複雑な対応を必要とする [13] が、同時に、リスクのある患者を特定し、予防戦略を提供し、疾患メカニズムの経過の早期に治療を開始するための十分な機会を提供することができる [14]。
この目的のために、本レビューでは、神経変性疾患および心血管疾患に適用される精密で具体的な個別の治療プログラムの一部となりうる主要な構成要素を議論することが考えられてきた。我々は、精密医学を「遺伝子、環境、生活習慣の個人差を考慮に入れた疾患治療と予防のための新興のアプローチ」と定義し、この新しいアプローチに焦点を当てている[15]。
人口の高い死亡率リスクに関連する他の多くの疾患と同様に、精密医学を心血管疾患に適用することは、がんの分野で起こったように、健康を改善するだけでなく、予防と治療の選択肢に革命をもたらすことが期待されている。精密医療の臨床応用は、「予防は治療よりも優れている」という前提に基づいて、患者の個別化された治療を開発することで達成できる[16]。さらに、我々はまた、ルーチンの臨床実践への洞察を提供するために、これまでに実証された精密医学の新技術の潜在的な利点を実証することによって、これらの複雑な慢性疾患を管理するための個別化医療(PeM)と精密医学(PM)の違いを概説したいと思う。
2. 個別化医療と精密医療の違いとは?
精密対個別化医療 その違いとは?
精密医療が、心血管疾患や神経変性疾患の患者の管理のための個別化された治療にどのように応用できるかをよりよく理解するためには、まず個別化医療と精密医療の違いを明確にする必要がある。今日の生物医学研究の特徴は、原因を見つけ、個人に焦点を当て、詳細を明らかにするという最低限の共通項にある。これを個別化医療(PeM)アプローチ、最近では精密医療(PM)と定義している。
National Research Councilによると、「個別化医療」は「精密医療」に近い意味を持つ古い用語である[10]。しかし、この分野の核となる概念のいくつかは1960年代初頭から存在している[17]。
この2つの用語がしばしば交換して使われることは珍しくないが、個別化医療と精密医療の間には、患者への異なるアプローチを指す概念的な区別がある[10]。
ヒポクラテスは何千年も前に患者ケアのための個別化医療のアプローチを導入した[17]。彼は病気の個別性と、「異なる患者に異なる薬を与えることの必要性について書いている。
一般に、個別化医療とは、個々の患者のニーズに合わせた薬物療法や予防ケアの提供を改善するための医療であることが受け入れられている[20]。これは、個人の嗜好、信念、態度、知識、社会的文脈に特に注意を払いながら、個人の遺伝的およびエピジェネティック情報[21]を利用するアプローチを指す。
このアプローチは、新しい技術の使用に基づいており、個人の固有の分子プロファイルに依存しており、特定の疾患に対して脆弱になるものへの対応において重要な役割を果たしている[22]。
研究と臨床ケアの進歩とともに、個別化医療を可能にする政策は、医療アプローチを変え、結果的に医療システムも変革してきた [23]。より正確なツールを備えた医療センターや高度な専門家の間での共同ネットワークの構築により、意図した通りに薬に反応せず、従来の医療システムでは対応できなかった患者グループを対象とした治療プロトコルを開発することができるようになった[24]。
これにより、各患者にとって安全で効果的な治療法とそうでない治療法を予測する能力が向上してきている。
これまでのところ、標準的な治療の大きな制限の1つは、そのほとんどが「平均的な患者」[20]のために設計されており、同じ病気の症状を持つすべての患者が共通のパトフォ・フェノタイプを共有しており、したがって、同じように治療されるべきであると仮定されていることである[25]。この「ワンサイズフィットオール」アプローチ[26]の結果として、図2に示すように、ある患者では治療が非常に成功することもあれば、そうでない患者では治療が成功しないこともある。
図2
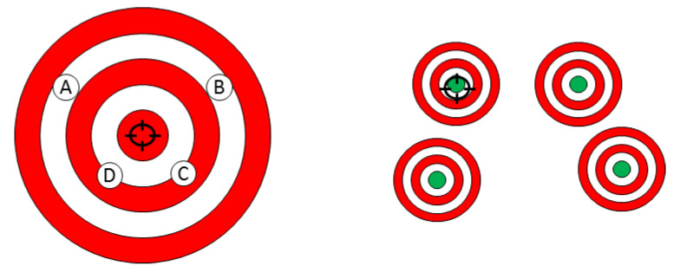
標準的なアプローチでは、同じ病気の症状を持つすべての患者は共通のパトフォ・フェノタイプを共有しており、したがって、同じように治療されるべきであると仮定している。目標である患者の回復を達成するために、医師は様々な治療法(ここではA,B,C,Dと表記)を自由に選択することができ、患者に適切な治療法を見つけるまで「テスト」しなければならない。これに対して、個別化医療は、患者さん一人ひとりに合った治療法を適切なタイミングで選択する能力を高めることを目的としている。
精密医療という言葉が非常によく使われるようになったのは最近のことであり、科学的な取り組みと政治的な取り組みによって可能になった[27]が、この概念は長年にわたって医療の一部であった。
2008年9月に発表された米国大統領執行部科学技術顧問会議の報告書[10]では、個別化医療という用語は「文字通り患者に固有の薬剤や医療機器を作成することを意味するのではなく、特定の疾患に対する感受性や特定の治療に対する反応が異なる小集団に個人を分類する能力を意味する」と明記されている[28]。
2015年1月、バラク・オバマ大統領が「プレシジョン・メディシン・イニシアチブ」[29]を立ち上げたとき、一般の人々が、改善方法、ヘルスケア、”人々がより長く、より幸せで、より健康的な生活を送れるようにする “方法に革命を起こす大胆な新しい取り組みとして、「プレシジョン・メディシン」[14,30]というより大きな概念に初めて触れることになった。
「精密医療」では、平均的な集団ではなく、定義された患者の小集団において、疾患の感受性を判断し、疾患の臨床経過を理解し、適切な薬剤や他の治療法を処方するために、固有の個人プロファイル(すなわち、遺伝学、暴露、ライフスタイル、および健康因子における個人差)に基づいて最適なケアを特定することに焦点が当てられている[25]。
精密医療の拡大は、疾患サブタイプの診断、定義、治療をより正確かつ正確に行うために、予測に重要なゲノミクス、生物学的データ、トランスクリプトミクス、プロテオミクスからの複数の情報源を利用することに基づいている[31]。
したがって、精密医療は、疾患をより高い分解能で定義し、新しい治療法で疾患のサブグループをより正確に標的化することを可能にする新しい医療戦略であり、顕著な例としては、嚢胞性線維症や癌が挙げられる[32]。
臨床症状が顕在化する前に特定できるバイオマーカーの発見と技術開発は、迅速なゲノム発見への道を開き、現在の医療アプローチを精密医療中心のものから、より包括的な精密健康への焦点へと転換させている[33]。
今後の精密医療は、医療提供者が、ゲノム配列、マイクロバイオーム構成、健康歴、ライフスタイル、食生活など、人々の固有の特徴に合わせて治療や予防戦略を調整することを可能にする。
3. シーケンス時代の概要
歴史的には、1975 年にサンガーによって DNA シーケンシング法の概念が導入され、研究と医療ゲ ノミクスの新しいパラダイムを切り開いた。長年にわたり、サンガー法はシーケンシングの中でも主要な方法として使用されており、13年の歳月をかけて2003年に終了したヒトゲノム計画の完成にも重要な役割を果たしている[35,36]。現在、この技術は単一遺伝子検査の診断に用いられるゴールドスタンダードなアプローチであるが、高コスト、感度の低下、時間的な制約から、低スループットのシーケンシングからハイスループットのシーケンシングへの移行が決定され、第二世代シーケンシング(2ndGS)別名次世代シーケンシング(NGS)または大規模並列シーケンシング時代として知られるようになった[37]。
NGSは、コストを削減し、数千から数百万のDNA配列をハイスループットかつ効率的に得ることができ、従来のサンガー法では達成できなかった結果が得られる可能性があることから、ヒトゲノムや関心のあるあらゆる生物を研究する能力を一変させた[37]。NGS技術の開発に参加した主な企業は、Sequencing by Synthesis (SBS)に基づく2つの異なる方法を通じて、Illumina、Roche 454,およびIon Torrent (Thermo Fisher, Waltham, MA, USA)であった。Roche 454とIon Torrentのアプローチは、ビーズ上にライゲーションされたDNA断片を「エマルジョンPCR」によってクローン増幅し、同じ分子の数千のコピーを生成する[38]。代わりに、イルミナによる固相増幅は、以前にフローセルの表面上でPCRによって増幅されたオリゴヌクレオチドの固定化に基づいており、「ブリッジ増幅」プロセスによってクラスター生成を開始する[39]。
ここ数年、MGI Tech Co. (MGI)は、ハイスループットシーケンサーの新たな競合メーカーとなった。MGI の技術は、ローリングサークル DNA 増幅(RCA)に基づくコンビナトリアルプローブアンカーライゲーション(Combinatorial Probe-Anchor Ligation: cPAL)[40] シーケンシングに基づいており、DNA ナノボール(DNB)と呼ばれるコンセタマー配列の最終構造を形成している。
シーケンシング技術の進歩は遺伝学研究に大きな影響を与え、ヒトゲノムの遺伝的変異とその健康や疾患への影響に関する知識を向上させた。遺伝性疾患の研究におけるこの新しいアプローチは、糖尿病、癌、心血管疾患や神経疾患などの多因子・多遺伝性疾患に関連する複雑な生物学的ネットワークの理解に革命をもたらした[41,42,43]。これらの技術はすべて、ゲノミクスと生物学的研究と医療診断の分野で急速に進歩し、これらの技術を「ベンチからベッドサイドまで」の方法で翻訳することを可能にした。個々のゲノムプロファイルは精密医療の重要な構成要素の一つであり、診断をカスタマイズしたり、治療患者の反応性を予測したりするために使用することができる。
4. 精密医療におけるNGSの応用
診断手順における NGS 技術の利点は、大量の情報を管理し、解釈することの難しさが遺伝子型-遺伝子型相関の未解決の問題であるとしても、データの速度、精度、および信頼性の向上である。NGSには、表1に示すように、体液(例えば、血液、唾液、脳脊髄液)や組織生検などの異なるDNA源からバリアントを同定することが可能な全ゲノムシークエンシング(WGS)全エクソームシークエンシング(WES)ターゲットシークエンシングなどの異なるアプリケーションが含まれる。さらに、NGSベースの検出方法は、希少で低頻度のバリアントを大規模に同定することを可能にし、入力DNAが少ないサンプルでのより高い分析感度を可能にするが、これは組織や生体液などの出発物質の入手性が悪い場合の特に重要な課題です[44]。
表1 さまざまなNGS戦略の主な用途、利点と限界
| 技術 | 対象地域 | 検出されたバリアント | 利点 | 制限事項 |
|---|---|---|---|---|
| WGS | ゲノム全体 | 〜4,000,000 |
|
|
| WES | ゲノムの2% | 〜20,000 |
|
|
| ターゲットパネル | いくつかの遺伝子 | 変数:パネルサイズによって異なります |
|
|
WGSは現在、ヒトの疾患に関与するすべての遺伝的変異を特定できる可能性を持つ、最も包括的な戦略である。生成されたデータは、コード化領域と非コード化領域を含むゲノム全体(約30億塩基)に拡張され、プロモーター、UTR、エンハンサーエレメント、クロマチンマークなどの調節領域における変異に関する追加情報を提供するだけでなく、大規模な構造変異、コピーナンバーバリアント(CNV)遺伝子融合、反転、欠失(indel)を確実に同定することができる[45]。通常、WGS実験では、1人当たり約300万~400万個のバリアントが同定されているが[46,47]、現在のところ、タンパク質コード領域外のバリアントを解釈することは非常に困難である。
WGSはゲノム変異のより網羅的な視点を提供するが、ターゲット・エンリッチメント戦略は、コストと利益のバランスを考慮した適切な代替手段であり、ここ数年で、先天性心疾患や神経変性疾患などの遺伝性疾患に関与する多くの駆動遺伝子や経路を同定するための一般的な方法となっている[48,49]。ターゲットシークエンシングでは、シークエンシングを行う前にDNAサンプルから特定のゲノム領域を捕捉することができるため、カバレッジが向上し、サンプルの多重化が容易になり、解析が容易になる。これらの手順は、2つの異なる選択戦略、すなわち、アンプリコンベースのアッセイおよびハイブリダイゼーションキャプチャーに基づいている。
マルチプレックスPCRは、アンプリコンベースの標的濃縮反応であり、ここでは、特定および標的領域に向けられた複数のプライマーが使用され、1本のPCR反応管内で複数の長距離PCRを並行して行うことができるようになっている[50]。非特異的なアンプリコンまたはプライマー干渉を生成する可能性を考慮すると、この方法のいくつかの制限は、最近RainDance Technologies (Hercules, CA, USA)によって、Digital PCR in droplets (ddPCR)を導入することによって克服された。この方法は、単一のPCR反応を可能にする単一のプライマー対を含む数百万個のマイクロ飛沫を生成するが[51]、同じアンプリコン内の複数の変異の存在を評価することができないなどのいくつかの制限がある。代替的なターゲット手順には、ターゲットDNAのフランク領域をアニーリングすることができる一本鎖DNAである分子インバージョンプローブ(MIP)の使用が含まれている。DNAポリメラーゼがターゲットとMIP配列の間のギャップを埋めると、アンプリコンはライゲーションされ、円形化され、円形化された断片のみの配列決定を可能にする [52]。
ハイブリダイゼーションキャプチャー戦略は、SureSelectやHaloPlex(Agilent Technologies, Santa Clara, CA, USA)Nextera(Illumina, San Diego, CA, USA)SeqCap(Roche, Basilea, Switzerland)などのターゲットエンリッチメント技術の基礎となっている[53]。これらの捕獲方法は、以前に断片化されたDNAサンプル中の標的領域を選択的にハイブリダイズさせる溶液中のDNAまたはRNA 5′ビオチン修飾オリゴヌクレオチドプローブ(ベイト)を使用する。磁性ストレプトアビジンビーズは、ビオチン化プローブの結合を可能にし、選択された領域は、配列決定の前にPCR反応によって濃縮される [54]。
Array Hybrid Captureに基づく標的濃縮戦略は、もともとヒトエクソーム全体のシークエンシングに使用されていた。現在では、PCRよりも高速で便利であり、したがって、エクソームに属する大量のデータでより良いパフォーマンスを発揮することから、WESシーケンシングは主に溶液中ハイブリダイゼーションキャプチャーによって行われている。
WESは、ヒトゲノム(約20,000遺伝子)の2%を占めるタンパク質をコードする領域に集中してシークエンシングを行うことができるが、個々のタンパク質の機能に影響を与える疾患関連変異の約85%を含んでいる必要がある[55]。WESのデータは通常、1人当たり約25,000個のコーディングバリアントを同定している[56]。この手法には、ヒトゲノムにアノテーションされていないタンパク質や、構造変異や潜在的なノンコーディング要素の変異を検出することができないという制限がある。これらの制限にもかかわらず、WESは多数のサンプルの並列スクリーニングを可能にし、出生前診断、異種疾患の原因となる駆動突然変異の検出、スクリーニング手順、および患者の治療管理に使用される迅速で信頼性の高い方法を提供するため、研究および臨床応用で広く使用されている[57]。
標的型NGSシーケンシングの進化により、ホットスポットまたはマルチジーンのカスタマイズされたパネルの導入により、これらの技術が臨床の基本的な部分となることが可能となった。現在では、いくつかの疾患に共通して関与しているよく研究された遺伝子を収集したパネルが多数販売されている。これらのパネルは、診断/プログノーシス手順、ファーマコゲノミクス、関連する変異疾患のスクリーニング、および個々の治療のための分子標的薬の選択に使用されている[58]。一例として、NGSベースの遺伝子パネルベースの検査は、日常診療における疾患患者の医学的調査のための主要な選択肢の一つである。この文脈では、より包括的なパネルの一つであるTruSight Cardio Panelは、174の遺伝子の遺伝的プロファイリングを測定し、心筋症、不整脈、大動脈疾患などの17の異なる遺伝性心疾患との関係を検証するように設計されている[59]。ここ数年、シーケンシング技術開発への注目と投資が高まり、第三世代の手法が登場し、その結果、第三世代シーケンシング(3rdGS)の始まりとなった。さらに、3rdGSは、高処理性DNAポリメラーゼによって長いリードを生成し、特に反復領域におけるゲノムアライメント分解能を向上させることを特徴としている。Pacific Biosciences社によって提案された最初の(3rdGS)商業化されたプラットフォームは、複製プロセス中の標識ヌクレオチドの蛍光検出に基づく単一分子リアルタイム(SMRT)シーケンシングを使用している[61]。ヌクレオチドの取り込みは、ゼロモード導波路(ZMW)と呼ばれる、一本鎖DNAテンプレートとDNAポリメラーゼ(後者はウェルの底に直接固定されている)を含むウェル内で行われる。発光が記録されると、ポリメラーゼは、次の標識されたdNTPの添加を可能にするために、背を向けられたdNTP結合フルオロフォアを切断する。
最近、Oxford Nanopore Technologies(Oxfors, UK) (ONT)は、MinIOnプラットフォームの開発により、TGSにナノポア技術を導入した。ナノポア・シーケンシングは、電解質溶液に浸したナノポア・メンブレンの穴の中をネイティブDNAやRNAが通過することで発生する電流の変化を、電位差をかけた状態で直接検出するものである。ヌクレオチド塩基の複数の組み合わせの通過による電流の特徴的な乱れを検出することで、解析された分子の配列を特定することが可能になる。
3rdGS技術に関連した改善は、読み取り品質の向上につながっているが、新鮮な出発材料や無傷の細胞などのいくつかの制限を克服するためには、大幅な進歩が必要とされている、さらに、高いシーケンシングエラー率に関連する問題
ロングリードシークエンシング技術は、デノボゲノムのアセンブリー[62]や複雑な構造を持つゲノムのシークエンシングにおいて特に効率的である。例えば、SMRTは、高い冗長性(GC塩基の約65.6%)またはX fragile syndrome(FXS)に関与する短いタンデムリピート(STP)を特徴とする結核菌ゲノムとしてのCGGの長い配列の配列決定を可能にした[63,64]。
NGSアプローチの実現可能性と汎用性は、この技術を精密医療の発展につながる臨床・診断分野に適したものにしている。とはいえ、NGSが患者診断や治療研究の標準的な調査手順となるためには、膨大な量のデータの管理と解釈、結果の実装、サンプル調製のための作業時間の短縮、ユーザーフレンドリーな解析ソフトウェアの開発など、克服すべき多くの課題が残されている。
4.1. 神経変性疾患
神経変性疾患(ND)は、神経細胞の機能が徐々に失われ、人間の脳の正常な活動が徐々に損なわれていく慢性疾患の幅広いグループである。これらのタイプの障害に罹患した患者は、記憶喪失、言語障害、および運動障害を含む様々な臨床的特徴を示す [65]。
このような脳障害はヨーロッパで65歳以上の約700万人を患っていると推定されているが、一般的な高齢化を考慮すると、来年にはさらに症例数が増加すると予想されている[66,67]。
通常、神経変性過程は臨床症状が現れる数年前から始まり、その後、患者は障害と向き合うために特別な治療を必要とする。その結果、臨床的な証拠が現れる前に、できるだけ早く病理学的メカニズムに対抗する必要がある[68]。
最近の生物医学研究は多くの進歩を遂げているが、病態の根底にあるすべてのメカニズムはまだ十分に解読されておらず、独自の治療法は問題を解決するための勝利のアプローチとは言えないようである。
実際、アルツハイマー病やパーキンソン病(PD)のような多くの神経変性疾患は、遺伝的要素が強い臨床的に不均一な疾患であり、そのために、同じ病態を持つ患者であっても、すべての患者に同じ治療を適用することができない[69,70,71]。特に、これらのサブグループは様々な分子特性を示すため、研究者および臨床家の目標は、これらのすべてのバリアントを発見し、カタログ化することである。最終的な目的は、神経変性疾患の分子的原因を理解し、効果的な標的治療法を見出すことである。つまり、生物学的ラベルのように、各サブタイプを識別し、カタログ化できるバイオマーカーを発見する必要がある。この結果が得られれば、個々の患者がどのサブバリアントの影響を受けているかを確実に理解し、この情報に基づいて治療をモデル化して個別化することが可能になる[34]。
考慮すべきもう一つの重要な側面は、遺伝的要素だけでなく、エピジェネティックな修飾因子や、栄養、喫煙習慣、運動、家族歴、化学物質への曝露、マイクロバイオーム、または他の病態の併存などの非遺伝的因子も、神経変性の進化のダイナミックな動きに影響を与えうるということである[72]。
近年、新しい技術の応用により、これらの病態の複雑さに関してより完全な見解が得られ、障害の発生と進行に特異的な影響を及ぼす様々な感受性因子の存在が強調され、精密医学的アプローチの開発が奨励されている[73]。
この文脈では、膨大な量のデジタル遺伝学的データの収集を可能にするNGS技術は、疾患の完全な分子シグネチャーだけでなく、そのようなシグネチャーを誘発したり維持したりするイベントのカスケードを定義するのにも役立つ。例えば、病的な脳組織と健常な脳組織の差分トランスクリプトーム解析は、2つの条件で異なる発現を示すタンパク質コード遺伝子、ノンコードRNA、またはスプライシングイベントを調べることを可能にしている[74,75,76,77]。これらすべてのデータを組み合わせることで、患者の「オーミック」プロファイルを提供し、ネットワークを発見することが可能となり、360度の神経疾患メカニズムの理解を深めることに貢献できる可能性がある。
実際、最近の大規模な生物学的データベース、プロテオミクス[78]のような患者を特徴づけるための強力な方法、大規模なデータセットを解析するための計算ツールの開発によって、精密医療のアプローチを広く適用する見通しが飛躍的に向上している。したがって、ゲノムワイド関連解析(GWAS)やNGSにより、前臨床病期を特定し、適切な鑑別診断を立案し、従来の治療に代わる早期かつ最適な治療戦略を提供できるようになることが望まれている[71]。
まだまだ理解すべきことが多くあるにもかかわらず、シーケンシング技術の心強い向上は、神経変性の分野で新たな希望に満ちた発見を促している。実際、がんに次いで神経疾患は、遺伝学やライフスタイルなどの要因に基づいて個人のヘルスケアを「オーダーメイド」で開発するという革新的なアプローチにより、精密医療を実現するための最も説得力のある機会を提供している[79]。
歴史的な観点から見ると、精密医療が神経変性疾患の世界に完全に参入したのは 2011年から活動している「Joint Program Neurodegenerative Disease Research」(JPND)として知られる欧州最大のネットワークのおかげであり、このネットワークには神経変性疾患、特にアルツハイマー病の課題に取り組むことを目的とした約30カ国が参加している。
この大規模なネットワークでは、神経変性疾患に関する精密医療プロジェクトに関する3,000万ユーロの提案募集を開始しており、アルツハイマー病やその他の形態の認知症など、未だ治療法のない疾患の原因を解明し、より良い治療を行うことを目的としている。そのため、神経変性疾患の研究にも分子医学を取り入れ、がん研究と同様の成果を上げようとしている[80]。
しかし、神経疾患における精密医療の可能性を現実的なものにするためには、基礎研究とトランスレーショナル研究の多くの異なる分野が連携し、異なる専門センターを横断して精密医療戦略を実施する必要がある。これらのネットワークの発展は、データの収集を容易にし、異なる研究から得られた情報を共有することを可能にする。この文脈では、患者のデータと比較するための対照データを提供することができる健康な個人からの多数のサンプルの関与もまた不可欠である。遺伝情報、診療所、患者の画像を一緒に組み合わせることで、徐々にパズルを解くことが可能になり、それが病気の明確なイメージにつながる。
この点では、ウェブベースのプラットフォームの優れた例として、「Italian IRCSS Network of Neuroscience and Neurorehabilitation」があり、患者の臨床ケアと神経変性疾患に適用される治療戦略の標準化と最適化を目的としている[81]。
欧州ネットワークが追求しているもう一つの重要な目的は、国際的なガイドラインを越えて、診断の方法を標準化する能力に関係している。実際、神経変性疾患の診断は正しいだけでは十分ではないが、欧州のすべての国で同一の診断が達成されるまでは、各疾患とその多数のサブタイプをカタログ化するための均質なデータを持つ十分な研究事例を持つことはできないだろう。したがって、研究と患者の両方に役立つ共通のコードを見つけることができるようになることが目的である。
これらの知見をまとめると、ヒトゲノムの完全な調査を容易にする新しいNGS技術の開発と並行して、研究者が神経疾患の希少な亜種に焦点を当てるようになる可能性がある。
オバマ大統領が「プレシジョン・メディシン・イニシアチブ」で指摘したように、図3に示すように、神経疾患患者が個々のゲノムの特徴を利用してより良い治療を受けられるように、情報を知識に変換するための継続的な努力が必要である[29]。
図3

オバマ大統領が「プレシジョン・メディシン・イニシアチブ」で指摘しているように、患者にとって最適で適切な治療法を選択するためには、個々のゲノムの特性を利用することが不可欠である。変更元:患者と医師と患者の漫画.svgと医師と患者のX線漫画.svg ウィキメディアコモンズから Videoplasty.com, CC-BY-SA 4′。
道のりはまだ長いが、いくつかの神経変性疾患における最近の進歩は、この分野における精密医学的アプローチの可能性を証明している。
マイクロRNA(miRNA)ファーマコ・エピゲノミクスに関連した最近の進歩は、疾患に関連したエピジェネティックな欠陥を治療するための薬剤の使用として定義され、より効果的な治療法の開発のための新しい戦略を提供している[82]。いくつかの脳疾患におけるmiRNAの関与については、実際に広範囲に研究されており、多くの著者がmiRNAを介したメカニズムによって制御された薬物反応の証拠を報告している。特に、AlievaらとMargisらの2つの独立した研究では、パーキンソン病患者において、いくつかの特定のmiRNA(すなわち、miR-7,miR-9-3p、miR-9-5p、miR-129およびmiR-132)の発現レベルが、ドーパミン受容体拮抗薬であるL-ドーパの治療によって回復することが報告されている[83,84]。
さらに、アルツハイマー病に関しては、現在のところ治療法はないものの、いくつかの薬剤による治療により、記憶障害などの一般的な症状が改善したり、安定化したりするようである。また、コリンエステラーゼ阻害剤やドーパミンアゴニストなどの特定の薬剤の使用は、神経細胞死や様々な脳障害に対する神経保護因子として知られているBDNF(脳由来神経栄養因子)転写物を標的とすることで知られているmiR-206の発現を調節することで、記憶障害や炎症を改善するようである[85]。
しかし、これらの進歩により、神経変性疾患の複雑な病態をより包括的に把握できるようになったとはいえ、治療標的としてのmiRNAの利用にはまだ議論の余地があり、特に送達方法や標的特異性に関しては、さらなる研究が必要であると考えられる。
また、神経変性分野における個別化医療については、これまで以上に多くの研究が行われ、有望な結果が得られている。実際、シーケンシング技術の飛躍的な進歩により、個人の遺伝的プロファイルに関する大量の情報を迅速かつ低コストで入手し、予防研究や直接標的を絞った臨床研究を行うことが可能となっている。
その点、WGSやWESのアプローチは、病理学の理解を深め、新しい治療法の開発につながる新規の希少な遺伝的変異体を特定することの重要性を証明している。例えば、アルツハイマー病に関しては、病気のリスクに著しく影響すると思われるゲノム配列のバリアントの大部分は、APP(アミロイド前駆体タンパク質)をコードする3つの主要な遺伝子、PSEN1とPSEN2(プレセニリン1,プレセニリン2)に存在している[87]。しかし、これらの亜種は60歳以前の症例では完全に浸透しているように見えるが、代わりにまれな亜種と強く結びついていると思われるアルツハイマー病の晩発型(高齢発症型アルツハイマー病)を明らかにしていない。
このトピックについてのいくつかの研究を言及するには、Cruchagaらは、PLD3,高度にアルツハイマー病に脆弱である脳領域で発現しているホスホリパーゼをコードする遺伝子の希少なバリアントのエキソームシーケンスによる発見を報告した、高齢発症型アルツハイマー病の7つの独立したケースでは、その病理学のためリスクを2倍にするようである[88]。
Jonssonらは全ゲノムシークエンシング法を用いて、アイスランド人のアルツハイマー病の有意なリスクをもたらす骨髄細胞2上に発現するトリガー受容体をコードするTREM2遺伝子のまれなミスセンス変異(rs75932628-T)を同定した[89]。
さらに、最近のNGS技術の進歩は、ヒトゲノムプロジェクトや国際ヒトハプロタイプマッププロジェクトなどのリソースの開発と相まって、表2に示すように、神経疾患におけるゲノムワイド関連解析(GWAS)の基礎を提供してきた。
表2 公開されているGWASのレビュー
表は、GWASによって同定されたアルツハイマー病およびパーキンソン病の感受性遺伝子をまとめたものである。異なる研究にまたがって複製された遺伝子は青色で示されている。
| 遺伝子/遺伝子座 | 疾患 | 参照 |
|---|---|---|
| TREM2 | アルツハイマー病 | Jonsson et al。、2013 [ 88 ] |
| ABCA7、BIN1、CD2AP、CLU、CR1、EPHA1、MS4A4A / MS4A6A、PICALM | アルツハイマー病 | Vardarajan et al。、2015 [ 90 ] |
| KIF5A | アルツハイマー病 | Nicolas et al。、2018 [ 91 ] |
| EXOC3L4 | アルツハイマー病 | Miller et al。、2018 [ 92 ] |
| PSMF1、PTPN21、ABCA7、ACE、EPHA1、SORL1 | アルツハイマー病 | Zhao et al。、2019 [ 93 ] |
| DNAJB2、HSJ1 | パーキンソン病 | Sanchez et al。、2016 [ 94 ] |
| 22q11.2 | パーキンソン病 | ブッチャー他、2017 [ 95 ] |
| PRKN | パーキンソン病 | Bravo et al。、2018 [ 90 ] |
| DNAH1、STAB1、ANK2、SH3GL2、NOD2 | パーキンソン病 | Germer et al。、2019 [ 96 ] |
ABCA7,BIN1,CD2AP、CLU、CR1,EPHA1,MS4A4A/MS4A6A、およびPICALMなどの確認されたGWAS遺伝子座の標的化シーケンシングアプローチにより、3つの独立した高齢発症型アルツハイマー病コホートにおいて、まれな欠失性変異の過剰な変異が同定された。シーケンシングの高いカバレッジにより、WESやWGSでは検出できなかったこれらの変異を同定することができた[96]。
同様の進歩は、PD分野の精密医療に関しても得られている。
GWASにより、PD48に関連する複数の遺伝子座の同定が可能になった。しかし、この場合、これらの遺伝子座内の希少な変異体の存在もまた、疾患の感受性の増加に寄与する可能性がある。
2019,Germerらは、ドイツのコホートにおいてWESアプローチを用いて、以前にGWASによってパーキンソン病と関連していた遺伝的座位における希少変異の存在を検証した。この研究では、71の遺伝子における54の潜在的な疾患関連変異の存在が証明され、同定された関連のいくつかは、PDリスクを修飾する可能性のある機能的効果を有する希少変異を指す可能性が示唆された[97]。
黒人南アフリカ人やナイジェリア人患者のパーキンソン病について興味深い研究が行われており、この疾患は近年急速に増加しているように思われる。しかし、この集団ではパーキンソン病の原因となる主要な遺伝子に共通の変異が検出されていないため、遺伝的に原因不明のPD症例が依然として多く存在している。結果として、これらの患者における変異の数が限られていることから、よく知られているPD遺伝子がこれらの集団では障害を引き起こす上でわずかな役割を果たしている可能性があり、他の遺伝子が関与している可能性が高いことが示唆されている [98,99]。
Gialluisiらは、イタリアから来た123人のパーキンソン病患者の探索的WES解析と、神経障害との遺伝的関連を調べるための運動性および非運動性PD表現型のエキソームワイド関連研究を報告している。この研究では、以前に脊髄性筋萎縮症(SMA)に関与していたGTF2H2遺伝子におけるパーキンソン病に関連する新しい変異(rs201330591)が証明されたが、ヨーロッパの他の独立したコホートでは再現されていなかった [100,101]。
以前に述べた患者ゲノムのハイスループットシーケンシングの例は、アルツハイマー病やパーキンソン病のような表現型的には類似しているが遺伝的には不均一な疾患の亜分類のための患者ゲノムの有用なアプローチであり、正確な疾患診断や希少疾患の治療を促進し得る新たな原因対立遺伝子の同定を可能にする。
4.2. 心血管疾患
心血管疾患は、循環器系に関連する様々な疾患で構成されており、突発的に発症して死に至ることもあれば、医療費に大きな影響を与える長期的な疾患の初期段階であることもある。
生活習慣の改善やエビデンスに基づいた治療など、心血管疾患sの撲滅に向けて多くの努力と進歩がなされているにもかかわらず、欧米諸国ではいまだに心血管疾患sは死因の第一位であり、世界の全死亡者数の約32%を占めている。残念ながら、この傾向はさらに悪化しており、2030年までに死亡者数は年間2,360万人以上に増加すると推定されている[25]。これらの予測は、世界的な健康負担の増加や医療費の増加と相まって、心血管疾患sに関する研究資金の増加に貢献している。
心血管疾患sの治療や予防を目的とした様々なアプローチや技術がある。ヒトゲノムプロジェクト(Human Genome Project: HGP)により、ゲノム全体の素因マーカー、薬理遺伝学、ゲノムシグネチャーに基づいた新しい治療法が開発された。HGPは、ヒト遺伝子の構造、組織、機能に関する詳細な情報を提供することで、細胞メカニズムを研究する新たなルートを切り開いた。
心血管疾患の進歩は、表3に示すように、ゲノムワイドアソシエーション研究(GWAS)に由来する遺伝的アーキテクチャ(遺伝学的バリアント、頻度、効果の大きさ)への新たな洞察を提供する。これらの研究により、心血管疾患や危険因子と関連する多くの遺伝子座が同定された[102,103]。さらに、GWASにより、新規の経路や治療法の改善が明らかになり、新規の創薬標的を評価し、個々の患者さんに合わせたアプローチを開発することが可能になった[104]。
表3 心血管疾患で発表されたGWASのレビュー
| 遺伝子 | 関連するCVD | 参照 |
|---|---|---|
| PCSK9 | 心筋梗塞 | 心筋梗塞遺伝学コンソーシアム(2009)[ 105 ]; Abifadel M. etal。(2003)[ 106 ]; コーエンJCら。(2006)[ 107 ]; Teslovich TM etal。(2010)[ 108 ] |
| PDGFD | 冠動脈疾患。 | 冠状動脈疾患C4D遺伝学コンソーシアム(2011)[ 109 ] |
| LRIG3 | うっ血性心不全 | スミスNLら。(2010)[ 110 ] |
| ZBTB17バッグ3MYBPC3 LMNA PLN | DCM | ヴィラードE.他 (2011)[ 111 ]; Walsh R. etal。(2017)[ 112 ]; Hershberger RE etal。(2013)[ 113 ] |
| PITX2 SCN10A | 心房細動 | Jabbari J. etal。(2016)[ 114 ]、Roselli C. etal。(2018)[ 115 ] |
| ACTN2 | 肥大型心筋症 | Chiu C. etal。(2010)[ 116 ] |
循環器内科では、個別化医療アプローチは、リスク予測、予防対策、標的治療アプローチなど、疾患の発生を特徴づけるすべての段階に適用可能な革新的なツールである。
心血管疾患の中でも、冠動脈疾患と拡張型心筋症は、個別化医療アプローチに特に関心が高い疾患である。これらの状態では、遺伝学からエピジェネティクス、プロテオミクスに至るまで、様々な因子が病態の発症に寄与するだけでなく、そのような状態の正確な診断にも寄与している。
4.3. 大動脈弁の石灰化病
大動脈弁の石灰化疾患(CAVD)は、無症候性(大動脈硬化症)の場合もあれば、弁組織のリモデリングをもたらし、大動脈弁狭窄症(AS)のような大動脈弁の血行力学的問題を引き起こす場合もある。心エコー図は現在、CAVD診断におけるゴールデンスタンダードであるが [117] 、疾患の進展を予測することはできず、その結果、疾患の初期段階での介入の可能性もない [118]。大動脈弁の石灰化の分類と定量化のための有用なツールとして、CT(コンピュータ断層撮影)が利用されるようになってきている [119] が、これも重症度の予測を可能にするだけで、疾患の進展を予測するものではない [120]。心血管イベントの発生における予測値を表すバイオマーカーの役割は、心血管アテローム性動脈硬化症において広く研究されてきた。いくつかのバイオマーカーが原因疾患因子として同定されているが、CAVDにおける遺伝的因子との関係の同定はまだ進行中である[118]。
65歳以上の被験者5201人を対象とした臨床研究では、著者らはLp(a)リポタンパク質と低密度コレステロール(LDL)とCAVDとの間に相関関係があることを明らかにした[121]。別の小規模な臨床研究(CAVD101例)では、Lp(a)が48mg/dlを超える高値と大動脈弁狭窄症の高リスクとの間に関係があることが強調されている[122]。これらのデータは、Lp(a)遺伝子座(rs10455872)のSNP(一塩基多型)と大動脈弁の石灰化との間に関係があるという2003年に発表された先行研究の結果を裏付けるものである。この同じ研究では、遺伝的Lp(a)のレベルの上昇がCAVDのリスク上昇と関連していることも示された[123]。さらに最近の研究では、遺伝的にLp(a)レベルが低いとCAVDのリスクが約37%低下することが報告されており[124]、血漿中のLp(a)レベルが高く、アポリポ蛋白B(OxPl-apoB)で酸化されたリン脂質を持つ患者は、大動脈弁狭窄症の発症傾向が高いことが報告されている[121]。弁膜症の病理学における遺伝学の役割は、ますます明らかになってきている。NOTCH1の突然変異と大動脈弁の重度の石灰化との関係は、動物モデルで確認されている [125]。内皮細胞 [126] や大動脈弁の細胞間質 [127] での NOTCH1h の調節解除は、弁の石灰化の進展を促進するようである。疾患の原因として同定されている遺伝子変異はごく少数であるが、新しい技術の利用が可能になれば、ヒト弁膜症に関与する追加の遺伝子の発見につながることが期待されている[128]。これは、他の血液学的異常のない人に拡大した体細胞クローンの血液細胞が存在すると定義され、高齢者に多く、血液学的癌のリスクの増加と関連している。CHIPはまた、心筋梗塞や動脈硬化などの心血管疾患のリスクの急激な増加とも関連している[129]。体性血球クローンで同定された変異は、最も頻繁に4つの遺伝子に影響を与えている。DNMT3A; TET2; ASXL1; JAK2。[129]. 各変異は個別に冠動脈疾患と関連している。この研究では、著者らは、2つの前向きコホート研究からの修正ネステッドケースコントロール研究デザインを使用した。Malmö’s Diet and Cancer (MDC) Study(Malmö’s Diet and Cancer Study)は、Malmö(スウェーデン)の住民である約30,000人の参加者を対象としたコミュニティベースの前向き観察研究である[130]。これらの変異を有する CHIP キャリアは、冠動脈の動脈硬化負荷の指標である冠動脈石灰化の増加も有している。最も特徴的な変異は、エピジェネティック制御に関与する遺伝子であるTET2におけるものである。変異した TET2 が心血管疾患の発症を促進するメカニズムはまだ完全には解明されていないが、動脈硬化を起こしやすい低密度リポ蛋白質受容体欠損マウス(Ldlr-/-)のモデルとして使用すると、TET2 の変異が内皮におけるマクロファージのリクルートを促進し、それによって炎症状態が促進され、これが動脈硬化性プラークの急速な発症を引き起こすと考えられていることが示されている[132]。
CAVDの病態はアテローム性動脈硬化プロセスと多くの類似点を共有している。マクロファージ介在性炎症は大動脈弁の石灰化において重要な役割を果たしている[133]が、Notch1はマクロファージの活性化と頻繁に関連している[134]。最近のデータはまた、NOTCH 標的遺伝子である HES1 の欠失が、マクロファージの内皮への接着に関与するケモカインである cxcl1 の発現を改善することを示している [135]。TET2 に よ っ て誘導 さ れた変異は、 cxcl142 を含む炎症メディエーターの発現の増加を引き起こし、TET2 が NOTCH1 をエピジェネティックに制御できることが最近観察されている [136]。これらのデータは、 マクロファージにおける TET2 の突然変異が NOTCH の制御解除につながり、 大動脈弁狭窄症の発症の素因となったり、 その進行を促進したりすることを示唆している。したがって、 TET2 は、 体細胞変異を持つ造血クローンの発生において、 動脈硬化症で起こるのと同様に、 大動脈弁狭窄症の発生の危険因子を構成しうる可能性があると考えられる。
4.4. 拡張型心筋症
拡張型心筋症(DCM)は、慢性虚血、高血圧、および/または後天性または先天性の弁の存在など、圧力および/または容積過負荷の明らかな原因がないにもかかわらず、左心室の進行性拡張および収縮機能の低下が観察されることによって定義される [137]。この病理学の原因は多数かつ不均質であり、DCMの病因は一般的に遺伝的原因と非遺伝的原因に分けられるが、診断されたDCMの多くは正確な病因の定義を見つけられていない。DCMのもう一つの重要な点は、臨床症状が重症度、発症年齢、予後の両方の点で大きく異なることである。家族歴が陽性であることは30~50%のDCMで明らかであるが、原因遺伝子は約40%の症例で同定されることがある [138]。遺伝的に決定されたサルコメアの変化、ミトコンドリアの変化および神経筋疾患は、家族歴がある場合に最も頻繁に同定される病因の一つであるが、毒性物質への曝露、妊娠、糖尿病、心筋炎などの後天的な疾患または環境条件は、表現型の出現および予後に寄与する。逆に、まだ同定されていない遺伝的変化が環境因子の影響を受けやすくし、表現型の変化が激しいDCMの出現を有利にすることもある。特発性」と定義されるDCMでは、約30%の症例で親和性の状態が見られる[138]。しかしながら、従来の遺伝子シークエンス戦略では、主に常染色体優性型に関与し、かつ可変性の浸透性を有する、同定される候補となる遺伝子が少ない。その結果、ほとんどのDCM患者では、病因がほとんど不明瞭なままであり、その結果、治療アプローチや予後の定義が難しくなっている。精密医療はどのようにしてこれらの病態の診断を改善し、患者の個別化された治療に向けて臨床医を導くことができるのであろうか?次世代シーケンシング技術(NGS:Next Generation Sequencing)の登場により、大規模かつ超高速な方法でデータが生成され、より広範囲のゲノムをカバーできるようになったことで、ゲノミクス研究に新たな次元が加わりました。このアプローチにより、DCMの原因となる遺伝子や変異の数が増加していることが明らかになっていた。このような遺伝的多様性は、おそらく疾患発現の極端な不均一性に関係していると思われる。重要な知見として、ラミニンA/C(LMNA)およびフィラミンC(FLNC)の変異は、それぞれ予後不良および不整脈の表現型を引き起こす傾向と関連しており、一方、TNT2の変異は早期発症の侵攻性疾患と関連している [139,140,141,142,143]。
再発する遺伝子検査の重要性についてはまだ議論の余地があるが、ガイドライン[144]によると、遺伝子検査は診断が疑わしい場合や境界線上の症例には有用であるが、そうでない場合は家族歴がある場合や他の危険因子が存在する場合には極めて重要であるとされている。例えば、ペースメーカー植え込みや心臓突然死(SCD)の家族歴がある患者や、心房室や心室内伝導遅延の証拠がある患者では、LMNA変異の存在が警鐘となり、早期のICD植え込みの決定につながる可能性がある[145]。
2015,LeeとWare [146]は、小児心筋症の遺伝子診断が患者管理にどのように影響するかを実証した。彼らは一例として、遺伝学的検査の利点を文書化した3つのケーススタディを報告した。最初の症例では、遺伝学がHCMに関連するナノオン症候群の診断に役立った。ナノン症候群は弁膜症と関連しており、バルーン弁膜形成術や手術などの介入を必要とする可能性があるため、このことは患者管理にとって非常に重要であった。2つ目の症例では、18歳のHCMの男性に遺伝子検査でサルコメリック変異が認められた。この結果を受けて、彼の弟は検査と突然変異に特化した遺伝子検査を受けた。この症例では、遺伝学的検査は、臨床医がより具体的な推奨事項を策定するのに役立つだけでなく、リスクを有する可能性のある他の家族を特定するのにも役立った。3番目の症例は、心臓移植の評価のために紹介された6歳の女性である。この少女はグリコーゲン貯蔵疾患の疑いで遺伝子検査を受けた。この症例は、特に小児心筋症の中に存在する病因の不均一性を示しており、DCMは心筋炎ではなく遺伝性疾患に関連している可能性がある。
さらに、高分解能画像診断の分野では、いくつかの技術的進歩により、心筋のリモデリングメカニズムや特異的な変化を、より特異的に、心筋の構造的影響や心臓損傷の種類とともに特徴づけることができるようになってきている。
正しい病因の定義は、知識の観点からだけでなく、病態生理学的、治療学的、予後学的な観点からも、いくつかの結果をもたらす。病態生理学的観点からは、例えば、ミトコンドリア機能のいくつかの遺伝的に決定された変化は、特定の環境曝露または特定の治療法の存在下でDCMの発症の可能性を増加させるかもしれない。ミトコンドリアは、その収縮機能を遂行するために心筋がATPの形でエネルギーを継続的に要求するための基本的なものである。ミトコンドリア機能の変化は、O2のフリーラジカルの生産を支持して、ATPの生産の減少だけでなく、酸化還元系の不均衡を決定する。このような変化は、例えば、アルコール依存症の患者だけでなく、特定の化学療法薬を投与された被験者においても報告されている。したがって、サイレントジェネラのミトコンドリアの遺伝的に決定的な変化は、そのような条件の存在下でDCMの表現型を生じさせる。それでも、DCMの治療は、特定のガイドラインを含むものではなく、高血圧、糖尿病または虚血性心疾患のような他の原因が蔓延している慢性心不全の影響を受けた患者のために計画された古典的な治療に基づいている。DCMの病因遺伝的特徴を定義する能力は、薬理学的、その他の新しい戦略の開発に不可欠なサポートを提供する。最後に、遺伝データと機器データ(MRIや心エコー)を統合することで、環境曝露や毒性因子を除去した後の可逆的な構造変化の可能性を特定し、患者の予後をより詳細に定義することが可能になる。
心筋症患者の遺伝子検査にはいくつかの利点がある。原因不明の左室肥大など、診断が疑わしい場合には、遺伝子検査が陽性であれば、臨床医は適切なスクリーニングや薬物療法、身体活動の推奨、家族のモニタリングを行うことができる。また、これらの検査は病理学的病因を特定し、適切な心臓スクリーニングと内科的治療、および他の臓器系の関与の適切な管理とモニタリングを可能にする。最後に、これらの検査はリスクの高い親族を特定し、リスク層別化を改善し、リスクの高い個人のみに心臓サーベイランスを実施する費用対効果の高い方法として非常に有用である[146]。
5. 結論
近年、個別化医療は多くの研究分野でホットな話題となっており、今後も大きな重要性を持つようになると思われる。この分野への関心の高さは、生物学的システムやハイスループット技術の発展によって説明できる。確かに、遺伝子解析から得られたデータの知識と解釈が増えることで、健康や疾患時の生理的事象の理解が深まり、個別化された診断と治療が促進されるであろう。また、このようなアプローチは、複数のデータソースからのインプットを統合することで、予防や治療のターゲットをより効果的に絞ることで、疾病の負担を軽減するためにも有益であると考えられる。さらに、個別化医療は、個々の患者に適した治療法を適切なタイミングで選択する能力を向上させることで、医療費の削減や有害事象の予防も目的としている。
しかし、個別化をすべての病態に適用することはできない。実際、異なる疾患では、生物学的要因、非生物学的要因、および環境要因を統合して意思決定を行う必要がある。複雑な疾患では、生物学的ネットワークの周辺構成要素は、遺伝的決定因子よりも疾患の発症に寄与する可能性が高く、また、疾患の発症に対して決定因子よりも確率的に寄与する可能性が高いであろう。
さらに、個別化医療に対するいかなる特定のアプローチの意義もまだ検証される必要がある。理論的には、提案されたどのような個別化されたアプローチも、現在のガイドラインに基づいた治療を超える有益性を示すためには、臨床試験によって確認されなければならない。
個別化医療アプローチの重要な特徴の一つは、複雑なネットワークの中心的かつ能動的なアクターとしての患者とその参加である。そのためには、一人ひとりが自分の病歴を自覚し、医療従事者や患者に対する第一段階の教育・訓練が必要不可欠であり、個別化医療アプローチが実現する未来に向けての準備が必要である。
さらに、ゲノミクス検査の結果に関する重要な問題は、「データのプライバシー」の管理である[147]。研究」と「臨床」のデータプライバシーを見分けなければならない。ゲノムデータの発達により、バイオサンプルの収集が急速に増加し、バイオバンクが作られた。米国や西欧やその他の国では、インフォームドコンセント協定に規定されているように、遺伝データを非公開にすることで、個々の参加者の研究のプライバシーを保護するために、様々なプログラムや法律で機密データの取り扱いが規制されている[148]。臨床の観点からは、ゲノム検査の結果から導き出される関連する問題は、主に「付随的所見」の場合の、これらの結果の患者への「返却」である。問題は、何が “知る権利で、何が知らない権利なのか “である。すべての患者が遺伝子検査結果の意味を知りたがったり、理解したりするわけではなく、主にがんやその他の慢性疾患の発症リスクを予測する場合には、遺伝子検査結果の意味を知りたがったり、理解したりすることはできない。このことは、患者やその家族に不安や抑うつをもたらす可能性があり、場合によっては、すべての遺伝的感受性が将来的に病気に発展することが予測できるわけではないため、不必要な害をもたらすことにもなりかねない[9,149]。一方で、ゲノムの結果に照らして、本人やその兄弟が「間に合う」病気を発症した場合には、倫理的な不公平感が生じる可能性がある。この問題に対処したガイドラインや勧告は少なく、国によって異なることが多い。これは、科学者がデータやサンプルを共有する必要がある国際共同研究の場合には、関連する問題となっている。この問題を克服するための一つの可能性は、倫理委員会に提出して承認を得る前に、プロジェクトの計画と設計の間にこの問題に直面することである。インフォームドコンセントモジュールには、この問題に関する条項が含まれているべきである。それにもかかわらず、同意のためのインフォームドコンセントを管理する医師は、研究に登録する前に、研究の参加者にとってのリスクと利益を明確にし、患者が研究に登録する前に、結果的に偶発的な所見に備えることを確実にしなければならない。
個別化医療や精密医療は、遺伝子検査の利用、バイオマーカーの同定、標的となる薬剤の開発などをベースに、個人を中心とした医療行為をカスタマイズすることを目的としている。この観点から、公的医療制度は重要な役割を果たしており、個別化医療の導入が進むことで、患者と社会に新たな可能性が約束されている。これは、ある種の慢性疾患の治療に大きな影響を与え、公衆衛生や個人の医療費に直接影響を与えている。
このように、これまでのところ、多くの障壁が未だに存在し、様々な専門分野における個別化医療や精密医療の実現と、その公衆衛生や医学教育への影響についての約束は、未だに果たされていない。最大の課題は、個別化医療を現代医療に統合することである[150]。2017年のPrithcardらは、PMC(Personalized Medicine Coalition)のヘルスケアワーキンググループ(HWG)が実施した調査結果を報告している[151]。PMCのHWGでは、教育と認知度、患者のエンパワーメント、価値認識、インフラと情報管理、ケアへのアクセスの確保という5つの分野が課題として挙げられていた。また、これらの課題を克服するための戦略についても議論し、医療提供の個別化医療への進化に向けた一歩を踏み出した。
社会経済的な健康格差の影響についてはほとんど知られていない。実際、バイオテクノロジーの高コストは健康格差を増幅させ、保健サービスの持続可能性の問題となる可能性があり、特に、これらの技術から最も恩恵を受けることができるにもかかわらず、それらの技術を利用する余裕がなく、アクセスすることも使用することもできない人々にとっては問題となる可能性がある[152]。