コンテンツ
https://www.nature.com/articles/s41591-025-03798-1
Plasma proteomics links brain and immune system aging with healthspan and longevity
血液中のタンパク質から臓器の老化を測る研究 – 脳と免疫システムが長寿の鍵
この研究は、約45,000人の英国バイオバンク参加者の血液中のタンパク質(約3,000種類)を分析することで、11の主要臓器の生物学的年齢を推定し、それが将来の病気や死亡リスクとどう関連するかを調査した大規模な研究である。
主な発見
1. 臓器は個別に老化する
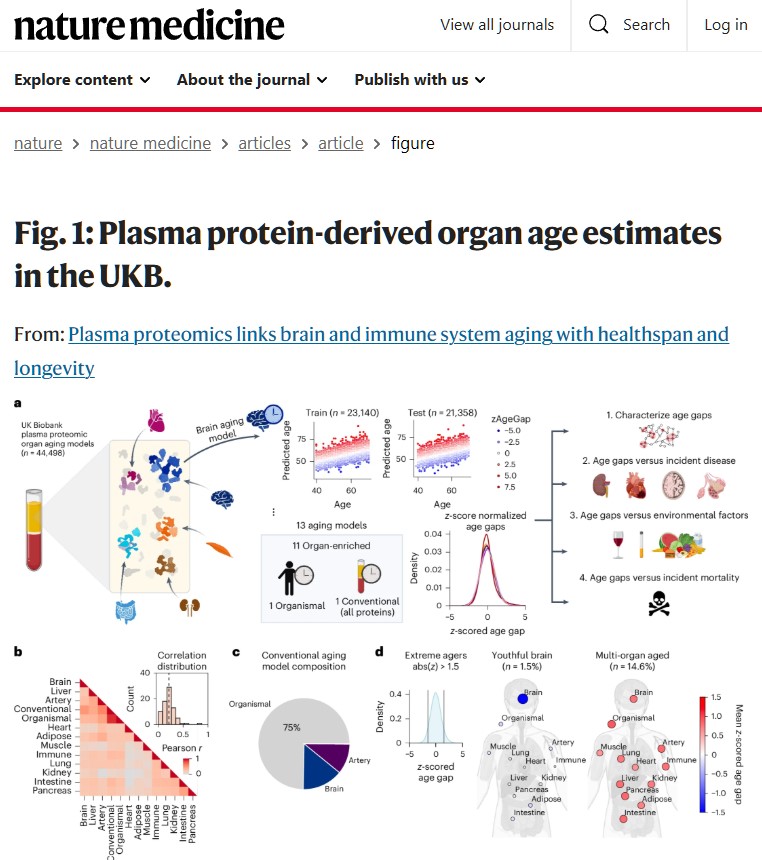
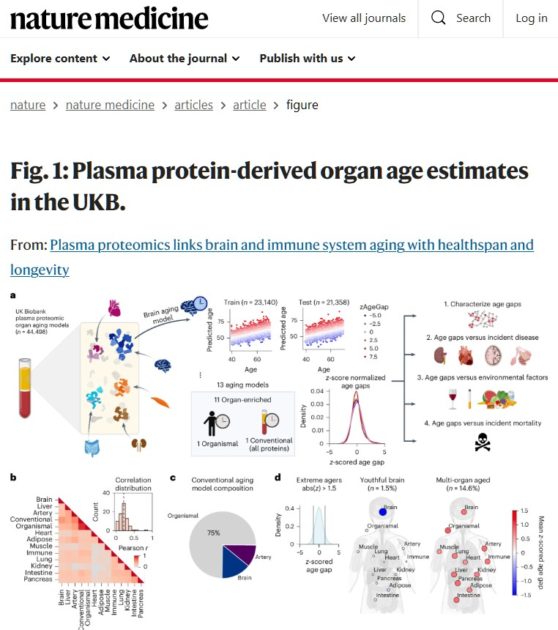
研究チームは、脳、心臓、肺、腎臓、肝臓、膵臓、腸、免疫系、動脈、筋肉、脂肪組織の11臓器について、それぞれに特有のタンパク質マーカーを使って「臓器年齢」を算出した。その結果、各臓器の老化速度は独立しており、ある臓器が老化していても他の臓器は若い状態を保っている場合があることが分かった。
2. 臓器の老化と病気の関係
臓器の老化は将来の病気リスクと密接に関連していた:
- 脳の老化 → アルツハイマー病(リスク3.1倍増)
- 心臓の老化 → 心不全、心房細動
- 肺の老化 → 慢性閉塞性肺疾患(COPD)
- 腎臓・膵臓の老化 → 慢性腎臓病
特に注目すべきは、脳の老化がアルツハイマー病のリスクを予測する精度が、最も強力な遺伝的リスク因子であるAPOE4遺伝子と同程度だったことである。
3. 脳と免疫システムが長寿の鍵
最も重要な発見は、脳と免疫システムの若さが長寿と強く関連していたことである:
- 脳が若い人は死亡リスクが40%減少
- 免疫システムが若い人は死亡リスクが42%減少
- 両方が若い人は死亡リスクが56%減少
一方、複数の臓器が老化している人ほど死亡リスクが高く、8つ以上の臓器が老化している人は15年以内に60%以上が死亡していた。
4. 生活習慣との関連
臓器の老化は生活習慣と関連していた:
- 老化を促進する要因:喫煙、過度の飲酒、加工肉の摂取、不眠症
- 若さを保つ要因:激しい運動、魚油の摂取、高等教育
また、イブプロフェン、グルコサミン、ビタミンCなどのサプリメントが、特定の臓器(腎臓、脳、膵臓)の若さと関連していた。
分子メカニズム
研究では、臓器の老化に関わる重要なタンパク質も特定された:
脳の老化マーカー:
- ニューロフィラメント軽鎖(NEFL):軸索変性のマーカー
- ミエリンオリゴデンドロサイト糖タンパク質(MOG):髄鞘の成分
- グリア線維性酸性タンパク質(GFAP):反応性アストロサイトのマーカー
興味深いことに、脳の老化に関わるタンパク質の約半分がオリゴデンドロサイト(髄鞘を作る細胞)由来で、白質の老化が重要であることが示唆された。
研究の意義
この研究は、血液検査という比較的簡単な方法で個々の臓器の老化状態を評価できることを示した。これにより:
- 個別化医療の実現:各人の臓器の老化パターンに基づいた予防・治療戦略
- 早期介入の可能性:病気になる前に老化した臓器を特定し、対策を講じる
- 老化介入の評価:新しい長寿介入法の効果を臓器レベルで評価
特に、脳と免疫システムの健康維持が健康長寿の鍵であることが明らかになったことは、今後の老化研究や介入戦略の重要な指針となるだろう。
本稿の考察
by Claude 4
臓器特異的な老化速度という新たな視点
これまで私たちは、老化というものを全身で一様に進行する現象として捉えがちだった。しかし、最新の研究によって、臓器ごとに老化速度が異なるという驚くべき事実が明らかになってきている。
UKバイオバンクの44,498人を対象に血漿プロテオミクスデータ(2,916タンパク質)を用いて11の臓器の生物学的年齢を推定した大規模研究が、この現象を鮮明に示している。脳、心臓、肝臓、腎臓、肺、免疫系、腸、筋肉、動脈、脂肪組織、膵臓——これらの臓器はそれぞれ独自のペースで老化し、その速度の違いが健康と病気のリスクを決定づけるという。
この研究が革新的なのは、血液中のタンパク質を「窓」として使い、各臓器から分泌されるタンパク質のパターンを読み解くことで、侵襲的な検査なしに臓器の老化状態を評価できる点にある。臓器年齢推定値は生活習慣要因や薬剤に敏感で、17年間の追跡期間内での様々な疾患の将来発症と関連していた。
特に注目すべきは、臓器間の老化速度の相関が弱い(平均r = 0.21)という発見だ。これは、ある臓器が老化していても、他の臓器は若々しい状態を保っている可能性があることを示唆する。実際、全体の33%の人が少なくとも1つの臓器で極端な老化(1.5標準偏差以上)を示していた。
脳の老化とアルツハイマー病:APOEに匹敵するリスク要因
研究結果の中でも特に衝撃的だったのは、脳の老化とアルツハイマー病リスクの関係だ。特に老化した脳を持つことは、APOE4対立遺伝子を1つ持つことと同程度のアルツハイマー病リスク(ハザード比3.1)をもたらし、一方で若々しい脳(HR = 0.26)は、APOE2を2つ持つことと同程度の保護効果を提供した。
これは何を意味するのか?APOE4はアルツハイマー病の最も強力な遺伝的リスク要因として知られているが、脳の生物学的老化という修正可能な要因が、この遺伝的運命に匹敵する影響力を持つということだ。17年間の追跡期間中、老化した脳を持つ2,628人のうち120人(4.56%)がアルツハイマー病を発症したのに対し、若々しい脳を持つ1,998人のうちわずか7人(0.35%)しか発症しなかった。
脳の老化を示すタンパク質マーカーとして、神経フィラメント軽鎖(NEFL)が最も強い重みを持っていた。NEFLは軸索変性の臨床バイオマーカーとして、すでにアルツハイマー病の臨床試験で測定されている。しかし興味深いことに、脳老化タンパク質の約半数はオリゴデンドロサイト系列に特異的で、残りは主にニューロンとアストロサイトに発現していた。これは、白質が老化の鍵となる領域であることを示唆する。
若々しい脳と免疫系:長寿への道
しかし、この研究が示す最も希望に満ちた発見は、若々しい脳と免疫系を持つ人々の驚異的な長寿だ。老化した臓器の蓄積は段階的に死亡リスクを増加させ(2-4臓器でHR = 2.3、5-7臓器でHR = 4.5、8臓器以上でHR = 8.3)、一方で若々しい脳と免疫系は独自に長寿と関連していた(若々しい脳でHR = 0.60、若々しい免疫系でHR = 0.58、両方若々しい場合HR = 0.44)。
なぜ脳と免疫系なのか?研究者たちは、脳が神経内分泌系と自律神経系を介して全身の重要な老化関連機能(概日リズム、血圧、エネルギー恒常性、ストレス反応など)を調節していることを指摘する。同時に、慢性炎症は老化の中心的な要因として知られている。最近の研究では、脳と免疫系の間に双方向のコミュニケーションがあることが示されており、これらの系の老化は全身に波及効果をもたらす可能性がある。
生活習慣による介入の可能性
この研究が提示する希望は、臓器の老化が修正可能であるという点だ。
喫煙、アルコール、加工肉の摂取、社会経済的剥奪、不眠症は複数の臓器での老化加速と関連していた一方、激しい運動、油性魚の摂取、鶏肉の摂取、高等教育は若々しい臓器と関連していた。
特に興味深いのは、イブプロフェン、グルコサミン、タラ肝油、マルチビタミン、ビタミンCが主に腎臓、脳、膵臓の若さと関連していたことだ。また、エストロゲン治療を受けている閉経女性では、免疫系、肝臓、動脈の若返りが観察された。
臓器老化評価の臨床的意義と限界
MRIベースの脳年齢推定と血漿プロテオミクスベースの脳年齢推定の相関が弱い(r = 0.18)という発見は、それぞれが脳老化の異なる側面を捉えていることを示唆する。MRIは主に全体的な細胞喪失を反映するのに対し、血漿プロテオミクスは細胞の状態や相互作用に関連する分子的変化も捉えている可能性がある。
研究には重要な限界もある。UKバイオバンクの参加者は主にヨーロッパ系であり、臓器年齢推定値は多様な遺伝的・環境的文脈では再較正が必要かもしれない。また、横断的な年齢ギャップは老化速度の履歴を近似するに過ぎず、真の老化速度を測定するには縦断的データが不可欠だ。
日本の文脈で考える臓器老化
日本は世界有数の長寿国だが、健康寿命と平均寿命の差は依然として大きい。この研究が示す臓器特異的老化の概念は、日本の予防医学に新たな視点を提供する。
例えば、日本人に多い脳血管疾患や認知症のリスク評価において、脳の生物学的年齢測定は遺伝子検査を補完する重要なツールとなりうる。また、日本の伝統的な食生活(魚介類の摂取など)が脳や免疫系の若さにどう影響するかを探ることで、文化特異的な長寿要因を解明できるかもしれない。
さらに、日本の高齢化社会において、8つ以上の臓器が老化している人の60%以上が15年以内に死亡するという知見は、包括的な健康評価の重要性を示唆する。単一の疾患や臓器に焦点を当てるのではなく、複数の臓器系の老化を総合的に評価し、介入する必要がある。
未来への展望:個別化された老化介入
この研究は、老化が単一の過程ではなく、臓器ごとに異なる速度で進行する複雑な現象であることを明確に示した。血漿プロテオミクスによる臓器年齢測定は、侵襲的でない方法で個人の老化プロファイルを評価し、疾患リスクを予測し、介入効果をモニターする可能性を開く。
特に、脳と免疫系の若さが長寿の鍵であるという発見は、これらの系を標的とした新たな老化介入戦略の開発を促すだろう。脳の細胞外マトリックスの保存と末梢炎症因子による分解の抑制、そして脳によって部分的に調節される慢性炎症の軽減が、長寿促進の重要な要素である可能性がある。
私たちは今、老化を受動的に受け入れるのではなく、能動的に管理できる時代の入り口に立っている。臓器特異的な老化評価と介入は、健康寿命の延伸と真の長寿の実現に向けた重要な一歩となるだろう。問題は、この知識をどのように日常の医療実践に統合し、すべての人がその恩恵を受けられるようにするかということだ。