On the evolutionary epidemiology of SARS-CoV-2
www.ncbi.nlm.nih.gov/pmc/articles/PMC7287426/
まとめ
COVID-19の原因となる新規コロナウイルスSARS-CoV-2が突然変異を起こしており、それゆえに現在のパンデミックの間に適応する可能性があることは疑いの余地がない。この進化が伝搬の変化、期間の変化、病気の重症度の変化につながるかどうかは明らかではない。このことが、進化の変化に対する警鐘を鳴らすものから、進化を否定するものまで、科学的、メディア的にかなりの議論を呼んでいる。ここでは、SARS-CoV-2の進化について現在知られていることがほとんどないことをレビューし、既存の進化論を拡張して、COVID-19パンデミック時に選択がウイルスにどのように作用したかを検討する。SARS-CoV-2がさらなる適応を受けているという決定的な証拠は現在のところないが、COVID-19の感染性または重症度の実質的な変化に対応して公衆衛生対策を調整できるように、進化的変化の証拠に基づいた分析を継続することが重要である。
本文
動物からヒトの宿主に飛び移った人獣共通感染症の病原体は、発生の初期段階では病原体についてほとんど知られていないため、公衆衛生上の大きな課題を引き起こす可能性がある。したがって、このような病原体に対する最も重要な公衆衛生上の介入は、感染を可能な限り抑制することである。現在のCOVID-19パンデミックは、SARS-CoV-2コロナウイルスによって引き起こされたものであるが、これは明らかな例である。旅行の制限から都市や国全体の封鎖まで、人間の社会的ネットワークにおける大規模な変化は、パンデミックを遅らせ、死者数を減少させるために非常に重要である。
人獣共通感染症の病原体は、宿主の移動後には適応力が低いことが多いため、新たな宿主である人間や医療・公衆衛生上の介入に対して、どのように進化するのかを問うのも自然なことである。宿主移動後の適応に関するいくつかの証拠が存在する例としては、ウサギのミクソマウイルス、鳥インフルエンザ、エボラ、ヒトのジカウイルスなどが挙げられる [1]。SARS-CoV-2では、ヒトの宿主へのさらなる適応も期待できるかもしれない。例えば、SARS-CoV-2はすでにヒト細胞への侵入に重要なACE2受容体と結合することができるが、計算モデルとデータは、結合親和性をさらに強化する可能性のある追加の変異を同定している[2]。
本論文では、利用可能なデータと進化モデルに基づいて、SARS-CoV-2の進化の可能性を探る。現時点では、既存の変異体がCOVID-19の進行、重症度、または感染に適応的な方法で影響を与えるという説得力のある証拠はない。しかし、モデルは、自然淘汰が強力であり、SARS-CoV-2が新たなヒト宿主で拡散する際に、その多様な側面に作用することを示している。我々は、人間の健康や病気の広がりに重要な影響を及ぼすウイルスの進化的変化を検出し、検証し、それに対応するためのより良い戦略を開発することを主張している。そうすることで、効果的な公衆衛生対策を実施するための一連のツールを強化することができる。
現在の経験的証拠
SARS-CoV-2出現
ヒト人口の増加は、ヒトと野生動物の相互作用の増加につながり、動物宿主からヒトへの病原体の移動(ズーノーゼ)を促進している[3]。新種へのウイルスのスピルオーバーには、新しい宿主細胞にドッキングして侵入を可能にするタンパク質の事前適応または急速な進化が必要である。SARS-CoV-2では、スパイクタンパク質の受容体結合ドメイン内の6つのアミノ酸が宿主標的受容体ACE2と結合し、ヒトへの感染を可能にするために重要である [4]。これらの重要なスパイクタンパク質残基は、現在までに同定された最も近縁のコロナウイルスであるカブトコウモリRholophus affinisから採取されたRaTG13(RaTG13とSARS-CoV-2はヌクレオチドレベルで96%類似している)にはすべて存在しないが、パンゴリンから採取されたコロナウイルスには存在している[4]。SARS-CoV-2のゲノムには最近の組換えの証拠がなく、パンゴリンが関与する組換え起源ではないことを主張している[5,6]。野生動物からのコロナウイルスのサンプリングが不十分であること、およびACE2受容体が類似している動物(ブタ、フェレット、ネコ、および非ヒト霊長類[2]を含む)が広範囲に存在することを考えると、最も近縁な動物の由来を特定できていないだけである[4]と考えられる。
SARS-CoV-2の遺伝的変異
疾患の歴史を知る手がかりは、系統樹から得られる。ヒトでは、SARS-CoV-2 は、成長する集団で予想されるように、多くの長い枝を持つ星のような系統樹を示している [7]。ゲノムサンプリングの経時変化に基づいて、置換率は1部位あたり年間0.00084と推定される(www.nextstrain.org [8];2020年5月16日)が、インフルエンザの置換率(ヘマグルチニン遺伝子におけるインフルエンザAの0.004-0.005置換/部位/年、インフルエンザBの0.002置換/部位/年[9])よりも2-6倍低い。SARS-CoV-2は、約30,000塩基のゲノム(図1)にわたって、約1週間に1回の頻度で遺伝子の変化を受けていることになる。

図1 SARS-CoV-2ゲノム間の多様性。
SARS-CoV-2ゲノム間の遺伝的多様性の分離(Nextstrain [8]より)。横軸はゲノムの位置、縦軸はエントロピー(最も遺伝的多様性が高い部位を強調した情報ベースの指標)。(A)ヌクレオチドレベル、(B)アミノ酸レベル。
Nextstrain [8] のようなゲノム追跡ツールを使用すると、発生中にその配列が利用可能になるとすぐに、遺伝的変異を非常に迅速に解析することができる。図1は、2020年5月16日に利用可能になった5,380のゲノム間のヌクレオチド変動を示している(図1A)。これらのうちのいくつかは非同義であり、それによってウイルスタンパク質のアミノ酸組成を変化させている(図1B)。
図1は、SARS-CoV-2におけるかなりの遺伝的変異を示しているが、これらの変化が機能的に意味を持つかどうかは不明である。その多くは、おそらくウイルスにとっては中性またはわずかに有害なものであり[5,10]、新しい感受性の高い宿主に運ばれたときに偶然に頻度が上昇したものである。機能的に有意性のない突然変異は容易に頻度が変動し、ウイルスの地理的な広がりを追跡したり、疫学的な動態を再構築するために使用できるゲノム指紋のような役割を果たす(例えば、2020年5月8日に発表されたNextstrainの国際的な広がりに関する状況報告書を参照)。長期的には、より遠縁のコロナウイルス系統間の遺伝的比較で見られるように、劇症的変異は排除されると予想される[6]。しかし、劇症的な突然変異であっても、その有効再生産数が1よりも大きいままである限り、パンデミックの間にその数が増加する可能性がある。
より議論の余地があるのは、ヒトで流通している非同義変異体のいずれかがウイルスの体力を増加させるかどうかである。Box 1では、適応性が疑われるSARS-CoV-2変異についての最も著名な研究のうちの4つと、注意すべき理由を説明している。
ボックス1
SARS-CoV-2の適応変異の探索
2019年12月に中国の武漢から新たな呼吸器疾患の最初の報告が浮上してから数週間以内に、科学者たちはすでにSARS-CoV-2のゲノム内でのヒトへの適応のシグネチャーの探索を開始していた。最も早く現れた研究の1つは、武漢で流通しているSARS-CoV-2の2つの株(株「L」と「S」)を特定し、前者の方がより「攻撃的」であるという機能的な影響を持つことを示唆していた[5]。この主張はメディアで広く取り上げられ、進化の変化によってCOVID-19がより深刻になるのではないかというかなりの憶測を呼んだ。しかし、この推論は2つの変異体の頻度のみに基づいており、蔓延する病気の星のような系統樹の基底枝上での突然変異の確率的な発生は、頻度データを十分に説明することができる[10]。原著者はその後、このより単純化された説明を認めている[5]。
同様に、最近の研究[37]では、スパイク遺伝子における非同義変異D614G(図1Bの’S’のピークを参照)が複数の国で頻度が増加していることを発見した。このパターンは、突然変異が選択的に有利な場合に予想されるが、純粋に中立的なサンプリングプロセスによっても説明できる。淘汰がなくても、突然変異の頻度が低い地理的な場所(例えば、中国)からの旅行者が新しい病気の発生源となり、その後、突然変異の頻度が(偶然にも)高い場所(例えば、イタリア)からの旅行者が新しい病気の発生源となると、複数の国で突然変異の頻度が並行して増加することが予想される。結論を出す前に、そのような中立的な説明の妥当性を評価することが重要である。Korberら[37]もまた、入院率とウイルス負荷の両方で選択の裏付けとなる証拠を探したが、後者だけが遺伝子型と関連しており、症状発症からの日数(ウイルス負荷の主要な決定因子である[21])のような因子はコントロールされておらず、検査がより利用可能になるにつれて時間の経過とともに変化した可能性がある。現在、いくつかのグループが機能的レベルと疫学的レベルの両方でSARS-CoV-2に対するD614Gの影響を調査しており、この突然変異の選択的重要性に光を当てることになるだろう。
メディアで注目されているもう一つの遺伝子変化は、シンガポールの複数のCOVID-19患者で見つかったORF8の382ヌクレオチド欠失である。この欠失が正に選択されたという直接的な証拠は存在しないが、2003-2004年の発生時に発生したSARS変異型を含む、他のコロナウイルスでも同様の欠失が発見されている[38]。細胞培養の実験では、これらの初期のSARS欠失の一つがウイルスの複製率を低下させることが実証された [39]。このような欠失が繰り返し出現することは興味深いが、そのような欠失を疾患転帰および/または感染率に結びつけるためには、直接的な証拠が必要である。
最後に、[40]は姉妹群比較を用いて、上述のD614G変異を含むSARS-CoV-2ゲノムで同定された31の特異的変異のいずれかが感染率の増加と関連しているかどうかを調べた。その結果、ほとんどの突然変異は、どちらかといえば感染率の低下と関連しているクラッドで発見されており、正に選択された対立遺伝子が存在するという証拠はないと結論づけた。しかし、姉妹種の比較には力がなく、血統の成長を促進するような派生的な特徴を見つけることに対して偏りがある。
最終的な結論は、急速に拡大している人獣共通感染症に伴う予想外の事態を考慮した上で、さらなるモニタリングと試験を待つことになる。
SARS-CoV-2の自然淘汰
遺伝的変異体の適応的意義はまだ確立されていないが、自然淘汰が病気の特徴にどのように作用するかについての洞察を得るために、進化論を用いることができる。SARS-CoV-2のモデル化は、重要な情報が不足しているため、現在のところ困難な状況にある。例えば、無症候性の症例の割合、無症候性の個体の相対的な感染性、およびこれらが年齢によってどのように変化するかについては、まだ十分に理解されていない。そこで我々はまず、正確なパラメータ値を指定せずに、一般的なモデルを探索する。次に、利用可能なデータと一致するパラメータ値を用いてダイナミクスを説明する。
病原体の短期および長期的な進化を理解するために、広範な理論が開発されてきた [11, 12, 13, 14, 15]。病原体形質の進化には、一般的に区別される2つのタイプがある:抗原性形質と疾患ライフサイクル形質 [15]。
抗原性進化とは、集団内の既存の免疫から逃れることができるウイルス遺伝子型の出現と広がりを意味する[16]。例えば、抗原性進化の継続は、季節性インフルエンザワクチンを定期的に更新しなければならない理由である-インフルエンザウイルスは、最終的にはワクチンによって誘導される免疫応答から逃れるほどに進化する[17]。SARS-CoV-2の場合、これまで自然免疫が存在しておらず[18]、ワクチンがまだ普及していないため、抗原性逃避変異に対する自然淘汰は非常に弱いものになる。しかし、保護免疫と逃避変異のモデル化は、もしSARS-CoV-2がヒト集団に蔓延した場合、将来の理論を考える上で重要な一歩となるだろう。
疾患のライフヒストリー進化とは、異なる疾患特性を引き起こす遺伝子型の出現と伝播のことである[19]。例えば、ウイルスの感染率、ウイルスが引き起こす無症状期間の長さ、感染によって誘発される死亡率などは、すべて疾患生命誌形質である。示されるように、これらの形質は、免疫学的にナイーブな集団の中で急速に広がっている新興疾患であっても、強い選択下にある可能性がある。
疫学のモデル化
病原体の進化を予測するためには、疫学的ダイナミックスと進化的ダイナミックスの間の複雑な相互作用を考慮しなければならない。したがって、重要な出発点は、SARS-CoV-2の疫学のための適切なモデルを開発することである。
複数の国のデータによると、感染してから症状が発現するまでの期間(潜伏期間)の中央値は約5日であることが示唆されている[20]。また、感染開始は症状発症の約2.5日前と推定されており、症状発症前に高い感染率を示している[21]。ウイルス負荷は症状発症後に低下し、約2〜4日で半減する [21]。これらの結果から、感染しているが感染していない段階と、感染力の強い症状前の段階があることが示唆されている。一旦感染すると、患者は比較的少ない医療介入で回復するか、より重症化して死亡率が高くなるかのどちらかである。症状のある患者の全体的な死亡率は1~2%と推定されており[22]、症状が現れてから死亡するまでの平均期間は約18日とされている[23]。最後に、感染者の中には、感染の経過を通して無症状のままでいる人もいる。システマティックレビューに基づいて、Buitrago-Garciaらは症例の29%が無症状のままであると推定しているが(95%CI:23-37%)、出版物のバイアスや、多くの研究で少なくとも1人の無症状者が必要とされていることから、これは過大評価である可能性があることに注意している[24]。新規感染の発生源については、彼らのレビューによると、新規感染の約40~60%が無症候性の症例であり、10%未満が無症候性の症例で、残りが症状を発症した症例であることが示唆されている[24]。彼らが強調しているように、これらの数字は非常に不確実なままである。図2は、我々が理解しているCOVID-19のこれらの重要な定性的な特徴を示しており、これを用いて様々な可能性のあるパラメータを用いてSARS-CoV-2の疫学と進化を調べることができる(詳細は補足情報を参照のこと)。
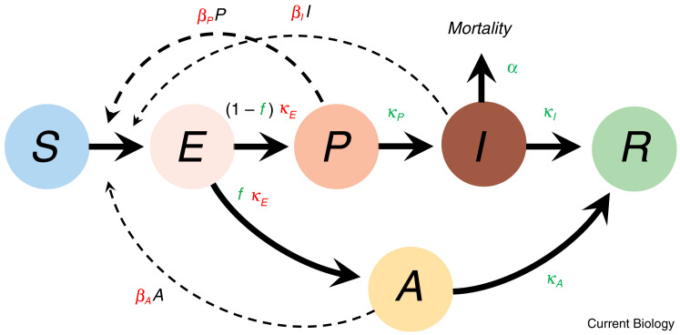
図2 COVID-19の疫学モデル
感染者との接触後、感染した個体(破線の曲線で示され、感染率はβi)に感染すると、感染可能な個体Sは感染者クラスEに入る。後者は最終的に症状のある段階であるIに進行し、αの割合で病気から死亡する(「病原性」と呼ばれている)。他のすべての個体は最終的に回復し、免疫があると仮定される。疾患クラス間の移行率はκiで表される。補足情報に示されているように、これらの形質に作用する選択は、感染率の増加と、曝露から感染に至るまでの間隔の短縮に有利である(赤色のパラメータは増加するように選択されている)。また、選択はまた、病原性の低下など、感染段階にある個体を長く維持する変異(緑色のパラメータは減少するように選択される)にも有利である。症状を持つ前の個体と症状を持つ個体が新たな感染源である限り、無症状の個体の割合の減少も選択に有利である(f)。
図3では、パラメータ値の例を用いて、進化がない場合の疫学的ダイナミクス(破線の曲線)を示している。公衆衛生上の介入がなければ(上のパネル)、SARS-CoV-2の急速な拡散により、高い有病率の感染が発生し(赤の曲線)、その後に集団免疫が発生し、局所的なパンデミックが停止する(’X’)。下のパネルでは、社会的距離が離れている期間(灰色の領域)を含めると、すべての感染率が60%減少する。社会的距離は「曲線を平坦に」し、パンデミックの持続時間を延長し、医療需要のピークを減少させる。病院が過密状態になった場合に生じる過剰な死亡率を考慮しなくても、社会的距離を置くことで総死亡者数も減少している(上と下のパネルのバーの高さを比較してほしい)。理由は微妙である。パンデミックの高さを減らすことで、公衆衛生対策は、社会的距離を置かなくても、病気を維持するのに十分な感染者がいなくなった時点で感染者の数を減らし、それによってその後の感染と死亡の数を減らす。さらに、公衆衛生上の措置は、効果的な治療法やワクチンが開発されるまでの時間を稼ぐことになり、下のパネルに示されている以上に死亡率を下げることになる。

図3 SARS-CoV-2のプリーオトロピーなしでの進化のシミュレーション。
周期的な社会的距離が存在しない場合(上のパネル)と存在する場合(下のパネル)のいずれかで、単一の形質にのみ影響を与える突然変異の進化と疫学的ダイナミクス。常駐ウイルスのパラメータ(r)は、利用可能なデータとほぼ一致するように選択されている:βrp= 3βrI= 10βrA= 1、κrE= 0.25、κrP= 1、κrI= 0.2、κrA= 0.11、ƒr= 0.2、αr= 0.005。これにより、基本的な再生産数Rr0≒2.3が得られる。突然変異アリールは、パネル(A)および(E)(すべての伝送率に1.2を乗じた)で感染を増加させ、パネル(B)および(F)(ƒm = 0.1)で無症状の症例の割合を減少させ、パネル(C)および(G)(κmP = 0.67)で前症状段階を介してよりゆっくりと進行し、パネル(D)および(H)(αm = 0)で病原性を減少させる。後者の場合、死亡率を低下させる変異体は伝播するが、選択性は非常に弱く、その効果はほとんど見られない。灰色の領域は、効果的な社会的距離が離れている期間を示している(すべての感染率が60%減少している)。曲線は、感染した個体数(赤)と感染しやすい個体数(青)を示しており、最初の感染しやすい個体数の割合と突然変異の頻度(黒)を示している。実線の曲線は進化を伴うものである(破線は進化を伴わないもの、参考までに)。挿入された棒グラフは、1%間隔でのダニによる累積死亡数を示している(ピンク、進化なし、赤、進化あり)。
進化のモデル化
次に、図2のモデルを用いて、ウイルスのライフヒストリーの形質(例えば、感染、病気の進行、病原性)を変化させる突然変異の運命を考慮することによって、SARS-CoV-2がどのように進化していくかを探る。機能的に関連する多くの突然変異は、たとえ選択的に有利な突然変異であっても、最初に発生したときには確率論的に失われる。実際、発生の初期段階で確率的損失から逃れる突然変異の確率は、式(S8)(補足情報)で記述することができる(この式は、完全に感染可能な集団において単一の感染者によって引き起こされる新規感染における平均値R 0と分散σ2に依存する)(R 0は「再生産数」と呼ばれることもある)。SARS-CoV-2 の伝播は非常に変化に富み、多くの新規感染につながるケースもあれば、全く感染しないケースもある。突然変異体のR 0が野生型のR 0と似ていると仮定すると(約2.5[25])、確率的損失から逃れる確率は、疾患転帰の不均一性が増加するにつれて急速に低下する(例えば、分散が平均R 0の1倍から10倍に増加するにつれて、89%から31%に低下する)。この結果は、SARS-CoV-2の進化における偶然性の高さを強調している。
補足情報では、確率的絶滅を回避する遺伝子型の進化のダイナミクスについて述べている。図2は、各生活史形質に対する選択の結果をまとめたものである(パラメータ値を指定せずに解析的に導き出したもので、その多くは不確定なままである)。もちろん、ウイルスの突然変異は多元的に複数の形質を同時に変化させることができる。例えば、ウイルスの複製率を増加させる突然変異は、感染率(βs)、病気の進行率(κs)、無症候性症例の割合(f)、および/または病原性(α)に影響を与えるかもしれない。このようなすべての形質に対する選択の総和効果は、補足情報の式(S6)で記述されているように、突然変異体の運命を支配する。
補足情報に示されている一般的な結果については、症状のある個体がすぐに隔離され、無症状の個体が新たな感染に寄与しない(βIとβAが無視できるほど)という特殊なケースを考慮することで、いくつかの直感を得ることができる。この場合(そして、非常に過渡的な暴露されたクラスを仮定して)、進化の変化は、症状を持つ前のクラスの選択によって駆動される。そこで、q P(新しい突然変異を持つ前兆感染の割合)の変化を表す一つの式を使って、突然変異のダイナミクスを記述することができる。
dq P /dt = sq P(1-q P) (1a)ここでq P(1-q P)は「遺伝的変動」を表し,sは次式で与えられる「選択係数」である.
s = S(1-ƒ)ΔβP・SβP Δƒ-ΔκP (1b)
(補足情報参照)。ここで、ΔβPは新しい変異と野生型との間の症状前伝播率の差、Δfは無症状個体の割合の差、ΔκPは症状前伝播率の差である。式(1)の「遺伝的分散」が正であることを考えると、突然変異はその「選択係数」が正である限り、頻度が増加することになる。
次に、これらの結果を用いて、SARS-CoV-2のライフヒストリー形質に作用する選択の性質を検討する。まず、それぞれの生活歴形質に作用する選択を単独で検討し、複数の形質に影響を与える突然変異がどのように進化するのかを探る。全体を通して,結果を説明するためだけに式(1)で表される特殊なケースを使用し,補足情報の式(S6)で記述されている選択の完全なモデルを使用する.付属の Mathematica パッケージはすべてのコードを提供し,図示した結果のロバスト性を確認するためにさまざまなパラメータを探索する(DRYAD: doi.org/10.5061/dryad.5hqbzkh3g から入手できる).
伝送速度
この結果は一般的に(式S6)であり、式(1)で最もはっきりと見ることができる。このことは、より高い感染率を持つ遺伝子型に対する選択が、免疫学的にナイーブな個体が多数存在する密度の高い集団において最も強くなることを意味する[11,13,14]が、他のシステムで実験的に検証されている予測である[26,27]。
社会的距離のような公衆衛生上の介入は、一般的に個人間の接触率を低下させ、その結果、すべての遺伝子型の感染率を低下させる。その結果、社会的距離はΔβsを減少させ(例えば、図3Eでは60%減少)、その結果、感染率を高めるための選択を弱めることになる。しかし、社会的距離を置くことで、より長い間、多くの感染者集団Sを維持することになるので、この疫学的フィードバックは、アウトブレイク期間中の選択の平均的な強さを増加させることになる。さらに、社会的距離を置くことで、より長い期間にわたって感染が拡散する(つまり曲線が平坦になる)。これにより、選択がより長い期間にわたって作用するようになり、その結果、より大きな進化の累積量が得られるようになる(Box 2)。全体的に見ると、適応的突然変異は、典型的には、社会的距離を置いている場合の方が、置いていない場合よりも最終的な頻度が高くなる(図3A,Eの黒い曲線を比較してほしい)。
ボックス2
進化とカーブの平坦化
COVID-19に対して用いられている主な公衆衛生上の介入は、接触率の低下、旅行者や病人の隔離、接触者の追跡に焦点を当てている。これらの介入は、感染(βs)を減らし、感染のタイムコースを記述する軌跡を「平坦化」することを目的としており、さらに良いことには、それをゼロに押しつぶすことである。これらの介入は、医療システムが症例の流入を管理し、命を救うために不可欠なものである。
パンデミック曲線をフラットにすることは、副次的な効果がある。パンデミックの持続時間を長くすることで、進化的変化が蓄積される期間を長くするのである。図3と44(上と下のパネルを比較)に見られるように、これらの介入は多くの場合、遺伝子頻度の全体的な変化を大きくする結果となる。この発見は、おそらく最初に思われるほど明白ではない。進化的適応には、遺伝子型間で異なる割合で新しい感染症が発生し、古い感染症が失われることが必要である。したがって、パンデミック期に発生する遺伝子頻度の進化的変化の累積量は、発生した新規感染の総数(つまりアウトブレイクの規模)に正の関係があると期待するのが妥当であるように思われる。そして、公衆衛生の介入は典型的にアウトブレイクの規模を縮小するので、我々はそれらが進化の総量をも縮小すると期待するかもしれない。しかし、これは真実ではない。進化の速度は、2つの異なる対立遺伝子を持つ感染症の成長速度の差(これが式(1)の選択係数)によって決定されるのに対し、アウトブレイクの規模の合計は、これらの成長速度の値そのものによって決定される。これが、進化生物学者が相対的な適性と絶対的な適性の区別と呼んでいるものである。つまり、社会的距離を縮めるような介入は、進化の発生速度を遅らせることなく、パンデミック病の成長速度を遅らせることができるのである。そのような介入は典型的には伝染病の期間を延長するので、他のすべての条件が等しくなれば、それによって進化の変化の総量がより大きくなる。もちろん、他のすべてが等しくある必要はない。なぜなら、社会的距離が選択の強さにも影響を与えることがあるからである(本文参照)。したがって、正味の結果は、これらの効果のバランスに左右される。
図4 多変量効果を伴うSARS-CoV-2の進化のシミュレーション。感染(すべての感染率に1.2を乗じたもの)と病原性の両方にプリーオトロピー効果を持つ突然変異の進化と疫学的ダイナミックス、病原性を2倍にするか(αm = 0.01、パネル(A)および(C))、または排除するか(αm = 0、パネル(B)および(D))。追加の詳細については、図3を参照のこと。
さらに、総感染数を減少させることは、SARS-CoV-2変異の入力を減少させ、その結果、適応を遅らせることになり、特に複雑な変異がフィットネスゲインの根底にある場合には、適応を遅らせることになる。さらに、急速なパンデミックによって局所的な進化の可能性がなくなったとしても(図3および4の「X」参照)、4)、SARS-CoV-2がヒト集団にまだ流通している限り、進化は全世界的に継続するだろう。このような状況において、公衆衛生対策が進化の変化に及ぼす正味の影響を判断するためには、突然変異の出現とその地理的な広がりを考慮したモデルが必要である。
進化は、感染有病率(図3Eの実線と破線の青線で、それぞれ進化の有無にかかわらず、残りの感染者数に対する累積影響を比較)と累積死亡者数(図3Eの挿入バーで、進化の有無にかかわらず、それぞれ赤とピンク色で表示)の両方の観点から、この病気の疫学に影響を与える可能性がある。進化的変化の公衆衛生上の重要性は、突然変異の効果の大きさにも依存する。
最後に、いくつかの突然変異は、介入にもかかわらずウイルス感染を可能にする場合、社会的距離の存在下でより強く選択されるようになるかもしれない(例えば、エアロゾル化または環境中での持続性に影響を与える突然変異)。迅速な接触者の追跡や検査のような他の介入は、本質的にいくつかの感染連鎖を排除するが、遺伝子型が等しく追跡される可能性がある限り、追跡されていない症例間での選択の強さに影響を与えるとは考えられない。
無症候性感染症
淘汰が無症候性症例の割合fにどのように作用するかは、ほとんどの新規感染の発生源に依存する。現在の推定値[24]によると、新規感染の10%未満が無症候性の個体に由来する。症状を発症する個人よりも無症候性の個人の方が感染における役割が小さい限り、選択は無症候性の症例数の減少に有利である(f値が低い;図3B,F)。専門的な用語では、図2の無症候性ルートを介して進行する感染の「生殖価値」が、最終的に症状を発症する個体のそれよりも低い限り(補足情報を参照)、選択はfを低くするように作用するが、それはウイルスの全体的な感染を増加させるからである。この結果は式(1)で最もはっきりと見ることができるが、フルモデルでも同様の結果が得られる(式(S6))。
式(1)はまた、無症候性症例の割合に対する選択の強さが、感染に関する選択と同様に、感受性の高い宿主の密度に比例することを示している。その結果、無症候性感染症の割合が低い遺伝子型に対する選択もまた、免疫学的にナイーブな個体が多数存在する密度の高い集団において最も強くなる。
症状を発症したら隔離することを目的とした公衆衛生対策は、症状につながる感染症の繁殖価値を低下させることで、この選択を弱めることになる。しかし、無症状の個体よりも症状を発症する前の個体からの感染が多い限り、選択の方向性は変わらない。
なぜなら、異なる感染経路の生殖価値は、各クラスの感染時間や、無症候性、前症候性、症候性からの相対的な感染率に強く依存しているからである(これについては直接の推定値がない)(補足情報参照)。また、無症候性症例の割合を変化させるような遺伝子変異がウイルスに存在するかどうかも不明であるが、これは感染時の宿主の特徴(年齢、健康状態など)に依存している可能性がある。
疾患の進行
自然淘汰は一般的に、人々が症状に気づかないように病気の罹患率を低下させる突然変異を含めて、 症状前の段階を長くする(つまりκP の値を小さくする)ことを好んでいる。簡単に言えば、前症候期が長ければ長いほど、ウイルスが感染する期間が長くなるということである(図3C,G)。
疾患クラス構造を持たない特殊ケースモデル(式(1))では、症状前クラスの長さに関する選択は、感受性のある個体数と社会的距離の程度(これらは症状前フェーズの長さΔκP に影響を与えない)には鈍感であるべきであることを示唆しているが、フルモデルでは、他のタイプの感染者に対する症状前クラスの生殖価値の変化のために、両方に敏感である(例えば、灰色領域の社会的距離の効果、図3Gを参照)。さらに、曲線を平坦にすることによって、公衆衛生対策は、より長い期間にわたって選択が作用することを可能にする(ボックス2)。このように、症状前段階の長さを増加させる突然変異は、社会的距離が離れている条件下では、より高い頻度に達する(図3C,Gの黒の曲線を比較してほしい)。
疾患の病原性
一般的に、病気による死亡率αは、それ自体を形質として考えた場合には、減少するように選択される(図3D,H; Supplemental Information)。しかしながら、この選択は、COVID-19を有するほとんどの個体が回復し、死亡率のコストが支払われるのは、実質的な感染が既に起こった後(症状前段階および症状初期段階)に、疾患の経過の遅い時期にのみであるため、弱い傾向がある。このことは、症状前の個体のみが感染すると仮定した式(1)で最も明確に見て取れる。この場合、病原性に関する選択は全く存在しない。
ここでも公衆衛生対策によって、自然淘汰がSARS-CoV-2にどのように作用するかが変わってくる。特に、症状が現れたら自己隔離することが広く推奨されていることは、病原性に対する直接的な選択を弱めている可能性が高いが、病原性に対する直接的な選択がすでに弱まっていたことを考えると、この効果は小さいに違いない(図3D,Hに見られるように)。さらに、病気の封じ込めという点での自己隔離の利点は、病原性に対する選択の減少による潜在的なコストの少なさをはるかに上回っている(図3D,Hの挿入バーチャートを比較してほしい)。
プレオトロピック突然変異
疾患の経過に影響を与えるウイルス性突然変異は、多くの場合、1つ以上の生命誌形質に影響を与える。このような多元的突然変異の運命は、各形質に対する選択的効果の総和に依存する(式(S6))。さらに、SARS-CoV-2の進化の将来を正確に予測するためには、突然変異が個人内のウイルス動態、ウイルス負荷、病気の進行に与える影響、およびこれらが病原体の伝播を支配する生活史形質とどのように関係しているかについてのデータが必要である。このようなデータがない場合には、モデル化を行うことで、様々な可能性についての理解を深めることができる。
重要な問題は、病原性がどのように進化するのかということである [28]。上述したように、病原性に対する直接選択は弱い(図3D,H)。したがって、病原性の進化は、主に多能性の間接的な効果によって駆動されることになる。図4では、2つの可能性のある例を考える。まず、突然変異がウイルスの複製率を増加させた場合に起こりうるように、より高い感染率βsとより高い死亡率α(正のプリーオトロピー、図4A,C)を結びつける突然変異を考えてみよう。この場合、進化はより高い死亡率(挿入バーを参照)をもたらし、伝達率の増加のための選択の間接的な結果となる(補足情報および[12,29]も参照)。あるいは、この病気が下気道ではなく上気道の細胞に優先的に感染する傾向があるような、組織のトロピズムを変化させる突然変異を考えてみよう。このような感染は、感染率は高くなるが、病原性は低い(負の多動性) [30]。これは、より低い死亡率のための間接的な選択を生み出すだろう(図4B,D)。
もちろん、多能性は病原性の進化をSARS-CoV-2の生活史の形質のいずれかと結びつける可能性がある。例えば、感染段階であるκsを延長するための選択は、副次的な結果として病原性を低下させるかもしれない(例えば、より弱い免疫反応が誘発される場合)。あるいは、より多くの症状のある症例(低 f)への選択は、多元的な病原性の増加をもたらすかもしれない。多動性は予測が難しいため、SARS-CoV-2の進化が患者にとって意味のある影響(陽性か陰性か)や病気の拡大につながるかどうかを自信を持って言うことができないのはそのためである。
結論
COVID-19のパンデミックの真っ只中にあって、病気の経過には大きな不確実性があり、この不確実性は、ウイルスがどのように進化するかという懸念によって高まっている(Box 3)。もし、新しいヒト宿主であるSARS-CoV-2の適合性を高めるような突然変異がなかったとしたら、驚くべきことであろう。しかし、選択されている生活史上の形質の配列と、突然変異がこれらの形質を結びつける無数の方法を考えると(図2)、病気への影響を明確に予測することは困難である。緩和努力に進化論的考察を取り入れる前に、過ちが人命にも公衆衛生費にも影響することを考えると、変異体がウイルスの適合性を高めるという主張を高い証拠基準で支持しなければならない。そのためには、中立的な説明を否定し、突然変異と疾患の特徴との間に明確な関連性があることを文書化する必要がある。これまでのところ、報告されているSARS-CoV-2の変異体のどれもがこの基準を満たしていない(Box 1)。
ボックス3
覚えておいてほしいメッセージ
・RNAウイルスSARS-CoV-2は遺伝的に可変であるが、既存の変異体がウイルスの適合性や病気の進行に影響を与えるという決定的な証拠は現在のところ存在しない。
・積極的な淘汰の主張は、病気の拡散と創始者イベントの確率性を考慮したヌルモデルに対して検証されなければならない。
・モデル化により、ウイルス感染、病気の進行、病気の重症度、またはこれらの特徴の組み合わせを変化させるSARS-CoV-2突然変異に対してどのように選択が作用するかが明らかになる。
・進化論的な考え方が公衆衛生への介入の指針となる前に、突然変異を疾患特性に結びつける直接的な証拠が必要である。
・機能的差異が検証されれば、迅速なタイピングにより、緩和策のための限られた資源を最も適切に調整し、対象を絞ることができるようになるだろう。
もちろん、証拠がないことは、消極的事実の証拠と同じではない。現在のところ、適応の範囲や既存の遺伝的変異体の機能的意義についてはほとんどわかっていない。この知識のギャップは、疾患の転帰と遺伝子変異を結びつけるデータが入手可能でないことによって悪化している。ウイルスがすでにヒトからヒトへの効果的な感染を示しているという事実は、さらなる適応の機会がほとんどないことを意味しているのかもしれない。同様に、SARS-CoV-2の突然変異率がインフルエンザに比べて低いことから、選択に応じてよりゆっくりと進化する可能性があることが示唆されている。一方で、ウイルスが親密な接触者に感染しないこともよく知られており[31]、これは感染をさらに拡大させる余地が十分にあることを示唆している。さらに、患者内で循環しているウイルスの数が多いということは、感染の過程であらゆる可能性のあるゲノム変異が生じる可能性があることを示唆している(唾液1 mLあたり10万個のウイルスコピーの中央値の推定値に基づく[32])。したがって、ヒト宿主における生存と感染のための強い選択に対応した適応は、非常に迅速に起こる可能性があり、最初にヒトに切り替わったときにはそうなっていたかもしれない。
この論文は、SARS-CoV-2が取る可能性のある進化経路について考えるための枠組みを提供し、メディアで流布している現在の誤報のいくつかを払拭することを目的としている。例えば、プリーオトロピーが存在しない場合、COVID-19による死亡率は、実際には選択的に中立的か選択されないかのどちらかである。さらに、感染率の増加に対する選択は、伝播が指数関数的であるパンデミックの初期段階で最も強くなる。我々の分析はまた、選択は、病気への進行が遅く、症状が軽度であるウイルスを長く好む可能性が高いことを示している。
これは、主な感染経路が死者との接触であるエボラとは対照的であり、より高い病原性が強く選択される可能性がある状況である [33,34]。一方、感染が多元的にウイルス複製速度の高速化と相同的に結合し、後者の方がより高い病原性につながる場合、より効率的な感染のための選択が結果的に病原性の進化的な増加をもたらす可能性がある(図4A,Cに示されているように)。
理論的な分析と同様に、我々の予測は、生物学的な情報に基づいたいくつかの単純化に依存している。例えば、我々は宿主内進化、感染過程における年齢と空間構造の役割、病気の感受性における宿主遺伝学の潜在的な重要性を無視してきた。同様に、創始者効果、遺伝的ドリフト、超蔓延などの偶然性の事象が新興疾患において特に重要であるという事実にもかかわらず、確率論の影響をほとんど無視していた。また、SARS-CoV-2については不明な点が多いことも強調しておきたい。SARS-CoV-2についての理解が深まり、新しいデータが出てくると、予測に磨きをかけ、ウイルス形質の短期的・長期的な進化のための他のシナリオを探ることが可能になる。細胞株や動物モデルを用いた実験データは、SARS-CoV-2の突然変異の多元的効果を明らかにするのに役立つだろう。系統分類学的手法は、どのような遺伝的変化が正の選択によって引き起こされたのかを明らかにするのに役立つ。このような方法には、予想以上に頻繁にアミノ酸の変化を受ける部位を探索する古典的なアプローチ(例えば、[35])や、系統の形状を利用して遺伝的変異が感染率および病原性に及ぼす影響を推測する新しい方法がある[36]。今後の研究の重要な課題は、COVID-19で見られる極端な確率性に対して推論が頑健であるかどうかを判断することである。ここでは、旅行者が異なる感染源から異なる日付で感染し、キャリアがウイルスを何十人もの個体に感染させることもあれば、誰にも感染させないこともある。
突然変異の機能的重要性を検出するためのより強力な方法は、SARS-CoV-2ゲノムの配列決定のための世界的な膨大な努力を活用することであろう。我々は、ウイルスサンプルを収集する際に、疾患転帰(症状発症からの時間、サンプリング時の症状の重症度)に関する情報を提供するメタデータを求めることを推奨し、入手可能な場合には、入院率、死亡率、および感染(接触者追跡が行われている場合)に関するデータを提供する。ゲノム変異を患者の健康および疫学的データと関連付けることは、変異が機能的に重要であるかどうかを確立する最も直接的な方法である(最近、入院データを用いて [37] が調査したように)。これらのデータはまた、[1]が主張しているように、新しい系統図法の多くを適用するためにも必要である。
最後に、機能的に重要な突然変異が確認された場合、それはどのようにして介入戦略に役立つのだろうか?この質問に対する答えは詳細に依存するが、パンデミック時の進化を追跡することの価値を補強するために、いくつかの可能性を検討することは有用である。ある変異体がより伝染性が高いことが判明した場合、その変異体が最も強く選択されている集団(つまり、免疫学的にナイーブな集団が密集している集団)に限られた公衆衛生資源を向けることで、その広がりを緩和することができる。同様に、機能的に重要なバリアントを区別するためにPCR検査を使用することで、公衆衛生当局者はどのバリアントが自分たちのコミュニティで流通しているかを知ることができ、それによって、より軽度の、あるいはより重度の病型が発生した場合には、社会的介入を緩めたり、厳しくしたりすることができるようになる。患者がどの亜種を持っているかを知ることで、医師は薬剤レジメンを調整することができ、リスクの高い状況ではより早い段階で、あるいはより積極的に薬剤を投与することができるようになる(個別化医療)。特に軽度の変異が発見されれば、意図的な予防接種も可能である。しかし、私たちはまず、どのバリアントがCOVID-19にとって機能的に重要なのかを知る必要がある。

