Contents
Nutrition, immunity and COVID-19
www.ncbi.nlm.nih.gov/pmc/articles/PMC7295866/
Published online 2020 May 20
Philip C Caldercorresponding author
要旨
免疫システムは、病原性のある生物(細菌、ウイルス、真菌、寄生虫)から宿主を守る。このような様々な脅威に対処するために、免疫系は無数の特殊な細胞タイプ、通信分子、機能的な反応を含むように進化していた。免疫系は常に活発に活動しており、モニタリングを行っているが、個人が感染するとその活動が活発になる。
このような活動の高まりに伴い、エネルギー源、生合成の基質、調節分子を必要とする新陳代謝が活発になるが、これらはすべて最終的には食事から得られるものである。多くのビタミン(A、B6,B12,葉酸、C、D、E)や微量元素(亜鉛、銅、セレン、鉄)は、人間の免疫システムをサポートし、感染症のリスクを軽減する上で重要な役割を果たすことが実証されている。
その他のビタミンや微量元素、アミノ酸、脂肪酸などの必須栄養素も重要である。上記に挙げた栄養素は、それぞれ抗菌や抗ウイルスの防御をサポートする役割を持っているが、特に亜鉛とセレンは後者に重要な役割を持っているようである。
万が一感染した場合に病原体に対処できるように、免疫システムをサポートするために必要な栄養素を十分な量摂取しておくことが賢明と思われる。腸内細菌叢は、免疫システムを教育し、調整する役割を果たしている。
腸内細菌叢異常は、多くの感染症を含む疾患の特徴であり、COVID-19に記載されている。健康なマイクロバイオータを達成するための食事的アプローチもまた、免疫系に利益をもたらすことができる。呼吸器上皮の重度の感染は、サイトカインストームと呼ばれる過剰で有害な宿主の炎症によって特徴づけられる急性呼吸窮迫症候群(ARDS)を引き起こし得る。これは、重度のCOVID-19の症例で見られる。
他の環境でのARDSでは、サイトカインストームはn-3脂肪酸によってコントロールされていることが証明されているが、これはおそらく、特殊な分解促進メディエーターへの代謝によってであろう。
キーワード:栄養失調、感染症、マイクロバイオーム、栄養欠乏、肺疾患
序論
免疫系は、有害な環境因子、特に細菌、ウイルス、真菌、寄生虫などの病原性生物から宿主を守るために存在している。このような脅威に対処するために、ヒトの免疫系は、無数の細胞タイプ、通信分子、機能的反応を含むように進化していた。免疫系は常に活発に活動しており、モニタリングを行っているが、個人が感染するとその活動が活発になる。
このような活動の高まりに伴い、新陳代謝が活発になり、エネルギー源、生合成の基質、調節分子が必要になる。これらのエネルギー源、基質、調節分子は最終的には食事から得られる。したがって、免疫システムが最適に機能するためには、幅広い栄養素を十分に供給することが不可欠である1。2
本稿の執筆時点では、世界は重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)と呼ばれる新しいコロナウイルスの感染によって引き起こされるパンデミックに陥っており、SARS-CoV-2による感染に伴う疾患は 2019年に発見されたコロナウイルス疾患(COVID-19)と呼ばれている3。
また、腸内微生物の不衛生を克服し、いわゆる「サイトカインストーム」を鎮める上での栄養の役割についても議論する。まず、コロナウイルスと免疫系の特徴について説明する。
コロナウイルス
コロナウイルスは、哺乳類や鳥類に多く見られる一本鎖 RNA ウイルスの大規模なグループです5 6 コロナウイルスは呼吸器疾患を引き起こし、頻度は低いであるが消化器疾患を引き起こす5 コロナウイルスによって引き起こされる呼吸器症状は、一般的な風邪様症状や軽度のインフルエンザ様症状から重度の肺炎まで多岐にわたる。2019年12月、中国の武漢で肺炎と死亡を引き起こす新型コロナウイルスが確認された3 4;この新型コロナウイルスは 2002年に重症急性呼吸窮迫症候群(ARDS)を引き起こしたSARS-CoVと遺伝的に類似していることから、SARS-CoV-2と呼ばれている。
実際、SARS-CoV-2は7番目に知られているヒトコロナウイルスである7 。これが、SARS-CoV-2がこれほど急速に広まった理由であろう。SARS-CoV-2は呼吸器上皮細胞に感染して上記のような症状を引き起こし、重症化すると人工呼吸器のサポートが必要になる。高齢者、特に糖尿病、心血管疾患、呼吸器疾患、高血圧などの既往症を持つ人は、免疫系が抑制されている人と同様に、重篤な症状や死亡率に特に影響を受けやすいと考えられている3 4 現在、SARS-CoV-2 への感染や COVID-19 の治療法はない。
現在の戦略は、人と人との接触を防ぐことでウイルスの拡散を抑えることを目的としている。SARS-CoV-2に対する免疫防御を提供するワクチンや、ウイルスの複製を防ぐ薬理学的治療法の研究が進められている。その間、個人の免疫システムを十分にサポートするためのアプローチが必要である。栄養学は、これらのアプローチの最前線にあるべきである。
免疫システム
紹介コメント
個人が感染因子にさらされると、免疫システムが重要な役割を果たすようになる。しかし、感染剤の性質は様々であり、そのため、免疫システムは、異なるタイプの感染剤に対処するために、異なるアプローチを必要としている。これらの異なるアプローチは、探索して破壊することを目的とする類似の一般的な戦略に従うが、関与する正確な免疫メカニズムは異なる場合がある。
例えば、ほとんどの細菌は宿主細胞に侵入せず、宿主の免疫系がアクセス可能なままである。多くの場合、これらの細菌は、生来の食細胞細胞(典型的には好中球、単球、マクロファージ、樹状細胞)に取り込まれ、細胞内の食細胞液胞内で死滅し、その後消化される。消化された細菌の残渣(抗原)は、その後、主要組織適合性クラス(MHC)IIを介して食細胞の表面に表示される。これらの抗原は、抗原特異的CD4+ヘルパーTリンパ球によって認識され、これにより、Tリンパ球、Bリンパ球(抗原特異的抗体を産生する)自然免疫細胞のさらなる活性化を含む、細菌に対する後天的(適応的)免疫反応が誘発される。細胞外細菌に対するこの反応は、明らかにそれらの細菌を殺すことを目的としている。
ウイルス(および一部の細菌)は、細胞外にのみ留まるのではなく、宿主細胞に侵入する;これは、感染した細胞の表面上のMHC Iを介して抗原の提示を誘発することができる。CD8+細胞傷害性Tリンパ球によるこれらの抗原の認識は、抗原を提示している宿主細胞を殺す結果となる。ナチュラルキラー細胞もまた、ウイルスに感染した細胞を認識し、感染した細胞を殺すことにより、細胞傷害性Tリンパ球と類似した方法で作用する。
このように、ウイルスに感染した細胞に対するこの反応は、ウイルスを保有している宿主細胞を殺すことを目的としている。宿主細胞を殺すことで、もちろんウイルスは解放され、宿主免疫細胞とウイルス感染細胞との間の戦いが続く。
宿主の効果的な防御を可能にする免疫系の一般的な機能は4つある。
- 病原体が体内に侵入しないようにバリアを作る。
- 病原体がバリアを破った場合、病原体を特定する。
- 病原体を排除する。
- 免疫学的記憶の生成
バリア機能
免疫系のバリア機能は、外部環境から病原体が体内に侵入するのを防ぐ働きをしている。これには、
- 皮膚や粘膜層(消化管、呼吸器、泌尿器)のような物理的バリア、
- 胃の酸性pHのような化学的バリア、
- 皮膚や腸管内の常在菌の存在、
- 唾液や涙に含まれるIgAや抗菌タンパク質のような分泌物、
- 補体システムのような生物学的バリア
が含まれる。
病原体の同定
病原体は、マクロファージ、単球、樹状細胞などの自然免疫系の細胞によって認識される。これは、病原体のグループに広く共有されている一般的な分子構造を認識するパターン認識受容体(PRR)の存在によって達成される。これらの構造は、微生物関連分子パターン(microbe-associated molecular patterns)またはMAMPと呼ばれている。
PRRがMAMPを認識すると、宿主防御応答の第一ラインが活性化される。PRRには、Toll様受容体(TLR)が含まれる。ヒトでは10種類以上の機能性TLRが同定されており、それぞれが細菌、ウイルス、真菌、寄生虫からの異なるMAMPを検出している。
これらの中で最もよく知られているのは、グラム陰性細菌の細胞壁からリポ多糖類を認識するTLR4と、グラム陽性細菌の細胞壁からリポ酸を認識するTLR2である。いくつかのTLRが自然免疫細胞の細胞表面に発現しているのは、TLRが認識する病原体、主に細菌が細胞外に存在するためである。
ウイルスは宿主細胞に侵入するため、細胞内TLRも存在することが重要である。実際、ウイルスDNA、ウイルス二本鎖RNA、ウイルス一本鎖RNAを認識する細胞内TLRが存在する。これらのうち、TLR7およびTLR8は、マクロファージ、単球、樹状細胞および他のいくつかの細胞型に存在し、コロナウイルスの一本鎖RNAの生得的認識において重要であると考えられる。
しかしながら、コロナウイルスコートのスパイク糖タンパク質を含むタンパク質もまた、細胞内および細胞外のPRRによって認識される可能性が高いと考えられている。
病原体の排除
前述したように、細胞外細菌は、マクロファージおよび樹状細胞を含む食細胞によって飲み込まれ得る。内包された細菌の消化後、抗原と呼ばれるペプチド断片は、貪食細胞の表面で(MHC IIを介して)抗原特異的CD4+ヘルパーTリンパ球に提示される。活性化されたヘルパーTリンパ球(特にTヘルパー1表現型)は増殖し、インターロイキン(IL)-2およびインターフェロン(IFN)-γを含むサイトカインを産生する。IFN-γは、Bリンパ球による抗原特異的抗体産生を促進する。これらの抗体は細菌をコートし、細菌を中和し、貪食のプロセスをより効率的なものにする。
ファゴサイトーシスと並行して、PRRを介した病原体の自然免疫細胞による認識は、炎症性シグナリング、活性化B細胞の核因子κ-光鎖-エンハンサー(NFκB)のような転写因子の活性化、炎症アッセンブリ、および腫瘍壊死因子(TNF)IL-1βおよびIL-12のような古典的な炎症性サイトカインの産生を誘発する。さらに、先に説明したように、ウイルスに感染した細胞は、感染した細胞を殺すように作用するナチュラルキラー細胞を直接活性化する。
さらに、PRRシグナルは、ウイルス抗原の処理と提示を担う樹状細胞の成熟を誘導し、後天性免疫を開始させる。呼吸器上皮細胞と樹状細胞の両方を含むウイルス感染細胞におけるMHC Iのアップレギュレーションは、CD8+細胞傷害性Tリンパ球へのウイルス抗原の提示をもたらす。これは、ペルフォリンのような細孔形成タンパク質の放出を介してウイルス感染細胞を殺すためにそれらを活性化する。
MHC IIとサイトカイン環境を介したウイルス抗原の提示は、CD4+ヘルパーTリンパ球の活性化につながり、Tヘルパー1の表現型に切り替わる。これらの細胞は、細胞傷害性Tリンパ球活性を促進するIL-2,および抗ウイルス抗体を産生するプラズマ細胞へのBリンパ球の分化を促進するIFN-γを産生する。これらの抗体は、遊離ウイルスと結合して中和することができる。
抗ウイルス免疫に関わるプロセスを図1にまとめた。
図1 抗ウイルス免疫の概要
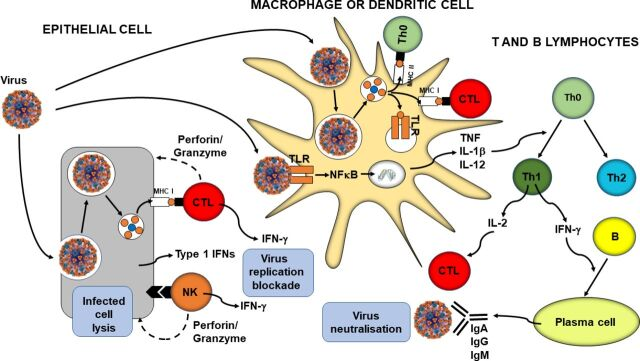
図中の事象は本文で説明している。B、Bリンパ球;CTL、細胞傷害性Tリンパ球;IFN、インターフェロン;Ig、免疫グロブリン;IL、インターロイキン;MHC、主要組織適合性クラス;NFκB、活性化B細胞の核因子κ-光鎖エンハンサー;NK、ナチュラルキラー細胞;Th、ヘルパーTリンパ球;TLR、Toll様受容体;TNF、腫瘍壊死因子
免疫学的記憶
免疫学的記憶とは、体が以前に遭遇した抗原を迅速かつ特異的に認識し、対応する免疫反応を開始する免疫系の能力を指す。免疫学的記憶には2つの側面がある。
第一に、抗体は何ヶ月から何年にもわたって循環の中で持続し、再感染から身を守ることができる。
第二に、活動的な免疫反応が停止した後も、少数のメモリーTリンパ球(CD4+とCD8+の両方)とBリンパ球が残っている。記憶細胞は長い寿命を持っている(数十年まで)。免疫学的記憶は、予防接種の基礎となるものである。
加齢が免疫系に与える影響
加齢は免疫力の低下と関連している可能性があり、これは免疫老化と呼ばれるプロセスである14-18。免疫老化と関連している要因の一つは、すべての免疫細胞の発生源である骨髄からの免疫細胞の産生量の減少である。
また、加齢に伴う胸腺の侵襲により、ナイーブTリンパ球の出力が低下し、新たな抗原への反応能力が低下する。免疫産生が低下するということは、若年成人に比べて、高齢者は呼吸器感染症や肺炎などの感染症への感受性が高く、ワクチン接種への反応が悪くなることを意味している14。15 19 20 腸粘膜はヒトの免疫組織の最大の部位であり、腸粘膜免疫系の老化はマウスモデルで実証されており、分泌IgA反応の低下、新しい抗原に対する口腔内耐性の低下、粘膜樹状細胞機能の低下を伴うことが、他の場所でレビューされている。
この状態は、心血管疾患、代謝性疾患(糖尿病、非アルコール性脂肪肝疾患)神経変性、およびいくつかの癌23 のような老化の慢性疾患のリスクの増加に寄与すると考えられており、感染したときに過剰な炎症反応を引き起こす可能性がある。
炎症は自然免疫反応の一部であり、自然免疫と後天的免疫は協調的かつ統合的に働くべきであるが(図1参照)過剰な炎症反応は後天的免疫の障害につながる可能性がある23。
ボックス1
加齢による免疫力低下(免疫産生)のいくつかの重要な特徴
Tリンパ球
循環の数の減少
- 異なる表現型間の不均衡
- ナイーブTリンパ球の産生および数の減少
- 非機能性メモリーTリンパ球の蓄積
- 抗原受容体の多様性の低下
- 反応性の低下
- 増殖障害
- インターロイキン(IL)2やインターフェロン(IFN)-γなどのサイトカインの産生障害
Bリンパ球
- ナイーブBリンパ球数の低下
- 非機能性メモリーBリンパ球の蓄積
- 反応性の低下
- 免疫グロブリンのバランスの変化
樹状細胞
- ファゴサイトーシスの減少
- Toll様受容体(TLR)の発現低下
- 反応性の低下
- 1型IFN産生の減少
好中球
- 循環中の数値は保存されている
- 化学走性が損なわれる
- 酸化的バーストと細菌の殺害に障害がある
- ファゴサイトーシスの障害
- TLR発現の低下
- 好中球細胞外トラップの産生低下
- 反応性の低下
単球
- TLR発現の変化
- 反応性の低下
- サイトカイン産生の変化パターン
マクロファージ
- ファゴサイトーシスの障害
- TLR発現の変化
ナチュラルキラー細胞
- 循環の中での数の増加
- 異なる表現型間の不均衡
- 障害された細胞毒性
- 反応性の低下
- サイトカインの障害された生産
免疫系に対する肥満の影響
肥満は、ヘルパーTリンパ球、細胞傷害性Tリンパ球、Bリンパ球、ナチュラルキラー細胞の活性低下を伴う免疫能力の低下24 25,および抗体やIFN-γ産生の低下と関連している可能性がある26-28。27 このことは、健康な体重の人と比較して、肥満の人は様々な細菌、ウイルス、真菌感染症への感受性が高く、24 29-31 とワクチン接種への反応が悪くなることを意味する。
2009年のH1N1インフルエンザAウイルスのパンデミックの間、肥満の人は感染に対する抗ウイルス反応の遅れと弱体化を示し、健康な体重の人と比較して病気からの回復が悪いことを示した。GreenとBeck32は、健康的な体重の人と比較して、ワクチン接種を受けた肥満の人はインフルエンザまたはインフルエンザ様疾患のリスクが2倍であり、肥満の人ではワクチン接種からの防御が不十分であることを示していることに注意している。
Sheridanら33は、健康な体重、過体重、肥満の人の血液中の免疫細胞のインフルエンザワクチンに対する反応を試験管内試験で調査した。血液中の免疫細胞をワクチンに曝露すると、活性化された細胞傷害性Tリンパ球の数、グランザイムを発現する細胞傷害性Tリンパ球の数、およびIFN-γを産生する細胞傷害性Tリンパ球の数が増加した。しかし、肥満個体からの細胞の応答は、それぞれ40%、ほぼ60%、65%と鈍化していた。太りすぎの人の細胞は、健康な体重の人と肥満の人の間で中間的な反応を示した。パンデミックH1N1インフルエンザAウイルスに対する血球の応答についても同様の知見がPaichらによって報告された34
逆説的に、肥満はまた、多くの炎症性メディエーターの血中濃度の増加、慢性的な低悪性度の炎症の状態にリンクされている35この状態は、老化の慢性的な状態のリスクの増加に寄与すると考えられている35と感染したときに過剰な炎症反応をマウントするために素因となる可能性がある。このことを裏付けるように、フランスの報告では、SARS-CoV-2に感染した肥満者の85.7%が機械的換気を必要としたのに対し、健康な体重の人は47.1%であったことが明らかになっている36。
栄養、免疫、感染
紹介コメント
免疫系は常に機能しているが、病原体の存在によって細胞が活性化される(「免疫系」を参照)。この活性化により、エネルギー産生基質(グルコース、アミノ酸、脂肪酸)に対する免疫系の需要が大幅に増加する。
免疫応答の活性化は、プロスタグランジンやロイコトリエンなどの脂質由来のメディエーターや、免疫グロブリン、ケモカイン、サイトカイン、サイトカイン受容体、接着分子、急性期タンパク質など、さまざまな種類のタンパク質の産生を誘導する。これには、それぞれ基質となる脂肪酸およびアミノ酸の利用可能性が必要である。
免疫応答は、細胞の大幅な増殖を伴うので、防御のために利用可能な免疫細胞の数を増加させる:これには、DNA、RNA、タンパク質および複合脂質の合成と、これをサポートする基質の利用可能性が必要である。エネルギーの生成と生合成に関与する代謝機械は、補酵素として多くの異なるビタミンやミネラルを必要とする。
アミノ酸(例えば、アルギニン)は、DNAの複製と細胞分裂の調節に役割を持つポリアミンの合成のための前駆体である。様々な微量栄養素(例:鉄、葉酸、亜鉛、マグネシウム)もまた、ヌクレオチドと核酸の合成に関与している。
ビタミンAやDなどの一部の栄養素とその代謝物は、免疫細胞の遺伝子発現を直接制御し、免疫細胞の成熟、分化、応答性に重要な役割を果たしている。宿主は、従来の抗酸化ビタミン(ビタミンCとE)と抗酸化酵素(スーパーオキシドジスムターゼ、カタラーゼ、グルタチオンペルオキシダーゼ)を介して、これらの抗酸化物質から保護する必要がある。
このように、免疫系の機能をサポートするための栄養素の役割は多種多様であり、適切な免疫応答を行うためには、これらの栄養素を十分かつバランスよく供給することが不可欠であることは容易に理解できるであろう。
本質的には、良質な栄養があれば、免疫系が課題の性質に関わらず、課題に適切に反応できる環境が整います。逆に栄養状態が悪ければ、免疫系が十分に反応できない環境を作り出してしまう。これは、自然免疫と後天的免疫の両方の障害を伴い、感染症に対する感受性と重症度の増加を伴う栄養不足の状態(「現実の生活」または実験的に誘導された状態)で十分に説明されている。
免疫機能の低下と感染症への感受性は、特定の栄養素の利用可能性と免疫防御との間に因果関係があることを示す欠乏症を是正することで回復させることができる。このことは、ビタミンA、B6,B12,C、D、葉酸(ビタミンB9)亜鉛、鉄、セレン、銅などの微量元素について、「免疫系の機能維持」を謳うことを認めている欧州食品安全局(European Food Safety Authority)によって認められている。
栄養と免疫に関する包括的なレビューは、主に微量栄養素の役割に焦点を当てたものが多く1 2 38-42,単著や複数の著者による有用な書籍もある43-46。以下のセクションの本文の一部は、以前に出版されたものから更新されている。
ビタミンA、免疫、感染症
ビタミンAとその代謝物(例えば、9-シス-レチノイン酸)が免疫や感染症に対する宿主の感受性に果たす役割については、多くのレビューがある47-54。ビタミンAは上皮組織の正常な分化と免疫細胞の成熟と機能に重要である。したがって、ビタミンAの欠乏は、バリア機能の障害、免疫反応の変化、様々な感染症への感受性の増加と関連している。
ビタミンA欠乏マウスでは、腸管バリアの破壊と粘液分泌の障害(粘液を産生する杯細胞の喪失による)が見られるが、これらはいずれも病原体の侵入を促進する。バリア機能に加えて、自然免疫の多くの側面は、ビタミンAとその代謝物によって調節されている。
ビタミンAは好中球の成熟を制御し、ビタミンA欠乏症では血液中の好中球数は増加するが、貪食機能は損なわれている。そのため、好中球が細菌を摂取して殺す能力が損なわれる。また、ビタミンAはマクロファージの食細胞活性や酸化バーストをサポートするので、細菌の殺傷を促進する。
ナチュラルキラー細胞の活性はビタミンAの欠乏によって低下し、抗ウイルス防御が損なわれることになる。ビタミンAの後天性免疫への影響はあまり明らかにされておらず、正確な状況や関与するビタミンA代謝物に依存している可能性がある。
ビタミンAは樹状細胞とCD4+ Tリンパ球の成熟を制御しており、その欠乏はTヘルパー1とTヘルパー2リンパ球のバランスを変化させる。ビタミンAの代謝物である9-シスレチノイン酸はTヘルパー1の応答を増強することが、実験モデル系での研究で示されている。
レチノイン酸は、Tリンパ球の腸関連リンパ組織への移動(ホーミング)を促進する。興味深いことに、いくつかの腸関連免疫細胞はレチノイン酸を合成することができる。レチノイン酸は、CD8+ Tリンパ球の生存と増殖、および抗体生成を含むBリンパ球の正常な機能に必要である。このことを裏付けるように、ビタミンAを投与されたビタミンA欠乏症のインドネシアの子供たちは、破傷風ワクチン接種に対する抗体反応がビタミンA欠乏症の子供たちよりも高いことが示されている56 。
ビタミンAを投与した小児を対象とした臨床試験のシステマティックレビューおよびメタアナリシスでは、全死因死亡率の減少57,はしか57および乳児の下痢による罹患率、罹患率、死亡率の減少57,急性肺炎における症状の改善58が報告されている(表1)。
表1 微量栄養素と呼吸器感染症に関する最近のメタアナリシスの要約
ビタミンB群、免疫力、感染症
最近、ビタミンB群と免疫に関する包括的なレビューがある59 。ビタミンB群は腸管免疫調節に関与しており、腸管バリア機能に寄与している。動物における葉酸欠乏は、胸腺と脾臓の萎縮を引き起こし、循環Tリンパ球数を減少させる。脾臓リンパ球の増殖も減少するが、好中球の貪食能と殺菌能は変化していないようである。
一方、ビタミンB12の欠乏は好中球の貪食能と殺菌能を低下させ、ビタミンB6の欠乏は胸腺と脾臓の萎縮、血中Tリンパ球数の低下、リンパ球増殖能とTリンパ球介在性免疫応答の障害を引き起こす。
ビタミンB6,B12,葉酸はいずれもナチュラルキラー細胞とCD8+細胞傷害性Tリンパ球の活性をサポートしており、抗ウイルス防御に重要な効果を発揮する。60
健康な高齢者を対象とした研究では、ビタミンB6が欠乏した食事を21日間摂取したところ、循環リンパ球の割合と総数が減少し、TおよびBリンパ球の増殖とIL-2産生が減少した。ビタミンB6を推奨摂取量以下のレベルで21日間再補充しても、免疫機能は初期値には戻らなかったが、推奨摂取量(体重70kgの人では1日あたり22.5μg/kg、1.575mg/日)で再補充しても、免疫機能は初期値に戻った。過剰なビタミンB6(1日あたり33.75μg/kg体重、70kgの人では2.362mg/日)を4日間投与すると、リンパ球増殖とIL-2産生がさらに増加した。
ビタミンC、免疫と感染
免疫や感染症に対する宿主の感受性にお けるビタミンCの役割についてのレビューがある。ビタミンCはコラーゲンの生合成に必要であり、上皮の完全性を維持するために不可欠である。また、感染部位への白血球の移動、貪食や細菌の殺傷、ナチュラルキラー細胞の活性、Tリンパ球の機能(特にCD8+細胞傷害性Tリンパ球)抗体産生など、免疫のいくつかの側面でも役割を果たしている。
Jacobら64は、健康な若年成人ヒトにおけるビタミンC欠乏食は、単核球ビタミンC含量を50%減少させ、リコール抗原に対するTリンパ球介在性免疫応答を低下させることを示した。
動物モデルにおけるビタミンC欠乏症は、さまざまな感染症への感受性を高める。あるメタアナリシスでは、特に食事摂取量が少ない人では、ビタミンCの補給により肺炎のリスクが有意に減少することが報告されている65(表1)。また、ビタミンCの補給は、特に身体的ストレスが強い人において、感冒などの上気道感染症の持続期間と重症度を減少させることも示されている63 66。
ビタミンD、免疫力と感染症
免疫や感染症に対する宿主の感受性におけるビタミンDとその代謝物の役割については、多くのレビューがある67-78。ビタミンDの活性型(1,25-ジヒドロキシビタミンD3)は、ここではビタミンDと呼ばれている。ビタミンD受容体はほとんどの免疫細胞で確認されており、免疫系のいくつかの細胞はその前駆体から活性型ビタミンDを合成することができる。
ビタミンDは上皮の完全性を高め、上皮細胞やマクロファージにおいて抗菌ペプチド(カテリシジンなど)の合成を誘導する79 80 。しかし、免疫の細胞構成要素に対するビタミンDの効果はかなり複雑である。ビタミンDは単球からマクロファージへの分化を促進し、自然免疫細胞による貪食、スーパーオキサイド産生、細菌の殺傷を増加させる。
また、抗原提示が損なわれることもあるが、樹状細胞による抗原処理を促進する。ビタミンDはまた、Tヘルパー1リンパ球によるT細胞の増殖やサイトカインの産生、Bリンパ球による抗体の産生を抑制することが報告されており、その効果の逆説的な性質が強調されている。
Tヘルパー2の反応に対する効果は明らかではなく、ビタミンDは調節性Tリンパ球の数を増加させるようである。ビタミンDはCD8+ Tリンパ球にはほとんど影響を与えないようである。
インフルエンザワクチン接種におけるビタミンDの状態の影響に関するシステマティックレビューとメタアナリシス(2367人を対象とした9つの研究)では、ビタミンD欠乏者ではインフルエンザAウイルスサブタイプH3N2とインフルエンザBウイルスに対する血清保護率が低いことが明らかになっている81。
これと一致するように、18,883人の成人を対象とした米国第3次国民健康・栄養調査のデータでは、血清25(OH)-ビタミンDと最近の上気道感染症との間に独立した逆相関が示されている83。日本の学童に冬期に4ヶ月間ビタミンDを補給したところ、インフルエンザのリスクが約40%減少したという報告もある85。
ビタミンE、免疫と感染症
免疫や感染症に対する宿主の感受性におけるビタミンEの役割については、多くのレビューがある。実験動物において、ビタミンE欠乏はリンパ球の増殖、ナチュラルキラー細胞活性、ワクチン接種後の特異的抗体産生、好中球による貪食を減少させる。ビタミンE欠乏はまた、感染性病原体に対する動物の感受性を増加させる。
実験動物の食事にビタミンEを補給すると、抗体産生、リンパ球増殖、Tヘルパー1型サイトカイン産生、ナチュラルキラー細胞活性、マクロファージによる貪食が増強される。ビタミンEは樹状細胞とCD4+ Tリンパ球の相互作用を促進する。
血漿中ビタミンEと細胞が介在する免疫応答との間には正の相関があり、60歳以上の健康な成人における感染症リスクとの間には負の相関があることが示されている93 。 -97
Meydaniら94 95の研究では、高用量のビタミンE補給(1つの研究94では800mg/日、他の研究95では60,200,800mg/日)がTヘルパー1細胞を介した免疫(リンパ球増殖、IL-2産生)を高め、B型肝炎ウイルスを含むワクチン接種反応を改善することが示されている。
高齢者にビタミンE(200mg/日)を補給すると、好中球の走化性と貪食性、ナチュラルキラー細胞活性、マイトジェン誘発性リンパ球増殖が改善された。ある研究では、1年間のビタミンE補給(200 IU/日~135 mg/日)が高齢者の上気道感染症のリスクを減少させたと報告されている99が、別の研究では、高齢者集団における呼吸器感染症の発生率、期間、重症度に対するビタミンE(200 mg/日)の補給の効果は認められなかった100。
亜鉛と免疫と感染症
免疫や感染症に対する宿主の感受性における亜鉛の役割については、多くのレビューがある。Readら110は最近、抗ウイルス免疫における亜鉛の役割について非常に洞察に富んだ評価を行っている。
亜鉛は、コロナウイルスのようなRNAウイルスが複製するのに必要なRNAポリメラーゼを阻害する111。インフルエンザウイルスの試験管内試験での複製は、亜鉛イオノフォアであるピロリジンジチオカルバミン酸によって阻害された112 。
亜鉛の欠乏は骨髄に著しい影響を与え、免疫前駆細胞の数を減少させ、ナイーブなBリンパ球の出力を低下させ、胸腺の萎縮を引き起こし、ナイーブなTリンパ球の出力を低下させる。そのため、亜鉛はTリンパ球とBリンパ球の数を維持する上で重要な役割を果たす。
亜鉛の欠乏は、貪食、呼吸破裂、ナチュラルキラー細胞の活性を含む自然免疫の多くの側面を損なう。また、亜鉛は微生物を捕らえる好中球の細胞外トラップ の放出をサポートしている115 。
亜鉛欠乏は後天性免疫にも顕著な影響を与える。循環するCD4+ Tリンパ球の数と機能(IL-2やIFN-γ産生など)が減少し、Tヘルパー2細胞が有利に働くように障害が生じる。同様に、亜鉛欠乏症ではBリンパ球数と抗体産生が減少する。亜鉛は抗ウイルス防御の重要な細胞であるCD8+細胞傷害性Tリンパ球の増殖をサポートする。116
中等度または軽度の亜鉛欠乏、または実験的な亜鉛欠乏症のヒトでは、ナチュラルキラー細胞活性、Tリンパ球増殖、IL-2産生、細胞を介した免疫反応の低下が見られるが、これらはすべて亜鉛の再補充により改善される。118
鎌状赤血球症に関連した亜鉛欠乏症の患者では、ナチュラルキラー 細胞活性が低下するが、亜鉛の補給により正常に戻すことができる。亜鉛の補給(30mg/日)は、米国の高齢者介護施設入居者のTリンパ球増殖を増加させたが、これは主にTリンパ球の数の増加による効果であった121 。
亜鉛欠乏が免疫成分に与える影響は広範囲にわたっており、亜鉛欠乏症で見られる感染症、特に下気道感染症や下痢症に対する感受性の増加に大きく寄与している。105 中国の子供を対象とした研究のメタアナリシスでは、呼吸器感染症を再発している人は毛髪亜鉛が少ない可能性が高いことが示されている122 。
亜鉛を用いた試験の最近のシステマティックレビューやメタアナリシスでは、成人の感冒の期間が短くなった123 124 、子供の肺炎の発生率と有病率が減少した125 、重度の肺炎を持つ成人に亜鉛を投与すると死亡率が減少した126 (表1
)。
銅、免疫、感染症
127-129 これらのレビューには、銅、免疫、感染症に関する多くの研究が引用されているが、ここではそれらの研究をまとめてみます。銅自体には抗菌作用がある。銅は好中球、単球、マクロファージの機能やナチュラルキラー細胞の活性をサポートする。銅は、増殖やIL-2産生などのTリンパ球の反応を促進する。動物における銅の欠乏は、様々な免疫機能に障害を与え、細菌や寄生虫に対する感受性を高める。130 メンケ症候群と呼ばれる先天性の稀な病気で、循環する銅を運ぶタンパク質であるケルロプラスミンが完全に欠如してい る子供たちは、免疫機能に障害があり、細菌感染や下痢、肺炎が増加している131 中国の子供たちを対象にした研究のメタ分析では、呼吸器感染症を再発している子供たちは、毛髪の銅が低い傾向があることが示されている122。
セレン、免疫と感染
132-138 これらのレビューには、ここで要約されるセレン、免疫、感染症の多くの研究への引用が含まれている。実験動物におけるセレン欠乏は、悪影響を与える抗体産生を含むTおよびBリンパ球機能を含む自然免疫および後天的免疫の両方のいくつかのコンポーネントに影響を与え、感染症への感受性を増加させる。ヒトにおける低セレン濃度は、ナチュラルキラー細胞活性の低下とマイコバクテリア疾患の増加とリンクされている。セレン欠乏は、コックスサッキーウイルス、ポリオウイルスとウイルス性を増加させるマウスインフルエンザウイルスの変異を可能にすることが示された。セレン補給(研究によっては100~300μg/日)は、高齢者を含むヒトの免疫機能の様々な側面を改善することが示されている146 147 セレン状態が低い英国の成人におけるセレン補給(50または100μg/日)は、ポリオウイルスワクチンに対する免疫反応のいくつかの側面を改善した148
鉄分・免疫・感染症
免疫と感染症に対する宿主の感受性における鉄の役割については、多くのレビューがある。鉄欠乏は胸腺の萎縮を誘導し、ナイーブTリンパ球の出力を低下させ、ヒトの免疫機能に複数の影響を及ぼす。その影響は広範囲に及び、呼吸器破裂や細菌殺しの障害、ナチュラルキラー細胞活性、Tリンパ球増殖、Tヘルパー1サイトカインの産生などが含まれる。Tリンパ球の増殖は、鉄欠乏症のカナダ人高齢女性では、鉄欠乏症の方が鉄欠乏症の方が鉄欠乏症の方が鉄欠乏症の方よりも50%~60%低かった160 。しかし、鉄欠乏と感染症への感受性の関係は依然として複雑である150 154-158 証拠は、原虫症やマイコバクテリアのようにライフサイクルの一部を細胞内で過ごす生物による感染症は、実際には鉄によって増強される可能性があることを示唆している。熱帯地域では、すべての年齢の小児において、特定の閾値を超える用量での鉄の摂取は、マラリアや肺炎を含む他の感染症のリスクの増加と関連している。したがって、マラリアパンデミック地域での鉄剤の介入は、特に若年者、免疫力が低下している者、マラリア感染のピークシーズン中の高用量は推奨されない。鉄の投与が感染症に及ぼす悪影響については、さまざまな説明がある。149-159 第二に、過剰な鉄は有害な炎症を助長する。第三に、微生物は鉄を必要とし、鉄を供給することで病原体の増殖を促進する可能性がある。154-157 159 最近の研究では、南アフリカの鉄分不足の学童に鉄分(50mgを週4日ずつ)を投与すると呼吸器感染症のリスクが増加した161;n-3脂肪酸(500mgを週4日ずつ)を併用すると鉄分の効果が緩和された。中国の子供を対象とした研究のメタ分析では、呼吸器感染症を再発した子供は髪の毛の鉄分が低い可能性が高いことが示された。
腸内細菌叢、免疫、感染症
ヒトの腸内細菌叢
人間の体には、皮膚、口、腸などの内部および外部の領域を植民地化する非常に多くの細菌やその他の生物が宿主となっている。特定の場所に存在する生物の共同体は、マイクロバイオータと呼ばれている。腸内細菌叢は個人差が大きく、環境因子への暴露の違いや、年齢や民族などの宿主表現型の影響を反映している。大腸は細菌種の数と多様性が最も多い場所であり、最近の推定では大腸内容物の1011個/gの細菌数が推定されている163。例えば、加齢に伴い、細菌叢の豊富さと多様性が減少する一方で、連鎖球菌、ブドウ球菌、腸球菌、腸内細菌を含む細菌が増加する170 。171 172 腸内細菌叢の異常は、腸内細菌叢の異常と呼ばれるもので、肥満や慢性的な加齢関連疾患を持つ人に見られる。
腸内マイクロバイオータ、プロバイオティクス、免疫システム
消化管内の常在菌は、病原体によるコロニー化に対するバリアを形成することで、宿主の免疫防御に役割を果たしていると考えられている。病気や抗生物質の使用は、このバリアを破壊し、病原菌の増殖に有利な環境を作り出すことができる。プロバイオティクスと呼ばれる外因性の、生きている、 “望ましい “細菌を提供することで、宿主の消化管バリアの維持に貢献することができるという証拠がある。
物理的なバリアを作ることに加えて、乳酸や抗菌性タンパク質を含む内因性常在菌とプロバイオティクス細菌の両方の代謝産物のいくつかは、病原体の成長を直接阻害することができる。179-181 宿主とのこれらのコミュニケーションは、細菌から放出される化学物質を通して、あるいは細胞間の直接の接触を通して起こる可能性があり、これらの相互作用を通して、プロバイオティクスは腸から離れた部位であっても免疫機能を活性化させることができると考えられている。
それにもかかわらず、これらの相互作用の正確な性質はあまり理解されていない。181 多くの研究では、様々なプロバイオティクスの単独または併用による、ヒトの免疫機能、感染症、炎症状態への影響が検討されている。ある種のプロバイオティクス生物は、自然免疫(特に貪食とナチュラルキラー細胞活性)を高めるように見えるが、後天的な免疫にはあまり顕著な影響を与えないようである。
最近のシステマティックレビューやメタアナリシスでは、プロバイオティクスやプレバイオティクス(これらは通常、ある種の細菌の増殖を促進する燃料として作用する難消化性オリゴ糖であり、多くのプロバイオティクスはビフィズス原性である)が成人の季節性インフルエンザワクチン接種に対する抗体反応を増強することが確認されている186 187 。
プロバイオティクス細菌と胃腸感染症
小児を対象とした多くの研究では、特定のプロバイオティクスを使用することで下痢の発生率と持続時間が低下することが報告されている。最近のシステマティックレビューとメタアナリシスでは、Lactobacillus paracasei CBA L74が下痢のリスクを減少させ、Lactobacillus acidophilus LBが下痢の持続時間を減少させ、プロバイオティクスとシンバイオティクス(プロバイオティクスとプレバイオティクスの組み合わせ)が下痢と入院の持続時間を減少させ、回復を早めることが報告されている。 189
ラクトバチルス・ラムノサスGGは下痢の期間を短縮すること、190 ラクトバチルス・ロイテリDSM 17938は下痢と入院の期間を短縮し、早期治癒率を高めること、191 192 バチルス・クラウジーは下痢と入院の期間を短縮すること、192 バチルス・クラウジーは下痢と入院の期間を短縮すること、193 バチルス・クラウジーは下痢と入院の期間を短縮することを示している。 193
成人では、プロバイオティクスが抗生物質に関連した下痢症から保護するという良い証拠がある。 -198 最近のシステマティックレビューとメタアナリシスでは、プロバイオティクスは18歳から64歳の成人の抗生物質関連下痢のリスクを減らすが、高齢者(65歳以上)では減らないこと、199 プロバイオティクスはClostridium difficile関連下痢のリスクを減らすこと、200 プロバイオティクスは抗生物質関連下痢とC. difficile関連下痢の発生率と期間を減らすこと、201 乳酸菌、特にLactobacillus caseiが最も効果的であること、L. 200 プロバイオティクスは、抗生物質関連の下痢症とC. difficile関連の下痢症の発生率と期間を減少させることができる。この研究から明らかなことは、プロバイオティクスは子供と大人の両方で下痢の予防と治療に有効であるが、異なるプロバイオティクスの種と株の効果にはかなりの違いがあり、あるタイプのプロバイオティクスで観察された効果は別のものに外挿することができないということである。
最近発表されたCOVID-19の予防と治療のハンドブック203は、’COVID-19の患者の中には、腸粘膜の直接のウイルス感染や抗ウイルス剤や抗感染剤による胃腸症状(腹痛や下痢など)がある’とコメントしている。ハンドブックでは、これらの患者に見られる腸内環境異常176「細菌の転座や二次感染につながる可能性があるため、微生物学的な調節剤や栄養サポートによって腸内環境のバランスを維持することが重要である」とし、「マイクロエコロジックス[プロバイオティクス? )は細菌の転座や二次感染を減らすことができる。
腸内有害菌を抑制し、毒素の産生を抑え、腸内マイクロフローラ異常症による感染を減らすことができる。患者の消化器症状を改善することができる。便性や排便回数を改善し、腸粘膜の萎縮を抑制することで下痢を減らすことができる。抗生物質をタイムリーに調整し、プロバイオティクスを処方することができる。
これらは「腸内細菌の転座や腸由来の感染の可能性を減らすことができる」としている。これらの記述は、COVID-19患者からのエビデンスよりもむしろ既存の文献に基づいているようであり、そのような介入がこれらの患者で行われて成功した(あるいは失敗した)という明確な記述はない。実際、Gao et al 204は「腸内細菌叢の調節がCOVID-19の治療において治療的な役割を果たすという直接的な臨床的証拠はない」と述べている。それにもかかわらず、この観察は、プロバイオティクスの投与がCOVID-19患者において臨床的に関連性を持つ可能性を示唆している。
プロバイオティクス細菌および呼吸器感染症
205 206 これらの観察から、感染時の呼吸器の体力維持には腸-肺軸が重要であることが示唆されている。主に小児を対象とし、主に異なる乳酸菌やビフィズス菌を用いて、ヒトの呼吸器疾患におけるプロバイオティクスの研究が数多く行われている。これらの研究の多くは、呼吸器感染症の発生率や重症度の低下という点でプロバイオティクスの利点を見出している。これらの研究は近年、システマティックレビューやメタアナリシスの対象となっている207-215;これらの知見は表2にまとめられている。
これらの知見をまとめると、プロバイオティクス、特にいくつかの乳酸菌とビフィズス菌は、ヒトにおける呼吸器感染症の発生率を低下させ、転帰を改善するといういくつかの証拠を提供している。このように、COVID-19の中国人患者の中には、乳酸菌とビフィズス菌176の数が少ない腸内環境異常を示したという観察は重要であるが、この腸内環境異常がこれらの患者におけるCOVID-19の素因となっているかどうかは知られていない。
しかしながら、乳酸菌およびビフィズス菌が免疫機能を改善し、季節性インフルエンザワクチン接種(これはウイルス感染を模倣したものである)に対する反応を高め、ウイルスによって引き起こされたものを含む呼吸器感染症の発生率を低下させ、呼吸器感染症を有する患者の転帰を改善する可能性があることを示す証拠の総体は、ウイルス性呼吸器感染症のリスクおよび重症度を低下させる戦略として、これらの生物の使用を支持するであろう。
表2 プロバイオティクスと呼吸器感染症について報告されている厳選されたシステマティックレビューとメタアナリシスの要約
| 著者 | 人口 | 含まれている試験 | プロバイオティクス | 結果 | 効果 |
| Vouloumanou et al 207 | 子供と大人 | 14件のRCT(3580人の参加者) | 任意(主に乳酸桿菌とビフィズス菌) | RTI | 4 / 10RCTはプロバイオティクスがRTIの発生率を 低下させたと報告5 / 6RCTはプロバイオティクスがRTIの症状の重症度を低下させたと報告した3 / 9RCTSはプロバイオティクスがRTIの期間を短縮したと報告した |
| Liu et al 208 | 重病の成人 | 12件のRCT(1546人の患者) | どれか | 院内肺炎 | 院内肺炎とプロバイオティクスのOR0.75(95%CI 0.57〜0.97) 病院での死亡率、集中治療室での死亡率、入院期間、集中治療室での滞在期間に対するプロバイオティクスの影響なし |
| Liu et al 209 | 子供達 | 4つのRCT(1805人の子供) | ラクトバチルスラムノサスGG | RTI | プロバイオティクスを使用したURTIのRR0.62(95%CI 0.50〜0.78)プロバイオティクスを使用したURTIの抗生物質治療のRR 0.80(95%CI 0.71〜0.91)LRTIまたは全体的な呼吸器感染症に対するプロバイオティクスの影響なし |
| キングら 210 | 子供と大人 | 20件のRCT(> 4141人の参加者) | どれか | RTI | プロバイオティクスを使用した1人あたりのSMDの病気の日数-0.31(95%CI -0.41〜-0.11); プロバイオティクスによる大量破壊兵器の病気の日数-0.77(95%CI -1.50から-0.04); プロバイオティクスによるSMD不在日数-0.17(95%CI -0.31〜-0.03) |
| ハオら 211 | 子供と大人 | 13件のRCT; メタアナリシスにおける12のRCTS(3750人の参加者) | どれか | URTI | 1つのURTIとプロバイオティクス0.53(95%CI 0.37〜0.76 )または少なくとも3つのURTIとプロバイオティクス0.53(95%CI 0.36〜0.80 )のORプロバイオティクス によるURTIの平均エピソード期間-1。89日(95%CI -2.03〜 -1.75 )またはプロバイオティクス0.65(95%CI 0.45〜0.94 )を伴うURTIの抗生物質処方 |
| Ozen et al 212 | 子供達 | 14件のRCT | 任意(主に乳酸桿菌とビフィズス菌) | URTI | ほとんどのRCTでプロバイオティクスの少なくとも1つの有益な効果が観察されました |
| Araujo et al 213 | 子供達 | 11件のRCT(2417人の子供) | どれか | RTI | いくつかのRCTは、新しいエピソードの減少、エピソードの期間の短縮、および症状の重症度の低下を報告しています |
| ワングら 214 | 子供達 | 23件のRCT(6269人の子供) | どれか | RTI | プロバイオティクス0.80(95%CI 0.82〜0.96)を使用した1つのRTIのRR。 プロバイオティクスを使用した子供1人あたりのRTIの日数-0.16(95%CI -0.29〜0.02) プロバイオティクスを使用しない日数-0.94(95%CI -1.72〜-0.15) |
| ラウルセンとHojsak 215 | 子供達 | 15件のRCT; メタアナリシスにおける12件のRCT(4527人の子供) | どれか | RTI | L.ラムノサスGGはRTIの期間を-0。78日短縮(95%CI -1.46から-0.090) 他のプロバイオティクスのメタアナリシスは不可能 |
LRTI、下気道感染症;RCT、ランダム化比較試験;RR、相対リスク;RTI、呼吸器感染症;SMD、標準化平均差;URTI、上気道感染症;WMD、加重平均差。
サイトカインストームを制御するための栄養介入
コロナウイルスは呼吸器疾患の原因となり、肺に大きなダメージを与える可能性がある。これにより、肺の細い血管から体液が漏れて肺胞が充満し、酸素が血流に入って体内の臓器に運ばれることが困難になる。このような場合には、人工呼吸のサポートが必要になる。宿主免疫系とコロナウイルスとの戦いの過程で、炎症反応が過剰に刺激されることがある。これは、活性酸素種、炎症性エイコサノイド、炎症性ケモカインおよびサイトカイン(TNF-α、IL-1β、IL-6など)の実質的な産生として現れる。このような抗酸化性、抗炎症性の状態は、「サイトカインストーム」と呼ばれている;これは、自然免疫系のこの反応が宿主組織にダメージを与えるようになり、実際に肺の損傷や呼吸不全を助長するからである。この状態がARDSである。コロナウイルス感染、サイトカインストームとARDSの関連性については、別の場所でエレガントに説明されている。216 ARDSによる死亡率は一般的に高い。COVID-19が進行した患者では、血流中の炎症性マーカーが著しく上昇していることが報告されている(217)。220 宿主組織に直接ダメージを与えるだけでなく、過剰な炎症反応(すなわちサイトカインストーム)は後天的な免疫反応を抑制する。
ARDSは、その親酸化性、親炎症性の状態のため、酸化ストレスと炎症を標的とした栄養素による治療が可能である。前者には、ビタミンC221 222やビタミンEなどの古典的な抗酸化物質や、抗酸化酵素の活性をサポートする微量元素223 224が含まれ、後者には生理活性の高いn-3系脂肪酸であるエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)が含まれている。
EPA と DHA は、アラキドン酸から産生される炎症性エイコサノイドの産生を減少させ、NFκB シグナルを阻害し、炎症性サイトカインの産生を減少させるために作用する抗炎症特性を持っている。 -231 単離されたウサギの肺を用いた傷害モデルを用いて、EPAはアラキドン酸由来の炎症性エイコサノイド、動脈圧、血管リークを減少させることが示された。
肺損傷の動物モデルでは、魚油は好中球の肺への蓄積を減少させ、234 肺透過性を減少させ、235 肺水腫を減少させ、236 心肺機能障害を減少させることが示されている。Heckerら238は、急性肺損傷のマウスモデルにおける魚油の有益な効果が、いくつかのSPMの受容体であるChemR23を欠失したマウスでは消失したことを報告している。
したがって、肺損傷におけるn-3脂肪酸の効果は、それらのSPMへの変換に起因する可能性がある。このことから、肺損傷の様々な動物モデルにおける個々の SPM の研究では、肺の炎症が減少し、細菌の殺傷が増加し、肺損傷が軽減または消失したことが報告されている(239-250)。
ARDS患者におけるn-3脂肪酸の多くの試験が実施されている。最も初期の試験251-253では、同じ経腸製剤を使用し、高用量のEPAとDHAに加え、抗酸化剤とγ-リノレン酸を投与した。これら3つの試験はいずれも、複数の炎症性疾患、呼吸器疾患、臨床結果に好ましい効果が報告されており、これらの試験のメタアナリシスでは、人工呼吸器の無呼吸日数、新しい臓器不全、集中治療室での在院日数、死亡率に有意な改善が見られた。
これらの試験のうち6試験では、n-3脂肪酸、抗酸化剤、γ-リノレン酸製剤が使用され、3試験ではn-3脂肪酸を主成分とする他の経腸製剤が使用され、1試験では非経口のn-3脂肪酸が使用された。メタアナリシスの結果を表 3 にまとめた。メタアナリシスでは、通常、他の生理活性栄養素と組み合わせたn-3系脂肪酸の投与は、「改善された酸素化とともに、機械的換気の持続時間と滞在期間の集中治療室の長さの短縮」につながったと結論づけている。
これらの観察結果をまとめると、ARDSの患者は、EPAとDHAはそれ自体の能力で抗炎症効果を持っているが、炎症にSPMへの変換を介して最も可能性の高いサイトカインストームを減らすために作用する抗酸化物質との組み合わせで、おそらくn-3脂肪酸でポジティブに治療することができるようである。
表3 ARDS患者におけるn-3脂肪酸を豊富に含む製剤の効果に関するDushianthanら255のメタアナリシスの結果の要約
| 結果 | 効果 | 95%CI | P値 |
| PaO 2 /のFiO 2 4日目(平均差、mmHgで) | 38.88 | 10.75から67.02 | 0.0068 |
| PaO 2 /のFiO 2 8日目(平均差、mmHgで) | 23.44 | 1.73から45.15 | 0.034 |
| 人工呼吸器の日数(平均差、日数) | −2.24 | −3.77〜−0.71 | 0.0042 |
| 新しい臓器不全(相対リスク) | 0.45 | 0.32〜0.63 | <0.00001 |
| 集中治療室滞在期間(平均差、日数) | −3.09 | −5.19〜−0.99 | 0.004 |
| 28日死亡率(相対リスク) | 0.64 | 0.49〜0.84 | 0.0015 |
| すべての原因による死亡率(相対リスク) | 0.79 | 0.59〜1.07 | 与えられていません |
ARDS、急性呼吸窮迫症候群、FiO2,分画刺激酸素、PaO2,動脈性酸素張力(または圧力)
良質な栄養を摂取して免疫系をサポートするためのステップ
前述したように、多くのビタミン(A、B6,B12,葉酸、C、D、E)と微量元素(亜鉛、銅、セレン、鉄)が免疫機能をサポートするために不可欠であることが強調されている。また、その他のビタミンや微量元素、アミノ酸、脂肪酸などの必須栄養素も重要である。免疫におけるこれらの栄養素の重要性を理解し、宿主がより良い病原体への暴露に対処することができるようにするには、欠乏の状態(実験的または’現実の世界’のいずれか)とその逆転から来ている。
このように、本質的な栄養素の率直な欠乏は、免疫機能を損ない、感染症への感受性を高めることが明らかになっており、この2つの結果は、欠乏を治療することで予防または逆転させることができる。これは食事療法によるものであるが、場合によっては、栄養素、欠乏の程度、および状況に応じて、サプリメントや他の治療的な投与を必要とすることもある。
率直な欠乏症から脱却して、1つ以上の必須栄養素の摂取量と状態が「最適以下」の人がすべての集団に存在することになる。そのような人々の免疫機能がどの程度損なわれるかは完全には明らかではない。しかし、様々な必須栄養素の摂取量が最適でない人は、免疫反応が最適でない可能性が高いと考えられ、これが一般集団に見られる免疫反応のばらつきの一因になっていると考えられる。
表4は、免疫系をサポートする主要な栄養素の良い食事源を示している。このリストから、免疫系をサポートするには、野菜、果物、ベリー類、ナッツ類、種子、穀類、豆類、肉類、卵、乳製品、脂っこい魚など、多様で変化に富んだ食事が最適であることがわかる。259
このような食事は、加工食品やジャンクフード、飽和脂肪や糖分の過剰摂取を避けることができる。高齢者(65歳から85歳)を対象とした無作為化比較試験では、1日に5食分以上の果物と野菜を摂取した群と、1日に2食分未満の果物と野菜を摂取した群では、肺炎球菌ワクチン接種に対する反応が良かったが、破傷風ワクチン接種に対する反応には両群間で差はなかったと報告されている260。
これは、ビタミンC、D、E、亜鉛、セレンがそうである。免疫系を十分にサポートするために必要なこれらの栄養素の摂取量を達成するために、免疫をターゲットにしたサプリメントの役割があるかもしれない。免疫系に対する栄養の「直接的」な効果に加えて、多くの植物性食品、繊維質、発酵食品は、健康な腸内微生物叢を形成し維持する役割を果たしており、これらの食品は免疫系をサポートするのにも役立つ167 175。
表4 免疫力をサポートする重要な栄養素の摂取源
| 栄養素 | 良い食事源 |
| ビタミンA(または同等のもの) | 牛乳とチーズ、卵、肝臓、油性魚、強化シリアル、濃いオレンジ色または緑色の野菜(例、ニンジン、サツマイモ、カボチャ、カボチャ、ケール、ほうれん草、ブロッコリー)、オレンジ色の果物(例、アプリコット、桃、パパイヤ、マンゴー) 、カンタロープメロン)、トマトジュース |
| ビタミンB 6 | 魚、鶏肉、肉、卵、全粒穀物、強化シリアル、多くの野菜(特に緑の葉)と果物、大豆、豆腐、酵母エキス |
| ビタミンB 12 | 魚、肉、いくつかの甲殻類、牛乳とチーズ、卵、強化された朝食用シリアル、酵母エキス |
| 葉酸 | ブロッコリー、芽キャベツ、緑の葉野菜(ほうれん草、ケール、キャベツ)、エンドウ豆、ひよこ豆、強化シリアル |
| ビタミンC | オレンジとオレンジジュース、赤と緑のピーマン、イチゴ、ブラックカラント、キウイ、ブロッコリー、芽キャベツ、ジャガイモ |
| ビタミンD | 油性の魚、肝臓、卵、栄養強化食品(スプレッドといくつかの朝食用シリアル) |
| ビタミンE | 多くの植物油、ナッツと種子、小麦胚芽(穀物中) |
| 亜鉛 | 貝、肉、チーズ、いくつかの穀物と種子、シリアル、種子または全粒パン |
| セレン | 魚介類、肉、卵、いくつかのナッツ、特にブラジルナッツ |
| 鉄 | 肉、肝臓、豆、ナッツ、ドライフルーツ(アプリコットなど)、全粒穀物(玄米など)、強化シリアル、最も濃い緑色の葉野菜(ほうれん草、ケール) |
| 銅 | 貝、ナッツ、肝臓、いくつかの野菜 |
| 必須アミノ酸 | 肉、鶏肉、魚、卵、牛乳とチーズ、大豆、ナッツと種子、豆類 |
| 必須脂肪酸 | 多くの種子、ナッツ、植物油 |
| 長鎖オメガ3脂肪酸(EPAおよびDHA) | 脂っこい魚 |
まとめと結論
免疫システムは、病原性のある生物(細菌、ウイルス、真菌、寄生虫)から宿主を守る。このような様々な脅威に対処するために、人間の免疫系は無数の特殊な細胞タイプ、通信分子、機能的な反応を含むように進化していた。免疫系は常に活発に活動しており、モニタリングを行っているが、個人が感染するとその活動が活発になる。
このような活動の高まりに伴い、新陳代謝が活発になり、エネルギー源、生合成の基質、調節分子を必要とするが、これらはすべて最終的には食事から得られるものである。欠乏症の人の実験研究や研究を通じて、多くのビタミン(A、B6,B12,葉酸、C、D、E)や微量元素(亜鉛、銅、セレン、鉄)が、人間の免疫システムをサポートし、感染症のリスクを軽減する上で重要な役割を果たすことが実証されている。
また、その他のビタミンや微量元素、アミノ酸、脂肪酸などの必須栄養素も重要である。上記に挙げた栄養素はすべて、抗菌や抗ウイルス防御をサポートする役割を持っているが、特に亜鉛とセレンは後者に重要な役割を持っているようである。
万が一感染した場合に病原体に対処できるように、免疫システムをサポートするために必要な栄養素を十分に摂取しておくことが大切である。現在の健康的な食事のガイドラインに沿った、多様で変化に富んだ植物性食品や動物性食品の食事を摂取することが、免疫システムをサポートするためには最適であろう。
しかし、免疫系を最適にサポートするために必要な微量栄養素(ビタミンC、D、E、亜鉛、セレン)の摂取量は、食事だけでは容易に達成できない摂取量を超えることができることが、ヒトでの試験結果から示唆されており、このような場合にはサプリメントの摂取が検討されるかもしれない。
腸内細菌叢は免疫系の教育と調整に役割を果たしており、腸内細菌叢の異常は多くの感染症を含む疾患の特徴である。したがって、健康的なマイクロバイオータを達成するための食事的アプローチは、免疫システムにも利益をもたらすことができる。プロバイオティクス細菌、特にいくつかの乳酸菌とビフィズス菌は、マイクロバイオータを修正し、免疫応答を調節し、呼吸器系を含む感染症から保護することができるという証拠がある。
多くの植物性食品、繊維質、発酵食品は、健康な腸内マイクロバイオータを作り、維持する役割を果たしているため、免疫システムをサポートするのにも役立つ。このように、特定の栄養素とそれを提供する食品は、感染した場合に宿主が細菌やウイルスからよりよく防御できるようにするために、免疫システムをサポートする役割を果たすことができる。
したがって、健康的な食生活は、コロナウイルスに感染した場合の結果を決定する重要な要因の一つではあるが、多くの要因の中の一つである。しかし、SARS-CoV-2やCOVID-19に関連した栄養学的研究は発表されていないことに注意することが重要である。
中国の研究者は、重症COVID-19患者のバイオシス異常を指摘し、プロバイオティクスによる治療を推奨しているが、それが行われたかどうか、また行われたとしても臨床転帰の改善に成功したかどうかは明らかではない。
呼吸器上皮の重度の感染は、サイトカインストームと呼ばれる過剰で有害な宿主の炎症を特徴とするARDSを引き起こす可能性がある。これは、重度のCOVID-19の症例で見られる。他の環境でのARDSでは、サイトカインストームは、おそらくSPMへの代謝を介して、n-3脂肪酸のEPAとDHAによって制御できるという証拠がある。この治療法は重症COVID-19では試みられておらず、調査が必要である。
