Contents
Nitazoxanide superiority to placebo to treat moderate COVID-19 – A Pilot prove of concept randomized double-blind clinical trial.
www.ncbi.nlm.nih.gov/pmc/articles/PMC8235996/
オンライン2021年6月27日掲載
Vinicius Fontanesi Blum,a Sérgio Cimerman,h James R Hunter,a Paulo Tierno,b Acioly Lacerda,c Alexandre Soeiro,d Florentino Cardoso,e Nancy Cristina Bellei,a Juliana Maricato, a Nathalia Mantovani,a Marcella Vassao,a Danilo Dias,a Juliana Galinskas,a Luis Mário Ramos Janini,a Joanna Reis Santos-Oliveira,f Alda Maria Da-Cruz,g and Ricardo Sobhie Diaza,⁎.
概要
背景
COVID-19を治療するための特異的な抗ウイルス剤がないため、候補となる薬剤の再配置が行われている。ニタゾキサニド(NTZ)は幅広い抗ウイルス作用を有する。
方法について
本試験は 2020年5月20日から 2020年9月21日までに軽度の呼吸不全で入院したSARS-COV-2 RT-PCR+(PCR)感染者50名(各アーム25名)を対象に、NTZ 600mg BIDとプラセボを7日間比較した無作為化二重盲検パイロット臨床試験である(ClinicalTrials.gov NCT04348409)。臨床的、ウイルス学的エンドポイントおよび炎症バイオマーカーを評価した。疾患重症度の5段階評価(SSD)を用いた。
調査結果
NTZ群では2名の患者が死亡したのに対し、プラセボ群では6名が死亡した(p=0.564)。SSD(p<0001)退院までの平均期間(6.6日対14日、p=0.021)21日目のPCR陰性化(p=0.035)を考慮すると、NTZはプラセボよりも優れていたが、プラセボ群では有害事象が多かった(p=0.04)。試験薬との関連が考えられる有害事象のうち、NTZ群で14件、プラセボ群で22件が検出された(p=0.24)。関連性が低いと思われる30件の有害事象のうち、21件はプラセボ群で発生した(p=0.04)。d-Dimer(p=0.001)US-RCP(p<0.002)TNF(p<0.038)IL-6(p<0.001)IL-8(p=0.014)CD4+Tリンパ球のHLA DR.(p<0.05)CD4+およびCD8+TのCD38(ともにp<0.05)CD4+のCD38およびHLA-DR.(p<0.01)において、ベースラインからの減少率はNTZ群で高かった。
解釈
プラセボと比較して、臨床およびウイルス学的転帰と炎症性転帰の改善において、NTZの優位性は、中等度のCOVID-19に対する本剤のより大規模な臨床試験でのさらなる検討を保証するものである。なお、プラセボ群での有害事象の発現率が高かったのは、COVID-19に関連する症状によるものと考えられる。
キーワード COVID-19,ニタゾキサニド、無作為化比較臨床試験、リンパ球細胞活性化マーカー、インターロイキン
研究の背景
本研究以前のエビデンス
SARS-CoV-2 or coronavirus or COVID-19, or virus “と “Nitazoxanide “という用語を用いて、この文脈における研究を文献で検索した。その結果、インフルエンザウイルス、呼吸器シンシチアルウイルス、エボラ出血熱、ノロウイルス、ロタウイルス、アデノウイルス、コロナウイルス、チクングニアウイルス、B型肝炎ウイルス、C型肝炎ウイルス、日本脳炎ウイルスなど、さまざまなウイルスに対するニタゾキサニド(NTZ)の抗ウイルス効果を示すいくつかの試験管内試験および臨床試験が見つかった。軽度のCOVID-19については、より大規模な無作為化プラセボ対照臨床試験が発表されており、臨床的なベネフィットは検出されなかったものの、NTZ群のウイルス量が有意に減少したことが記録されている。
本試験の付加価値
今回の小規模無作為化概念実証パイロット試験では、NTZを使用した中等度COVID-19患者の退院までの期間が短縮されたことが確認された。また、NTZ治療を受けた患者では、SARS-COV-2 RT-PCR陰性化の速度が速く、実験室内の炎症マーカーがより低下し、リンパ球T細胞活性化マーカーが低下したことが確認された a この結果を受けて、CIVID-19に対するNTZの潜在的な臨床効果および抗ウイルス効果をさらに検討することができた
入手可能なすべての証拠の意味するところ
小規模な臨床研究の場合ではあるが、肯定的な結果は、この薬剤が、いまだに十分な抗ウイルス剤のレジメンがない疾患の治療に将来的に使用できる可能性を示唆している。
Alt-text ラベルなしボックス
1. はじめに
重症のCOVID-19の症例は、最大で約14%の患者に観察される。さらに、明らかな呼吸不全、ショック、多臓器不全を伴う重篤な疾患は、約3.6%から5%の患者に現れる。これらは、異なる臨床表現型のサブグループを構成している[1,2]。重症の場合、死亡までの平均開始期間は、中国では18.8日、中国以外では24.7日となっている[3,4]。死に至るケースは、通常、症状が出てから10日目以降に発生する[5,6]。COVID-19患者の多くは、軽症および中等症から1週間以内に回復するが、一部の患者は第2週目に重症肺炎を発症し、続いて第3週目にサイトカインストーム、成人呼吸窮迫症候群(ARDS)多臓器不全、播種性血管内凝固症候群を発症する[7], [8], [9]。異なるサンプルタイプのウイルス量と疾患の重症度には相関関係が認められた。呼吸器系のサンプルでは、重症の患者が軽症の患者よりも有意に高いウイルス量を示した[10,11]。
ACE2は、SARS-Cov-2の主要な受容体であり、ウイルスの細胞内への侵入を可能にする。ウイルスに感染した上皮細胞は、インターフェロン応答性遺伝子を介してインターフェロンを産生し、強固な自然免疫反応を引き起こす[12]。その後、樹状細胞、マクロファージ、好中球が適応免疫反応を引き起こす。COVID-19で死亡した患者の剖検では、気管支肺炎部位にマクロファージが多く浸潤していることが明らかになった[13]。さらに、COVID-19患者の脾臓やリンパ節には、SARS-CoV-2核タンパク質抗原を含むACE2発現マクロファージが浸潤していることが判明した。これらのマクロファージはIL-6の有意な産生を示したことから、COVID-19疾患における過剰な炎症に寄与している可能性が示唆された[14]。これらの知見は、炎症反応がウイルスの直接的な活動よりもさらに破壊的である可能性を示唆している[15]。SARS-CoV-2では、T細胞数が基準値の下限の半分近くになり、重症の場合には低くなる傾向があったため、T細胞はより大きな影響を受けてた。
炎症性サイトカインが病気の予後に重要な役割を果たしていることから、マクロファージの肺障害への関与が大きいことが研究されている[16,17]。さらに重要なことに、マクロファージ活性化症候群(MAS)は、肺の炎症に寄与する重篤な危険因子として記述されている。そのため、COVID-19の重症例で観察されるIL-6の激しい炎症反応については、すでに議論されている[6,14]。通常、ウイルス感染後の健康回復を担うこの反応は、MASを経験した患者の回復を損なう可能性がある[15,16,18]。マクロファージの活性化とともにIL-6が大量に産生されることで、他のウイルス感染症では一般的に達成されない血清反応性Cタンパク質(RCP)が高値を示すことが説明できる。同様に、ヒトでCOVID-19に最も近い類縁関係にある重症急性呼吸器症候群(SARS)でも、IL-6の高産生が報告されている。SARSにおけるIL-6の産生強度は、インフルエンザやパラインフルエンザなどの一般的なウイルス性呼吸器疾患よりもさらに高かった[6,19,20]。逆に、IFN-I(IFN-αおよびIFN-β)は、SARS-COVおよび中東呼吸器症候群(MERS)-COVの感染に対して保護効果を示しているが、SARS CoV-2の感染マウスではIFN-I経路が阻害されている[21,22]。
ニタゾキサニド(NTZ)とその代謝物であるチゾキサニドは,当初は原虫病治療薬として開発されたが,複数のメカニズムで広域抗ウイルス剤として作用することが明らかになったため,近年,抗ウイルス作用への関心が高まっている。これらは、ウイルスの種類によって異なるようであるが、一般的に、インターフェロンシグナル伝達経路やウイルスの複製に関与するmTORC1など、宿主が制御する経路に干渉する[23,24]。また、ウイルスのRNA阻害やDNA複製を誘発する作用、ウイルスのタンパク質発現を直接阻害する作用、宿主細胞の代謝を阻害する作用、ウイルスの免疫回避機構を阻害する作用など、抗ウイルス機構に影響を与える[23], [24], [25]。
NTZは、インフルエンザウイルスの治療において、ウイルスのヘマグルチニンの成熟を選択的に阻害し、細胞内での輸送やウイルスタンパク質の宿主膜への挿入を阻害することが臨床的に評価されている[26,27]。また、合併症のない急性インフルエンザ感染症の治療において、600mgと300mgの5日間投与のレジメンをプラセボと比較した研究では、600mg投与群で軽度の有害事象のみで症状の期間が短縮したことが報告されている[28]。
NTZの単独使用や他の抗ウイルス剤との併用を目的とした臨床試験が多く提案されている(clinicaltrials.gov)。その中で、米国のNCT04486313では、800名の患者を対象に、300mg2錠BIDとプラセボを用いて、軽度から中等度の患者の有効性と安全性を評価している。また、アルゼンチンでは、135名の患者を対象に、NTZ 500mgを6時間ごとに14日間投与し、プラセボと比較して、軽度の患者の有効性と安全性を検討するフェーズII/IIIが計画されている(NCT04463264)。また、メキシコでは、500mgを6時間ごとに2日間、その後12時間ごとに4日間投与する予防的治療法としての臨床試験が計画されている(NCT04406246,150名のボランティア)。また、メキシコでは、再び、ヒドロキシクロロキン200mgを1日2回、10日間使用する方法と、NTZ 500mg BIDとヒドロキシクロロキン200mg BIDを10日間使用する方法とを比較し、安全性と有効性を検討する試験が募集されている(NCT04341493,患者数86名)。) また、エジプトでは、500mgを1日4回、14日間使用した試験と、ソホスブビル/レディパスビルの併用療法(400mgおよび90mg、経口)を1日1回、14日間使用した試験(240名、NCT04498936)で、安全性と有効性を確認する予定である。また、エジプトでは、NTZ、イベルメクチン、リバビリン200mgまたは400mgを7日間投与する試験とプラセボを比較する試験(NCT04392427)や、NTZとイベルメクチン、クロロキン、アジスロマイシンを併用する試験が計画されている(Tanta University Hospital、NCT04382846,NCT04360356,NCT04361318,NCT04351347,NCT04345419)。ナイジェリアでは、98名の患者を対象に、NTZ 1000mg BIDと300/100mgのアタザナビル/リトナビル錠QDを28日間使用し、標準治療と比較して有効性と安全性を検討する試験が計画されている(NCT04459286)。
ある研究では、SARS-CoV-2に対する潜在的な活性を持つ32種類の薬剤の組み合わせを、in silicoモデルを用いて73種類特定し、その後試験管内試験で検証した。この研究では、NTZがレムデシビル、アモジアキン、ウミフェノビルと高い相乗効果を示すことが報告されている[29]。
NTZは、従来の投与間隔では、血漿および肺におけるウイルス病原体のEC50を上回る平均/中央値のCmax濃度を持つと予測されている[30]。したがって、今回の試験では、中等度のCOVID-19患者の少人数グループを対象に、NTZの安全性と有効性をプラセボと比較して評価することを目的としている。そのために、臨床像が一致し、鼻腔および口腔咽頭ぬぐい液中のSARS-COV-2のRT-PCRが陽性の患者を選びました。
2. 方法
NTZの試験管内試験効果評価のため、VERO E6細胞を90%コンフルエントな細胞単層になるまで培養した後、DMSOおよびNTZを最終濃度0.1μM,0.5μM、1.0μM、10μMで1時間処理した。コントロールとして、モック感染細胞と未処理細胞を用いた。培養の1時間後、細胞に臨床分離されたSARS-CoV-2 EPI_ISL_413,016を0.05の感染多能性で感染させた。2時間のウイルス吸着期間の後、各ウェルをPBSで2回洗浄し、上述のNTZを含む500μLの新鮮な培地で完了し、さらに48時間培養した。感染後48時間目に上清を回収し、ウイルス量と細胞生存率を測定した。細胞生存率および細胞毒性効果は、乳酸脱水素酵素ベースの細胞毒性検出キット(Roche,Basel,Switzerland)を用いて、感染後48時間後に測定した。
本試験は、無作為化二重盲検臨床試験のパイロット版である。本試験の主な目的は、より多くの患者を対象とした試験の準備として、NTZを投与した患者の安全性およびSARS-COV-2 RNAの検出効果をプラセボと比較して評価することであった。COVID-19患者におけるNTZの安全性は、ここで調査すべき不確実な領域の1つであった。また、炎症マーカーがCOVID-19治療の臨床試験のエンドポイントとして価値があるかどうか、特にT細胞活性化マーカーについても検討したいと思う。試験対象者は、qPCRが陽性で症状が一致するCOVID-19と診断された50名で、年齢は18歳以上、性別は問わず、軽度の呼吸不全(PO2飽和度が96%以下)で重篤ではない状態で入院し、症状が出てから最大36時間経過していた(図1参照)。50名のサンプルサイズは、本臨床試験の実施可能性を考慮して、試験デザイン時に決定した。50人のサンプルに対する統計的検出力の計算は、試験が始まってから行った。試験期間中(1日目から21日目まで)にPCR-RTがより有意に減少した症例の割合の差に基づいて、検出力の計算を行った。エフェクトサイズ(2つの可能性のある結果を識別する能力)は、中程度の強さとされる0.5とした。また、アルファ誤差を0.05とし、サンプルサイズを各アーム25とした。計算に使用したソフトウェアは,統計プログラミングシステムRのpwrパッケージのpwr.2p.test(v.4.0.3)で,42.4%の検出力が得られた[34,35]。これは,完全な第3相試験研究には十分ではないと考えられるが,このパイロット試験には十分であると判断した。本試験は、ブラジル・サンパウロ州のInstituto do Coração – Incor(サンパウロ市)Beneficiencia Portuguesa(サンパウロ市)Vera Cruz病院(カンピーナス市)SPDM / Hospital Geral de Guarulhos(グアルーリョス市)Hospital Municipal Dr. Francisco Moran(バルエリ市)Hospital Prevent Senior(サンパウロ市)の計6病院が参加した多施設共同試験である。試験は2020年5月20日から 2020年9月21日まで行われた。サンプルと実験室での検査は、ブラジルのサンパウロにあるサンパウロ連邦大学のLaboratório de Retrovirologiaで処理され、インターロイキン分析はLaboratório Interdisciplinar de Pesquisa Médicas (Instituto Oswaldo Cruz/FIOCRUZ)で行われた。
図1

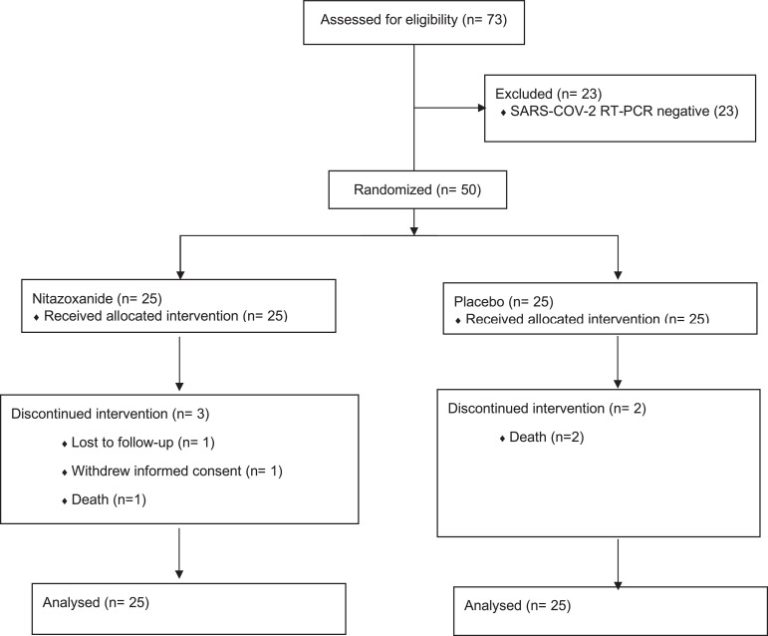
スクリーニングと無作為化 COVID-19の軽度/中等度の仮説で入院した患者(73名)をスクリーニングし,鼻腔および咽頭ぬぐい液でSARS-COV-2のRT-PCRが陽性になった時点で50名を無作為化した(RT-PCRの結果は入院後12時間以内に得られた).患者はニタゾキサニド(25人)またはプラセボ(25人)を投与するように割り当てられた。5人の患者は、割り当てられた試験介入による7日間の治療を受けなかった。Nitazoxanide群では、1名の患者が試験2日目に染色し、1名の患者が試験薬を4回投与され、インフォームドコンセントを撤回した。もう1人の患者は、試験の5日目に健康状態が良好なまま退院し、追跡調査ができなくなった。プラセボ群では、2日目に1名、4日目に1名の患者が染まった。すべての患者の利用可能なデータは、試験期間終了時までに解析されている。
HIV,HTLVⅠまたはⅡに感染している患者,抗悪性腫瘍剤治療を受けている参加者,免疫抑制状態にある重度の自己免疫疾患患者,移植を受けた患者,妊娠中または授乳中の女性,その他の臨床状態で健康および参加者の生命に差し迫った危険があると治験責任医師が判断した患者は除外された。また、COVID-19の治療薬や、モノクローナル抗体や抗インターロイキンなど、COVID-19の特異的症状に対する薬剤を過去に投与された患者は除外した。サンプル数が少ないため,RStudio ソフトウェア,バージョン 1.2.1335(Integrated Development for R. RStudio, PBC, Boston, MA URL www.rstudio.com/)を用いて,サイズ 4 のブロックによる無作為化を行った。契約研究機関(Azidus,ブラジル)が無作為化配列を作成し,参加者を介入群に割り当てた。無作為化後、患者は二重盲検法でNTZ 600mg BIDを7日間連続で食事とともに投与された(25名)またはプラセボ比較薬を7日間連続で食事とともに投与された(25名)。治験薬およびプラセボは、ロマーク研究所(NTZ特許保有者、米国フロリダ州)が発行したNTZ製造許可証を保有する製薬会社Farmoaquimica(FQM)社(ブラジル)が製造し、提供した。本試験では、薬物動態および忍容性に関する経験に基づき、NTZの600mg BID用量を選択した[23,26,28,31]。臨床評価は、入院期間中は毎日行い、入院21日以前の退院例では、外来診療所や遠隔医療でフォローアップを行った。この原稿は、CONSORTガイドライン(https://www.equator-network.org/wp-content/uploads/2013/09/CONSORT-2010-Checklist-MS-Word.doc)に厳密に従っている。
ウイルスの評価は、1日目(ベースライン、組み入れ基準)4日目、7日目、14日目、21日目に、鼻腔および咽頭拭い液から採取したSARS-COV-2の定性RT-PCR、およびqPCRウイルスロードによって行った。臨床状態,入院期間,院内死亡率,人工呼吸の必要性,再入院の必要性に関する評価が行われた。ベースライン、10日目、21日目に、超高感度RCP(US-RCP)d-ダイマー、CPK、CK-MB、血清インターロイキン、リンパ球活性化マーカーなどの臨床検査を行った。
製造元の指示に従い、SARS-COV-2 RT-PCR定性分析は、AllplexTM 2019-nCoV Assay、バージョン2.1,2020年10月30日に実施した。SARS-COV-2 RT-PCRウイルス負荷については、QIAamp RNA Viral kit(Qiagen,独)を用いてRNAを抽出し、抽出したRNA 5μLと、既述のようにSARS-CoV-2プライマーおよびプローブを含む反応バッファー15μL、およびHot Start go Taq reagent mix(Promega,Madison,Wi)を用いてRT-qPCRを行った。サーマルサイクルは,55℃で30分,続いて95℃で15分,さらに95℃で15秒,58℃で45秒を40サイクル行った。このプロトコルでは,SARS-CoV-2のRdRp標的nCoV_IP2を検出した。リアルタイムPCR装置(7500 Applied Biosystems)を用い、96ウェルプレートを用いてqRT-PCRを行った。合成RNAを用いて標準曲線を作成し,標準曲線のCTと各サンプルのCTを比較してサンプルのRNAウイルス量を求めた。
血漿中の IL-6, TNF, IL-8, IL-10, IFN-ɣ, IL-1β, IL-4, IL-5, IL-17A, IL-12p70, IL-13 のサイトカインレベルを評価し、Luminex テクノロジー(米国)を用いてサイトカイン含量を算出した。このために、マルチプレックスアッセイを行い、サイトカインの血清レベルを定量化した。データ解析は、メーカーが提供するソフトウェア(R&D Systems社、米国)を用いて行った。標準曲線とアッセイの感度を確立するために、組換えサイトカインを使用した。結果は、平均蛍光強度(MFI)で表した。各標準曲線の最終点のMFIを用いて、各サイトカインの検出限界を決定した。
リンパ球活性化マーカーは、フローサイトメトリーによってアクセスされ、他に記載されているように、CD4+およびCD8+ T細胞上のHLA-DR.およびCD38を含んでいた[36]。簡単に言うと、末梢血単核細胞(PBMC)を分離し、凍結保存した。解凍後、PBMCを抗CD3 APCおよび抗CD4 PercP(リンパ球系亜集団用)抗CD38 FITCおよび抗HLA-DR.PE(細胞活性化用)で標識した。PE(細胞活性化用)を使用した。固定した細胞をFACSCalibur装置で取得し、CellQuestソフトウェア(BD Biosciences, San Diego CA, USA)で解析した。結果は、CD4+およびCD8+ Tリンパ球のうち、CD38+HLA-DR.+細胞の割合で表した。
患者の分析はすべて、割り当てられた無作為化グループ内で行った。統計解析には、Kruskal-Wallisノンパラメトリック順位検定を用いた分散の一元解析が含まれた。その他の統計的疑問については、数値変数についてはWilcoxon Rank Sum Testを、カテゴリー変数についてはChi-Squared testを用いた。すべての分析は,R統計システムおよび言語とその適切なパッケージを用いて行った[35].12名の参加者が試験の早期に参加を中止し、そのうち5名はNTZ群、7名はプラセボ群であった。試験を早期に中止した参加者には、中止または死亡時までのすべての臨床検査および臨床データが記録・分析された。NTZ群では、1名が2日目(死亡)まで、1名が3日目(インフォームド・コンセントを撤回)まで、1名が5日目(追跡調査不能)まで、2名が7日目(死亡および追跡調査不能)までデータが収集された。プラセボ群では、2日目まで(死亡)が1名、4日目まで(死亡)が1名、7日目まで(死亡)が1名、10日目まで(死亡)が1名、14日目まで(死亡)が1名、15日目まで(死亡およびインフォームド・コンセントの撤回)が2名で、データが収集されていた。これらがデータ収集の唯一のギャップである。本研究は,ClinicalTrials.gov(NCT04348409)に登録され,ブラジル国立施設審査委員会の承認(CONEP;承認番号CAAE-30,628,420.0.0000.5412)および各地域の施設審査委員会の承認を得た。インフォームド・コンセントを得ている。
2.1. 資金提供者の役割
FMQは、原稿提出前に本研究のデータを確認し、ブラジル国立衛生局(ANVISA)への報告書を作成した。学術論文の著者は,研究デザイン,データ収集,データ分析,データ解釈,および原稿執筆のコントロールを保持した。
3. 研究結果
本研究は、NTZを投与したVero E6細胞でウイルス量が用量反応的に減少したことから、NTZの試験管内試験での活性を確認した後に開始した。また、DMSOによる感染経過への影響はなく、NTZ投与による48時間後の細胞毒性効果も認められなかった(補足図1)。
患者の特徴を表1に示した。各群のバランスは良好で、NTZ群では体重とBMIが高かった。その他の併存疾患の有病率はグループ間で同等であった(data on file)。WHOの勧告に従い、参加者の臨床経過は、経時的に疾患の重症度を測定する順序尺度を用いて評価した[33]。尺度は毎日実施し、最悪のスコアを記録した。WHO特別委員会に従って使用された順序尺度を、本研究の縮小されたサンプルサイズの評価を容易にするために、より少ないアンカー(5つ)を用いて以下のように適応した。1=外来患者,2=酸素を使用しない入院,3=非侵襲的酸素使用による入院,4=侵襲的酸素使用による集中治療,5=死亡。臨床的進化スコアの縦断的分析では、治療法間に有意差が認められた(表1,p=0.001)。両群とも、時間の経過とともにスケールスコアの減少が見られた。しかし、NTZ治療群の減少には有意な差が見られた(p<0.001)。4日目には、NTZ群の31.8%が外来治療を受け、9%が酸素吸入または集中治療室(ICU)に入院していたが、プラセボ群では外来治療を受けていたのは8.3%のみで、29.2%が酸素吸入またはICUに入院したままであった。7日目には、NTZグループの参加者の68.4%が外来治療を受けていたのに対し、プラセボの参加者は31.8%であった。14日目には、NTZグループの参加者の84.2%が外来治療を受けていたのに対し、プラセボの参加者は55%であった
表1 患者の特徴および臨床的、炎症的、ウイルス学的結果
| 腕
|
||||||||
|---|---|---|---|---|---|---|---|---|
| 21日目の違い
|
||||||||
| レベル | ニタゾキサニド | プラセボ | レート比 | P -Value | レート比 | P -Value | ||
| 番号 | 25 | 25 | ||||||
| 性別 (%) | 男性的 | 7(28) | 8(32) | 1143 | ||||
| フェミニン | 18(72) | 17(68) | 0,944 | |||||
| 人種 (%) | 白い | 21(42) | 16(32) | 0,762 | ||||
| 混合 | 3(6) | 7(14) | 2333 | |||||
| 黒 | 1(2) | 2(4) | 2000年 | |||||
| 年齢の中央値(中央値(IQR)) | 64(17) | 64(21) | 1000 | |||||
| 年齢層 (%) | 65未満 | 14(28) | 13(26) | 0,929 | ||||
| 65歳以上 | 11(22) | 12(24) | 1091 | |||||
| 高さ(平均(sd)) | 1.71(0.08) | 1.68(0.1) | 0,982 | |||||
| 重量(平均(sd)) | 89.2(17) | 76.18(13.04) | 0,854 | |||||
| BMI(平均(sd)) | 30.41(4.12) | 27.06(3.7) | 0,890 | |||||
| リリース日(平均(sd)) | 6.16(4.07) | 9.12(4.33) | 1481 | 0,021 | ||||
| 疾患スケールスコアの重大度(平均(sd)) | 1.7(0.8) | 2.13(1.03) | 1253 | 0,001 | ||||
| 1日目のウイルス量(平均(sd)) | 29.03(4.84) | 28.88(4.89) | 0,995 | 0,984 | ||||
| RT-PCRの違い1日目-21日目(平均(sd)) | −30.15(4.50) | −22.17(12.67) | 0,735 | 0,035 | ||||
| 補足O2から削除(平均(sd)) | 3.72(3.29) | 5.88(4.14) | 1580 | 0,082 | ||||
| 1日目のO2飽和度(オキシメータ)(平均(sd)) | 93.00(1.68) | 93.80(1.94) | 1009 | 0,984 | ||||
| 入院患者(#) | 4日目 | 12 | 16 | 1481 | 0,300 | |||
| 7日目 | 5 | 10 | 2222 | 0,134 | ||||
| 14日目 | 2 | 5 | 2778 | 0,202 | ||||
| 21日目 | 1 | 2 | 2222 | 0,503 | ||||
| 酸素補給(#) | 4日目 | 8 | 10 | 1389 | 0,487 | |||
| 7日目 | 5 | 6 | 1333 | 0,634 | ||||
| 14日目 | 2 | 3 | 1667年 | 0,572 | ||||
| 21日目 | 1 | 2 | 2222 | 0,503 | ||||
| 侵襲的人工呼吸 | 4日目 | 1 | 3 | 3333 | 0,268 | |||
| 7日目 | 1 | 4 | 4444 | 0,144 | ||||
| 14日目 | 1 | 1 | 1111 | 0,941 | ||||
| 21日目 | 0 | 0 | ||||||
| 死 | 7日目 | 2 | 3 | 2000年 | 0,564 | |||
| 14日目 | 0 | 2 | NA | 0,157 | ||||
| 21日目 | 0 | 1 | 2000年 | 0,564 | ||||
| リンパ球(平均(sd)) | 1日目 | 1029.36(526.66) | 944.88(619.43) | |||||
| 7日目 | 1162.36(689.14) | 1188.57(615.77 | ||||||
| D-ダイマー(平均(sd)) | 1日目 | 1.15(1.66) | 1.71(1.83) | |||||
| 10日目 | 1.16(1.67) | 1.65(1.79) | ||||||
| 21日目 | 1.18(1.71) | 1.82(1.96) | 0.026 € | 1943年 | 0,001 | |||
| US- C反応性タンパク質(平均(sd)) | 1日目 | 47.11(70.51) | 96.23(110.43) | |||||
| 10日目 | 46.33(70.56) | 87.85(106.53) | ||||||
| 21日目 | 45.35(71.26) | 88.13(101.72) | <0.001 € | 1544 | 0,002 | |||
| TNF-α(MFI(sd)) | 1日目 | 155.54(53.46) | 196.17(62.97) | |||||
| 10日目 | 126.06(33.76) | 167.69(132.92) | ||||||
| 21日目 | 136.17(38.38) | 149.12(45.88) | <0.001 € | 1095 | 0,038 | |||
| IL-6(MFI(sd)) | 1日目 | 571.19(557.70) | 1024.55(1242.96) | |||||
| 10日目 | 323.14(685.86) | 943.60(1395.63) | ||||||
| 21日目 | 114.19(61.02) | 412.86(407.52) | <0.001 € | 3616 | <0.001 | |||
| IL-8(MFI(sd)) | 1日目 | 291.72(145.17) | 205.88(167.34) | |||||
| 10日目 | 196.65(85.82) | 164.25(56.53) | ||||||
| 21日目 | 180.06(72.12) | 250.57(133.17) | <0.001 € | 1392 | 0,014 | |||
p値:ノンパラメトリック、Wilcoxon検定。Sd = 標準偏差。
€=進化のp値。MFI = Media Intensity Fluorescenceの略。
死亡数/割合/頻度を検討したところ、NTZ群で2名、プラセボ群で6名、合計8名の死亡が確認され、すべてARDSによる死亡であった(p=0.564)。また、侵襲的人工呼吸を必要とした人数を評価したところ、NTZ群2名、プラセボ群6名の合計8名で、同様の差が見られた(p=0.08)。酸素補給から離脱するまでの期間を評価したところ、NTZ群の離脱期間の中央値は3日であったことが確認された。一方、プラセボ群では8日であった(p=0.08)。退院までの平均日数は、プラセボ群が14日だったのに対し、NTZ群は6.2日であった(p=0.021)。
NTZ群では2名の患者が死亡した。この2名のうち、患者P3は67歳の男性で、全身性動脈性高血圧症(SAH)BMI(body mass index)25であった。ベースラインの臨床検査では、総リンパ球数702(総白血球数7800から9%)d-ダイマー0.94(0,5mcg/mLまでが正常)US-RCP193.45mg/L(3mg/Lまでが正常)IL-6 557.5MFIであった。試験開始から8日後にARDSで死亡した。NTZグループのもう一人の患者P6は、63歳の男性で、2型糖尿病と脂質異常症を患っており、BMIは31であった。ベースラインの臨床検査では、総白血球数14,250(リンパ球数1100)d-ダイマー0.78mcg/ml、US-RCP107.07mcg/L、IL-6 163.0MFIであった。また、試験開始後8日目にARDSで死亡した。プラセボ群で死亡した患者のうち、P8は88歳の女性で、SAHを発症し、BMIは24であった。ベースラインの臨床検査では、総リンパ球数680(総白血球数7560)d-ダイマー1.56mcg/ml、US-RCP345.67mcg/L、IL-6 4872MFIであった。穿孔性憩室炎によるARDSと腹部敗血症でD21に死亡した。患者P14は65歳の女性で、以前はあまり定義されていなかった心筋症で、BMIは25であった。ベースラインの臨床検査では、総リンパ球数2320(総白血球数10,340)d-ダイマー0.8mcg/mL、US-RCP 319.83mcg/L、IL-6 4658MFIであった。D4にARDS、難治性心原性ショック、急性腎不全で死亡した。患者P24は、55歳の男性で、2型糖尿病、BMI26であった。ベースラインの臨床検査では、総リンパ球数970(総白血球数10,500)d-ダイマー0.58mcg/mL、US-RCP19.36mcg/L、IL-6 239.5MFIであった。D5にARDSで死亡した。患者P27は71歳の男性で、過去に合併症はなく、BMIは24であった。患者P27は71歳の男性で、既往症はなく、BMIは24であった。ベースラインの臨床検査では、総リンパ球数470(総白血球数12,950)d-ダイマー0.94mcg/mL、US-RCP166.77mcg/L、IL-6 849.0MFIであった。D14日にARDS、細菌性敗血症、全身出血、急性腎不全、難治性ショックで死亡した。患者P17は78歳の男性で、ヘビースモーカー、BMIは32であった。ベースラインの臨床検査では、総リンパ球数460(総白血球数11,710)d-ダイマー0.8mcg/mL、US-RCP94.53mcg/L、IL-6 585MFIであった。D3にARDSで死亡した。プラセボ群で最後に死亡したのはP43で、73歳の女性で、肥満(BMI32)であった。ベースラインの臨床検査では、総リンパ球数930(総白血球数13,480)d-ダイマー0.82mcg/mL、US-RCP187.59mcg/L、IL-6 417MFIであった。D12日にARDSと急性腎不全で死亡した。
SARS-COV-2定性RT-PCRの結果は、経時的に群間で有意差があり、NTZ群に有利であった(p=0.045)。21日目には治療法間で有意差があり(表1,p=0.035)RT-PCR陰性の割合は、プラセボ群の78.9%に対し、NTZ群では100%であった(19例中15例、21日目までに6例が死亡したため)。SARS-COV-2ウイルス量は治療群間で差がなく、両群のウイルス量は時間の経過とともに有意に減少した(p < 0.0001)。図2は、21日間の試験期間中、NTZ投与群のウイルス量がプラセボ投与群よりもわずかに早く低下したことを示している(傾きはプラセボ投与群の-1.08に対してNTZ投与群の-1.19)。
図2 Nitazoxanide(NTZ)とプラセボの2つの治療群のウイルス量の相対的な傾き
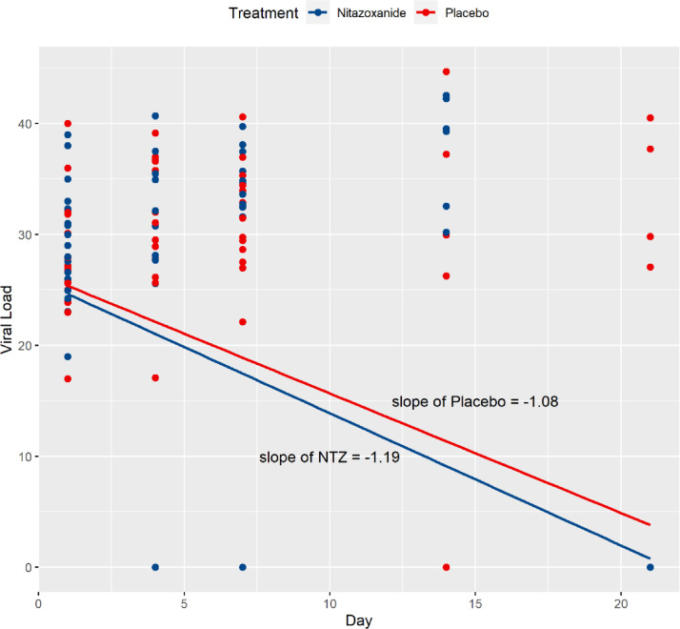
表1に見られるように、d-DimerやUS-RCPなどの非特異的な炎症マーカーは、NTZ群の方がプラセボ群よりも有意に減少した。同様に、TNF、IL-6,IL-8などのインターロイキンの血漿レベルの低下はNTZ群でより顕著であったが、IL-10,IFN-ɣ、IL-1β、IL-4,IL-5,IL-17A、IL-12p70,IL-13については有意な差は見られなかった(data on file)。
CD4+T細胞およびCD8+T細胞のCD38およびHLA-DR.に見られるように、リンパ球のT細胞活性化マーカーは、NTZ群、プラセボ群ともに、常に経時的に減少する傾向を示した(図3)。CD4+T細胞のHLA DR.は、21日目にNTZ群がプラセボ群よりも有意に低かった(p<0.05;図3B)。同様に、CD4+およびCD8+ T細胞リンパ球におけるCD38のレベルは、21日目にNTZ群で低くなっていた(いずれもp<0.05;図3Aおよびand3C)。さらに、両マーカーの共発現を評価したところ(CD38とHLA-DR.)21日目のCD4+ T細胞においても両試験群間で有意な差があり、NTZが有利であった(p<0.01,図3E)。
図3 NTZ群とプラセボ群のT細胞活性化状態の経時変化。全群の患者の末梢血単核細胞

(PBMC)は、フィコール・ハイパーク勾配遠心分離で得た。1日目、10日目、21日目にPBMCを融解し、免疫表現型解析に用いた。CD38+CD4+T細胞(3A)HLA-DR.+CD4+T細胞(3B)CD38+CD8+T細胞(3C)HLA-DR.+CD8+T細胞(3D)CD38+HLA-DR.+CD4+T細胞(3E)およびCD38+HLA-DR.+CD8+T細胞(3F)のMFIは、中央値±標準偏差で表した。プラセボは黒丸、Nitazoxanideは緑丸で表示した。
合計36件の有害事象が観察され、NTZ群で14件、プラセボ群で22件であった(p=0.24)。薬剤との関連が考えられる6件のうち、4件はNTZ群、2件はプラセボ群で発生した(p=0.99)。治療薬との関連が考えられない30件の有害事象のうち、21件はプラセボ群で発生した(p=0.04)。
治療薬との因果関係が考えられる有害事象のうち、NTZ群では軽度が1件、中等度が3件であり、プラセボ群では軽度の有害事象のみが検出された。NTZ群の有害事象のうち2件は重度(死亡)であった。肝酵素の上昇、腎不全、消化器症状、頭痛など、従来、有害事象として想定されていたものを考慮すると、プラセボ群の発現率が高かったのは、ウイルスが宿主の様々な臓器や組織にダメージを与えたことに起因すると考えられる。有害事象の全リストは、補足表1および2に記載されている。
4. 考察
SARS-COV-2の複製サイクルを中断できる特異的な抗ウイルス剤がないため,我々は中等症のCOVID-19患者を対象にNTZの安全性と有効性を検討するため,プラセボ対照パイロット試験を計画した。まず、我々の研究室では、SARS-COV-2に対する明白な抗ウイルス活性の存在を示し、また、SARS-COV-2ブラジル共通株を用いた試験管内試験において、この薬剤による細胞毒性がないことを証明した(補足図1)。しかし、他の新興ウイルス変異株における効果はまだ明らかになっていないと認識している。我々は、パイロット試験に参加した患者にどのような変異株が存在し、これらの特定の株に対するNTZの抗ウイルス活性を検討していない。NTZが安全な薬剤であることは理解しているが、今回検討した用量は比較的控えめであり、600mg BIDを用いてインフルエンザウイルスに対する抗ウイルス効果を検討した過去の研究に基づいている[28]。なお、NTZは1000mgBIDで採用されたことがあるが、安全性には大きな問題はなかった[29,31,32,37]。また、以前の投与量推定では、SARS-COV-2の抑制濃度をConcentration troughレベルにするためには、より高用量が必要であることが示されている[38]。現在、NTZの1500mg BID用量がイギリスで第I相安全性試験で検討されていることが報告されている[38]。今回の臨床試験では、治療期間が短かったものの、最適な用量でない単剤治療は、薬剤の選択圧の下でウイルスの複製を可能にし、薬剤耐性株の選択の危険性があるため、COVID-19に対する抗ウイルス介入が緊急に必要とされる時期に、この薬剤の活性を危うくする可能性があると認識している。しかし、まだ安全と考えられている薬剤であっても、新規疾患の場合には、最初は投与量を大幅に増やさず、重症度の高くない患者で試験を行うべきであることを理解している。学習経験として、ヒドロキシクロロキンを用いたある研究では、重症度の高い患者のCOVID-19に高用量を使用したところ、許容できないほどの死亡率の上昇が見られた[39]。さらに、SARS-CoV-2に対するNTZの推定IC50およびIC90は0.68μg/mLおよび1.84μg/mLであり[37]、NTZ 300mgを1日2回投与した場合、血漿中のピーク濃度は4.6μg/mLとなり、試験管内試験の抗ウイルス濃度をはるかに超えていた[23,28]。
パイロット臨床試験は、通常、有効性や効果を検証するには不十分であるが、いくつかの臨床的および実験的なエンドポイントが評価された。死亡数に治療法間で統計的に有意な差がなかったとしても、治療法間の死亡数の割合の予想差(16%)は臨床的に重要であると考えられ、より大きなサンプルサイズの研究で考慮すべき傾向であることが観察された。同様に、侵襲的機械式人工呼吸を必要とした被験者の数は、統計的に有意ではないものの、プラセボ群の方が多く(p=0.08)やはりサンプルサイズを大きくすることで何らかの違いが明らかになる可能性がある。また、酸素補給を中止するまでの期間(3日対8日)は、統計的に有意ではなかったが(p=0.08)退院までの平均期間がNTZ群で低かったことを加えると、臨床エンドポイントの一貫性が明らかになるかもしれない(p=0.021)。
この試験の主要評価項目は、NTZによる治療に対するウイルス学的反応であり、SARS-COV-2のPCRが陰性で試験を終了した患者の数には、統計的に有意な差が認められた。同様に、US-RCPの減少に見られるように、急性炎症過程はNTZ群でより有意に減少した。COVID-19では、US-RCPが予後の悪化と進化の悪化に関係していることが認識されている[40,41]。ここでは、この非特異的な炎症マーカーの減少が、ウイルス感染のより良い制御に対応していると推測することができる。驚くことではないが、IL-6は患者の間で上昇し、NTZ群ではより高い減衰が見られた。IL-6は、様々な種類の細胞から血液中に放出され、急性期反応を誘発する重要な炎症性メディエーターとして作用し、発熱、白血球の動員、活性化、血行動態への影響など、局所的および全身的な変化を引き起こし、疾患悪化のリスクを高めるマーカーでもある[42]。
その上、NTZ群ではプラセボ群に比べて21日目にTNF値が低く、統計的に有意な減少が認められた。TNFは、COVID-19で最も変化するサイトカインの1つであり[43,44]、抗TNF薬を用いてこの疾患の炎症性亢進期を制御する提案が存在する。抗TNF療法は、COVID-19における炎症に起因する毛細血管の漏出を緩和し、その結果、呼吸不全や死亡率を低下させることが考えられる[45]。また、NTZの使用に伴うTNFの有意な減少は、COVID-19の回復過程における別の利点に対応することももっともである。さらに、IL-8はNTZ群でベースライン期間と比較して疾患の21日目まで有意に減少したが、これは試験のプラセボ群では起こりなかった。入院時の血清IL-6,IL-8,TNF-αの高値は、患者の生存率の強力かつ独立した予測因子であることが実証されている[44]。また、IL-8は、炎症時の好中球の動員と活性化に極めて重要な役割を果たす強力な炎症性サイトカインであり、IL-8はCOVID-19の患者に頻繁に見られる好中球増加症に寄与している可能性がある[46]。IFN-I(IFN-α、IFN-β)など、防御効果を示す可能性のある他のIFNは測定しておらず[21,22]、我々が提案した治療法に関しては、この情報はまだ不足している。
我々は、中等度のSARS-CoV-2感染が、CD4+およびCD8+ T細胞リンパ球におけるCD38およびHLA-DR…. のレベルから推測されるリンパ球T細胞の活性化をもたらし、試験薬がこの細胞の活性化を緩和することができるかどうかを検討した。リンパ球減少は疾患経過の悪化と関連しており、リンパ球数の正常化はCOVID-19の回復を示していた[47]。そのため、細胞活性化パラメータを分析する際には、疾患の回復に伴うリンパ球T細胞の活性化を過大評価しないよう、細胞数の割合ではなくMFIを評価することにした。興味深いことに、これらのマーカーはいずれの患者群でもベースラインでは高く、時間の経過とともに徐々に低下していることが確認できた。
さらに、21日目のCD4+ HLA-DR.+ T細胞リンパ球の減少は、NTZ投与群がプラセボ群よりも有意に高かった。これは、治療を受けた患者のCOVID-19炎症が薬剤によって減少したことに関連する証拠の1つである。なお、IL-6の産生源である単球については、本試験では評価していない。ICUでCOVID-19を投与された患者では、IL-6を産生するCD14+ CD16+単球の著しい増加が観察されたことが報告されている[48]。
本試験の主な目的の1つは、COVID-19患者におけるNTZの安全性を評価することであったが、興味深いことに、有害事象の発生率はプラセボ治療を受けた患者で有意に高かった。この差は単なる偶然によるものかもしれないが、有害事象はCOVID-19に関連した症状であり、NTZ投与群では軽減できた可能性があると言える。本試験はサンプル数が少ないため、臨床的なエンドポイントを分析した場合、治療群がプラセボよりも優れていることは期待できなかった。しかし、疾患の症状、酸素離脱、退院などのアウトカムを評価したところ、NTZ投与群が優れてた。
COVID-19のようなウイルス感染症を効果的に治療するためには、他のウイルス感染症と同様に、様々なウイルスの複製サイクル段階に作用する抗ウイルス剤を併用することが必要であると考えられる。3´-5′校正活性を持つエキソヌクレアーゼによって行われるウイルス核酸の重合を修正するメカニズム[49]があったとしても、これはこのウイルスの遺伝的多様性を減少させ、耐性変異株が急速に選択される可能性を緩和するものであり、少なくとも抗ウイルス治療の効力を高めるためには、複数の薬剤の組み合わせが必要であることが考えられる。このような背景から、NTZはSARS-COV-2の複製サイクルの2つ以上の段階で抗ウイルス作用を発揮すると考えられる。異なるウイルスでは、この薬剤はウイルスのRNAおよびDNA複製の阻害と、ウイルスのタンパク質発現の直接的な阻害を同時に行っている[23,25]。さらに、宿主の細胞代謝に干渉するメカニズムとして、NTZによるインターフェロンの増量があり、それ自体が追加の抗ウイルスメカニズムに関係していると考えられる[23,24]。しかし、SARS-CoV-2感染症に対するNTZの効果は、より大規模な臨床試験で確認されれば、その作用機序がより明確になることが必要であると考えられる。また、特にウイルス量が多い場合には、ウイルスの抵抗性によるNTZ治療からの逃避についても評価する必要がある。SARS-COV-2の進化に伴い、ブラジルのアマゾンのP.1株のような新しい新興株では、より高い感染力と高いウイルス量が示唆されている[50]。
今回発表された結果は、軽症のCOVID-19を対象とした大規模な無作為化プラセボ対照臨床試験とは対照的であり、NTZ群でウイルス量が有意に減少したことが記録されているにもかかわらず、臨床的有用性は検出されなかったことを認識している[51]。この試験では、NTZ 500mgを5日間TIDで投与したのに対し、我々の試験では600mgを7日間BIDで投与した。実際、軽症のCOVID-19は、病気が自然に治癒するため、抗ウイルス治療(もしあれば)の恩恵を受けないと推測できる。軽度のCOVID-19の無作為化患者475名のうち、死亡は報告されず、ICUに入院したのは2名のみで、いずれもNTZ群であった[51]。
この試験で得られた免疫学的および炎症学的所見を解釈するには、NTZの直接的な免疫調節作用と、NTZの抗ウイルス作用およびそれに伴うウイルス複製の減少に起因する間接的な免疫学的影響とを切り離すことができないため、若干の注意が必要である。また、NTZの場合、プラセボ対照試験の二重盲検性が損なわれることを認識している。NTZは、一部の人の尿の色から肉眼で確認できる効果をもたらす。また、このような少数の患者を対象とすることで、頻度の低い有害事象の発生が不明瞭になる可能性がある。このような顕著な炎症性の特徴を持つ疾患に、これまで使用されていなかったこの薬剤が関連することで、重篤な症状が発生する可能性がある。しかし、本試験の臨床的および実験的結果は、中等度/重度のCOVID-19を対象とした第3相試験を実施する動機付けとなった。今回の試験の限界として、薬物動態データがないことを認識している。異なる作用機序に対する本薬の最も適切な投与量についての理解が不十分であることを考慮すると、第3相試験に集中的な薬物動態解析のサブスタディを組み込むことが基本となるであろう。
結論として、今回の小規模な概念実証パイロット試験では、退院までの期間が明らかに短縮され、SARS-COV-2 RT-PCR陰性化が早まり、d-Dimer、US-RCP、TNF、IL-6,IL-8などの炎症マーカーがより低下し、CD4+のHLA DR.やCD38などのリンパ球T細胞活性化マーカーもより低下したことが確認できたという。CD4+のHLA DR、CD4+およびCD8+ TのCD38,CD4のCD38およびHLA-DR.などのリンパ球T細胞活性化マーカーの低下が、NTZ投与群ではプラセボ投与群と比較して高かった。