Contents
Molecular Mechanisms of Exercise and Healthspan
www.ncbi.nlm.nih.gov/pmc/articles/PMC8909156/
2022年3月3日オンライン公開
運動と健康寿命の分子メカニズム
要旨
健康寿命とは、我々が生きている間に大きな疾病に罹患することなく過ごすことができる期間のことだ。不健康なライフスタイルの選択と慢性疾患が健康寿命を縮め、莫大な経済的負担をもたらす現代社会では、健康寿命を促進する方法を見つけることが科学界の緊急の目標になっている。運動は、人類が最も古くから行ってきた効果的なライフスタイルの介入方法の一つであり、多くの慢性疾患の治療と予防の両方を可能にするため、その解決策の中心になると思われる。ここでは、定期的な運動が臓器系の機能性を高め、病気を予防することによって健康寿命を延ばすことについての現在のエビデンスと意見をレビューする。
キーワード:健康寿命、運動、慢性疾患、適応症
1. はじめに
中国最初の皇帝、秦の始皇帝が不老不死の薬を全国的に探すよう命じてから、2200年が経過した。秦の始皇帝は、不老不死の薬を探すよう命じ、その努力もむなしく、8000体の兵馬俑を作り、長寿の追求を禁ずるために一緒に埋葬された[1]。現代医学の歴史を通じて、皇帝の夢と同じように、科学者たちは寿命を延ばす方法の探求を止めることはなかった。過去50年間、莫大な投資による大規模な研究開発により、米国では寿命が10年延びました[2]。2019年、世界の65歳以上の人口は7億300万人を超え、この数は2050年には15億人を超えると予測されている[3]。しかし、健康寿命(大きな衰弱のない人生の期間)は、延長されていない[2]。加齢は、ほぼすべての慢性疾患の最も重要な危険因子であるため [4,5]、健康寿命の改善なしに寿命が延びると、社会の著しい高齢化と経済の持続不可能性につながるという難問が生じる。
ここ数十年の研究から得られた証拠や理論によると、人間の寿命は主に自然原因(慢性疾患)と遺伝によって設定された限界に達しているか、それに近づいている可能性がある[6,7]。「ヘルシーエイジング」、つまり、人が加齢に伴う永久障害や慢性疾患に罹患する前に、健康な生活の余命を最大限に延ばすという概念が、過去20年間に出現し、大きな人気を博している[8,9,10]。21世紀には、健康寿命の延長に関する研究が切実に求められている [11,12,13]。現在までに、米国では2100件以上の臨床試験が行われており、慢性疾患の状況下で生活の質(QOL)を向上させる治療法に焦点が当てられている。寿命と同様に、健康寿命も多くの要因、すなわち遺伝、環境要因、社会経済状態、食事摂取や身体活動などのライフスタイルの選択によって影響を受ける可能性がある。
2. 健康寿命を延ばすための薬としての運動
健康寿命を延ばすための最も古く強力な「薬」は、組織化され、目的を持って繰り返し行われる身体活動、すなわち運動トレーニングである。外科医による最初の運動処方の記録は、古代ギリシャや中国の黄河文明など様々な古代文明に数千年前にまで遡ることができます [14] 。ここ数十年の公衆衛生研究により、高い体力が全死因死亡率や慢性疾患、特に心臓血管疾患、代謝障害、がんの発症を遅らせる最も重要な要因であるという議論の余地のない証拠が示されている [15,16,17].また、長期の運動トレーニングが、心肺系、筋骨格系、神経系、内分泌系、免疫系など、複数の器官系の分子基盤を再構築することが、膨大な数の研究証拠によって証明されている [18,19,20].例えば、Wenらは、40万人以上を対象とした12年間の研究において、1日15分または1週間に90分の中強度の運動でも全死亡率を低下させることができるという結論に至る証拠を発見した[21]。
全体として、運動は持久運動とレジスタンス運動の2種類に分けることができる。持久的運動は、しばしば有酸素運動と呼ばれ、距離走、水泳、サイクリングなどの酸素利用エネルギー代謝、すなわちミトコンドリア呼吸に大きく依存する運動レジメンと定義される。持久的運動の主な効果は、心肺機能の強化とともに、骨格筋のミトコンドリア量、毛細血管密度、遅筋の酸化性筋繊維の質量および速筋の酸化性筋繊維の割合の増加である[22,23,24]. レジスタンス運動は、時に無酸素運動と呼ばれ、酸素消費にあまり依存せず、短時間で力を生み出すために、主に嫌気性エネルギー代謝、すなわちクレアチンリン酸(CP)と嫌気性解糖に依存する。代表的なレジスタンス運動のレジメンは、バイセップカール、レッグエクステンション、スプリント、パワーリフティングのような重く、低レップのウェイトトレーニングである。レジスタンス運動の適応には、主に速筋、解糖系筋の肥大が含まれ、通常ミトコンドリア量は増加しないか、中程度にしか増加しない [25,26]。最近の証拠では、ミトコンドリアの量は変化しないかもしれないが、抵抗運動は既存のミトコンドリアの機能性を改善する可能性があり、抵抗運動はミトコンドリアの質の調節にも寄与することが示唆されている [27]。
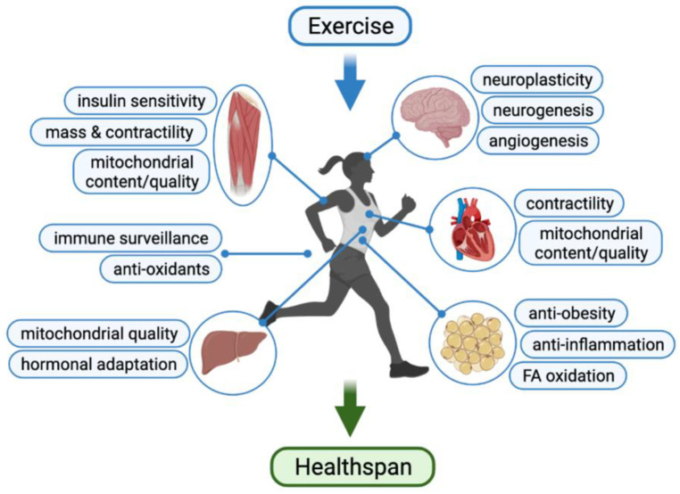
運動の最も直接的な実行者は骨格筋と心臓であるが、定期的な運動は、健康に優れた多面的な利点を持つ、ほぼすべての器官系における全身的な変化にもつながる(図1)。このレビューでは、運動トレーニングが、心血管系、骨格筋、神経系の機能を高め、がんの発生を予防することによって健康寿命を促進する上でいかに重要であるかについて、現在の見解とエビデンスをまとめる。
図1健康寿命の延伸における運動効果の図解
3. 循環器系
3.1. 心血管系機能促進における運動効果
心血管系疾患は、世界中のすべての死亡原因の第一位であり、座りがちなライフスタイルは最大の危険因子の一つである[28,29]。心肺体力の最も直接的な臨床指標は心拍出量とVO2maxで、どちらも加齢とともに低下する主要なパラメータであり、健康寿命を決定する要因になる可能性がある[30]。心拍出量は、1分間に左心室から送り出される酸素を含んだ血液の量と定義され、一回拍出量と心拍数の積として計算される。健康な人であれば、厳しい運動によって心拍出量は4倍増加し、訓練されたエリートアスリートでは、この増加は6~8倍に達する可能性がある[17]。VO2maxは、運動中にすべての臓器系で利用される最大酸素量のことだ。1980年代以降、VO2maxは年齢、性別、運動モードに関係なく、持久的運動トレーニングによって増加することがよく分類されており、老化関連疾患の危険因子の重要な測定値である[31]。Griesらによる徹底的な分析では、成人期の運動トレーニングによるVO2maxの向上は、アスリートでは80歳代まで維持できることが示されている[32]。
運動を介した心血管系の健康増進のメカニズムとして、心不全の原因となる線維化などの病理学的変化を伴う病的肥大とは対照的に、生理的肥大、すなわち、収縮機能の強化とともに心筋量が増加することが提案されている。生理的肥大は、運動トレーニング中の壁応力の増加やその他のシグナル伝達事象に反応して起こる。一連の研究により、インスリン受容体基質1/2(Akt1/2)、IGF受容体、ホスホイノシチド3キナーゼ(PI3K)などのインスリンおよびインスリン様成長因子1(IGF1)経路が、マウスの運動を介した生理的肥大に重要であることが発見された[33,34,35,36,37]。肥大に加えて、収縮装置のリモデリング、ミトコンドリアのリモデリング、代謝の変化、血管新生を含む他の多くの適応も、遺伝子発現の変化とともに運動トレーニング中に起こる [33,38,39].運動トレーニングに応じた生理学的な心臓の成長に関連する他の経路は、まだ十分に解明されていない。したがって、今後、運動による生理的肥大と心機能強化の背後にあるメカニズムの徹底的な調査に焦点を当てた研究が、運動の健康寿命への利益に関する新しい洞察を提供することになる。
3.2. 心血管系疾患(CVD)改善における運動の効果
持久的運動は、健康寿命を縮める最大の危険因子である心筋梗塞 [40,41,42,43,44] 、動脈硬化 [45,46] 、高血圧 [47,48,49] に対して予防と治療の両方の効果があることも実証されている。長期間の持久力運動は、加齢に伴う心拍出量とVO2maxの低下を遅らせ、疾病予防とQOLの向上に寄与することが多くの証拠から示されている[50,51,52,53,54]。過去10年間で、「医学としての運動」という考え方が非常に広まり、患者の心血管系の問題に取り組むための運動レジメンと方法論に焦点を当てた多くの臨床研究が行われるようになった [55,56,57,58] 。全体として、心血管系疾患の患者には、中等度から低強度の(最大HRが60%未満)持久運動を週3~5回の頻度で処方することが推奨されている[55]。過去50年間、運動を介したCVDに対する保護と虚血再灌流(I/R)などの心臓損傷からの回復促進の分子メカニズムを解明するために多大な努力がなされてきたが、我々の理解はまだ不完全である。
心不全は、世界的な死因の上位を占めている。運動は、心不全を予防し、さらに心筋損傷を引き起こすことなく治療するための最良の介入である [59,60,61,62,63] 。1999年のヒト慢性心不全患者への運動介入における初期の研究では、中強度のサイクリング(60%VO2max)を1年間行うことで、心臓の予後とQOLの改善が見られた [64] 。心不全に対する運動効果のメカニズムは多面的であり、正確な分子標的が明確に理解されていない。運動が心不全予防にプラスの影響を与える可能性のある側面としては、エネルギー代謝の向上 [39,65] 、酸化ストレスの緩和 [66] 、ミトコンドリア機能の改善 [64,67] などがあるが、その分子メカニズムの明確な解明はまだである。
アテローム性動脈硬化症は、世界中で何百万人もの人々が罹患している慢性血管疾患である。動脈硬化の病理は複雑で多面的であり、炎症因子と内皮の活性化が初期に寄与し、最終的に動脈壁病変が形成され、コレステロールを多く含む脂質が血管内に閉塞を形成し、有害な損傷を引き起こす。運動は、動脈硬化の発症を予防する方法として、(1)内皮機能を高め、(2)抗炎症および抗酸化作用を示すことが発見されている [68,69,70,71,72,73,74,75,76].
全体として、CVDにおける運動効果の基礎となる分子メカニズムは、多面的であり、不完全に理解されている。何よりもまず、運動によって誘導される生理的なストレスシグナルが鍵になる可能性がある。運動におけるストレスシグナリングキナーゼとして最も研究されているのは、5′AMP-activated kinase(AMPK)であり、エネルギー的ストレス、すなわちAMP/ADP濃度の上昇の際に活性化されるからである[77]。長年の研究により、虚血再灌流(I/R)、線維化、血管機能不全などのCVDにおいて重要なシグナル伝達分子であることが判明している[78,79,80,81,82]。AMPK は、触媒αドメイン、非触媒βドメイン、および制御、AMP/APD 結合γドメインを有するヘテロ三量体複合体である。各サブユニットは、別々の遺伝子によってコードされる異なるアイソフォームを有し、これにより異なる組織のAMPKの発現が決定される(α1、α2、β1、β2、γ1、γ2、およびγ3)。心臓では、α2-、β2-、γ1-サブユニットが最もよく発現している[83]。急性運動は、エネルギー的ストレスとシグナル伝達イベントを引き起こし、AMPKが感知して活性化し、一連のリン酸化カスケードを引き起こして下流のシグナル伝達を調節する。最近の証拠では、AMPKの細胞内局在も重要である可能性が示唆されており、例えば、運動はミトコンドリアに関連するAMPKを特異的に活性化する可能性がある[84]。細胞内AMPKプールに関する今後の研究により、AMPKがどのように運動効果を制御しているかについての理解が深まるであろう。
ミトコンドリアは、CVDの進行に中心的な役割を果たすため、運動を介したCVDからの保護においても重要な役割を果たす可能性がある [85,86] 。運動トレーニングは、ミトコンドリア量(生合成)と動態(分裂、融合、マイトファジー)の両方を改善する可能性がある。ミトコンドリアおよび酸化代謝のマスター転写共活性化因子であるペルオキシソーム増殖因子活性化受容体共活性化因子(PGC-1α)の転写および存在量の増加が、運動後のミトコンドリア生合成の増加に関与することが十分に確立されている[87,88,89]。さらに、最近の証拠では、量の増加と並んで、ミトコンドリアの質の向上もまた、CVDから心臓を保護する重要な要因である可能性があることが示唆されている[67,90,91,92]。ミトコンドリアの質は通常、O2消費量、膜の完全性、形態で測定され、これらはすべて定期的な運動によって向上させることができる[93,94,95,96,97,98]。2019年の研究では、糖尿病性心筋症における心機能の維持には、マクロオートファジーよりもマイトファジーが重要であることが判明した[99]。このモデルでは、運動によるマイトファジーの必要性は検討されていないが、他の心損傷モデルでは、運動がマイトファジーのアップレギュレーションを通じて心機能の維持に役立つ可能性が疑われている[100,101,102]。
最後に、持久的運動による骨格筋由来の液性因子は、疾患条件下での心不全の病的な進展に対して保護する可能性がある。例えば、細胞外スーパーオキシドジスムターゼ(EcSOD)はスーパーオキシドスカベンジャーであり、運動により骨格筋で発現が上昇し、循環を介して心臓を含む末梢組織/器官に移動し、糖尿病性心筋症を予防することが知られている[103,104]。
4. 骨格筋
4.1. 骨格筋の量と強さにおける運動効果
骨格筋の質は、筋量(筋線維の数と大きさ)と筋力(筋線維の力の生成と収縮性)で構成され、運動性、バランス、運動協調性に重要であるため、QOLにとって最も重要な要因の1つである。重要なことは、筋肉量と筋力の両方が減少すると、健康寿命が短くなることである [105,106]。加齢に伴う骨格筋量の減少(サルコペニア)及び虚弱は、高齢者における最も一般的な疾病の原因の一つであり、60歳以上の人口の10%以上に影響を及ぼす[107,108,109]。しかし、筋肉量の減少は、定期的な運動によって大幅に遅らせたり、予防することができ、健康寿命を延ばすことができる[110,111]。臨床研究によると、加齢による筋断面積の減少は、若い人と比べて20~25%程度であることが分かっている[112,113]。重要なことは、無酸素運動は、筋断面積または筋量によって測定される加齢に伴うサルコペニアを有意に遅らせることができることである [113,114,115] 。また、持久的な運動もサルコペンの状態を改善することができることを示唆する証拠もある[116,117]。
運動を介した筋肉量の促進および保存の基礎となる機序は、十分に理解されていない。いくつかの標的が、筋肉量の調節に重要な役割を果たすものとして同定されている。ミオスタチンは、トランスフォーミング成長因子-β(TGF-β)スーパーファミリーのメンバーであり、筋肉の成長を逆調節し、サルコペニア患者では発現が増加している [118] 。持久運動とレジスタンス運動の両方がミオスタチンの筋肉と血漿レベルを低下させ、これは筋肉の衰弱の緩和に寄与する可能性がある[119,120,121,122].siRNAによるミオスタチンのノックダウンと持久的運動トレーニングの組み合わせは、常在幹細胞の活性化を伴う骨格筋の肥大を促進することが示されている[123]。また、Akt-mTOR経路などの同化シグナルを介したタンパク質合成も、運動トレーニングによる筋肉量の改善と関連していることが研究により示されている[124,125]。興味深いことに、ラパマイシン感受性と非感受性の両方のmTORが、レジスタンス運動による筋タンパク質合成に重要であるようである[126,127]。さらに、筋肉の消耗に寄与するMuRF-1やAtrogin-1などのタンパク質分解性ユビキチンリガーゼは、運動トレーニングにより減少させることができる[128]。全体として、運動の利点は明らかに多面的なメカニズムである。したがって、今後、遺伝的動物モデルを用いた研究が必要であり、理解を深める必要がある。
筋力は、単位筋肉量あたりの最大力生産能力であり、QOLにも重要である。これは、筋収縮の振幅と速度で測定され、通常、加齢とともに低下する [129]。レジスタンス運動は、筋力を向上させることによっても筋機能を改善する。健康な若い男性は、12週間のレジスタンス運動介入後、繊維ピークパワーを30~42%増加させることができる [130] 。持久的運動は、筋繊維の収縮プロファイルを改善することも示されている [131,132,133] 。興味深いことに、生涯有酸素運動トレーニングを受けた70歳代の女性は、座り仕事の人と比較して繊維のサイズや質量が増加することなく、I型繊維の強度が増加し、IIa型繊維の収縮速度が増加した [134].そのメカニズムとして考えられるのは、Ca2+感受性の向上であり、繊維が所定の最大下Ca2+濃度にさらされたときに生じる力として定義される。タイプI、IIa、IIa/IIX繊維については、スプリントトレーニング後に変化は観察されず [135]、タイプIとIIa繊維については、マスターランナーと定住者の間で違いは観察されなかったが [136] 、高齢女性のタイプI繊維では、レジスタンストレーニングによるCa2+感度への効果が観察されている [137].
骨格筋機能の臨床的な評価は、運動能力であり、しばしばトレッドミルランニング、エルゴメーターバイク、6分間歩行で測定される。重要なことは、運動能力は、全死亡率と逆相関していることであり [138] 、多くの無作為化臨床試験で、運動介入によって様々な健康および疾患集団の運動能力が改善することが示された [139,140,141] 。運動トレーニング、特に持久的運動トレーニングによる運動能力の向上の根底には、ミトコンドリア生合成、血管新生、繊維型変換など、骨格筋における様々な生理学的および生化学的適応がある。これらの適応的変化は、身体能力の向上やその他の健康増進の基礎となる。具体的には、持久的な運動トレーニングによって誘発されるIIb/IId/x型繊維からIIa型繊維への繊維型変換は、カルシニューリン-活性化T細胞核因子(NFAT)経路の活性化によって引き起こされるようである[142,143,144]。運動トレーニングもまた、エネルギー的なホメオスタシスの調節に関連する閉鎖的な適応を誘発する。運動トレーニング、特に持久的運動は、骨格筋におけるミトコンドリア生合成を誘導し、これは転写共活性化因子、ペルオキシソーム増殖剤活性化受容体γ共活性化因子1α(PGC-1α)の発現/活性が誘導されて引き起こされ、新しいミトコンドリア生合成に向けてミトコンドリアおよび核ゲノムの転写を調節している[88,145,146,147]。最後に、持久的な運動トレーニングによる運動能力の向上は、血管新生、すなわち、ガスおよび栄養供給を改善するために、募集した骨格筋における既存の毛細血管からの毛細血管ネットワークの拡張とも関連している。PGC-1αは、低酸素誘導因子(HIF)非依存的に骨格筋の血管新生を制御する重要な因子として浮上し、PGC-1αがオーファン核受容体エストロゲン関連受容体-α(ERRα)を共活性化することが明らかになった[148]。全身Pgc-1α遺伝子欠損は、VEGFタンパク質発現の減少および急性および慢性運動トレーニングに対する反応の鈍化をもたらした[149]。重要なことは、Pgc-1α遺伝子の筋肉特異的な欠失により、収縮活性誘発性のVEGF発現および運動誘発性の血管新生が著しく減少したが、繊維型の変化は見られなかったことである[147,150]。Vegfa遺伝子の筋肉特異的な欠失は、骨格筋における毛細血管密度および運動トレーニング誘発性の血管新生を有意に減少させた[151,152]。
要約すると、高度なシグナル伝達ネットワークが、運動によって誘発される骨格筋の適応を媒介し、質量、筋力、持久力の向上につながる。このような筋収縮機能の向上は、健康寿命を大きく促進する。今後の研究により、骨格筋の高度に協調的なリモデリングプロセスが解明され、健康寿命における骨格筋の健康の重要性がさらに明らかにされることだろう。
4.2. 骨格筋の代謝における運動効果
インスリン抵抗性や肥満などの代謝性疾患は、健康寿命を縮める大きな要因の一つである。骨格筋は体重の40%を占める臓器であり、食後のグルコース取り込みの大部分を担っている [153] 。幸いなことに、骨格筋は運動介入の最大の受益者の一つでもあり、II型糖尿病などの多くの代謝性疾患をライフスタイルの介入によって回避または遅延可能にしている [154]。長い間、筋収縮が筋肉におけるインスリン感受性の増加を刺激することが示されてきた[155,156,157]。また、長期的な研究により、長期間の運動トレーニングがインスリン感受性の改善をもたらすことがわかった[158,159,160,161,162]。分子生物学的には、運動中の筋収縮がグルコーストランスポーター4(GLUT4)小胞の細胞膜への移動を刺激し、グルコース取り込みを著しく上昇させることが立証されており[163,164]、これは運動誘発性のAMPKによるTBC1D1のリン酸化を介して制御されている[165,166,167]。さらに、ミトコンドリアの量と質も運動に応じて上昇し、長時間の運動中により効率的なエネルギー生産に寄与している[87,168,169,170,171]。さらに最近では,ミトコンドリアの質を制御するミトコンドリアダイナミクス,すなわち,分裂,融合およびマイトファジーが,骨格筋代謝における運動効果のもう一つの重要な側面として持ち上がっている[172,173,174].興味深いことに、運動によるミトコンドリア関連のメカニズムのほぼ全ては、運動によって活性化されるエネルギーセンサーであるAMPKのシグナル伝達を必要としているようである[175]。我々の研究室による最近の証拠では、AMPKのユニークなプールがミトコンドリアに局在していることが発見された。他の研究室では、AMPKが他のオルガネラに局在して主要経路を制御する可能性も示唆している[84,176]。小器官特異的なAMPKに関する今後の研究は、運動が骨格筋の代謝改善をどのように誘導するかについての理解に大きく貢献する可能性がある。
4.3. 運動によって誘発される筋肉由来の抗酸化物質
過去10年間の臨床研究および動物実験により、活性酸素種(ROS)の無秩序な過剰生産による酸化ストレスが、老化、糖尿病、心代謝系疾患などの多くの疾患の根底にある大きな問題であり、健康寿命を延ばす上で最大の阻害要因の一つとなっていることが判明している[177,178]。そこで、運動による抗酸化作用がこの点で健康を促進することが提案されているが、そのメカニズムはまだ不完全に理解されているに過ぎない[179,180,181]。
運動を介した抗酸化システムの促進という考え方は、薬理学的な補充とは異なるものである。運動は骨格筋の酸化ストレスを “生理的 “に増加させ、その結果、酸化ダメージに対抗するための酵素反応を増加させる生理学的経路がオンになり、他の組織/器官にも利益をもたらすというものである [182,183] 。最近、酸化ストレスに対する防御の第一線としてスーパーオキシドアニオン(O2-)を中和する酵素ファミリーであるスーパーオキシドジスムターゼ(SODs)に関する研究により、これらの酵素が抗酸化システムの強化を通じて運動を介した利益に重要である可能性が提案されている [184].特に、細胞外スーパーオキシドジスムターゼ(EcSOD)は、細胞表面や細胞外マトリックス上の活性酸素を消去する能力を持つ唯一の抗酸化物質として知られており、注目を集めている[185,186]。2015年の我々の研究室の研究では、EcSODは主に骨格筋に発現し、運動トレーニングによって発現が上昇し、循環を経て主に心臓や肺に蓄積され、糖尿病性心筋症の状態で抗酸化作用を発揮することが明らかにされた[187]。2017年のフォローアップ研究では、さらに、骨格筋由来のEcSODが、遺伝子過剰発現と血清輸血により、内皮の活性化を抑制して保護効果を生み出し、多臓器不全のモデルでマウスを保護することが実証された[187]。全体として、この証拠は、全身の抗酸化能力の強化という点で、筋肉と他の臓器の間のクロストークが、健康寿命の延長における運動の利点を部分的に説明する可能性があることを示していた。EcSODや他のミオカインがどのようにしてこのような保護作用を発揮するのか、その詳細なメカニズムに関する現在の知識を広げるための今後の研究も必要である。
5. 脂肪組織
肥満症は、一般的に肥満度指数で測定され、過剰な体脂肪が関与する複合的な疾患である。肥満症は、米国で大流行し、世界的な健康問題になっている[188]。肥満は、心血管疾患や糖尿病などの他の多くの疾患と相関し、健康寿命に大きな負担となる最も深刻な代謝症候群の1つである。現在までのところ、肥満の最も効果的な対策は、健康的な食事と身体的な運動を含むライフスタイルの管理である[189,190,191]。過度の脂肪は、ミトコンドリアへの脂肪毒性を介して、骨格筋のインスリン感受性の低下を引き起こす可能性がある[192,193,194]。過度の脂肪化はまた、炎症促進因子および酸化促進因子の産生および分泌により有害である[195,196,197,198]。これらの経路の基礎となる正確なメカニズムは、まだ十分に理解されていない。一方、運動はエネルギー需要を満たすために脂肪酸酸化を誘発することが知られており [199,200]、長期の運動トレーニングは、脂肪酸酸化と同様に脂肪酸を取り込む筋肉の能力を高めるようである [201,202,203,204]. 今後の研究では、これらの点から、脂肪組織における運動効果の分子標的を調査する必要がある。
脂肪組織もまた哺乳類の代謝器官であり、主に白色脂肪組織(WAT)と褐色脂肪組織(BAT)から構成されている。WATはトリグリセリドの形でエネルギーを貯蔵するのに対し、BATは活性化するとミトコンドリアの結合が解除されて熱が発生する戦慄性熱発生を担っている[205]。その後、WATからBATへの変換である脂肪組織の褐変は、代謝に正に寄与し、老化と負の相関があることが発見され、健康寿命を延ばすための重要な側面となる可能性があることがわかった[206,207]。運動による白色脂肪組織の褐変は、よく知られている [208,209]。しかし、そのメカニズムはまだ解明されていない。2019年の研究では、WATの褐変を誘導することが示されているペプチドであるイリシンを産生するマウスのフィブロネクチンタイプIIIドメイン含有5(Fndc5)遺伝子を欠失させると、運動による代謝の効果が著しく低くなることが示されている[210]。別の研究では、インターロイキン6(IL-6)が、BATにおける熱発生の主要な分子メディエーターであるアンカップリングプロテイン1(UCP1)のベースライン発現と運動誘発性のアップレギュレーションの両方に必要であると報告されている[211]。したがって、運動によって誘発されるWATの褐変の背後にあるメカニズムを解明する今後の研究は、運動を介した筋肉-脂肪組織のクロストークがどのように健康寿命を延ばす可能性があるかについて明確な理解を生み出すために、依然として保証されている。
6. 肝臓
非アルコール性脂肪性肝疾患(NAFLD)は、アルコール使用ではなく、脂肪酸の蓄積によって引き起こされる肝疾患と定義されている。NAFLDは、肝脂肪症から非アルコール性脂肪肝炎(NASH)、線維症、肝硬変に至るまで、様々な状態を含む世界的に普及している疾患であり、最終的には肝不全に進行し、健康寿命を縮める大きな障害となり得る[212,213]。NAFLDは、主にメタボリックシンドロームの肝臓の症状であると考えられている。したがって、メタボリック運動による効果は、NAFLDの改善または発症の遅延につながると考えるのが妥当であろう。実際、2つの独立したランダム化比較臨床試験で、有酸素運動またはレジスタンストレーニングのいずれかの運動トレーニングが、NAFLD患者の肝脂肪を減少させることが確認されている [214,215] 。
運動効果は極めて多面的であり、NAFLDは体重減少やインスリン感受性改善などの「二次的」効果によって恩恵を受ける可能性があるため、NAFLDにおける運動効果の分子メカニズムに関して特定の経路に絞り込むことは困難である。その上、NAFLDモデルの動物表現型とヒト患者との間に矛盾があるため、運動効果を媒介する可能性のある肝要因についても困難がある [216]. それでも、齧歯類モデルにおけるいくつかの研究は、インスリン抵抗性の改善、高脂血症の減少、肝炎の減少が運動効果の潜在的なメカニズムであることを示唆している [217,218,219] 。2014年のある研究では、マウスNASHモデルにおいて、運動が障害された肝ミトコンドリア呼吸を回復できることが示唆され、運動効果がミトコンドリア調節によって媒介されている可能性が提起された[220]。全体として、NAFLDにおける運動効果の分子作用についてより完全な理解を形成するために、今後のメカニズム研究が必要である。
線維芽細胞増殖因子21(FGF21)は、主に肝臓と筋肉で放出されるホルモンであり、運動のようなストレス条件下で著しく発現が上昇し、その後循環を通じて異なる組織/器官に局在することができる[221,222,223,224]。2016年の研究では、FGF21がラットの任意輪走行後の耐糖能と肝トリグリセリドの改善に必要であることが示され、FGF21が運動効果の重要なメディエーターとなる可能性が示された[225]。別の研究では、FGF21が肝臓のミトコンドリア機能に必要であることが示された。しかしながら、FGF21の機能的役割は逆説的であるように思われ、その制御因子と正確な作用機序は明確に理解されていない。例えば、2019年の研究では、FGF21-/-マウスは、Bnip3を介したマイトファジーを制御することにより、潜在的に絶食誘発性筋萎縮から保護されることが示された[226]。したがって、今後の研究では、FGF21が健康寿命における運動の利益をどのように媒介するかを完全に理解するために、FGF21の上流/下流制御因子に焦点を当てることが重要だ。
7. 中枢神経系
7.1. 神経系の健康に対する運動による効果
神経疾患は、米国および世界において多大な負担となっており、2030年までに16兆ドル以上の費用がかかると予測されている[227,228,229]。生活の質の喪失の原因となり、加齢によって悪化する一般的な神経疾患には、アルツハイマー病、認知症、パーキンソン病、多発性硬化症、てんかんなどがある。過去数十年の間に、定期的な運動は認知機能の低下を緩和し予防する上で明らかに最も強力な方法であることを示唆する多くの証拠がある [230,231,232,233,234,235,236,237,238], パーキンソン病 [238,239,240], 多発性硬化症 [241,242,243,244,245,246,247,248,249], そしてうつ [250, 251,252]. すべての年齢層で、定期的な運動は、認知機能、協調性、視空間記憶、学習能力など、中枢神経系機能を高めることが示されている[253,254,255,256,257]。Hatchらによる最近の研究では、30分の高強度間欠的な運動でも、若年成人の認知機能を高めるのに十分であることが判明した[255]。また、Cartaらによる最近の臨床試験では、持久力、抵抗運動、バランス活動を組み合わせた12週間の中強度の運動が、健康な高齢者の認知機能を有意に改善することが実証された[256]。注目すべきは、臨床研究およびメタアナリシスでは、中程度の運動と比較して、激しい運動体制が脳機能を高める上で優れているという結果は得られておらず、運動の「理想量」が存在し、異なる集団に最適な運動プログラムを決定するには他の要因を考慮する必要があることを示唆している [258、259、260]。この考え方は、高強度インターバルトレーニング(HIIT)[257]、協調運動[263,264]、太極拳などの心身運動[265,266]など、脳機能増強における様々な運動様式を評価した多くの研究[261,262]を促した。全体として、定期的な運動は、精神/神経機能に関して健康寿命を改善するための最も顕著なライフスタイル介入であることに変わりはない。
7.2. 運動が中枢神経系に及ぼす恩恵のメカニズム
7.2.1. 神経可塑性
神経可塑性とは、運動などの行動刺激に適応する際に、神経細胞ネットワークが構造的・機能的に変化する過程と能力のことだ。齧歯類とヒトの両方の運動モデルにおいて、持久的な運動トレーニングが海馬などの異なる領域の脳体積を増加させることが研究で示されている [267,268] 。また、運動トレーニングは、海馬、外側扁桃体基底部、内側前頭前皮質、大脳皮質の硝子体ニューロンなど、脳の多くの領域で樹状突起の長さと複雑さを増強する[269,270,271,272]。これらの脳容積や樹状突起の形態的変化はすべて、運動による運動技能、記憶、認知機能の向上、神経変性疾患からの保護に寄与していると考えられている[273,274,275]。
運動による神経可塑性の向上は、多くの場合、多面的なニューロン機能変化と関連している [276]。運動は、若年および高齢のげっ歯類における海馬領域において、持続的なパターン化された刺激によるニューロンコミュニケーション/シグナル伝達の長期的強化を表すプロセスである長期増強を改善する可能性があり、この適応は強度および期間依存的であるようだ[277,278,279,280,281,282]。2015年の研究では、12日間の自発的な車輪走行が海馬のアストロサイトマーカーを増加させ、アストロサイトの形態を変化させることも示し、グリア機能も運動による海馬の可塑性の強化に関与している可能性が示唆された[283]。全体として、この証拠は、神経可塑性が健康寿命における運動の利点の重要な側面であることを明確に証明した。これらの経路における分子メディエーターに関する今後の研究が不可欠である。
脳由来神経栄養因子(BDNF)は、運動を介した神経可塑性の増強に重要であることが最初に発見された分子の一つである[284,285]。ラットを用いた初期の研究では、BDNFとその受容体であるトロポミオシン受容体キナーゼB(TrkB)の発現が、自発的な車輪走行運動後に共に劇的に増加し[286]、これは、異なる運動様式と異なる年齢での後の研究によって確認されている[287,288]。逆に、TrkBの薬理学的阻害は、運動誘発性の神経可塑性マー カーの増加をブロックした[286]。実際、ヒトの研究でも、運動によるBDNFと認知機能の向上との間に強い相関があり、海馬領域が関与していることが報告されている[289,290]。しかしながら、運動によるBDNFとその下流標的の制御に関するメカニズムは不明である。初期の研究では、海馬のインスリン様成長因子(IGF-1)受容体をブロックすると、運動刺激によるBDNF発現の誘導が逆転することが示され、IGF-1の重要性が示唆された[291,292]。IGF-1受容体の遮断は、海馬における運動誘発性のシナプシンI発現、カルシウム/カルモジュリンプロテインキナーゼII(CaMKII)およびマイトジェン活性化プロテインキナーゼII(MAPKII)のリン酸化も鈍化させた[291]。興味深いことに、最近のエビデンスでは、有酸素運動とレジスタンス運動は、どちらも認知機能を改善するが、異なる下流の分子経路を介して作用する可能性が示唆されている [293,294].結論として、BDNF、IGF-1およびその下流のカスケードを含む分子経路に関する今後の研究は、脳の健康における運動の利点に神経可塑性が極めて重要な役割を果たすことを理解する上で非常に重要である。
7.2.2. 血管新生
細胞レベルでは、持久的運動は、脳における神経新生、血管新生、ニューロン可塑性、血管機能を促進する細胞経路を再構築することが示されている[295,296,297]。現在では、VO2maxが脳の血管機能の予測因子であり、老化中の認知能力の維持と密接に関連することが確立されている[298]。Ainslieらは、加齢による中大脳動脈血流量の減少があるにもかかわらず、ほぼすべての年齢層(18~79歳)において、持久的運動トレーニングを受けた人の中大脳動脈血流速度は、座っている人に比べて~17%大きいことを明らかにした[295].赤澤らは、12週間のサイクリング介入により、高齢者の脳微小血管の緊張を、座りっぱなしの対照群と比較して有意に高めることができたことを示した[299]。
7.2.3. 神経新生
長期間の持久的運動は、認知症やアルツハイマー病など、加齢に伴ういくつかの認知障害の背景にある海馬領域の神経細胞の体積減少を有意に遅らせることができる[267]。BDNF、インスリン様成長因子-1(IGF-1)、血管内皮成長因子(VEGF)など、神経新生刺激能を有するいくつかの分子が、海馬領域における運動誘発性神経新生に重要であることが示されている[285,300,301,302]。重要なことは、運動によって誘発されるBDNFが、高齢者集団における神経新生を促進する上で重要であることが研究で示唆されており、神経細胞の健康寿命におけるこのメカニズムの重要性が強調されていることである [303] 。カテプシンB(CTSB)は、骨格筋から新たに同定されたミオカインで、有酸素運動により発現が上昇し、血液脳関門を通過して脳の生化学を制御する可能性があるが、その機能と神経新生促進に直接作用するかどうかは完全に理解されていない[304]。
レジスタンス運動も認知機能の維持に有効であるが、そのエビデンスは比較的限られており、そのメカニズムもまだ研究されていない[305]。ある研究では、中強度または高強度のレジスタンス運動を24週間続けると、高齢者の認知機能を改善できることが示され[306]、同様の研究では、週1~2回のレジスタンス運動が高齢女性の認知機能強化に有効であることが示されている[307]。結論として、神経機能を向上させる運動適応の背後にある分子的・細胞的メカニズムは、まだ解明されていない。興味深いことに、最近の臨床研究のメタアナリシスでは、高齢者において中強度の持久運動よりもレジスタンストレーニングを多く取り入れたトレーニングレジームの方がBDNFの増加がより顕著であることが示されている[308]。定期的な運動がどのように神経系の健康、ひいては健康寿命を増進させるかについて理解を深めるために、今後さらにメカニズムに基づいた研究が必要である。
8. がんの予防
がんは、米国だけでも毎年600,000人以上の命を奪っている [309]。長い間、定期的な運動は、すべてではないにしても、多くの種類のがんの予防に非常に効果的であることが知られてきた [310]。癌性悪液質、体重減少、および認知機能の低下は、癌に関連する最も有害な併存疾患であり、健康寿命を大きく損ねるものである。がんは、正常な細胞の増殖を制御する腫瘍抑制遺伝子の変異から始まり、制御不能な増殖を引き起こし、正常な細胞を腫瘍細胞へと変化させる。成熟した腫瘍微小環境により、腫瘍細胞は最終的に本格的ながんに発展する可能性がある[311]。広範な臨床試験とメタアナリシスにより、身体活動レベルまたは定期的な運動が、少なくとも結腸癌、乳癌、腎臓癌、子宮内膜癌、膀胱癌、食道癌、胃癌、肺癌を含む多くの種類の癌のリスク低下と正の相関があることが明らかになっている [312,313,314,315,316].運動トレーニングをがんの一次治療や二次予防としてどのように利用できるかという研究が提案されており、社会的に大きな影響を与えることになるだろう [317,318]。
定期的な運動の抗がん作用の基礎となる分子メカニズムに関する有力な仮説は、運動を介した免疫系の調整に関するものであり、腫瘍細胞は微小環境を介してこれを回避することができる [319]。免疫系に対する有益な作用が知られていることから、定期的な運動は、自然免疫系および適応免疫系を改善することにより、腫瘍の微小環境の発生を抑制するのに役立つ可能性がある [317]。Pedersenらによる最近の研究では、皮下メラノーマのマウスモデルにおいて、随意的な車輪走行が腫瘍組織へのナチュラルキラー(NK)細胞の浸潤を誘導し、これが腫瘍増殖の抑制に寄与する可能性が示された [320]。もう一つの潜在的なメカニズムは、運動トレーニングが、発癌と関連している全体的な細胞の酸化ストレスを減少させることである[321,322]。我々は以前、持久的な運動が骨格筋における細胞外スーパーオキシドジスムターゼ(EcSOD)のアップレギュレーションをもたらし、それが心臓、肺、その他の末梢器官に循環して酸化的損傷からそれらを保護することを示した [104,187].結論として、健康寿命を延ばすための運動の幅広い影響を理解するために、運動を介した抗がん作用の根底にあるメカニズムを解明することが強く求められている。
9. 結論
要約すると、運動トレーニングはQOLを維持し、健康寿命を延ばす最も強力な「薬」であることに変わりはない。様々な臓器系における運動効果の分子的解明により、運動は慢性疾患に対する最も強力なライフスタイルの介入であることが再確認された。人間の寿命は限界に近づいているように思われるが、健康寿命、そしておそらく寿命を改善するために、あらゆる地域社会で身体活動を促進することに大きな可能性が潜んでいるのである。