コンテンツ
Melatonin and Health: Insights of Melatonin Action, Biological Functions, and Associated Disorders
https://pubmed.ncbi.nlm.nih.gov/36752886
Cell Mol Neurobiol. 2023 Feb 8 : 1-22.
doi: 10.1007/s10571-023-01324-w [Epub ahead of print].
PMCID: PMC9907215
PMID: 36752886
記事のまとめ
この論文は、メラトニンの生理学的役割と医学的応用について包括的に概説している。主な内容は以下である:
- メラトニンは松果体から分泌されるホルモンで、概日リズムの調節に重要な役割を果たす。メラトニンの合成と分泌は光によって抑制され、暗闇で促進される。
- メラトニンは主にMT1とMT2という2つの受容体を介して作用する。これらの受容体は脳や末梢組織に広く分布している。
- メラトニンには抗酸化作用、免疫調節作用、神経保護作用などの多様な生理作用がある。
- メラトニンは様々な疾患との関連が示唆されている。例えば、神経変性疾患、高血圧、糖尿病、がん、自己免疫疾患などである。
- メラトニンは睡眠障害や気分障害の治療に用いられている。また、アゴメラチンなどのメラトニン作動薬が開発されている。
- メラトニンは生殖機能の調節にも関与している。多嚢胞性卵巣症候群(PCOS)などの生殖器系疾患との関連も示唆されている。
- メラトニンには抗炎症作用や疼痛緩和作用もあり、様々な炎症性疾患や痛みの治療に応用できる可能性がある。
- メラトニンは感染症に対する防御機能も持つ。ウイルス感染や細菌感染に対する保護効果が報告されている。
この論文は、メラトニンが生物学的に重要な分子であり、様々な生理機能や病態に関与していることを示している。今後さらなる研究によって、メラトニンの医療応用の可能性が広がることが期待される。
メラトニンが改善効果示す主な疾患のまとめ:
1. 神経疾患
パーキンソン病: メラトニンは抗酸化作用と抗炎症作用を通じて神経保護効果を示す。線条体と海馬において、脂質の過酸化を防ぎ、MPTP誘発PDモデルにおける神経細胞死を阻止する。
アルツハイマー病: メラトニンは抗アミロイド原性作用を示し、βアミロイド(Aβ)の蓄積を防ぐ。また、アミロイド前駆体タンパク質(APP)の合成を停止させ、Aβの形成を阻害する。
脳浮腫・外傷性脳損傷: メラトニンは抗炎症作用と抗酸化作用により脳損傷を軽減する。
うつ病::メラトニンは概日リズムの調整を通じてうつ症状を改善する。
脳虚血::メラトニンは潜在的な抗酸化物質として作用し、虚血傷害から保護する。
高ホモシステイン尿症・神経膠腫・フェニルケトン尿症: これらの疾患に対するメラトニンの効果が報告されているが、詳細なメカニズムについてはさらなる研究が必要。
2. 心血管疾患
高血圧::メラトニンは血管拡張作用と抗酸化作用により血圧を低下させる。夜間高血圧患者におけるメラトニンの摂取は、収縮期および拡張期血圧を低下させることが示されている。
3. 代謝性疾患
糖尿病::メラトニンはインスリン感受性を改善し、血糖値の調節を助ける。糖尿病モデル動物において、メラトニンの経口投与が抗高血糖効果をもたらすことが示されている。
肥満::メラトニンは代謝を促進し、体重増加を抑制する可能性がある。高脂肪食による体重増加を最小限に抑えることが報告されている。
4. 自己免疫疾患
関節リウマチ (RA): メラトニンの効果については議論がある。一部の研究では抗炎症作用が報告されているが、他の研究では症状を悪化させる可能性も示唆されている。
多発性硬化症 (MS): メラトニンは免疫調節作用により症状を改善する可能性がある。MS患者では、メラトニンの概日リズムが乱れていることが報告されている。
全身性エリテマトーデス (SLE): メラトニンの効果は一貫していないが、一部の研究では抗炎症作用が報告されている。
5. 感染症
敗血症::メラトニンは抗酸化作用と免疫調節作用により、敗血症性ショックの治療に有効である。
マラリア: メラトニンはマラリア原虫の成長と発達の引き金として働く可能性があり、その阻害が治療戦略となる可能性がある。
ウイルス性脳炎: メラトニンの投与は、ウイルス性脳炎モデルにおいて発病を遅らせ、死亡率を減少させることが報告されている。
6.がん
乳がん・前立腺がん・結腸直腸がん: メラトニンは抗腫瘍効果を示し、がん細胞の増殖を抑制する可能性がある。特に乳がんに対する保護的役割が多く報告されている。
7. 精神疾患
双極性障害・大うつ病性障害・季節性感情障害: メラトニンは概日リズムの調整を通じてこれらの気分障害の症状を改善する可能性がある。
8. その他
不眠症::メラトニンは睡眠-覚醒サイクルを調整し、睡眠の質を改善する。
痛み::メラトニンは抗炎症作用と神経保護作用により、痛みを軽減する。様々な経路を通じて鎮痛効果を発揮する。
多嚢胞性卵巣症候群(PCOS): メラトニンは卵巣機能を改善し、ホルモンバランスを調整する。PCOSモデルにおいて、メラトニンの投与がグルコース代謝と内皮血管機能を改善することが報告されている。
メラトニンの脳への作用メカニズムと主な効能:
作用メカニズム:
- 主に膜結合型Gタンパク質共役受容体(MT1とMT2)を介して作用
- 視交叉上核(SCN)の概日リズム調節に関与
- 海馬ニューロンに直接作用し記憶形成に関与
- 抗酸化作用によりフリーラジカルを消去
- 抗炎症作用により炎症性サイトカインの産生を抑制
- ミトコンドリア機能を保護
主な効能:
- 概日リズムと睡眠パターンの調節
- 記憶と学習能力の向上
- 抗うつ作用と気分の安定化
- 神経保護作用:
- アルツハイマー病やパーキンソン病などの神経変性疾患の進行を遅延
- 脳卒中や外傷性脳損傷からの保護
- 抗不安作用
- 鎮痛作用
- 認知機能の改善
- 脳の加齢プロセスの遅延
- 季節性感情障害(SAD)の症状改善
- 脳腫瘍(神経膠腫など)の抑制
メラトニンは、その多面的な作用メカニズムにより、脳の健康維持と様々な神経学的・精神医学的疾患の予防・治療に広範な効果を示すことが示唆されている。
要旨
メラトニンは自然界に広く分布するユビキタス分子であり、多くの生物によって産生される。ヒトでは、松果体がメラトニンの主要産生部位であり、網膜、リンパ球、骨髄、消化管、胸腺などでも産生されている。神経ホルモンとしてのメラトニンは循環系に放出され、全身の組織に浸透する。メラトニンの合成と分泌は、明るいと抑制され、暗いと促進される。メラトニンは主に、メラトニン受容体1(MT1)とメラトニン受容体2(MT2)という異なる経路を通じてその効果を発揮する。メラトニンは睡眠パターンと概日リズムの調節に役立つ。さらに、メラトニンは抗酸化物質として作用し、抗興奮作用と抗炎症作用によって、体内で発生した過剰なフリーラジカルを消去する。メラトニンには他にも、強壮、催眠、免疫調節、生殖、思春期のタイミング、気分障害、移植など、さまざまな機能がある。メラトニンの産生または合成における欠乏は、乳がんや神経変性疾患のような多くの疾患の発症に関連していることが判明している。メラトニンは、痛みを伴う疾患における鎮痛薬として使用される可能性があり、その役割は非常に有望である。前世紀において、炎症性疾患、胃腸疾患、癌、気分障害など様々な疾患の治療におけるメラトニンの幅広い利用に関して、関心が高まってきた。いくつかのメラトニン作動薬が合成され、疾患治療に広く用いられている。この総説では、メラトニンの生化学的性質と、ヒトの様々な疾患における治療の可能性について述べる。
グラフィカル・アブストラクト

キーワード: メラトニン, 治療, 抗酸化, 疾患, アゴニスト
はじめに
メラトニン」という言葉は、ギリシャ語で「暗闇を意味するmelas」と「暗闇のホルモンを意味するtonos」に由来しており、動物界のすべての生物に見られるどこにでもあるホルモンである。インドールアミンの一種であるメラトニン(N-アセチル-5-メトキシトリプタミン)は、主に松果体から分泌され、必須アミノ酸であるトリプトファンが炭素5で水酸化され、トリプトファン水酸化酵素によって5-ヒドロキシトリプトファンを形成することによって合成される。5-ヒドロキシトリプトファンの脱炭酸は、酵素アリールアルキルアミン N-アセチルトランスフェラーゼによるアセチル化で、メラトニンの直接の前駆体である N-アセチルセロトニンを生成する主要な神経伝達物質、5-ヒドロキシトリプタミン(セロトニン)をもたらす。その後、酵素アセチル-セロトニン-メチルトランスフェラーゼ(ASMT)がメチル化の過程を経て、N-アセチルセロトニンをメラトニンに変換する(Coon et al. 2001)(図 1)。松果体はメラトニンの主要な合成・分泌器だが、他の器官、すなわち網膜、硬膜腺(Cardinali and Rosner 1971)、消化管(Bubenik 2002)およびリンパ球によるごく少量のメラトニンの形成を示す多くの報告もある。メラトニンの痕跡は、果実、種子、葉のような高等植物の様々な部分で有意に同定されている(Tan et al. 2016; Reiter et al. 2014 )。しかし、これらの植物部位に含まれるレベルは、人間に供給するには低すぎる。原始的なバクテリアにメラトニンが広く分布していることは、この分子の起源が古く、生物の進化から保持されてきたことを示している(Pshenichnyuk et al. 2017)。細菌では、メラトニンは共生によって進化した。以前は、メラトニンは光合成や代謝経路、フリーラジカル解毒プロセスに関与していると考えられていた(Manchester et al. 2015; Tan et al. 2015 )。しかし、進化の過程でメラトニンは多様化し、酸化ストレスに抵抗するだけでなく、生体リズムに影響を与え、炎症状態を軽減するという優勢な役割を示す多面性を獲得した(Tan et al. 2010; Tamtaji et al. 2018)。異なる種は、多様なメラトニン生合成経路と、これらの経路に関与する酵素をコードする遺伝子を進化させてきた(Back et al. 2016)。メラトニンの役割は、複数の生合成代謝経路への関与から極めて明らかだ。単細胞生物と多細胞生物では、細胞内局在に位置するメラトニンの生合成に関与する酵素が何らかの形で変化している可能性がある(Lee et al. 2017)。メラトニンの生合成の局在部位が細胞内別々であることは、その効率的な制御に有益かもしれない(Back et al. 2016; Byeon et al. 2015)。メラトニンの分泌は、アセチルセロトニンメチルトランスフェラーゼ(ASMT)とも呼ばれるヒドロキシインドール-O-メチルトランスフェラーゼ(HIOMT)という酵素によって制御され、間接的に光神経系によって指令される(Jang et al. 2010)。実質細胞内には多くの毛細血管が存在し、過剰な代謝活動を可能にしている。松果体には血液脳関門がないため、角膜下器官(SFO)、正中隆起、脳室下器官(SCO)のような他の脳室周囲腺と類似性を示すが、これらはすべて第三脳室屋根の上衣細胞から産生される(Hissa et al.) 生きている種では、メラトニン分泌の概日的様式が観察され、夜間に最もレベルが高くなり、N-アセチルトランスフェラーゼ(NAT)酵素活性が30~70倍増加する。メラトニンの産生と放出は、研究されたすべての種において、暗い時間帯にピークを迎え、日中に低下する(Binkley et al. 1988; Bolliet et al. 1996)。松果体はメラトニンを貯蔵しないが、松果体の合成能力は血漿濃度によって反映される。松果体は哺乳類以外の脊椎動物の初期では光に直接反応するが、高等脊椎動物ではもはや光に感応しない。メラトニンは脂質と水への溶解度が高いため、血液脳関門を含むほとんどの細胞膜を容易に通過して分布する(Pardridge and Mietus 1980)。循環に放出されると、さまざまな体液、細胞区画、組織に容易に入り込む。メラトニンは主に夜間に合成され、その血漿中濃度のピークは午前3時から4時ごろに見られる。循環中のメラトニンは全身の組織に移動し、血液脳関門を通過して脳の活動を容易に調節することができる。生後3ヵ月までは、メラトニンの分泌はないか非常に少ない。その後、3~4歳でメラトニンの分泌はピークに達し、成人になると80%減少する。一時的に、この変化は体の大きさの成長ではなく、性的成熟と関連づけられてきた。しかし、小児期に一定のメラトニンが産生されるのは、体の大きさが大きくなるためである(Waldhauserら、 1993)。
図1 ヒトにおけるメラトニン合成経路

表1 メラトニンの産生に影響を与える要因
| 因子 | メラトニンへの影響 | 備考 |
|---|---|---|
| ライト | 抑制 | 波長460~480nmの光強度が30倍以上の効果がある。 |
| 光 | 位相シフト | 波長の短い光が有効であることが判明 |
| 睡眠のタイミング | 位相シフト | 二次的部分光照射 |
| エクササイズ | 位相シフトの増加 | 活発 |
| 5-ヒドロキシトリプタミン | フルボキサミン増加 | 代謝作用 |
| β-アドレナリン受容体A | 合成減少 | 降圧剤 |
| クロルプロマジン | 増加 | 代謝作用 |
| ベンゾジアゼピン | 変化は様々 | – |
| イブプロフェン、アスピリン | 減少 | – |
| アルコール | 減少 | – |
| 喫煙 | 変更の可能性 | – |
| カフェイン | 増加 | – |
| 経口避妊薬 | 増加 | – |
| テストステロン | 減少 | – |
| エストラジオール | 減少するが、まだ明確ではない | – |
| 月経周期 | 変化が一定しない | – |
メラトニンの食用供給源
メラトニンは、食用植物であれ、植物由来の製品であれ、さまざまな食品に含まれていることが知られている。植物や少数の食品はメラトニンを持っているだけでなく、その前駆体も持っている。植物において、メラトニンの存在は普遍的である。しかし、その濃度は、植物組織においてピコグラムからマイクログラムまで様々である(Tan et al. 2012)。表 表22 は、食品および植物中のクロマトグラフィーおよび免疫学的手法によって検出されたメラトニンの量を示している。植物中のメラトニンは、酸化ストレスの軽減、種子の成長と発芽の促進、ストレスに対する抵抗性の向上、免疫系の刺激、概日リズムの調節、葉の気孔閉鎖の制御、干ばつ、有害化学物質、塩分、重金属ストレス、紫外線、高低周囲温度、水ストレス、光誘導ストレスに対する抗ストレス剤として重要な役割を果たしている。さらに、メラトニンは、抗菌作用、抗ウイルス作用、抗真菌作用などの様々な特性を含む、植物の生物学的ストレスに対抗する役割も示している。
表2 食用植物および関連食品中のメラトニン量
| 植物/食品 | 量 | 部品/臓器 | 参考文献 |
|---|---|---|---|
| トマト | 3-114 ng/g | フルーツ | Iritiら(2010)、Sturtzら(2011)。 |
| ストロベリー | 1-11 ng/g | 果実 | イリティら(2010) |
| 米/大麦 | 300-1000 pg/g | 種子 | 服部ら (1995) |
| トウモロコシ | 14-53 ng/g | 種子 | メナら(2012) |
| クルミ | 3-4 ng/g | 種子 | Reiterら (2005) |
| オリーブ油 | pg/ml | 種子 | デ・ラ・プエルタら (2007) |
| ブラックペッパー | 1093 ng/g | リーフ | パドゥマノンダら (2014) |
| クルクマ | 120 ng/g | ルート | Chenら (2003) |
| コリアンダー | 7 ng/g | 種子 | マンチェスターら (2000) |
| ブラックマスタード | 129 ng/g | 種子 | マンチェスターら (2000) |
| アーモンド | 39 ng/g | 種子 | マンチェスターら (2000) |
| チェリー | 18 ng/g | 果物 | ブルクハルトら(2001) |
| ザクロ | 5.5 ng/g | 果実 | Mena et al. (2012) |
| フェンネル | 28 ng/g | 種子 | マンチェスターら (2000) |
| 大根 | 485 ng/g | 球根 | チェンら (2003) |
| ビール | 52-170 pg/ml | 果実 | マルドナドら (2009) |
| ワイン | 50-230 pg/ml | 果物 | イリティら (2010) |

受容体と作用機序
メラトニンは内分泌、自己分泌、副分泌の各モードを通じて作用を示す多面的なホルモンである(Reiter 2003)。メラトニンの作用は、受容体との結合によって、あるいは直接作用することによって促進される。種内では、メラトニン受容体の密度と位置にはかなりのばらつきがある(Morgan et al. 1994; Liu et al. 2016)。哺乳類では、メラトニンは細胞膜受容体、カルモジュリンのような細胞内タンパク質、またはオーファン核内受容体に結合することで効果を示す。
メラトニンはまた、カルレティキュリン、カルモジュリン、チューブリンなどの細胞内タンパク質分子との相互作用を示す(Bolliet et al. 1996)。カルモジュリンは細胞内二次メッセンジャーである。メラトニンはカルモジュリンへの結合においてカルシウムと直接競合する(Bolliet et al. 1996; Ekmekcioglu 2006 )が、これはまたがんで観察される抗増殖効果の原因かもしれない。メラトニンの免疫調節作用は、メラトニンがレチノイド関連希少核ホルモン受容体ファミリー(RZR/ROR)に結合することにより、単核細胞でIL-2とIL-6が合成されることに起因する(Ekmekcioglu 2006)。
動物細胞では、メラトニンは主に膜結合型Gタンパク質共役受容体(GPCR)を介してその効果を発揮する(Jockers et al.) 哺乳類では、メラトニンの3つのGPCRはMT1、MT2、MT3であり、1つの核内受容体も同定されている(Reppert et al. 1995; Nosjean et al. 2000)。メラトニンの受容体は広く分布しており、脳、心臓血管系、大動脈、心室壁、脳動脈および冠動脈、胆嚢、肝臓、網膜、耳下腺、虫垂、盲腸、結腸、皮膚、膵臓、血小板、免疫系細胞、腎臓、褐色および白色脂肪細胞、乳房および卵巣顆粒膜細胞、前立腺の上皮細胞、胎児腎臓、胎盤子宮筋層(Uz et al. 2005、Hardeland 2012)。消化管の空腸と結腸粘膜には、一般的にメラトニンの受容体のほとんどが存在する(Bolliet et al. 1996)。メラトニンは様々な分子経路の関与を通してその作用を示すので、最も記載されている経路は、特定の膜受容体、すなわちML1すなわち高親和性部位と低親和性すなわちML2部位の活性化を含む(Dubocovich 1995; Morganら 1994)。一方、新しく精製されたML2レセプターは、キノン還元酵素ファミリーに属するMT3タンパク質とも呼ばれている(Cardinali et al. 1997)。染色体の位置と分子構造に基づいて、メラトニンの受容体(MT1とMT2)は異なるサブタイプとして記述されている(Reppert et al. 1995; Dubocovich et al. 2003)。
MT1レセプター
MT1はMell a受容体としても知られ、351個のアミノ酸からなり、ヒトでは第4染色体にコードされている(Li et al. 2013)。メラニンaは、概日時計の解剖学的部位である視床下部の視索傍と視交叉上核(SCN)、大脳皮質、視床、黒質、小脳、側坐核、網膜に広く分布している(Jockers et al. >2008)。標的細胞のGPCRスーパーファミリーのこれらの高親和性受容体にメラトニンが結合すると、アデニル酸シクラーゼ/cAMP活性が阻害され、ホスホリパーゼC/IP3 actionが増加する(Ebisawa et al. >1994)。MT1レセプターにはMT1aとMT2bの2つのサブグループがある(Morganら 1994)。MT1受容体を発現する心血管やSCNでは、概日リズムの調節に役立ち(Dubocovichら 1998; Liuら 1997)、心血管を収縮させる(Doolenら 1998)。これらの領域とは別に、脳や末梢組織の他の部分もMT1を発現している(Clemensら 2001; Ramら 2002)。
MT2レセプター
363個のアミノ酸を持ち、ヒトの11番染色体上にコードされている(Li et al. データ-dl-u>2013)。MT2受容体はMell b受容体としても知られ、親和性が低く、ホスホイノシトール加水分解(Brzezinski 1997)、網膜生理(Klein 1985)、概日リズム調節(Dubocovich et al. 1998)、心臓血管拡張(Doolen et al. 1998)、炎症反応(Lotufo et al. 2001; Li and Witt-Enderby 2000; Masana and Dubocovich 2001; Von Gall et al. 2002). MT2レセプターの局在はMT1に比べて制限されており、主に網膜、二次的に海馬、皮質、脳室傍核、小脳に存在する(Zawilska et al. 2009; Li and Witt-Enderby 2000; Masana and Dubocovich 2001; Von Gall et al. 2002).
MT3レセプター
当初、MT3はシリアンハムスターの腎臓から精製され、MT2と同様の結合プロファイルを示した(Dubocovich 1995; Molinari et al. 1996; Nosjean et al. 2000)。MT3タンパク質は、解毒酵素であるヒトのキノン還元酵素2と95%同一であることが発見された(Nosjean et al. 2000)。MT3レセプターが活性化されると、ロイコトリエンB4による白血球付着が阻害され、眼圧が低下する(Dubocovich et al. 2003)。
これに加えて、メラトニンのいくつかの特性は膜受容体では説明できない。オーファン核ホルモン受容体スーパーファミリーRZR/RORとして知られる別の受容体群が、メラトニンの天然のリガンドであるようだ。メラトニンの免疫調節特性は、これらの核内結合受容体のためである(Carrillo-Vicoら、 2003)。
メラトニンの作用(非受容体を介する)
メラトニンの活性のほとんどは受容体を介するものである。しかし、いくつかは受容体分子が関与することで起こるため、非受容体を介するものであり、その顕著な例がフリーラジカル消去活性である。強力な抗酸化物質であるメラトニンは、フリーラジカルの消去に直接関与しており、その代謝産物も同様である(Galano et al. 2013)。また、多くの消去経路を活性化し、抗酸化酵素活性を高める(Barlow-Waldenら 1995; Rodriguezら 2004)。また、遷移金属と結合するため、ヒドロキシルラジカルの生成を防ぐ(Galano et al. 2015)。ミトコンドリアに高濃度に存在するメラトニンは、タンパク質、脂質、DNAをフリーラジカルによる酸化損傷から保護する(Venegas et al. 2012; Garcia et al. 2014)。メラトニンの抗酸化的役割は、細胞呼吸のためにフリーラジカル産生が自然現象であるミトコンドリア活動にとって最も重要である(Reiter et al. 2017)。抗酸化剤の役割とは別に、メラトニンは呼吸鎖複合体IとIVを制御するだけでなく、ミトコンドリアDNAの変異や欠失を防ぐという主要な役割も果たしている(Jou et al. >2002)。メラトニンのこの作用は、メラトニンとタンパク質との間の直接的な相互作用によって生じる。メラトニンは、Ca2+-カルモジュリンとの直接相互作用により、Ca2+/カルモジュリン依存性プロテインキナーゼII活性と自己リン酸化を阻害することにより、タンパク質の分解において拮抗的な役割を果たす(Benitrez-Kingら、 1996)。ATM(ホスホイノシチド3-キナーゼ関連キナーゼ)の発現をダウンレギュレーションし、DNA分解に関与するヒストンH2AXリン酸化プロセスによってDNA損傷を防ぐ(Majidinia et al. >2017)。
メラトニンと脳
メラトニンは多様な役割を持ち、主に脳に影響を及ぼす。概日リズム、季節適応、思春期の発達思春期の発達を調節する役割がある(Pandi et al. 2008)。メラトニンは、海馬ニューロンに直接作用することで記憶形成を調節し、記憶と関連している(Comai and Gobbi 2014)。また、体の姿勢やバランスも制御する(Pandi et al. 2008)。メラトニンには、抗侵害受容作用、抗うつ作用、抗不安作用、運動調節作用がある(Uz et al. 2005)。メラトニンには、神経保護作用、血圧降下作用、疼痛調節作用、血管、網膜、骨芽細胞分化、季節性生殖、卵巣生理、抗腫瘍、抗酸化作用がある(Li et al. 2013)。視床下部ニューロンからは、ゴナドトロピン放出ホルモン(GnRH)の分泌がメラトニンによって調節され、さらに卵胞刺激ホルモン(FSH)と黄体形成ホルモン(LH)の合成に影響を与える(Dubocovich et al.) 顆粒膜細胞では、プロゲステロンの産生はメラトニンによって促進される(Dubocovich et al. 2003)。メラトニンはまた、エストロゲン受容体の発現とエストロゲンの活性化を阻害する(Carlberg 2000)。メラトニンは、パーキンソン病(Gunata et al. 2020)、アルツハイマー病(Vecchierini et al. 2021)、脳浮腫と外傷性脳損傷(Dehghan et al. 2013)、うつ病(Grima et al. 2018)、脳虚血(Tang et al. 2014)、高ホモシステイン尿症(Karolczak and Watala 2021)、神経膠腫(Lai et al. 2019)、フェニルケトン尿症(Yano et al. 2016)がある。メラトニンはアミロイドーシスを抑制することが示された(Shukla et al. 2017)。
メラトニンの抗酸化、抗炎症、神経保護的役割
ヒトでは、脳内の酸素消費量が20%と高く、この消費量の増加が酸化ストレスを引き起こし、体内で有毒なフリーラジカル分子を生成する。これらの高反応性分子は、DNA、タンパク質、細胞膜にダメージを与える(Gupta et al. 2003)。膜とミエリン鞘にかなりの脂肪が存在すると、フリーラジカルによる損傷が増強されるため、酸化物質と抗酸化物質のバランスが崩れる(Skaper et al. 1999)。活性酸素種(ROS)によるダメージは、血液脳関門を損ない、興奮性神経伝達物質であるグルタミン酸の細胞外への発現を亢進させ、脱分極の引き金となる(Gilman et al.) 活性酸素はまた、遺伝子発現の変化をもたらし、アポトーシスのカスケードを開始し、ニューロンの生存率を低下させる(Gilgun-Sherkiら、 2002)。メラトニンは、抗酸化物質としての役割を通じて、内因的にフリーラジカルを消去する(Tordjman et al. 2017)。メラトニンサプリメントの摂取は、スーパーオキシドジスムターゼ(SOD)とグルタチオンペルオキシダーゼ(GPx)活性を高める(Mayo et al. 2002)。このように、メラトニンはその抗酸化力によって神経保護能を発揮する。脳卒中が発症すると、活性酸素と炎症の産生が亢進し、細胞が大量に破壊される。神経細胞の生存は活発なエネルギー代謝に依存しているため、脳血流が阻害され、グルコースや酸素の供給が制限されると、虚血性脳卒中が発症し、神経細胞に致命的な影響を及ぼす可能性がある(Flynn et al. 2008)。グルコースと酸素が不足すると、多くの経路を通じて細胞の生存が損なわれる。特に、ATP依存性のNa+/K+-ATPaseの機能が低下し、細胞内にNa+ ;その結果、無酸素性脱分極と電位依存性カルシウムチャネルの活性化が起こり、Na2+/Ca2+ ;交換が乱れると、細胞内にCa2+ が蓄積し、細胞傷害が始まる(Stys 1998)。メラトニンは潜在的な抗酸化物質であり、虚血傷害から保護する(Watson et al. 2016; Wu et al. 2017 )。
脳卒中を誘発した動物モデルにメラトニンを投与すると、脳梗塞が減少する(Sinha et al. 2001; Pei et al. 2003)。メラトニンは灰白質と白質に保護能力を与え、炎症カスケードと血液脳透過性を減少させる(Chen et al. 2006; Lee et al. 2007)。メラトニン注射は、ラットモデルにおける酸化的脳損傷を減衰させる(Ersahin et al. 2009; Wu et al. 2017)。メラトニンはまた、Ca2+ homeostasisと、酸素グルコース欠乏虚血ラットモデルへの放出を防ぐことによる細胞外グルタミン酸レベルの減少にも役立つ(Patiño et al. 2016)。脳への傷害を誘発したラットモデルにおいて、メラトニンは、傷害部位への循環中のマクロファージ/単球と好中球の移動を減少させるため、抗炎症特性を示した(Lee et al. 2007)。Paredesら(2015)は、メラトニンの摂取により、非摂取群と比較して、海馬と大脳皮質の虚血領域において、インターロイキン-1β(IL-1β)、腫瘍壊死因子α(TNF-α)、BAD、BAXが有意に減少したことを報告している。
アルツハイマー病(AD)は、加齢に伴う障害であり、記憶関連領域における有毒タンパク質βアミロイド(Aβ)と神経原線維変化(NFT)の沈着により、認知行動の進行性低下をもたらす(Ittner and Gotz 2011; He et al. 2010)。神経細胞の損失と酸化ストレスは、有害なタンパク質分子の沈着によって引き起こされる(Sultana and Butterfield 2010; Jeong 2017)。Aβが生成したフリーラジカル、膜機能障害、炎症の蓄積によって生じる酸化ストレスは、ADの発症に重要な役割を果たす(Prasad 2017; Nesi et al. 2017)。最近の研究では、ADに対する抗アミロイド原性メラトニン作用が報告されている(Shukla et al. 2017)。また、メラトニンはアミロイド前駆体タンパク質(APP)の合成を停止させ、Aβの形成を阻害する(Lahiri 1999)。メラトニンの長期投与は、トランスジェニックマウスの海馬と皮質におけるAβの蓄積を防ぐことが知られている(Olcese et al. 2009)。ADでは、メラトニンはAβ促進酸化ストレスと脂質過酸化を減少させるため、強い抗酸化物質として作用する(Daniels et al. 1998; Shukla et al. 2017)。メラトニンがADトランスジェニックマウスの皮質においてカタラーゼ、GPx、SODのような特定の抗酸化物質のレベルを維持することが報告されている(Olcese et al. 2009)。
世界中で何百万人もの人々がパーキンソン病(PD)に苦しんでいる(Elbaz and Moisan 2008; Wirdefeldt et al. 2011)。PDは神経変性疾患であり、遺伝、年齢、喫煙、乳製品の摂取、マンガンや鉛への曝露など、PDの発症に関連する複数の病因因子がある(Elbaz and Moisan 2008; Hughes et al. 2017; Ma et al. 2017)。黒質小体部(SNC)では、PDにおいてドパミン作動性神経細胞の喪失があり、その結果、線条体ドパミン枯渇が生じ、最終的に、硬直、振戦、徐脈、姿勢障害をもたらす平滑筋の障害を引き起こす(Tansey et al. 2007; Maguire-Zeiss and Federoff 2010)。加齢に伴うPDは酸化圧を伴うことが多くの報告で証明されている(Padurariu et al. 2013)。PDの発症では、フリーラジカルが開始因子である。この疾患の不可欠な特徴は、PDにおける不眠症とうつ病であり、睡眠の障害は精神医学的徴候と認知機能の低下に関係している。PDを引き起こす様々な要因を図に示す。図2。
図2 パーキンソン病の要因
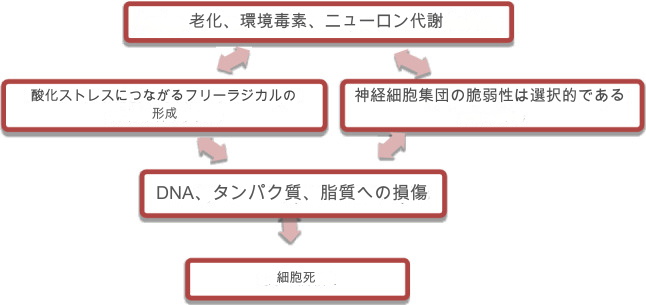
線条体と海馬において、メラトニン投与は脂質の過酸化を防ぎ、それによってMPTP誘発PDモデルにおける神経細胞死を阻止する(Antolinら、 2002)。PD誘発動物モデルにおいて、メラトニンは6-OHDAにおける黒質経路のSODとカタラーゼの抗酸化酵素活性を調節する。したがって、メラトニンはその抗酸化作用と抗炎症作用を通じて神経保護作用を示すことがわかる。
メラトニンと高血圧
高血圧は、痩せた人に比べて肥満の人に多く観察され、メラトニンが血圧の調節や調整に果たす役割は、長年研究者にとって興味深いテーマであったようだ(Poirier et al. 2006; Qin et al. 2013; Cook et al. 2011). 哺乳類では、メラトニンは心拍数と動脈血圧を調節する(Simko and Pechanova 2009; Reiter et al. 2010)。 1994; Krause et al. 1995; Pang et al. 1993, 1996). 高血圧の患者は、交感神経と副交感神経の心臓緊張の変化を伴う昼夜のリズムの乱れを示す(Nakano et al. 2001)。高血圧の結果である冠動脈性心疾患を患っている人は、夜間のメラトニンレベルが低下している(Brugger et al.) 同様に、ラットの松果体摘出は高血圧をもたらすことが報告されており、内因性メラトニンの投与は松果体摘出ラットの血圧上昇を抑制した(Simko and Paulis 2007)。日中に高血圧になる人は概日リズムが乱れているという強い証拠がある(Simko and Paulis 2007)。松果体からメラトニンの分泌はSCNによって制御され(Buijsら 2003)、メラトニンはその高親和性受容体を介してSCNにフィードバックを送り、そこで自身の産生や他の概日リズムを制御する(Amaral and Cipolla-Neto 2018)。夜間のメラトニン分泌は、主要なペースメーカーを通じて概日リズムを直接後押しし、昼夜リズム(Cipolla-Neto and Amaral 2018)とBP(Scheerら 2004)の改善に重要な役割を担っている。Grossmanら(2006)は、メラトニン(2 mg、4 週間)を就寝時に投与することで、夜間の収縮期および拡張期BPが低下したことを報告している。メラトニンが血圧に影響を及ぼす方法はいくつかある。活性酸素と活性窒素種(RNS)は高血圧の発生に重要な役割を持つが(Anwar et al. 2001; Pechanova et al. 2006)、抗酸化物質は活性酸素とNOSの高血圧作用を減少させる。メラトニンは、細胞内のスーパーオキシドアニオン含量、マロンジアルデヒド、NF-κB発現を低下させ、GPx活性を増強することにより、血圧を低下させることが報告されている(Girouard et al. 2004; Nava et al. 2003; Paulis 2006). 高血圧の若い女性患者では、夜間メラトニンのレベルが低いことが高血圧発症の危険因子と考えられている(Forman et al. 2010)。高血圧患者では、メラトニンの分泌障害により、メラトニンの夜間濃度が低下した(Zeman et al. 2005)。これらの所見の結果、メラトニンは、糖尿病でない患者や高血圧性心疾患、夜間高血圧の症例において、強力な治療分子となる(Reiter et al. 2010)。夜間高血圧患者におけるメラトニンの摂取は、収縮期および拡張期血圧を低下させた(Grossman et al. 2011)。
メラトニンと糖尿病について
糖尿病(DM)は、血中グルコース濃度の上昇とインスリンの分泌および作用の欠陥に関連する糖質代謝の障害である(Ali et al. 2017, b; Bhat et al. 2017)。メラトニンは、睡眠と概日調節におけるその役割のために重要性を増してきた。しかし、最近では、耐糖能や2型糖尿病(T2D)のリスクや治療における役割が重要視されている。これは、MTNR1BにおけるT2Dリスク変異の部分的発見と、概日リズムの乱れがグルコース代謝に部分的に悪影響を及ぼすためである(Mason et al. 2020)。概日リズムの乱れは、肥満や糖尿病などのメタボリックシンドロームを引き起こすことが報告されている(Pulimeno et al. 2013)。インスリン分泌とグルコースホメオスタシスにおけるメラトニンの役割については、多くの報告がある。T2D患者ではメラトニンの減少が報告されている(Prokopenko et al. 2009)。メタボリックシンドロームとT2Dの実験モデルである若いZucker diabetic fatty (ZDF)ラットにおけるメラトニンのグルコースホメオスタシスの役割について行われた研究では、メラトニンの経口投与が、β細胞機能の改善を通じて若いZDFラットにおいて抗高血糖効果をもたらすことが明らかにされた(Agil et al. 2012)。研究では、メラトニン受容体の欠乏が、膵島ホルモンとグルコーストランスポーター(Glut 1とGlut 2)のレベルに直接関係していることが明らかにされている(Bazwinsky-Wutschkeら、 2014)。インスリンの分泌が血漿中のメラトニン濃度に反比例するという知見に基づく、メラトニンとT2Dの関係(Peschke et al. 2013)。夜間光曝露の結果としてメラトニンの分泌を抑制することは、T2Dの発症に不可欠なパラメータである可能性がある(Fonken and Nelson 2014)。多くの文献が、睡眠命令の乱れと耐糖能の低下およびT2Dとの相関を示唆している(Donga et al. 2010; Yaggi et al. 2006)。Hajamらによって報告された研究(2022)は、糖尿病誘発腎傷害モデルラットにインスリンとメラトニンを併用投与した場合の治療効果を報告している。報告された研究の結果は、血清の生化学的パラメーター、血清中の抗炎症分子、腎臓の組織構造の変化によって確認されたように、インスリンとメラトニンの併用が糖尿病によって引き起こされた腎障害の治療にかなり有効である可能性があることを明らかにした(Hajam et al. 2022)。メラトニンの投与は、膵β細胞におけるインスリンの合成を調節するとともに、楽観的インスリン効果を増強する(Hajam and Rai 2019)。
メラトニンと癌
前世紀の間に、結腸直腸癌、乳癌、前立腺癌、白血病、膵臓癌、黒色腫のような様々な悪性腫瘍に対するメラトニンのコスト特性を評価した様々な報告がある(Foon 1989)。これらの研究は、エストロゲン受容体を発現する乳がん細胞において有望な結果をもたらした。がんは、心血管系疾患に次いで世界的に最も多くの死亡者数を占めている(Ferlay et al. 2012; Fitzmaurice et al. 2015)。統計的には、男女ともに肺がんによる死亡が最も多く、男性の死亡では前立腺がん、女性の死亡では乳がんがトップである(Ferlay et al. 2012; Fan et al. 2015; Torre et al. 2016; James et al. 2017). 現在までの腫瘍性疾患のデータから、ヒトのがんの進行は、突然変異、遺伝子の過剰発現、悪性度、組織学などの疾患生物学的特徴に依存するだけでなく、免疫系や内分泌系の状態を含む患者の免疫生物学的反応にも依存することが明らかに示唆されている(Foon 1989)。同様に、免疫系の機能不全は免疫細胞の活性に依存するのではなく、主に松果体の影響を受ける神経内分泌生理の変調にも依存する。松果体は、ペプチドホルモンや様々な抗がんインドール分子、そして主にメラトニンホルモンの分泌を通じて、抗腫瘍抗増殖機能を発揮する(Brzezinski 1997)。松果体ホルモンの特徴が明らかになる以前は、腫瘍の発症と播種は松果体摘出によることが知られていた(Buswell 1975)。メラトニンとがんとの関連は何十年も前から研究されており、多数の疫学研究がメラトニンのがんに対する保護能を支持している(Nooshinfar et al. 2017; Li et al. 2017)。さまざまな研究により、メラトニン以外にも、多くの抗がんホルモンが松果体によって産生されている可能性が報告されている(Anisomov et al. 2001)。様々な研究が、様々なタイプの癌におけるメラトニンの予防的役割を実証している(Cos and Sanchez-Barcelo 2000; Wang et al. 2012; Kanishi et al. 2000; Subramanian et al. 2007). 腫瘍との闘いに役立つメラトニンの重要な特性は、細胞賦活作用と細胞毒性作用で腫瘍性増幅を減少させる能力である(Martin et al. 2007; Liu et al. 2016)。他のいくつかの研究では、乳腺がんに対するメラトニンの保護的役割が報告されている(Kosar et al. 2016; Gatti et al. 2017)。循環メラトニンの減少は、発がん物質7,12-ジメチルベンズ(a)-アントラセン(DMBA)を介した乳腺腫瘍の有病率の増加と関連していることが報告されており、メラトニンによる治療はその発生率を最小限に抑える(Chu et al. 2018)。MCF-7ホルモン依存性乳がん細胞に対するメラトニンとレチノイン酸の併用は、細胞増殖を完全に阻止し、アポトーシスの活性化によって細胞数を減少させた(Margheri et al. 2012)。他の研究者らは、メラトニンが細胞周期の分化を阻害する能力を通じて腫瘍の進行を抑制することを報告している(Sánchez-Sánchezら、 2011; Cabreraら、 2010; Martinら、 2007 )。
メラトニンと肥満
概日時計の障害と肥満発症を結びつける証拠はかなりある。肥満とクロノディスラプションの因果関係は双方向的であるにもかかわらず(Bray and Young 2012)、メラトニンとそのアゴニストの投与は概日リズムのリセットに有効であることが証明されている(Zawilska et al.Cardinali et al. 2011; She et al.2009; Oxenkrug and Summergrad 2010)や肥満に関連した障害の修正に有効であることが証明されている。さらに、肥満は睡眠障害のような様々な併存疾患と関連しており、メラトニンや他の薬剤が有効であることが示されている(Cardinali et al. 2011)。メラトニンは、エネルギー代謝と体重管理に関与しているという仮説がある。季節性動物の体内では、代謝と脂肪量の調節におけるメラトニンの関与が最初に研究され、確立され(Bartness and Wade 1985)、季節および概日リズム調節因子としての活動に結びついた(Arendt 2006)。動物種にもよるが、光周変動や外因性メラトニン注射による循環メラトニン濃度の上昇は、最終的にこれらの季節性動物の体脂肪量の減少や増加に関係していた(Bartness and Wade 1985)。肥満Zuckerラットを長い光周期の条件にさらすと、短い光周期の動物に比べて体重が増加した(Larkinら 1991)。また、松果体を除去すると循環中のメラトニン濃度が低下し、肥満ラットでは3 週間後に健康なラットと比較して体重が増加した(Prunet-Marcassus et al. 2003)。正常ラットでは、術後期間を2ヵ月に延長すると、体も心臓も体重が増加した(Kurcerら、 2006)。メラトニン(30 mg/kg/日、消灯1 時間前)は、3 週間、これらの松果体切除による変化を防ぐことができた(Prunet-Marcassus et al. 2003)。同じ研究者らは、同じようにメラトニンを投与すると、高脂肪食による体重増加を最小限に抑えることができる一方で、全体的な食物摂取量には影響を与えないことを発見した(Prunet-Marcassusら、 2003)。肥満によって誘発される脂質異常症の症状は、メラトニンによって改善されることが証明されている。これは、非肥満性高コレステロール血症ラットで最初に注目され(Hussain 2007)、その後、さまざまな肥満誘発ラットモデルで検証された(Agil et al. 2012)。メラトニンは、以前に示されたように、受容体媒介または非受容体媒介経路を介してその多様な機能を発揮する(Venegas et al. 2012)。肥満の治療と予防におけるメラトニンの治療効力は、動物モデルにおける高い有効性の結果とともによくまとめられている(Barrenetxe et al. 2004; Shieh et al. 2009)。
メラトニンと自己免疫
関節リウマチ(RA)、多発性硬化症(MS)、全身性エリテマトーデス(SLE)のような免疫不全疾患の発症とメラトニンの外因性および内因性産生は、メラトニンと他の自己免疫疾患との関係に関するデータが乏しいにもかかわらず、複数の研究で関連付けられている。この点に関して、乾癬患者は概日性メラトニンの分泌障害があることが示されている(Mozzanica et al. 1988)。自己免疫性難聴患者では、メラトニンはII型コラーゲンによって誘導されるリンパ球の増殖を抑制し(Lopez-Gonzalez et al. 1997)、実験モデルにおいて特発性膜性腎症から保護する(Wu et al. 2012)。世界的には、人口の1%が関節リウマチ(RA)に罹患しており、この自己免疫疾患に対するメラトニンの効果については議論の余地があるようだ(McInnes and Schett 2011)。RAは進行性の炎症性疾患であり、関節に深刻な影響を及ぼし、それによって重度の障害を引き起こす(Ali et al. 2017a, b)。実験的関節炎モデルを用いたいくつかの研究は、メラトニン(内因性および外因性)が悪影響を及ぼすことを示唆している。その結果、常時暗所で飼育されている動物は、常時明所で生活している動物に比べて血清中の抗コラーゲン抗体の力価が上昇し、重症のコラーゲン誘発性関節炎を発症する。松果体摘出術は、恒常的な暗闇の影響を打ち消すために用いられた(Hanssonら、 1993)。さらに、一定の光の下に置かれ、II型コラーゲンで免疫されたマウスでは、重症型の関節炎が発症したが、発症時(30-39日目)のメラトニン投与は、疾患の臨床徴候に影響を与えなかった(Hanssonら 1992)。アジュバント誘発関節炎モデルにおいて、インドールアミンによる予防および/または治療療法は、メラトニンの有害な効果を示した研究と比較して、インドメタシンと同等の方法で後肢の腫脹を低下させる(Chen and Wei 2002)。RAの罹患率と重症度の増加は高緯度と関連しており、冬の長い夜におけるメラトニン産生の増加がRAと関連している可能性を示唆している。UV-Bは松果体からのメラトニン合成を減少させる傾向があるため、RAの発症はUV-B曝露と逆相関している(Arkema et al. >2013)。RA患者では、夜間のメラトニン濃度は、イタリア出身者に比べてヨーロッパ出身者の方が高かった(Cutolo et al. 2005)。早朝、RAの症状は悪化する(Cutolo and Masi 2005)。様々な研究で、RA患者では健康な人に比べて早朝の血清メラトニン濃度が高いことが報告されている(Cutolo et al. 2005; Sulli et al. 2002)。RA患者では、血漿中のメラトニン濃度が有意に減少していた(West and Oosthuizen 1992)。RAで培養した滑膜マクロファージでは、メラトニン分子の結合部位は親和性が高く、メラトニンの摂取はNOとIL-12のレベルをそれぞれ増加させた(Maestroniら 2002; Cutoloら 1999 )。メラトニンレベルは、RA患者の滑膜液の方が高かった(Maestroni et al. 2002)。
若年成人において、多発性硬化症(MS)は最も有病率の高い神経疾患であり、世界的な罹患者数は100万~250万人で、中年女性の罹患率が世界的に増加している。ミエリンに対する免疫学的反応によって引き起こされる神経変性疾患である(Lassmann and Horssen 2011)。MSの病因はいまだ不明だが、北方諸国での罹患率が高いことから、環境要素の1つとして緯度が関与しているようである(Kurtzke 1977)。丘陵地では近隣の低地と比較して発症率が低下するため(Kurtzke 1967)、日照時間の減少と関連している(van der Mei et al. 2003)。最近では、幼少期の交代勤務がMSのリスク上昇に関連しており、MSリスクと交代勤務の長さには正の相関がある(Hedstrom et al. 2011)。MS患者では、メラトニンとMT6の概日リズムの両方が乱れている。メラトニンは、悪化したMS患者の大部分で概日リズムが逆転していた(Sandyk and Awerbuch 1992)。
全身性エリテマトーデス(SLE)は複雑な自己免疫疾患であり、その発症率は10万人あたり20-150例、年間1-10例と推定されている。血液や組織において、免疫複合体の形成は、SLEの顕著な特徴である実質的な組織損傷を引き起こす(Tsokos 2011)。メラトニンと狼瘡の場合、狼瘡傾向マウスでは概日リズムのアンカップリングが見られる(Lechnerら 2000)。
SLEのマウスモデルにおいて、メラトニン治療は、投与時期や動物の性別などの様々な基準によって、一貫した効果を示さない。朝のメラトニン投与は狼瘡傾向マウスの生存率を改善したが、夕方の投与ではその効果は再現されなかった(Lenzら、 1995)。メスマウスの腎臓において、メラトニンの補充は、ループスになりやすい動物において、血管病変と炎症性浸潤を効果的に減少させ、抗コラーゲンIIと抗DNA自己抗体価を減少させ、炎症性サイトカインの産生を低下させ、抗炎症性サイトカインの生成を増加させた(Jimenez-Caliani et al. 2006)およびプリスタン誘発性狼瘡(Zhou et al.) メラトニンは、雄の狼瘡になりやすいマウス(Jimenez-Caliani et al. 2006)にはほとんど影響を与えず、病状を悪化させることもなかった。
メラトニンと敗血症
主に敗血症は、宿主の全身に炎症を引き起こす微生物感染症である。一般に、細菌、ウイルス、真菌、その他の寄生虫などの微生物病原体が原因となる(Annane et al. 2005; Calandra and Co 2005 )。グラム陰性菌は細胞壁にリポ多糖(LPS)を持っており、それが最終的に敗血症の開始に関与していることが判明している(Sriskandan and Cohen 1995)。LPSは、核内因子κBのような細胞内シグナル伝達経路を活性化することにより、サイトカイン、ケモカイン、iNOS、熱ショックタンパク質のような炎症分子の遺伝子と発現を著しく誘導する(Victorら 2004; Tsiotouら 2005 )。敗血症の間、炎症性メディエーターと抗炎症性メディエーターの自然なバランスが崩れ、いくつかの炎症性メディエーターが放出される(Pinsky 2001)。敗血症の初期には、IL-1やTNF-αのような可溶性の炎症分子が放出される。IL-1は活性酸素の発生とプロテアーゼの刺激を引き起こし、一方、細胞の活性化はTNF-αによって引き起こされる。敗血症の発症には、インターフェロンやインターロイキンなどのメディエーターが関与している。ヒトと動物モデルの両方において、メラトニンの補充は敗血症性ショックの治療に有効である。敗血症と細菌感染におけるメラトニンの有益な特性を図に示す。図3。
図3 メラトニンと敗血症におけるその有益な効果

メラトニンとマラリア
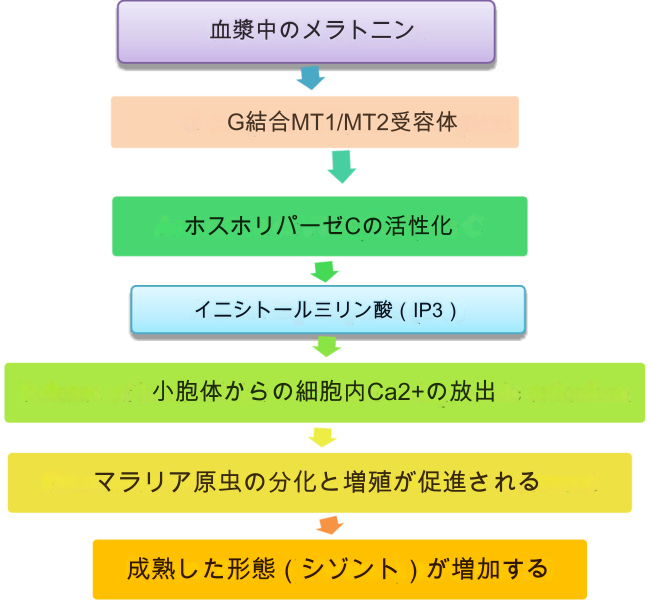
マラリアは、世界中で約2億人が罹患し、毎年100万人以上が死亡する深刻な原虫性疾患のひとつである(佐藤 2021)。ヒトのマラリアの原因として一般的なマラリア原虫とは別に、より病原性の高い寄生虫として知られているのがマラリア原虫である;Plasmodium knowlesi マレーシアだけでなく世界中で急速に広がっている(White 2008; Yusof et al. 2014; Singh and Daneshvar 2013)。過去には、殺虫剤散布を含む世界的なマラリア撲滅活動によって、良い結果がもたらされた。マラリア感染は強力な抗マラリア薬のおかげで撲滅に成功したが、薬剤耐性の増加に伴い、薬剤耐性マラリアが再発している。マラリア寄生虫の遺伝子調査における最近の発見によれば、メラトニンはマラリア原虫 の成長と発達の引き金として働く(Mallaupoma et al.) 同じことが、Plasmodium knowlesiにも当てはまるかもしれない。その結果、夜間を通してマラリア原虫 の種に対するメラトニンの作用をうまく阻害する治療戦略には、明るい光の治療やメラトニンの受容体の遮断が含まれ、ヒトのマラリアを根絶するための実行可能な選択肢とみなすことができる。メラトニンがマラリア原虫 の細胞周期に及ぼす治療的影響は、図 4に表されている。
図4 原虫のライフサイクルに対するメラトニンの効果を表すグラフの概要
ワクチン接種におけるメラトニン
ワクチンは、特定の病気に対する免疫を開発するための重要な取り組みであり、既存のワクチンの効率を高めることに注目が集まっている。ワクチン接種の免疫促進効果は、病原体に対する効果的な免疫反応の生成と支持に効果的な抗原部分と適切なアジュバントによって定義される。いくつかのin vivo研究では、メラトニンの免疫調節作用に基づき、メラトニンをワクチン剤として使用することが検討されている。ヒツジでは、跛行(Katzら、 1991)は Dichelobacter nodosus (Regodónら、 2005)によって引き起こされ、メラトニンの投与はワクチン接種したヒツジの体液性応答を増強した。注射や移植によって投与されたメラトニンはまた、トロンビン刺激に対する血小板の反応を増加させ、凝集速度、凝集率、凝集遅延時間を改善した(Regodónら、 2012)。 クロストリジウム・ペルフリンゲンス タイプDをワクチン接種したヒツジにおいて、メラトニンの投与は有益な免疫反応を呼び起こした(Regodón et al. 2012)。興味深いことに、血清抗体の最高濃度は分娩前ワクチン接種後に認められたことから、免疫時期もメラトニンの有益な効果を付与する上で重要な役割を果たすことも判明した。前立腺がんに対するワクチン開発において、メラトニンの使用の可能性が述べられているが、現在までデータは発表されていない(Connor 2008)。メラトニンは、ケジラミ抗原と可溶性ワーム抗原のワクチン効果を有意に改善し、GSHレベルも上昇させた(Soliman et al.) アルツハイマー病に対するワクチン開発において、アジュバントとしてのメラトニンの使用は非常に効果的であることが証明されている。
メラトニンと生殖
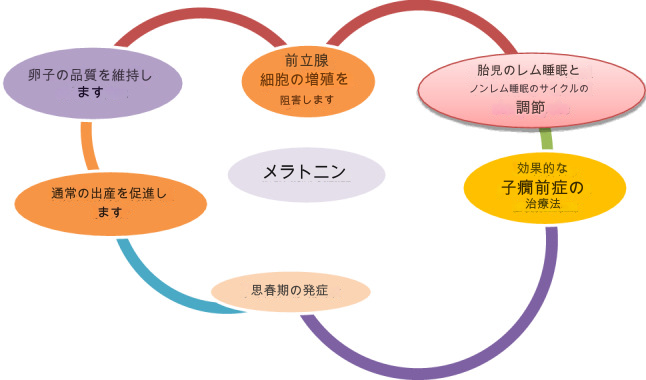
メラトニンは多種多様な生理学的特性を持つ潜在的分子であり、さまざまな種において生殖状態に影響を与えることが知られている(Thiéblot and Le Bars 1955)。メラトニンが発見される以前、1898年のHuebnerによる研究では、ヒトの松果体の腫瘍が思春期の発育に影響を及ぼすことが報告され、松果体系列の何らかの分子が生殖機能に影響を及ぼすことが示唆された。この発見の結果、多くの研究者が多くの種で松果体と生殖状態の関係を調査したが、機能的関係を証明することに成功した研究者はほとんどいない(Thiéblot and Le Bars 1955)。ある研究では、外因性メラトニンを投与した雌ラットにおいて、卵巣重量が減少したことが報告されている(Wurtman et al. 1963)。それ以来、多数の種において生殖機能がメラトニンを介して松果体によって影響されることを示唆する多くの証拠がある(Reiter 1993)。光周期を介したメラトニンの分泌頻度が生殖能力に直接的な影響を与えるという、かなりの証拠がある。メラトニンの主要な生理的目的は、1日の明暗(LD)サイクルを説明することである。生殖機能に対するメラトニンの潜在的な影響は、図に示されている5。
図5 メラトニンと生殖状態への影響
気分障害におけるメラトニン
双極性障害(BD)、大うつ病性障害(MDD)、季節性感情障害(SAD)など、さまざまな気分障害の発症において、メラトニンの役割が明らかにされている。BD患者に関連する主な異常は、睡眠障害、特に夜間の睡眠減少と概日リズムの異常である(Harvey 2008; Mansour et al. 2005)。BD患者では、うつ病の段階でメラトニンの分泌が著しく減少し、症状が寛解すると正常に戻る。MDD患者では、早朝の覚醒、気分、注意力、日中の疲労などの障害がよく知られている。MDD患者では、体内のメラトニン濃度が上昇し、このホルモンの相転移がこの疾患の最大の臨床的特徴と考えられている。SADでは、冬季の患者はうつ病エピソードを経験し、夏季には軽快する。SAD患者ではメラトニンの季節変動が認められる。気分障害の病態では、患者のほとんどが概日リズムと睡眠の障害に苦しんでいる。いくつかの気分障害の患者では、メラトニンレベルの変化により、視床下部前部の視交叉上核にある生物時計機能に異常が生じる。したがって、概日時計の機能を回復させることができる抗うつ薬を用いた治療法が開発されるべきであり、その意味で、アゴメラチンは抗うつ薬としてかなり有効であることが判明している。アゴメラチンは化学合成されたナフタレン化合物で、主にMT1およびMT2受容体に作用する。この薬物の半減期はメラトニンよりも長く、主にCYPアイソザイム(CYPA1、CYPA2、CYP2C9)を介して肝臓で代謝される。アゴメラチンは、アドレナリン作動性、ドーパミン作動性、ムスカリン作動性、ヒスタミン作動性の受容体に対して有意な親和性を示さない。気分障害の治療において、アゴメラチンは異常な概日リズムと乱れた睡眠パターンを再同期させるため、非常に有用である(Kennedy et al.) アゴメラチンの抗うつ作用に加えて、睡眠パターンの乱れ、服薬中止、性機能障害などの副作用は認められなかった。アゴメラチンは強迫性障害の治療にも非常に有効であることが判明している(Fornaro 2011)。近年、多くの研究により、アゴメラチンは臨床的有効性、安全性、忍容性に優れていることが報告されている(Rouillon 2006; Kennedy and Rizvi 2010)。
移植におけるメラトニン
メラトニンの役割はまた、動物モデルにおいて有益であるとして、移植片の生存期間の延長に見出されている。心臓移植のラットモデルにおいて、メラトニン(200 mg/kg)はリンパ球の増殖を減少させるため、同種移植片の免疫反応を抑制し、拒絶反応を止め、移植片の生存期間を延ばすことがわかった(Jung et al. 2004)。同時に、再灌流障害を伴う肺の長時間の虚血後にも同様の効果が観察された(Inciら 2002)。非肥満性糖尿病マウスにおいて、メラトニンの大量投与は、T細胞増殖を抑制し、IL-10細胞集団を増加させるため、膵島移植片の生存を優位に促進した(Lin et al.) 卵巣移植のラットモデルでは、メラトニン投与は免疫抑制特性を示した(Sapmaz et al. 2003)。メラトニンで治療したヒトの卵巣移植片の同等の研究調査では、アポトーシスの減少が示された(Friedman et al. 2012)。虚血再灌流傷害動物モデルでは、メラトニン投与による保護効果が報告されている(Fildes et al. >2009)。メラトニンの摂取は、アポトーシス細胞、酸化分子の減少、好中球の動員を引き起こし、GSHも上昇させた(Baykara et al. 2009)。
メラトニンとその他の感染症
前世紀の間、メラトニンは重要な抗生物質、抗寄生虫、抗ウイルス剤として考えられてきた(Bagnaresi et al. 2012)。メラトニンの保護的役割は、ウイルス感染を引き起こすベネズエラ馬脳脊髄炎ウイルス(VEEV)に対して見出されている(Montiel et al. 2015)。1920年から1970年にかけて、このウイルス感染症のアウトブレイクが南米北部で発生し、数千人の人々、ロバ、馬が罹患した(Bowen and Calisher 1976)。この感染症は1995年にも再発し、罹患地域で死亡率を引き起こした(Weaver et al. 1996)。この感染症は興奮と運動亢進を引き起こし、その後、運動低下、昏睡、麻痺、死に至った。マウスでは、感染したウイルスを用いた一連の実験的研究が行われ、メラトニン投与後、脳と血液中のウイルス量が減少したため、死亡率が低下し、発病が遅れた(Bonilla et al. >1997)。免疫不全マウスでは、VEEVレベルは、免疫低下マウスと比較して、メラトニン処理によって脳内で減少し、メラトニンが抗ウイルス活性を示すためには免疫系の完全性が必要であることを提唱している(Bonilla et al. 2001)。病原性脳筋心筋炎ウイルス(EMCV)によって引き起こされる疾患である脳炎では、マウスのメラトニン補充は、EMCV亜致死量に感染したげっ歯類の麻痺と死亡を予防した(Wongchitrat et al. 2010)。 セムリキ森林ウイルス(SFV)に感染したマウスは中枢神経系に欠陥があり、死を引き起こすという研究報告があり、メラトニンの投与はウイルス血症を減少させ、発病を遅らせ、死亡率を減少させた(Carrillo-Vico et al. 2013)。細菌感染の様々な開発モデルにおいて、メラトニンは有毒なフリーラジカルの消去に強力な役割を持ち、抗酸化作用もあるようである(Manchester et al. 2015)。 結核菌では、夏の始まりと冬の終わりにピークを迎える感染症例の季節性を報告した研究はほとんどない(Liao et al. 2019)。季節性の変化はすべて報告されており、メラトニン濃度の年変動が免疫系の季節変動を引き起こすと提唱する研究者は少ない(Ozkank et al. >2012)。メラトニンの補給は、寄生虫感染症の治療にかなり有効であることが判明している。
メラトニンと痛み
組織の潜在的な損傷は、不快な感覚である痛みを引き起こす。痛みの知覚メカニズムは、生化学的、神経生理学的、体液性、心理学的パラメーターからなる多因子事象である(Shavali et al. 2005)。組織損傷時には、サイトカイン、プロスタグランジン、TNF-α、ブラジキニン、ロイコトリエンなどのさまざまな炎症分子が血液循環中に放出される。これらの炎症性物質は直接作用するか、受容体に作用する物質を放出し、痛みの伝達経路に関与するニューロンの興奮性を促進する(Meyer 2006)。痛みをコントロールし、管理することは大きな関心事であり、そのために様々な薬剤が使用されている。非ステロイド性抗炎症薬であれアスピリンであれ、使用される薬剤のほとんどは、シクロオキシゲナーゼを阻害することで効果を示す(Fokunang et al. 2018)。ヒトやげっ歯類では、日内変動を伴う疼痛知覚が報告されている(Tappe-Theodor and Kuner 2014)。暗期には痛みをあまり感じないことが判明しているが、健常人の症例では、痛みレベルの長期遅延が報告されている(Tappe-Theodor and Kuner 2014)。この現象は、おそらく夜間のメラトニンレベルの上昇に起因すると考えられ、この観察により、多くの実験デザインとモデルが開発された。初期の研究で報告されたメラトニンの抗侵害受容特性は、ベンゾジアゼピン作動性(BZD)経路とアヘン経路が関与していることを示している。これらに加え、メラトニンは神経伝達系と関連受容体部位シグマ系、BZD、アドレナリン作動性、セロトニン作動性、グルタミン酸作動性、ドーパミン作動性、そしてMT1/MT2受容体を直接介してその作用に影響を及ぼす(Mantovani et al.) 抗侵害受容特性は、シクロオキシゲナーゼ(COX)とNMDA受容体を介して相互作用する一酸化窒素分子によっても発揮される(Curyら、 2011)。
メラトニンと多嚢胞性卵巣症候群(PCOS)
多嚢胞性卵巣症候群(PCOS)は、生殖年齢にある女性の20%に影響を及ぼす複雑な内分泌疾患である(Shaikh et al. 2014)。PCOSは様々な環境因子と遺伝因子の相互作用により発症する。PCOSに関連する臨床的特徴は、高アンドロゲン血症、無排卵性不妊症、月経不順、肥満であり、これらの不定愁訴のために女性はしばしば治療を求める。近年、PCOSに対する理解や治療法が進歩したにもかかわらず、多くの疑問がまだ解決されていない。しかし、減量や栄養カウンセリングを含む生活習慣の見直しは治療計画に含まれている。卵母細胞、卵胞細胞、細胞栄養芽細胞は、女性の生殖系におけるメラトニン産生部位の一部である。卵巣と卵胞内液にあるメラトニンの受容体は、卵胞成熟の様々な段階で性ステロイドの分泌を維持する。卵胞成熟期において、メラトニンは強力な抗酸化物質であり、フリーラジカルを効果的に消去するため、卵巣卵胞を保護する。女性の生殖生理において、メラトニンの作用は、卵巣、視床下部、下垂体にある受容体を介して媒介される(Reiter et al. 2009)。メラトニンは、卵母細胞や発育中の胎児を酸化ストレスから保護することが知られている(Tan et al. >2003)。PCOSに罹患した女性において、メラトニンのレベルは、病因におけるその役割について知るために、様々な研究によって測定されている(Luboshitzky et al. 2003, 2004)。実験動物モデルにおいて、外因性メラトニンの投与がグルコース止血と内皮血管機能を改善することを示唆する研究結果もある(Pai and Majumdar 2014)。PCOS患者では、メラトニンの摂取により、生殖および代謝異常に対する保護機能が付与される。
メラトニン作動薬
メラトニンホルモンは様々な有益な特性を持っており、その結果、多くのアゴニストが合成されてきた。数多くの病態において、メラトニンと他の薬剤の併用は非常に有用であることが証明されている。メラトニン分子は循環半減期が短いため、治療の可能性は限られている。メラトニンの作動薬のいくつかを以下に示す。
アゴメラチン
アゴメラチンは、MT1/MT2受容体の合成アゴニストである。アゴメラチンはMT1/MT2受容体に対して100倍の選択性を示す。Agomelatineの半減期はメラトニンに比べて長い(2 h)。世界40カ国以上で、この薬は現在市販されており、主に成人うつ病の治療に使用されている(Fornaro 2011; Carney and Shelton 2011)。うつ病患者において、この薬は症状を緩和し、概日リズムを回復させる。この薬剤の臨床目的は中等度から重度のうつ病を対象とするものであったが、このメラトニンの作動薬はGAD、SAD、BDの治療にもかなり有効であることが判明している(da Rocha and Correa 2011)。アゴメラチンのクロノバイオティクスおよび睡眠誘導作用は、SCNにあるメラトニン作動性受容体によるものである。これまでに実施されたすべての研究において、アゴメラチンは良好な安全性と忍容性を示している。
タシメルテオン
MT1/MT2受容体ファミリーの非選択的アゴニストがタシメルテオンである。この薬剤は第III相臨床試験を成功裏に通過し、最小限の副作用で睡眠の維持と入眠を改善するのにかなり有効であることが判明した(Arendt and Rajaratnam 2008)。
ラメルテオン
2005年、FDAはこの薬を睡眠障害、不眠症、その他の睡眠障害の治療薬として承認した(Cajochen 2005)。この薬剤は、MT1/MT2の受容体に対して高い親和性(メラトニンの3-16倍)を持つ、かなり選択的なアゴニストである(Kato et al. >2005)。異なる年齢層(18~83歳)の不眠症患者において、本薬は罹患者の総睡眠時間を延長させることが判明した(Greenblatt et al. 2007)。さらに、この薬物はMT3、ドーパミン、ベンゾジアゼピン、アヘン、セロトニン受容体には親和性を示さなかった(Zammit et al. 2009)。循環中、ラメルテオンの半減期はメラトニンよりはるかに長い(1~2時間)。消化管では、ラメルテオンの約84%が速やかに吸収される。
ピロメラチン
この薬は5HT1A、5HT1D、5HT2Bの作動薬であり、現在も齧歯類動物モデルを用いた研究開発中である。この薬は第II相試験を完了しており、その対象には不眠症、抗不安、抗うつ効果の治療が含まれている。
結論
メラトニンは自然界に広く分布するユビキタス分子であり、動物、ヒト、植物、菌類、単細胞生物によって合成される。生物学的には、メラトニンは主に細胞膜に存在するGタンパク質共役受容体を通じて作用し、MT1とMT2が2つの機能的受容体である。ヒトを含むすべての哺乳類は、体のさまざまな器官でこれらを発現している。メラトニンは、免疫調整、抗酸化、生殖、思春期のタイミング、催眠、オンコスタティック、気分、行動、痛み、クロノバイオティックなど、幅広い機能を示す。メラトニンの産生不全や受容体の発現障害は、肥満、乳がん、神経疾患、糖尿病、高血圧、前立腺がん、自己免疫疾患、気分障害、移植など、さまざまな異常と関連している。慢性不眠症や睡眠障害にもメラトニン分子の関与が認められている。酸化的損傷を減少させる上で、メラトニンの機能は極めて重要であるようだ。様々な障害を予防・治療するために、外因性メラトニンの投与が多くの臨床試験で用いられてきた。様々な障害を治療する目的で、多くのメラトニン作動薬が合成・開発されてきた。新しいメラトニン作動薬の開発により、より優れた薬物動態を持つという新しい臨床領域が形成された。このように、メラトニンは生物界において非常に重要なホルモン分子である。
