MARIA GUTSCHI – REVIEW OF QUALITY ISSUES WITH MRNA INJECTIONS 5 NOV 2022
https://www.bitchute.com/video/1MG7hHpprd9P/
2022年11月5日
各国の規制アプローチの違いや、合成mRNAによって産生されるスパイクタンパク質の独自性に関する懸念など、mRNAワクチン開発の複雑さが話題となった。マリア・グッツィらはまた、生産規模の拡大、無傷のmRNAの純度の維持、mRNAデリバリー用の脂質ナノ粒子の製造工程と特性の理解における課題についても議論した。さらに、mRNAベースの医薬品開発におけるアッセイ、力価、品質管理の問題点を強調し、標準化の欠如と脂質ナノ粒子内の核酸の潜在的な化学修飾についての懸念を提起した。
課題とリスク
mRNAワクチン:
- mRNAは遺伝子操作されたものであり、天然のヒトmRNAではない。そのため、翻訳におけるエラー、タンパク質のミスフォールディング、自己免疫のリスク、未知の影響が生じる可能性がある。
- mRNAワクチンによって産生されるスパイクタンパク質の特性は十分に解明されていない。その塩基配列や特性は、製造業者による独占情報とみなされている。
- 製造されたmRNAの純度や品質に懸念がある。
脂質ナノ粒子:
- 使用される脂質ナノ粒子は、これまでヒトで試験されたことがない。人体内での薬理作用や動態は未知数である。
- 製造工程を急速に拡大する必要があり、品質上の問題が生じた。LNPは不安定になりやすい。
- 遅れて移動する脂質種が発見されたが、これは脂質によるmRNAの化学修飾を示すものであり、懸念される。
製造:
- 製造工程は非常に複雑で、多くの工程があり、サプライヤーも異なる拠点や国にまたがっている。これは品質管理上の課題につながる。
- 急速なスケールアップのため、バッチ間のばらつきの問題がある。
- 汚染、不適切なラベリング、コールドチェーンの維持、管理ミスなどが懸念される。
タイムライン
- マリア・グッツィはいくつかの重要な日付について言及した:
- ファイザー社のワクチンは2020年12月にEUで条件付き承認を取得した。
- EMAはファイザー社に対し、スパイクタンパク質の特性に関する詳細なデータを提供する期限を2021年7月に設定したが、この期限は守られなかった。
概要
- mRNAワクチンの製造と承認プロセス
- 薬剤師であり薬事規制の専門家であるマリア・グッツィは、ファイザー社のワクチンのEUA申請をレビューし、2つの重大なレッドフラッグを特定した。
- マリア・グッツィは、EMAとFDAでは、言語や書式を含め、医薬品の添付文書に関する要件や嗜好が異なることを指摘した。
- マリア・グッツィは、ワクチン製造は複雑で、280のコンポーネントと複数のサプライヤーが関与していると述べている。
- EMAはmRNAを医薬品として評価し、その遺伝子工学的手法に注目している。
- スパイクタンパク質に焦点を当てた、タンパク質生産のためのウイルスmRNAの遺伝子工学。
- 科学者たちは、タンパク質合成を増加させるためにウイルスmRNAを遺伝子工学的に操作する。
- マリア・グッツィは、産生されたタンパク質の証拠の欠如など、合成mRNAワクチン開発の課題について議論する。
- COVID-19ワクチン開発、規制上の懸念、専有情報。
- マリア・グッツィ:”EMAはファイザー社のワクチンに特徴づけの欠如と用法用量の更新のフラグを立てた”
- マリア・グッツィ:”EMAはファイザー社に対し、7月までにスパイクタンパク質の機能性を示すよう要求したが、まだ保留中”
- マリア・グッツィは、合成mRNAとスパイクタンパク質の生産に関連する専有情報について議論している。
- COVID-19ワクチン開発におけるmRNA生産と品質の問題。
- バイオテクノロジー企業はCOVID-19ワクチン用の純粋なmRNAの製造が困難であり、EMAの懸念につながった。
- EMAのデータでは、臨床試験バッチとの製造上の違いから規制上のフラグが立っていた。
- 研究者は遺伝子治療用の高品質mRNAを製造する際の課題について述べている。
- マリア・グッツィは、無菌性や純度に関する懸念など、脂質ナノ粒子製品の品質管理対策について述べている。
- マリア・グッツィは、特殊な機械や化学薬品の使用など、脂質ナノ粒子製造プロセスの独自性について説明する。
- mRNAデリバリーのための脂質ナノ粒子製剤。
- マリア・グッツィは、脂質ナノ粒子(LNP)は丸い形ではなく、ブリップのような形をしており、末端のブリーブの中にmRNAが入っていると説明する。
- LNPへのmRNAの封入率は約20%と推定され、80%は空である。
- マリア・グッツィは、他の薬剤との相互作用の可能性や適切な品質管理の必要性など、脂質ナノ粒子をベースとした薬剤の安全性と有効性に関する懸念について論じている。
- マリア・グッツィは、バイアル内のmRNAと脂質含有量の正確性を確保するためのin vitro発現試験と力価試験の重要性を強調する。
- アッセイの問題、不純物、投与ミスなど、医薬品開発の課題。
- マリア・グッツィは、医薬品開発のためのアッセイと標準に関する課題について、外部バリデーションの欠如と標準化されていないコンペンディウムについて言及した。
- マリア・グッツィは、臨床への未知の影響や金属触媒の可能性など、脂質ナノ粒子内の化学修飾mRNAに関する問題を強調している。
- マリア・グッツィは、日本での死亡例を引き合いに出し、マデルナワクチンのステンレススチー ル粒子について懸念を表明している。
- マリア・グッツィは、カナダでの例を挙げ、ワクチン流通における大きな問題として投与ミスを取り上げた。
- ワクチン製品の品質と安全性に関する懸念。
- 発言者は、ワクチンの表示と包装の問題を強調し、エラーにつながっているとしている。
- マリア・グッツィは、ワクチン製品の品質と製造基準のばらつきについて懸念を示す。
- マリア・グッツィは、バッチ間のばらつきやスパイクタンパク質の構造に関する知識不足など、mRNAワクチンの薬理学を理解する上での課題について論じている。
トランスクリプト
マリア・グッツィ
こんにちは皆さん。私はここにいられてうれしいです。私は薬剤師の訓練を受けていますが、政府、規制当局、病院製造など、幅広い分野での経験があります。新しいmRNAワクチンが承認された時、私は自宅にいました。そして、他の医薬品の評価に通常使用しているヨーロッパ医薬品庁(EMA)のデータを確認しに行きました。これは他の誰かや何かとは独立して行ったものです。EMAのデータを確認し始めたのは、EMAのデータが完全で、よく整理されており、FDA(米国食品医薬品局)やHealth Canada(カナダ保健省)よりもデータの墨塗りが少ないため、医薬品評価に使用するのに適していると考えたからです。

すべての規制当局が共通技術文書(CTD)と呼ばれるものに基づいて作業していることに注意することが重要です。したがって、ヨーロッパ、日本、カナダ、米国のいずれにおいても、ほぼ同じ情報が得られます。国によって変わるのは、例えば、EMAは牛血清を一切求めないのに対し、カナダはすべてのフランス語表記を求めるなど、そういった大きな違いがあります。
このワクチンの評価方法はローリングレビュー方式でした。通常、製薬会社はすべてのデータをまとめてから規制当局に提出するのですが、今回はデータが出るたびに提出されました。規制当局にとってはデータを整理するのが少し大変だったようです。ニューイングランド医学雑誌の中心的な臨床試験論文は2020年11月に公開され、1ヶ月後の2020年12月にファイザーワクチンが条件付き販売承認(EUAと同等)を取得しました。EMAはこの報告書を2021年1月にウェブサイトで公開しました。さらに、機密文書の束が2021年1月にダークウェブに流出しました。私はそれを4月頃まで見ていませんでしたが、かなりの疑問点が埋まりました。
この報告書を読んで、私にとって2つの大きな警告サインがありました。このワクチンは、私が今まで見てきた医薬品製造の中で最も複雑で、非常に多くの工程があります。280の成分があり、多数の製造工場、25の異なるサプライヤー、すべて冷蔵保存が必要で、サイト間で迅速に輸送する必要があり、必ずしも同じ大陸にあるわけではありません。
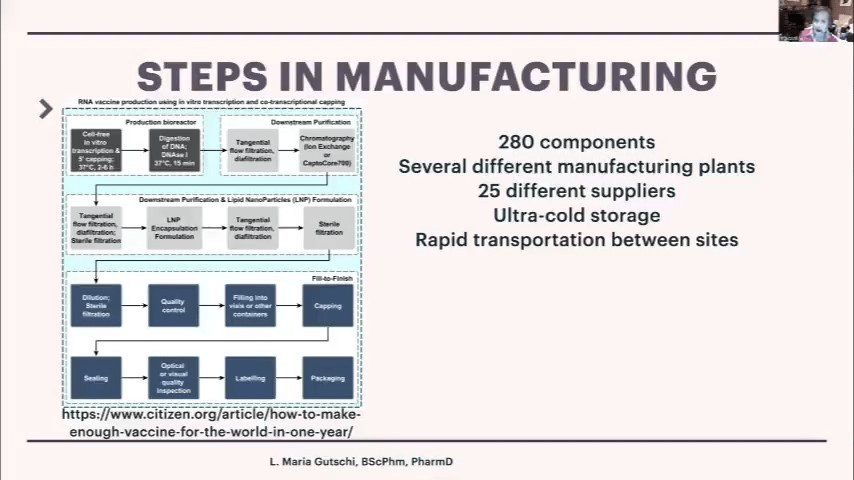
RNAワクチンの製造では、バイオリアクターの部分はかなり標準的です。無細胞系とDNA鋳型を作り、そこからmRNAを作ります。次に精製が必要ですが、これは非常に重要です。そしてLNP(脂質ナノ粒子)を作る必要があります。LNPは実際にはかなり複雑で、デリケートであり、無菌ろ過を行う必要があります。最後に、充填仕上げの複数の工程があります。充填仕上げは皆忘れがちですが、重要な部分です。実際、当初ワクチンを大量に供給するのにボトルネックになっていました。すべての工場を活性化し再稼働させる必要があったからです。生産ラインが使用されているため、現在ベビー用タイレノールなどの供給が滞っているのも、その理由の1つです。これらのラインは1日24時間、週7日、年間365日稼働しているのです。
通常、関節リウマチ治療薬のヒュミラなどの生物学的製剤は、上部の工程のみを通過し、中間の工程は通過しません。つまり、製造、ろ過、充填を行うだけで、ある国から別の国に移動する必要はないのです。
mRNAについてお話しましょう。EMAがこの製品を評価するために決定した方法は、FDAやHealth Canadaとは少し異なり、mRNAを活性薬物成分とみなし、注意深く検討するというものでした。これらのワクチンのmRNAは遺伝子操作されたものであり、ヒトのmRNAでもなければ、ウイルスのmRNAでもなく、完全に遺伝子操作されたものであることを皆さんに知っておいていただくことが重要です。
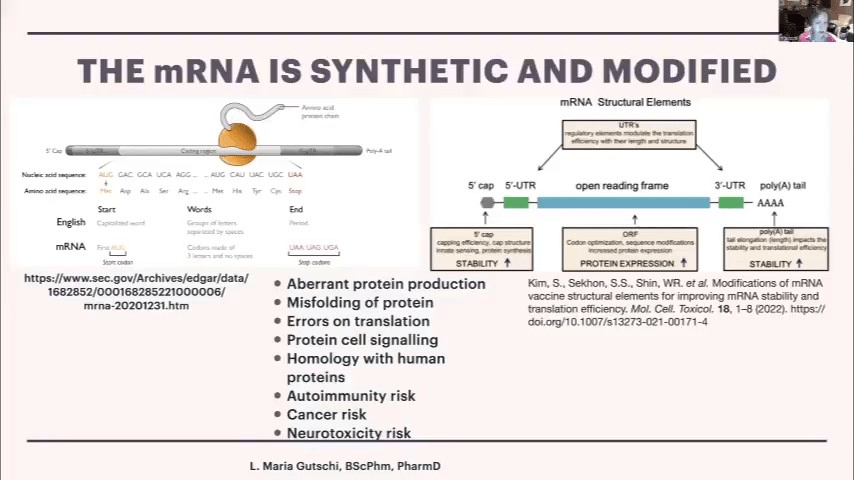
mRNAについて簡単に説明すると、mRNAが通過し、タンパク質であるアミノ酸が出てくるリボソームがあります。この場合、スパイクタンパク質ということになります。開始コドンから始まり、これは大文字の単語のようなもので、アミノ酸に翻訳されないので5’非翻訳領域と呼ばれています。次にコード領域である翻訳領域があり、ここでアミノ酸が出てきます。最後に終止コドンがあり、タンパク質の合成を停止するよう指示します。そして、安定性のためのポリAテールがあります。
遺伝子操作を行うために、科学者たちは次のようなことを行います。これには時間がかかりますが、彼らがどのようにしてこれを数日で行ったのかはわかりません。コドンは1つのアミノ酸をコードする3文字で、もしユラシルをN1-メチル-シュードウリジンに変えると、同じアミノ酸が得られますが、元のウイルスmRNAを使用した場合の100倍ものタンパク質発現が得られます。それが彼らが行ったことで、すべてのユラシルをN1-メチル-シュードウリジンに置き換えたのです。
キャッピングはそれほど悪くありませんでした。3’側については、今ではそれがヒト由来であることがわかっています。つまり、奇妙なものの遺伝子操作と、誰も何をするかわからないヒト由来の3’非翻訳領域があるということです。そして323’テールがあります。遺伝子操作を行うと、リボソームとあなたの細胞は、mRNAを新しい奇妙なアクセントのあるmRNAやコードとみなします。それで、しばしばぐらつきが生じ、それらを誤読することがあります。その結果、奇妙なタンパク質、タンパク質のミスフォールディング、翻訳エラーが生じる可能性があり、これは避けられません。忠実に翻訳されることはないでしょう。相同性があり、これは通常のタンパク質と似ているが異なるという意味で、自己免疫、先天性の問題の抑制、がんのリスク、神経毒性のリスクなどが時々起こります。このようなことは通常、遺伝子治療ではなく遺伝子操作治療と考えられる場合に調べられます。しかし、これがワクチンであるため、というよりも、この製品の使用目的が感染症対策であるため、FDA規則やEMA規則の下では、この合成遺伝子操作のためのこのような大変な作業をすべて行う必要はありません。
最終的に、私はこれをプロドラッグと呼んでいます。なぜなら、mRNAは最初の部分に過ぎず、我々が本当に見たいのは、我々のmRNAによって生成されるスパイクタンパク質だからです。ここにある写真は、141キロダルトンの重さを持つ武漢株のスパイクです。皆さんも同じような写真を見たことがあるでしょう。武漢株のスパイク、オミクロン株、デルタ株、アルファ株、BT系統、PBSで見たすべての株の写真を見たことがあると思います。私は、誰かに合成mRNAによって生成されたスパイクタンパク質の写真を公に示してもらいたいと思います。私の知る限り、私はそれを全く見つけることができません。1年半探し続けてきましたが、見つかりません。これが私にとって最大の警告サインであり、なぜそれが示されなかったのか、なぜEMAと規制当局がリボソームによって生成されたタンパク質の実際の配列を入手できなかったのか、理由になっています。それはまた、かなり大きいようです。これについてお見せしましょう。

これは医薬品規制当局としては非常に異例なことです。彼らが使用している言葉を見てみましょう。「特性評価の重大な欠陥」、「生物学的特性評価が提示されていない」、「作用機序」、「私たちはそれがどのように機能するかさえ知りません」、「容認できない」、「関連情報を更新すべき」。「mRNAの全塩基配列を明らかにすることは不可能だと言っているが、ここではスパイクタンパク質についてもう少し知る必要がある」。「それが機能していることを確認する必要がある」。これは強い言葉です。2020年11月、EMAから漏洩したデータから、非常に強い言葉が出ています。
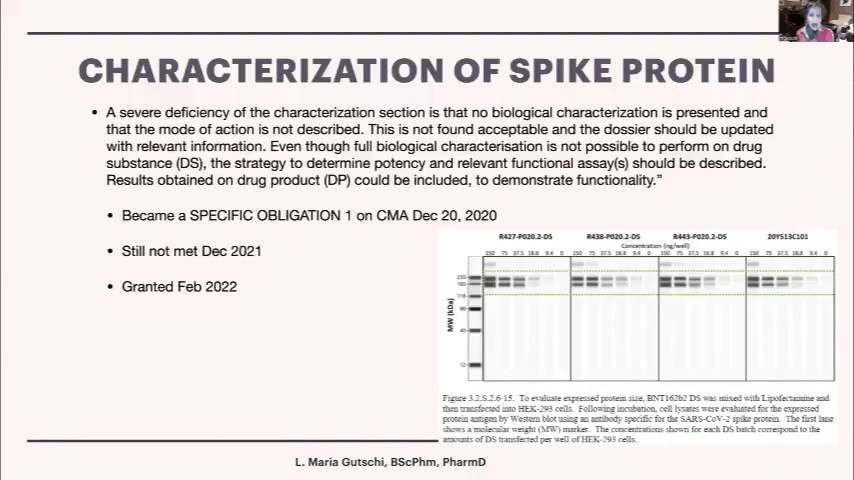
EMAは、この条件付き販売承認の一部として、「特定の義務」と呼ばれる大きな規制上の警告を発しました。そして、ファイザーに対し、「スピードアップして、7月までにこれを示す必要がある」と伝えました。7月になっても間に合わず、12月になってもまだ間に合いませんでした。2020年2月、EMAは降参し、「そうだ。おそらくそれは単に糖だけなのだろう」と言い、「理にかなっている。余分な重さはすべて糖によるものだと思う。合格だ」と言いました。私よりもっと多くのことを知っている多くの人々はこれに本当に動揺し、彼らは私に、糖を取り除いてウェスタンブロットを行い、少なくとも同じ重さであるか、ウェスタンブロット上で同じに見えるかを確認するのは簡単だと言っています。
これは、ファイザーが当初、それぞれの異なるバッチで作成したウェスタンブロットです。しかし、140キロダルトンではなく、180キロダルトン以上あることがわかります。これが私にとっての大きな未解決の問題です。私の能力の限りを尽くしても答えは出ていません。

さらに非常に奇妙なのは、実際にこれを調べたいと思うかもしれない大学からの情報が全くないことです。公開されているものは何もありません。これは私が見つけた唯一のものです。アメリカ中西部のオハイオ州にある小さな薬学部で、5000人の学生がいます。おそらくアクセスできたので、モデルナワクチンを入手したのでしょう。そして、サル、マウス胚細胞を使ってこの実験を行いました。左から右に見ていくと、これらのマウス胚細胞で、6時間後、24時間後、3日後、5日後、12日後にスパイクタンパク質の産生が始まったのがわかります。これはかなり驚くべきことだと思います。ここでサイズが約180であることがわかります。これはおそらく完全なスパイクで、他のものが多数あり、それはおそらくS1スパイクです。そして、他のものがたくさんあります。それらのタンパク質は何なのでしょうか。十分によくわかっていません。これは予備的なものです。公表されておらず、今後も公表されることはないと思います。
最も興味深いのは、モデルナとファイザーとのコミュニケーションの中で、合成mRNAの発現に関して、各社のメディカルインフォメーショングループが、トランスフェクション後48時間以上のタンパク質のダイナミクスを調べていないことを明らかにしたことです。だから、3日後、5日後、12日後に何が起こっているのかわからないのです。また、独自情報であるため、発現したタンパク質の性質に関する情報も一切開示しないとのことです。つまり、残念ですが、これは独自情報なので見せてもらえません。
遺伝子組み換えまたは合成mRNAによって生成される実際のスパイクタンパク質は、独自情報と考えられています。これは必ずしも特許と同じではありません。独自情報とは、共有すべきでない重要なビジネス情報を意味します。私はpmprb(特許医薬品価格審査委員会)で独自情報を常に扱っていました。EMAがその独自情報を見ることができない理由はありません。公開することも共有することもできません。彼らができることは、「ええ、スパイクタンパク質は大丈夫です。武漢のスパイクのようです。すべて問題ない」と言うだけです。それだけ言えばよかったのです。
彼らはそれをしていません。だから、これは私にとって大きな疑問です。もう一つ起こっていたのは、バイオンテック社は実際にこの製品の製造者ですが、これまでに市場に出た薬がなかったということです。そのため、ワクチン生産を数千回分から数百万回分に拡大しなければなりませんでした。使用していた手順を拡大する必要があり、製造や製造ラインの設定などを行ったことがある人なら誰でも、それが難しいことを知っています。

これは本当に、元のバッチは臨床試験で使用されました。RNAの純度、RNAの完全性は、目標は85%以上が完全なmRNAに対応することでした。バイオンテック社からのサンプルでさえ、85%以上ではないものがあることがわかります。目標を達成したバッチは1つだけでした。このような作業の達人であるバイオンテック社でさえ、難しさがありました。
ファイザー社は、拡大地域であるマサチューセッツ州でmRNAを製造することに決めました。マサチューセッツ州は、米国でバイオエンジニアリングを行うのに最適な場所の1つです。彼らは何をすべきかを知っています。それでも、拡大プロセスで十分に純粋なmRNAを製造するのに苦労しました。ベルギーのプールでは、さらに成功度が低くなりました。そのため、市販バッチでは完全なmRNAの純度が得られていません。このことは、EMAに多大な動揺を引き起こしました。FDAやHealth Canadaと大規模な電話会議を行い、「何をすべきか、何が起こっているのか、どうやってこれを証明するのか」と話し合いました。通常、医薬品評価や医薬品開発では、これは新しいランダム化比較試験の対象となります。なぜなら、元のものとは全く異なるように見えるからです。バイオシミラー(バイオ後続品)のようなものです。ヒュミラのジェネリック医薬品を作る場合、臨床試験を行わなければなりません。同じだと言うだけではだめなのです。それが明らかに行われませんでした。なぜそれが行われなかったのかという大きな疑問もあります。しかし、EMAのデータは、彼らが非常に、非常に、非常に動揺していたことを示しています。
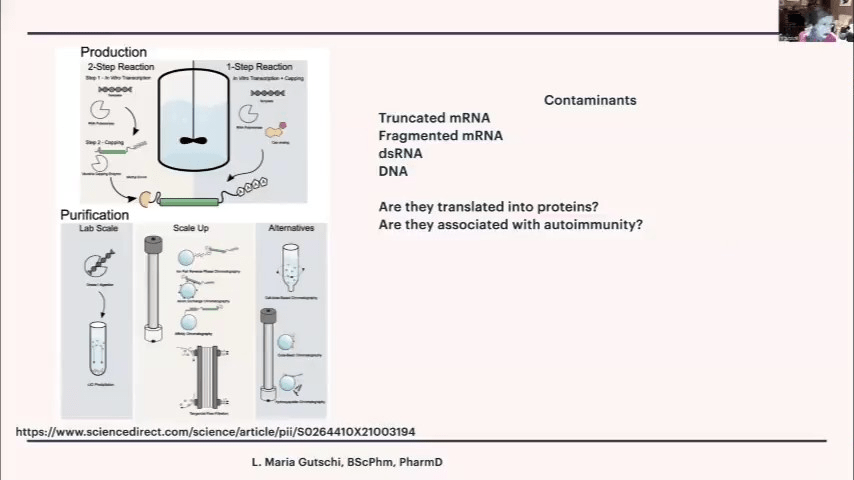
生産がなぜそれほど異なるのかについて、もう一つの具体的な義務、規制上の警告をお伝えしましょう。左側は、比較的純粋なmRNAが得られた小さなバッチのための2段階の反応です。最初にキャッピングとポリAテールの付加を行い、次に多数のろ過と精製を行います。沈殿、塩化リチウム沈殿、最後に磁気ビーズを使用します。磁気ビーズはすべてのmRNAに付着し、ただ吸い取るだけで、きれいになり、比較的良好な製品が得られます。
拡大では、巨大なバッグを使用しています。38リットルから900リットルまで作っています。誰かが想像できるでしょうか。900リットルのバイオバッグの中で、大腸菌がこのmRNAをすべて作り出しているのです。そして同時に、キャッピングアナログを行い、うまくmRNAに付着することを期待しています。そして、一連のろ過を行います。これを行うだけで、かなりの数のろ過が必要であり、他の方法と同じ品質を得ることは難しいことがわかります。
では、完全なmRNAでないとしたら、そこに何が入っているのでしょうか。切り詰められたmRNA、つまりmRNAの一部で、おそらくポリAテールが付いているもの、ポリAテールを持たない断片化したmRNA、二本鎖RNAは本来あってはならないものです。
できるだけ取り除こうとしましたが、大腸菌から残ったDNAとテンプレートから残ったDNAがあります。EMAは、これらの切り詰められた断片化したmRNAの一部がタンパク質に翻訳され、自己免疫に関連している可能性があることを非常に懸念していました。
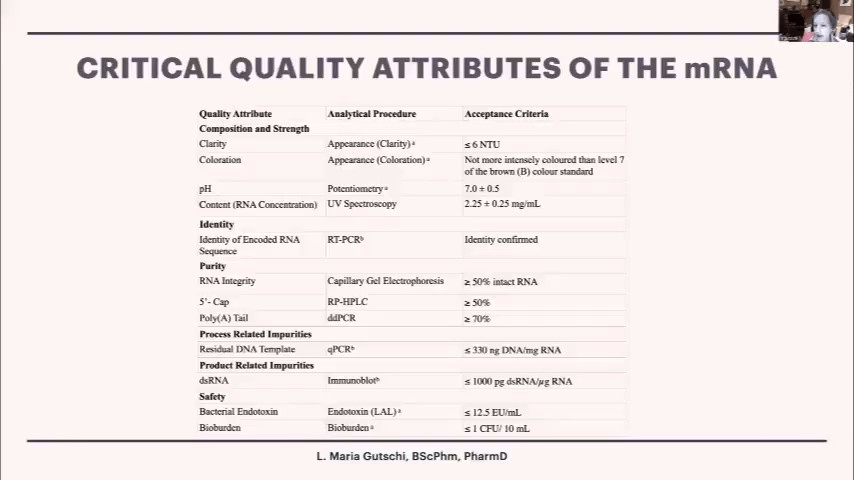
ファイザーからの回答を求めましたが、それは行われませんでした。mRNAワクチンの製造工程では、mRNAの品質基準として、製造工程の最終段階で少なくとも50%のmRNAが無傷であること、50%の5’キャップ(mRNAの翻訳開始位置を指定する)が存在すること、70%のポリAテール(mRNAを安定化させる)が存在することが求められています。
二本鎖RNAやDNAの含有量についても基準値が設けられていますが、一般的な医薬品の基準値と比べて高いのか低いのかは私にはわかりません。mRNAワクチンには防腐剤を含めることができないため、できるだけ無菌的に製造する必要があります。また、大腸菌で培養しているため、大腸菌の細胞壁が混入しないよう注意が必要です。
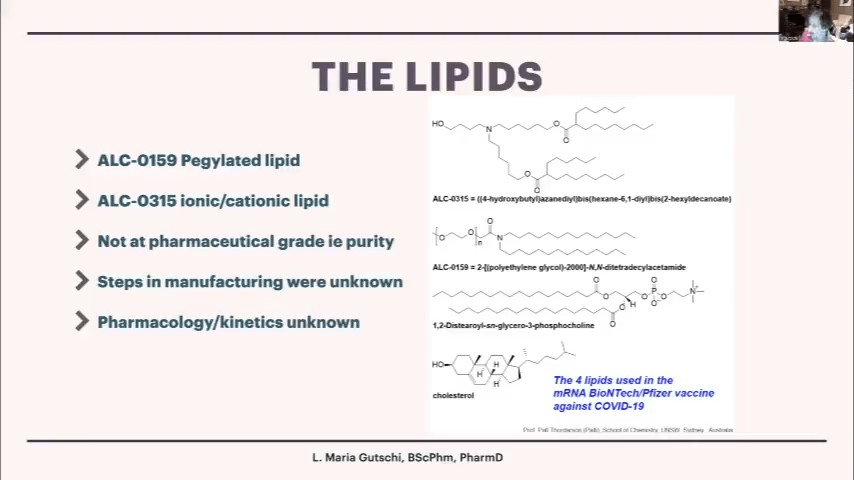
脂質については、ALC-0159とALC-0315は以前にヒトでの使用例がなく、通常であれば毒性や薬物動態の検討が必要とされるはずです。また、これらの脂質は医薬品グレードの純度ではなく、精製工程を経る必要がありました。個々の脂質の薬理学的特性や体内動態については不明な点が多くあります。
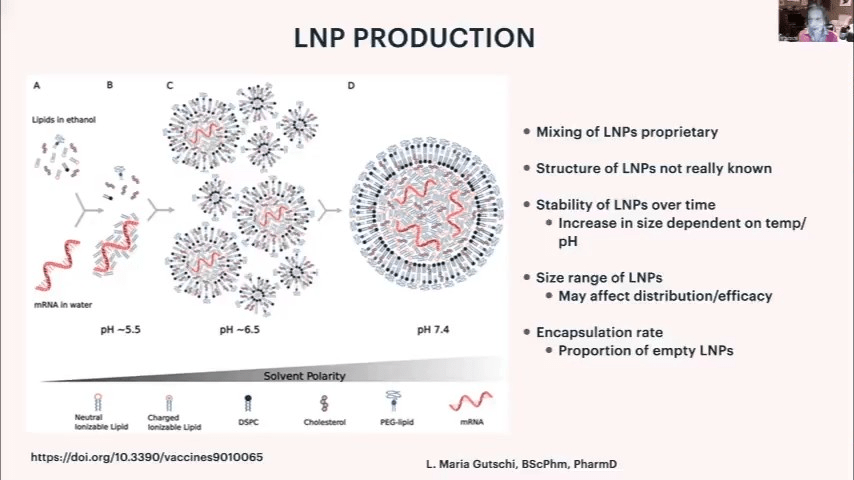
脂質ナノ粒子(LNP)の製造については、当初は世界で20人程度しか製造方法を知らず、特殊な機械を使用するため、多くの人材の育成が必要でした。LNPの製造方法はノウハウに属し、ファイザーやモデルナも詳細を把握していません。
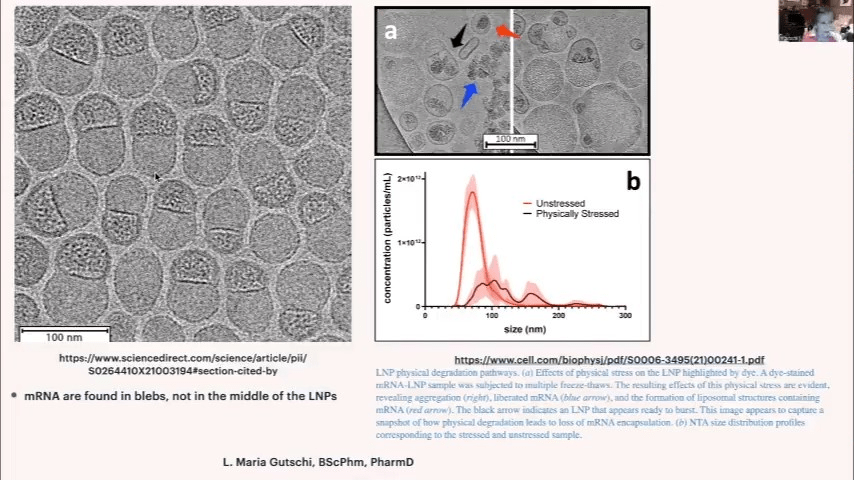
LNPの形状は、一般的に考えられているような真円ではなく、mRNAを内包した不定形の粒子です。mRNAを内包しないLNPも存在し、カプセル化率は現在80%程度とのことです。LNPは経時的に凝集しやすく、特にpHや温度の変化、物理的ストレスにより凝集が促進されます。
脂質に関しては、薬物相互作用、特に向精神薬との相互作用が懸念されています。また、肝移植後の薬物動態への影響も不明です。LNPを構成する個々の脂質の代謝・排泄についても検討が必要です。LNPの体内動態を予測するために、別の医薬品であるオンパットロ(肝臓の遺伝性疾患治療薬)のデータが利用されましたが、これは前例のない手法です。
製造工程の後期で、高感度の分析法を用いることで初めて検出された「遅延移動種」と呼ばれる成分が確認されました。これは、mRNAが脂質により化学修飾を受けたものと考えられ、本来あってはならないものです。臨床的な影響は不明ですが、懸念すべき問題だと考えます。
ロット間のばらつきについては、当初は基準範囲が広く設定されていましたが、バイアルごとの品質もばらつきがあります。凝集物や変色が見られた場合は使用を中止する必要があります。
モデルナ社のワクチンからステンレス片が検出され、日本で2〜3名が接種後に死亡した事例がありました。医薬品としては許容できないレベルの異物混入であり、なぜ出荷されたのか理解に苦しみます。コールドチェーンの問題よりも、投与時のエラーの方がより大きな問題だと考えます。ラベルのデザインが紛らわしく、添付文書の記載ミスもあり、現場での取り違えが起こりやすい状況です。
以上をまとめると、mRNAワクチンは品質管理の面で問題が多く、GMP(Good Manufacturing Practice、医薬品の製造管理および品質管理に関する基準)を満たしていないと考えられます。ロット間、バイアル間のばらつきも大きく、基本的な薬学的情報も不足しています。これらの問題が解決されない限り、安定的に高品質の製品を供給することは難しいでしょう。

さらに、ワクチンに対する個人の反応のばらつきは、ワクチン自体のばらつきよりも大きい可能性があります。LNPのサイズ分布、カプセル化率、安定性などの物理化学的特性や、体内動態、mRNAの発現効率、スパイクタンパク質の性状などが個人差に影響を与えていると考えられます。同じロットのワクチンを接種しても、副反応の有無や重症度には個人差があり、現時点ではその要因を特定することは困難です。ただし、製造工程の改善により、ロット間のばらつきは以前よりは小さくなっていると考えられます。
その問題は深刻だと思います。その後は、充填・仕上げ、品質管理、ラベリング、目視検査、包装などの工程があり、そこでもさまざまな問題が起こり得ます。最終的には、各バイアル・ロットが品質管理の基準を満たしているかが確認されます。
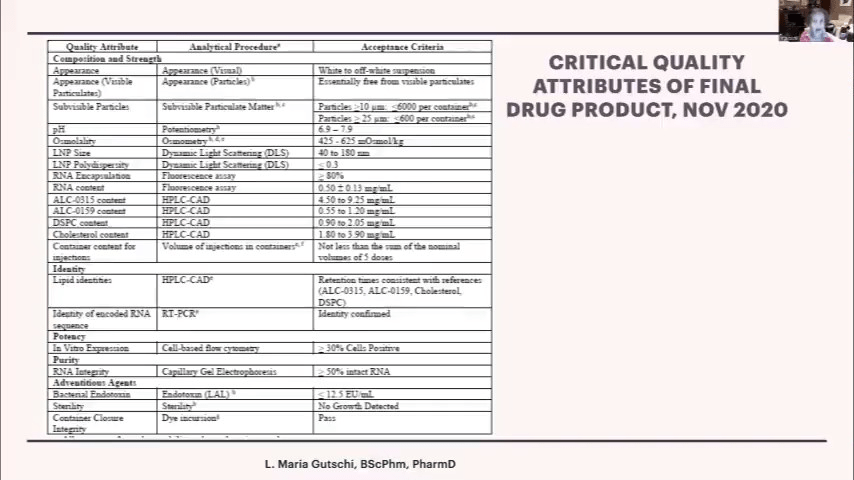
分析手順の中で特に重要なのが、ワクチンの力価(ポテンシー)またはin vitro発現効率の評価です。ファイザー社とEMAの間で、実際のmRNAと脂質からなるバイアル内の製剤の力価をどのように測定するかについて、議論がありました。最終的に、私にはよくわからないのですが、ある種のアッセイ系を用いて、30%以上の細胞で発現が見られることを基準とすることになったようです。ただし、このアッセイでは、すべての細胞がmRNAを発現するわけではないことに注意が必要です。
アッセイの話に戻りますが、バイオンテック社は以前に医薬品の上市経験がなかったため、すべての分析法がインハウスで行われていました。つまり、「これが我々のやり方であり、これが我々のテスト方法だ」というわけです。これに対してEMAは、「君らは正気か?そんなものは認められない。すべての分析法を外部機関によってバリデーションしなければならない」と言いました。その結果、EMAまたは条件付き販売承認を取得する際には、すべての分析法が外部機関によってバリデーションされ、適切な項目を測定していること、分析法が意図したとおりに機能することが確認されていました。

分析を行う際には、適切な方法で実施し、手順を遵守することが重要です。しかし、この薬剤については、USP(United States Pharmacopeia、米国薬局方)のような公定書に基づく品質基準がありませんでした。私が抗がん剤を調製する際には、常にUSPに従う必要がありました。
条件付き販売承認の段階では、「遅延移動種」と呼ばれる成分が、高感度の分析法を用いることにより初めて検出されました。これは、LNP内部で起こっていることの一部です。mRNAの核酸の一部が、カチオン性脂質により化学修飾を受けていたのです。本来、このようなことがあってはなりません。mRNAが分解されてしまうことを意味するからです。
分解されたmRNAが体内に入った場合、どのような影響があるのでしょうか。臨床的な影響は不明です。また、カチオン性脂質がDNAに対しても同様の作用をするのか、どの程度の頻度で起こるのかもわかっていません。
この現象は、脂質中に金属が存在する場合にのみ起こるため、金属が触媒として働くと考えられています。そのため、脂質の純度を高めるための努力が続けられており、ある程度の改善は見られるようです。しかし、事前にこの問題を把握できていなかったことは、私としては非常に憂慮すべき点だと思います。
ロット間のばらつきについては、条件付き販売承認の段階では基準の範囲が広く設定されていましたが、バイアルごとにも品質の違いがあります。凝集や変色が見られることもあるのです。私はファイザー社の添付文書(患者向けではなく、薬剤師向けのもの)を確認しましたが、そこには凝集や変色が見られた場合は使用を中止するよう記載されていました。

私たちは日常的にこのようなチェックを行っているでしょうか。そもそも、なぜ凝集が起こるのでしょうか。本来あってはならないことです。EMAもこの点を問題視しており、LNPの品質に問題があることを示唆していました。
モデルナ社のワクチンからステンレス片が検出された件については、私は衝撃を受けました。これがどれほど深刻な問題なのか、皆さんはご存知でしょうか。日本で肉眼で確認できるようなステンレス片が見つかり、モデルナ社のワクチンを接種した2〜3名が死亡したのです。ステンレス片が原因かどうかはわかりませんが、そもそもなぜ工場から出荷されたのでしょうか。
私は病院薬剤部の責任者を務めた経験がありますが、新しいクリーンルームを設置し、スタッフを教育し、抗がん剤の調製基準を設けました。もし抗がん剤にステンレス片のような異物が混入していたら、免許は取り消され、二度と仕事はできなくなるでしょう。それほど重大な問題なのです。
スペインの充填工場で、このようなことが起こっていたことを知らなかったと言い、わざと出荷したのは信じがたいことです。
コールドチェーンの問題については、皆さん懸念されているようですが、私はそれほど問題視していません。LNPは、コールドチェーンが適切に管理されているかどうかにかかわらず、問題を抱えているからです。
私が考える最も深刻な問題は、カナダのCCAでもあまり議論されていない投与エラーです。投与量の間違い、再構成の間違い、投与方法の間違いなど、さまざまなエラーが起こっています。薬剤師としては、患者の安全を最優先に考え、エラーを防ぐためのシステムアプローチを心がけています。
皆さん、これをよく見てください。ここに示したのは、モデルナ社のバイアルのラベルです。左側の2つのラベルを見て、どちらが多価ワクチンでどちらが単価ワクチンなのか、遠目で判別できるでしょうか。違いは、片方が灰色のストライプ、もう片方が紫のストライプになっているだけです。また、「BA.4/5」という表示が小さすぎて、一つ一つ読まなければわかりません。誰もがそんなことはしないでしょう。
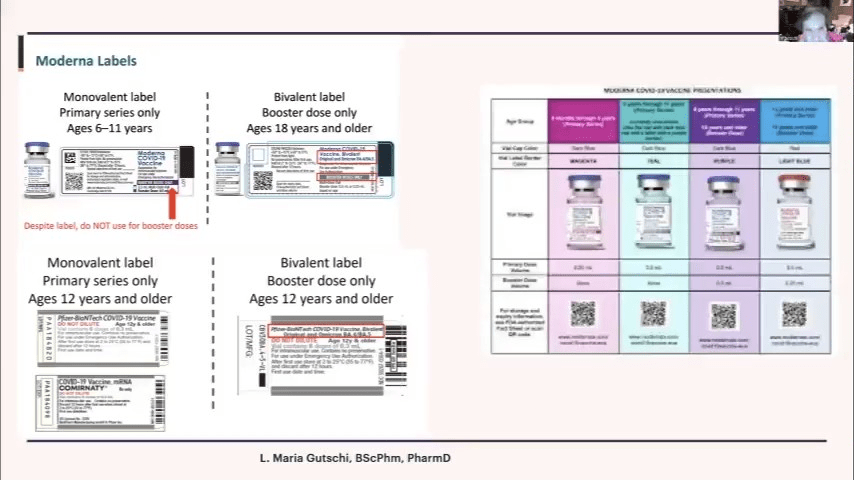
モデルナ社の単価ワクチンのラベルには、「6〜11歳の小児に対する初回接種シリーズ用」と書かれていますが、「追加接種用」とも書かれています。これは間違いで、追加接種用ではありません。それなのに、モデルナ社はこのラベルを使用して出荷したのです。信じられないことです。
ファイザー社のバイアルを見ると、すべて灰色です。一体どうやって見分けろというのでしょうか。私たちは、キャップの色を変えたり、ラベルの色を変えたりして、一目で見分けられるようにしています。ここに、バイオンテック社の多価ワクチンのラベルがありますが、「多価」の表示が小さすぎて読めません。本当に驚くべきことです。このような状況では、エラーが多発するのも当然です。
もし私の病院だったら、一つ一つのバイアルに識別用のタグを付け、停止標識のようなマークを付けたバッグに入れ、取り違えないように別の場所に保管するでしょう。取り違えは必ず起こるからです。
まとめると、私の見解では、このワクチン製品は品質が悪く、不純物が混入していると考えられます。化学・製造・管理の面で、規制当局の対応は不十分でした。GMP基準を満たしていない点が多数あります。ロット間のばらつきだけでなく、バイアル間のばらつきもあります。これは製造基準の問題であり、基本的な薬学的情報が不足していることや、これまでに明らかになったエラーを考えると、ワクチンを回収して製造方法を見直すべきだと思います。

個人的には、現在の製品ラインでは、安定的に高品質の製品を供給することは難しいのではないかと考えています。ワクチンに対する個人の反応のばらつきは、ワクチン自体のばらつきよりも大きい可能性があることを指摘しておきたいと思います。私はこの点について検討を進めているところです。
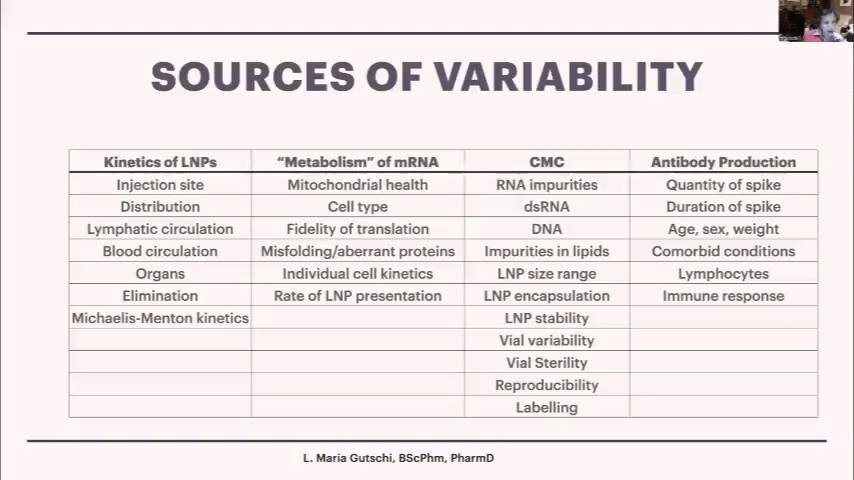
スライドの中央にあるCMCは、Chemistry, Manufacturing and Control(化学・製造・管理)の略です。LNPのサイズ分布、カプセル化率(カプセル化率が50%しかない場合、十分なmRNA量が得られない)、安定性の問題、バイアルの再現性やラベルの問題など、さまざまなばらつきの要因があります。
しかし、LNPの体内動態(薬物動態)も重要です。体内動態とは、体内で薬物がどのように振る舞うかを示すものです。スライドの1〜3列目は、この製品の薬理学的な側面を示しており、最後の列はワクチンとしての側面、すなわち抗体産生の部分を表しています。後者についてはある程度研究が進んでいると思います。
LNPの体内動態については、ほとんどわかっていません。リンパ球や血液循環にどの程度分布するのか、肝臓に取り込まれた後に再び放出されるのかなど、詳細は不明です。私の考えでは、後者のような動態を示すのではないかと推測しています。
LNPがどこで排泄されるのかについても、よくわかっていません。腎臓で排泄されるとすれば、脂質はより水溶性の高い物質に変換される必要があります。EMAの資料によると、この過程には長い時間がかかるようです。
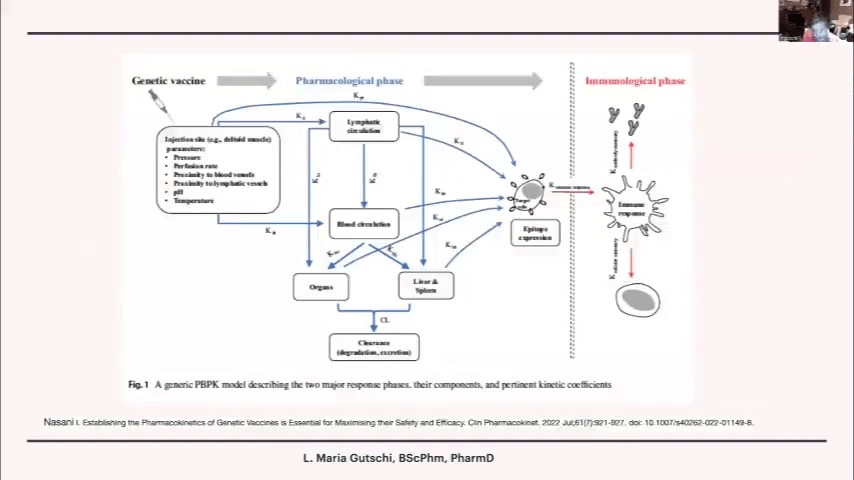
LNPは天然由来の製剤であるため、従来の薬物動態(一次速度論または非常に複雑な動態)に従うとは考えにくいです。mRNAについても、ほとんど何もわかっていません。標的となる細胞種は何か、翻訳の忠実性はどうか、誤った折りたたみや異常なタンパク質が生成されないか、細胞ごとに発現が異なるのか、LNPを大量に与えた場合に変化が起こるのかなど、基本的な薬理学的情報が不足しています。
バイアルごとのばらつきやロット間のばらつきについては、EMAとFDAの尽力により、特にLNPの製造工程については改善が見られるようです。しかし、異常な切断や断片化が起こったmRNAの問題は依然として残されており、その量についても不明です。生成されるスパイクタンパク質の性状も、まだわかっていません。

体内動態について興味のある方は、私に直接相談してください。
結局のところ、ワクチンの効果は賭けのようなものだと思います。1回接種しても、中等度〜重度の副反応が出ないこともあれば、出ることもあり、予測できません。同じバイアルのワクチンを接種した夫婦でも、片方は3日間具合が悪くなり、もう片方は何ともないということがあります。つまり、個人差が非常に大きいのです。
以上が私の講演の要約ですが、近日中にCCAのウェブサイトに掲載される予定です。

