Contents
Keep out! SARS-CoV-2 entry inhibitors: their role and utility as COVID-19 therapeutics
www.ncbi.nlm.nih.gov/pmc/articles/PMC8301738/
オンラインで2021年7月23日公開
Lennox Chitsike, Penelope Duerksen-Hughescorresponding author
要旨
COVID-19パンデミックは、医療インフラや社会・経済生活にかつてないほどの負担を強いている。パンデミックを終息させ、死亡率や社会的・経済的生活への影響を大幅に軽減するためには、効果的な解決策が必要である。効果的で広く利用可能なワクチンは、パンデミックを終わらせるための最善の方法であると考えられていた。実際、現在、いくつかの効果的なワクチンが利用可能になっており、この目標達成に向けてすでに大きく前進している。
それにもかかわらず、現在のワクチンが効きにくい突然変異を持つ新たなSARS-CoV-2の亜種が登場したことで、懸念が高まっている。さらに、ワクチンの摂取を望まない、あるいは摂取できない人もいる。世界中の保健担当者が集団免疫を獲得するためにワクチン接種に奔走している中、上述のような課題があることから、COVID-19治療薬はワクチンと並行して使用する必要があると考えられる。
ここでは、中和抗体が初期または軽度のCOVID-19患者に与えた影響と、COVID-19の早期管理に中和抗体が承認されたことが、同様の作用機序を持つ他のウイルス侵入阻害剤にとってどのような意味を持つのかを説明する。また、多価抗体、組換えACE2,ミニプロテインなどの様々なウイルス侵入阻害剤を用いた治療戦略は、曝露前の予防だけでなく、SARS-CoV-2の抗原ドリフトや将来の人獣共通感染症であるサルベコウイルスからの保護にも有効であることを示す研究にも注目している。
キーワード
SARS-CoV-2,COVID-19,ウイルス侵入阻害剤、抗体、SARS-CoV-2亜種、予防、新興サルベコウイルス
はじめに
新型コロナウイルスSARS-CoV-2による疾患「COVID-19」は 2019年末に発症して間もなく、パンデミックおよび世界的な緊急事態として宣言された。今日の時点で、この病気は約300万人の命を奪い、世界に何兆ドルもの損害を与えている[1, 2]。大多数の人がこの病気から回復し、軽度または全く症状が出ないにもかかわらず、このウイルスの病原性と伝達性は、インフルエンザによる季節性インフルエンザのような他の進行中のウイルス性疾患で見られるよりも高い死亡率の負担をCOVID-19に付与している[3, 4]。この致死率とウイルスの新規性を考慮すると、COVID-19を取り巻く科学は急速に発展している分野と言える。治療法の開発と検証には、科学的評価の厳格さと、パンデミックの猛威を抑えるための治療法開発の迅速さとの間で、微妙なバランスが求められている。科学界はSARS-CoV-2の性質を解明し続けているが、SARS-CoV-2と感染の結果については、SARS-CoV-2が発見された当初よりもはるかに多くのことがわかっている[5-7]。
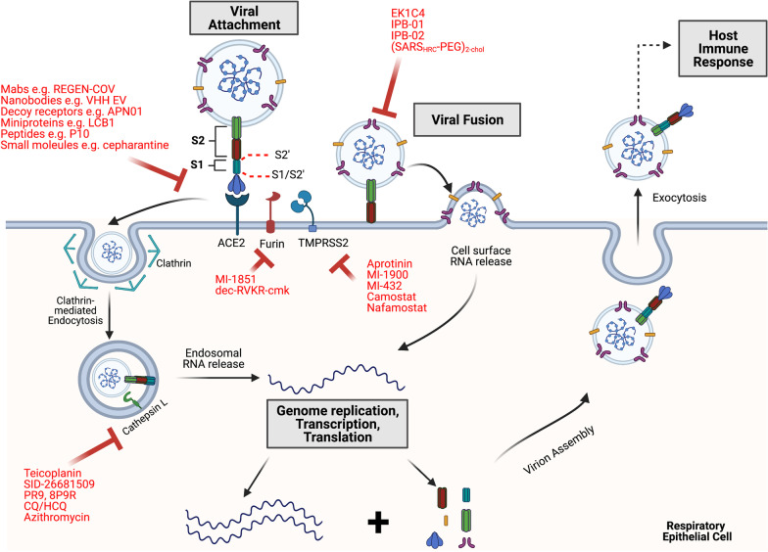
SARS-CoV-2は、ベータコロナウイルス属属のエンベロープ型、ポジティブセンスの一本鎖RNAである[6, 7]。主な侵入口は鼻腔で、曝露後にそこから感染が始まる[8-10]。具体的には,ウイルスのスパイク(S)糖タンパク質が,アンジオテンシン変換酵素2(ACE2)として知られる細胞内受容体に結合することで,ウイルスは鼻腔上皮細胞に侵入する。結合後、ウイルスはエンドサイトーシスまたは細胞表面の膜との融合によって細胞内に侵入する。ウイルスは細胞質にゲノムを放出した後、宿主の翻訳機構を乗っ取り、大きなポリプロテインの生成を指示する。このポリプロテインからは、RNA依存性のRNAポリメラーゼやヘリカーゼなどの必須タンパク質がウイルスのタンパク質分解による切断を経て作られる。複製タンパク質は、付属タンパク質や構造タンパク質を合成するための鋳型となるゲノムRNAやサブゲノムRNAを生成する[3, 7, 11]。ゲノムRNAとタンパク質が組み合わされてビリオンとなり、エキソサイトーシスによって細胞の外に出て、新しい細胞に感染する(図1)。その後、ウイルスは誤嚥や気道の細胞への感染を通じて、下気道系に広がる可能性がある[3, 7-10]。自然免疫と適応免疫のバランスのとれた免疫反応により、ウイルスの増殖は管理され、ほとんどが上気道に限定され、その結果、患者の大部分に軽度の症状が観察される[12, 13]。
図1 SARS-CoV-2のライフサイクルとウイルス侵入の阻害因子の概要
SARS-CoV-2は、まず細胞表面のACE2に結合し、エンドサイトーシスやカテプシンの活性化を受けてエンドソームから、あるいはフーリンやTMPRSS2などのプロテアーゼによるS活性化を受けて細胞表面膜から直接、RNAを細胞質に放出する。細胞質では、(+)ゲノムRNAがORF1a/bから直接翻訳され、複合レプリカーゼ装置の非構造タンパク質(RdRpなど)を含むポリタンパク質に変換される。(-)センスRNAが合成され、(+)センスゲノムRNAやサブゲノムRNAの鋳型となり、そこから構造タンパク質やアクセサリータンパク質が作られる。これらのタンパク質とゲノムRNAは、新しいビリオンを組み立てるために利用され、エキソサイトーシスによって細胞の外に出ていく。ウイルスと感染した細胞の死は、宿主の免疫反応を引き起こす。ここで示した各侵入段階において、ハイライトされたウイルス侵入チェックポイント(細胞受容体、酵素、ウイルスタンパク質を含む)をそれぞれ阻害する多くの候補(赤色で表示)が、プレ臨床、臨床、またはその両方で感染症に対する有効性を示している。(図はBiorenderを使用している。)
しかし、一部の人はその後、より重篤な症状を発症する。これは、ウイルスによる免疫回避がうまくいったことや、免疫系の反応が遅れたり損なわれたりしたことが原因であると考えられている[9, 12, 13]。SARS-CoV-2を制御するには、自然免疫、B細胞、CD4+ T細胞、CD8+ T細胞が関与するバランスの取れた反応が必要であることが示されている[12]。このバランスのとれた反応がない場合、ウイルスは最終的に肺のガス交換ユニットに到達し、II型肺胞細胞に感染する[9]。初期の免疫反応が弱まると、ウイルスが複製され、新しい細胞に広がっていく。感染した細胞はアポトーシスを起こして死滅し、その死は肺胞の損傷だけでなく、IL-6,IFN-γ、IL-8,TNF-α、IL-1βなどの炎症性サイトカインの過剰な産生を引き起こす[3, 9, 11, 14, 15]。宿主細胞によるこれらのサイトカインの放出(サイトカイン・ストームとも呼ばれる)は、抗ウイルス免疫反応をさらに歪め、通常、単球や好中球などの免疫細胞の動員と同時に起こる[12, 16]。これらの事象が相互に作用することで、重症の場合は悪循環に陥り、血管伝染性の亢進、肺水腫、急性呼吸窮迫症候群(ARDS)多臓器不全、死亡などの合併症を引き起こす可能性がある[3, 11, 15]。
SARS-CoV-2とCOVID-19の臨床的進行パターンに関するこれらの新しい概念は、いくつかの問題を明らかにした。例えば、COVID-19の病態には2つの段階があり、この病気の治療には2つの異なる戦略が必要であることがわかっている。具体的には、COVID-19の初期段階では、ウイルスの増殖と伝播が疾患の進行や治癒を促す主な要因となる。後期になると、宿主による炎症反応が、ウイルスの増殖よりもはるかに重要になる[11, 17]。このような理解は、現在のCOVID-19の治療法にも反映されている。軽度から中等度のCOVID-19と早期に診断されたが、併存疾患やその他の要因により入院のリスクがある外来患者の治療には、後述するように、中和する抗SARS-CoV-2モノクローナル抗体の投与がよく行われる。しかし、入院している患者には、補助酸素や人工呼吸が必要かどうかに応じて、レデムセビル、デキサマゾン、バリチニブ、またはこれらからなるコンビナトリアルレジメンを投与することがある[18]。重要なことは、感染の初期段階でウイルスを標的とすることで、迅速なウイルス検査から大きな利益を得ることができるということである。これは、宿主を介した免疫反応が亢進して、肺炎、ARDS、多臓器不全、高凝固などの致命的な合併症を引き起こす前に、迅速な診断によって治療の機会を捉えることができるからである[19]。このようなCOVID-19の早期治療は、病気の回復率を短縮し、入院を防ぎ、COVID-19を管理するためのより費用対効果の高い方法となる[11, 17]。これまでのところ、モノクローナル抗体はCOVID-19の早期管理に承認されている。これらの研究では、有意な中和力と有効性が示されており、少なくとも初期段階では、ウイルスの侵入を標的とすることがCOVID-19の治療に有効であることが証明されている[18, 20]。しかし、これらの有望な結果は、他のタイプの侵入阻害剤の可能性を十分に考慮したものではなかった。このパンデミックをワクチンで終息させるという使命が、変異型の増加により新たな課題に直面している中、これらの他の潜在的治療薬がどのようにこれらの問題を軽減するのに役立つのかという新たな疑問が生まれている。
この総説では、臨床使用のための抗SARS-CoV-2中和モノクローナル抗体の開発と、軽度から中等度のCOVID-19の早期管理に与えた影響についてまとめている。これらのコンセプトは、現在利用可能なワクチンが新たなSARS-CoV-2亜種の増加により課題となっていることを示す新たな証拠との関連で議論されている。また、SARS-CoV-2の変異体に対応するために抗体が直面している課題を明らかにし、他の多くの進入阻害候補とともに、どのようにしてこれらの課題を克服できるかを説明する。最後に、侵入阻害剤の予防薬としての可能性と、新たなSARS-CoV-2系統や将来のコロナウイルスの発生に対して果たすことのできる役割について議論し、評価する。
ウイルス進入阻害剤とその翻訳上の関連性
SARS-CoV-2に対するいくつかの有効なワクチンが利用できるようになったことで、世界中の何十億人もの人々に希望が与えられた[21, 22]。パンデミックが始まって以来、ワクチン接種は、COVID-19に対処するための長期的かつ最も持続可能な解決策として適切に見なされていた。そのため、現在利用可能なワクチンが、臨床試験において体液性免疫と細胞性免疫の両方を誘導し、被接種者を実質的に保護することが示されているのは心強いことである[12, 23]。ワクチンが世界中で継続的に展開されるのと同時に、より多くの人々が感染や病気からの回復によって保護免疫を獲得することになる。とはいえ、ワクチンが入手可能になったからといって、利用可能な治療法や、より効果的な新しい治療法の開発の必要性がなくなるわけではないことに注意することが重要だ。まず、利用可能なワクチンは、まだ感染していない人には効果があるが、すでに感染している人には効果がない。第二に、十分なワクチン接種率を達成するための課題がある。専門家によると、COVID-19に関連する入院や死亡からアメリカ国民を十分に守るためには、約80~85%のワクチン接種率が必要だと言われている[24-26]。特に現在のワクチンの中には2回接種が推奨されているものもあるため、集団免疫を獲得したり、この病気を根絶したりするのに十分な人数にワクチンを接種するには時間がかかる。さらに、WHOによると、世界のワクチンの配分は不公平で、高所得国と高中所得国は開発途上国に比べて利用可能なワクチンの大部分を受け取っている。今後もワクチンへのアクセスを公平にするためには、WHOが開発したCOVAXのような、発展途上国へのワクチン提供を目的としたイニシアチブが必要である [27-30]。もう一つの問題は、ワクチンを摂取できない免疫不全患者や、ワクチンを躊躇して接種を延期することを選択する人々など、アクセスが与えられてもワクチンを接種しない人々から生じるものである。最近の報告によると、アメリカ人のかなりの部分がワクチンを受けたくないと考えており、ヤンセン社とアストラゼネカ社のワクチンの最近の一時停止は、このためらいを悪化させ、集団免疫に到達する計画を狂わせる可能性がある[24, 31-33]。ワクチンを接種していない集団は、必然的に「より適した」ウイルス種が進化・出現するための貯蔵庫・工場となり、病気との戦いや根絶に向けた努力が損なわれる可能性がある。
おそらく最も懸念されるのは、ワクチンによって誘導される抗体による中和に対する感受性が低下した新しい亜種の出現であり、これらの亜種は現在のワクチンの防御効果に対する最大の脅威となっている。本稿執筆時点で、世界には、Alpha(B.1.1.7)Beta(B.1.351)Gamma(P.1)Delta(B.1.617.2)という4つの主要な懸念される変種(VOC)が存在する。さらに、Lambda(C.37)などの注目すべき変異体が現在調査中である[34-36]。重要なのは、VOC のベータ、ガンマ、デルタにはスパイクタンパクに E484K や L452R といった変異があり、これが高い病原性、再感染率、ファイザーやモデルナなどの主要なワクチンを接種した人の血清に対する耐性をもたらしていることである[36-45]。最近、WHOやEurosurveillanceの報告書によると、前述のVOCはその起源から世界の何百もの国に広がっており、SARS-CoV-2の原型を凌ぐ新規感染源として急速に普及している例もある[36, 46, 47]。このような新しい株の出現は、将来、より致命的なウイルス性疾患が発生するのではないかという懸念を引き起こす。
そのため、これらのワクチンに加えて、新たな治療戦略が早急に必要とされている。COVID-19を対象とした初期のトランスレーショナルリサーチでは、主に重症患者の治療法を特定することに重点が置かれており、入院中の患者を対象に抗ウイルス剤や免疫調整剤を試験するいくつかのドラッグ・リパーパス・キャンペーンが行われていたことからもわかる。試験された抗ウイルス剤の多くは、翻訳やRNA複製など、ウイルスのライフサイクルにおけるより高度なチェックポイントを標的としていた。レデムシビルは、これらの研究から生まれた薬剤のひとつで、現在、酸素吸入を必要とする入院患者の治療に使用されている[48-50]。しかし、入院していないCOVID-19患者を早期に治療することで、予後が改善することもわかっていた。このことは、早期管理のための治療法をより多く特定することの重要性を強調している。さらに、医療介入なしで最終的に回復した外来患者の中には、疲労、味覚や嗅覚の喪失、さらには認知障害や心肺機能障害などの長期的な影響を受ける人もいる[19, 51]。このような患者はレムデシビル治療の対象外であり、このような人々のための治療法を開発することで、回復と生活の質を改善できる可能性がある。抗体やその他のウイルス侵入阻害剤は、入院を最小限に抑え、慢性的な晩期障害を予防し、感染期間を短縮して死亡率を下げることで感染拡大を遅らせることができる可能性があるため、これらの懸念に対処するための適切な候補となる。ワクチンは新規感染の防止に役立つが、侵入阻害剤は、ワクチンを接種していない集団やワクチンを接種してもブレイクスルー感染症を発症するCOVID-19と戦うことで、これらの利益を補完する。さらに、抗体カクテルやその他のウイルス進入阻害剤の使用は、新しい亜種や他のコロナウイルスのクレードに対抗する可能性も示している。以下では、抗体や、組換えヒト可溶性ACE2,ミニプロテイン、ペプチド、低分子などの代替的な侵入阻害剤を用いて、SARS-CoV-2の侵入を阻害する可能性について述べる。
スパイク、ACE2,およびそれらの相互作用を標的とする
SARS-CoV-2 Spikeは,ウイルス膜の表面に存在するホモ三量体のタンパク質である[52, 53]。各単量体は,N末端とC末端にそれぞれ配置された2つのサブユニット,S1とS2から構成される。S1は,N末端ドメイン(NTD)と受容体結合ドメイン(RBD)からなる。RBDの中には,受容体結合モチーフ(RBM)と呼ばれるサブドメインがある[54, 55]。ウイルスは、S1のRBDとACE2が直接接触することで、ACE2を発現している標的細胞と最初に接触する[56]。この受容体の結合とウイルスの付着は,ウイルスが細胞内に侵入する最初のステップであり,したがって魅力的な治療標的となる(図1)。次のステップでは、細胞膜との融合が起こり、ウイルスゲノムの細胞質への放出が促進されるが、これを仲介するのがS2サブユニットである。S2は、融合ペプチド(FP)2つのα-ヘリカルなヘプタッドリピート(HR1とHR2)ループ領域、膜貫通ドメイン(TM)細胞質尾部(CT)から構成されている。ACE2がS1に結合すると,FPが宿主細胞膜に挿入されるような構造変化と処理が引き起こされる[54, 55]。三量体の各サブユニットから 1つずつ出ているHR1リピートは、HR2リピートと一緒に反平行にリフォールディングし、6ヘリックスバンドル(6HB)と呼ばれるコイル・コイル融合コアを形成する。この構造によってウイルス膜と細胞膜が一緒になり、細胞の融合とウイルスの内容物の細胞質への放出が促進される[54, 55]。このステップは非常に重要で、ウイルスが生産的な感染を達成するためには完了する必要がある。したがって、このステップは、選択的に標的とすることができるもう1つの侵入チェックポイントである。Spike糖タンパク質のドメイン構造とACE2の結合モチーフを図2に示す。SARS-CoV-2の侵入におけるこれら、2つの異なるステップを標的として、様々な治療用タンパク質やその誘導体、低分子化合物が採用されている。
図2 SARS-CoV-2 Spike糖タンパク質のドメイン構造とSpikeとACE2の相互作用
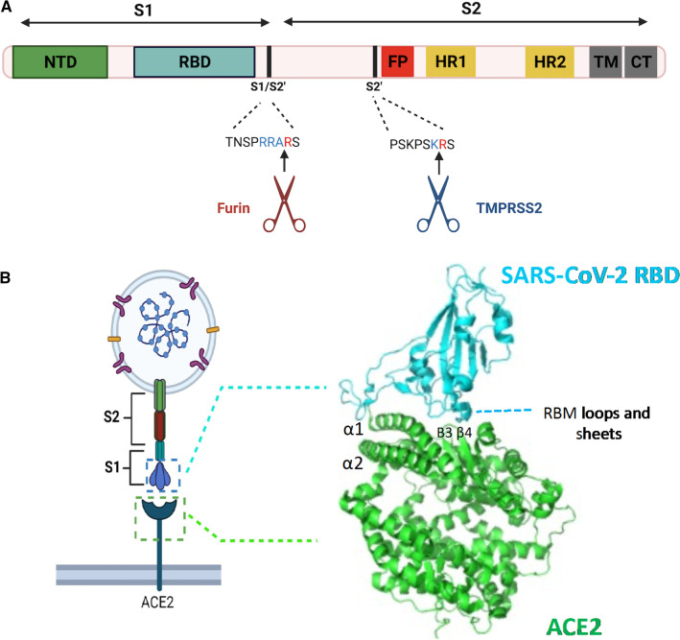
a SARS-CoV-2 Spikeのドメイン構造は、S1とS2の2つのサブユニットからなる。S1は、NTD、RBDドメイン、RBD内のRBMからなる。S2と細胞膜の融合が起こるためのプライミングとSの活性化には、S1/S2’とS2という2つの切断部位が必要である。S1/S2’はfurinにより、S2’はTMPRSS2により、それぞれ示された切断部位で切断される。S2サブユニットは、FP;HR1とHR2,TM、および細胞質尾部(CT)からなる。 b スパイクとACE2受容体の相互作用は、S1のRBDとACE2のエクトドメインモチーフの結合によって規定される。具体的には、S1 RBDのRBMが、主にα1とα2,β3/β4の結合モチーフの残基と結合する。(図はBiorenderで作成)
中和抗体
2020年8月、COVID-19患者への緊急使用を目的とした、回復期血漿(CP)がFDAより承認された。CPは主に、SARS-CoV-2感染から回復したばかりの人の中和抗体で構成されている。したがって、これらの抗体は、ウイルスの細胞内への侵入を阻止し、ウイルスのクリアランスを促進する可能性がある。CPは、過去に発生した他の病原体の集団感染でも使用されており、一般的には、感染を予防し、病気の期間と重症度を短縮すると理解されている[4, 57, 58]。しかし,COVID-19の場合,CPから得られる臨床的有用性の証拠は,これまでのところ一貫していない。これは,よくコントロールされた研究が不足していることと,血漿の不均一性,抗体価を調製する際の標準化されたプロトコルの欠如,およびこの血漿をどのように投与するのが最善かといったCPに関連する課題が原因である[59-61]。対照的に、モノクローナル抗体(Mab)を含む合成抗体は、より特異的で均質であり、生産面での拡張性があるため、これらの制限のいくつかを克服することができる。この種の抗体は、回復期血漿、トランスジェニックマウス、B細胞の分離、ファージディスプレイライブラリなどから作製することができる[15, 62, 63]。COVID-19が登場して以来、Mabsの分野では爆発的な発見がなされている。大半のMabsは、RBDのエピトープに結合し、ACE2との相互作用を防ぐことでウイルスを中和していることが明らかになっている。生物層干渉法(BLI)や表面プラズモン共鳴(SPR)などの技術を用いた特性評価や、X線/クライオ電子顕微鏡による構造研究から、このACE2結合の拮抗は、RBDに高い親和性と特異性を持って結合する抗体の能力によって可能になることが明らかになっている[62-65]。このような知見は,試験管内試験でシュードタイプおよび生のSARS-CoV-2の感染を中和することや,ウイルスによる肺障害からげっ歯類や霊長類を治療的に保護することを示す研究によっても裏付けられている[15, 55-58]。このようにして特性化された抗体の代表的な例としては,CCL12.1,311mab-31B5および311mab-32D4,CR3022,S309,B38,CB6,4A8などが挙げられる[15, 62-64]。これらのうちのいくつかはまもなく臨床試験に進む予定であり、さらにいくつかは、CT-P59,VIR-7831,AZD7442,TY027,SCTA01,SAB-185など、すでに臨床試験で治療効果が評価されている[15, 62-64, 66]。
現在,Regeneron社の中和モノクローナル抗体(カシリビマブとイムデビマブ,またはREGEN-COV)とEli Lilly社の中和モノクローナル抗体(バムラニビマブとエテセビマブ)がすでに緊急使用許可(EUA)を得ている.REGEN-COVの承認は2020年11月に取得され、Eli Lillyの併用療法は最近2021年2月に承認された[67, 68]。臨床的には、これらの抗体レジメンは、ウイルス量と入院患者数を減少させる能力があることが実証されており、現在、重症化するリスクのある患者の軽度から中等度のCOVID-19の治療に処方されている[67-69]。このように臨床効果が注目されている一方で、ワクチンの有効性に継続的な課題をもたらす抗原ドリフトは、抗体の有効性を制限する恐れもある。多くの研究では、新しい変異体、特にB.1.351やP.1などのE484K変異を含む変異体が、中和Mabsの効果に対して大きな抵抗性を示すという知見が報告されている[70-72]。これは、抗体を単剤で使用する場合に特に顕著である。実際、米国政府は、当初は単剤療法として承認されていたバムラニビマブの単独使用に警告を発し、現在ではバムラニビマブとエテセビマブの併用を推奨している[75]。2つのEUAカクテルに含まれる個々の抗体は、それぞれ異なるエピトープを認識するため、組み合わせて使用することで、エスケープミュータントや耐性の発生を抑えることができる。新しいデータによると、バムラニビマブとイテセビマブの併用療法は、どちらか一方の抗体単独療法と比較して、亜種に対する中和効果が比較的高いことが示されている。一方、REGEN-COVは、これまでに試験されたすべての亜種に対する効力をほぼ維持している[69, 76, 77]。これらの観察結果は、カクテルの使用を正当化するものであり、中和逃避変異に対抗するために、より保存されたエピトープから抗体を設計することの重要性を強調するとともに、将来の変種や大パンデミックに備えて、広範囲の抗体やその他の治療法を作成する必要性を示している。
幸いなことに、中和の幅が広い生物製剤の開発は、すでに研究が進んでいる分野である。Rappazzoらは、指向性進化を利用して作られた抗体が幅広い活性を持つことを示した。具体的には、高度に保存されたエピトープを認識する彼らの親和性成熟体の1つであるADG-2は、試験管内試験で本物のSARS-CoV-2に対して強力な中和作用を示し、SARS-CoVおよびSARS-CoV-2に感染したマウスをウイルスの複製および肺の病理から保護した。さらに重要なことは、ほとんどのSARS-CoV-2を中和するEUA抗体と比較すると、ADG-2はSARS-CoV、SARS-CoV-2,WIVI、LYRa11,Rs4231,GD-Pangolin、Pangolin-GX-P2Vを含むクレード1のサルベコウイルスに対してより広い範囲で中和を示したことである[78]。Wecらの別の研究でも、回復期のCOVID-19患者から、SARS-CoV、SARS-CoV-2,WIVIをクロス中和するいくつかの抗体を同定している[79]。さらに最近では、2つの研究が同様の発見を報告している。Starrらは,保存されていて機能的に制約のあるRBD残基を標的とする抗体を発見した。そのうちの1つであるS2H97は、SARS-CoV-2関連のサルベコウイルスに対して高い親和性と中和の幅を示した[80]。また,高度に保存されたRBDエピトープに結合するS2X259は,すべてのVOCと幅広いスペクトルのヒトおよび人獣共通感染症のサルベコウイルスをクロス中和することが明らかになった。特に、S2X259をシリアのハムスターに予防的に投与することで、SARS-CoV-2およびB.1.351亜種のチャレンジに対して防御することができた[81]。変異体に対して同様の効果を示したその他の抗体は、表11にまとめられている[82-84]。
表1
クロスニュートラリゼーション、エスケープミュータントの抑制、および循環している変異体やサルベコウイルスに対する広範な活性において、治療的または予防的な有効性を示したウイルス侵入阻害剤の著名な例
| 抑制剤タイプ | エージェント | 研究デザイン/モデル | 主な結果 | 参考文献 |
|---|---|---|---|---|
| 抗体 | ADG-2 | invitroおよびinvivoでの偽型およびWTSARSウイルス | 中和されたSARS-CoV、SARS-CoV-2、バットSARSr CoV、サルベコウイルス、およびSARS-CoVおよびSARS-CoV-2から保護されたマウス | [ 78 ] |
| ADI-55689 | invitroでの偽型とWTSARSウイルス | 中和されたSARS-CoV、SARS-CoV-2、細胞内のSARS様WIVIのバット | [ 79 ] | |
| S2H97、S2X259 | invitroおよびinvivoでの偽型およびWTSARSウイルス | 中和されたSARS-CoV-2、すべてのサルベコウイルスクレード。脱出変異体を防ぎ、すべてのVOCを中和しました。SARS-CoV-2およびB.1.351から保護されたシリアのハムスター | [ 80、81 ] | |
| REGN10987 + REGN10933 | invitroでのSARS-CoV-2シュードタイプ | 薬剤はinvitroでの脱出変異体の選択を妨げた | [ 82 ] | |
| S309 + S304 | invitroでの偽型および非感染性SARSウイルス | 中和されたSARS-CoV-2、SARS-CoV、WIVIシュードタイプ、および細胞内の生きたSARS-CoV-2 | [ 83 ] | |
| CV38-142 + COVA1-16 | invitroでの偽型および非感染性SARSウイルス | 細胞内の中和されたSARS-CoV、SARS-CoV-2、B.1.1.7およびB.1.351 | [ 84 ] | |
| ナノボディ | 複数の候補者(例:VHH VE) | invitroでの偽型とWTSARSウイルス | VEはSARS-CoV、SARS-CoV-2およびエスケープ変異体を中和しました | [ 89 ] |
| 複数の候補者(NB34、36、N105) | invitroでの偽型とWTSARSウイルス | 中和されたSARS-CoV-2および細胞内のB.1.1.7およびB.1.351を含む変異体 | [ 90、94 ] | |
| 複数の候補(Nb30、Nb56三量体) | invitroでの偽型 | 細胞内の中和されたSARS-CoV-2およびVOC(英国および南アフリカの亜種) | [ 91 ] | |
| 複数の候補者(S1-1、S1-RBD-15) | invitroでの偽型とWTSARSウイルス | 中和されたSARS-CoV、SARS-CoV-2、B.1.351および細胞内のエスケープ変異体 | [ 95 ] | |
| 複数の候補者(例:WNb 2 + 7) | invitroおよびinvivoでの偽型およびWTSARSウイルス | invitroで中和されたSARS-CoV-2、invitroでのN501Y D614G変異体、および予防的にマウスのウイルス量を減少させた | [ 96 ] | |
| デコイ受容体 | sACE22.v2.4 | invitroでの偽型とWTSARSウイルス | 細胞内のヒトおよびコウモリからのSARS関連ウイルスを利用するさまざまなACE2を中和しました | [ 102 ] |
| CTC-445.2d、CTC-445.2t | invitroおよびinvivoでの偽型およびWTSARSウイルス | 変異体を回避するための回復力を示した。invitroでSARS-CoV-2を中和した。SARS-CoV-2から保護されたマウスとハムスター | [ 103 ] | |
| ACE2(740)-Fc | invitroでの偽型とWTSARSウイルス | 中和されたSARS-CoV-2およびその他のACE2を利用する細胞内のCoV | [ 102 ] | |
| LCB1 | invitroおよびinvivoでのWTSARSウイルス | 中和されたWTSARS-CoV-2 in vitroおよび予防的に保護されたマウスをSARS-CoV-2、B.1.1.7およびE484K / N501Y変異体から | [ 106、107 ] | |
| 融合阻害剤 | EK1、EK1C4 | invitroおよびinvivoでの偽型およびWTSARSウイルス | invitroでSARS-CoV-2、SARS-CoV、MERS、WIVI、HCoV-NL63、HCoV-0C43を含むさまざまなCoVの侵入を抑制しました。MERS、HCoV-0C43、SARS-CoV-2から保護されたマウス | [ 122、123 ] |
| IPB-01、IPB-02 | invitroでのSARSウイルスの偽型 | 細胞内でのSARS-CoVおよびSARS-CoV-2の侵入の抑制 | [ 124 ] | |
| (SARS HRC -PEG 4)2-chol | invitroおよびinvivoでのWTSARS-CoV-2 | invitroでのSARS-CoV-2侵入の抑制およびSARS-CoV-2感染からの予防的に保護されたフェレット | [ 125 ] |
しかし、現在の、あるいは潜在的なエスケープミュータントへの対応に成功しているのは、抗体だけではない。ナノボディもまた、有効な選択肢であることがわかってきた。ナノボディは、免疫化されたラマやラクダ、ファージディスプレイから生成されたシングルドメイン抗体である[85-88]。最近発表された証拠によると、多価のナノボディは、複数の非重複エピトープへの結合、アビディティ効果、通常の抗体ではほとんどアクセスできない保存されたエピトープへの結合により、循環している亜種を中和し、耐性のあるエスケープミュータントの出現を防ぐことができる[89-96]。表11は、これらの研究から得られた主な知見をまとめたものである。さらに、モノクローナル抗体を曝露前および曝露後の予防薬(PEPrs)として使用する可能性を考慮すると、ナノボディは有益な特性を持っていると考えられる。前臨床的には、モノクローナル抗体は治療的価値に加えて予防的価値がある。マウス、ハムスター、アカゲザルなどの動物モデルにおいて、SARS-CoV-2関連の呼吸器障害を予防したという証拠が広く報告されている[97-101]。また、現在進行中のEUAモノクローナル抗体療法の臨床試験から得られた予備的な証拠も非常に有望である[102-104]。しかし、潜在的なPEPrs治療法を外来で広く使用するには、簡便に投与できる薬剤が最も実用的であることを指摘しておくことが重要だ。抗体は分子量が大きく、安定性が低く、複雑で製造コストが高い。現在、抗体は通常、医療施設で静脈内投与されているが、医療施設は潜在的な輸液反応に対処するためのリソースを備えていなければならない。一方、ナノボディは、より小さく、安価に作ることができ、吸入器や鼻腔スプレーを使用して、より簡単で便利な肺への送達のためにネブライズすることができる[63, 85]。これらの事実を総合すると,病気の早期発症時の変異体への対応や,曝露前後の感染予防の観点から,モノクローナル抗体カクテル,広域抗体,多価ナノボディが将来的な課題となる。
組換えヒト可溶性ACE2およびその他のタンパク質ベースの抗ウイルス剤
タンパク質ベースの抗ウイルス剤の使用は、S1のRBDに結合する抗体またはその機能的断片が主流となっている。この戦略に代わるものとして、SARS-CoV-2の受容体として機能するACE2のエクトドメインを標的とする方法がある。これらのデコイ受容体(図3)は、内因性の膜貫通型ACE2がスパイクに結合するのを凌駕する可能性のあるスカベンジャーのような働きをする[15]。さらに、エスケープ変異体は、RBDやNTDに特異的な変異を加えた抗体防御を回避できることがあるが、デコイ受容体は内在性ACE2と同じ結合界面を持つため、病原性を失わずにデコイから逃れることはより困難である。さらに、可溶性ACE2は、ARDSやSARSの治療に焦点を当てた臨床研究で示されているように、すでに安全であることがわかっている[15]。したがって、可溶性ACE2受容体は安全であり、SARS-CoV-2感染症に対して有効である可能性が高いと予想される。Monteilらが臨床グレードの可溶性組換えヒトACE2(hrACE2)を用いて行った前臨床試験では、この可能性が確認され、hrACE2がSARS-CoV-2の感染を有意に防いだことが示されている[105]。現在、多くの進行中の臨床試験が、可溶性rACE2の可能性を評価している[15]。例えば、rhACE2 APN01は現在、第2相臨床試験が行われている。第1相データでは、APN01がウイルス血症およびウイルス力価を低下させることが示され、第2相データの予備的証拠では、APN01が医学的合併症のリスクを低下させ、回復時間を短縮することが示されている[106, 107]。これらの興味深い発見に触発され、他のグループは、計算機設計、深い変異誘発、親和性成熟を用いて、さらに強力な可溶性ACE2を設計した。Chanらの研究では、Sの結合に関与する117残基の変異に基づいて親和性成熟を用いて設計された可溶性ACE2がsACE22.v2.4の発見につながったことが示されている。sACE22.v2.4はWTのsACE2よりも強力で、変異体に対する回復力は、SARS-CoV-2,SARS-CoV、SARS類似のコウモリコロナウイルスなど、ACE2を侵入口とするコロナウイルスを強力に中和する能力によって例証されている[108]。GlasgowとLinskyらによる他の2つの研究でも,同様のアプローチが採用され,成功を収めている[109, 110].特にLinskyらが設計した2つのデコイ、すなわちCTC-445.2dとCTC-445.2tは、SARSウイルスの強力な中和作用を示し、1回の予防投与でシリアハムスターをSARS-CoV-2から保護した[110]。さらに重要なことに,他の知見では,より小さなバージョンのデコイ受容体でも,強力な中和効果が得られることが示されている[111]。AHB1,AHB2,LCB1,LCB3を含む超安定ミニタンパク質結合体は、試験管内試験においてナノからピコモルの範囲でSARS-CoV-2の感染を見事に抑制した[112]。わずか56残基のLCB1は、トランスジェニックCOVID-19マウスモデルにおいて、腹腔内投与(LCB1-Fc)または鼻腔内投与(LCB1v1.3)した際の生体内試験有効性を評価するフォローアップ研究において、リードバインダーとして使用された。その結果、LCB1は、ウイルス接種の5日前に鼻腔内投与した場合でも、曝露前と同様に、曝露後のSARS-CoV-2による肺疾患を予防した。特に、LCB1v1.3は、鼻から予防的に投与することで、スパイクのB.1.1.7変異体、主要なE484KおよびN501Y変異をコードする変異体に対して、生体内試験でマウスを保護した[113]。これらのタンパク質ベースの抗ウイルス剤は、臨床的にも期待されており、現在の治療や予防の可能性だけでなく、将来的に再出現するACE2を利用したコロナウイルスに対する保護の可能性も秘めている。
図3 ウイルスの表面膜への侵入を標的とする戦略のまとめ
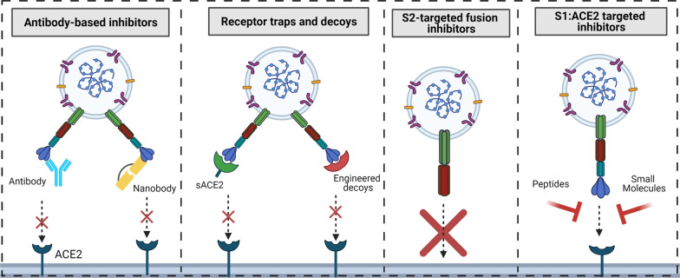
モノクローナル抗体とナノボディからなる抗体ベースの阻害剤を含む4つのアプローチを紹介している。受容体デコイは、WTの可溶性ACE2や、WTのACE2よりも高い親和性を持つように設計されたACE2で構成されている。また、S2と細胞膜の融合を防ぐために、主にS2のHR2に基づいた様々な阻害剤が設計されている。また、S1のRBDとACE2の相互作用を阻害するように設計されたペプチドや低分子化合物も作られている。(図はBiorenderで作成している)
S1とS2を標的としたペプチド
ペプチドは、ウイルスの侵入を防ぐためにSpikeとACE2に向けられる、もう一つのタイプの阻害剤である。ペプチドは、抗体や他のタンパク質ベースの抗ウイルス剤よりも小さく、シンプルで安価に作ることができる。ペプチドのよく知られた欠点は、全身に投与した場合、分解や代謝のためにバイオアベイラビリティーが低いことである[113]。しかし、COVID-19の治療薬としては、この欠点は、肺に直接投与するためのネブライザーや乾燥エアロゾルパウダーによって容易に克服することができる[113]。一般的に、SARS-CoV-2 Spikeを標的としたペプチド阻害剤は、S1のRBD:ACE2の結合を阻害するものと、S2の膜との融合を阻害するものの2つのグループに分けることができる(図3)。Huang研究室やCho研究室などのグループによる以前の研究では、ACE2の重要なS1 RBD認識モチーフ(図2b参照)例えばN末端のヘリックス(α-1)にあるモチーフから抽出したペプチドが、有意な競合的拮抗作用や抗ウイルス活性をもたらすことが示されていた[114, 115]。例えば,Choのグループは,空間的に近い非連続の2つのセグメントを連結することで,SARS-CoVの感染を100nMの半減期阻害濃度で阻害できることを示した[114]。他の研究でも,S1由来の直鎖状ペプチドで同様の結果が報告されている[116, 117]。SARS-CoVおよびSARS-CoV-2のS1 RBDとACE2との間の結合コンフォメーションが類似していること、およびSARS-CoVおよびSARS-CoV-2のS1 RBDの高い配列同一性を考慮すると、SARS-CoV-2のACE2:S1 RBD結合に対するペプチドも有効であると考える理由がある[62]。Karoyanらの研究結果は、この予想を裏付けているように見える。彼らのデータによると,ACE2のペプチダーゼドメイン(PD)のαヘリックスのペプチド断片(P8,P9,P10)は,らせん状に折りたたまれる傾向のある残基で合理的に修飾されており,本物のSARS-CoV-2に対してナノモル領域で高い結合親和性と抗ウイルス活性を示すことが示されている[118].また,Curreliらの研究では,二重ステープリングで構造的に安定化されたACE2の類似領域からのペプチドが,シュードタイプおよび生のSARS-CoV-2に対してマイクロモルの低濃度で阻害活性を示すことが示されている[119].また、S1 RBDの結合モチーフ、特に図2bに示すようなRBMを利用したペプチドについては、ある研究室がSARS-CoV-2のシュードウイルスに対してサブマイクロモルの抗ウイルス活性を持つSARS-BLOCK™と呼ばれるペプチド群を報告している[120]。一方で、ペプチド阻害剤の活性がより緩やかであったり、全く活性がないことを報告している研究もある。例えば,Zhang研究室は,ACE2のPDのαヘリックスからの23merペプチドがナノモル領域の高い結合親和性を示したにもかかわらず、S1 RBDに結合する可溶性ACE2に対する競争力を欠いていたと発表した[121, 122]。確かに,ここでの結合の欠如は,Zhangらが設計した直鎖状のネイティブペプチドの溶液中での二次構造が限られているためではないかという議論が成り立つ[113]。それにもかかわらず,別のグループは,ペプチドのヘリシティを劇的に改善するステープリングを行っても,安定化したペプチドでも,安定化していないペプチドでも,評価できるような結合活性は観察されなかったことを示している[123]。我々の研究室では,ACE2またはS1 RBDの結合モチーフから合理的に設計されたペプチドが,低マイクロモル領域でわずかな阻害活性を示すことを発見した(未発表)。S1 RBDとACE2の相互作用を阻害するペプチドの活性と、COVID-19治療薬としての可能性について、より安全な結論を得るためには、これらの矛盾したデータが必要である。
上述したように、ウイルスの細胞膜との融合もまた、治療の標的となりうるポイントである。HR1とHR2の両方が一緒になって6HBを形成し、その後融合する必要があるため、一方の領域を模倣したペプチドを設計すれば、融合コアの形成を競合的に妨害することができる[54, 55]。このアプローチは、HIVのようなヘプタッド領域を持つ他のウイルスの侵入を防ぐために利用されている。実際、エンフビルチドは、HIV感染症の治療に承認されている融合阻害剤である[113]。HR2は通常,HR1指向のペプチドを作るためのテンプレートとして使用され,このアプローチはコロナウイルスへの適用に成功している[113]。この研究の多くは,SARS-CoV-2が発生する前に発表され,SARS-CoV,MERS-CoV,HCOV-229Eなどのウイルスを対象としていた[124, 125]。おそらく最も印象的な結果は 2019年に報告されたOC43-HR2Pから得られたものである[126]。OC43-HR2Pペプチドは、HCOV-OC43のHR2ドメインに由来するもので、α-およびβ-コロナウイルスに対して幅広いスペクトル活性を示した。本研究で最適化されたOC43-HR2Pのバージョン(EK1)は、SARS-CoV-2が出現するとすぐにテストされ、試験管内試験でSARS-CoV-2感染に対して強力な活性を示した。また、EK1の脂質結合型であるEK1C4は、SARS-CoV-2感染に対するIC50が37nMであることが、マウスを用いた試験で明らかになった。このマウス試験では、EK1C4は、良好な生体内試験安全性プロファイルだけでなく、経鼻投与後の抗ウイルス活性と代謝安定性も示した[127, 128]。SARS-CoVのような以前のhCoV株から活性が延長されたのは、HR領域の高い保存性に起因する。例えば,SARS-CoVとSARS-CoV-2のHR1とHR2は,それぞれ92.6%と100%の類似性を有している[113]。この保存性により,hCoVに対する幅広いスペクトル活性が期待できる。他のHR2由来のペプチドも同定され、SARS-CoVに対して試験されている。IPB-01とIPB-02は,SARS-CoVとSARS-CoV-2の疑似ウイルスの感染に対して,低いナノモルの活性を示した[129].また,(SARSHRC-PEG4)2-cholと呼ばれる別の脂質修飾融合ペプチドは,SARS-CoV-2を3.8nMの半最大阻害濃度で阻害し,鼻腔内投与によりフェレットをSARS-CoV-2感染から保護した[130].汎特異的な活性と動物の生体内試験保護は,融合阻害剤が臨床的に有用である可能性を示している.全体として,ペプチドは,さらなる研究が必要ではあるが,将来的にCOVID-19の治療オプションとして有望である.
ACE2:S1 RBDの相互作用を阻害する低分子化合物
一般的に、低分子治療薬は、ペプチドに比べて細胞伝染性や代謝性などの問題を克服するのに適しているが、その開発には時間がかかる。これまでのところ、COVID-19に対する低分子治療薬の開発は、すでに臨床使用が承認されているか、臨床試験に関連する規制プロセスを経た抗ウイルス剤の再利用が中心であった。エボラ出血熱の治療薬として臨床試験が行われていたレムデシビルは、この方法で発見された。さらに、RdRP、ヘリカーゼ、プロテアーゼの各タンパク質を標的としたRNAウイルス用の抗ウイルス剤が、COVID-19に対する有効性についてさらなる臨床評価を行っている[48, 131]。ウイルスの侵入阻害剤についても同様のアプローチを採用することができる。残念ながら、文献によると、以前に侵入阻害剤として評価された低分子阻害剤のほとんどは、規制当局の承認を受けていない。さらに、報告されている前臨床試験での効力は、大部分が低マイクロモル領域であり、これらの候補のほとんどは、まずSARS-CoV-2の文脈で試験を行い、その後、親和性と効力を最適化する必要があることを示唆している[132-134]。ACE2を利用するコロナウイルスの文脈で、S1 RBDとACE2,およびそれらの相互作用を標的とする阻害剤の例としては、セファランチン、VE607,SSAA09E2,エモジン、HTCC、HM-HTCCなどがある[132-134]。ACE2:S1 RBDの相互作用を標的とする候補を評価した我々の研究室での薬物再評価試験では、試験したものの中でセファランチンが最も有望な候補であり、ACE2に結合するSARS-CoV-2 RBDに対して1桁マイクロモルの効力を示した(未発表)。実際、最近の論文では、これらの観察結果が検証され、セファランチンは、試験管内試験でシュードタイプおよびオーセンティックなSARS-CoV-2感染に対して,0.73μMから30μMの範囲で抗ウイルス活性を示すことが示されている[135-141]。さらに,コロナウイルスに対して新規の活性を持つ低分子阻害剤の候補もいくつか同定されている。Hansonらは,RBDとACE2の相互作用をIC50 5.5 μMで阻害するコリガンを高濃度スクリーニングにより発見した[142]。Dayらの研究では、SPRを用いたRBD:ACE2のスクリーニングが3,141化合物に対して行われた。生きたSARS-CoV-2を用いた試験管内試験研究では,ヒットした化合物であるスラミンとエバンスブルーが,許容できる選択性とIC50値(それぞれ46μMと28μM)で抗ウイルス活性を有することが示された[143].上述の他の研究と比較して、ACE2とS1のRBD相互作用を標的とした低分子化合物の研究は、まだ発展途上の分野である。これまでに報告されている抗ウイルス剤の効力は控えめであり、有効な薬剤に発展させるためには、さらに大幅な最適化が必要であることを示している。小分子やその他の薬剤を用いて、細胞表面の膜からのウイルスの侵入を防ぐ戦略を図3にまとめた。
宿主のプロテアーゼとエンドソームの酸性化阻害剤
S1とS2は、ウイルスの付着と膜の融合を仲介し、ウイルスが遺伝子情報を取り出せるようにするが、これら、2つのサブユニットの機能は、少なくとも3種類の宿主プロテアーゼ(フーリン、カテプシン、表面セリンプロテアーゼ)の関与によって可能となる。ウイルスの侵入は一般的に、ウイルスが表面の膜と直接融合するか、エンドサイトに取り込まれるかのいずれかによって行われるが、どのプロテアーゼが融合活性を促進する上で優位に立つかを決定するのは、その侵入経路である[54, 55, 108, 144]。SARS-CoV-2 Spikeタンパク質には、S1/S2’とS2’という2つの切断部位がある。非エンドサイトへの侵入のために、S1/S2’部位は主にfurinプロプロテインコンバージョンアーゼによって切断される。この開裂により、S2’部位がTMPRSS2などの表面トリプシン様セリンプロテアーゼに対してより完全に明らかになると考えられる。S2’部位は融合ペプチド(FP)のすぐ上流にあり、TMPRSS2による切断によって、疎水性のペプチド(FP)が膜に挿入され(図2a)その後、すでに述べたように6HBが形成される。逆に、ウイルスがエンドサイトーシスの経路をとる場合は、カテプシンがより支配的な役割を果たすことになる[54, 55, 108, 144]。具体的には、コロナウイルスのS2’の切断には、カテプシンLのアイソフォームがより重要であることが示されている。カテプシンLはリソソームのシステインプロテアーゼであり、その機能は他の多くのカテプシンと同様、pHに依存しており、最適なpH活性は3~6.5の範囲にある[114, 144, 145]。これらのプロテアーゼによるスパイクの切断がなければ、ウイルスはリソソームやオートリソソームの膜と融合して、そのゲノムを細胞質に放出することができない(図1)。したがって、上述した3つの異なるクラスのプロテアーゼはすべて、COVID-19の治療介入のための合理的なターゲットとなる。
フーリンおよびTMPRSS2の阻害
フーリン阻害剤は、インフルエンザなどの他のウイルスを標的とする可能性が報告されているが、SARS-CoV-2にも関連があるかもしれない。SARS-CoV Spikeには、一塩基性のS2’部位のみが存在し、SARS-CoV-2に見られるS1/S2’部位のための余分な多塩基性(RRAR)モチーフは存在しない(図2a)。SARS-CoV-2のS1/S2’は、おそらく活性化の役割を果たしており、これがSARS-CoV-2の高い病原性と多臓器感染性の一因となっている可能性がある[11, 144]。S1/S2’部位の処理を阻害する一般的な方法は、ペプチド基質の模倣物を設計することである。フーリンプロテアーゼが認識するコンセンサス配列はR-X-R/K-R↓であり,過去の研究では,ペプチドミメティックであるデカノイル-RVKR-クロロメチルケトン(dec-RVKR-cmk)がフーリンを阻害し,ウイルス糖タンパク質の切断を阻害することが示されている[144, 146].SARS-CoV-2の研究では,dec-RVKR-cmkは試験管内試験で感染を阻害し,IC50は5μMであった[147].また,別のフーリン阻害剤であるMI-1851は,Calu-3細胞におけるSARS-CoV-2の力価を10μMで約200倍に低下させることが分かっている[146]。TMPRSS2については,MERSやSARS-CoVなどの過去のコロナウイルス株に対して,ペプチドミメティックと低分子の両方の様々な阻害剤が報告されている[144, 147, 148]。SARS-CoV-2に対して有望な活性を示したペプチドミメティック阻害剤には,アプロチニン,MI-1900,MI-432がある。アプロチニンは、以前にインフルエンザ感染対策として臨床試験が行われており、10μMでSARS-CoV-2の増殖を有意に抑制することも示されている[144, 149]。MI-1900とMI-432は、同様の実験条件でアプロチニンよりも高い効力を示しており、より有望である。さらに重要なことは、MI-1851とMI-432の併用療法は、どちらか一方の療法のみの場合よりも実行可能であり、より効果的であったことである[146]。同様に有望なのが、TMPRSS2の低分子阻害剤であるcamostatとnafamostat mesylateである。カモスタットとメシル酸ナファモスタットは、膵炎と播種性血管内凝固の臨床承認を得ている類似薬である[150]。実際、カモスタットは、SARS-CoV-2の細胞内への侵入を阻止する有意な活性が示された初期の低分子阻害剤の1つである[56]。しかし、実際にはナファモスタットの方がより強力なアナログであり、Calu-3細胞におけるSARS-CoV-2の複製を10nMのEC50で阻害することが示されている[145, 147]。どちらの阻害剤もCOVID-19の治療薬として評価するために現在臨床試験が行われており,その有効性に関する結果が待ち望まれている[56, 151]。
カテプシンの阻害
コロナウイルスに対するカテプシン阻害剤も様々な研究で報告されている。その中には,テイコプラニン,K1777,SSAA09E1,SID-26681509,P9誘導体などがある[64, 113, 144, 152, 153]。テイコプラニンは,SARS-CoV-2シュードビリオンのエントリーに対して,IC50が1.6 µMと良好な活性を示している[154]。同じことがSID-26681509とP9誘導体にも言える。Ouらの研究では、カテプシンL阻害剤であるSID 26681509は、2μMで独立してSARS-CoV-2 S疑似ウイルスの侵入を約76%減少させた[155]。P9の誘導体であるP9Rおよび8P9Rもまた、SARS-CoVおよびSARS-CoV-2に対して、マイクロモルからナノモルの低濃度で有意な活性を示している[156, 157]。さらに重要なことに、8P9Rはマウスやハムスターの生体内でSARS-CoV-2のウイルス量を減少させ、抗ウイルス活性を示した[157]。SID-26681509のような上述の阻害剤は,内因性の基質を模倣して酵素活性部位と相互作用することにより,直接的な方法でカテプシンのプロテアーゼ活性を阻害する。しかし、pH調節による間接的なプロテアーゼ活性の阻害も選択肢の一つである。エンドソーム酸性化阻害剤は、このメカニズムで作用し、パンデミックの初期には、いくつかの薬剤が有効な治療法として大いに注目されていた[152]。クロロキン、ヒドロキシクロロキン、アジスロマイシンなどのこのような阻害剤は、エンドソームのpHを上昇させ、pHを最適な範囲外にシフトさせることで、間接的にカテプシンプロテアーゼの活性を抑制することで機能する[158-160]。このように合理的で有望な前臨床活動にもかかわらず、これらの阻害剤は、様々な臨床試験で評価されても、一貫した確固たる効果の証拠を示していない[158-163]。心臓関連の毒性や網膜症など、クロロキン誘導体の副作用が知られていることから、現在、臨床使用の検討は保留されている[164]。これらのエンドソーム酸性化阻害剤に対する勧告にもかかわらず、他のプロテアーゼ阻害剤は、その特異性から臨床開発の候補として残っている。今後の研究で、将来のCOVID-19治療薬としての有用性が明らかになり、決定されることであろう。
結論と今後の展望
COVID-19は、初期のウイルス期と、より危険な宿主免疫反応期の二相性の病気であると理解されている。この知識は、感染者の治療法を見つけるための翻訳・臨床治療戦略を形作ってきた。SARS-CoV-2の抗原性の変化は、COVID-19との戦いにも影響を与えている。現在、4つの主要な変異株が確認されているが、これらの株は一般的に感染力が高く、ワクチンやモノクローナル抗体の効果に対して抵抗性を示している[36, 37]。ワクチン、特にmRNAベースのワクチンは、効果が低下しているとはいえ、亜種に対してある程度の防御効果があることが示されており、将来的にはブースターショットを含む複数回のワクチン投与が必要になるかもしれない[165-168]。保健当局は、すでに確認されている注目すべき亜種についても引き続きモニタリングする予定である。さらに、SARS-CoV-2の出現により、別の人獣共通感染症の波及が起こり、さらに致命的な大パンデミックを引き起こすのではないかという懸念も新たにされている。過去20年間だけでも、新興のRNAウイルスから 10件以上の深刻なアウトブレイクを経験していることを考えると、こうした懸念は杞憂ではない[169]。このような背景から、現在実施されている対策に注目が集まっており、利用可能な証拠に基づいて、どのようにして対策をより効果的にすることができるかが問われている。さらに、重要なのは、変異株や潜在的なアウトブレイクに対処するための将来計画の策定である。
このレビューでは、ワクチンの有用性と、COVID-19対策に残されたギャップを明らかにした。次に、侵入阻害剤の作用機序から、COVID-19の早期管理に適した薬剤であることを示し、そのような阻害剤の研究を継続することが重要である理由を説明した。モノクローナル抗体は、医薬品開発のパイプラインの中で最も進んでおり、すでに使用が承認されているもの(EUA)もあれば、臨床試験が進んでいるものもある[66]。また、モノクローナル抗体、多価ナノボディ、リコンビナント可溶性ACE2のカクテルは、現在流通しているものを含む変異株に対する治療効果や、家族を超えた幅広いコロナウイルスへの有効性を示している。抗体は、スパイクの保存領域を含む複数のエピトープを標的としているため、耐性を抑え、幅広い活性を発揮することができる。組換えACE2をベースにした薬剤では、内因性受容体との類似性から同様の効果が得られ、感染力を失うことなく変異株の発生を困難にしている。これらのタンパク質ベースの抗ウイルス剤は、これらの貴重な治療効果と将来のパンデミックに対する治療薬としての可能性に加えて、曝露の数日前からの予防的投与にも有効であることが示されている。先に述べたように、これらの薬剤を用いた予防的治療によって、様々なサブグループの人々が恩恵を受けるであろう。
ミニプロテイン、ペプチド、低分子治療薬については、現在の文献によると、臨床開発の面では抗体や組み換えACE2ほど進んでいないようである。しかし、これらの治療薬の有用性は、その大きさと、経口薬や吸入薬のように自分で投与できる治療用製剤への開発が容易であることにある。そのため、研究者や意思決定者が外来患者の予防に侵入阻害剤を使用する可能性を評価するためには、さらなる研究が必要とされている。また、鼻腔が最も支配的で初期の感染部位であることを考慮すると、鼻腔スプレーを使用してエアロゾル化することは、肺へのウイルス拡散を防ぐ上で有益である可能性がある[8]。最後に、侵入阻害剤やその他の抗ウイルス剤、宿主の免疫反応に対する治療法の開発にさらなる投資が必要である。なぜなら、これらの治療法が利用できるかどうかは、将来のSARS-CoV-2系統だけでなく、将来のコロナウイルスのパンデミックへの対応にも影響するからである。最近の出来事から、COVID-19によるパンデミックのような大パンデミックを予防したり、それに備えたりすることは、何の準備もせずにそのような大パンデミックに遭遇するよりも、インパクトもコストも大きいということがはっきりしている。このような理由から、将来のパンデミックに対するプロアクティブでプリエンプティブな対策に投資しようとする米国や国際社会の提案は賞賛に値するが、これはこの開発によってパンデミック発生から効果的な治療対応までの時間が短縮されるからである。