Contents
Is Sleep Disruption a Cause or Consequence of Alzheimer’s Disease? Reviewing Its Possible Role as a Biomarker
www.ncbi.nlm.nih.gov/pmc/articles/PMC7037733/
要旨
近年、睡眠は認知処理に重要であるという考えが強まっている。アルツハイマー病は世界的に最も一般的な認知症であり、睡眠障害の有病率も高い。しかし、この病気の異なる側面の間に悪循環が生じるため、因果関係を確立することは困難である。
現在では、睡眠は記憶を定着させ、アルツハイマー病患者の脳に蓄積された過剰なβアミロイドや高リン酸化タウを除去するために重要であることがわかってきている。
このレビューでは、睡眠障害がどのように多くの場合、アルツハイマー病における認知機能の低下と同様に、いくつかの病理学的特徴に何年も前に先行するかを議論する。我々は、通常の老化とは対照的に、アルツハイマー病における睡眠パターンの変化に焦点を当てて、記憶の統合に睡眠の関連性を説明する。また、睡眠の変化がアルツハイマー病発症リスクを予測するのに有用なバイオマーカーとなりうるかどうかを分析し、睡眠関連のバイオマーカーとして提案されているものをまとめた。
睡眠微細構造の解析は、アルツハイマー病のバイオマーカーとして有用な特定の振動パターンを検出するために有用であることが強調されている。
キーワード
レム、NREM、徐波睡眠、SWA、スピンドル、脳脊髄液アミロイド、脳脊髄液タウ
1. はじめに
睡眠の質と持続時間が認知プロセスに関連していることを示すエビデンスが蓄積されている。認知障害や睡眠障害は、多くの場合、いくつかの病態と関連しているが、これらの関連性の本質はまだ不明であり、因果関係を確立することは困難である。アルツハイマー病は、これらの疾患の一つであり、世界的に最も一般的な認知症である。古典的には、エピソード記憶の低下から始まるが、精神神経症状は非常に早い段階で現れることがあり、早期診断を困難にしている[1,2]。
アルツハイマー病は睡眠障害の有病率と重症度が高く[3,4,5]、睡眠障害はしばしばアルツハイマー病の診断に何年も先行し、認知機能の低下の前にも現れる可能性があることを示す研究がある[6]。実際には、縦断的な疫学研究では、1年後に認知機能障害を持つ健康な人々の貧しい睡眠の質をリンクしている[7]。Limらは、コミュニティベースの前向き研究で、睡眠の断片化が高い人は、6年間の追跡調査でアルツハイマー病発症のリスクが1.5倍高いことを発見した[8]。同様に、Benedictらは50歳以上の男性1574人を評価した40年間の研究を行い、睡眠障害のある人はアルツハイマー病発症リスクが51%上昇することを観察した[9]。同様に、Bubuらはメタアナリシスで、睡眠障害のある患者の認知症リスクは1.68倍と推定した[10]。さらに、最近の多施設研究では、中年期と終末期の不眠症の両方が認知症リスクの上昇と関連していた[11]。
それは、睡眠障害を持つ人々の影響を受けた脳構造は、アルツハイマー病の脆弱な領域と一致していることに注意することは興味深いことである。海馬、前帯状突起、扁桃体、帯状回の灰白質体積の低下[12,13,14,15,16,17,18,19]、および皮質萎縮の程度の高さが、認知機能障害のない不眠症患者で記述されている[14,20]。45歳から75歳までの認知障害のない成人で行われた最近の研究では、不眠症患者は他の研究と一致するアルツハイマー病関連領域の灰白質体積の減少を示したことがわかった。さらに、彼らはこれらの被験者の左尾状部の容積が大きいことを発見したが、これはまた、アルツハイマー病遺伝子変異の無症候性キャリアに見られることができる[21]。最後に、中年の認知障害のない成人を対象とした非常に最近の研究では、不眠症のAPOE-ε4キャリア(アルツハイマー病の主な危険因子)では、不眠症の有無にかかわらず、キャリアではない場合と比較して、左角回、両側上前頭回、視床下部、右海馬の灰白質体積が低いことが明らかになった[21]。
この時間的および解剖学的関係は、睡眠障害がアルツハイマー病の病態に影響を与えたり、悪化させたりする可能性があり、睡眠の改善がアルツハイマー病の進行を遅らせるのに役立つ可能性があることを示唆しているかもしれない[22,23]。さらに、睡眠の変化は認知症の発症リスクを予測するために用いられる可能性があり、疾患の初期指標としても機能する可能性がある。睡眠障害がアルツハイマー病の発症や臨床経過を加速させる危険因子であれば、疾患バイオマーカーの開発に利用することができる。さらに、電気生理学的記録は非侵襲的で比較的安価であるため、高感度・高特異性の睡眠バイオマーカーは非常に有用である。
本論文では、睡眠障害とアルツハイマー病の神経病理学的基盤との関連性を検討し、この関係の因果関係の可能性とバイオマーカーとしての睡眠のもっともらしい役割に光を当てることを目的としている。まず、記憶の定着と睡眠の関連性に焦点を当て、続いて、睡眠障害と加齢に伴う睡眠と記憶のパターンについて簡単なレビューを行う。次に、臨床症状として、あるいは危険因子としてのアルツハイマー病における睡眠障害を強調し、睡眠障害と疾患の病理を結びつける振動性、生化学的、システムベースのメカニズムをまとめ、議論する。最後に、睡眠障害とゴールドスタンダードアルツハイマー病バイオマーカーとの関係、およびアルツハイマー病の早期発見のための可能性のあるバイオマーカーとして提案されているいくつかの睡眠変化について議論する。
2. 宣言的記憶統合における睡眠の役割
宣言的記憶は、記憶の統合の初期段階でも想起においても海馬依存性であり[24]、統合が起こると海馬に依存しない記憶になる[25]。特にアルツハイマー病では、初期段階では宣言的エピソード記憶が影響を受けるが、他のタイプの記憶は病気の進行に伴って悪化するだけである[2,26,27,28]。
アクティブシステム統合仮説は、現在、宣言的記憶の統合のメカニズムに関する最も重要な理論の一つである。この仮説は、睡眠中の大脳新皮質と海馬の相互作用に焦点を当てている。符号化後の記憶は乏しく、海馬に大きく依存している。より安定した長期記憶を作るために、海馬の表象は睡眠中に繰り返し再活性化される。これらの再活性化は、新しい表象を既存の記憶に統合する大脳新皮質領域を再活性化する。[29]。
宣言的記憶の統合における睡眠の重要な役割は、十分な証拠によって指摘されている。第一に、睡眠の量(特定の睡眠段階の量)が学習や環境の豊かさの後に増加し、その結果として海馬と皮質の可塑性が増加したことである。第二に、睡眠(特定の睡眠段階)は、特定の記憶や学習課題のパフォーマンスを向上させた。最後に、睡眠不足は様々な方法で認知処理を障害し、健康なヒトでは長期増強(LTP)可塑性を誘導する能力を低下させた [30,31]。
哺乳類の睡眠は、急速眼球運動(REM)睡眠とノンレム睡眠(NREM)睡眠の間の周期的な交替で構成されている。レム睡眠は、特に海馬に現れるシータ活動(4-8Hz)とガンマ活動(30-120Hz)が特徴である。NREM睡眠は、光睡眠(N1,N2)と深層睡眠(N3,徐波睡眠-徐波睡眠とも呼ばれる)に分けられる。NREM睡眠のN2段階では、スリープスピンドルと呼ばれる12~15Hzの間の突然の脳の振動的な活動のバーストを表示する特徴的なタラモ-皮質の再活性化がある。N3のNREM睡眠は、1~4Hzの間の遅波と、遅波活動(SWA)を表す1Hz未満の遅振動(SO)によって特徴づけられる[32]。この段階では、海馬と大脳新皮質の間の相互作用が起こる。[33]。最後に、N3 NREMでは、高周波振動(120-200Hz)として見られる高度に同期したスパイクの断続的なパターンである海馬の鋭波/リップルも出現する[34,35,36]。これは海馬の記憶表象の再活性化を表し、エピソード記憶の認知バイオマーカーとして提案されている[37]。睡眠紡錘体は、その発生が遅い振動によってしばしば不明瞭になるN3睡眠中にも発生する[38](要約は図1を参照)。
図1 記憶の統合における睡眠の役割
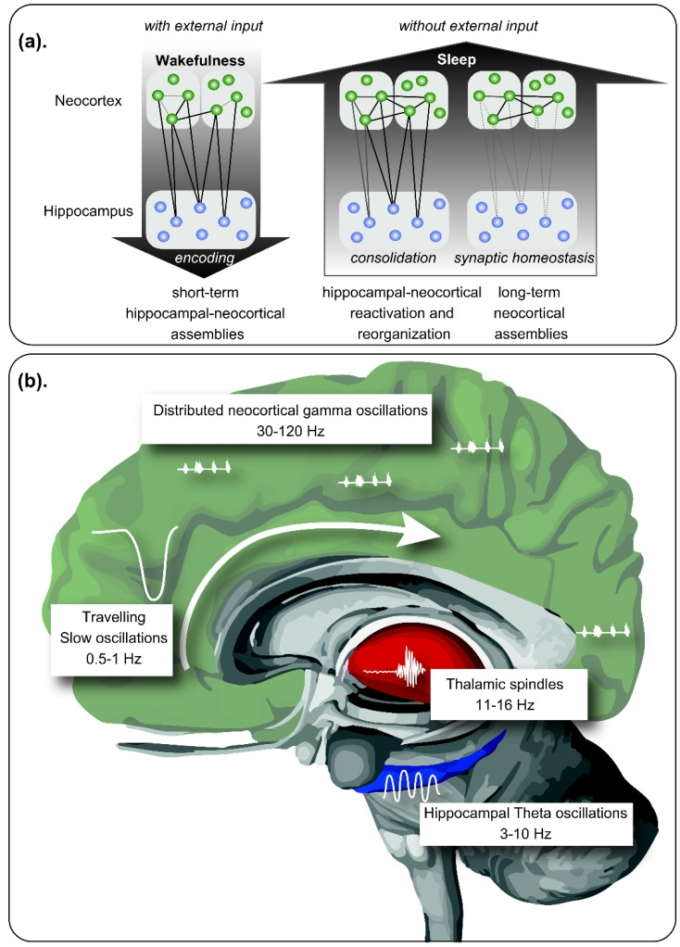
(a) 醒時には、大脳新皮質と海馬形成に分布するニューロン集合体によって新しい記憶がコード化され、文脈情報が統合される。睡眠時には、外部からの入力がない場合、記憶の再編成が行われ、海馬-大脳皮質回路と視床皮質回路の再活性化によって、いくつかのニューロン集合体が強化される。神経可塑性は、弱い記憶の痕跡の消滅とともに、より強い海馬に依存しない大脳皮質接続の強化を可能にする。
(b) 層的に結合した神経振動が睡眠中の記憶処理を可能にする。睡眠中の神経振動は、非高速眼球運動(NREM)睡眠中に皮質領域を伝播し、脳波の方向に沿ってアップステートとダウンステートを示する。ダウンステートの間はニューロンの休息が観察され、アップステートの間は、視床に由来する睡眠紡錘体と相まって、以前のニューロンの集合体のリプレイを伴う高度に同期した放電が観察される。レム睡眠は、大脳新皮質内に分布するガンマ株活動と相まって、他の構造物の中でも特に海馬形成部で顕著なシータ波が特徴である。この期間には、場所細胞とグリッド細胞はリプレイを示し、文脈記憶の統合を可能にする。Born and Wilhelm (2012) [42]より改変。
NREM睡眠中の相互作用とこれらの振動のタイミングは、海馬、大脳新皮質、および他の構造物間の正しいコミュニケーションにとって重要である。正確なタイミングは、視床紡錘体が正しいSO位相と結合することを可能にする。特定のSO-スピンドルのカップリングは、その後、シナプス可塑性を促進し、統合を強化するが、間違ったタイミングでのカップリングは、記憶形成を低下させる。同時に、海馬の鋭波/リップルはスピンドルとタイミングを合わせる必要があり、これはスピンドルとリップルのカップリングをもたらす。したがって、これらの波の正しいタイミングと特性は、再活性化された海馬の情報(波紋)が視床(紡錘体)を経由して大脳新皮質(SO)に伝達されることを可能にする。このプロセスは、情報を長期記憶として保存するシナプス統合プロセスを促進する[39]。
最後に、レム睡眠は大脳辺縁構造内のシータ活動の分布を示すことから、特に感情的な記憶を処理すると考えられている。さらに、レム睡眠は、シータ振動とガンマ振動の間の特徴的な結合により、作業記憶と空間記憶の統合にも重要であると考えられている[40]。この観点から、レム睡眠は、以前にNREM睡眠中に統合された記憶痕跡の統合と再結合を媒介すると考えられる[41]。
3. 睡眠障害における睡眠と記憶
睡眠は記憶の定着に重要であるため、睡眠が乱れると記憶障害を引き起こす可能性がある。ここでは、不眠症と閉塞性睡眠時無呼吸症候群(OSA)について簡単に説明する。不眠症と閉塞性睡眠時無呼吸症候群(OSA)は、睡眠時間の短縮、睡眠構造の変化、および/または断片的な睡眠の生成によって、睡眠に関連した記憶の統合に影響を与えることが示されている[43]。
3.1. 不眠症
不眠症は、日中の障害に関連した睡眠の開始または維持の困難、または早朝の覚醒と定義される。[43]。ヨーロッパでの有病率は5.7%~19%であり[44]、慢性型の不眠症は心血管疾患[45]、うつ病[46]、および認知機能障害[47]のリスクの高さと関連していた。これらのリスクは、24時間あたりの睡眠時間が7時間未満と定義される短い睡眠時間を示す患者で高くなっていた。さらに、不眠症は多発性硬化症、てんかん、アルツハイマー病などの他の障害を伴うことが多いだけでなく、それらの症状を悪化させる可能性もある[48]。
冒頭で述べたアルツハイマー病に関連する脳領域の体積変化に加えて、不眠症患者では、視床下部、視床、上行網室活性化系、島皮質、扁桃体、海馬、前帯状皮質および内側前頭前野の活動の低下が見られた。不眠症における覚醒系の過活動と感情・認知系の調節障害を示唆する所見である[49]。
不眠症患者はまた、徐波睡眠とレム睡眠の両方の量の減少、睡眠段階のシフト、速い脳波周波数、および短時間の覚醒と微小覚醒の頻度の増加を示した[48]。これらの変化、特に徐波睡眠の減少は、睡眠依存性の宣言的記憶の統合の障害を引き起こした[50]。
3.2. 閉塞性睡眠時無呼吸症候群
OSAは、全人口の有病率は9%~38%であり、[51]、年齢とともに増加する慢性睡眠障害である。[52]。OSAは、部分的な(低呼吸)または完全な(無呼吸)上気道閉塞の反復的なエピソードによって特徴づけられ、間欠的な低酸素、高カルビア、および一晩中の覚醒をもたらす。[53]。患者は、前頭前運動回、後頭後感覚回、島皮質および側頭皮質などの領域で皮質の菲薄化を示しており[54]、これは神経細胞の損傷および萎縮を示し、認知機能の低下につながる。
OSA患者は、ベッドでの睡眠時間の割合として定義される睡眠効率の著しい低下を示すことがある。また、入眠後の覚醒度と覚醒指数の上昇を示し、睡眠の断片化につながっていた。[55]。さらに、これらの患者はSWAの時間経過が異なり、徐波睡眠とN2の両方で睡眠紡錘指数が低下し[56]、紡錘頻度が低下していた[57]。
これらの変化は、注意、記憶、実行機能、精神運動機能、視覚空間機能など多くの領域で認知障害を引き起こし[53]、高齢者では軽度認知障害(MCI)や認知症につながる可能性がある[58]。
4. 正常老化における睡眠と記憶の変化
加齢に伴い、睡眠のパターンと構造にいくつかの変化が起こり、その変化は人生の60歳以降に特に顕著であった。ヒトでは、正常な加齢は睡眠相の進行と関連しており、高齢者は頻繁に睡眠相のシフトを示し、早寝早起きと早朝の起床を繰り返している[59,60]。夜間総睡眠時間は、10年間で8-12分のほぼ直線的な減少を示した。[59,61,62,63]。さらに、睡眠効率もまた、60歳以降の10年間で緩やかではあるが連続的な低下を示した[62]。
睡眠段階に関しては、NREM-REM睡眠サイクルは少なく、短くなっていた。加齢は、レム睡眠の割合が直線的に減少し[60,61]、深いNREM睡眠の量が減少し、軽いNREMの持続時間が増加することで補われることを特徴としていた[47,64,65,66]。成人期における睡眠構造のこれらの変化は、2つの異なるメタアナリシスによって確認されており、そのうちの1つは小児期から老年期までの被験者を対象としたものである[61,62]。軽い睡眠が優勢であると、睡眠はより脆弱になり、これは覚醒回数と夜間の覚醒回数の増加、および睡眠開始後の覚醒時間の長さにつながる[62,64]。そのため、睡眠維持が変化し、睡眠の統合性が低下し、断片化が増加した。この夜間の睡眠時間と質の低下は、日中の眠気と日中の昼寝の増加を伴っていた[59]。
睡眠のマイクロアーキテクチャーについては、SWAは中年成人で振幅、密度、平均周波数の重要な減少を示し、62歳以降に特に顕著に悪化する[65,67,68]。また、加齢に伴うN2睡眠紡錘体密度の有意な低下も見られた。Martinら(2013)は、紡錘体の密度と振幅の加齢に伴う減少は、前側の派生でより顕著であったのに対し、持続時間は後側の派生で減少したことを発見した。各紡錘体の特徴は、異なる地形パターンを示すように見えたので、彼らは、この地形特異性が、睡眠の年齢に敏感な変化を局在化するための良いバイオマーカーである可能性を示唆した[69]。
これらの変化は、記憶や学習を含む情動的および認知的処理に影響を与えた。加齢は記憶障害と関連しており、加齢に伴う記憶障害が睡眠障害によって媒介されていることを示唆する十分な証拠があった。単語学習のパラダイムを用いた場合、徐波睡眠の持続時間は、高齢者の睡眠後の記憶の精度を予測した[70]。同様に、SWAの障害の程度は、夜間の睡眠中に記憶の定着が悪くなることを予測し、その結果、翌日の物忘れが多くなることを予測した[71,72]。これらの睡眠組織の変化と認知処理への寄与は、高齢者に見られる認知機能の低下を部分的に説明することができる。
さらに、睡眠障害、特に不眠症と睡眠呼吸障害の有病率は加齢とともに増加した。[73,74,75]. これらの障害は認知障害につながる可能性があり、横断的研究では、不眠症の高齢者は記憶スパン、視覚的および意味的次元の統合、および実行機能タスクにおいて有意に悪い成績を示した[76,77,78]。
5. アルツハイマー病における睡眠障害
アルツハイマー病患者の睡眠障害は以前から知られていたが、以前は神経変性過程の結果と考えられていた。しかし、現在の疫学研究では、アルツハイマー病患者の睡眠障害は通常の加齢に起こる生理的障害をはるかに超えていることが示された[10]。初期の研究では、睡眠の変化は非認知症の人たちよりも認知症の人たちに多く見られることが指摘されている[79]。5634人のアルツハイマー病患者を含むメタアナリシス[2]で指摘されたように、この有病率は14-69%の間で変化した。684人のアルツハイマー病患者を対象とした日本の別の多施設レトロスペクティブ研究では、有病率は21.3%であることがわかった[80]。他の研究では、MCIとアルツハイマー病患者の60%以上が少なくとも1つの臨床的な睡眠障害[3,81]を持っていたことが判明しており、不眠症とOSAが2つの最も一般的なものである。有病率のこれらの不一致は、アルツハイマー病の認知障害が患者が睡眠障害を確実に伝えることを困難にするかもしれないので、多くの研究における睡眠質問票の使用に関連している可能性がある[82]。
最近の研究では、早期発症型のアルツハイマー病患者における睡眠変化の有病率と重症度が高いことが強調されている[2,3]。さらに、睡眠障害は一般的に、より重度の認知症状や神経精神症状の発現などの悪化、生活の質の低下、さらには介護者の負担の増加と関連していた[83,84,85]。Bubuらが実施したメタアナリシスでは、睡眠の変化が認知障害や症候性アルツハイマー病だけでなく、アルツハイマー病を発症する過程にある人の予測バイオマーカーの変化にも関連していることが示された[10]。
アルツハイマー病患者は睡眠/覚醒サイクルに有意な変化を示し、夜間の覚醒回数の増加と夜間睡眠のより大きな断片化を示した。[79]。この夜行性の変化は、主に表層的な睡眠からなるはるかに長い昼間の睡眠で補われた。[86,87]。
睡眠のマイクロアーキテクチャーについても、夜間の睡眠は軽めの睡眠段階に支配されており、徐波睡眠とREM睡眠の割合は有意に低かった[87]。重要なことは、患者を疾患の重症度別に分けた場合、レム睡眠に費やされる時間は、疾患が進行するにつれて減少する傾向があったことである。さらに、認知機能の低下と並行して、徐波睡眠の減少の明らかな進行が観察された[88,89]。これらの変化については、次の章で詳しく分析していきたいと思う。
6. 睡眠がアルツハイマー病の病因に関与する可能性のあるメカニズム
アロイス・アルツハイマー博士は1907年にアルツハイマー病患者の脳に見られる2つの主要な病変、老人性斑と神経原線維のもつれについて説明した[90]。老人斑はほとんどがβアミロイドペプチド(アミロイドβ)で構成されており、これが凝集して沈殿する傾向が強く、この疾患の典型的な斑点を形成していた[91]。一方、神経原線維のもつれは、主にタウと呼ばれる細胞骨格タンパク質が高リン酸化状態(P-tau)で形成されていた。タウが高リン酸化されると細胞骨格が破壊され、神経細胞に取り返しのつかない損傷を与え、神経変性につながるアポトーシス経路が始まる[92]。
6.1. 睡眠呼吸障害とアルツハイマー病との関連メカニズム
前述のBubuら(2017)が実施したメタアナリシスによると、OSAはアルツハイマー病のリスク上昇と最も関連する睡眠問題であった[10]。睡眠の断片化、日中の眠気、有意な心血管系および代謝系の障害と関連していた。さらに、OSAは注意力、エピソード記憶、作業記憶、実行機能など多くの領域で認知機能障害を誘発するため、高齢者のMCIや認知症発症の危険因子である可能性があると考えられた[93]。
アルツハイマー病とOSAはともに有病率の高い慢性疾患であり、両者には重複があることが知られていた。メタアナリシスでは、Emamianらは、アルツハイマー病患者は年齢をマッチさせた認知機能障害のない対照群に比べてOSAを発症するリスクが5倍高いことを明らかにしており[94]、この線では、アルツハイマー病患者の約50%が診断後にOSAを発症することが記述されている[95]。逆に、OSA患者は注意力や記憶力などの実行機能の神経心理学的テストでより悪い結果が得られた。重要なことは、少なくとも1つのAPOEε4対立遺伝子を持ち、したがってアルツハイマー病発症のリスクがあるOSA患者は、この遺伝子を持たないOSA患者よりも低いスコアを示したことである[93]。これに関して、認知的に正常な高齢女性を対象としたプロスペクティブ研究では、重度の睡眠呼吸障害を有する患者は、追跡調査時にMCIまたは認知症を発症するリスクが高いことが示された[47]。さらに、OSAはMCIの早期発症やアルツハイマー病への進行と関連していた。[96]。しかし、約2万人の被験者を対象としたメタアナリシスでは、睡眠関連呼吸障害は男性よりも女性の方が認知機能低下のリスクが有意に高いことが証明されており、このリスクには性差があるように思われる[97]。
最近の研究では、睡眠関連呼吸障害とアルツハイマー病の脳脊髄液バイオマーカーとの関連が見られている。Osorioら(2014)は、認知的に正常な高齢者を研究している間に、ApoE4対立遺伝子を持たないOSA被験者において、脳脊髄液 total-tau t(-tau)、リン酸化タウ、およびアミロイドβの増加を発見した。逆に、OSAを治療すると、これらの被験者は徐波睡眠の増加と脳脊髄液アミロイドβのレベルの低下を示したため、彼らはOSAを治療することでアルツハイマー病バイオマーカーを改善できることを示した[98]。
低酸素に加えて、睡眠構造や睡眠の質の漸進的な悪化、脳の流れの低下などの他の因子が、OSA患者の認知障害や、両方の病態を持つ患者のアルツハイマー病の悪化に寄与している可能性がある[99]。
6.2. 睡眠とアミロイド負荷
これまでの研究では、アミロイドβレベルと睡眠との関係が示されているが、因果関係があるかどうかはまだ議論の余地がある。アルツハイマー病のマウスモデルを用いて睡眠障害を評価した最近の研究では、動物は生後6カ月以降にのみ睡眠の変化を示し、これらの変化は認知行動テストのパフォーマンスと相関していることがわかった[100]。しかし、著者らは、アミロイドβ脳レベルを測定していないとアミロイド病理が現れるまで睡眠障害がなかったという彼らの結論は、病理の出現の推定年齢に基づいていた。逆に、別のマウスモデル研究では、プラークにアミロイドβが沈着する前に、生後3-4カ月で脳波と睡眠構造の両方の変化が現れることが示された[6]。
神経細胞は継続的にアミロイドβを放出するのではなく、代謝活動に応じて放出する。[101,102]。脳脊髄液や血液の代謝は概日的に調節されているため、アミロイドβの濃度は一日を通して周期的に変動している[103,104]。したがって、脳の細胞外空間におけるこのペプチドの濃度は、活動期には増加し、安静時には減少する[105,106]。このことは、マウスモデルを用いて、細胞外空間におけるアミロイドβのレベルが動物の覚醒時間と有意に相関し、睡眠時間とは負の相関があり、NREM睡眠ではより強調されていることを示したKangらによっても実証されている。さらに、睡眠遮断は前日のレベルの明らかな上昇をもたらし、大脳皮質におけるアミロイドβプラークの形成を増加させた[105]。
ヒトの研究では、睡眠遮断は認知的に正常な人の脳脊髄液アミロイドβのレベルを変化させ、これは一晩の完全な睡眠遮断の後に見ることができた[107,108]。さらに、アミロイド沈着のある認知的に正常な高齢者では、アミロイド沈着のない人よりも睡眠の質が悪かった[109]。さらに、減少した断片化された徐波睡眠は脳脊髄液アミロイドβの増加と関連していた[110]。特に興味深いのは、認知的に正常な高齢者を対象としたMander at al. (2015)の研究である。この研究では、著者らは内側前頭前野におけるアミロイドβの蓄積、SWAの減少、海馬依存性記憶統合の変化との間の因果関係を確立しようとモデルを精緻化した[111]。その結果、最良のモデルは、睡眠を媒介とした記憶保持力の低下に対するアミロイドβの蓄積の間接的な影響を反映していることを発見した。この結果は、睡眠上のアミロイドβ沈着の因果関係、および記憶障害上の睡眠の関係を示唆しているだろう[111]。アルツハイマー病では、アミロイドβは内側と外側の前頭前野、後帯状体、前帯状体[113,114]などのNREM 徐波睡眠[112]を生成する領域に蓄積される。興味深いことに、皮質アミロイドβが高い人は、海馬依存性の記憶力が同等に低下していた。[111,115,116,117]。これらの所見は、NREM睡眠がアミロイドβ蓄積とアルツハイマー病の特徴的な海馬依存性記憶喪失との間のリンクであるという結論を導く可能性がある。
それにもかかわらず、いくつかの著者は、睡眠とアミロイド病理との間に双方向の関係があることを指摘している。Holtzmanのグループは、睡眠障害と覚醒度の増加は、アミロイドβの産生の増加とクリアランスの減少につながると推測していた。さらに、一旦アミロイドβが蓄積されると、マウスとヒトの両方で証明されているように、より多くの睡眠の変化をもたらする[118]。一方、Luceyらは、アミロイドβが初期に出現すると、NREM睡眠における遅発振動の発生が阻害されることを提案している。この欠損は、順番に、覚醒依存性のアミロイドβの産生を増加させ、睡眠依存性のクリアランスを減少させ、アミロイドβの堆積を加速させ、その結果、アルツハイマー病の病理学的カスケードを悪化させるだろう[104,119]。
6.3. 睡眠とタウの病理
非常に最近の研究では、タウ病理と睡眠のさまざまな側面との関係を探った。前述のLuceyら(2019)の研究では、アミロイドβだけでなく、タウ病理も認知的に正常な人とMCIを持つ人の睡眠障害と相関していた。著者らはNREM睡眠中のSWAを分析し、アルツハイマー病病理とSWAの間には逆の関係があり、特に研究した周波数の低い範囲(1-2Hz)では逆の関係があることを示した。さらに、彼らはアミロイドβとSWAの間よりもタウとSWAの間のより強い関係を発見し、アミロイドβよりもむしろタウ症が無症候性または軽度の症状のアルツハイマー病における睡眠障害と相関すると結論づけた[119]。Kamら(2019)による別の研究では、NREM睡眠は脳脊髄液アミロイドβ、リン酸化タウ、および総タウの量と相関していた。興味深いことに、3つのうち、年齢、性別、およびApoE4を調整した後、総タウは睡眠紡錘体密度と最も有意に関連するものであった。さらに、紡錘体の持続時間、数、および高速紡錘体の密度もまた、総タウレベルと負の相関を示した[120]。最後に、Holthら(2019)は、実験動物とヒトの両方で、睡眠覚醒周期と睡眠不足が間質液および脳脊髄液中のタウ量に影響を与えることを発見した。さらに、彼らは、睡眠障害がマウスにおける病理学的タウ凝集体の放出と伝播を促進し、ヒトにおける睡眠遮断が脳脊髄液のタウ量の50%以上の増加をもたらすという直接的な証拠を提供した[121]。
アルツハイマー病におけるタウ症は、認知障害の最初の兆候の数十年前にリン酸化タウが現れ、そこから、それは内耳皮質や海馬[122]などの他の記憶に関連する領域に軸索を介して広がって、脊髄局で非常に早く始まるように思われた。そのことを念頭に置いて、Zhuら(2018)は、アルツハイマー病と関連する変異を持つヒトタウタンパク質を発現したトランスジェニックマウスの蝸牛座および海馬におけるタウパシーに対する慢性的な睡眠障害の影響を検討した。今回の研究では、成人期早期の睡眠障害が運動能力の低下を加速させ、脊髄小体部の神経細胞の損失を増加させることを明らかにした。さらに、彼らはリン酸化タウオリゴマーのレベルが上昇していることを発見したが、これは睡眠遮断期間の6カ月後にも観察され、この領域の障害が長く維持されていることを示している[123]。他のマウス研究では、慢性的な睡眠制限がタウレベルを上昇させ、海馬依存性記憶を損なう可能性があることを証明することで、これらの結果を補強している[124,125]。
最後に、SO-睡眠紡錘体結合の障害は内側側頭葉におけるタウ負荷の増加の予測因子ではあるが、アミロイドβ負荷の予測因子ではない可能性があり、一方、1Hz未満のSWAの振幅の減少はアミロイドβ負荷の予測因子である可能性があることが最近提案されている[126]。
まとめると、睡眠異常はアミロイドβとタウの両方を増加させ、これらの病理学的タンパク質が睡眠障害を誘発する可能性があることを支持するエビデンスがあった。したがって、これら2つのプロセスの間に生じる双方向の役割または正のフィードバックを強調することが重要である。
6.4. 睡眠とグリンパティック系
間質空間内での小代謝物やその他の分子の輸送は、アミロイドβやタウなどの神経毒性を持つ可能性のあるペプチドのクリアランスを決定した。脳脊髄液は間質液と物質を交換することで、細胞活動の産物を排除していた。この経路を用いた睡眠は、神経代謝に由来する複数の潜在的に有毒な廃棄物物質を除去するという重要な機能を有していた可能性が高く、これが睡眠の回復能力を説明している可能性がある[127]。
それにもかかわらず、過去10年の間に、睡眠とアミロイドβなどの物質の沈着との関係をよりよく説明する試みとして、溶質クリアランスのための新たな経路が提案されている。Iliffのグループは、マウスを用いて、傍脈性ドレナージによる間質液のクリアランスを可能にする傍脈性経路を最初に記述した[128]。中枢神経系では、血管は水チャネルアクアポリン-4を発現するアストロサイトポッドサイトに囲まれていた。AQP4を欠損したマウスは、この傍脈系を介した脳脊髄液流入が減少し、間質性アミロイドβクリアランスが減少していた。リンパ系との類推の結果、このメカニズムは「グリンパティック系」と呼ばれた。
グリンパティック系の活動は、覚醒した脳よりもむしろ睡眠中の脳の重要な特徴であるように思われた。したがって、このような血管傍流の変化が、げっ歯類とヒトの両方で観察された細胞外および脳脊髄液のアミロイドβレベルの概日変動の根底にある可能性がある[129]。Xieら[130]は、覚醒マウスと生理的睡眠または麻酔によって誘発された睡眠状態のマウスを比較した研究において、アミロイドβは覚醒時よりも生理的睡眠または麻酔時の方がより効率的に(2倍の速度で)除去されることを発見した。さらに、覚醒状態では脳間質空間の減少があることを証明した。これらの著者らは、覚醒時の間質空間の収縮により、間質液の流れや脳脊髄液の侵入に対する脳組織の抵抗が増大しているのではないかと仮説を立てた。さらに、覚醒マウスにアドレナリン拮抗薬を投与すると、睡眠時や麻酔時と同程度のレベルでトレーサーの脳脊髄液への流入量が増加し、間質の容積も増加することから、この変化はアドレナリン作用によるものではないかと考えられた。しかし、高齢マウスではグリンパティック系機能が80-90%低下していることから明らかなように、加齢とともにグリンパティック系活性は急激に低下するようである[131]が、ヒトへの外挿にはさらなる証拠と実験が必要である。
これらの結果に基づいて、多くの研究者がこの睡眠、代謝物クリアランス、およびアルツハイマー病の発症を結びつける新しいメカニズムに注目している[127,129,132,133,134]が、反対の意見や批判的な意見もある[135]。
7. アルツハイマー病における睡眠関連バイオマーカーの提案
現在、脳脊髄液のアミロイドβ値とタウ値の評価がアルツハイマー病のゴールドスタンダードなバイオマーカーとなっている。しかし、これは腰椎穿刺を必要とし、不快な手順であるだけでなく、侵襲性もある。このため、信頼性の高い非侵襲的な新しいバイオマーカーを調査することが重要であり、いくつかの特異的な睡眠異常が良い候補となり得る。
前述したように、睡眠段階は、記憶処理、神経細胞の休息、および恒常性の維持に関連する特定の振動活動によって特徴づけられる。したがって、有用な新しいバイオマーカーの探索においては、特定の振動パターンに現れる変化と、それらのゴールドスタンダードバイオマーカーとの関係を分析することは興味深いことである。
7.1. 一般的な脳波の特徴
アルツハイマー病患者における初期の研究では、覚醒およびレム睡眠時の後頭部EEG(9.40Hzから6.40Hzまで)の鈍化、静かな覚醒状態または睡眠中の発作的な鋭い波の発生、および「不十分に形成されているか、または存在しない」紡錘体活動が実証された[88]。一般的に、深い睡眠の減少、覚醒の増加、および脳波活動の漸進的な鈍化は、正常な加齢に見られたが、アルツハイマー病患者では顕著に強調された。
7.2. NREMにおけるSWA
健康な高齢者における研究では、SWAの減少とSWAの破壊の両方が脳脊髄液アミロイドβの上昇と関連していることがわかった[99,110,136]。同様に、Manderら(2015)は、NREM睡眠SOがアミロイドβの沈着と相関していることを観察した。アミロイド病理とNREM睡眠障害との関連がMCIやアルツハイマー病だけでなく、前臨床段階の高齢者でも発生していたことを考えると、著者らはNREM睡眠における<1Hzの徐波動性活動指数の低下が、前臨床アルツハイマー病の新たなバイオマーカーを構成する可能性があると提案した[111]。具体的には、N3徐波振動の減少は脳脊髄液アミロイドβ42の上昇と関連しており[99,110]、睡眠ポリグラフ中の徐波活動の中断は脳脊髄液アミロイドβ40の上昇を誘導していた[136]。前述のOsorioら(2014)の研究は、認知的に正常な高齢者を対象とした研究で、ポリソムノグラフィと脳脊髄液測定値を組み合わせてバイオマーカーを探索する際に有用な客観的尺度を提供した[98]。彼らは、脳脊髄液のアミロイドβ42レベル、徐波睡眠持続時間、および他の徐波睡眠パラメータの間に有意な逆相関があることを発見した。特に、年齢とApoEの状態をコントロールした場合、前頭電極の総SWAは脳脊髄液アミロイドβ42レベルの低下の最も良い予測因子であった。驚くべきことに、彼らは脳脊髄液アミロイドβ42と総睡眠時間やN1,N2,レム睡眠の時間との間に相関関係を見いだせなかった。したがって、減少した断片化された徐波睡眠は脳脊髄液アミロイドβ42のレベルが高いことと相関していた。これらの知見に照らして、著者らは、アミロイド沈着に先立って可溶性アミロイドβレベルが上昇することから、乱れた深層睡眠が病態と因果関係を持つ可能性を示唆している[110]。
一方、Luceyらは、無症候性または軽度のアルツハイマー病において、SWA、特に1-2Hzの周波数について、アミロイドβよりもむしろタウとの間に強い逆相関があることを発見した。そこで著者らは、NREMにおけるSWAの減少はアルツハイマー病の初期のバイオマーカーである可能性があり、その測定が侵襲的な技術を必要としないことを考えると、アルツハイマー病の病理の進行と治療に対する反応をモニターするのにも役立つ可能性があることを提案した[104]。
7.3. その他の可能性のあるバイオマーカー
認知機能の正常な高齢者を対象とした最近の研究では、N2睡眠時の紡錘体密度と脳脊髄液の総タウ、リン酸化タウ、アミロイドβとの間に有意な負の相関があることが明らかになった。この相関は特に総タウと総タウ/アミロイドβの比と同様に強いものであった。それにもかかわらず、脳脊髄液のタウ測定は総睡眠時間や睡眠の質とは相関しなかった[120]。したがって、N2の紡錘体密度はアルツハイマー病バイオマーカーとして別の候補となりうる。
一方、SO測定はアミロイドβと非常によく相関していたが、特に内側側頭葉におけるタウの最大の蓄積を予測したのはSO-Spindle結合であった[126]。SO-スピンドルのカップリングが睡眠依存性の海馬記憶処理[137]に関与していたことを考えると、アルツハイマー病関連の認知機能低下への貢献は驚くべきことではなかった。
ヒトアミロイド前駆体タンパク質(h-APP)を持つトランスジェニックマウスを用いた研究では、正味のシータパワーやガンマパワーに差は見られなかったが、シータ-ガンマ結合は劇的に減少していることが判明した[138]。他の研究では、ガンマ結合のさらなる変化が証明されている。[139]。しかし、シータ結合とシータ・ガンマ結合が優勢なヒトのレム睡眠では、これまで同様のデータは報告されていない[140]。レム睡眠の中断がMCIやアルツハイマー病患者のMini-Mental State Examinationのスコアを悪化させると予測されているように、ヒトでこれらの問題を評価することは価値があるだろう[141,142,143]。
最後に、グリンパティック系に関与する分子は、アルツハイマー病の病理学における将来の睡眠関連バイオマーカーの研究のもう一つのラインとなり得る(表1)。
表1 可能性のある睡眠バイオマーカーの現在の証拠とゴールドスタンダードのアルツハイマー病バイオマーカーとの関連

8. 睡眠振動活動はアルツハイマー病のための良いバイオマーカーになり得るか?
アルツハイマー病の診断のための良いバイオマーカーを確立するための基準には、以下が含まれる:疾患の病態生理学的プロセスを反映すること;アルツハイマー病に対して高い感度と特異性を示すこと;薬理学的介入に反応すること;そして再現性があり、非侵襲的であり、安価であり、迅速であること[144]。したがって、特異的な睡眠変化は、アルツハイマー病に関連する病理学的な脳プロセスを反映しているので、すなわち、アミロイドβとタウレベルに相関するので、良い候補になるかもしれない。優れたバイオマーカーは、アルツハイマー病の2つの主要な病理学的シグネチャーであるアミロイドβとリン酸化タウと独立して相関しなければならないことを強調することが重要であり、それはこれらの睡眠変化の場合である。さらに、これらの評価は再現性があり、非侵襲的で、費用対効果の高いものであり、携帯用機器の開発により、ポリソムノグラフィーは患者がどこにいても実行できる非複雑な技術となっている。
それにもかかわらず、アルツハイマー病に対する感度と特異性はまだ分析されておらず、また薬理学的介入に関連した変化も分析されていない。最近の研究では、一般的なデータや睡眠マイクロアーキテクチャの視覚的な分析よりも、特定の振動パターンを研究することの有用性の方が高いことが指摘されている。睡眠を助けるために使用されている現在の薬剤は、これらの特定のパラメータを改善するように設計されていないため、このような介入に対する睡眠に関連する可能性のあるバイオマーカーの反応を評価するためには、より多くの研究が必要である。
さらに、多くの神経学的および精神医学的疾患は睡眠障害を呈している。したがって、より高い特異性に到達するためには、アルツハイマー病でのみ発生する睡眠振動のマイクロアーキテクチャの変化を検出することが鍵となる。このような詳細は、アルツハイマー病の動物モデルでよりよくコントロールされ、ヒトでの研究でさらに検証される可能性がある。さらに、アルツハイマー病は女性の方が有病率が高いことを考えると、睡眠研究のデザインは睡眠パラメータの性差を考慮しなければならない。
これらの障害が克服されれば、睡眠関連バイオマーカーは、疾患の重症度や認知機能の低下とよく相関しているように思われるため、認知機能の低下した患者のアルツハイマー病の診断をサポートするツールとして、また疾患の進行を評価するツールとして有望な役割を持つことができる。
9. 結論
睡眠の変化は、正常な老化とアルツハイマー病の両方で発生し、彼らは総睡眠時間、レム睡眠、および深いNREM睡眠(徐波睡眠)の減少、および睡眠の断片化の増加と光NREM相に費やされた時間の増加が含まれている。しかし、いくつかの特定の振動パターン(SWAおよび紡錘体密度の減少、およびシータ-ガンマ結合と同様に低速振動-睡眠紡錘体結合の障害)は、アルツハイマー病神経病理学のバイオマーカーの増加と関連している。証拠は、睡眠異常とアミロイドβとタウの負担との間の双方向の関係を支持しており、睡眠障害はアルツハイマー病の原因と結果の両方であるかもしれないことを意味している。それにもかかわらず、これらの関連性については、特にグリンパティック系が睡眠とアルツハイマー病を結びつける可能性のある新たな経路として記述された後、まだ多くのことを学ぶ必要がある。最後に、睡眠障害に関連した特定の振動パターンは、疾患の早期診断や進行の追跡に役立つバイオマーカーとして良い候補となるようであるが、臨床現場で有用なバイオマーカーとして検討する前に、より多くの研究が必要とされている。アルツハイマー病と睡眠障害に関連する主な特徴をまとめた模式図を図2に示する。
図2 アルツハイマー病における可能性のある睡眠バイオマーカーをまとめた模式図
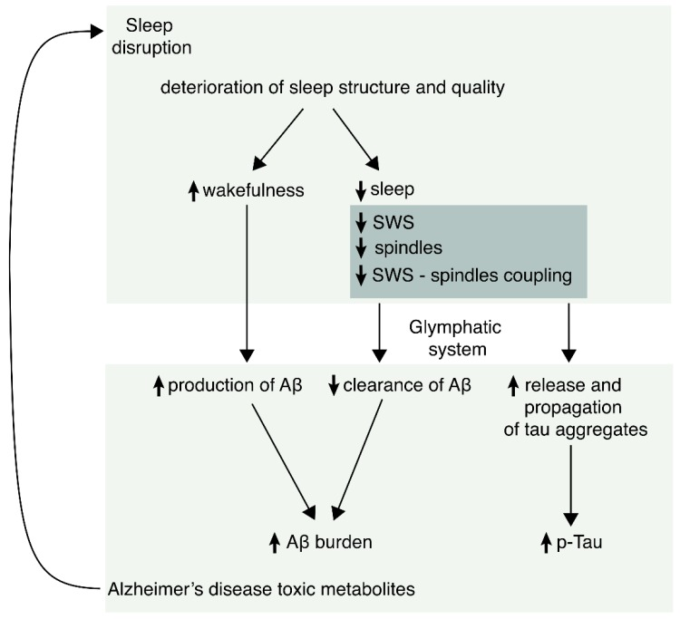
実験的証拠は、睡眠障害がアルツハイマー病の初期に現れることを示唆している。睡眠異常は、病的なタウとβアミロイドペプチド(アミロイドβ)のより多くの形成を誘発する。同様に、アミロイドβとP-tauの両方が睡眠障害を誘発し、正のフィードバックプロセスを生成する。
