Contents
Gut-Muscle Axis Exists and May Affect Skeletal Muscle Adaptation to Training
オンラインで公開2020年5月18日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7285193/
カタルジナ・プシェフウォッカ、1 マルチン・フォルワルスキー、2 カロリナ・カチュミエルチャク=シエデレッカ、3 カロリナ・スコニエツナ=ジデッカ、4 ヤン・ヤチェク・カッチョル1,※1
要旨
過度のトレーニングは、慢性的な酸化ストレスと炎症によって、生理学的な筋肉の適応を制限する可能性がある。不適切な食事や過度のトレーニングは、腸の恒常性を乱し、結果的に炎症を促進する可能性がある。これらの要因を総合すると、腸内生態系のバランスが崩れ、免疫系の調節障害を引き起こす可能性がある。したがって、免疫系を調節し、酸化ストレスを軽減することができる腸内細菌叢の組成を最適化することが重要であると考えられる。さらに、最適な腸内マイクロバイオータ組成は、筋肉のタンパク質合成やミトコンドリアの生合成・機能、筋肉のグリコーゲン貯蔵にも影響を及ぼす可能性がある。Aproperlyバランスのとれたマイクロバイオームはまた、さらに高分子損傷を減衰させる可能性がある炎症性マーカーと活性酸素種の産生を減らすことができる。その結果、プロバイオティクスの補充は、有酸素性と嫌気性のパフォーマンスにいくつかの有益な効果を持っている可能性がある。腸-筋軸の現象は、アスリートだけでなく、機能維持のためにも継続的に探究していく必要がある。
キーワード
腸内細菌叢、アスリート、筋機能、腸-筋軸
1. はじめに
腸内細菌叢は、消化管内に生息する微生物で構成され、その数は推定で1014個を超える。微生物相のゲノムサイズはヒトゲノムの150倍を超えており、ヒトの全細胞の約10倍以上の細菌細胞を網羅している[1,2]。腸内マイクロバイオータの生物多様性と全体的な構成は、ヒトの体内で正常な恒常性を維持する上で重要な役割を果たしている。細菌は腸内マイクロバイオータの中で最も豊富な集団であり、1000種以上の異なる細菌種が観察されている。ヒトの腸内細菌叢は主に4つの系統で構成されている。Firmicutes、Bacteroidetes、Proteobacteria、およびActinobacteria [2]。これらの細菌叢のバランスが崩れると、消化管の微小生態学的環境が変化し、様々な疾患の発症に寄与すると考えられている。腸内細菌は多くの機能に関与しており、宿主の栄養状態、代謝機能、免疫系の成熟、上皮細胞の成熟に影響を与えることが示されている。さらに、これらの細菌は病原体から保護し、脳機能に影響を与える可能性がある[3,4]。さらに、腸内細菌叢の構成は個人差があり、遺伝的背景(程度は低いが)年齢、性別、居住地、薬物投与などのいくつかの要因によって変化する可能性がある[5,6]。しかし、食事と身体活動のレベルは、生物多様性を変更したり、確立された腸内細菌叢内の特定の細菌種のレベルを変更するための主な決定要因である[7]。
適度な身体活動は、人体に多方向の有益な効果をもたらす。トレーニングによる刺激は、生理学的および代謝的な適応を引き起こす。骨格筋の主な変化としては、ミトコンドリアの生合成の増加とその機能の強化、基質輸送タンパク質の濃度、代謝経路に関与する酵素の活性、筋肉内のグリコーゲン貯蔵などが挙げられる[8]。定期的な運動の結果、筋タンパク質合成はトレーニングの強度に応じて変化しながら強化される。これは、物理的および化学的メカニズムによって制御されている[9]。簡単に言えば、シグナル伝達経路には、タンパク質のターンオーバーと遺伝子発現に対する短期的な変化だけでなく、細胞内の代謝に対する長期的な変化が含まれている。さらに、哺乳類のラパマイシンキナーゼ(mTOR)の活性化は、開始基質のリン酸化と同化のためのトランスレーショナルシグナルの促進を介して、筋タンパク質合成を増加させるために重要な役割を果たしている[9]。しかし、過剰な運動は、炎症や栄養制限、酸化ストレスや代謝ストレスを促進し、筋肉の構築を制限し、筋肉量の純損失を引き起こす可能性があることに注意する必要がある。このシナリオでは、過剰な運動は筋萎縮経路の活性化につながり、核内因子κB(NF-κB)またはフォークヘッドボックスO(FOXO)のレベルをそれらのリン酸化形態で増加させる可能性がある[10,11]。
複数の研究により、適度な身体活動が腸内細菌叢に有益な効果をもたらすことが示されているが、腸内細菌叢が大規模なトレーニングに対する筋肉の適応に影響を与えるかどうかは不明である。最近の研究では、プロスポーツ選手の過度の運動が腸内細菌叢の恒常性を乱す可能性があることが示された[12]。具体的には、大量のトレーニングは、酸素と栄養素に対する筋肉の要求量の増加と関連していた。さらに、腸管血流の長期的な悪化は、一時的な虚血を引き起こし、粘膜の機能不全や腸管透過性の上昇につながることが示されている[13]。その結果、日和見病原体やそれに関連した毒素の増殖を促進することで、マイクロバイオータプロファイルの大幅な変化が観察された。その結果、日和見性病原体とそれに関連した毒素の増殖を促進し、血流中への病原体や細菌毒素の移動を促し、局所的および全身的な炎症経路を活性化させる可能性があった[14]。これらの研究から、腸内の健康なマイクロバイオームの維持がトレーニングに対する筋肉の適応に影響を与えることは明らかである。具体的には、炎症性経路、同化・異化プロセス、栄養素の利用可能性と代謝産物生産の調節を調節することで、マイクロバイオータが間接的な役割を果たしている可能性がある。
2. 食事・運動・マイクロバイオータの関連性
食事の構成と質は、アスリートの運動能力に大きく影響する。タンパク質合成の最適化、運動時のエネルギー備蓄量の増加、トレーニング後の再生能力の向上、怪我のリスクの低減には、十分なエネルギー、マクロ栄養素、微量栄養素の摂取が不可欠である。エネルギー摂取不足は、スポーツにおける相対的エネルギー欠乏症(RED-S)と呼ばれる複数の負の結果をもたらす[15]。内分泌系や免疫系の障害、筋グリコーゲンの貯蔵不足、マイクロバイオームの不均衡などにより、スポーツのパフォーマンスを損なう可能性がある[16]。このように、炭水化物、脂肪、およびタンパク質の摂取、ならびに健康な腸内マイクロバイオームの保全は、アスリートの運動能力を維持するために不可欠である。
骨格筋の主な間接的なエネルギー基質として、炭水化物とそのグリコーゲンとしての貯蔵は、有酸素運動と無酸素運動の両方の間の適切な筋肉機能に明確な役割を持っている。具体的には、炭水化物をグリコーゲンとして保存する個人の能力は、ミトコンドリアの生合成と機能に影響を与えるだけでなく、トレーニング耐性に関与するシグナル伝達経路の特定のレギュレータとして機能することが示されている[17,18]。腸内細菌はまた、炭水化物の調節を通して運動能力を維持する役割を持っている。腸内細菌は、未消化の断片から短鎖脂肪酸(SCFAs)を生成するために炭水化物の大腸発酵を促進する。SCFAsは、代謝機能の向上や腸管上皮膜の強化など、宿主生物に複数のプラス効果をもたらすことを特徴としている[19,20]。さらに、炭水化物摂取量を減らす食事は、脂肪消費量の増加との関連性から、運動能力への負の影響と関連している。
脂肪含有量の高い低炭水化物食は、高炭水化物食とは対照的に、運動経済性を損ない、ワークアウト誘発性の有酸素性フィットネスの成長を阻害する[21]。さらに、過剰な脂肪摂取はまた、SCFAsの産生に基質を制限する腸内マイクロバイオータの組成に大きな影響を与える可能性がある。動物実験では、炎症性サイトカイン合成を誘導する細菌の数が増加すると、血漿リポ多糖類(LPS)の含有量が増加するだけでなく、NF-kBの発現が増強され、炎症性の遺伝子をオンにすることと関連していることが示されている[22]。また、高脂肪食は細菌株の多様性とバクテロイデスの豊富さを減少させ、FirmicutesとProteobacteriaの増殖を促進する[23]。さらに、硫酸還元菌の増加も実証されている。これらの細菌は硫化物を産生し、粘液中のジスルフィド結合の減少や、ゲップレット細胞から分泌されるゲル形成性高分子蛋白質ネットワークMUC2の破壊につながる可能性がある。これらの変化は、粘膜の再生と粘液層の安定性に重要な役割を果たしている。粘膜バリアの障害は、腸管粘膜の炎症を悪化させ、炎症性疾患を促進する可能性がある[24]。これらの観察はすべて、主に飽和脂肪と加工食品を含む高脂肪食の場合に報告された。しかし、オメガ3酸と共役リノール酸(CLA)の場合には、好ましくない変化は見られなかった。それらの消費は酪酸合成とバクテロイデテス/フィルミキュートス比を増加させた[25]。
十分なタンパク質の摂取は、肥大と筋力を助長するトレーニングプロセスへの筋肉の適応を最大化するために不可欠である[26]。しかし、過剰なタンパク質摂取は、クロストリジウム、デスルフォビブリオ、ペプトストレプトコッカス、アシダミノコッカス、ヴェイロネラ、プロピオニバクテリウム、バチルス、バクテロイデス、ブドウ球菌などのタンパク質発酵菌、プロテオバクテリア科の他の種の増加を引き起こす[27]。また、Bacteroides、Lactobacillus、Bifidobacterium、Prevotella、Ruminococcus、Roseburia、Faecalibacteriumなどの炭水化物発酵菌の減少と関連していた[28,29]。大腸での未消化のタンパク質残基の発酵は、アンモニア、生体アミン、インドール化合物、およびフェノール類などの副産物の生産を伴い、腸、代謝、免疫学的および神経学的機能に有害な影響を及ぼす可能性がある。これらの化合物は、炎症反応を悪化させ、組織の透過性を高め、胃腸症状を激化させる可能性がある[30]。タンパク質の過剰消費は、より高い炭水化物の摂取、特に腸内細菌にとって好ましい基質である難消化性多糖類によって相殺される可能性があるようである[30]。
適度なトレーニングは、消化管に生息する細菌種の多様性に有益な効果をもたらす。様々なアスリートのマイクロバイオームは、タンパク質や炭水化物の代謝やSCFAsの産生に関与する細菌遺伝子の高い多様性や増加レベルと相関している[31,32]。また、サイクリストを対象とした研究では、炭水化物代謝に関わる細菌の活性が高いことが運動頻度と相関していることが示されている。さらに、プレボテラ菌の増加は、リジン生合成、アラニン、アスパラギン酸、グルタミン酸の代謝、d-グルタミン、d-グルタミン酸の代謝などのアミノ酸代謝経路や、炭水化物代謝にもプラスの影響を与えることが示された。また、ハイパフォーマンスアスリートでは、メタノブレビバクター・スミチイ科のメタン産生菌の割合が多いほど、エネルギーの過剰産生や炭水化物代謝に関連していた[33]。Durkらが行った研究では、最大酸素摂取量(VO2max)で表されるトレーニングレベルとFirmicutes/Bacteroidetes比との間にも正の関連性があることが明らかになった[34]。炎症性の観点からは、トレーニングによって誘発される腸内マイクロバイオーム組成の変化は宿主の健康に有益であるように思われる。また、定期的な運動は、神経保護効果を高めることで脳機能をサポートする可能性がある。トレーニングの結果、毒性代謝物であるトリプトファン-キヌレニンを神経保護効果のあるキヌレニン酸に変換するキヌレニンアミノトランスフェラーゼの遺伝子発現が増加した。また、腫瘍壊死因子α(TNF-α)などの炎症性サイトカインも、キヌレニンの毒性キノリン酸への分解を促進することが示されている[35]。また、最適な腸内微生物叢構成は、炎症を調節したり、トリプトファンの代謝に影響を与えたりすることで、脳の機能やうつ病の予防にも良い影響を与えているようである。これらはいずれも、間接的にフィジカルトレーニングの質に影響を与える可能性がある[36]。
前述したように、過度のトレーニングは、腸虚血、腸管バリア透過性の亢進、酸化ストレスの上昇を介して微小生態学的不均衡を導入する可能性がある。これは炎症反応の悪化につながり、その結果、筋肉機能の低下とともに異化作用の増加につながる。また、ペプトストレプトコッカス、ブドウ球菌、ペプトニフィルス、アシダミノコッカス、フソバクテリウムなどの潜在的に有害な細菌が増加し、バクテロイデス、フェカリバクテリウム、コリンセラ、ローズブリアなどの抗炎症性の種が減少することも悪影響を及ぼす可能性がある。このことは、長時間の生理的ストレスを受けた兵士の便を分析したKarlらの研究[37]で明らかになった。彼らは、腸内マイクロバイオータ組成、生活習慣、骨格筋機能との間に間接的な関係を示した。これは、腸-筋肉軸の仮説を支持し、マイクロバイオータアスリートのためのターゲット療法の必要性を示している。
フィジカルトレーニング中には、骨格筋の負荷が高まることで活性酸素(ROS)が過剰に生成される。活性酸素の発生は、脂質やタンパク質の過酸化、筋肉細胞膜のコンポーネントの混乱を引き起こし、すべて一緒に結果的に筋肉の機能を乱す[38]。したがって、トレーニングの過負荷と身体活動の欠如、および不動化の両方が酸化ストレスを増加させる[39,40]。一方、定期的なトレーニングは抗酸化酵素の適応をもたらし、スーパーオキシドジスムターゼ(SOD)、カタラーゼ(CAT)、グルタチオンペルオキシダーゼ(GPx)の活性を高める。また、フリーラジカルによるダメージを軽減し、抗酸化力を高め、活性酸素によるダメージを修復する酵素の活性を高める[41]。これらの知見は、Malekiらが実施した研究でも裏付けられている。彼らは、レクリエーショントレーニングを行っている参加者の精液では、活動的でない参加者やプロのアスリートと比較して、SODとCAT活性が高く、活性酸素レベルが低いことを実証した[42]。同様の観察を行った Brinkmann らは、中程度の強度のエクササイズを行うと、骨格筋でより高い SOD と GPx 活性が誘導されることを報告している [43]。また、活性酸素の産生は、PGC-1αタンパク質を活性化することで、有酸素運動のポテンシャルにプラスの影響を与えることが示されている。活性酸素はミトコンドリアの生合成を増加させ、結果として有酸素能力の向上につながる[44]。これまでの研究では、活性酸素がミトゲン活性化プロテインキナーゼ(MAPK)活性に影響を与えることで筋タンパク質合成を調節し、それがプロ蛋白質代謝性インスリン様成長因子1(IGF-1)をサポートしていることが示されている[45]。また、最近では、抗酸化物質の過剰な補給がチトクロームc酸化酵素やクエン酸合成酵素の量を減少させ、電子輸送鎖(ETC)機能を損なうことも示唆されている[44]。
腸内マイクロバイオームもまた、酸化ストレスの低減に寄与する可能性がある。いくつかの細菌株は、様々なメカニズムを介して抗酸化特性を有する。これらには、抗酸化酵素の発現、プロ炎症性サイトカインまたは病原体の存在によって引き起こされる炎症の調節、および抗酸化物質のより大きな吸収による代謝調節が含まれる[46]。具体的には、ラクトバチルス・プランタラム(Lactobacillus plantarum)ラクトバチルス・ガセリ(Lactobacillus gasseri)ラクトバチルス・フェルメンタム(Lactobacillus fermentum)ラクトコッカス・ラクティス(Lactococcus Lactis)ストレプトコッカス・サーモフィルス(Streptococcus thermophilus)などの細菌種がSOD活性を増加させることができることを示す研究もある[47]。さらに、ラクトバチルス属、ラクトコッカス属、およびビフィドバクテリウム属は、すべて腸内グルタチオン(GSH)レベルを上昇させることが示されており、これはヒドロキシルラジカル(OH*)の消去に重要な役割を果たしている[47]。同様に、動物実験では、微生物相が大腸菌と腸球菌に富んでいる一方で、乳酸菌に乏しい個体は、酸化ストレスに対する感受性が高いことが実証されている[48]。Martatelliらはアスリートを対象とした試験を実施し、ラクトバチルス・ラムノサスとラクトバチルス・パラカセイのプロバイオティクス種の補充は、高強度運動への反応として血漿抗酸化レベルを増加させ、活性酸素の発生を中和したことを示した。また、プロバイオティクス種の補給は、4週間の集中的な運動トレーニング期間の後、血漿反応性代謝物レベルの低下と血漿生物学的抗酸化能の上昇と関連していた[46]。全体的に、これらの知見は明らかに適切な食事、適切な運動レジーム、およびミトコンドリア機能と筋肉の構築を増加させるためのより高いグリコーゲン貯蔵を促進するための健康的なマイクロバイオームのバランスをとることが不可欠であることを支持している。一方で、バランスの取れていない食事、不十分または過剰なトレーニングレジーム、および機能不全のマイクロバイオームは、炎症の増加、酸化ストレス、ミトコンドリア機能の低下、および筋肉の萎縮の可能性に関連している(図1)。
図1 健康/不健康な食事と運動/運動不足の組み合わせによるヒトの骨格筋への作用を示す模式図
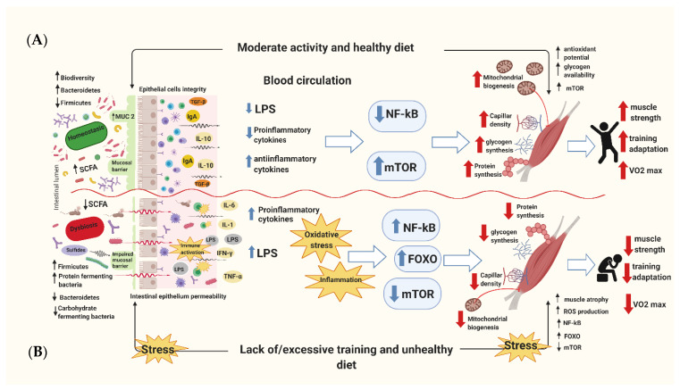
A)適切にバランスのとれた食事と体系的な適度な運動は、酸化ストレスや炎症状態を軽減することで骨格筋機能に恩恵を与える直接的および間接的な効果を示している。その結果、より高い筋グリコーゲン貯蔵量とミトコンドリアの生合成と機能の増加、さらには同化シグナル伝達経路の優位性にシフトし、有酸素運動能力をincrecreasethe。B)逆の効果が観察されるのは、バランスのとれていない食事と、不十分または過度の運動努力の場合である。これは、炎症性および酸化ストレスマーカーの増加、筋グリコーゲンを貯蔵する能力の低下、ミトコンドリア機能の低下、筋肉の萎縮および体脂肪のより高い蓄積をもたらす。
3. アナボリックプロセスと異化プロセスに及ぼす微生物の影響
腸内マイクロバイオームは、いくつかの経路を通じてヒト骨格筋の代謝に影響を与える可能性がある。マイクロバイオータ組成と筋機能との関係に関する証拠は、加齢に伴うサルコペニアの病態に記載されている。筋萎縮は、抗炎症およびプロアナボリックメディエーターを送る種の数の減少と相関していることが指摘されている。サルコペニアは、筋毛細血管の減少、インスリン感受性の低下および炎症の重症度と関連しており、ミトコンドリアの生合成および機能の低下、ならびにタンパク質合成の障害をもたらす[49]。
高齢者のサルコペニアと全身性の衰弱は、腸管機能障害と相関しており、腸管バリア透過性の上昇、血中LPSレベルの上昇、免疫系の活性化、インスリン感受性の低下に寄与している[50]。さらに、動物実験では、乳酸菌株を投与したマウスの筋萎縮マーカー(Atrogin-1,MuRF1,LC3タンパク質、カテプシンL)の減少、および乳酸菌プランタラムを投与したマウスの筋量と筋力の増加が明らかに強調されている[51,52]。さらに、Buiguesらは、13週間の多系統の乳酸菌とビフィズス菌のプロバイオティクス混合物の補充が、高齢者の持久力と筋力を向上させたことを実証した。この研究では、フラクトオリゴ糖とイヌリンを摂取した高齢者は、手の握力と自己申告による疲労度の有意な改善を経験したことが示された[53]。
ホメオスタシスの欠如は、LPSを介した全身炎症の原因となるエンドトキシン性グラム陰性菌の増加と関連していた。また、Escherichia/Shigella、Klebsiella、およびCitrobacter種がLPSプールに有意に寄与していることも注目されている[54]。血清LPSレベルの上昇は、Firmicutes/Bacteroidetesの比率の増加と相関している[55]。その結果、細菌の細胞壁におけるLPSの存在は、TLR4および骨髄分化因子2(DM2)を含む免疫細胞受容体の表面への脂質Aの結合を引き起こす。LPSは、CD14およびDM2と組み合わせてTLR4によって認識され、したがって、プロ炎症性サイトカインの産生において重要な役割を果たすNF-κB活性化を誘導する可能性がある[14,56]。さらに、LPS レベルの上昇は腸内恒常性の崩壊と関連しており、ゾヌリンや脂肪酸結合タンパク質 2 (FABP2) などの血中腸管透過性マーカーの増加と相関している [57]。腸管上皮のこの増大した透過性は、細菌が腸管腔から延髄へと移動し、免疫系を活性化して炎症を促進することと関連している。しかし、ビフィズス菌やコリンゼラ菌などのアクチノバクテリア属細菌は、腸管上皮機能をサポートする抗炎症作用や免疫調節作用を有することが示されていることに留意すべきである。したがって、ビフィズス菌株を含むプロバイオティクスは、物理的ストレスによって引き起こされる炎症反応を減少させる可能性がある[58]。
また、腸内細菌が産生するSCFAは、炎症から腸管バリアを保護し、腸管バリアの完全性にプラスの影響を与えることが実証されている。特に、カンジダ・アルビカンス属は、プロ炎症性TNF-α誘導に関与していることが示されている[59]。腸内毒素特性を持ち、IL-6などの炎症性サイトカインをアップレギュレートするグラム陰性菌の量の増加を伴うことが多い[60]。腸管透過性レベルの上昇とそれに伴う血流への病原体の通過は、IL-1,TNF-α、およびインターフェロンγ(IFN-γ)の分泌を誘導し、プロ炎症作用を引き起こす[61]。また、腸内微生物叢の組成は、トランスフォーミング成長因子(TGF-β)やIL-10などの抗炎症性サイトカインの分泌を刺激することで、炎症抑制に影響を与える。Bacteroides fragilis菌はTLR2を介してIL-10を産生し、Th17リンパ球の増殖を抑制することが証明されている[62]。乳酸菌やビフィズス菌ファミリーは、IL-10,TGF-β、トリプトファン-2,3-ジオキシゲナーゼ(IDO)などの抗炎症性サイトカインの分泌に影響を与え、Treg刺激だけでなく、Th1,Th2,ヘルパーリンパ球のTh17抑制を引き起こすことで、炎症の抑制と関連している[63]。免疫寛容性の喪失によるバイオシスは、上皮および腸管バリア機能を損なう。その結果、プロTh17と抗炎症性Tregリンパ球のバランスが乱れる。
慢性炎症下では、筋タンパク質合成およびトレーニング適応が制限される可能性がある。特に、筋繊維の基底膜と漿膜の間に位置するサテライト細胞は、再生と筋成長の間に重要な役割を果たしている[64]。筋繊維の合成および分解は、同化および異化プロセスを決定する多くの交差シグナル伝達経路の制御下にある。ユビキチン-プロテアソーム系に属する2つのE3ユビキチンリガーゼは、主に筋タンパク質分解に関与している。Atrogin-1とMuscle RING finger protein (MuRF1)である。これらの転写活性の上昇は、NF-kB核因子やリン酸化されたFOXOタンパク質によって制御されている。したがって、これらのシグナル伝達経路の阻害は、骨格筋の萎縮に対する保護と関連している[65,66]。プロ炎症性サイトカインの分泌もまたNF-kBを活性化し、骨格筋の萎縮に寄与する。これは主に、IκB(IKKβ)を活性化することが可能なTNF-αによって媒介され、その活性型はIκBタンパク質をリン酸化し、それによってNF-κBシグナル伝達を誘発し、異化に向けて遺伝子転写を変化させることができる[67]。
筋原線維タンパク質の合成は、細胞内分子経路を活性化する細胞外シグナルに依存している。mTORは筋タンパク質合成の過程で重要な役割を果たしているようである。mTOR の活性化は、翻訳効率を高めるシグナル伝達経路と開始基質のリン酸化を介して、同化プロセスの強化につながる[9]。レジスタンストレーニング中の機械的な収縮は骨格筋からIGF-1を放出し、mTORの活性化を可能にする。タンパク質またはアミノ酸の摂取もまた、mTORシグナル伝達の強化に寄与し、運動刺激との相乗効果を実証している[68]。細胞外マトリックスに分泌されたIGF-1は、特殊なIGF結合タンパク質(IGFBP)と結合し、同化シグナルを処理する特定の受容体の活性化を可能にする[69]。
身体トレーニングは、アデノシン三リン酸ATPレベルの低下とATP/AMP(アデノシン一リン酸)比の乱れにつながり、エネルギーストレスの発生を引き起こす。AMPの高濃度化は、AMP活性化プロテインキナーゼ(AMPK)を刺激し、異化過程を開始してエネルギー資源の平準化を図る。AMPKは、好気性および嫌気性エネルギー産生を促進し、グリコーゲンおよびコレステロール合成を阻害し、PGC-1α発現を介してミトコンドリア生合成を誘導する[70]。AMPKの生物学的役割はまた、mTOR活性を低下させ、タンパク質の分解を促進することで細胞成分の循環を制御する。AMPKレベルの上昇は、FOXOタンパク質活性化の増加と正の相関がある[71]。ストレス応答はFOXOタンパク質のリン酸化を引き起こし、オートファジー遺伝子の転写を激化させ、タンパク質破壊(主にFOXO3)に寄与する。しかし、定期的な運動はオートファジーを誘導するが、これは筋繊維の再構築の前に必要なステップである。オートファジーの亢進が筋の成長と機能の障害と関連していることは明らかである[70,72]。
過度のトレーニング負荷と再生期間の不足は、疲労や一時的なスポーツパフォーマンスの低下を引き起こす可能性がある。したがって、運動後の適切な再生はトレーニング適応における重要な要素である[73]。運動によって誘発される組織損傷は適応過程の生理的な一部であるが、慢性的なトレーニング負荷や再生期間の不足は、アスリートのウェルビーイングやスポーツ能力に悪影響を及ぼす可能性がある[74]。具体的には、過度のトレーニングによって引き起こされる組織損傷は、損傷した構造の再構築と筋適応の促進を目的としたサイトカイン、主にインターロイキン-1b(IL-1b)、TNF-a、インターロイキン-8(IL-8)、インターロイキン-6(IL-6)の過剰生産からなる急性および局所的な炎症反応を引き起こす可能性がある。その結果、炎症性サイトカインを誘導し、全身の炎症を引き起こす可能性のある循環単球の活性化があり[75,76]、インスリン抵抗性、小胞体ストレス、およびその結果として筋肉の萎縮を引き起こす[73]。さらに、活性酸素の発生は、タンパク質合成を混乱させ、炎症反応を促進し、運動後の再生プロセスの効率を低下させる可能性がある[77]。
Jägerらは、Streptococcus thermophilus FP4株とBifidobacterium breve BR03株のサプリメントを使用することで、炎症状態を調整し、筋トレ適応力を高める有益な効果があることを実証している。この研究では、プロバイオティクスのサプリメント期間21日間の摂取により、トレーニングを受けた男性15人の偏心運動後48時間の血中IL-6レベルが低下した。また、トレーニングによる運動制限を軽減し、再生期間の短縮に寄与した[78]。炎症パラメータと筋機能に対するポジティブな効果は、Wen-Chingらによっても実証されている。 彼らは、トライアスリートにラクトバチルス・プランタラムPS128を長期的に補給すると、血漿クレアチンキンス(CK)レベルが低下したことに気づいた。さらに、再生期の炎症や酸化ストレスの様々なマーカーにも有意な改善が見られた。これらの改善は、ミエロペルオキシダーゼ(MPO)とIL-10の上昇だけでなく、TNF-α、IFN-γ、IL-6,およびIL-8の減少に現れた [79]。プロバイオティクスサプリメントの有効性はまた、他の炎症パラメータを変更することなく、枯草菌DE111治療の12週間のTNF-αレベルを減少させたことを示したタウンゼントらによって実証された[80]。Robertsらによって行われた別の研究では、多系統プロバイオティクス(ラクトバチルス・アシドフィルスCUL-60,ラクトバチルス・アシドフィルスCUL-21,ビフィドバクテリウム・ビフィダムCUL-20,およびビフィドバクテリウム・アニマリス)を12週間使用した場合のトライアスロン選手の腸管透過性に対するポジティブな効果が明確に示された。フラクトオリゴ糖とα-リノール酸の補給を併用したプロバイオティクスは、対照群と比較して血中エンドトキシンレベルの低下と関連していた[81]。
4. 細菌産物とその筋機能への影響
腸内細菌は、様々な生物学的に活性な代謝物を産生することで人体に影響を与える。最もよく知られている細菌代謝物の一つは、SCFAsである。SCFA は、1 日の総エネルギー需要の最大 10%の供給源になると考えられている [82]。酪酸、酢酸およびプロピオン酸は、最もよく知られているSCFAであり、全SCFAの95%もの割合を占めている。
酪酸は、細胞の成長と分化を調節する上で重要な役割を果たしているようである[83]。Roseburia、Clostridia、Eubacteria属は、主な酪酸生産者である[4]。酪酸には、腸管バリアの強化、抗菌ペプチドの分泌促進、Tregリンパ球活性化、好中球遊走の調節、TLRサイレンシング、炎症性サイトカイン産生の減少、およびリンパ球または顆粒球活性の抑制など、酪酸に関連した多くの抗炎症特性がある。さらに、酪酸はNF-kBおよびプロテインキナーゼB(AKT)シグナル伝達を変化させ[84]、LPSに拮抗することで炎症反応を抑制することが示されている。さらに、腸管透過性を低下させ、組織のインスリン感受性を改善し、脂肪分解を増加させ、骨格筋のグルコース取り込みを刺激する[49]。
同様の抗炎症特性はアセテートについても観察されている。それはグルカゴン様ペプチド-1 (GLP-1) と YY ペプチドの分泌に影響を与え、その結果、食欲抑制、脂肪分解、エネルギー支出の増加をもたらす。さらに、アセテートは、グルコースの取り込みを刺激し、インスリン感受性を高めることにより、骨格筋に有益な効果がある[85]。プロピオン酸と酪酸は腸内ホルモンの分泌を調節してインスリン感受性を高め、グルコース代謝に影響を与え[86]、グルコース産生前駆体となり、脂肪分解阻害剤となる[87]。
SCFAと骨格筋との直接的な関係は、筋AMPキナーゼと骨格筋組織におけるタンパク質の沈着を介している。SCFAはAMP/ATP比を増加させることにより、またはFfar2-レプチン経路を介してAMPKを活性化するが、正確なメカニズムは知られていない[88]。腸内細菌は、抗菌活性を有する二次胆汁酸を産生する可能性がある。微生物は肝臓および骨格筋受容体に影響を与え、ファルネソイドX受容体(FXR)の活性を調節する可能性があることが示されている[89]。この受容体は、エネルギー代謝経路、リポタンパク質およびグルコースターンオーバーにおいて重要な役割を果たしている。腸内微生物は、FXR 阻害を緩和することで、代謝バランスの維持や筋細胞の同化に寄与する可能性がある。また、胆汁酸塩は腸内で免疫調節・抗炎症化合物に変換される可能性がある[90,91]。
5. マイクロバイオームと栄養素の利用可能性
腸内細菌叢は、それらの消化と吸収に参加することにより、アミノ酸の可用性とプロファイルに影響を与える。特に注目すべきは、フソバクテリウム(Fusobacterium)バクテロイデス(Bacteroides)ヴェイロネラ(Veillonella)メガスファエラ(Megasphaera elsdenii)およびセレノモナス(Selenomonas ruminantium)は、すべてタンパク質分解に関与し、アミノ酸の廃棄を増加させる[92]。さらに、Streptococcus bovis、Selenomonas ruminantium、およびPrevotella bryantiiのようないくつかの細菌種は、生理的なペプチド濃度の存在下でアミノ酸のde novo生合成に関与している[93]。腸内細菌はトリプトファンを直接消費することでトリプトファンの代謝に重要な役割を果たしており、宿主生物への供給を制限している[36]。一方、腸内細菌叢の組成は、循環中のトリプトファン代謝物のレベルと脳内のセロトニン(5-HT)のレベルを決定する重要な因子である[92]ため、筋トレ適応に悪影響を及ぼす。
微生物のもう一つの重要な役割は、葉酸、リボフラビン(B2)コバラミン(B12)ビタミンKなどのビタミンの生産にある。ビタミンBは、様々な経路を介して筋細胞の同化プロセスに必要であり、DNAの複製と修復、ヌクレオチドとアミノ酸の合成、酸化ストレスの調節などの代謝機能のいくつかを含む。ビフィドバクテリウム・ロンガム、ビフィドバクテリウム・ビフィダム、ラクトバチルス・ロイテリは、いずれもビタミン合成に関与している[94]。腸内細菌もポリフェノールを代謝することができるが、腸内の好ましくない条件下ではその効率が低下することがある。ポリフェノールは抗酸化性および抗炎症性を有し、ミトコンドリアの生合成および機能にも寄与する[95]。
乳酸を利用する細菌は、運動能力に重要な役割を持っているようである。乳酸は血清から腸管腔に浸透し、そこでプロピオン酸を中心としたSCFAsに変換される。その後、SCFAsは直接循環に入り、コリサイクル変換を経て、追加のエネルギー源となる[96]。Scheimanらによって行われた最近の研究では、炭素の唯一の供給源が乳酸塩であるVeillonella atypica属の重要な役割が示されている。これらの細菌属の数は、高性能アスリートの腸内で上昇していた。また、Veillonella atypica属菌をマウスに移植すると、有意なランニングタイムの改善に関連することが示されている。このことから、酵素の調節や乳酸のプロピオン酸への変換がアスリートのパフォーマンス向上に役割を果たしていることが報告されている[97]。最後に、動物モデルでは、SCFA(主にプロピオン酸)が酸素取り込みを最大化し、心拍数を上昇させる役割が示されているが、ヒトでは安静時エネルギー消費量の増加を引き起こす可能性がある[98,99]。
6. グルコース代謝
現在の知見に照らすと、グルコース輸送およびエネルギーバランスに関与する腸管受容体Gpr41およびSglt1の発現は、骨格筋の酸素代謝の増加と関連している。細菌性SCFAはGpr41受容体を活性化し、グルカゴン様ペプチド1(GLP-1)を放出する内分泌経路に影響を与え、インスリン分泌を刺激することができる[100,101]。同様のメカニズムは、グルコースの恒常性維持に関与するナトリウムグルコース共輸送体Sglt1の場合にも観察される。Nayらは、抗生物質を投与されたマウスは、対照群に比べてGpr1およびSglt1遺伝子の発現が低下し、筋グリコーゲン含量の低下と相関していることを報告している[101]。
抗生物質治療によって引き起こされることが多い腸内環境異常は、SCFAsおよび胆汁酸(BA)合成の変化に寄与し、Zarrinparらで示された。 腸球の主なエネルギー源である酪酸の制限は、グルコース補償を引き起こす。その結果、これは、低血清グルコースレベルだけでなく、インスリン感受性および増加した肝グルコース産生にも翻訳される[102]。また、腸管異常症が骨格筋のグルコース利用可能性を低下させ、結果としてグリコーゲン貯蔵量の減少をもたらす可能性があることも報告されている。筋肉のグリコーゲン含量は、アスリートの有酸素エネルギー代謝を決定する重要な因子である。グリコーゲンレベルの障害は、筋力と機能の低下を引き起こし、生体エネルギー代謝の障害につながる可能性がある[18]。この概念は、腸内細菌叢の組成と筋グリコーゲン含量との間に相関関係がある別の研究によって支持された。無菌マウスは、正常なマイクロバイオーム組成を持つ個体と比較して、筋グリコーゲンレベルが低いことが示された[101]。このデータは、グルコースなどのエネルギー基質の利用可能性を改善することで、骨格筋機能におけるマイクロバイオータの重要な役割を実証している。
7. マイクロバイオータとミトコンドリア機能の相互作用
腸内微生物は、様々な方法でミトコンドリア機能に影響を及ぼす可能性がある。主に病原性細菌によって産生される LPS は、TLR を介して NF-kB シグナルと炎症反応を活性化し、炎症性サイトカインの産生を促進する。TLRの活性化は間接的にETCの活性化を増加させ、ミトコンドリアの活性酸素発生につながる[103]。病原性リステリア・モノサイトゲネス種の増殖は、ミトコンドリアネットワークの断片化に寄与し、その機能を混乱させることが指摘されている[104]。また、他の腸内細菌であるMycobacterium tuberculosisやEhrlichia chaffeensisなどは、LPSが誘導する経路を阻害したり、SOD活性を増加させることで、活性酸素の発生を抑制することが示されている[103]。
さらに、アミノ酸還元菌、例えば大腸菌やサルモネラ菌は硫化水素(H2S)産生能を有することも報告されている。多量に発生したH2Sは、チトクロームc酸化酵素活性を低下させることで、ミトコンドリアのETCを阻害する[103]。SCFAsなどの他の細菌代謝物は、骨格筋における好気性エネルギー代謝の調節に寄与する可能性がある。これは主に酪酸と、その効率を高めるためにクレブスサイクルに入る能力を介して起こる[105]。しかし、最近のデータでは、イソバニル酸3-O-スフラート(IVAS)もまた、ヒト細胞におけるグルコースの吸収および代謝にプラスの効果を有する可能性が示唆されている。IVASは、GLUT-4およびGLUT-1,ホスファチジルイノシトール3-キナーゼ(PI3K)およびAKTリン酸化を活性化することにより、用量依存的にグルコース輸送を増加させることが示された[106]。PI3Kは、インスリン感受性を調節することにより、筋肉の代謝およびミトコンドリアの恒常性に重要であると考えられている[107]。
8. 神経活性分子の微生物による変調
最近では,これら 2 つの器官間で双方向のコミュニケーションを可能にする腸-脳軸(GBA)の存在が,複数の研究で裏付けられている.そのシグナル伝達経路は,主に自律神経系(ANS)の交感神経線維と副交感神経線維を介して進行する求心性ニューロンと放出性ニューロンで構成されている.この双方向のクロストークを利用して、腸からの信号は脳の機能に影響を与え、気分や反射活動を調整することができる。同様に、中枢神経系は、胃腸(GI)のトラック運動と胃内の酸分泌を変化させ、排便プロセスを制御する可能性がある[108,109]。
腸内細菌叢は、いくつかの神経活性分子を生成することにより、腸と脳のコミュニケーションにおいて重要な役割を果たしていることが確立されている。例えば、ラクトバチルス属の株は、脳内の重要な抑制性伝達物質であるγ-アミノ酪酸(GABA)を産生することが実証されている。同様に、他の細菌種は、ノルアドレナリン(例えば、バチルス・マイコイデス、バチルス・サブチリス)ドーパミン(例えば、バチルス・セレウス、バチルス・マイコイデス、バチルス・サブチリス)およびセロトニン(例えば、ラクトコッカス・ラクティス、ラクトバチルス・プランタラム、ストレプトコッカス・サーモフィルス)の合成が可能であることが示された[108,110,111]。したがって、腸内細菌は神経伝達物質の活性を変化させる可能性があり、その結果、宿主神経系と相互作用して精神的健康を調節し、その結果、代謝および運動能力を調節することが明らかになっている。
これらの知見を裏付けるように、最近の全身的なレビューでは、適度なトレーニングが視床下部のGABAレベルの上昇に寄与し、安静時血圧、心拍数、交感神経緊張の低下と関連していることが示されている。さらに、ストレスの多い状況下では、ドーパミンがGI管内で合成されることが示された。一方、トレーニングの過負荷は、筋肉の疲労や中枢神経系の変化を引き起こし、気分障害、疲労、不眠、抑うつ状態につながることが報告されている。中枢疲労は5-HTの放出量の上昇と関連しており、身体能力の低下につながる可能性がある。また、脳内の5-HTレベルの低下は、気分障害、うつ病、心機能の歪み、血圧の変化などの症状を引き起こす可能性があることが明らかになった。全体的に、腸内細菌叢は神経伝達物質とホルモンの生産と調節を促進することが示されており、その結果、アスリートの幸福感、気分、モチベーション、再生の主観的感覚に影響を与えている[112]。
興味深いことに、Bravoらが行った研究では、乳酸菌ラムノサスを慢性的に摂取することで中枢GABA受容体の発現に変化が生じ、ストレス誘発性コルチコステロン(CORT)だけでなく、不安や抑うつに関連した行動を減少させることが示されている[113]。さらに、GF動物の5-HTレベルは、通常コロニー化した動物と比較して、血中および結腸で低いことが示された。この効果はSCFAなどの細菌分子に依存していることが示唆された[114]。さらに、Crumeyrolle-Arriasらは、ストレスへの応答における腸内細菌の重要な役割を実証した。GFマウスは、特異的病原体を持たないマウスと比較して、血清CORT濃度が高く、視床下部でのコルチコトロピン放出因子mRNA発現が上昇し、海馬でのドーパミン作動性ターンオーバー率が低下した。これらの変化は、腸内細菌叢の欠如がストレス応答を悪化させることを示唆している[115]。さらに、内因性グルココルチコイドレベルの慢性的な上昇は、肝グルコ新生の前駆体として機能するアミノ酸を生成するために、タンパク質合成の速度を低下させ、タンパク質分解を増加させた可能性がある。しかし、骨格筋では、これが酸化ストレス[116]および骨格筋萎縮の発生、および筋力低下[117,118]につながる可能性がある。これらのデータから、腸内微生物組成は、視床下部-下垂体-副腎皮質軸の調節を介した適切なストレス応答の発達と機能に重要な役割を果たしており、その結果、アスリートの運動能力に影響を与えているのではないかと推測される。
9. マイクロバイオームが運動能力に与える影響
表1に示すように、トレーニングパラメータを改善し、トレーニング能力を向上させるために、腸内細菌叢を標的とした戦略の有効性が多くの研究で示されている。これらの研究は、酸化ストレスと運動誘発性炎症を緩和する腸内細菌叢の能力を示している[78,79,80,119,120]。Jagerらが実施した試験では、Bacillus coagulans GBI-30プロバイオティクスサプリメントがWingateテストで測定された嫌気性能力を改善することが示されている[121]。運動後の再生に対するプロバイオティクスの補給の肯定的な特性は、Bifidobacterium longum 35624 [122]とLactobacillus plantarum PS128 [79]を使用して、それぞれCarbuhnらと同様にHuangらによって提示されている。両試験群において、アスリートはプラセボ群と比較して、プロバイオティクス群の方が回復時間が早いと感じたと報告している。
表1 運動に対するマイクロバイオータの効果
| 参考文献 | 研究モデル | 運動の種類 | 介入 | スポーツパフォーマンスの直接的および間接的パラメータに対する介入の有益な効果 |
|---|---|---|---|---|
| Hsu etal。2015 [ 119 ] | マウス | 遠泳 | 3つの研究グループ:プロバイオティクスなし(特定病原体除去(SPF))との無菌(GF)とバクテロイデスフラジリス(BF)の比較 | ↑血清グルタチオンペルオキシダーゼ(GPx)とカタラーゼ(Cat)の 活性 ↑肝臓GPxの活性↑筋肉量 ↑抗酸化特性 ↑フリーラジカル損傷保護 ↑筋肉量の持久力(運動を消耗時間まで延長) 肝臓のスーパーオキシドジスムターゼ(SOD)に違いはありませんと猫の活動 |
| Unsal etal。2018 [ 120 ] | ラット | 徹底的な水泳トライアル | Fourstudyグループ:対照、プラセボ、運動、運動+プロバイオティクス | ↓酸化ストレス ↑抗酸化酵素活性 ↑抗酸化バランス |
| 研究製品:多菌株プロバイオティクス混合物VSL#3(Lactobacillus casei、L。plantarum、L。acidophilus、L。delbrueckiisubsp。bulgaricus、Bifidobacterium longum、B。breve、およびB.infantis、Streptococcus salivarius) | ||||
| Scheiman etal。2019 [ 97 ] | マウス | 徹底的なトレッドミルの実行 | 2つの研究グループ:対照と補足 | ↑乳酸の利用 ↑血中短鎖脂肪酸(SCFA)濃度 ↑運動を消耗時間まで延長(トレッドミルトレーニング) ↑コリ回路効率 |
| 研究製品:ベイロネラ、プロピオン酸 | ||||
| Chen etal。2016 [ 52 ] | マウス | 握力と遠泳 | 3つの研究グループ:車両、2.05ˆ108CFU / kg(LP10-1X)、および1.03ˆ109CFU / kg(LP10-5X)。 | ↑相対的な筋肉量と筋力 ↑1型筋線維の数 ↑運動を疲労時間まで延長(水泳試験) ↓運動後の乳酸塩血中濃度 ↓運動後のアンモニア血中濃度 ↓運動後のCK ↓運動後のアンモニア、アルブミン、クレアチニンとトリグリセリドの濃度 上記のすべての変化は用量依存的でした |
| 研究製品:ラクトバチルスプランタルムTWK10(LP10) | ||||
| ホフマン等。2019 [ 123 ] | 兵隊 | 垂直跳びパワー、100mシャトル走行2回 | 2つの研究グループ:バチルスコアグランスとプラセボ | ↑インターフェロンガンマ(IFN)-γおよびインターロイキン-10(IL-10)濃度 ↑平均ジャンプパワー 60秒のプルアップ、100 mシャトル走行、シャトル走行疲労率 への影響なしコルチゾールおよびテストステロン濃度 への影響なし影響なしCKおよび炎症誘発性サイトカイン濃度について |
| 研究製品: バチルス・コアグランス | ||||
| Jager etal。2016 [ 121 ] | レクリエーショントレーニングマン | 有害な運動の試合 | 2つの研究グループ:20gのカゼイン消費量および/または20gのカゼインとバチルス消費量 | ↑ワークアウトを損傷した後の再生知覚 ↑ウィンゲートテストでのスポーツパフォーマンス ↓ワークアウトを損傷した24時間後と72時間後の痛みの知覚 ↓運動後の血液CK 筋力と厚さに影響なし |
| 研究製品:バチルスコアグランスGBI-30 | ||||
| ロバーツら。2016 [ 81 ] | 訓練を受けていない男性と女性 | トライアスロン固有のステージ時間(水泳、自転車、ランニング) | 3つの研究グループ:プロバイオティクス、プロバイオティクス+抗酸化剤、プラセボ | ↓トレーニング後6日までの血中リポ多糖(LPS)レベル ↓レース期間 |
| 研究製品:ビフィドバテリウムとラクトバチルスの混合物 | ||||
| Toohey et.al. 2018 [ 124 ] | バレーボール選手(女子) | スクワット、デッドリフト、ベンチプレス、垂直跳び、敏捷性、等尺性中腿プルテスト | 2つの研究グループ:プロバイオティクスとプラセボ | ↓プラセボ群と比較した体脂肪量レベル 強度や運動能力への影響はありません。 |
| 研究製品:枯草 菌 | ||||
| Jager etal。2016 [ 78 ] | 筋力トレーニングを受けた男性 | 肘の偏心運動 | 2つの研究グループ:プロバイオティクスとプラセボ | ↓損傷トレーニング後48時間でIL-6濃度が上昇 ↑損傷運動 後24〜72時間での最大随意等尺性ピークトルク↑損傷トレーニング後の屈曲腕角度 平均最大随意等尺性ピークへの 影響なし損傷運動後の血漿CKレベルへの明確な影響なし |
| 研究製品:Streptococcus thermophilus FP4 Bifidobacterium breve BR03 | ||||
| Carbuhn etal。2018 [ 122 ] | スイマー(女性) | 有酸素/無酸素水泳タイムトライアルとフォースプレート垂直跳び | 2つの研究グループ:プロバイオティクスとプラセボ | ↑トレーニング後の再生知覚 有酸素および無酸素水泳パフォーマンステスト への影響なし同心/偏心力の生成への影響 なし血清IL-1、LPS、およびLPS結合タンパク質(LBP)濃度の違いなし |
| 研究製品:Bifidobacterium longum 35624 | ||||
| Townsend etal。2018 [ 80 ] | 野球選手(男性) | 10ヤードスプリントテスト、敏捷性テスト、走り幅跳び | 2つのグループ:プロバイオティクスとプラセボ | ↓トレーニング後の血中TNF-α濃度 IL-10、ゾヌリン、テストステロン、コルチゾール濃度、唾液免疫グロブリンA(SIgA)分泌に有意な影響 なし強度、パフォーマンス、体組成に違いはありません |
| 研究製品:枯草菌DE111 | ||||
| 黄ら。2019 [ 79 ] | トライアスリート | トライアスロン選手権 | 2つの研究グループ:乳酸桿菌とプラセボ | ↓酸化ストレスレベル ↑チオレドキシン(TRX)とMPO調節による抗酸化能 ↑運動後の血中BCAA濃度 ↑運動後の再生率 ↑運動後の血中IL-10濃度 ↓運動後の血中IL-6、IL-8、 TNF-αIFN-γ濃度 ↓回復期間中のCKレベル ↑ウィンゲートテストでの嫌気性能力 体組成に有意差 なし運動後のCK、ミオグロビン、乳酸デヒドロゲナーゼ(LDH)、アンモニア、乳酸、FFAへの影響なし |
| 研究製品:ラクトバチルスプランタルムPS128 |
表の記号。↑-増加、↓-減少
また、動物実験では、運動を疲弊時間まで延長することにより、アスリートの有酸素体力にプロバイオティクスのポジティブな効果があることが示されている。Hsuらは、最適な腸内細菌叢の組成を持つマウスにおいて、筋肉量と持久力の増強、および抗酸化力が観察された[119]。これらの観察は、Chenらが行ったその後の医学実験と一致している。同様の報告は、乳酸利用における細菌の役割を実証したScheimanらによるもので、その結果、運動能力の向上につながっている[97]。
10. 結論
現在の知見に照らすと、腸内マイクロバイオータの介入は人体に有益な効果をもたらし、結果として運動能力の向上につながる可能性があるように思われる。免疫応答の調節、酸化ストレス、代謝プロセス、栄養素のバイオアベイラビリティは、マイクロバイオータがトレーニング適応に影響を与える主なメカニズムと考えられている。マイクロバイオームはまた、筋タンパク質合成、ミトコンドリアの生合成と機能、筋グリコーゲン貯蔵にも影響を与える可能性がある。生理的適応を低下させ、炎症性マーカーや活性酸素の発生を増加させるだけでなく、フリーラジカルマクロモレキュラーの破壊を引き起こし、すべてが骨格筋の萎縮に寄与する可能性がある。一方で、多くの研究では、プロバイオティクスの補給がアスリートの有酸素性と無酸素性のパフォーマンスに有益な効果があることが示されている。これらのプロセスのすべてがよく理解されているわけではなく、この腸と筋肉の関係を探るための将来の研究のための明確な必要性がある。これらの研究は、アスリートに焦点を当て、アスリートの生理的な筋肉機能の維持に関する理解を深めるように努力すべきである。
