Contents
Glycinergic signaling in the human nervous system: An overview of therapeutic drug targets and clinical effects
www.ncbi.nlm.nih.gov/pmc/articles/PMC6007534/
要旨
グリシンおよび関連する内因性化合物(d-セリン、d-アラニン、サルコシン)は、興奮性および抑制性の神経伝達において重要な役割を果たしており、グリシントランスポーター1および2(GlyT1およびGlyT2)d-アミノ酸酸化酵素(DAAO)セリンラスマ-ゼ(SRR)アラニン-セリン-システイントランスポーター1(Asc-1)およびキヌレニンアミノトランスフェラーゼ(KAT)を含む多くの酵素およびトランスポーターの影響を受けている。
化合物の関連するヒト臨床試験については、MEDLINE、Web of Science、PsychINFOで検索した。N-メチル-d-アスパラギン酸受容体のグリシンB部位の低分子アゴニストの外因性投与を利用した多くの研究が行われており、グリシントランスポーター1型(GlyT1)阻害剤も増加している。
これらの化合物の臨床効果をレビューするとともに、新規化合物の潜在的な効果についても検討した。
キーワード
グリシン、NMDA、d-セリン、d-アラニン、ビトペルチン、グリシントランスポーター1阻害薬、d-アミノ酸オキシダーゼ、ラパスチネル、抗精神病薬の増強
序論
中枢神経系(中枢神経系)の伝達物質としてのグリシンの生理的役割は複雑であり、その処理を理解することで、様々な潜在的な治療標的を明らかにし、その多くが探索されていた。古典的には、グリシンはガンマ-アミノ酪酸(GABA)と並んで抑制性の神経伝達物質と考えられており、グルタミン酸は主要な興奮性の神経伝達物質である1。脳幹と脊髄では、グリシン神経細胞はグリシンを放出してストリキニーネ感受性グリシン受容体(GlyRs、グリシンA結合部位とも呼ばれる)に作用し、GABA-A、セロトニン3型(5HT3)ニコチンアセチルコリン(nAChR)受容体と構造的に相同性のあるリガンドゲートイオンチャネルとなる1。グリシンはまた、イオントロピー性グルタミン酸受容体のn-メチル-d-アスパラギン酸(NMDA)サブタイプの必須のコアゴニストとして機能し、そのようなものとして興奮性神経伝達を促進する2 。この部位はしばしばNMDA受容体(グリシンBとも呼ばれている)のグリシン調節部位(GMS)と呼ばれているが、シナプスNMDA受容体(NMDAR)の主要な内因性リガンドはラセミ体のd-セリンであることが示されている3 。
グリシン受容体に加えて、2つのグリシントランスポーター(GlyT1とGlyT2)がクローニングされており、シナプスからグリシンを除去する機能を持っている(図)4。GlyT1 は興奮性シナプスでグリシンの不飽和濃度を維持している5 。一方、GlyT2 は抑制性(グリシン作動性)シナプスのシナプス前表面に位置している6,7 。
図1 グリシンシナプスおよびグルタミン酸シナプスにおけるグリシンの受容体、酵素、およびトランスポーターの概要
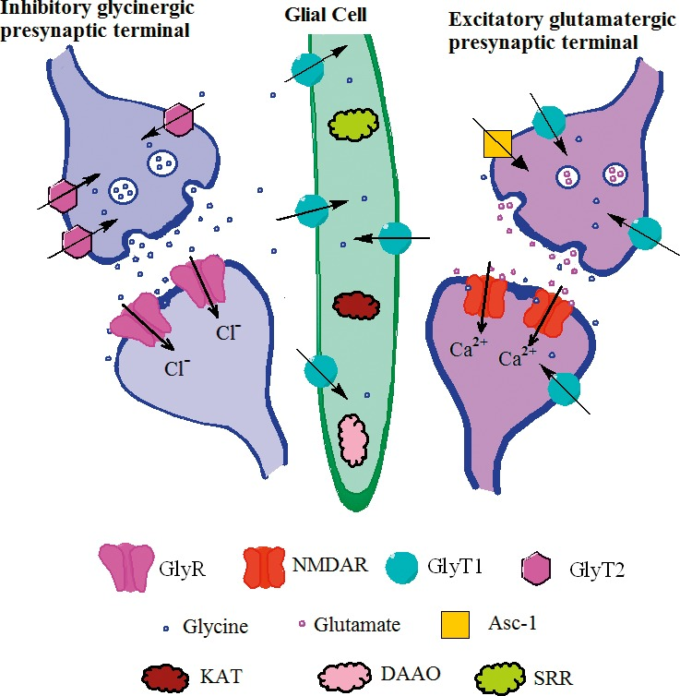
抑制性グリシンシナプスでは、グリア細胞表面上のシナプス前グリシントランスポーター2(GlyT2)とGlyT1の両方がグリシンの細胞外濃度を調節するのに役立つ。N-メチル-D-アスパラギン酸受容体(NMDAR)との興奮性グルタミン酸シナプスは、グルタミン酸結合とグリシンB部位への結合の両方を必要とし、通常はd-セリンによる結合が必要である。アラニン-セリン-システイントランスポーター1(Asc-1)は、シナプスからシナプス前末端バウトンへのd-セリンの除去を行うことができる。キヌレニンアミノトランスフェラーゼ(KAT)d-アミノ酸オキシダーゼ(DAAO)およびセリンラセマーゼ(SRR)は、グリア細胞に存在し、d-セリンおよび本文中で論じられている他のリガンドの代謝に関与している。
グリシン受容体やトランスポーター以外にも、グリシン、d-セリン、キヌレン酸(グリシンB部位の内因性アンタゴニスト)の代謝に関与する酵素も、統合失調症ではこれらのシステムが変化する可能性があることが示されているため、薬物療法の標的となる可能性がある8,9。これらには、d-アミノ酸酸化酵素(DAAO)セリンラセマーゼ(SRR)アラニン-セリン-システイントランスポーター-1(Asc-1)およびキヌリネンアミノトランスフェラーゼ(KAT)が含まれる。
本レビューでは、グリシン関連の作用部位に対する現在の治療薬の影響、単剤療法および増強戦略としてのグリシン特異的薬剤(グリシン、d-セリン、d-アラニン、およびサルコシン)の臨床試験、および主にGLYT1阻害薬に限定される開発中の薬剤の第3相試験に関する知識に焦点を当てている。本レビューの範囲を限定するために、グリシンB部位部分作動薬であるd-cycloserine(DCS)の研究については、詳細なレビューは行わない。簡単に言うと、NMDARは長期的な増強、したがって学習において重要な役割を果たしているため、DCSは、これらのセッション中に学習を強化するのを助けるために、様々な認知行動療法や暴露療法を増強するために研究されてきた。この介入の有効性は、心理療法介入の個々のセッションの効果に大きく依存している10 。最初に、グリシン作動性神経伝達の概要を説明することで、文献レビューでカバーされている臨床試験結果の議論のために読者を準備する。
グリシン作動性神経伝達の生化学と薬理学
グリシンを介した抑制性シグナル伝達は、主に脊髄、脳幹、尾部脳で行われ、シナプス後のニューロン上のGlyRsでの作用を必要とする11 。GlyRはリガンドゲート型イオンチャネルであり、主に塩化物イオンに対して透過性がある。塩化物イオンの流入は、活動電位の伝播を阻害するシナプス後細胞の過分極化につながる。グリシン受容体は、グリシン> β-アラニン>タウリン> d-またはl-アラニン> l l-セリン>> d-セリン.12,13の順序で強力である既知の内因性アゴニストの限られた数を持っている。
GlyR はアルカロイドであるストリキニーネに高親和性で拮抗するため、GlyR は一般にストリキニーネ感受性と呼ばれ、NMDAR 上のグリシン結合部位と区別されている14。
GlyRとGlyT2は、様々な病態に対する治療標的となる可能性がある。13,15 GlyRの変異は、予期せぬ聴覚刺激や視覚刺激が、短時間の筋肉のこわばりを伴った過剰な驚愕反応の引き金となる神経発達障害である多錐体症(驚愕症としても知られている)に関与している。誇張された驚愕(例えば、不安障害、心的外傷後ストレス障害)によってマークされた他の条件は、したがって、このシステム.16を調節することによって影響を受ける可能性がある 脊髄と脳幹の神経伝達におけるグリシンの抑制的役割は、同様に慢性神経障害性疼痛を治療するための努力で悪用されている。
グリシンとNMDARのグリシンB部位に作用する関連分子の役割は広く研究されており、これらの受容体が広く分布していることに見合うだけの広範囲な臨床的意味合いを持っている。NMDAR は認知、学習、記憶に関わる重要な機能を担っている19 。脳脊髄液中のグリシン濃度は高いが、NMDARのコアゴニスト部位は、シナプスからのグリシン輸送のために、生体内では一般的に飽和していないという証拠がある5,20。d-セリン濃度は主に3つのタンパク質の活性によって調節される:l-セリンをd-セリンに変換するSRR、d-セリンの分解を担うDAAO、シナプスからd-セリンを除去するAsc-1である(図)。DAAO阻害剤のみが臨床試験に至っているが、3つのタンパク質はすべて治療薬の標的となる可能性がある。
統合失調症のNMDA-hypofunction仮説は、この受容体のアンタゴニスト(例:フェンシクリジン、ケタミン)が、健常者において統合失調症の症状を模倣した陽性と陰性の両方の症状や認知障害を誘発するという点で優れている25 。NMDARの直接的な過剰刺激は興奮毒性があり、神経細胞の損傷や死につながる26 。このため、興奮毒性のある状態(脳卒中や頭部外傷など)の影響を最小限に抑えるために、NMDA活性を低下させるように設計された薬剤が研究されてきた。さらに最近の研究では、NMDARアンタゴニストであるケタミンの抗うつ効果とその後の類似分子の開発に焦点が当てられている(Wijesinghe27 が本誌でレビューしている)。NMDA機能のグリシンへの依存性は、この部位をうつ病にも興味深いものにしている。最後に、長期的な増強と学習におけるNMDARの役割のために、グリシンBアゴニストは認知増強剤として研究されていた。
研究方法
MEDLINE、Web of Science、PsycINFOのオンラインデータベースを、グリシン、受容体、トランスポーター、インヒビター、d-セリン、d-アラニン、サルコシン、セリンラセミターゼ、d-アミノ酸オキシダーゼ、キヌレン酸、神経伝達、精神医学の用語を組み合わせて、筆頭著者(R.S.)が検索し、ヒト臨床試験に限定して英語で日付制限なしに検索した。グリシンB部分作動薬DCSの試験は、レビューの範囲を制限するために含まれなかった。検索は、最初に2015年12月に実施され、ピアレビューのプロセスを通して繰り返され 2016年5月に終了した。タイトル、要旨
、および関連論文は、適切な場合には論文の参考文献と同様に、現在のトピックとの関連性があるかどうかを調査した。その他のリソースは、必要に応じて背景情報を拡充し、適切な場合には前臨床情報を提供するために使用された。
結果
グリシン-Bアゴニスト
一群として、内因性グリシンBアゴニスト(グリシン、D-セリン、D-アラニン)は、外因性に投与された場合、脳への浸透性が悪いため、理想的な薬理学的薬剤ではない。また、研究では、短期的にはより肯定的な結果が得られ、より長く、より大規模な試験では効果がないことが示されている。これは、グリシンB部位の活性化がNMDARのエンドサイトーシスを促進し、NMDARの内部化につながるという観察に関係していると考えられる。
グリシン
外因性グリシンは、統合失調症とその前駆体、強迫性障害、および痛みの症候群を含む様々な条件の治療に研究されている。全体として取られて、これらの研究は幾分混合した結果を持っていた。29-32 グリシンの血液脳関門を通過する輸送は低いが、脳脊髄液レベルは中等度から高用量によって用量依存的に影響を受ける可能性がある33。
2010年に行われた統合失調症の治療薬としてグリシンを用いた研究のメタアナリシスでは、この適応を対象とした10件の研究を基にグリシンの用量反応を分析している。グリシンの投与量は15~60g/日であり、最も多くの場合は総体重の0.8g/kgとして投与されている34。適応にかかわらず、ポジティブな治療効果に必要なグリシンの大量投与は、胃腸の副作用や味の悪さのために忍容性が悪い場合がある34,35。
統合失調症を発症するリスクがあると判断された患者を対象としたグリシン単剤療法の2つの短期試験(Criteria of Psychosis-risk Syndromesを使用)の報告36では、SOPS(精神病リスク症状尺度)とM薬物有害反応S(Montgomery-Asberg Depression Rating Scale)で良好な結果が得られていることが示されている。これらの試験は、10名の患者さんを対象に8週間の非盲検試験を実施し、その後16週間の治療期間を経て、8名の患者さんを対象に12週間のプラセボ対照試験を実施した(各治療群4名)。投与量は目標用量である0.4mg/kgを1日2回1日2回、11日間かけて滴定し、両試験とも1日総量80gを上限とした。これらの試験では、口当たりを改善するためにグリシンのマイクロカプセル化製剤が使用された。非盲検試験では、すべてのアウトカム指標(SOPS-全体、陽性、陰性、無秩序、一般、M薬物有害反応S)において有意な改善が認められた。プラセボ対照試験では、統計的に有意な群間効果はM薬物有害反応Sの改善のみであった(効果量-2.06,P < 0.05)。これらの試験は、サンプルサイズと抗精神病薬以外の背景薬物療法を考慮しているために制限されている(ただし、プラセボ対照試験では、各治療群で抗うつ薬で治療されている患者が1人だけに限定されていた)。
Greenbergら35は無作為化プラセボ対照試験で、プライマリーアウトカム指標であるYale-Brown強迫性尺度(Y-BOCS)によって評価される強迫性障害の重症度に対する30gを1日2回、12週間にわたって滴定したグリシンの補助的効果を研究した。参加者には、登録前の12週間、変更されていない精神薬理学的レジメンおよび/または精神療法的治療を継続することが許可された。24名の被験者(各群12名)が登録された後、8名の被験者が試験終了前に味覚不耐性および/または吐き気を理由に治療群から脱落した。最終的な解析の結果、Y-BOCSは治療を継続した週ごとに0.82(95%信頼区間-1.62~0.01,P = 0.053)の平均値で減少した。著者らは、治療に反応した2人の患者が、継続的な利益を得て1年以上グリシンを服用し続けたことに注意している。
認知テストのバッテリーに直前に経口投与0.8 g/kgのグリシンの13健康な男性コントロールでの研究29は、ワーキングメモリ、宣言的記憶、注意、または知覚処理の測定に影響を与えないことがわかった。認知タスク上のグリシンの効果は、おそらく投与と治療条件の違いに関連して、一貫性がなかった。
慢性局所疼痛症候群1の患者を対象とした試験18では、二重盲検プラセボ対照クロスオーバー試験において、バクロフェンの髄腔内投与が可能な患者19人にグリシンの髄腔内投与が行われた。投与量は 8 mg/24 h から開始し,4 週目には 8 mg/24 h を週 1 回増量して 32 mg/24 h とした。治療間に1週間のウォッシュアウト期間を設けた4週間の治療期間中に,患者と臨床家の疼痛,運動障害,活動性,グローバル印象を測定した。2群間に有意差はなかった。副作用として最も頻繁に報告されたのは眠気、頭痛、感覚障害、悪心・嘔吐であり、両群間に差はなかった。
d-セリン
初期のプラセボ対照試験では、統合失調症の治療にd-セリンをクロザピンの増量に使用し、d-セリンを30mg/kg/日で6週間投与した37。治療開始時の有害事象は、シンプソン・アンガス評価尺度(SAS)異常不随意運動尺度(AIMS)バーンズアカシジア評価尺度(BARS)を用いて測定された。いずれの群においても有意な副作用は認められなかった。これらの結果は、本薬の有効性に悪影響を及ぼす部分作動薬DCSの使用とは対照的であった。また、非クロザピン系抗精神病薬にd-セリン30mg/kg/dを追加した以前の研究38では、陽性、陰性、認知症状に効果があり、忍容性も良好であった。この先行試験の患者は主に第一世代の抗精神病薬で治療された。オランザピンとリスペリドンで治療された患者を対象とした6週間のクロスオーバー試験39では、PANSS陰性、陽性、認知症状のスコアが有意に(P < 0.001)改善され、これらの結果が再現された。後に行われた4週間の用量漸増試験40では、複合PANSSの効果の大きさおよび用量ごとの相互作用に基づいて、60mg/kg/d以上の用量がより効果的である可能性が示唆された。
心的外傷後ストレス障害(PTSD)の慢性症状を有する22名の患者を対象とした6週間のプラセボ対照クロスオーバー試験41において、d-セリン30mg/kg/dが投与された。ハミルトン不安と戦闘関連PTSDのミシシッピ尺度では、プラセボ群と比較して治療群で有意な減少が認められ(それぞれP = 0.007,P = 0.001)Clinician-Administered PTSD尺度では有意差は認められなかった(P = 0.07)。患者のうち19人は薬物療法を受けており、その中には治療用量の抗うつ薬が含まれていた。
特殊集団におけるd-セリン
9~18歳のトゥレット症候群の小児9人にd-セリン(最大30mg/kg/d)を6週間投与し、エール・グローバルチック重症度尺度(Yale Global Tic Severity Scale)チックの合計スコア、および複合スコアによって決定されるチック抑制効果を評価した42。これらの転帰は、d-セリンとプラセボの両群間(平均改善率39.5 vs 30.2,P = 0.50,25.0 vs 34.0,P = 0.69)またはリルゾールとプラセボの両群間(43.7,P = 0.35,38.0,P = 0.85)で、複合スコアまたは総チックスコアに有意差は認められなかった。
d-アラニン
d-アラニンはグリシンB部位の選択的かつ強力な内因性リガンドであり、DAAOやAsc-1によっても制御されている。32 人の患者を対象に、統合失調症の補助的治療法として研究が行われた43 。32人の患者のうち14人にオレンジジュース中のd-アラニン100mg/kgを6週間投与し、プラセボと比較したところ、d-アラニン群ではPANSS全体で11%の減少(P < 0.0001)PANSS陽性で13%の減少(P < 0.0001)PANSS-認知的で12%の減少(P = 0.0002)SANSで17%の減少(P < 0.0001)が認められた。SAS、BARS、およびAIMSによって測定された副作用は有意ではなく、群間で差はなかった。見かけの治療量100mg/kgは、d-セリン(治療量30mg/kg/d)と比較してd-アラニンの効力が低いこと、およびグリシン(治療量800mg/kg/d)と比較してバイオアベイラビリティが中間的であることと一致している43,44。
グリシン-B部分作動薬
様々な精神疾患を対象に研究されてきた抗感染性DCSに加えて、このクラスでは、後に続く受容体の脱感作と内在化を伴わずにNMDARの機能を促進するための新しい薬剤が開発されてきた10,28。グリシンB部分作動薬GLYX-13(ラパスチネル)の単回静脈内投与が、今回のエピソード中に生体アミン系抗うつ薬による治療に反応しなかった大うつ病性障害(MDD)患者に行われた45 。投与量は1,5,10,30mg/kgで、症状は2時間後のHDRSに基づいて改善し、7日目には持続した。本剤は、このプルーフ・オブ・コンセプト試験と、抗うつ薬の持続的な有効性を示した反復投与の別の試験に基づいて、第3相試験に移行している。
グリシンB拮抗薬
多くの合成グリシンB拮抗薬が、様々な臨床現場で研究されてきた。これらの薬剤には、ガベスチネル、リコスチネル、GV196771,およびGW468816が含まれる。
NMDARの過剰活性化は、細胞内カルシウムの上昇を生じ、細胞死につながる代謝障害をもたらす。グリシンB部位拮抗薬ガベスチネル(GV150526)は、急性期脳卒中患者を対象とした大規模無作為化臨床試験において、安全性と忍容性が確認され、ラットの梗塞サイズに対する良好な結果が得られた46 。患者は症状発症から6時間以内に治療を受ける必要があった。主要エンドポイントは3ヵ月後の生存率とBarthel日常生活動作指数を組み合わせたものであった。試験薬とプラセボの間では、一次アウトカム、二次アウトカムに差は認められなかった。GAIN Americasの結果は、同様の否定的転帰を示した。
リコスチネル
リコスチネルもまたグリシンB拮抗薬であり、急性虚血性脳卒中を対象に研究が行われたが、プラセボ対照試験ではかなり小規模であった48 。44人の患者には、リコスチネルの増量投与(3mg/kgまで)が行われた。治療もプラセボとの分離は認められなかったが、大きな精神催眠作用や重大な安全性の懸念は認められなかった。高用量(1.2~3mg/kg)では、一過性の鎮静、めまい、吐き気が認められた。
GW468816
新しい研究では、最近禁欲した女性喫煙者を対象に、グリシンB拮抗薬GW468816を200mg/dの用量で5週間投与して再燃を予防する研究が行われた。これは、NMDARを媒介とするグルタミン酸シグナルの役割を示唆する証拠と、非グリシンNMDA拮抗薬が様々な中毒性薬物の投与後にドーパミン放出を変化させるという観察に基づいている49,50。血漿中薬物濃度は喫煙の結果や渇望の自己申告とは相関しなかった。副作用は認められず、試験薬が過少投与されていた可能性が示唆された。
GV196771
GV196771は強力な選択的グリシンB拮抗薬であり、神経障害性疼痛を有する63名の被験者(32名が試験薬を投与された)を対象に、無作為化二重盲検、プラセボ対照、並行群間比較試験が実施された51 。群間で自発痛や誘発痛、定量的感覚検査、患者の満足度に差はなかった。研究者らは、これらの結果が動物実験と再現しなかった理由として、中枢部への浸透性の低さが説明できるのではないかと推測している。
キヌレン酸
キヌレン酸(KYNA)は、NMDARのグリシンB部位の内因性競合的アンタゴニストであり、α7 nAChRの非競合的アンタゴニストでもある。KYNAはトリプトファン代謝の産物であり、キヌレニンアミノトランスフェラーゼ(KAT)に依存している。KATを阻害してKYNAを減少させることは、グリシンと関連した薬力学的標的となる可能性があることを示しており、この分野での研究が活発化している。脳内KYNAの大部分はキヌレニンアミノトランスフェラーゼII(KAT II)によって産生され、KAT IIの阻害剤を用いた前臨床試験では、ラットと霊長類以外の動物の認知機能の改善が示されている52 。
トリプトファン/キヌレニン代謝の変化もまた、MDDに関与している。選択的セロトニン再取り込み阻害薬(SSRI)であるエスシタロプラムを20-40mg/dの用量で健常者と大うつ病エピソードの基準を満たした人に12週間投与したところ、神経毒性のあるキヌレニン代謝物、3-ヒドロキシキヌレニン、キノリン酸(後者はNMDARアゴニストである)のレベルが低下することが明らかになった53 。これはトリプトファン代謝をセロトニン産生にシフトさせる機能である可能性が高いため、SSRIのクラス効果である可能性がある。
グリシントランスポーター1阻害薬
GlyT1阻害剤のヒト臨床試験を表にまとめた。これらの薬剤には、ビトパーチン、GSK1018921,ORG-25935,およびサルコシン(N-メチルグリシン)が含まれる。GlyT1の阻害は、シナプス内のグリシンの量を増加させ、GlyT1の50%占有は、シナプス内グリシンの2倍の増加に相当する。ビトペルチンの第3相試験では有望性が示されたが、この分子の開発はその後、統合失調症に対する開発が断念されている59 。第一世代の抗精神病薬ハロペリドール、チオリダジン、クロルプロマジンはGlyT1によるグリシンの取り込みを阻害することが示されているが、クロザピンとオランザピンは阻害しなかった。
表. グリシントランスポーター1阻害剤のヒト試験の特徴
原文参照
グリシントランスポーター2阻害剤
GlyT2阻害剤の開発は、まだヒトでの発表された研究には至っていない。この分野の研究により、内因性脂肪酸であるN-アラキドニルグリシン(NAGly)の役割が明らかになり、エンドカンナビノイドであるアナンドアミドと構造的に関連しており、比較的選択的なGlyT2阻害剤となっている。前臨床研究では、GlyT2阻害剤が疼痛状態に有用であることが示唆されている。
d-アミノ酸酸化酵素阻害剤
72,73 d-セリンとd-アラニンはともにグリシンB部位の強力なアゴニストであるため、これらの分子の濃度を上げることでNMDARの活性を高めることができる。そのため、d-セリンとd-アラニンの両方を代謝する酵素であるDAAOを阻害することが注目されている。
第一世代と第二世代の抗精神病薬を併用した無作為化二重盲検プラセボ対照臨床試験では、抗精神病薬治療で3ヵ月以上安定していた慢性統合失調症患者に対して、安息香酸ナトリウム1g/d(DAAO阻害薬)を安息香酸ナトリウムに起因する副作用がほとんどない追加治療として投与したところ、プラセボと比較して21%のPANSSスコアの改善が認められた76 。別の無作為化二重盲検プラセボ対照臨床試験では、安息香酸ナトリウム療法を受けた軽度認知障害または軽度アルツハイマー病患者の認知機能評価尺度において、プラセボに比べて統計学的に有意な改善が認められた。
抗精神病薬リスペリドンがDAAOを阻害することを示唆する証拠がいくつかあり、これが統合失調症の治療効果に寄与している可能性がある78。
クロザピン
統合失調症の治療にグリシン作動性薬剤を用いた増強試験34,79では、クロザピン投与患者の症状は改善しない傾向があり、症状を悪化させることが多い。このことは、クロザピンが独立して何らかのグリシン活性を発揮していることを示唆している。本薬はグリア細胞からのd-セリン(グルタミン酸と同様に)の放出を促進し、NMDA受容体のアップレギュレーションにつながることが示されている80 。
議論
中枢神経系におけるグリシン作動性伝達を調節する薬理学的薬剤は、治療的介入を促進するための無数の機会を提供している。興奮性と抑制性の両方の役割があること、内因性リガンドのベースラインレベルが変化すること、NMDARの比較的迅速な適応応答のため、普遍的に有効な薬剤はまだ開発されていない。GlyT1阻害剤、KAT阻害剤、DAAO阻害剤、およびSRRとAsc-1を調節する薬剤に関する新たな研究は、いずれ、現在利用可能な治療薬を増強したり、代替品を提供したりするような新規作用を有する、実行可能な化合物につながる可能性がある。ラパスチネル(GLYX-13)の前臨床試験では、脱感作やNMDARの内在化を伴わない治療戦略が示唆されており、これは以前に考えられていたよりも早く実現する可能性がある。
精神科臨床医はこれらの新薬を待ち望んでいるが、グリシン、d-セリン、d-アラニン、β-アラニン、タウリン、サルコシンは栄養補助食品のベンダーを通じて患者に提供されていることに注意することが重要である。患者のサプリメントの併用を評価することは、包括的な投薬レビューの際に常に重要であり、これらの一見無害に見えるアミノ酸や誘導体は見落とされがちである。特に、β-アラニンは人気のあるエルゴジェニック補助剤となっており、多くのワークアウトサプリメントに含まれている。この薬剤の精神科適応のためのヒト臨床試験はないが、麻痺の神経学的副作用は十分に文書化されている。精神保健の臨床家は、患者を治療する際には、最小のアミノ酸であるグリシンの驚異的な神経学的効果を念頭に置いておくべきである。
