Contents
Glutamine: Metabolism and Immune Function, Supplementation and Clinical Translation
www.ncbi.nlm.nih.gov/pmc/articles/PMC6266414/
要旨
グルタミンは、体内で最も豊富で汎用性の高いアミノ酸である。健康と疾患において、免疫細胞によるグルタミンの消費率は、グルコースと同等かそれ以上である。例えば、試験管内試験および生体内試験の研究では、グルタミンは、リンパ球の増殖およびサイトカイン産生、マクロファージの貪食プラス分泌活性、および好中球の細菌殺傷のための必須栄養素であることが決定されている。
グルタミンの循環への放出および利用可能性は、主に腸、肝臓、および骨格筋などの主要な代謝器官によって制御される。異化/過異化状態の間にグルタミンは代謝機能のために不可欠になることができるが、その可用性は、アミノ酸の組織間代謝における恒常性の障害のために損なわれる可能性がある。
この理由から、グルタミンは現在、臨床栄養補給プロトコルの一部であり、および/または免疫抑制された個体に推奨されている。しかしながら、異化/高異化状態(例えば、病気/重症、外傷後、敗血症、疲弊した運動選手)の広い範囲では、アミノ酸血漿/血流濃度(グルタミン血症としても知られている)に基づいてグルタミン補給(経口/非経口または非経口)が推奨されるべきかどうかを決定することは、現在のところ困難である。
グルタミン補充の有益な免疫ベースの効果はすでに確立されているが、生体内でのポジティブな転帰に関する多くの疑問やエビデンスはまだ提示されていない。したがって、本論文では、主要臓器におけるグルタミン代謝が免疫系の細胞にとってどのように重要であるかについての統合的なレビューを提供する。また、グルタミンの代謝と作用、異化状態におけるグルタミン補給の効果に関連する重要な問題についても論じている。
キーワード
栄養、アミノ酸、白血球、骨格筋、腸、肝臓
1. はじめに
最も基本的なレベルでは、アミノ酸は、私たちの細胞や組織内のタンパク質のビルディングブロックであり、水の次に哺乳類で2番目に豊富な化合物である。アミノ酸は、内因性および/または外因性(すなわち、食事)タンパク質から得ることができ、それらの可用性は、細胞の生存、維持、および増殖のための基本的な重要性である。特に哺乳類は、免疫応答を助けるためにアミノ酸の異化を増加させることによって病原体の感染を制御するための生化学的および代謝経路を開発しており、その結果、侵入した微生物への窒素含有栄養素の利用可能性を制限している[1]。この進化のメカニズムはまた、感染に対するそれ自身の炎症反応を制御するために宿主にとって有利になる。
遺伝子コードに詳細に記載されている20種類のアミノ酸のうち、グルタミンはアミノ酸代謝と免疫機能の汎用性を示す最良の例を提供している。グルタミンは、体内で最も豊富で汎用性の高いアミノ酸であり、中間代謝、組織間のアンモニア(NH3)輸送を介した器官間窒素交換、およびpHの恒常性に基本的な重要性を持っている。ほぼすべての細胞において、グルタミンは、ヌクレオチド合成(プリン、ピリミジン、アミノ糖)ニコチンアミド・アデニン・ジヌクレオチド・リン酸(NADPH)抗酸化物質、および細胞の完全性と機能の維持に関与する他の多くの生合成経路の基質として使用することができる[2,3,4]。
体内のほとんどの細胞は、一定のターンオーバーおよび/または栄養素の供給で機能しているが、免疫系の細胞は、頻繁に栄養素が制限された微小環境下で機能する必要がある[1]。グルコースは重要な代謝物であり、体内の多くの細胞にとって主要な燃料であるが、リンパ球、好中球、マクロファージなどの免疫系の細胞は、敗血症、火傷や手術からの回復、栄養失調などの異化状態や、高強度・大量の運動などの条件下で、グルコースと同等かそれ以上の速度でグルタミンを利用している[5,6]。この理論は、1980年代にオックスフォード大学のエリック・ニューショルム(1935-2011,現在では「免疫代謝」という概念の仮説と証拠の起源として広く受け入れられている)[3,7]の研究室によって最初に実験的に確認され、その後、世界中の他の多くの研究室によっても確認された[4,8,9]。このため、グルタミンは「免疫系の燃料」と考えられており、血中濃度が低いと免疫細胞の機能が損なわれ、その結果、臨床成績が悪くなり、死亡リスクが高まる可能性がある[10]。
現在、グルタミンは、術前および術後の患者のための臨床栄養補給の構成要素として日常的に供給されており、また、免疫機能を回復させるために多くのエリートアスリートにも供給されている。グルタミン補給の免疫媒介効果を支持する証拠は増えているが、いくつかの疑問や具体的な検討事項がまだ残っている。したがって、本研究の目的は、腸、肝臓、骨格筋などの主要臓器におけるグルタミン代謝が、免疫系の細胞にとってどのように重要であるかについて、統合的なレビューを提供することである。これらの主要臓器はグルタミンの利用可能性を制御しており、グルタミン血症(血流中のグルタミン濃度)に関して重要な考慮事項を明らかにしている。健康と病気におけるグルタミン補給の免疫増強特性と関連するパラダイムについてもここで議論されている。
2. グルタミン代謝の簡単な概要
グルタミンは炭素数5個のl-α-アミノ酸で、分子量は146.15kDa、元素組成は炭素(41.09%)、水素(6.90%)、酸素(32.84%)、窒素(19.17%)で構成されている。生理的なpHに関しては、グルタミンは中性アミノ酸に分類されるが、栄養学的には非必須アミノ酸に分類される。グルタミンは2つのアミノ基、すなわちα-アミノ基と容易に加水分解可能な側鎖アミド基を有しており、これらの特徴は、窒素トランスポーターおよびNH3キャリアとしてグルタミンが果たす役割を可能にする。また、グルタミンはタンパク質原性アミノ酸、すなわちタンパク質に組み込まれるアミノ酸であり、結合アミノ酸の5〜6%を占めている[9]。
体重が約70kgの健康な人は、全身に約70~80gのグルタミンが分布している[11]。同位体および薬物動態学的手法を用いて、グルタミンの内因性産生量は40~80g/日と推定されている[12,13]。血液サンプルから得られた血漿中のグルタミン濃度は~500~800μM/L(絶食状態で12時間後に記録された値)の間で変化し、血液中の全遊離アミノ酸プールの約20%を占めている[9]。肝臓や骨格筋などの組織では、グルタミン濃度は血漿中よりもさらに高く、全アミノ酸プールの約40%~60%を占めている[14,15]。血漿と組織の両方において、グルタミン濃度は他のアミノ酸の10倍から100倍を超えており、このため、グルタミンは体内に最も豊富に存在するアミノ酸と考えられている。
全身では、グルタミンの濃度と利用可能性は、その合成および/または放出と、ヒトの臓器や組織による取り込みとの間のバランスに依存している。肺、肝臓、脳、骨格筋、脂肪組織は臓器組織特異的なグルタミン合成活性を有する。一方、主にグルタミンを消費する組織、例えば腸粘膜、白血球、腎細管細胞などは、グルタミナーゼ活性が高く、グルタミンを分解できる補酵素を有している。しかしながら、肝臓はグルタミンを消費する部位となり、筋肉組織などの組織は、炭水化物[16]および/またはアミノ酸[17]の摂取量の減少、異化度の高い状況、および/または疾患およびストレス[5]などの特定の条件下で、グルタミン合成の低下を示すことがある。他の多くの因子-主にグルココルチコイド[18]、甲状腺ホルモン[19]、成長ホルモン[20]、およびインスリン[21]-は、グルタミン代謝調節酵素によって実行される活性を調節することができる。
いくつかの酵素がグルタミン代謝に関与している;2つの主要な細胞内酵素はグルタミン合成酵素(グルタミン合成酵素、EC 6.3.1.1.2)およびリン酸依存性グルタミナーゼ(グルタミナーゼ、EC 3.5.1.2)である。グルタミン合成酵素はアンモニウムイオン(NH4+)からグルタミンを合成する反応の引き金となり、ATPの消費によりグルタミン酸を合成するのに対し、グルタミナーゼはグルタミンの加水分解を行い、グルタミン酸とNH4+に変換している[22,23](図1)。細胞内の位置に関しては、グルタミナーゼ(活性型)が主にミトコンドリア内に存在するのに対し、グルタミン合成酵素は主に細胞質に存在する。これらの位置は酵素の機能と一致している。グルタミン合成酵素は、細胞質タンパク質とヌクレオチドの合成のためのグルタミンを生成するのに対し、グルタミナーゼは、エネルギー源または代謝中間体の源として2-オキソグルタル酸でトリカルボン酸サイクル(TCA、また、クレブスサイクルとして知られている)エントリへの重要なステップとしてグルタミン酸へのグルタミン変換を触媒する[3]。
図1 グルタミンの合成と加水分解
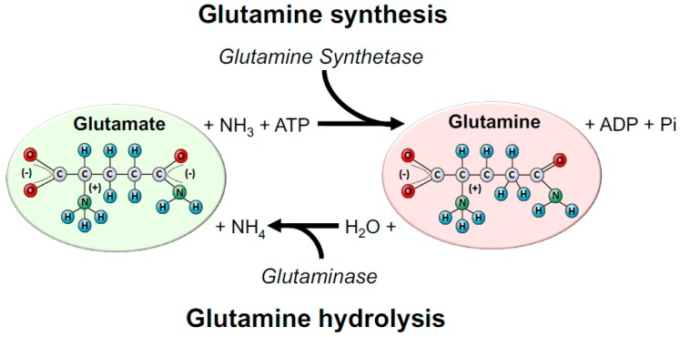
グルタミンは主にグルタミン合成酵素(GS)によって合成され、グルタミナーゼ(グルタミナーゼ)という酵素によって加水分解される。グルタミン合成酵素はグルタミン酸とアンモニア(NH3)を原料としてグルタミン生合成を触媒する。この反応では、1個のATPが消費される。グルタミン酸は、外因性に得られる(すなわち、食事)および/または内因性アミノ酸の異化から得られる多くのアミノ酸によって提供され得る。一方、グルタミナーゼは、グルタミンを加水分解してグルタミン酸およびアンモニウムイオン(NH4)に変換する役割を担う。体内のほぼ全ての細胞がグルタミン合成酵素とグルタミナーゼを発現しており、それらの優勢な発現と活性は、健康時と疾患時に組織がグルタミンを産生しやすいか消費しやすいかを決定する。
グルタミン合成酵素によるグルタミン合成は、グルタミン酸の利用可能性に依存する。グルタミン酸は、グルタミン酸脱水素酵素の作用により、あるいは分岐鎖アミノ酸(BCAA)などの他のアミノ酸(主にロイシン)の異化作用により、2-オキソグルタル酸NH4から合成される[17,24]。ラットを用いた研究では、ロイシンなどのBCAAは、ほぼ独占的にα-ケトグルタル酸とのトランスアミノ化を受けてグルタミン酸を形成し、グルタミン酸は遊離NH3を取り込み、グルタミン合成酵素の作用でグルタミンを形成することが報告されている[6,24](図2)。
図2 健康状態および異化/過異化状態における組織内グルタミンの産生と利用
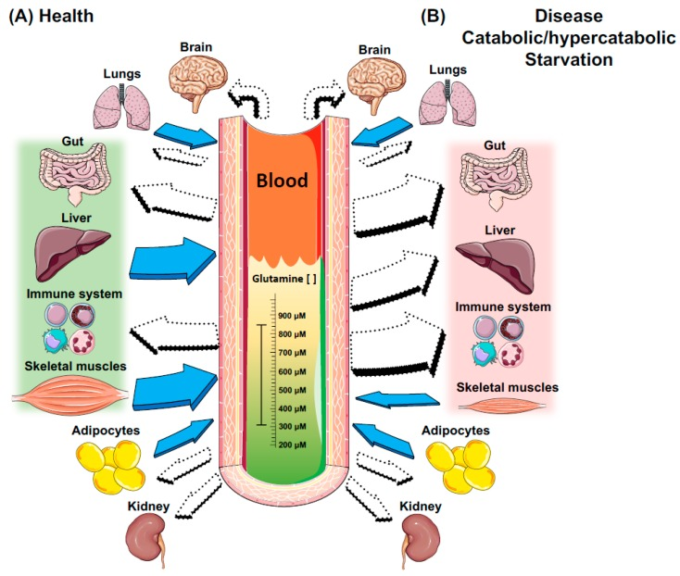
塗りつぶした矢印は、グルタミン合成酵素活性を示し、それゆえグルタミンを産生する組織を示し、白い矢印は、グルタミナーゼ活性を示し、それゆえグルタミンを消費する組織を示す。健康状態および/または給餌状態では、グルタミンの貯蔵は、血漿/血流および組織において平衡状態にあり、主に肝臓および骨格筋によって常に維持されている。一方、免疫系の細胞は、状況(A)ではグルコースとグルタミンに極めて依存し、状況(B)ではさらに依存している。腸はグルタミンの主要な消費部位であるが、状況(B)では、状況(A)と比較して、腔側膜と基底側膜の両方からのグルタミンの消費が劇的に増加している。また、肝臓がグルタミンの主要な生産者の役割をグルタミンの主要な消費者に切り替えて、グルタミンレベルを維持するために全身が骨格筋の能力/貯蔵に依存する。しかし、このプロセスは通常、筋肉のタンパク質分解、萎縮、悪液質の劇的な増加を伴う。肺と脂肪組織は、グルタミン合成酵素とグルタミナーゼの両方の酵素を示し、それゆえに、状況(A)と(B)でグルタミンを生産し、消費することができる。脳と腎臓はグルタミン合成酵素を示さず、グルタミナーゼのみを示すので、状況(A)と(B)では主に血漿グルタミンの利用可能性に依存している。
グルタミン組織および血中濃度は、グルタミン合成酵素またはグルタミナーゼ活性に依存する。内因性グルタミン合成は、癌[25]、敗血症[4,26]、感染症[27,28]、手術[8]、外傷[10]などの異化状態では、人体の要求を満たしていないだけでなく、激しい運動中や長時間の運動中[29,30]にも対応している。グルタミンは、グルタミナーゼ発現の増加を促進し、グルタミン合成酵素作用を阻害することにより、このような欠乏状態において条件付き必須アミノ酸の役割を担っている[14]。しかし、血漿中のグルタミン濃度は正常濃度(すなわち500~800μmol/L)から300~400μmol/Lに低下するが、免疫細胞などこのアミノ酸に依存する細胞は、実際には増殖や機能の面ではあまり影響を受けないことを強調する価値がある[6]。一方、組織異化が高いと、筋肉や肝臓を中心としたヒト組織内のグルタミンストックが減少する(図3)。このアミノ酸はプリン、ピリミジン、アミノ糖の合成に窒素原子を供給するため、ヒト組織内のグルタミン濃度の低下は全身に影響を与える[31]。これらの組織における高グルタミン分解が持続すると、グルタミンの利用可能性に依存する多くの代謝経路や機構が影響を受け、結果として免疫抑制が生じる。さらに最近の研究では、細菌感染症(大腸菌など)がその代謝を変化させ、グルタミンを利用して酸ストレスや銅毒性の影響を抑制できることが報告されている[32]。したがって、細菌性病原体は、宿主が課した抗菌戦略に重要なコア代謝経路を変更することによって適応し、生き残ることができる。
図3 グルタミンの組織間代謝
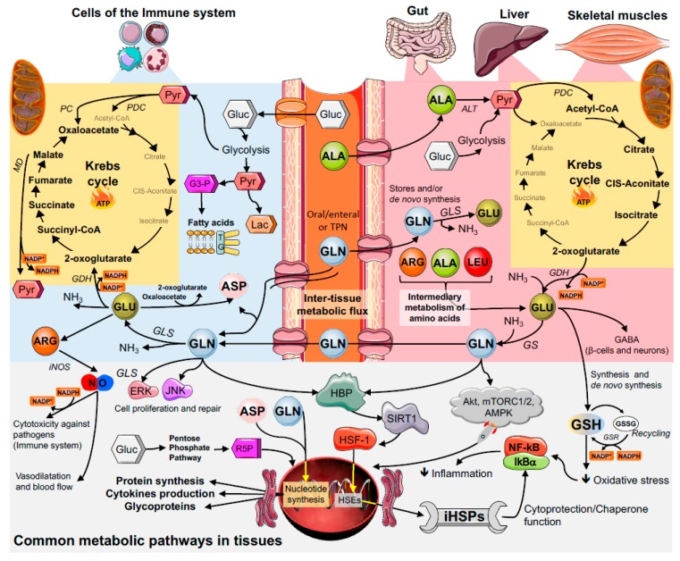
フラックスは、骨格筋、肝臓、腸で始まり、免疫細胞で継続している。略語。グルタミン、GLN;グルタミン酸、GLU;アスパラギン酸、ASP;アルギニン、ARG;ロイシン、LEU;アラニン、ALA;グルコース、Gluc;ピルビン酸、Pyr;ピルビン酸脱水素酵素、PDC;ピルビン酸カルボキシラーゼ、PC;リンゴ酸脱水素酵素、MD;グリセルアルデヒド-3-リン酸塩、G3-P。乳酸、Lac;トリアシルグリセロール、TG;リボース5-リン酸、R5P;アラニンアミノトランスフェラーゼ、ALT;グルタミン酸脱水素酵素、GDH;グルタミン合成酵素、GS;グルタミナーゼ、グルタミナーゼ;誘導性一酸化窒素合成酵素、iNOS。細胞内熱ショック蛋白質、iHSP;熱ショック因子1,HSF-1;熱ショック要素、HSE;サーチュイン1,SIRT1;ヘキソサミン生合成経路、HBP;アンモニア、NH3;グルタチオン、GSH;酸化GSH、GSSG。グルタチオンSリダクターゼ、GSR;プロテインキナーゼB、AKT;AMP活性化プロテインキナーゼ、AMPK;mTOR複合体1および2,mTORC1/2,細胞外シグナル調節キナーゼ、ERK;c-Jun N末端キナーゼ、JNK;γ-アミノ酪酸、GABA。
3. グルタミンの恒常性維持に関わる重要な代謝器官
3.1. 腸
小腸および大腸の両方とも、食事および/または血流の両方から供給される大量のグルタミンを代謝することができる[33,34]。腸にとってのグルタミンは、エネルギー基質としてのグルコースよりも定量的に関連性が高い。例えば、腸球では、グルタミン炭素は2つの主要な経路、すなわち i)デルタ1-ピロリン-5-カルボキシレートを形成することによって;(iii)またはクレブスサイクルの中間体としてのα-ケトグルタル酸への変換によってである。第1の経路は、腸内で見られるアミノ酸濃度の約10%を利用して、グルタミン炭素からプロリン、オルニチンおよびシトルリンを形成することを可能にする。グルタミンの別の10〜15%は組織タンパク質に組み込まれる;それの最も高い割合(約75%)は、エネルギー生産目的のためにクレブスサイクルで代謝される[14,35]。
グルタミナーゼによって触媒されるグルタミンのグルタミン酸への加水分解は、グルタミンの消費から生じる最初の反応に相当する[36]。グルタミン消費の主要部位は腸であるが、腸組織内のグルタミン濃度は低い。これは、グルタミナーゼ活性が高い(3-6μmol/時間/タンパク質mg)ことに加えて、基質であるグルタミンに対するグルタミナーゼの親和性が高いことに起因する。興味深いことに、GSLの存在と特定の細胞型によるグルタミンの使用との間には相関関係がある。腸内細胞で発見されたほぼすべてのグルタミナーゼは、ミトコンドリア膜に結合している。腸管組織におけるグルタミナーゼ活性の調節は、組織の完全性を維持し、栄養素の十分な吸収を可能にするために重要であるだけでなく、血流への細菌の移動(すなわち敗血症)を防ぐためにも重要である[37]。長期間の絶食や栄養不良状態は、グルタミナーゼ活性の低下と関連している;一方で、グルタミナーゼ活性は、分岐鎖アミノ酸および/またはl-アラニル-l-グルタミンの経腸栄養を投与した後、食後期間に増加する[38]。
プロテアソームに関連するATP-ユビキチン依存性タンパク質分解経路は、内因性の短命または異常なタンパク質/ペプチドを分解することが知られているだけでなく、炎症反応の制御に参加している。ATP-ユビキチン依存性のタンパク質分解経路は、非常に短命な腸粘膜タンパク質のターンオーバーに重要である可能性がある。実際、B細胞インヒビター(IκB)ユビキチン化は、核内でのκ光ポリペプチド遺伝子エンハンサー(NF-κB)の核内因子の転座を可能にし、したがって、プロ炎症性遺伝子の転写を可能にする[17,39,40](図3)。グルタミンは、このアミノ酸がユビキチン遺伝子の発現を低下させるため、腸球におけるタンパク質合成を刺激し、ユビキチン依存性のタンパク質分解を低下させる。グルタミンは、Caco-2細胞(ヒト大腸上皮細胞)におけるアルギニン-コハク酸合成酵素の遺伝子発現を増加させることができる。グルタミンは腸球内の細胞外シグナル調節キナーゼ(ERK)とc-Jun N末端キナーゼ(JNK)を活性化し、c-Jun遺伝子の発現とアクチベータープロテイン1(AP-1)として知られる転写因子の活性を有意に増加させる[41,42]。このようなグルタミンの作用は、細胞の増殖と修復に対する成長因子の効果を増強する。熱ショック(43℃)は腸管上皮細胞死を誘導するが、これはグルタミンの欠乏により悪化する可能性がある。しかし、筋肉組織で起こるように、グルタミンの補充は、ヒートショックに関連した細胞死を用量依存的に減少させることができる。グルタミンのこの効果は、部分的には、HSP 70の遺伝子発現を増加させるアミノ酸の能力に起因している[37]。
サイトカイン産生の調節障害は、炎症性腸疾患(IBD)の病因において主要な役割を果たしている。IBD(クローン病または潰瘍性大腸炎)患者の腸粘膜は、インターロイキン(IL-)1β、IL-6,IL-8,および腫瘍壊死因子α(TNF-α)などの炎症性サイトカインを多量に産生することが報告されているが、IL-10などの抗炎症性サイトカインの産生はそれほど顕著に増加しないのと対照的である。例えば、Coeffierら[43]は、グルタミンが、おそらく転写後の経路によって、ヒト腸粘膜によるプロ炎症性サイトカイン産生を減少させることを検証した。グルタミンは、サイトカイン産生のバランスが崩れた炎症状態を調節するのに有用である可能性がある。
3.2. 骨格筋
体内のグルタミンの利用可能性と代謝は、骨格筋組織に直接関連している。骨格筋は、筋肉組織単位質量あたりのグルタミン合成酵素酵素活性が比較的低いにもかかわらず、グルタミンのストック、合成、および放出の最も関連性の高い部位である[11]。このように、骨格筋はヒトの体内で最も豊富に存在する組織の一つであるため、グルタミン代謝において基本的な役割を果たしている[44]。筋肉内グルタミン含量は、骨格筋組織に見られる総遊離アミノ酸の50~60%に相当する。体内グルタミンの約80%は骨格筋で発見され、この濃度はヒト血漿で記録された濃度の30倍以上である[45,46]。筋組織内の遊離アミノ酸濃度は、筋繊維の種類に依存する。ラットの骨格筋を用いて行われた研究では、グルタミン濃度は速筋線維(タイプ2)よりも遅筋線維(タイプ1)の方が3倍高いことが示された。遅筋線維のグルタミン濃度が高いのは、グルタミン合成酵素酵素活性が高く、グルタミン合成のためのATP利用可能性が高いためである[47]。
インスリンおよびインスリン様成長因子(IGF)などのホルモンは、細胞内環境へのグルタミン輸送を刺激し、一方、グルココルチコイドは細胞外空間へのグルタミン放出を刺激する。骨格筋を通るグルタミンの膜貫通勾配は高く、これが細胞膜を通るアミノ酸の拡散を制限している。グルタミンは、積極的にナトリウム依存性のチャネルシステムを介して細胞に輸送され、その結果はATPの消費である。筋細胞膜を介したグルタミンの輸送は、他のすべてのアミノ酸の輸送よりも高速である[48]。興味深いことに、細胞内液中のグルタミン利用可能性の一定の維持だけでなく、細胞膜を横切る高いグルタミン濃度勾配は、アミノ酸の輸送システムの親和性、その細胞内ターンオーバー比と細胞外供給、細胞内および細胞外ナトリウム濃度、およびキャリア分子のために競合する他のアミノ酸の影響など、多くの経路によってサポートされている[49,50]。
吸収後の状態では、骨格筋におけるグルタミン合成の約50%は血流からのグルタミン酸の取り込みを介して行われ、これはグルタミン-グルタミン酸サイクルの一部を特徴づける事実である。それはまた、BCAAs、グルタミン酸、アスパラギン、アスパラギンの放出につながるが、さらに、筋タンパク質の異化は、直接グルタミンを生成する。これらのアミノ酸の炭素骨格は、グルタミンのデノボ合成に使用される[51,52]。グルタミンとアラニンはそれぞれ、吸収後の状態で骨格筋から放出されるアミノ酸の48%と32%に対応している;1分子あたり2個の窒素原子を含むグルタミンは、主な筋肉の窒素放出源である。グルタミンとアラニンの交換率は体内でのその豊富さを超えており、筋タンパク質中でのそれらの発生は10〜15%に相当するため、骨格筋におけるグルタミンとアラニンのde novo合成の常時必要性を示している[4]。骨格筋におけるグルタミン合成速度(約50mmol/h)は、他のアミノ酸について記録されたものよりも高い。したがって、グルタミンとアラニンは、人間の栄養状態やホルモン状態、および物理的な運動によって影響を受ける細胞の代謝状態に依存するプロセスにおいて、細胞内でのアミノ酸の相互変換から生じるはずである[53,54]。
異化状態における筋グルタミン代謝に関する最初の研究の1つは、骨格筋におけるグルタミン濃度の低下が敗血症状態の患者の生存率の低下と関連していることを記録している。重症患者における深刻な筋グルタミン濃度の低下(タンパク質分解による正常濃度の平均80%の低下)は、骨格筋からのグルタミン合成および放出の増加を伴う。これは、重度の異化状態の間、骨格筋におけるメッセンジャーRNA(mRNA)およびグルタミン合成酵素酵素活性の増加のために起こる。グルココルチコイドは、細胞質で起こるグルココルチコイド受容体依存性のプロセスを介して、筋肉組織内のグルタミン合成酵素 mRNAの量を増加させる可能性がある。グルココルチコイドは細胞質の受容体に結合した後、核に移動し、そこでグルココルチコイド応答エレメントを含む領域に結合し、特にグルタミン合成酵素遺伝子の転写を誘導する[55,56]。
生理的ストレスに応答してグルタミン合成酵素活性は増加するが、タンパク質量はmRNAの増加と並行して増加しないことがあり、転写後制御機構の活性化を示唆している。このように、前記酵素の活性は、細胞内グルタミン濃度を介して、細胞内グルタミン濃度が低下するとグルタミン合成酵素酵素活性が上昇する転写後制御機構によって制御されているように思われる。しかし、グルタミン合成酵素酵素はグルタミンの存在下では比較的不安定であるため、細胞内グルタミン濃度が上昇するとグルタミン合成酵素の分解が速くなる。さらに、グルココルチコイドと細胞内グルタミン枯渇は、骨格筋におけるグルタミン合成酵素発現を増加させることで相乗的に作用する[57]。
いくつかの細胞型を用いた試験管内試験研究では、グルタミンが収縮性タンパク質の遺伝子発現も変化させることが実証されている。ある研究によると、心筋細胞の成長と成熟は、α-ミオシン重鎖(α-MHC)やα-アクチンなどのタンパク質のmRNA含量の増加を伴っており、両方のパラメータは非病理学的な肥大と考えられていた[58]。他の研究では、健康な患者または病気の患者において、必須の組織サイズおよび質量調節因子と考えられているラパマイシンの哺乳類標的(mTOR)などの経路の活性化を媒介する際にグルタミンが果たす関連する役割が強調されている。実際、筋肉細胞における同化誘導剤としてのアミノ酸、主にロイシンの使用は、グルタミンが利用できない場合、mTORを介してその作用が損なわれている[17]。筋内容関連遺伝子の発現を調節する上でグルタミンが果たす本質的な役割にもかかわらず、単独で適用されるサプリメントは、筋肉量の増加を促進することができるという仮説を支持する生体内試験の研究はない。
グルタミンが果たすもう一つの重要な役割は、抗酸化作用や細胞保護作用としても知られている傷害に対する保護反応や抵抗反応を調節する能力と関連している。異化状況で生成された高い酸化ストレスは、NF-κBのような古典的な経路を介してプロアポトーシス刺激で絶頂に達するいくつかの効果をもたらす。活性酸素種(ROS)は、ラジカル種と非ラジカル種の両方で、ミネラル、リン脂質膜、およびタンパク質に反応し、他の関連する化合物の間で、細胞の恒常性に影響を与える[59]。グルタミンは、ヒートショックプロテイン(HSP)の発現を調節することができる。急性炎症マウス(敗血症モデルであるエンドトキシン血症を受けた)を用いて行った研究によると、動物の組織内でのグルタミンの利用可能性の増加は、主に70(最も多く存在する形)90,27 kDaファミリーでのHSPの発現を維持するのに役立った。骨格筋および肝筋に関する結果は、タンパク質および遺伝子発現レベルで記録された。また、HSP合成に重要なヒートショック因子1(HSF-1)や抗酸化系と連携する酵素など、他の遺伝子もグルタミンに対して高い応答性を示した(図3)。グルタミンに起因するグルタミン酸は、グルタチオン合成に不可欠な基質であり、グルタチオンS-リダクターゼ(GSR)やグルタチオンペルオキシダーゼ1(GPx1)などの遺伝子の発現を変化させる。グルタミンの細胞保護作用や抗酸化作用は、NF-κB によって媒介される炎症性経路の活性や発現が変調されている高異化状態では特に重要であると考えられる[4,39]。
3.3. 肝臓
肝臓は代謝性が高く、消化管から到着した血液成分の解毒、消化を助ける胆汁の生成、炭水化物、脂質、タンパク質、薬物の代謝、血液のpHバランス、血漿タンパク質の合成、グリコーゲンや脂質の貯蔵・合成など多くの機能を持っている。既に示されているように、グルタミンは、アミノ酸(グルタミン酸)TCA成分(α-ケトグルタル酸)ヌクレオチド(AMP、プリン、ピリミジン)などの他の代謝物の生成のための重要な前駆体であり、シャペロン機能の活性化(HSP応答によって媒介される)および抗酸化防御(グルタチオン、GSHによって媒介される)とともに、重要な前駆体である。したがって、グルタミンは、肝臓におけるエネルギー代謝や肝細胞の増殖に極めて重要である。さらに、グルタミンは、他の非炭水化物構成要素からのグルコース産生プロセスであるグルコネオジェネシスのための重要な前駆体であり、これは、グリコーゲン貯蔵庫の枯渇に続く絶食状態および飢餓状態で血糖値を維持することを可能にする肝臓の中心的な代謝経路である。重症時には、骨格筋がグルタミンの主要な供給者であり、肝臓が主要な消費者である[28,60]。この消費は、上記の肝臓活動の多くをサポートするが、窒素代謝に関与する重要なアミノ酸として、肝肝細胞におけるグルタミンの取り込みは、グルタミナーゼによるグルタミン酸NH3への変換により、尿素サイクルの活性を調節する[61]。その結果、肝臓は血中pHを調節し、グルタミンを利用して尿素サイクルを介してNH3の解毒を行う。
NH3とNH4+はアミノ酸の代謝残渣であり、腸から肝臓に送られる血液にはNH3/NH4+が豊富に含まれている。肝細胞のミトコンドリアでは、NH3のATPと重炭酸イオン(HCO3-)との反応は、尿素サイクルの重要な中間体であるCP合成酵素(CPS)によるリン酸カルバモイル(CP)の形成につながる。オルニチン・トランスカルバミラーゼの作用下で、オルニチンはCPと反応してシトルリンを形成する。これはその後、様々な生化学反応を経てアルギニン、フマル酸塩、最終的に尿素を形成し、肝細胞の細胞質から血液中に排泄される。最終的な尿素形成反応では、オルニチンが再生され、追加のNH3による尿素サイクルの周期的な継続を可能にする。重要なことは、ミトコンドリア内のグルタミン濃度がCP生成によるフラックスを調節することである。グルタミン濃度が高いと、グルタミナーゼ活性を介してグルタミン酸とNH3が増加し、NH3はオルニチンと反応してCPを形成する。NH3は肝臓でもグルタミナーゼの共活性化因子であり[62,63]、肝臓のグルタミナーゼはグルタミン酸によって阻害されないので[61,64]、生成されたグルタミン酸はグルタミナーゼとCPSの両方の活性化因子であるN-アセチルグルタミン酸を形成することができる[65,66]。その結果、これらの生化学的メカニズムの両方は、ミトコンドリア内のNH3のレベルの上昇(消化管血液およびグルタミン分解から供給される)NH3に対するCPSの高い親和性、およびグルタミナーゼの活性の増加により、尿素形成に向けた高いフラックスをもたらす。しかし、尿素の最終的な生成は、グルタミンの細胞内レベルと、その結果、細胞外環境からのその取り込みによって制御されているように見える。
肝細胞におけるグルタミンの細胞内、細胞間および細胞外輸送は、NH3/NH4+から尿素への変換、その後の排泄、およびHCO3-への影響による血中pHバランスの中心的なものである。肝臓の構造は絶妙に設計されており、腸から血液や栄養分を受け取る門脈周辺の肝細胞が、上記のようにグルタミンを用いた尿素産生を主に担当している。しかし、肝静脈に近い遠位の肝細胞は、循環にグルタミンの再合成と分泌のために、大動脈周囲肝細胞をバイパスするものを含む血液からの残りのNH4+を利用する。この後者のシナリオでは、NH3/NH4+は、肝周囲の肝細胞に入り、基質としてグルタミン酸を使用して、グルタミンは、グルタミン合成酵素によって生成される。このプロセスは、尿素の生成と窒素の廃棄に肝周囲の肝細胞によって使用されたグルタミンを補充しながら、肝周囲のプロセスを脱出する任意のNH3/NH4+をスカベンジする。肝臓の異なる機能領域は、グルタミン代謝酵素の発現状況によって示され、高レベルのグルタミナーゼが門脈領域で見られるのに対し[67,68]、肝細胞の7%のみがグルタミン合成酵素を発現し、これらは肝静脈の中心部で特異的に見られた[69]。
これらの肝領域間でのグルタミンの細胞間または肝コンパートメント化された循環もまた、胸膜周囲および肝静脈周囲の肝細胞における特異的な膜トランスポーターによって媒介される。これらの輸送系はまた、Na+およびグルタミンの進入時のH+のアンチポート転座によって、細胞内および細胞外pHを制御する。食事からのグルタミンは、2個のNa+イオンとともに脈管周囲肝細胞によって取り込まれ、一方、1個のH+は、肝細胞から逆方向に細胞外空間に押し出される。このプロセスは、細胞外(すなわち血液中)のグルタミンとNa+の濃度、およびH+の細胞内濃度によって駆動される。本質的には、この方向性輸送もまた、細胞内と細胞外の空間の間の相対的なpH差によって制御され、そのような細胞周囲の肝グルタミンの取り込みは、細胞外の酸性化と細胞内のアルカリ化につながる一方で、肝周囲の肝細胞からのグルタミンの輸出は、細胞内の酸性化と細胞外のアルカリ化につながる[61]。ラット肝臓の灌流実験では、細胞外pHのわずかなアルカリ増加(0.4単位)が肝細胞へのグルタミンのミトコンドリア輸入を促進することが示されており、H+は細胞外pHを低下させ、平衡を維持するために外部に輸送される可能性がある。ミトコンドリアのグルタミン濃度は約15〜50mMに増加し、細胞外(0.6mM)と細胞質(6mM)のグルタミン濃度は、これらの灌流モデルでは変化しないままであるが[70,71]。したがって、肝周囲肝細胞におけるグルタミナーゼを介した制御とフラックスは、グルタミンの細胞内濃度によって制御されており、細胞外ソースからのグルタミンのエントリの速度だけではない。肝周囲の肝細胞では、血液中へのグルタミンの合成と放出は、細胞質の増加と細胞外濃度の低下によって促進され、細胞内の酸性度が低い環境と相まって、H+のアンチポート細胞質流入によって打ち消されている[61]。
重要なことに、グルタミンのインポートおよびエクスポートは、浸透圧バランスにも影響を与え、その結果、肝細胞の容積に影響を与える。これは、胆汁の合成および放出[72]を含む肝機能にさらなる影響を及ぼすだけでなく、グリコーゲン、脂質、およびタンパク質合成[61]などの同化プロセスを制御する。主に、グルタミンの取り込みは、グリコーゲンと脂肪酸合成の増加につながる肝細胞の膨潤と水分補給を促進し[73]、P38マイトジェン活性化プロテインキナーゼ(p38 MAPK)シグナリング[76]によって媒介されるタンパク質分解の減少をもたらす。グリシンやアラニンなどの他のアミノ酸は、インスリンなどの同化ホルモンとともに肝細胞の膨らみを促進し、生合成プロセスの増加をもたらし[77]、一方、グルカゴンなどの異化ホルモンは細胞内グルタミンレベルを低下させ、肝細胞の収縮を誘発した[78]。その結果、細胞内グルタミンレベルの低下による脱水は、細胞量の減少、異化過程の開始、およびインスリン抵抗性の状態を特徴とし、最近では、高張性輸液がヒトにおいてグルコースの調節障害を引き起こすことが示された[79]。
肝臓はインスリン感受性の臓器であり、骨格筋と同様にグリコーゲン合成を介したグルコースの処理を担当している。インスリン抵抗性の発現およびそれに続くグルコース障害状態は、過剰な脂質蓄積を特徴とする非アルコール性脂肪性肝疾患(NAFLD)および細胞外マトリックス(ECM)の沈着の増加を特徴とする非アルコール性脂肪性肝炎(NASH)などの慢性障害へと進行する可能性がある[80,81]。これらの慢性疾患は、肝硬変および場合によっては肝細胞がんとして発現し、さらに肝細胞の損傷をもたらす可能性がある。肝臓は、感染症(例えば、B型およびC型肝炎)アルコール中毒、代謝性疾患、および長期にわたる不健康な食生活など、様々な方法で損傷を受ける可能性がある。この損傷は、炎症性肝環境を誘発し、肝組織の線維化を引き起こし、肝機能障害を引き起こす[80]。治療されていない線維化は最終的に肝硬変に進行し、ほとんどが不可逆的である[80]。肝線維化の主要なメディエーターは、肝細胞上皮と洞質の間のDisseの内皮下空間に存在する間葉系の線維性細胞である肝星状細胞(HSC)である。通常は休止状態にあるが、これらの細胞は肝障害の後に活性化され、サイトカインに反応して増殖し、損傷の修復を助ける。しかしながら、過剰活性化または活性化状態を解消できない場合(炎症性刺激への継続的な曝露による慢性的な活性化)は、肝細胞機能および微小絨毛の喪失などの正常な肝臓の構造に負の結果をもたらすDisseの空間におけるECM沈着の増加につながる可能性がある[80,82]。肝臓マクロファージであるクッパファー細胞もまた、これらの状態で活性化され、造血幹細胞とともにプロ炎症性肝環境を促進する。これらの細胞のプロ炎症性活性化剤については本稿の範囲を超えているが、造血幹細胞が増殖を維持するためにグルタミン代謝を必要とすることが実証されている。活性化された造血幹細胞は、増殖のためにグルタミンから∝ケトグルタル酸や非必須アミノ酸への変換に依存しており、グルタミンの減少は造血幹細胞の活性化を著しく損なうことが示された[82]。さらに、グルタミンは、コラーゲンおよびECM形成の重要な構成要素であるプロリン合成の前駆体として使用することができる[82]。
現時点では、グルタミンサプリメントがNAFLD [83]またはNASH [84]の進行を遅らせることを示すいくつかの証拠があるが、ほとんどの研究はげっ歯類を用いて行われている。グルタミンサプリメントがヒトでNAFLDまたはNASHの進行を予防することを示す説得力のある証拠はないが、これはこれらの障害に寄与する複数の因子が複雑に絡み合っているためであろう。肝臓は注目すべき臓器であり、再生能力を有しており、切除後の肝臓の成長および修復にグルタミン補給が有利である可能性があることを示す研究もあるが、これも動物実験に限られている[85]。しかし、他の研究では、グルタミンレベルの上昇が肝不全と関連しており、その重症度は血漿グルタミンと相関していることが示唆されている[86]。したがって、尿素合成を超える肝機能に対するグルタミンの効果は完全には探索されておらず、肝機能が低下している患者への外因性グルタミンの投与は慎重に検討する必要がある[86]。
4. グルタミンと免疫細胞機能
グルタミンが最初に生物学的に重要な分子であると考えられたのは、1873年に間接的な証拠によってタンパク質の構造的構成要素として特徴づけられたときでしたが、その後、1883年には特定の植物から豊富な遊離グルタミンが発見された。興味深いことに、1930年代にハンス・アドルフ・クレブス(Sir Hans Adolf Krebs, 1900-1981)によって行われた研究の後、研究の数は増加した。その時、そして科学の歴史の中で初めて、クレブス卿は、哺乳類の組織がグルタミン[22]を加水分解し、合成することができることを発見した。1950年代には、イーグルら[87]は、グルタミンが細胞培養培地中の他のアミノ酸よりも大きい量で単離された線維芽細胞によって利用されたことを報告した。グルタミンが非必須アミノ酸として分類され、血漿や組織中のレベルを測定することが困難であったため、その段階でのさらなる研究は妨げられた。1960 年代、1970 年代、1980 年代を通じて、ハンス・クレブス、フィリップ・ランドル(1926-2006)デレク・ウィリアムソン(1929-1998)エリック・ニューショルム(1935-2011)はすべて、試験管内試験 での単離細胞からヒト実験、生体内試験 実験まで、さまざまな研究モデルを利用して代謝調節に取り組んできた。グルコースは重要な代謝物であり、体内の多数の細胞の主な燃料であるが、1980年代の初期/中期に、Eric Newsholmeは、グルタミンがリンパ球[7]やマクロファージ[88]などの白血球機能の重要なモジュレーターであるという証拠を進めることができた。このレビューの著者の一人であるNewsholme Pら(1986; 1987)[88,89,90]は、マクロファージがグルタミンを積極的に利用することを初めて報告した。Pithon-Curiら(1997)[91,92]は、好中球によるグルタミンの消費を初めて記述した。リンパ球およびマクロファージにおけるグルタミン代謝に関するEricおよびPhilip Newsholmeによる研究は、それぞれ、他の多くの出版物を促し、1960年代後半および1970年代初頭の年間平均2〜3件の出版物から、過去20年間で年間約50件の出版物へと急増した。
感染および/または高異化の間、すべての免疫細胞によるグルタミン消費率は、グルコースと同程度またはそれ以上である[89,90]。しかしながら、免疫系細胞によるグルタミンの需要の増加は、肝臓などの他の組織によるこのアミノ酸の使用の増加とともに、ヒトの体内でのグルタミン不足につながる可能性がある。また、グルタミン合成の最も重要な部位の一つである骨格筋は、血漿中グルタミン濃度維持への貢献度を低下させる(図2)。この影響は、状況によっては、疾患や感染症の悪化に大きく寄与し、および/またはその後の感染症のリスクを増大させ、生命を脅かす可能性を示唆している[93]。
免疫細胞では、グルコースは主に乳酸に変換される(解糖)のに対し、グルタミンはグルタミン分解と呼ばれるプロセスでCO2への部分酸化を経てグルタミン酸、アスパラギン酸、アラニンに変換される[3](図3)。この特異的な変換は、免疫系細胞の効果的な機能に重要な役割を果たしている。さらに、解糖経路と並行する代謝経路であるペントースリン酸経路を介して、細胞はRNAやDNA構造に見られるペントース糖の前駆体であるリボース-5-リン酸(炭素数5個の糖)や、リン脂質合成のためのグリセロール-3-リン酸を産生することができる[94]。一方、グルタミンの分解、したがってNH3の形成、およびアスパラギン酸は、DNAおよびRNAのプリンおよびピリミジンの合成につながる。免疫系細胞におけるいくつかの遺伝子の発現は、グルタミンの利用可能性に大きく依存している[3]。例えば、免疫系細胞の増殖制御においてグルタミンが果たす役割は、ERKやJNKキナーゼなどのタンパク質の活性化を通じて生じる。両タンパク質は、JNK や AP-1 などの転写因子の活性化に作用し、細胞増殖関連遺伝子の転写につながる。例えば、適切なグルタミン濃度は、CD25,CD45RO、CD71などの主要なリンパ球細胞表面マーカーの発現、およびインターフェロン-γ(IFN-γ)TNF-α、およびIL-6などのサイトカインの産生を導く[2,31,95,96]。このように、グルタミンは白血球のエネルギー基質として作用し、細胞増殖、組織修復過程活性、病原体認識に関連する細胞内経路において重要な役割を果たしている[97]。
4.1. 好中球
好中球生存エンドサイトーシスおよび活性酸素発生の主要な基質はグルコースである。しかし、グルコースはこれらの細胞による唯一のエネルギー代謝源ではない。興味深いことに、マクロファージやリンパ球などの他の白血球と比較すると、好中球は最も高い割合でグルタミンを消費する[98,99]。グルタミンの多くは、好中球でグルタミン酸、アスパラギン酸(クレブスサイクル活性を介して)および乳酸に変換される。適切な条件下では、CO2,グルタミン、およびグルタミン酸は、GSHを含む白血球の代謝および機能のための必須化合物の生成において重要な役割を果たしている。好中球は、また、好中球性細胞外トラップ(NETs)と呼ばれる未凝縮クロマチンと抗菌因子で構成されるタンパク質構造を使用している。NETの作用は、活性酸素の形成、ミエロペルオキシダーゼ(MPO)やエラスターゼなどの酵素の合成だけでなく、病原性因子を克服し、細胞外細菌を破壊することができる成分を必要とする[100]。活性酸素が関与するプロセスは、NADPHオキシダーゼ2(NOX2)複合体の活性化に依存する。抗菌活性を示すスーパーオキシドアニオン(O2-)を形成するために必要なので、グルタミンに基づいて、リンゴ酸合成はリンゴ酵素を使用して相当量のNADPHを生成する。同様に、マクロファージは、エネルギー源としてNADPHを使用することにより、誘導性NO合成酵素(iNOS)の作用により、アルギニン、したがって一酸化窒素(NO)合成のためにグルタミンを使用する。グルタミンは好中球のNADPH酸化酵素を介してスーパーオキシドの生成を増加させる。6-ジアゾ-5-オキソ-l-ノルロイシン(DON)は、リン酸依存性グルタミナーゼの阻害剤であり、従ってグルタミン代謝の阻害剤であるが、酢酸ミリスチン酸ホルボル(PMA)で刺激された好中球によるスーパーオキサイド産生の有意な減少を引き起こす。PMAはNADPH酸化酵素複合体の主要な構成要素であるgp91,p22,およびp47のmRNAの発現を上昇させる。グルタミンは、PMAの非存在下でも存在下でも、これら3つのタンパク質の発現を増加させる。グルタミンは、ATPの生成とNADPHオキシダーゼ複合体[101]の構成要素の発現の調節を介して、おそらく、好中球におけるスーパーオキシドの産生を高める。グルタミンは、好中球におけるアドレナリンによって誘導されるNADPHオキシダーゼ活性とスーパーオキシド産生の変化を防ぐ役割を果たしている[102]。
4.2. マクロファージ
グルコースおよびグルタミンの代謝は、マクロファージの活性化プロセス中に深く影響を受ける[103,104]。マクロファージのグルコースおよびグルタミン代謝に対するチオグリコレート(炎症性刺激)およびバチルス・カルメット・ゲラン-BCG(活性化刺激)の効果が研究されている[105]。チオグリコラートまたはBCGはヘキソキナーゼとクエン酸合成酵素の活性を高め、グルコース酸化も促進するが、BCGはグルタミン代謝を顕著に増加させる。リポ多糖類(LPS)の投与もまた、マクロファージの代謝および機能に顕著な変化を引き起こす(レビューについては、NagyおよびHaschemi [106]を参照のこと。グルコースおよびグルタミンの代謝はまた、マクロファージの特殊な機能を実行する能力に必要な転写プログラムをアップレギュレートする偏光シグナルに関与している。プロテインキナーゼB(PKBまたはAkt)mTOR複合体1(mTORC1)mTORC2,およびAMP活性化プロテインキナーゼ(AMPK)は、代謝経路および関連するシグナル活性化において重要な役割を果たしている[107,108]。例えば、細胞外グルタミンは、mTORC1を制御するための特異的な飢餓誘発栄養シグナルとして機能する可能性がある。[17]. マクロファージによるTNF-α、IL-1,およびIL-6などのプロ炎症性サイトカインの合成および分泌もまた、グルタミンの利用可能性によって制御される。
マクロファージの異なる集団は現在、M1およびM2などのように同定されている[109,110,111]。M1およびM2は、実際には、マクロファージ活性化状態のスペクトルのまだ完全には知られていない2つの極端なものである[109,111,112]。シグナル伝達経路のリプログラミングは、M1またはM2表現型マクロファージの形成に関与している。マクロファージの代謝リプログラミングには、グルタミンとグルコース代謝の重要な変化が含まれている[113]。ヒトマクロファージのIL-4誘導分極のための脂肪酸の必要性を同定した報告はない[114]。しかしながら、この問題は依然として論争の的となっている。興味深いことに、マクロファージは、プロまたは抗炎症細胞のために分極するために、その代謝と機能を再プログラムし、これは環境条件と刺激の結果である[115]。マクロファージをLPSで処理すると、グルコース依存性の酸化的リン酸化から好気性の解糖への切り替えが促進される。ピルビン酸キナーゼM2は、低酸素誘導因子1-α(Hif-1α)活性とIL-1β発現を調節し、LPSで活性化されたマクロファージにおけるWarburg効果を誘導する鍵となる分子である[117]。このメカニズムにより、M1マクロファージは宿主防御反応に必要なATP形成の迅速な増加を示する[113,118,119]。M1マクロファージ(LPSで処理された)は、イソクエン酸脱水素酵素のステップ反応で発生する基質フラックスの偏差の2つのポイントを持っているのに対し、M2マクロファージのTCAサイクルは代謝フラックスの脱出を持っていない、1つはイソクエン酸脱水素酵素のステップ反応で発生し、もう1つはポストコハク酸形成で発生する。その結果、LPSマクロファージの活性化を調節するTCAサイクル中間体(例えば、コハク酸塩、α-ケトグルタル酸塩、クエン酸塩、およびイタコン酸塩)の蓄積がある[119]。イタコン酸は、Kelch-like ECH-associated protein 1 (KEAP1)のアルキル化を介した核内因子エリスロイド2関連因子2 (Nrf2)の活性化を介して抗炎症性を有する[97]。グルタミンは、マクロファージ代替活性化のIL-4誘導に完全に必要とされるようである[120,121]。Liu, er al)。 [122]は、グルタミン分解によって生成されたα-ケトグルタル酸がM2マクロファージの分化を促進することを報告している。PPARγは、IL-4誘導遺伝子の発現やマクロファージ呼吸およびグルタミン酸化の刺激に必要であることが報告されている[123]。マクロファージ代謝の特徴は、特定の組織微小環境によって異なり、これは組織常駐型マクロファージ機能にとって重要である。腹膜にはグルタミン代謝産物であるグルタミン酸が豊富に含まれており、このグルタミン酸は常駐マクロファージによって微生物の感知下で特定の代謝変化を誘導するために利用される[121]。全体として見ると、グルタミン代謝はマクロファージ活性化の相乗的なサポーターおよびモジュレーターとして非常に重要な役割を果たしている。
4.3. リンパ球
リンパ球の活性化は、その機能を最適化するための特定の代謝経路と関連している。複数の細胞外シグナルの統合は、転写プログラムやシグナル伝達経路に影響を与え、例えばCD4+ T細胞では、エネルギー代謝、細胞増殖、サイトカイン産生の調節を含む複数のイベントを決定する。関連する生体エネルギープロセスはAMPKの活性化に依存しており、免疫細胞の分化における代謝とシグナル伝達経路の間のクロストークを示唆している。Greiner, er al)。 [124]は、ラット胸腺細胞において、コンカナバリン(ConA)による抗原刺激後に嫌気性解糖経路の利用が強く増加することを報告している。Eric Newsholmeのグループは、リンパ球によるグルタミンの利用を初めて報告した[125]。グルタミンは、さまざまな方法でこれらの細胞の機能に重要な役割を果たしている。ピルビン酸は、細胞内のグルコースとグルタミンの代謝の共通生成物である。Curi, er al)。 [126]は、腸間膜リンパ球がConAで刺激されるとピルビン酸カルボキシラーゼを介してピルビン酸の酸化が増加したことを報告しており、グルコースとグルタミンの両方がリンパ球の増殖と機能の制御に関与していることを示している。ミトコンドリアは白血球の活性化を制御できることが報告されている。クレブスサイクルの代謝産物であり、グルコースとグルタミンの代謝によって産生されるコハク酸、フマル酸、クエン酸は、自然免疫細胞と適応免疫細胞のいずれかで、免疫と炎症の制御に関与している[97]。
ほとんどのグルコース分子はグルコーストランスポーター1(GLUT1)を介して輸送されるが、これは非活性化リンパ球では観察されない[127]。GLUT1は、刺激後に細胞表面に急速に移行するため、リンパ球活性化の重要な代謝マーカーである。ブドウ糖欠乏は、CD4+ T細胞によるIL-2,TNF-α、INF-γ、およびIL-4の産生の増加と同様に、基底増殖率の低下を引き起こす [128]。GLUT1タンパク質レベルを超えたAktによる細胞内シグナル伝達の活性化は、グルコース取り込みとT細胞の活性化をさらに増加させる。リンパ細胞の刺激は、mTORタンパク質に作用してグルコースのGLUT1取り込みの増加を導く[129]。mTOR欠損マウスではエフェクターTリンパ球の分化が低下するため、この経路はCD4+ T細胞サブセットの分化にも関与している[130,131]。対照的に、AMPK経路は、このタンパク質のシグナル伝達を抑制することでmTORを阻害し、解糖経路ではなくミトコンドリア酸化代謝の活性化を促進する[132,133]。グルタミンは、TおよびBリンパ球の増殖過程だけでなく、これらの細胞が提示するタンパク質合成、IL-2産生、および抗体合成速度にも必要である。現在、グルタミン代謝がリンパ球の活性化に重要な役割を果たしているという証拠が蓄積されている。グルタミンは、ヒトBリンパ球の形質細胞への分化およびリンパ芽球形質転換に必要である[134]。
細胞の増殖過程では、高エネルギー消費のためのATPと、脂質(コレステロールやトリグリセリド)やRNAやDNA合成のためのヌクレオチドなどの複合分子の生合成のための前駆体の両方を必要とする。リンパ球は、特定の刺激下で迅速な増殖活動を行うために、酸化的リン酸化から好気性解糖+グルタミン分解に切り替わり、グルコースとグルタミンの利用量を著しく増加させる。なぜなら、グルコース代謝は生合成経路の中間体を提供し、T細胞の成長と分化のための必須条件であるからである[135]。解糖は、炎症性サイトカイン、主にINF-γとIL-2の産生に関連したエフェクターT細胞の機能において重要な役割を果たしている[136]。siRNAの使用によるグリセルアルデヒド3-リン酸脱水素酵素(GAPDH)mRNAの遮断は、リンパ球におけるINF-γの減少を促進する[136]。したがって、高い解糖活性は、Th0細胞からTh1細胞への分化と密接に関連している[132]。解糖経路の阻害はこのプロセスをブロックするのに対し、Treg細胞への分化を促進する。増殖細胞による解糖の増加は、グルコースの取り込みの増加と解糖酵素の発現と活性の増加に関連しているが、酸化的リン酸化経路(OXPHOS)でのグルコースの利用は減少している。したがって、「代謝スイッチ」は、より高いエネルギー要求を満たし、高分子の生合成に必要な代謝中間体を生成し、安静時のリンパ球の代謝機能を抑制する。不十分な栄養供給または特異的な代謝阻害は、グルコースを利用できないことで、試験管内試験および生体内試験でのT細胞の分化を阻害するため、T細胞の活性化と増殖を阻害する[135,137]。ミトコンドリアの動態は、Tリンパ球の代謝および機能と密接に関連している。活性化されたエフェクターT細胞はミトコンドリアをパンクさせ、代謝経路の活性を高めているのに対し、メモリーTリンパ球は融合ミトコンドリアを示し、酸化的リン酸化活性を高めている[138]。HIF1-αは樹状細胞の成熟とT細胞の活性化において中心的な役割を果たしている。この因子は、遺伝子発現の変化を通じて白血球の代謝リプログラミングを制御し、その結果、免疫細胞の機能を制御している[139]。
解糖とグルタミン分解は、リンパ球機能への適切性を確保するために強く関連している。ヘキソサミン生合成は、ウリジン二リン酸N-アセチルグルコサミン(UDP-GlcNAc)のde novo合成にグルコースとグルタミンを必要とする。この糖ヌクレオチドは、Asn(N)結合糖鎖のN-アセチルグルコサミン分岐を促進することにより、受容体エンドサイトーシスおよびシグナル伝達を阻害する。Araujo, er al)。 [140]は、好気性の高い解糖とグルタミン分解が協調してマウスT細胞芽球におけるUDP-GlcNAc合成とN-グリカン分岐を減少させることを報告しているが、これはヘキソサミン合成のためのこれらの代謝物の利用可能性が低いためである。その結果、抗炎症性誘導T調節因子(iTreg)の分化よりも、TH17の成長および炎症促進性の特徴が優勢となる。後者のプロセスは、エンドサイトーシスを介したIL-2受容体-α(CD25)の損失によって促進される。その後、著者らは、高好気性解糖およびグルタミニリシス活性を伴う主な機能は、N-グリカン生合成への前駆体を制限することであると仮定した。Tリンパ球のこの代謝機能は、自己免疫や癌に顕著な影響を与えている。グルタミンはまた、プトレシンやポリアミン、スペルミジン、スペルミンの合成の前駆体としても機能する。高レベルのポリアミンが腫瘍細胞や自己免疫疾患の自己反応性B細胞やT細胞で報告されている。ポリアミンは、正常な免疫細胞機能の制御に役割を果たすことが記載されており、自己免疫や抗腫瘍免疫細胞の特性と関連している[141]。
5. グルタミンサプリメントの免疫調節特性
血漿中のグルタミン濃度は、敗血症、熱傷、外傷などの重篤な疾患状態にある患者では、免疫細胞が激しく活動している間に低下する可能性がある。骨格筋は、哺乳類におけるグルタミンの主な供給源である。この組織は、上述のように、このアミノ酸を合成、貯蔵、放出して、リンパ系器官や白血球などのいくつかの器官や細胞[89]によって利用される。血漿/血流グルタミンレベルの低下は、骨格筋におけるグルタミン産生の不足、または利用細胞による過剰な消費、またはその両方の結果である(図2)。血漿中グルタミン利用可能量の減少は、いくつかの臨床状態における免疫機能の低下に寄与することが報告されている。実際、グルタミンの欠乏は、リンパ球の増殖を減少させ、表面活性化タンパク質の発現やサイトカインの産生を低下させ、これらの細胞のアポトーシスを誘導する[9]。食事へのグルタミンの添加は、細菌の挑戦に対する実験動物の生存率を増加させる。グルタミンの非経口投与は、手術、放射線治療、骨髄移植、または損傷後の患者に有益であることが報告されている[5,142]。動物やヒトでは、感染症発症前にグルタミンを投与することで、このアミノ酸の欠乏を防ぐことで感染症を予防できる可能性があると考えられている[143]。
作用機序については、グルタミンは細胞代謝、シグナル伝達タンパク質、細胞防御、修復調節因子などの遺伝子の発現を調節し、細胞内シグナル伝達経路を活性化する[2]。グルタミンの作用は、NF-κBやMAPKなどのリン酸化によるシグナル伝達経路の活性化にも関与している[144]。このように、グルタミンの機能は、代謝燃料やタンパク質合成前駆体の機能を超えている。このアミノ酸は、遺伝子発現やシグナル伝達経路の活性化に作用し、白血球機能の重要な調節因子でもある。
5.1. グルタミン-GSH軸と細胞の酸化還元状態
GSH(γ-l-グルタミル-l-システイニルグリシン)は、哺乳類細胞の中で最も重要で高濃度(0.5-10 mmol/L)の非酵素性抗酸化物質である。GSHの約85~90%は細胞質に存在し、約10~15%はミトコンドリア、核マトリックス、ペルオキシソームなどの小器官に存在している。GSHは、活性酸素と直接反応して酸化GSH(GSSG)を生成することができる抗酸化物質であり、また、グルタチオンペルオキシダーゼ酵素(GPx)によって触媒される過酸化物還元のために電子を提供することもできる[145]。細胞の酸化還元状態は、グルタチオンジスルフィド(GSSG)とGSHの細胞内濃度の比から得ることができ、その比は[GSSG]/[GSH]であり、その結果、GSHが減少し、GSSGの量が増加する[59]。細胞の酸化還元状態は、結果的にGSH濃度に関連しており、アミノ酸の利用可能性にも影響される。グルタミン(グルタミン酸を介して)システインおよびグリシンは、GSHの合成のための前駆体アミノ酸である。しかし、これらの3つのアミノ酸のうち、グルタミン酸は、GSH中間体の合成において最初の、そしておそらく最も重要なステップを表している。グルタミン酸の合成は、順番に、グルタミンの細胞内利用可能性に依存している。したがって、より高いグルタミン/グルタミン酸比は、GSH合成のための基質の利用可能性を強化する[39]。
ヒトの体内のすべての細胞型がGSHを合成することができるが、肝臓は定量的にGSHの新規合成のための主要な器官です(生理学的条件では循環GSHの90%程度を占めている)(図3)。肝GSHの濃度が高いのは、主にAlton Meister(1922-1995)に敬意を表してマイスターサイクルとしても知られるγ-グルタミルサイクルの酵素であるグルタチオン還元酵素の高活性によるものである[146]。このサイクルは、肝臓によって局所的に消費されるか、またはホルモン調節(例えば、グルカゴン、バソプレシン、およびカテコールアミン)の下でGSHを提供し、GSHは、血漿および骨格筋などの他の組織に輸出され得る。細胞内および細胞外GSH濃度は、その合成と分解のバランス、および細胞質と異なる小器官または細胞外空間との間でGSHを輸送する細胞の能力によって決定される[147]。
フリーラジカルおよび活性酸素の産生は、好中球およびマクロファージなどの食細胞に見られる細胞のシグナル伝達および免疫介在性の酸化バーストに不可欠である。逆に、酸化還元バランスの慢性的および/または誇張された変化が、癌、心血管疾患、糖尿病、敗血症、および一般的な感染症などの多くの急性および慢性疾患において重要な役割を果たしているという証拠が増えている。例えば、敗血症やウイルス感染などの急性炎症状況では、細胞内の酸化還元状態が上昇し、すべての細胞コンパートメントが酸化ストレス(活性酸素のレベルが上昇し、抗酸化システムによる除去が少ないことを特徴とする)に対して脆弱である[10,39]。このような状況では、グルタミンの利用可能性が低いと、グルタミン-GSH軸を介した低抗酸化保護につながるため、グルタミンの状態は健康/回復の結果を決定する上でさらに重要になる。実際、多くの実験研究[4,39,148,149]および観察研究[10,26]では、高異化作用の間、グルタミンの血漿中濃度の低さが 死亡率の独立した危険因子であることがすでに確認されている[150]。
5.2. ヒートショックプロテインの応答
生理的な課題に対して迅速かつ適切な修正を加えて応答するすべての生物の能力は、生存のために不可欠な機能である。最も基本的な細胞レベルでは、生物は、ヒートショック、毒素、酸化剤、感染、炎症、および他のいくつかのストレス状況などの好ましくない条件に、ストレス関連遺伝子(ヒートショック遺伝子としても知られている)の発現を変化させることによって応答する。この反応は、HSPとして知られる細胞保護タンパク質をコードする遺伝子の特定のセットの迅速な誘導を伴う[94]。HSPは、分子量に応じてクラスター化されたポリペプチドタンパク質のファミリーであり、多くの細胞内機能を有する。おそらく、HSPによって示される最も重要な機能は、分子シャペロンの作用である。この機能は、タンパク質の輸送を助け、フォールディング中のタンパク質の凝集を防ぎ、新しく合成されたポリペプチド鎖をミスフォールディングやタンパク質の変性から保護する[151]。ここ数年、いくつかのHSPファミリー(例えば、HSP10,HSP25,HSP27;HSP90)が研究されてきたが、文献で最も有名でよく記載されているのは、HSP70(すなわち、HSP72+HSP73)ファミリーである[29,151,152]。HSP70は、NF-κBをオフにし、炎症性メディエーターの産生を減衰させることにより、抗炎症タンパク質として作用する[153]。さらに、HSP70は、mTOR/Akt経路を制御することでオートファジーを調節し、タンパク質分解に関連するシグナル伝達経路をブロックする[152]。
ヒト血漿と同程度の濃度のグルタミンは、LPS処理を受けた末梢血単核細胞において、HSP72遺伝子の発現を有意に増加させる。一方、グルタミン濃度の低下は単球におけるHSP72発現の低下をもたらす;この効果はmRNAの安定性に依存する。グルタミンの術前投与は、炎症反応の悪化に関連することが多いサイクリックAMP応答要素結合タンパク質(CREB)の活性化レベルを低下させることにより、HSP70発現を調節することができる。この効果は、iNOS活性に依存し、NO産生の増加をもたらす。他の研究では、今回の結果を支持し、同様のメカニズムや、HSP25,HSP27,HSP90などの他のHSPの発現への影響が報告されている。
グルタミンは、ヘキソサミン生合成経路(HBP、図3)を介したHSPの発現調節に重要な役割を果たしている[21,94]。HBPでは、グルタミンは酵素であるフルクトース-6-リン酸アミドトランスフェラーゼ(GFAT、HBPの第一段階および律速段階)を介してUDP-GlcNAcおよび(UDP)-N-アセチルガラクトサミン(UDP-GalNAc)の産生を導く。UDP-GlcNAcおよびUDP-GalNAcは、O-linked-N-アセチルグルコサミニル(O-GlcNAc)トランスフェラーゼ(別名OGT)の酵素作用により、核内および細胞質タンパク質のセリンまたはスレオニンのヒドロキシル部位に結合することがある[94]。UDP-GlcNAcの主な供与体は、グルコース、グルタミン、およびHBPからのウリジン三リン酸(UTP)である。興味深いことに、栄養素の利用可能性と細胞ストレスの両方がO-GlcNAc下流のシグナル伝達に影響を与え、驚くことではないが、このメカニズムはまた、いくつかの代謝性疾患、感染症、および炎症性プロセスで変化している[154,155]。O-GlcNAc合成は、多くの転写因子、例えばSp1,真核生物イニシエーション因子2(eIF2)のリン酸化、およびサーチュイン-1(SIRT1)の活性化につながる[156]。Sp1とeIF2の両方とも、主要な熱ショック真核因子であるHSF-1の誘導のための重要な転写因子である[157]。あるいは、SIRT1は、HS遺伝子のプロモーターに結合することにより、HSF-1の発現を増強し、その活性化を延長し、HSPの発現を導く[94,158]。O-GlcNAc/Sp1経路はHSPの遺伝子発現および産生の主なメカニズムと考えられているが、グルタミンはp38/MAPKを介してHBPにも作用し、好中球などの細胞におけるHSPの発現につながる可能性がある。この反応は、高強度身体運動後の好中球のアポトーシスの減少を説明する可能性がある[144]。さらに、グルタミンは、HBPフラックスを増加させることにより、グリコーゲン合成酵素キナーゼ3β(グルタミン合成酵素K-3β)すなわちSer303で転写因子をリン酸化することによりHSF-1の活性化を構成的に阻害する酵素を阻害することにより、HSPの発現を刺激する[94,159]。
In vitro [21,160]および生体内試験 [4,39,161,162,163]の研究は、グルタミンの利用可能性が細胞の恒常性を維持し、細胞内HSP(iHSP)レベルによって媒介される強化された保護を介して、環境および生理学的ストレスの課題に対する細胞の生存を促進することを実証している[94]。興味深いことに、重度の感染および/または異化作用の下では、体内のグルタミン利用可能性が低いと、最終的には異常なiHSPを伴い、HSPの細胞外空間への放出(eHSP)につながる可能性がある[4]。一方、eHSPはまた、Toll様受容体2(TLR2)および4(TLR4)と相互作用することにより、ストレスシグナルおよびプロ炎症性分子として機能することができる[164]。この作用は、多くの細胞においてiHSPをダウンレギュレートし、アポトーシスを導くことができ[4]、また、骨格筋細胞におけるインスリン抵抗性の増加[165]、および糖尿病患者におけるβ細胞障害にも関連している。現在、末梢血単核球(PBMCs)で測定した細胞外/細胞内HSP70比率指数(H-index)という、免疫炎症状態の新規かつ総合的な指標が確立されている[94]。
6. グルタミン送達の臨床翻訳
グルタミンは、植物性および動物性タンパク質ベースの食品中に比較的高濃度で存在する(表1)。7万人以上の参加者を対象とした有効な食物頻度調査票(FFQ)を用いて、Lenders, er al)。 [166]は、グルタミン(6.85 ± 2.19 g/日)グルタミン酸(7.27 ± 2.44 g/日)およびロイシン(7.01 ± 2.27 g/日)がタンパク質ベースの食事で最も多くの摂取量を占めることを示した。したがって、バランスのとれた食事は、グルタミンをはじめ、恒常性、成長、健康維持のための必須アミノ酸と非必須アミノ酸を提供していることになる。さらに、バランスのとれた食事をしている健康な人では、グルタミンの補給は、免疫モニタリングの効果を高めたり、病気や病気のエピソードを予防したりするものではないことも述べておく。
表1
遺伝子配列決定法([ 166 ]から採用)を使用した、一部の動物性および野菜性食品の総タンパク質、グルタミン、グルタミン酸、およびロイシン(g / 100g食品)含有量。
| g / 100g食品 | 牛肉 |
スキムミルク |
白米 |
コーン |
豆腐 |
卵 |
|---|---|---|---|---|---|---|
| 総タンパク質 | 25.9 | 3.43.4 | 2.7 | 2.5 | 6.6 | 12.6 |
| グルタミン | 1.2 | 0.3 | 0.3 | 0.4 | 0.6 0.6 | 0.6 0.6 |
| グルタメート | 2.7 | 0.4 | 0.2 | 0.05 | 0.7 | 1.0 |
| ロイシン | 2.2 | 0.4 | 0.2 | 0.4 | 0.5 | 0.9 |
逆に、重症および/または重症、敗血症、外傷、および手術後の状況下では、患者は慢性的な衰弱およびいくつかの栄養制限(例えば、意識不明の状態、胃腸障害、および/または咀嚼に関連する問題)に苦しみ、これらはホメオスタシスを損ない、および悪い臨床転帰と関連している。アミノ酸代謝および/または中間代謝における重度の障害および/または骨格筋のタンパク質分解に続く中間代謝は、ハイパーメタボリック/ハイパー異化状態の重要な特徴である [167]。超異化作用の間、グルタミンを含むいくつかの非必須アミノ酸が条件付きで必須になる。前述したように、グルタミンは細胞の恒常性に不可欠であり、グルタミンが欠乏している環境では細胞は生存および/または増殖できない。したがって、グルタミンのような非合成アミノ酸サプリメントの投与は、ここ数年の研究対象となっており、現在、高異化症および/または病気の患者に適応されている。しかしながら、グルタミン補充の有効性は、混乱し、論争の的になっている結果[150,168,169]のために頻繁に疑問視されている。
グルタミンは通常、その遊離形態(単離アミノ酸としても知られている)を利用して投与されるか、またはジペプチド形態(図4)としても知られている別のアミノ酸と結合して投与される。潜在的な回復の健康上の利点を持ついくつかのグルタミンジペプチドは、l-グリシル-l-グルタミン(Gly-Gln)およびl-アルギニル-l-グルタミン(Arg-Gln)のような記述されている;しかしながら、最もよく知られているのは、おそらくl-アラニル-l-グルタミン(Ala-Gln)[170]である。非経口的に投与することで、多くの臨床的および実験的研究および適切な系統的レビュー[168]は、グルタミンジペプチドが、感染性合併症[171,172,173,174]、入院期間の長さ[9,175]、および重症患者の死亡率[10,176,177]を減少させることができると結論づけている。遊離グルタミンまたはグルタミンジペプチドの選択は、患者の異化状況および/または最も適した投与経路(例えば、経腸栄養および非経口栄養)に大きく依存する。例えば、全非経口栄養(TPN)を受けている患者において、グルタミンジペプチドは、遊離グルタミン(20℃で36g/L H2O)[170]と比較した場合、滅菌中の安定性、長期保存、および高い溶解度範囲(それぞれ、20℃で154g/L H2O、20℃で568g/L H2O)などのいくつかの利点を提供する。さらに、遊離グルタミンは、通常、結晶性アミノ酸粉末として市販されており、市販のTPN溶液に希釈することができるが、この手順では、制御された温度(すなわち、4℃)での毎日の調製、特定の膜ろ過による滅菌に続く無菌状態、および濃度が1〜2%を超えないようにすることが必要である。低濃度であれば、TPN溶液は患者の水分摂取量を増やして1日のグルタミン推奨量を満たすことができるので、これは特に重要であるが、水分制限のある患者ではこれは不可能である。
図4 経腸・非経口グルタミン(GLN)供給のメカニズム
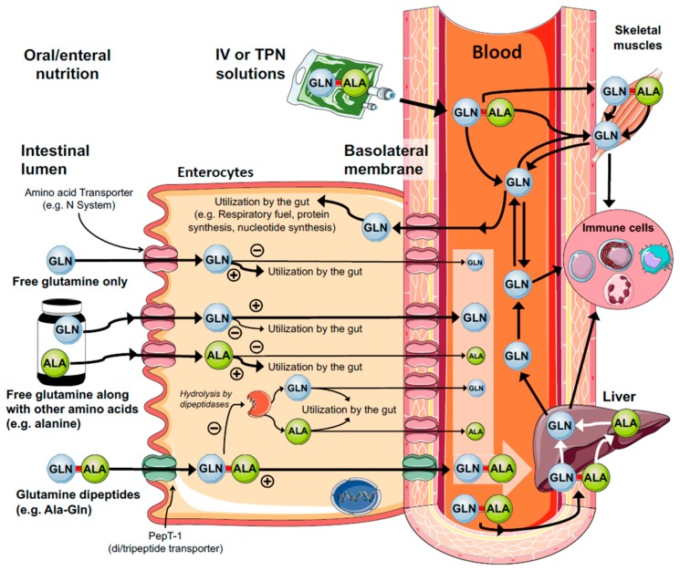
グルタミンは、腸球などの急速に分裂する細胞にとって重要な基質である。外因性/食事(腔膜)および/または内因性グルタミン合成(基底膜)の両方から得られるグルタミンの主要な消費部位である。遊離グルタミン補給は、主に腸内で代謝され、グルタミン血症および組織貯蔵に貧弱に寄与する。一方、グルタミンジペプチド(例えば、Ala-Gln、Gly-Gln、Arg-Gln)は、腸内代謝から脱出し、血漿および標的組織に速やかにグルタミンを供給する。この効果は、主に腸球の腔内膜に位置するオリゴペプチドトランスポーター1(Pept-1)に起因する。
経口/経腸栄養または非経口栄養の両方において、典型的なグルタミンの1日投与量(遊離型およびジペプチド型)は、20〜35g/24時間の固定用量から、体重1kgあたり1.0g未満(通常は0.3g〜0.5g)の調整用量まで様々である[168]。グルタミンの遊離型またはジペプチド型を非経口的に投与した場合に血流中に直接投与される他の栄養剤または薬物としては、血漿グルタミンの増加は、経口/経口飼料と比較して優れている[178]。しかしながら、非経口経路は、標的組織への栄養素の送達を確保することができるが、それは常に侵襲的な経路であり、それ自体が感染症のリスクを高める可能性があることに留意すべきである。非経口溶液を使用するかどうかの決定は、栄養状態の不良、体重および体格指数の劇的な低下、血漿アルブミンの低値、および/または窒素および組織機能の重度の損失など、いくつかの栄養パラメータに基づいて行わなければならないことが強く推奨される。
自宅または病院で定期的に経腸栄養を行っている個人、および最終的にグルタミン補給が推奨されるエリートアスリートにとっては、経口または経腸ルートが常により生理的である。さらに、経腸液は、免疫学的機能に重要な他の中間アミノ酸誘導体を産生するために腸細胞を刺激し、また、アルギニンおよびその下流代謝物(例えば、オルニチンおよびシトルリン)などの高異化症患者においても損なわれている[179]。動物モデルおよびヒトにおける実験研究では、経口/非経口遊離グルタミン[50]またはAla-Gln補充後±30分から±120分の間にグルタミン血症の増加が示されている[50,177]。しかし、Ala-Glnによって促進されるピーク濃度および曲線下面積は、遊離グルタミン供給と比較して優れている傾向がある。この効果は、腸球の内腔微小絨毛膜に位置するヒトオリゴペプチドトランスポーター1(Pept-1)の発現によるところが大きい[180]が、それよりも少ない程度では、傍細胞機構と細胞貫通型ペプチドの転座[181,182](図4)を介して。Pept-1は、グルタミンジペプチドを含む多様なジ/トリペプチドの高容量、低親和性プロトン共役型コトランスポーターである。Pept-1は、20個のL-αアミノ酸に由来する約400個のジペプチドと約8000個のトリペプチドを輸送することができるため、哺乳類の腸内でのタンパク質吸収の主要な経路と考えられている[180]。その結果、Ala-Glnの経腸投与に由来する遊離グルタミンおよび/またはアラニンを血流中に放出することができ、したがって、肝臓[183]、免疫系[39]、腎臓[184]および骨格筋[53]を含む標的組織にアミノ酸を利用できるようにする(図4)。興味深いことに、Ala-Glnによって促進される効果はまた、ペプチド製剤中のアミノ酸であるアラニンの存在によって媒介される。感染[4,39]に提出された生体内試験の動物モデルでアラ-Glnの補充と比較したときに遊離アラニンと一緒に経口の遊離グルタミンは、同様の代謝、抗酸化、および免疫学的効果を促進し、疲れる有酸素[30,45,53]と抵抗性の物理的な運動[29,162]に。重要なことに、これらの実験のすべてにおいて、補充されたグループは、等窒素および等カロリー溶液、すなわち、グルタミン/100 mLの13.46 gおよびアラニン/100 mLの8.20 gを含む両方を受けた。正確なメカニズムはまだ不明であるが、両方のアミノ酸が並行して、特に吸収性の細胞で働いていることは明らかである(図4)。例えば、アラニンは、アラニンアミノトランスフェラーゼを介してピルビン酸に急速に代謝され、同時に2-オキソグルタル酸からグルタミン酸が産生され、GSHによって媒介される抗酸化防御に寄与する。他の遊離アミノ酸の組み合わせを試験する必要があるが、これらの重要な発見は、特定の高異化症患者のための新しい処方の設計につながる可能性がある。
経口/経口または非経口のグルタミンサプリメントは、動物モデルとヒトの両方で何百もの研究でテストされており、単一の栄養素のサプリメントとして提供されている場合(他の添加物と組み合わせていない)安全であると考えることができる。さらに、グルタミンのサプリメントは、その内因性の生産またはde novo合成を永久に抑制および/または阻害することができることを示す科学的証拠はない。しかし、過剰な用量で提供される他のアミノ酸として、それは高アミノ酸血症を促進し、悪い臨床転帰をもたらす可能性がある。栄養学的評価および生化学的検査によって裏付けられた適切な評価なしに、患者にグルタミンの補給を提供することは最善の方法ではないと考えられている。
がんにおけるグルタミン代謝および補充はまた、科学的なコミュニティの間で多くの懸念を提起しており、いくつかのコメントに値する。癌細胞がグルタミンの代謝と利用可能性に非常に依存していることはよく知られているが、生体内の癌/腫瘍細胞でグルタミンが果たす役割はまだ論争の的になっており、したがって、サプリメントの効果がある。癌細胞は、好気性解糖(ウォルバーグ効果としても知られている)したがってグルコースを利用して、超骨格的な生存と成長を維持している[185,186]。一方で、栄養代謝の調節における癌遺伝子や腫瘍抑制因子の役割についての証拠が増えてきている[187]。これらの遺伝子における異常な変異は、栄養代謝の変化につながり、がん細胞の発生および/または進行に有意に寄与しうる[186]。例えば、グルコース、グルタミン、脂質、および酢酸は、炭素およびエネルギー源として利用することができる[25]。複雑さのレベルを高めるために、栄養源は、異なるタイプの癌および/または腫瘍細胞の間で異なる場合があり、非常に不均一である[25,187]。例えば、肺癌細胞株は、試験管内試験ではグルタミン供給に大きく依存しているが、生体内試験実験では、グルコースがピルビン酸カルボキシラーゼ[188]の作用を介してクレブスサイクルに供給される炭素の好ましい供給源であり、グルタミン消費量にはほとんど変化がないことが実証されている[187]。ヒトおよびマウスのグリオーマは高率のグルコース異化を示し、グルコースを使用してグルタミンを合成し、グルタミンはグルタミン酸アンモニアリガーゼ(GLUL)を介してグルタミンを合成し、グルタミンの循環とは無関係にペントースリン酸経路を介したヌクレオチド生合成を促進する[189,190]。逆に、前立腺がん細胞株は、細胞内脂質代謝の異常を示し [191]、グルタミン酸酵素およびグルタミントランスポーターの遺伝子発現の増加を示し、それによりグルタミン取り込みを介して細胞増殖を刺激する [192]。
がん細胞の栄養代謝における多様性は、異なる栄養学的アプローチが考慮されるべきであることを示唆している。しかしながら、研究はまた、グルタミンの外因性供給ががん患者における化学療法および放射線によって促進される副作用を減衰させうるかどうかを対象としている [193]。システマティックレビューでは、Saylesら [194] が15件の研究のうち11件で、経口グルタミン補充(用量範囲:30g/日を3回に分けて投与、または7.5~24g/日)が粘膜炎(頭頸部がん患者の90%に共通)のグレードを有意に低下させたこと [193] 、および/またはがん患者の体重減少を減衰させたことを報告している。二重盲検、プラセボ対照、ランダム化試験において、化学療法を受けている大腸がん患者にグルタミンを18g/日(治療前および治療中の5日間)補充した。グルタミン投与により、腸管吸収・透過性、下痢、腸粘膜炎などの化学療法によって誘発される副作用が減少した[195]。全体として、がん患者へのグルタミン補給は、ある種のがん細胞を燃料とし、健康に悪影響を及ぼす可能性もあることを強調することが重要である。しかしながら、癌細胞の代謝スイッチングの強力な能力を考慮すると、グルコースおよび/または脂質も同様の効果を誘発することができ、したがって、これらの栄養素なしでは、ヒトが生存し、免疫および/または免疫モニタリングを維持することは困難であろう。前述したように、グルタミン補充の適性を決定するためには、適切で、場合によっては個別化された患者の評価が必要である。
低血漿グルタミン濃度(低グルタミン血症)は、通常、グルタミン外因性供給の必要性を示すパラメータとして使用される。しかし、血漿中のグルタミン濃度と組織中のグルタミン濃度の相関関係は、高異化症患者間で大きく異なり、したがって研究間でも大きく異なる[150]。例えば、筋肉のグルタミンは、腹部手術患者では劇的に減少したが、血漿では変化は検出されなかった[196]。しかし、重症患者では、筋グルタミンの著しい低下が見られるが、血漿中には変動のある低下が見られる[150]。腸や肝臓などの他の重要なグルタミン部位では、血漿と組織グルタミンの減少が同時に見られるか、あるいは大病の間は逆の関係を示すこともある[86,197,198]。これらの所見はまた、感染症や疲弊した運動を行ったラット[29,45,183]やマウス[4,199]で得られたデータとも一致している。
血漿と組織のグルタミン濃度の間の変動は、全身の遊離グルタミンのごく一部が血漿中に存在するという事実に起因している。混乱を追加するために、低グルタミン利用可能性(低血漿グルタミン濃度に類似した、例えば±400μM)に維持されたリンパ球などの免疫系の細胞は、安静時の値(例えば600μM)と比較しても、依然として増殖することが知られている[4,7,90]。多様な末梢血単核細胞(PBMC)によるマクロファージの貪食およびサイトカイン産生の速度はまた、グルタミンの±<600μMのグルタミンで低下した速度で、グルタミンの利用可能性に依存している[21,200]。したがって、一部の異化/高異化症患者にとって、グルタミン濃度の変化、特に血漿中のグルタミン濃度の変化は、必ずしも免疫機能に影響を与え、抑制するとは限らず、免疫パラメータや機能、およびAPACHE IIまたはSAPS IIIなどの死亡リスク予測因子から得られるデータでは、おそらく有意な変化が観察されないかもしれない。まとめると、低グルタミン血症は、死亡率および/または不良な臨床転帰の独立した変数としてしか解釈できない[10,93,168,169,174,201]。血漿グルタミンの劇的な変化と重症患者の転帰との間の具体的な関係を探るためには、より詳細な研究が必要である。現在、グルタミン補充の決定は、適切な栄養評価、および最終的にはリスク予測因子と同盟した免疫炎症性パラメータのセットに基づいて行われるべきである。さらに、グルタミン補充研究は、最も病状の悪い患者(すなわち、2つ以上の臓器不全を有する)のみがこの栄養介入の対象となった試験では判断できず、このような状況では、超生理学的用量は適切な栄養学的解決策とは言えない。
7. 結論と今後の展望
免疫細胞は、生存、増殖、機能、そして最終的に病原体から私たちの体を守るために、グルタミンの利用可能性に大きく依存している。異化/過異化状態の間、グルタミンの需要は劇的に増加し、グルタミン欠乏と免疫機能の重度の障害につながる可能性がある。しかしながら、低グルタミン利用可能性は、すべての異化/不妊または重症患者において観察されるわけではなく、したがって、すべての個人がグルタミン補給の恩恵を受けるわけではない。血糖値と同様に、血漿グルタミンおよび組織間代謝フラックスは、腸、肝臓、および骨格筋などの重要な器官による高異化の間であっても一定レベルに維持されることを考慮することが重要である。驚くべきことではないが、低グルタミン血症の状態および重症度は、ヒトおよび動物研究の間で大きく異なり、それ自体がグルタミン外因性供給の合理的な議論を提供するものではない。
いくつかの異化状況、および/または食事から得られるグルタミンが不足している場合には、アミノ酸の補給が必要とされるかもしれない。この点で、グルタミン補給の免疫特性は広範囲に研究されており、新たな疑問や視点が定式化されている。例えば、研究は、栄養介入の頻度、疾患またはストレス状況に関連した最適な用量、および他のアミノ酸またはジペプチドの組み合わせとの併用投与を決定する必要がある。さらに、メタボロミクス時代の進化は、細胞機能に重要な新しい代謝物(マクロファージにおけるイタコン酸など)を同定し、グルタミン代謝の複雑な制御についての理解を向上させ、「免疫系の燃料」という概念を超えていく可能性を秘めている。
