Contents
From Protein to Pandemic: The Transdisciplinary Approach Needed to Prevent Spillover and the Next Pandemic
オンラインで2021年7月2日に公開
レイナ・K・プラウライト(Raina K. Plowright)1,*とピーター・J・ハドソン(Peter J. Hudson)2
要旨
パンデミックは、10-9 mのウイルス生物学から106 mの地球規模の感染まで、一連のプロセスの結果として起こる。病原体は、感染したリザーバー宿主から始まり、種間接触、自然免疫反応、潜在的な宿主内の受容体タンパク質構造、そして素朴な宿主集団を介した新規病原体の地球規模での拡散などの一連のイベントを経て、ある宿主種から別の宿主種へと移動する。それぞれの事象は、ウイルスの進行を妨げる潜在的な障壁となるため、統合的な学際的アプローチによって特徴づけられるべきである。疫病の制御は、曝露、感染、疾病の予防に基づいている。しかし、究極のパンデミック防止策は、波及現象そのものを防止することである。ここでは、種の壁を越えてヒトに感染し、高い死亡率を示すコウモリ由来のウイルス群であるヘニパウイルスのスピルオーバーを防ぐ可能性に注目する。本論文では、スピルオーバーのプロセス、ひいては将来のパンデミックを防ぐために必要な学際的なアプローチについて述べる。
キーワード:人獣共通感染症のスピルオーバー、コウモリウイルス、ヘニパウイルス、ヘンドラウイルス、ニパウイルス、学際的研究、パンデミック防止、パンデミックの起源
1. パンデミックの要因を特定する学際的な研究
近年のパンデミックは,ウイルスのスピルオーバーの結果として発生している。スピルオーバーとは,病原体が動物宿主からヒトに感染する一連のプロセスのことで,そのスケールは10-9 mのウイルスタンパク質構造から106 mの地球規模の伝播にまで及ぶ。このプロセスは,感染,排出,流出,拡散のカスケードとしてまとめられている[2]。スピルオーバーの理解と防止には,ウイルスのタンパク質構造や適応から,リザーバー宿主の免疫学,行動,生理学,種間接触,人間の行動,公衆衛生に至るまでの専門知識を有する複数の科学技術が必要であり,それらは国や国際的な政策を通じて形成される.
感染症の制御に関する従来のアプローチは、予防を中心としたもので、例えば、曝露を防ぐための検疫やマスク、感染や発病を防ぐためのワクチン、病気の進行を防ぐための治療薬などがある。これらの戦略は多くのヒトの感染症に対して有効であるが、病原体がヒトの間に広がってから適用される。我々には、新しい病原体がヒト集団に侵入する前にその拡散を防ぐためのツールセットも、拡散後に感染の拡大を抑制するための迅速な対応メカニズムもない。これは、現在進行中のCOVID-19パンデミックが人間の死亡率や苦しみに大きな影響を与え、世界的な経済的コストがかかっていることを考えると、重大な失敗である[5]。また,20年前から将来のパンデミックを警告してきたこと[6,7,8]や,2003年のSARS-COV,2012年のMERS,2013~2016年のエボラ出血熱に象徴されるように,新規疾患の出現速度が加速していることを考えると,これは驚くべきことである[4,9,10]。この論文では,次のような具体的な問題を取り上げている。病原体が人間の宿主に侵入する前に、リザーバー宿主のレベルで次のパンデミックを防ぐにはどうすればよいか?
人獣共通感染症のスピルオーバーとは,病原体がリザーバー宿主からヒトに感染するまでの,病原体の通過プロセスのことである[1].病原体が未熟なヒト宿主で効率的に複製・感染することができれば、ヒトからヒトへの感染が起こる可能性がある。時には、中間的な橋渡し宿主での適応が、宿主の障壁を乗り越えるための不可欠なステップとなることがある[3,11,12]。例えば、イヌパルボウイルスはアライグマで循環した後に宿主範囲を拡大し[13]、シミアン免疫不全ウイルス(SIV)は旧世界のサルのウイルスから進化し、チンパンジーやゴリラに感染した後にヒト免疫不全ウイルス(HIV)となった[14]。基本再生産数(R0)の値が1以上になるように,ウイルスが効率的に感染することができれば,新しいウイルスは広がり続ける可能性がある[4]。全体のプロセスは、病原体がヒトへの感染を成功させるために通過しなければならない特定の障壁を持つ階層であり、病原体がいずれかの段階で失敗すると、それ以降の進行が妨げられる[1](図1)。例えば、スピルオーバーには、リザーバーホストとレシピエントホストが同時に存在し、病原体の感染量をヒトに運ぶ曝露経路が必要となる。これがウイルスであれば、宿主の粘膜表面の抗ウイルス因子を打ち消し、宿主細胞の受容体に結合し、宿主の自然免疫反応を回避し、宿主の外に出ることができる組織で複製して、次の感染を成功させることができなければならない [1,3,11]。このような連携には、適切な生物学的条件と、感染性ウイルスと感受性の高い宿主との偶然の一致の両方が必要である。
図1 スピルオーバーの理解と予測に必要な生物学的データ(左)と、スピルオーバーの重要なメカニズム(右)を並べたもの
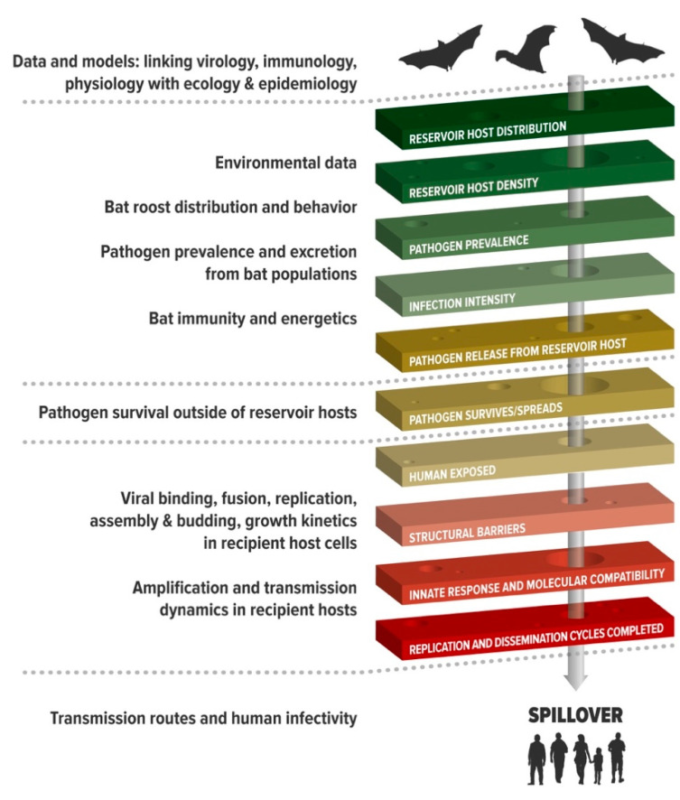
さらに、人間の曝露を理解するために、疫学や社会科学が採用されている。Plowrightら[1]から引用した。
この階層を構成する条件を理解するためには、スピルオーバーを構成要素のプロセスに分解し、データ、モデル、生物学的洞察を統合して、スピルオーバーを、その多くが非線形である相互作用のネットワークの創発特性として説明する必要がある(図1)。このような研究には、複数のスケールでの調査が必要である。そのためには、重要な障害を特定し、その洞察を観察されたパターンを説明するモデルに統合し、効果的な介入方法を特定することができる学際的な科学者のチームが必要となる。これには主に生物学的な洞察が必要であるが、伝統的な生物学の分野を超えて、環境科学、計算科学、社会科学、工学、健康科学、さらには人文地理学、人口統計学、宗教、法律、経済、政治などの人文科学の分野も含まれる。重要なことは、スピルオーバー・プロセスにおける複雑性と非線形性を、数学的モデリングや人工知能によって統合し、出現するネットワークの構成要素を特定する必要があるということである[15,16,17,18,19]。
このような学際的なチームを作り、維持することは、学問的な意味合いの問題や、複雑なシステムを見るための様々な視点を考えると、簡単ではない。解決のためには,専門家コミュニティのさまざまなメンバーがどのように問題を捉え,解決するかを理解しているリーダーが,頻繁かつ集中的に招集し,調整することが必要であり,同時に,知的枠組みを共有することで結束力を高める必要がある[20].チームには,複雑で学際的な問題の解決に専心し,分子スケールから地球スケールまでのシステムダイナミクスを概念化して追跡することができ,知識,方法,専門性を分野の境界を越えて適用できる科学者が含まれていなければならない.より専門性の高いチームメンバーは、自分の専門分野に深く精通していると同時に、専門分野を超えて協力する必要があり、またその能力も必要である。このようなチームのメンバーは、時間と忍耐を惜しまず、時には所属機関からの奨励金や報酬がほとんどない中で貢献しなければならない。
2. 次のパンデミック 波及効果を防ぐことが究極のアプローチ
歴史が将来の出来事を予測するものであるならば、次のパンデミックは、動物 [21] から発生する呼吸器系ウイルス感染症である可能性が高く、おそらく哺乳類であり、げっ歯類やコウモリである可能性が高いであろう [22]。そのウイルスは、他の未知のコロナウイルス、ヘニパウイルス、パラミクソウイルス、またはインフルエンザウイルスである可能性がある。ジカウイルスやウエストナイルウイルスなどの媒介性疾患による感染は、媒介者の分布や噛みつきの特徴によって広がりが制限されるため、パンデミックになる可能性は低いと考えられている[23]。細菌は,組換えや新規の遺伝要素を獲得する能力があるにもかかわらず,新規の宿主に飛び込んだ後に出現することはほとんどないが[24],抗菌薬耐性のある細菌は,単純な制御や予防の手段がないまま,急速に広がる恐れがある[25,26]。大きな懸念は、感染効率が高く、一部のグループで死亡率が高いウイルスが出現することである[4]。例えば、SARS-CoV-2のように、前症候性または無症候性の感染、高い症例致死率、4を超えるR0を持つウイルスが出現すれば、大混乱に陥る可能性がある。このようなウイルスが野生で流通している可能性は高い。このウイルスが人間の中に飛び込んできて広がるのをどうやって防げばいいのであろうか?次のパンデミックを、スピルオーバー現象が起こる前に、リザーバーホストのレベルで食い止めることができるのか?
ヒトへの感染が発生した場合、公衆衛生部門は適切に、公衆衛生上の緊急事態を軽減することに注力する。多くの場合、最初のスピルオーバーから人獣共通感染症の病原体がヒト集団で確認されるまでにタイムラグがあり、これがスピルオーバーのタイムリーな調査を妨げている。例えば,2013年から 2016年にかけて西アフリカで発生したエボラ出血熱の起源を調べるために調査チームがギニアのメリアンドゥに到着したのは,パンデミックの引き金となったスピルオーバーから約4か月後であった[27]。その時には,スピルオーバーを引き起こした条件はほぼ確実に過ぎ去っていた。同様に,SARS-CoV-2のパンデミックは,中国でパンデミックが始まってから1年近く経ってから国際チームが調査した[28]。エボラ出血熱による何千人もの感染者と死亡者、そしてSARS-CoV-2による何百万人もの感染者と死亡者は、それぞれ1つのスピルオーバーによって引き起こされた可能性がある。国際的な関心と資金提供のほとんどは、これらの出来事そのものではなく、そのような出来事の前に自然界を循環している病原体のカタログ化[29,30,31]や、より重要なこととして、そのような出来事の後にリスクの高い動物や人間のコミュニティで病原体を検出することに向けられている[32,33]。スピルオーバーを防ぐことが究極のパンデミック予防になることは間違いないが、そのためには、スピルオーバー現象を引き起こす複数のプロセスに注目する必要がある。パンデミック防止のためのこのようなアプローチのフレームワークを開発することは、スピルオーバーが一般的であり、過去の複数のスピルオーバーイベントに焦点を当てた研究が可能なシステムにおいて最も実現可能である。
3. 波及現象が繰り返されるシステムでは、そのプロセスを理解することができる。
スピルオーバーのプロセスを理解するためには、再現されたスピルオーバーイベントの詳細なデータが必要である。そのため、問題となっている病原体の多くは、スピルオーバー防止に必要な知見を得るのに適した候補ではない。例えば、SARS-CoV-1,SARS-CoV-2,そしてエボラ出血熱の大部分は、コウモリからの単一のスピルオーバー事象(通常は、ヒトに到達する前につなぎの宿主に感染する)に由来する可能性がある。そのため、スピルオーバー現象を研究するためのサンプル数は少ない。さらに、これらの病原体のリザーバー宿主が特定されていないため、スピルオーバーの要因を研究することは困難である[34]。より多くの投資と調査が行われれば、おそらく軽度の疾患と限られた経路で定期的にヒトにスピルオーバーするSARS類似のβ-コロナウイルス(サルベコウイルス)が間もなく特定されると思われる[35,36]。これらのウイルスは、病原性サルベコウイルスのスピルオーバーに関する理解を深めるための実験台になるはずである。現在のところ、ヘンドラ・ウイルスとニパ・ウイルスは、特徴づけられた5種類のヘニパ・ウイルスのうちの2種類であり、他のコウモリ媒介ウイルスに比べて比較的頻繁にスピルオーバーが検出されるため、コウモリ媒介ウイルスのスピルオーバーを研究するための最も有望な候補システムであると考えられる。
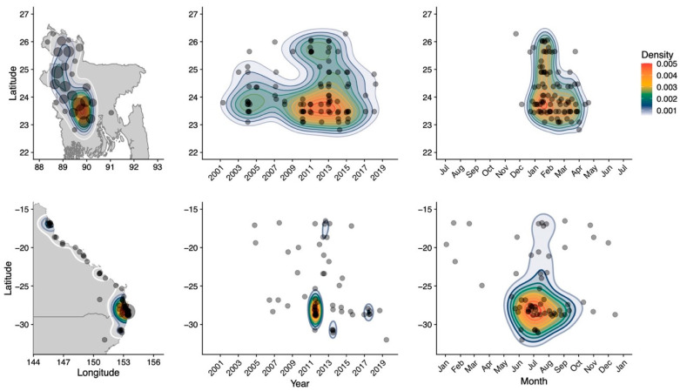
バングラデシュでは 2001年以降、ニパウイルスの複数のスピルオーバーが定期的に検出されており[37,38]、また、亜熱帯オーストラリアでは、過去10年間、2〜3年ごとにヘンドラウイルスのスピルオーバーのクラスターが発生しており、ヘンドラウイルスの単一のスピルオーバーはほぼ毎年検出されている[34](図2)。ヒトからヒトへの感染はニパウイルスではまれで、ヘンドラウイルスではないため、これらの記録はそれぞれ独立したスピルオーバーイベントとして現れている。どちらの国でも、ほとんどのスピルオーバーは冬に発生しており[34,37]、年に複数回のスピルオーバーが発生することで、空間的・時間的なパターンを観察・研究することができる(図2)。
図2 緯度・経度別(左)緯度・年別(中)緯度・月別(右)のニパウイルス(上)とヘンドラウイルス(下)のスピルオーバーの数。上のパネルはMcKeeら[37](本号)から引用。
最近のニパウイルスによるヒトへの感染のほとんどは,コウモリが尿や唾液を介して樹液を汚染した後,ナツメヤシの樹液を食べたことが原因であった[39].ヘンドラのヒトへの感染は、感染した馬という橋渡し宿主への暴露の結果として起こる。どちらの場合も、感染経路は、人間が大量のウイルスにさらされ、その後、重篤な感染症を引き起こすことになる。バングラデシュに馬がいたり、オーストラリアでナツメヤシの樹液を食べていたりすると、ウイルスの感染経路が入れ替わる可能性があるが、どちらの経路でもヒトは大量のウイルスにさらされることになる。
ニパウイルスのヒトからヒトへの直接感染の証拠はあるものの、感染するケースが9%しかないためか、感染の連鎖は急速に途絶えてしまう[38]。ニパ・ウイルスに感染したヒトは一般的に複数の他のヒトに感染させないため、基本再生産数であるR0は<1であり、ウイルスはヒト集団の中で広く拡散することはない[38]。したがって、ヒトでの症例が確認されたことは、スピルオーバーが比較的最近起こったことを意味しており、ウイルスが種を超えて流れるために揃う条件を特定することはまだ可能であると考えられる。
4. スピルオーバーを阻止するための学際的なアプローチ
コウモリウイルスのスピルオーバーを研究するための学際的アプローチの実例として、ヘニパウイルスを用いてスピルオーバーを理解し防止するためのフレームワークを開発したBat One Healthチーム(www.batonehealth.org, accessed on 25 June 2021)のアプローチを見てみよう(図1および図3)。彼らは、スピルオーバー階層(図1)の各構成要素を研究することで、スピルオーバーを促進する重要なプロセスを特定し、学際的なチームを結成して構成要素を詳細に研究し、複数のレベルで情報を統合した(図3)。以下のセクションでは、パンデミック防止のために重要と思われる研究分野を紹介する。このようなアプローチにより、ヘニパウイルスのシステムで開発されたデータ、モデル、洞察は、サルベコウイルスやエボラウイルスなど、波及効果が小さい他の病原体にも適用できる理解の枠組みと考えられることを提案している。
図3 Bat One Healthによる病原体のスピルオーバーを研究するための学際的かつ収束的なアプ ーチ
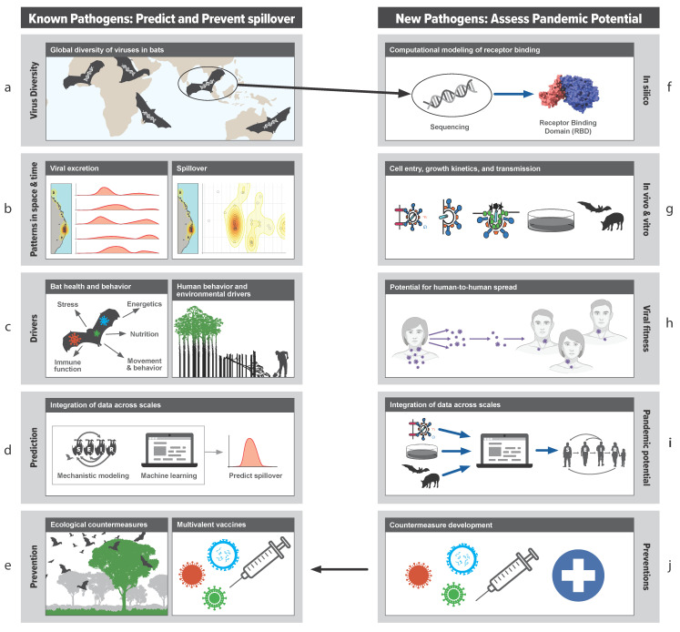
(www.batonehealth.org, accessed on 25 June 2021)。左側では、生態学的、生理学的、行動学的な情報が、宿主とウイルスの動態と一緒に収集される(a-c)。データはモデルに統合され、予測を行い(d)スピルオーバーを防ぐための介入策を開発する(e)。右側は、in silico、試験管内試験、生体内試験でのウイルスの適合性を調べることで、ウイルスのパンデミックの可能性を評価するプロアクティブな手段である(f-j)。
4.1. リザーバーホストの生態
1973年,Theodosius Dobzhanskyは,「生物学では,進化の観点からでなければ意味をなさないものは何もない」という有名な言葉を残している[40].我々は,新興感染症についても,リザーバー宿主の生態に照らし合わせなければ意味をなさないことを提案する。スピルオーバーのきっかけとなる出来事は、宿主の分布、個体数動態、摂食行動、体調、そして結果的に宿主と病原体の関係など、宿主の生態を根本的に変える環境変化に根ざしている可能性が高いのである[2]。
基本的に、空間的・時間的なスピルオーバーのリスクは、ランドスケープにおける病原体の分布の関数であり、その分布はリザーバー宿主種の分布によって決定される[41](図3a)。しかし、いくつかのリザーバー宿主集団は、他よりも高いスピルオーバー・リスクを示す可能性がある。多くのコウモリ種は、餌場やねぐらを乱す土地利用の変化に敏感である[42,43]。これらのストレス要因を生き延びるために、一部の種は人間が支配する最適ではない環境を利用する緊急生命誌戦略によって適応している [43,44]。その結果、人間との接触が増え、病原体の排出量が増加する。例えば、花が咲かなかったり、花の咲く木が取り除かれたりすると、遊牧民であるネクトバラスコウモリは、採餌のエネルギーコストを削減するために、都市部に常駐する糞食動物となる [45,46,47]。このような個体群は人間と定期的に接触し、エネルギー的にストレスを受けてウイルスを排出しやすいため、スピルオーバーのリスクが高くなる[48]。例として、オーストラリアのオオコウモリは、冬の生息地が失われたことに対応して、ヘンドラウイルスの出現と同時に、都市部や農業地域に急速に移動した[34]。対照的に、バングラデシュでは、P. mediusが都市部に居住するようになったのは、歴史的な森林伐採のためにおそらく数十年前に起こったことである[37]。
スピルオーバー・リスクを評価するためのサンプリングは、分布の変化や環境ストレスを経験している個体群や、異常な行動をとっている個体群(例えば、人間のいる風景の中で質の低い餌を食べている)に焦点を当てるべきである。リモートセンシングやAI予測はこれらの個体群の位置を特定するのに役立つが、人為的なストレス要因に対応してコウモリの個体群やスピルオーバーのリスクがどのように変化しているかを記録するためには、長期的な個体群調査が不可欠である。
4.2. リザーバー宿主からのウイルス排出とその要因
コウモリのヘニパウイルス、コロナウイルス、フィロウイルスを含む多くの病原体は、宿主との関係がダイナミックに変動している[49](図3b)。感染と排出は季節的なもので、繁殖、集合、ナイーブな若い個体の宿主集団への導入などのサイクルによって推進されることがある[50,51,52]。さらに、年齢、性別、繁殖状況、栄養状態、重複感染、ストレスなどが個体間のばらつきの原因となり、20%の宿主が感染イベントの80%の原因となることもある[53,54]。また、ストレスの多い時期にコウモリに潜伏していたウイルスが再活性化することも、ヘニパウイルスの排出の要因として提案されている[51]。ヘンドラウイルスに加えて複数のパラミクソウイルスが同時に排泄されるのは、栄養ストレスと同時に空間的に限定された短いパルスであり、ストレスの期間がコウモリからのウイルス排泄に影響を与える可能性があるというさらなる証拠である[55]。
スピルオーバーのリスクが高まる時期や場所を特定するには、リザーバーとなる宿主集団を空間的にも時間的にも繰り返しサンプリングする必要がある[41,49](図3b)。一方,横断的なサンプリングでは,宿主に慢性的に感染する病原体を特定できる可能性が高く,フィロウイルスやパラミクソウイルスのように一過性の感染や断続的な排出を引き起こす病原体は完全に見逃される可能性がある[49].アダプティブ・プールド・サンプリング,ベイズデータ統合,モデルガイド・サンプリングなどの最適なサンプリング手法は,最も効率的なサンプリング頻度,強度,範囲を決定するのに役立つ可能性がある[18,56,57]。宿主の人口動態、状態、免疫に関するメタデータは、環境ストレス要因が病原体の排出にどのように影響するかを理解する上で非常に重要だが [58,59] 、試薬の不足 [60] やコウモリの新しい抗ウイルス防御に関する知識の不足 [61] がこれらの研究の妨げとなっている。因果関係の推論を確立するためには、フィールド観察の相関的解釈を、推定される原因となるストレス因子を再現する実験によって補完する必要がある[62]。例えば、特定の栄養素を摂取させずに、ウイルス様粒子、疑似ウイルス、本物のウイルスなどを用いて実験を行うことができる。制御された実験は,交絡変数を最小限に抑えることができるが,生態系における創発的な特性や相互作用を見逃すことにもなる.そのため、システムを擾乱し、その結果をモデル予測と比較するフィールド実験は、洞察力に富んでいると言えるであろう。
4.3. コウモリと人間の行動と近さ
上述した生態学的およびウイルス学的要因は病原体の圧力を発生させるが、リザーバーホストと人間の両方の行動は、効果的な曝露経路を通じて感染量のウイルスを供給することを可能にする。例えば、Pteropus medius(インドオオコウモリ)はナツメヤシの樹液を食べ、人間はこの樹液を摂取する。P. alecto(クロオオコウモリ)は馬のパドックで餌を食べ、馬は汚染された草を摂取し、人間は呼吸困難に陥った馬の内視鏡検査などの獣医学的介入によって感染する[39,63]。これらのメカニズムを理解するためには、集中的な疫学的・社会学的調査が必要であり、多くのシステムについて人獣共通感染症の波及経路は依然として謎に包まれている。例えば,インドのケララ州におけるニパ・ウイルスのスピルオーバー,西アフリカにおけるエボラ・ウイルスのスピルオーバー,アジアにおけるSARS-CoV-2のスピルオーバーをもたらした条件はいまだに不明である[27,28,64]。スピルオーバーの原因となる感染したリザーバーホスト(例:ナツメヤシの樹液を食べるコウモリ)と、曝露されることになる人間(例:HIV陽性者などの免疫不全者)を特定することは困難である。
流出リスクに対する人間の認識や感染リスクへの反応は複雑である [65]。コミュニティ内の異なるグループでは、リスクを異なる方法で認識する明確で明確なナラティブが普及している。これらの語りは、知識に基づいていることはほとんどなく、多くの場合、同業者の視点や誤解に基づいている[65]。例えば、オーストラリア人は、近くの一時的な花蜜パルスを食べるために都市部に現れる大きなコウモリのコロニーに否定的な反応を示すかもしれない。このようなねぐらにいるコウモリの排泄物は財産に損害を与え、その臭いも不快である。しかし、これらのコウモリから人間に直接波及する危険性は低い。実際、これまでに発生したほとんどのスピルオーバーは、最近コウモリが住み着いた農業地域で、高品質の花蜜ではなく質の悪い果実を食べるコウモリによって発生しており[34]、すべてのケースで馬が橋渡し宿主となっている[66]。幸いなことに、ヘンドラウイルスに有効な馬用ワクチンがあるが [67,68]、馬の所有者への普及率は低いのが現状である。対照的に、バングラデシュでは、ナツメヤシの樹液からの感染リスクに対する認識が、樹液の消費を止めるには至らず、樹液とコウモリの接触を防ぐために採取ポットに蓋をするといった簡単な介入につながっている[69]。中国では,SARS-CoV-1の波及がウェットマーケット内で発生したことはよく知られてたが[70],2つ目のサルベコウイルスに効果的にさらされるリスクは政策立案者によって無視され,食用の野生動物の飼育やブッシュミートや生きた動物の輸入が続けられてた。パンデミック防止のための統合的アプローチに行動科学を含めることで、病原体のスピルオーバーを促進する行動を特定し、調査することが可能となる[71]。
4.4. データの統合
どのような学際的研究においても、課題は、主要な推進要因を 捉え、過去のパターンを説明し、将来の事象を予測する方法で、 生命科学と社会科学を統合することである(3d)。スピルオーバーについては、システムの一部分における小さな変化が、リスクの大きな変化を引き起こす可能性がある。例えば、感染したコウモリがナツメヤシの樹液を感受性の高い人間と共有することは、ある風景の中では広く行われているかもしれないが、コウモリの病原体の負荷がわずかに急増したり、人間が樹液を飲む行動がわずかに増加したりすることで、システムがスピルオーバーに傾く可能性がある。このように,スピルオーバーは,宿主密度から感染量効果に至るまでの非線形相互作用の創発的な特性である [1,72].このような非線形の相互作用を理解し,予測を立て,介入すべきポイントを特定するためには,メカニズムモデリング,機械学習,シミュレーションなどの統合的なアプローチが必要である[58,64,73,74,75].推進要因とダイナミクスが理解できれば,効果のある介入策を考案することがより現実的になる。例えば,出現の根本原因に対処する生態学的な対策(土地被覆の変更など[76])や,予測される波及現象に対応して展開できる医学的な対策などが挙げられる。
4.5. ウイルスの機能的特性
コウモリは、ヘニパウイルス、フィロウイルス、コロナウイルス、パラミクソウイルスの多くの変異株を含む多様なウイルスを保有しており、その多くは未知の人獣共通感染症の可能性を秘めている[22,77]。新種のウイルスを同定することは、宿主とウイルスの相互作用の自然史や自然の多様性を理解するのに役立つ。しかし、ほとんどのウイルスは、リザーバー宿主や新しいレシピエント宿主に害を与えない。ウイルスの多様性が豊富なところでは、ウイルスとレシピエントホストとの各接触の確率的な結果は、ウイルスが一連の障壁を通過して感染を確立するかどうかを反映している。したがって、ウイルスの発見は、各ウイルスがこれらの障壁を通過する能力を集中的に機能評価することと組み合わせることをお勧めする(図3f-j)。
理想的には、人獣共通感染症の可能性を明らかにするために、新しい生息地やリスクの高い場所を含む広い範囲でコウモリを採取し(図3a)新しい変異株を同定する必要がある[30]。in silicoでヒトの受容体への結合を推定した後、ウイルスの侵入、複製、組み立て、出芽、融合、増殖の動態を試験管内試験および生体内試験で研究することができる[78,79,80,81]。ヒトへの感染の可能性が推定された後、モデル種での生体内試験実験により、ヒトからヒトへの感染の可能性、ひいてはパンデミックの可能性を評価することができる[82]。ウイルス学のデータを拡大して疫学的な洞察を得るためには、モデリングを通じてウイルス学と疫学を統合することが不可欠である[83]。このような遺伝子型から表現型へのつながりは、リスク評価のための知識ベースを構築する。懸念される変異株は,詳細な研究(図3a~d)や対策の開発(多価ワクチンや治療薬など,図3e)のために優先順位をつけることができる.
我々が提案する研究課題(図1および図3)は、パンデミックへの対応を、人間社会でパンデミックが拡大した後の事後的な対応から、波及する前にパンデミックのプロセスを阻止する積極的な対応へと移行させるものである。このように学際的なアプローチをとることで、時空間におけるウイルスのスピルオーバーのリスクと、このリスクを引き起こすメカニズムを特定することができ、その結果、ウイルス出現の根本原因への対処や、スピルオーバープロセスの各段階への介入に焦点を当てることが可能になる。流出を防ぐためのあらゆる努力が失敗したとしても、公衆衛生上の介入が可能なレベルでの正確な予測により、大パンデミックがパンデミックに発展する前に、最大のリスクをもたらすウイルスの遺伝子型に対してワクチンや治療薬を展開することができる。しかし、究極のパンデミック防止策は、スピルオーバー現象そのものを防止することである。
