Evidence-Based Medicine and Clinical Research: Both Are Needed, Neither Is Perfect
pubmed.ncbi.nlm.nih.gov/29631266/
2018年4月9日
要旨
現在、個々の臨床の専門性、患者の価値観や願望、利用可能な最善の研究という3つの柱に依存するEBM(Evidence-based Medicine)という概念を無視した現代医療は考えられない。しかし、EBMは完璧ではない。臨床研究も完璧とは程遠いものだ。
本稿では、EBMが提供する基本的な原理、機会、論争の概要を紹介する。また、臨床研究に関する現在の議論についてもまとめている。また、EBMと臨床研究の問題点に対する潜在的な解決策についても議論されている。
小児栄養学に関連した具体的な問題があれば、その文脈で基本原理と限界を論じる試みがなされた。しかし、結論はEBMや臨床研究全般に適用可能である。今後も新しい健康データ方法が出てくることを考えると、EBMや臨床研究の世界は変化していくと思われる。しかし、最終的な目標は変わらず、患者の健康アウトカムの向上である。
キーメッセージ
- 過去25年の間に、個々の臨床専門知識、最良の研究エビデンス、患者の価値観や状況に基づいたエビデンスに基づく医療(EBM)が定義され、医療のあり方が大きく変化してきた。しかし、EBMは完璧なものではなく、その概念はその批判に応えて進化している。
- 臨床研究の多くは、設計、実施、分析、報告が不十分である。質の高い研究を開発するための戦略が開発されている。すべての関係者がこれを厳守すれば、より有効で信頼性の高い研究結果が得られるはずである。
- 今後も新しい健康データ方法が出てくることを考えると、EBMや臨床研究の世界は変化していくと思われる。しかし、最終的な目標は、患者さんの健康状態の改善であることに変わりはない。
序論
現在、個々の臨床の専門性、患者の価値観や願望、現在のベストエビデンスの3本柱に依存するEBM(Evidence-based Medicine)という概念を無視した現代医療は考えられない(図1)。しかし、EBMは完璧なものではない。広く引用されている専門家であるスタンフォード大学疫学教授のJohn Ioannidis氏は、EBMは “業界の広告ツールになりつつある “と主張している。EBMの柱の一つである臨床研究も完璧とは程遠い。研究に疑問を呈した医学界の著名人の中には、ランセット誌の編集者であるリチャード・ホートン氏がいるが、このように述べている。
「科学に対する反論は簡単である。科学的な文献の多くは、おそらく半分は、単に真実ではないかもしれない。サンプルサイズが小さく、効果が小さく、無効な探索分析、明らかな利益相反、疑わしい重要性のパンデミックを追求する強迫観念などの研究に悩まされ、科学は暗黒の方向に向かっている」[1]。
20年以上にわたってThe New England Journal of Medicineの編集者を務めたMarcia Angellは、次のように書いている:
「公表されている臨床研究の多くを信じたり、信頼できる医師の判断や権威ある医療ガイドラインに頼ったりすることは、もはや不可能だ」[2]。
Ioannidisは、理論モデルに基づいて、「公表されている研究結果のほとんどはおそらく虚偽である」と結論づけた[3]。また、最も影響力のある医学研究の原著論文のうち、30%もの論文が後になって誤りや誇張であることが判明すると主張している[4]。
図1. エビデンスに基づく医療の三要素(専門知識、価値観、エビデンス)は、健康の意思決定においても同様の役割を果たしている。
小児研究の状況は特に難しい。成人では試験されているが、乳幼児や子供に使用されている介入は、効果がなかったり、不適切であったり、有害であったりする可能性がある。The New England Journal of Medicine、The Journal of the American Medical Association、Pediatrics、Archives of Pediatrics and Adolescent Medicine、Annals of Internal Medicine、Archives of Internal Medicineなどの主要6誌に掲載された2008年のレビューでは、子供の研究と大人の研究を比較した結果、子供の研究は無作為化比較試験(RCT)システマティックレビュー、治療法の研究である可能性が有意に低いことが明らかになっている。最高のエビデンスの源泉とみなされるこのような研究が不足しているとすれば、医療行為や子どものケアの質に大きな影響を与えることになる [5]。雑誌の選択や評価期間(3ヶ月のみ)が、公表されているすべての文献を反映しているとは考えにくいとしても、多くの小児科研究の問題点を指摘している。
本論文では、EBMによって提供される基本的な原理、機会、論争の概要を説明する。また、臨床研究に関する現在の議論をまとめ、EBMと臨床研究の問題点をどのように克服するかについても述べている。小児栄養学に関連した具体的な問題があるとすれば、この文脈の中で基本原理と限界について議論する試みがなされた。しかし、すべての結論はEBMや臨床研究全般に適用可能である。
EBMの歴史
今から四半世紀以上も前の1991年、当時マクマスター大学の若手研修医だったGordon Guyattは、最初に「科学的医学」(婉曲的に言えば、彼の先輩たちにはあまり受け入れられていなかった)という言葉を生み出し、その後、「エビデンスに基づく医学」という言葉を生み出した[6]。その後間もなく1996年には、EBMの生みの親とされる彼の師匠であるDavid Sackettらが、EBMを「個々の患者のケアについての意思決定を行う際に、現在の最善のエビデンスを良心的、明示的、かつ賢明に利用すること」と定義した[7](図1)。世界の臨床現場に革命を起こした概念が誕生したのである。それは、医療従事者に、どの治療が効果があり、どの治療が効果がないかを判断するためのツールを提供することで、医療の世界を変え、多くの意味で今も変化させ続けている。したがって 2007年にThe BMJ誌が過去160年間の医学におけるマイルストーンのトップ15を選んだ際、麻酔、抗生物質、DNA構造の発見、衛生、ワクチン、経口補水液[8]に次いで、EBMがその中に含まれていたことは驚くに値しない。
EBMを実践するためのステップ
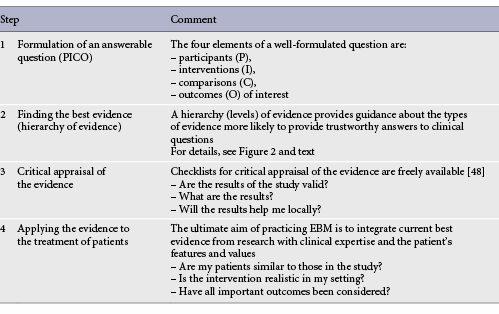
EBMを実践するためには、以下の4つのステップが必要である(表1)。(1)回答可能な質問(問題)の策定、(2)最良のエビデンスの発見、(3)エビデンスの批判的評価、(4)そのエビデンスを患者の治療に応用する、の4つのステップである。
表1. EBMを実践するためのステップ [48]
エビデンスの階層
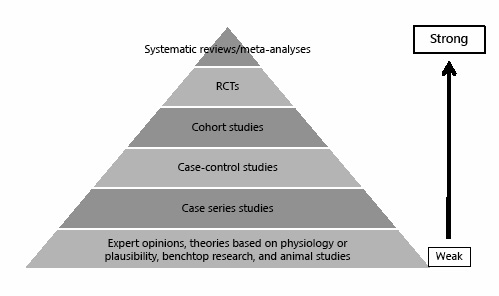
一般的なガイドラインに過ぎないが、エビデンスの階層(レベル)は、どのタイプのエビデンスが臨床的な質問に対して信頼できる回答を提供しやすいかについての有用な指針を提供している。どの階層が適切かは、質問された臨床質問の種類によって異なる(表2)。治療研究に加えて診断研究、予後研究、スクリーニング研究を含むエビデンスの拡張階層(レベル)は、Oxford Center for Evidence-Based Medicine [9]によって発表されている。注目すべきは、質問の種類にかかわらず、システマティックレビューが最も強力なエビデンスを提供すると考えられていることである。
表2 臨床的質問の種類によって必要とされる研究の種類が異なる

介入問題については、システマティックレビュー、メタアナリシスの次に(エビデンス強度の高い順に)RCT、コホート研究、症例対照研究、症例シリーズ研究、そして最後に専門家の意見や理論、基礎研究、動物実験が続く(図2)。このように、利用可能であれば、RCTやメタアナリシスを臨床的意思決定の裏付けとして用いるべきである。最高レベルのエビデンスが入手できない場合は、より低いレベルのエビデンスに移行する必要がある。しかし、方法論のランクが低ければ低いほど、結果の頑健性が低くなり、研究の結果が客観的な所見を表す可能性が低くなる。階層の底辺にあるのは動物研究と基礎研究(細胞・実験室研究)である。動物研究や細胞研究の方法論的な問題について議論することは、この記事の範囲を超えている。しかし、多くの研究により、動物実験ではヒトでの結果を予測できないことが多いことが明らかになっている。また、単離された細胞を用いた実験では、体内で行われた実験とは異なる結果が得られることもある。一方で、注目すべき発見の多くは、動物を用いた重要な実験(例:臓器移植)がなければ、実現できなかったであろう。さらに、1901年以来、生理学や医学のノーベル賞受賞者のほぼ全員が、全員とは言わないまでも、基礎データや動物データに頼って研究を行ってきたのである。
図2. エビデンスの階層(レベル)(エビデンスの強さの降順)。RCT、無作為化比較試験。
EBMへの批判
EBMに関連した最初の出版物から、EBMは「料理本のような医学」[10]、「臨床の専門性を否定する」[11]、「患者の価値観を無視する」[12]といった非難が批判者によってよく使われてきた。2000年の解説では、これらの批判(その多くはEBMに対する誤った認識とされていた)はすべてStrausとMcAlisterによって取り上げられている[13]。しかし、時の流れは批判を和らげるものではなかった。さらに今日では、多くの “EBMインサイダー “によって、EBMの現在の方向性に対する懸念が提起されている。最近、ヨアニディスは「エビデンスに基づいた医療が乗っ取られた」と挑戦的に述べている[14]。
彼は次のように述べている:“EBMがより影響力を持つようになるにつれて、EBMもまた、本来の目的とは異なるアジェンダに奉仕するためにハイジャックされた”。
また、彼は、臨床エビデンスが “業界の広告ツールになりつつある “とも主張している。要するに、研究の実施や報告の仕方、ひいては医療の実践の仕方、さらには健康や病気の定義にまで産業界が影響を及ぼすことが懸念されているのである。また、EBMという言葉の乱用や誤用も懸念される。Ioannidisが指摘しているように、“科学の完全性、透明性、偏りのない公平性をあまり気にすることなく、自分たちの見解や製品を支持したがるエミネンスベースの専門家や対立する利害関係者 “が存在しているのである。
2014年には、Evidence-Based Medicine Renaissance Groupを代表してGreenhalghら[15]がThe BMJ誌で挑発的な質問をしている:“Evidence based medicine: a movement in crisis? このグループは、この見解を支持するためにいくつかの論拠を提供した。
- 第一に、既得権益者によるEBMの悪用が含まれている。実際、特定の状況下では、産業界の関与/資金提供(すなわち、商業的利益)がこのようなバイアスをもたらす可能性がある。
- 第二に、管理しきれないほどの量のエビデンス、特に臨床ガイドラインの作成が課題となっている。
- 第三に、統計的には有意だが臨床的には無関係な有益性が誇張されている。
- 第四に、当初のコンセプトに反して、EBMは現在のところ患者中心ではない。
- 最後に、EBMガイドラインが複数の疾患(多疾患)を持つ患者に適切に対応できていないことが問題である。1人の患者に2つ以上の長期的な疾患が共存していることは、ユニークな課題を提示している。1つの病態と治療選択肢を対象としたエビデンスに基づく「ワンサイズフィットオール」アプローチは明らかに不適切である。
小児医療の現場では、かつては致命的であった多くの疾患が現代医学によって治療されている。
RCTの批判
EBMの中で最も激しく批判されているのは、RCTとメタアナリシスの使用である。無作為化比較試験とは、2つ以上の介入を無作為に割り付けて比較する実験と定義されている。大規模で、よく設計され、よく実施されたRCTは、医療介入(治療や予防)の有効性を評価するためのゴールドスタンダードと考えられている。RCTは、因果関係を特定する最良の方法であり、有効性を決定することができる(どの治療法が優れているかを確定的に確立することができる)。既知の交絡因子や未知の交絡因子による偏りが少ないという事実は、他のすべての研究デザインと比較して強みとなっている。
しかし、RCTに関してはいくつかの懸念点がある。研究の計画と実施がバイアスや系統的エラーを防止したと思われる程度である内部妥当性に加えて、結果が他の状況や研究集団を超えて一般化される可能性がある程度であると定義される外部妥当性[16]が大きな懸念事項の一つであり、RCTのアキレス腱と考えられている。
そのような例の一つは、非常に低出生体重児に外挿すべきではないかもしれない結果を持つ期の乳児で実施された研究である。
小児栄養学のRCTs
RCTの数の増加に伴い、研究者は小児栄養学の分野におけるRCTの限界を認識してきた。
第一に、乳児・児童の栄養実践に関連した決定的に関連性の高いアウトカムは、明らかになるまでに何年もかかる可能性がある。そのため、最終的な結果に至る過程のほんの一部以上をカバーするのに十分な時間をかけてRCTを設計し、実施することは困難である。
第二に、食事/栄養および関連する曝露は複雑で相互に関連しており、ほとんどの場合、短期的な影響は中期から長期的には持続しない。ほとんどの研究では、複数の暴露(欠乏または潜在的な過剰)が共存し、特定の結果を定義するために相互作用する実生活の条件を反映していないかもしれない単一のマクロまたは微量栄養素の変化への応答を評価する。
第三に、試験の結果は、所望の結果を達成する上での有効性を示す(または実証しない)ことである。このような試験の結果は、特定の介入と与えられた研究集団に照らして単純かつ確実に解釈することができる。しかし、他の集団への外挿や、試験で試験されたものと全く同じではない介入への外挿は不適切であるかもしれない。
表3は、無作為化臨床試験の実施における主な障壁をまとめたものである。
表3. 無作為化臨床試験の実施における主な障壁

それでも、RCTの結果が医療行為を変える可能性がある。小児栄養学研究では、RCTで取り上げられた臨床的な疑問の一例として、以下のようなものがある。ヒト乳をベースとしたヒト乳強化剤とウシ乳をベースとしたヒト乳強化剤のいずれかでヒト乳を強化すること(介入)は、極早産の乳児(母集団)における壊死性腸炎(NEC)のリスク(転帰)に効果があるか?207人の乳児(出生体重:500~1,250g)を対象とした本RCTでは、ヒト乳のみを投与された群では、NECと外科的介入を必要とするNECのリスクが有意に減少した。盲検化の欠如がこの研究の限界の一つであった。それでも、この知見は早産児のNECのリスクを低減するためのヒト乳の使用を強く支持するものである[17]。
メタアナリシスの批判
メタアナリシスは、システマティックレビュー、すなわち明確に定式化された問題のレビューから始まる。しかし、システマティックレビューのみとは異なり、統計的手法を用いて、すべてのRCTの結果をプールし、それらをまとめて分析することができる。メタアナリシスを行う主な理由は、統計力を向上させ、臨床的に重要な差が存在する場合には確実に検出できる可能性を高めることと、効果の推定精度を向上させ、効果の信頼区間を狭くすることにある。個々の試験結果をプールしておくか、別々にしておくかを決定する際には、試験が問題と方法の両方の点で十分に均質であるかどうかを検討することが重要である。PICO」の頭字語は、理想的には、プールされる研究間で、母集団、介入、比較、アウトカムが同じ(または非常に類似している)であるべきである。したがって、システマティックレビューを行うことは常に適切であり、すべてのメタアナリシスの前にはシステマティックレビューを行うべきである。しかし、すべてのシステマティックレビューがメタアナリシスで締めくくられるべきではない;実際、メタアナリシスを行うことは時に誤りであり、誤解を招くことさえある。
メタアナリシスは、当初から「メガ・サイリネス」[18]、「シュメタアナリシス」[19]、「統計的錬金術」[20]、「リンゴとオレンジの混合」[21]などと批判されていた。このような批判にもかかわらず、メタアナリシス(小児栄養学分野を含む)は急速に増加しており、なくなることはないだろう。しかし、メタアナリシスの増加と同時に批判も増えている。例えば、メタアナリシスが指数関数的に増加していることへの懸念が指摘されている。いくつかのトピックについては、これらのレビューに含まれる個々の試験よりもシステマティックレビューの方が多い。Ioannidesは最近、「システマティックレビューの生産はパンデミックの割合に達している」と述べている。「おそらく、ほとんどのシステマティックレビューは不必要であり、誤解を招く、あるいは矛盾するものである」[22]。メタアナリシスで考えられる欠陥には、すべての関連する研究を特定できなかったこと(そのため、1つのデータベースを検索するだけでは決して十分ではない)含まれている試験のバイアスのリスク(どのようなメタアナリシスも、構成されている研究と同じ程度のものでしかない)未発表データの除外(未発表データを含めることで、出版バイアスのリスクが軽減される)反対の結論(レビューの質問、検索戦略などの違いがこれを引き起こしている可能性がある)および これには原因があるかもしれない);結論の不一致(「明確な証拠がない」または「さらなる研究が必要である」などのイライラする記述)[23]。
小児栄養学におけるメタアナリシス
システマティックレビュー/メタアナリシスの過剰生産というこの告発は、小児栄養学においては真実なのだろうか?わずか2年間(2016-2017)で、少なくとも14のメタアナリシスが発表され、同じトピックに関する以前に発表されたかなりの数のメタアナリシス[24]に加えて、NECのリスクを軽減するプロバイオティクスの効果を評価することを目的としている。しかし、ほとんどの既存のメタアナリシスでは系統特異的な効果を十分に考慮していないため、どのプロバイオティクス系統を使用すべきかは不明のままである。この例は、システマティックレビュー/メタアナリシスの過剰生産は、同様に小児栄養学の問題である可能性があることを示している。あまりにも多くのメタアナリシスがあることを考えると、おそらくそれは、大規模な、多施設、よく計画された、よく定義された結果とよく実行された試験を行うことに戻る時間である。多くの発表されたメタアナリシスの共著者(私のような)が真剣に考えるべきことである。
臨床研究の問題点
EBM時代には、EBMの柱の一つである臨床研究の質が最重要視されている。しかし、先に述べたように、臨床研究の多くは、設計、実施、分析、報告が不十分であることが懸念されている。その結果、臨床研究から導き出された結論が間違っている可能性がある。この問題に最初に取り組んだのはAltman [25]である。彼は1994年のBMJ社説の中で、「より少ない研究、より良い研究、そして正しい理由で行われる研究」が必要であると述べている。最近では、Ioannidisは(単独または同僚と)この問題に関する多数の論文を発表しており、その中には高い引用度を誇る「Why Most Published Research Findings Are False」という出版物も含まれている[3]。数学的モデルに基づいて、Ioannidisは、p値が0.05未満の公表された生物医学的研究結果の50%以上が偽陽性である可能性が高いと結論づけた。しかし、すべての人が同意するわけではない。例えば、Jager and Leek [26]は別の論文(ここでも統計モデルに基づいている)で、p値の14%だけが偽陽性である可能性が高いと主張している。バイアスの程度に関する議論は続くかもしれないが、それにもかかわらず、問題が存在することを示している。
なぜ臨床研究の質は最適ではないままなのか?考慮すべき重要な要因としては、以下のようなものがある[3](表4も参照)。
表 4. 研究所見の解釈(真実である可能性が低い場合)([3]に基づく)

サンプルサイズとパワー不足の研究
研究の規模が小さければ小さいほど、研究結果が真である可能性は低くなる。統計力が低いと、科学研究の目的が弱まり、真の効果を検出する可能性が低くなる。また、統計的に有意な結果が真の効果を反映している可能性も低くなる。
効果の大きさ
効果量が小さい場合(パワー不足の研究ではよくあることである)研究結果が真実である可能性が低くなる。
p値0.05への不当な依存。
p値だけに頼るのは問題があるかもしれない。偽陽性と偽陰性の両方の結果が出る可能性がある。注目すべきは 2016年3月に米国統計協会(ASA)がp値の誤用に対して警告を発したことである。その声明の中で、ASAは研究者に対して、p値だけに基づいて科学的な結論を導き出したり、政策決定を行ったりすることを避けるように助言している[27]。
確認の欠如(複製)
研究の再現性は科学的プロセスの重要な要素である。単純な研究の反復を妨げる要因としては、科学的な新規性の欠如や、単一の研究で有効性が証明された治療法への関心の欠如など、様々なものがある。しかし、当然のことながら、単一の研究だけでは臨床実践を変えるには決して十分ではないため、原則として繰り返しの研究が必要である。研究結果が再現できない場合は、その研究結果が真実である可能性が低いことを意味する。所見の不一致は、どちらの結果が正しいかを示すものではない。両方とも不正確な場合もあるが、元の所見を再現することが困難であることを示している。ポジティブな結果とネガティブな結果の両方を公表することが重要である。
事前選択
検定した仮説の数が多ければ多いほど、偽陽性の結果を発見する可能性が高くなる。同様に、検定した関係性の選択が少ないほど、研究結果が真である可能性は低くなる。
分析の柔軟性
研究デザインや定義、結果、分析に柔軟性があればあるほど、研究結果が真実である可能性は低くなる。方法論の厳密さは、偏った知見のリスクを減らす可能性が高い。
“科学の「ホット」な分野
研究分野が熱いほど、特定の分野に関与する科学チームが増える傾向にあり、印象的な結果を得るための競争が激化することで、誤った知見が得られる可能性が高まる。
財務上の利益
科学分野における金銭的(その他の)利益や偏見が大きければ大きいほど、研究結果が真実である可能性は低くなる。これには、財務的および非財務的な利益相反(後述)に加えて、研究データの操作や不正行為、および/または選択的な結果報告も含まれる。
産業界とのベッドの中で
理想的には、どのような研究の著者も利益相反がないことが望ましい。しかし、現実の世界では、必ずしもそうではない。多くの環境では、大学や公的資金提供団体、政府機関によって、学術研究者と産業界との研究協力が奨励されていることさえある。例えば、EU最大の研究・イノベーションプログラムである「Horizon 2020」では、イノベーションの実現を容易にすることを最終目標に、共同研究を推進している。
医学では、一般的に利益相反というと、著者と産業界との金銭的なつながりを意味する。しかし、利益相反はもっと広範な問題である。非財務的な利益相反の例としては、研究トピックに関連した強い個人的な信念、個人的な関係、制度的な関係、またはキャリア開発への願望などが挙げられる[28]。他の研究者もまた、金銭的、非金銭的に関わらず、利益相反がないとは限らない。例えば、ロビイスト、患者会、研究者、弁護士、メディカルライター、広告やソーシャルネットワーキングの専門家、医師、管理者、政策立案者もまた、業界の支援を受けている可能性がある[29]。まとめると、関係するすべての部分の利益相反を排除することは非現実的な目標かもしれないが、潜在的または事実上の利益相反の透明性を高め、開示することが優先事項であるべきである。産業界がスポンサーとなっていない研究と比較して、産業界がスポンサーとなっている研究は、より有利な有効性と有害性の知見と、より有利な結論が得られる傾向があった [30]。
小児栄養学においては、母乳育児の保護と促進の必要性から、乳児用粉ミルクの製造業者による研究への資金提供は、さらに議論の余地があると考えられる。しかし、乳児用粉ミルクが関与する研究の場合、研究者が高品質の乳児用製品を製造する手段を持たないため、産業界の関与は避けられない。しかし、医薬品やその他の市販製品やサービスの効果、安全性、利益について信頼できる証拠を得るために、独立した資金提供を受けた研究を行うことは望ましい目標である。
EBMの問題点を解決するために何ができるか?
患者ケアに関連する系統的なバイアス、無駄遣い、エラー、不正」への対応として、著名な個人のグループが「より良い健康のためのEBMマニフェスト」(表5)を発表した[31]。このように、問題点が特定されただけでなく、EBMを修正するためのアジェンダが提案された。提案された解決策のリストは完全ではないかもしれない。そこで、「EBMマニフェスト」の一部として、誰でもオンラインフォームを通じて提案を投稿することができるようになっている。
表5. より良い健康のためのEBMマニフェスト[31]

全体的に、「EBMマニフェスト」の著者が提案した解決策は、他の人が提案したものと類似している[16]。EBMは、個々の患者のケアを最優先事項とすべきである。最高の研究エビデンスと臨床の専門知識および患者の価値観の統合としてのEBMの当初の理解に沿って、ガイドラインに従うことへの依存度を低くして、患者への個別化されたエビデンスの適用が強調されている。研究は臨床的に関連性があり、より良い報告がなされ、応用されるべきである。批判的評価スキルのトレーニングは重要であるが、単独で行うべきではなく、意思決定のスキルを共有する必要がある。エビデンスサマリーや臨床ガイドラインの言語、フォーマット、プレゼンテーションは、実際の臨床でエビデンスに基づいた情報を使用する人々の役に立つものでなければならない。出版社とジャーナル編集者は、出版された資料が医療従事者に利用されるようにする責任がある。
臨床研究を改善するために何ができるか?
研究実施のための基準
2014,The Lancet誌は「研究」と題した5本の連載記事を発表した。Increasing Value, Reducing Waste(価値を高め、無駄を減らす)」と題して、以下のような議論をしている。(1)研究の利用者に関連する問題に基づいて資金が提供されるように研究の優先順位を設定する[32]、(2)研究のデザイン、実施、分析(主な問題として、プロトコルやデザインの不備、情報の有用性の低さ、統計的な力や結果の誤認、他のエビデンスへの配慮の不足などがある)[33]、(3)生物医学的研究の規制と管理[34]、(4)完全にアクセス可能な研究情報の役割[35]、(5)不完全な研究や使用不能な研究[36]である。
小児研究を実施するための基準
それとは別に、近年、小児臨床研究を強化するために重要な進展が見られている。2009年には、小児保健における研究の基準(Standards for Research:StaR)イニシアティブが設立された [37]。このイニシアチブは、現在の小児臨床試験の不足と不足に対処するものであった。StaRの目的は、最新の研究基準の使用を促進することにより、小児臨床研究の設計、実施、報告の質を向上させ、エビデンスが方法論的に頑健で重要なものとなるようにすることである。
臨床研究の報告基準
時間と資源を無駄にしないためには、研究は十分に実施されるだけでなく、適切に報告される必要がある。臨床研究の報告が不完全であったり、不十分であったり、不正確であったりすることが問題となっており、 臨床的意思決定における臨床研究の役割を低下させているという証拠がある。
報告によく見られる欠点としては、研究全体の報告がない、または報告が遅れていること、研究所見に関連して一部の結果のみを選択的に報告すること、 研究方法や介入の説明において重要な情報が省略されていること、論文本文や要旨における結果の省略や解釈の誤り、有害性の報告が 不十分または歪曲されていること、結果、データ、グラフの表示が紛らわしい、または誤解を招くことなどが挙げられる [38]。
報告の問題を認識した上で、ジャーナル編集者は、方法論者、研究者、臨床医、専門組織のメンバーなどの他の利害関係者とともに、デザイン、実施、解析のすべての詳細が原稿に含まれていることを確認するために、臨床研究報告のための多くの基準を策定してきた。
中でも、これらの基準(すべてEQUATOR Networkのウェブサイト:www.equator-network.org)には、以下のものが含まれている。CONSORT(Consolidated Standards of Reporting Trials)[39]、PRISMA(Preferred Reporting Items for the Systematic Reviews and Meta-Analyses)[40]、STARD(Standard for the Reporting of Diagnostic Accuracy Studies)[41]、MOOSE(Meta-Analysis of Observational Studies in Epidemiology)[42]。
雑誌によるこれらの報告ガイドラインの承認は非常に多様である。しかし、編集者は現在では、出版のために原稿を提出する際に、これらの基準に従うことを著者に要求するケースが増えている。
科学者の評価方法を変えるための取り組み
現行の科学評価システムは、ビブリオメトリクスに大きく依存しており、研究の質よりも量を重視している。しかし、科学者の評価や報酬のあり方を変えることで、研究の質を向上させる方法に焦点を当てた取り組みがいくつかある。その一例が、より良い研究評価の指針となる10の原則を特定したアルトメトリクスの専門家グループが2015年に発表した「ライデン・マニフェスト」である[43](表6)。これらの基準に従えば、研究の完全性が向上する可能性が高い。少なくとも一部の科学機関では、すでに量より質を奨励する方針を策定している[44]。
表 6. 研究評価基準のためのライデン宣言。研究評価の指針となる 10 の原則 [43]

臨床試験の変化
臨床研究は進化している。2016,The New England Journal of Medicine誌は「The Changing Face of Clinical Trials」と題した論文集を発表し、臨床試験者が臨床試験者のために書いた臨床試験のデザイン、パフォーマンス、解釈における現在の課題を検証している。このシリーズでは、特に新しい臨床試験デザインを取り上げている。現在の研究方法の限界を認識することは、より新しい研究デザインへとつながっていく。その例としては、実用的試験(大きな強みは、参加者が治療や診断戦略を受ける人々を広く代表しており、高い一般化可能性があること)や適応的試験デザイン(治験責任医師が進行中の試験の基本的な特徴を変更するために使用する)などがある。
「ビッグデータ」と「実世界のデータ」
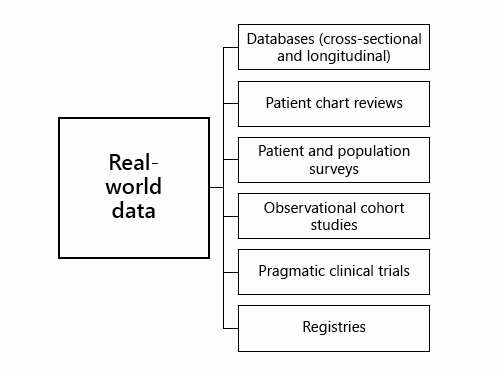
今後、意思決定は “ビッグデータ “と “実世界のデータ “によって影響を受ける可能性がある。”ビッグデータ”(しばしば3つのV:ボリューム、ベロシティ、多様性によって特徴づけられる)は、分析と活用を可能にするために特殊な計算ツールを必要とする、非常に大規模な情報セットの収集を説明する用語である[45]「ビッグデータ」のサブセットは「実世界のエビデンス」(「実世界データ」とも呼ばれる)であり、電子カルテ、登録、病院記録、健康保険データなどのソースから得られるデータとして定義されている[46](図3)。「実世界の」データは、臨床試験の設定の外で、ある治療法が「実際の」患者に効果があるかどうかを確認することを可能にしている[47]。しかし、「ビッグデータ」や「実世界のデータ」は魅力的かもしれないが、その真の価値やエビデンスが偏りのないものであるかどうかは不明である。メタ分析的アプローチと同様に、これらのデータも正確であることが重要だ。
図3. 「実世界のデータ」(エビデンス)のソース。
見解のまとめ
すべての健康に関する意思決定は、質の高い科学的データに基づいて行われるべきである。したがって、EBMと臨床研究の両方が必要とされている。しかし、EBMも臨床研究も完璧ではない。臨床研究は質に大きな差があり、したがって、得られたエビデンスの信頼性にも大きな差がある。EBMと臨床研究の強みと限界を理解することが重要である。EBMを固定化するための解決策が提案されている。同様に、質の高い研究を発展させるための戦略も開発されてきた。研究者、学術機関、資金提供団体、産業界、ジャーナル、出版社が厳密に遵守すれば、より有効で信頼できる知見が得られるはずである。今後も新しい健康データ方法が出てくることを考えると、EBMや臨床研究の世界は変化していくであろう。しかし、最終的な目標は、患者さんの健康状態の改善であることに変わりはない。
