Contents
Effects of Sweeteners on the Gut Microbiota: A Review of Experimental Studies and Clinical Trials
www.ncbi.nlm.nih.gov/pmc/articles/PMC6363527/

概要
低カロリーであることや、糖分の多い製品の健康への懸念から、無糖食品の消費が増えている。ショ糖の数十万倍の甘さを持つ甘味料が砂糖の代替品として頻繁に消費されている。非栄養性甘味料(NNSs)は、安全でよく耐えられると考えられているが、グルコース不耐症、甘い味の受容体の活性化、および腸内細菌叢の組成物への変化への影響は議論の的になっている。
このレビューでは、批判的に非栄養性甘味料s、合成甘味料(アセスルファムK、アスパルテーム、シクラメート、サッカリン、ネオテーム、アドバンテーム、スクラロース)と天然甘味料(天然甘味料s;タウマチン、ステビオールグルコシド、モネリン、ネオヘスペリジンジヒドロカルコン、グリチルリチン)と栄養性甘味料(ポリオールまたは糖アルコール)の両方の効果を支持する証拠を議論している人間の腸内細菌叢の組成に。
これまでのところ、サッカリンとスクラロース(非栄養性甘味料)とステビア(天然甘味料)のみが腸内マイクロバイオータの組成を変化させている。
定義によって、プレバイオティクスは、難消化性の食品成分であるが、いくつかのポリオールは、少なくとも部分的に、受動的な拡散によって小腸で吸収することができる:しかし、そのようなイソマルト、マルチトール、ラクチトール、およびキシリトールなどのそれらの数は、大腸に到達し、ヒトのビフィズス菌の数を増加させることができる。甘味料がヒトの腸内マイクロバイオームの組成に及ぼす影響については、さらなる研究が必要である。
キーワード:栄養性甘味料、非栄養性甘味料、甘味料、卓上甘味料、マイクロバイオータ
序論
ショ糖やグルコースフルクトースシロップを中心とした糖類の消費量は世界的に飛躍的に増加しており、健康への悪影響やメタボリックシンドローム、心血管疾患、2型糖尿病(2型糖尿病)などのメタボリック疾患への懸念が高まっていることから、遊離糖類の摂取量を減らす動機付けとなっている。甘味料は、砂糖の甘味を模倣した糖代替物であるが、エネルギー摂取量にはほとんど影響がない(1,2)。
甘味料の甘さは、基準糖であるショ糖との関係で測定される。生物学的には、甘さの知覚は、タンパク質のCクラスの一部を形成するGタンパク質[味覚受容体タイプ1と2(それぞれT1R1とT1R2,)]に結合されている味蕾上の受容体を介して発生する(3)。
非栄養性甘味料(NNSs)は、ショ糖やコーンシロップなどのカロリーや栄養性甘味料と比較してグラムあたりの高い甘味度と低いカロリー含有量を持っている甘味料として定義されている。非栄養性甘味料は、合成または天然の起源であることができ、後者はますます消費されている(4,5)。低カロリー甘味料(LCSs)は、ポリオールや糖アルコール、他の新糖のような、低消化性の炭水化物であり、それらの砂糖またはシロップ源の水素化に由来する。糖アルコールは、砂糖と同じくらいの甘さが約25〜100%である。糖アルコールは砂糖よりも若干カロリーが低く、虫歯を促進したり、血糖値の急激な上昇を引き起こすことはない(6)。
非栄養性甘味料も低カロリー甘味料も、清涼飲料水、乳製品、粉末ドリンクミックス、焼き菓子、デザート、キャンディー、チョコレート、プリン、缶詰、ジャムやゼリー、菓子チューインガムなど、多くのカロリー低減食品の原料として使用されているため、糖尿病患者だけでなく、一般の人々にも消費されている。さらに、それらは家庭で、カフェテリアで、そしてレストランで卓上甘味料として使用することができる(6)。
甘味料の米国FDAの承認プロセスは、推定摂取量、そのすべての用途からの甘味料の累積的な影響、および動物における毒性試験を決定することを含んでいる。さらに、欧州連合(EU)では、欧州食品安全機関(EFSA)およびコーデックス・アリメンタリウス(Codex Alimentarius)が、非栄養性甘味料および低カロリー甘味料が人間の消費に安全であり、1日の許容摂取量(ADI)内で消費される限り、癌やその他の健康関連の問題を引き起こさないことを評価し、確認している。今日までに、FDAは食品および飲み物のための6つの高強度人工甘味料を承認した: アセスルファムカリウム(アセスルファムK)アスパルテーム、ネオテーム、サッカリン、スクラロース、およびアドバンテーム。さらに、天然由来のステビオール配糖体、タウマチン、羅漢果エキスの3つの非栄養性甘味料がFDAによって承認されている(6)。EUのEFSAは、11種類の非栄養性甘味料をヒト消費用に承認している。アセスルファムK(E-950)アドバンテーム(E-969)アスパルテーム(E-951)アスパルテーム-アセスルファム塩(E-962)シクラミック酸とそのナトリウムおよびカルシウム塩(E-952)。ネオヘスペリジンジヒドロカルコン(E-959)ネオタメ(E-961)サッカリン(E-954)ステビオール配糖体(E-960,10種類の配糖体を含む)スクラロース(E-955)タウマチン(E-957)などが挙げられる(7)。
食品用ポリオールは、ショ糖や他の遊離糖の代用として、量に対して甘味のある低カロリーの炭水化物である。彼らはエリスリトール、水添デンプン加水分解物(時々マルチトールシロップ、水添グルコースシロップ、ポリグリシトール、ポリグルシトール、または単にHSHとして記載されている)イソマルト、ラクチトール、マルチトール、マンニトール、ソルビトール、およびキシリトールが含まれている。米国では、FDAはいくつかのポリオールを一般的に安全と認識されているものとして分類しているが、他のポリオールは食品添加物として承認されている。EUで承認されている低カロリー甘味料には、ソルビトールおよびソルビトールシロップ(E420)マンニトール(E421)イソマルト(E-953)ポリグリシトールシロップ(E-964)マルチトールおよびマルチトールシロップ(E-965)ラクチトール(E-966)キシリトール(E-967)およびエリスリトール(E-968)が含まれている(7)。
FDA、EFSA、コーデックス・アリメンタリウス、および多くの国の当局は、非栄養性甘味料および低カロリー甘味料の両方が一般的に安全であり、よく許容されることを認識しているが、ヒトの健康に対する甘味料の影響については論争がある(2)。ダイエットソーダを中心とした非栄養性甘味料の消費は、いくつかの研究では関連を見つけられなかったが、肥満、メタボリックシンドローム、および2型糖尿病(8-12)のリスクの増加に関連している(13,14)。一般的に使用されている非栄養性の人工甘味料の消費は、腸内細菌叢への組成および機能的変化の誘導を通じて、グルコース不耐症の発症を促進する(15)。対照的に、非栄養性甘味料の消費は血糖値を低下させ、これは甘味受容体の活性化よりもむしろ炭水化物負荷が低いことに起因する(16)。一部の人では、ポリオールの過剰な消費は、豆類および特定の高繊維食品に対する胃腸反応に類似した、ガスまたは下剤効果などの胃腸症状を引き起こす可能性がある。このような症状は、個人の感受性や同時に食べた他の食品に依存する(17)。
腸内微生物群集は、ヒトの健康と疾患において重要な役割を果たしている;実際、腸内マイクロバイオームは、代謝、免疫、成長、および未消化炭水化物の発酵に関与している(18)。さらに重要なことに、腸内マイクロバイオームは免疫系と協力し、免疫細胞の成熟と多くの病態生理学的条件への感受性の誘導を促進するシグナルを提供している(19)。マイクロバイオームの組成と機能は調節されており、食事によって急速に変化する可能性がある(20)。非栄養性甘味料/無栄養人工甘味料と低カロリー甘味料消費との間の潜在的な関連としてのマイクロバイオームを研究することの重要性と、ヒトの健康、食事、および腸内マイクロバイオータの間のよく知られた相互作用のために、現在、研究が進められている。しかし、健康な集団と非健康な集団の両方における非栄養性甘味料と低カロリー甘味料の健康効果に関連するエビデンスには多くのギャップがある。そこで、非栄養性甘味料と低カロリー甘味料の腸内マイクロバイオータへの影響を記述した文献を批判的にレビューした。
知識の現状
腸内細菌叢に及ぼす強力な甘味料の効果
強力な甘味料は、カロリー含有量が無視できるほどの高出力甘味料であり、食品には少量しか使用されていない。それらのすべてが合成甘味料と天然甘味料に分類されている(5)。それらの構造とADI、およびそれらの主な生物学的効果は、表1に要約されている。
表1 天然・合成甘味料の構造・ADI・生物学的効果1
| 甘味料 | ADI、mg・kg -1・d -1 | 構造 | 生物学的影響 |
|---|---|---|---|
| アセスルファムK(E-950) | 15 | C 4 H 4 KNO 4 S | アセスルファムKは人体によって代謝されるが、これは大多数の研究で無害であると説明されている。体重や耐糖能に影響はない。 |
| アスパルテーム(E-951) | 40 | C 14 H 18 N 2 O 5 | アミノ酸の組み合わせであるアスパルテーム、すなわちl-フェニルアラニンとl-アスパラギン酸は、メチルエステル結合を介して急速に吸収される。この化合物は安全であり、遺伝子変異に対する毒性はない。 |
| ネオテーム(E-961) | 2 | C 20 H 30 N 2 O 5 | ネオテームはアスパルテームと非常によく似た構造の甘味料である。フェニルケトン尿症の患者には安全であるが、糖尿病患者にも安全である。その代謝に関しては、摂取されたネオテームの半分は吸収されず、糞便から排泄されるが、残りの半分は脱エステル化されたネオテームとして尿中に排泄される。 |
| アドバンテーム(E-969) | 5 | C 24 H 30 N 2 O 7 | アドバンテームは、アスパルテームとイソバニリンから化学合成によって得られ、フェニルアラニンの供給源である。この化合物は無毒または発がん性があり、食品添加物として消費されるリスクはない。 |
| チクロ(E-952) | 11 | C 6 H 12 NNaO 3 S | チクロは、シクロヘキシルアミン(毒性化合物)のスルホン化によって調製される。EUは食品への使用を承認したが、FDAは1969年にGRASステータスを削除し、1970年に完全に禁止した。体重や耐糖能への影響はない。 |
| サッカリン(E-954) | 5 | C 7 H 5 NO 3 S | サッカリンは尿から排泄され、体内で代謝されないが、胎盤を通過して母乳を介して移動する可能性がある。その消費は、妊娠中または授乳中の女性にはお勧めできない。 |
| スクラロース(E-955) | 5 | C 12 H 22 O 11 | スクラロースは、ショ糖の3-ヒドロキシル基を置換することによって得られる。摂取したスクラロースの約11〜27%が腸から吸収され、腎臓に排泄される。スクラロースは安全である。 |
| ステビオール配糖体(E-960) | 4 | 変数 | ステビオール配糖体は、ステビアレバウディアナベルトーニの葉から抽出された分子である。結腸のバクテリアはそれらをステビオールグルクロニドに変換し、最終的に尿を通して排泄される。これらの分子の消費は安全である。 |
| グリチルリチン | NA | C 42 H 62 O 16 | グリチルリチンは、Glycyrrhizaglabraの根と根茎から得られるトリテルペノイドサポニンです。EUでは、抽出物に含まれるグリチルレチン酸の糖質コルチコイド効果を考慮すると、その消費は100 mg / dの制限で安全であると見なされている。 |
| ネオヘスペリジンジヒドロカルコン(E-959) | 4 | C 28 H 36 O 15 | ネオヘスペリジンジヒドロカルコンは、Citrus aurantium Lの未熟果実の皮に由来する半天然甘味料である。1994年からEUで承認されているが、米国では承認されていない。 |
| ソーマチン(E-957) | 50 | — | ソーマチンは、Thaumatococcus danielliBennett植物から抽出された化合物の混合物である。甘味料として、EUと米国の両方で承認されており、GRASと見なされている。 |
1ADI、許容可能な毎日の摂取量;EU、欧州連合;GRAS、一般的に安全として認識されている;NA、利用できない。
合成甘味料
アセスルファムK
アセスルファムは酸性環状スルホンアミドであり、アセスルファムK(E-950)はアセスルファムのカリウム塩である。アセスルファムKはヒトの体内で代謝され、15mg/kg体重のADIを有する(5, 21)。
アセスルファムKはCaraラットの糞便微生物によるグルコース発酵を減少させ、甘味料がグルコース輸送系に影響を与える可能性を示唆している(22)。アセスルファムKの効果は、腸内微生物の機能能力とは関連していなかった(23)。
蒸留水と15mgのアセスルファムK/kgを投与されたマウスを対象とした研究では、全細菌、Firmicutes、Bacteroidetes、および他のいくつかの属名が2群間で類似していたことが示され、アセスルファムKの摂取がマウスの腸内微生物叢およびその代謝にほとんど影響を及ぼさないことが立証された(24)。対照的に、Bianら(25)はその逆で、アセスルファムKを4週間摂取するとCD-1マウスの腸内細菌叢に影響があることを発見した。アセスルファムKを摂取したオスマウスでは、バクテロイデスが非常に増加し、AnererostipesとSutterellaの個体数にも大きな変化が見られた。一方,雌マウスでは,アセスルファムK処理によりラクトバチルスとクロストリジウムの相対的な存在量が減少した。このようなアセスルファムK摂取後の腸内細菌叢の変化は、性特異的な効果を示している(25)。
これらの矛盾した結果の主な理由は、各試験におけるアセスルファムKの投与量に関係していると考えられる。第1の試験では15体重mg-kg-1 -d-1の投与量が用いられ(24)第2の試験では37.5体重mg-kg-1 -d-1の投与量が用いられた(25)。ヒトへの摂取に関しては、Uebansoら(24)の研究ではADIの最大値を使用したが、Bianら(25)の研究ではADIの推奨値の2倍以上を超えていた。実際、この研究は生理学的には無関係かもしれない(25)。
アスパルテーム
アスパルテーム(E-951)は、アスパラギン酸とフェニルアラニンからなるジペプチドで、後者のカルボキシル末端基がメチル化されている(N-l-α-アスパラチル-フェニルアラニン1-メチルエステル)。ショ糖の約200倍の甘さがある。アスパルテームの代謝と運命は、全身性の加水分解によって構成部分に支配されており、親化合物はほとんど、または全く一般循環には入らない。EUの規制番号1169/2011によると、アスパルテームを使用するすべての食品は、”アスパルテーム(フェニルアラニンのソース)を含む “という言葉を含む目に見えるラベルを持っていなければならない。アスパルテームのADIは40mg/kg体重(5)である。
アスパルテームの400mgの用量は、糖尿病の有無にかかわらず、被験者のピークインスリン濃度に影響を与えなかったが、血漿中グルコース濃度の低下を引き起こした(26)。TordoffとAlleva(27)は、アスパルテームと高果糖コーンシロップの摂取量を比較し、アスパルテームは糖質摂取量を減少させると結論づけた。ヒトにおけるアスパルテームの安全性に関しては膨大な量の情報があるが、アスパルテーム摂取が腸内細菌叢の組成に及ぼす影響に焦点を当てた研究はほとんどなかった。
ラットを用いて、慢性的な低用量アスパルテーム摂取が体組成計、代謝、および微生物変数に与える影響を、食事誘発性肥満モデルで検証した。ラットを無作為に4つのグループに分け、8 wkの間、以下を受けた:標準的な飼料ペレットダイエット群(脂肪からのキロカロリーの12%)と、飲料水で自由摂取水または5-7 mgのアスパルテーム-kg体重-1.d-1と高脂肪ダイエット群(脂肪からのキロカロリーの60%)と、飲料水で自由摂取水または5-7 mgのアスパルテーム-kg体重-1.d-1を受けた。アスパルテームの摂取は、標準的な飼料ペレット食群と高脂肪食群の両方において、体組成とは無関係に空腹時グルコース濃度を増加させた。メタボロミクス分析により、アスパルテームは急速に代謝され、SCFA 産生、特にプロピオン酸産生に関連していることが示された。アスパルテームを投与された動物では微生物組成の変化が観察され、総細菌数とEnterobacteriaceaeとClostridium leptumの豊富さが増加した(28)。また、アスパルテームを 11 wk 投与したマウスはグルコース不耐症を発症したが、微生物叢の解析では群間で有意な差は認められなかった(15)。
我々の知る限りでは、アスパルテームがヒトの腸内マイクロバイオームに及ぼす潜在的な影響についてのデータはない。この非栄養性甘味料は小腸で急速に加水分解されるため、アスパルテームが腸内マイクロバイオームにどのような影響を及ぼすかを理解することは困難である。実際、非常に高用量のアスパルテーム(>200 mg/kg)を摂取しても、アスパルテームは急速に分解されるため、血中には検出されない(29)。摂取すると、アスパルテームは、アスパラギン酸、フェニルアラニン、メタノールおよびそれらの成分を含む残留成分に分解され、容易に吸収されて大腸に到達しない(30)。
ネオテームとアドバンテーム
ネオテーム(E-961)は、アスパルテームに近い構造を持つショ糖の7000倍から13000倍の甘さを持つ人工甘味料です[N-N-(3,3-ジメチルブチル-L-α-アスパルチル-L-フェニルアラニン-1-メチルエステル)]。FDAおよびEFSAは、一般使用のためのネオテームを承認している。推奨ADIは0.3mg・kg体重-1・d-1である。ネオテームは中等度の熱安定性があり、非常に強力で、急速に代謝され、完全に消失し、体内に蓄積することはないようである。ネオテームを給与したマウス等の試験動物では、身体症状、水分摂取量、臨床病理学的評価に異常は認められず、病的、死亡率、臓器毒性、巨視的、顕微鏡的な死後所見は報告されていない(31-33)。
2013年にEUで承認されたAdvantame(E-969)は、アスパルテームとバニリンを原料とするアスパルテームのN置換誘導体で、ショ糖の約2万倍の甘味を持つ(34)。2013年にはEFSAのパネルがADIを5mg・kg体重-1・d-1に設定し、食品添加物として無毒、非発がん性、安全性を認めている(7)。
食品の甘味料として必要なのは微量のアドバンタメやネオタメだけなので、どちらの甘味料も動物やヒトでは評価されていない。ネオテームの腸内加水分解から得られるメタノールの量は、一般的な食品に含まれる量よりもはるかに少ないため、ネオテームまたはアドバンテームが腸内微生物叢に影響を及ぼす可能性は低い。
シクラメート
シクラメートは50カ国以上で使用されている。EUではシクラミン酸とそのナトリウムおよびカルシウム塩を食品用として承認している(E952)が、FDAは1969年に安全性として一般的に認められていたステータスを削除し、1970年には完全に禁止された(5)。これは、シクラメート単独よりも毒性が強いシクラメートの代謝物であるシクロヘキシルアミンを添加したシクラメート-サッカリン混合物をラットに給与したところ、膀胱腫瘍が検出されたためである(35, 36)。しかし、これらの研究はデザインや用量の問題で厳しく批判され(37)、シクラメートの再評価が行われている。EUでは、シクラメートのADIは7mg/kg体重である(5, 7)。
シクラメートによる微生物相の変化についての最初の知見は、Drasarらの研究で報告されている(38)。著者らは、ラットにおけるシクラメートのシクロヘキシルアミンへの変換が、シクラメートの非経口投与後、またはシクラメートの肝臓、脾臓、腎臓、または血液製剤とのインキュベーションのいずれの後にも起こらないことを観察した。主な仮説は、シクロヘキシルアミンの形成は、微生物の代謝の結果として腸内でのみ発生するというものであった(38)。
1985年、Mallettら(39)は、嫌気性培養系で試験管内試験に維持したラットの腸内微生物叢を用いて、代謝性シクラメートの適応を試験した。その結果、8 wk でシクロヘキシミドの最大形成が認められ、糞便中のスルファマターゼ活性が増加することがわかった。著者らは、シクラメートの投与後、試験管内試験系で培養した糞便微生物叢に分類学的変化は見られなかった。
シクラメートの存在は、Caraラットの微生物叢によるグルコースの発酵を減少させた(22)。シクラメートは腸内の細菌スルファターゼ活性を増加させる(40)。我々の知る限りでは、ヒトの腸内微生物叢に対するシクラメートの効果に関する利用可能なデータはない。
サッカリン
食品や飲料の範囲は、その潜在的な発がん性についての議論にもかかわらず、安全であると考えられているサッカリン(E-954)によって甘くされている。しかし、研究では、サッカリンの消費は、腸内細菌叢を摂食する可能性があることを示している。そのADIは、すべての集中的な甘味料(5 mg/kg体重)(5)の最も低い。
10日間のラット盲腸からの好気性および嫌気性微生物集団に対する7.5%サッカリンの効果がテストされた。ラットは、介入の終了時に盲腸内容物中に検出された約90mgのサッカリンを摂取した。サッカリンの存在は、嫌気性微生物の総数を変化させなかったが、盲腸内容物から微生物の特定の嫌気性グループの排除をもたらした(41)。
サッカリンの投与は、サッカリンの2.5%用量を受けたラットの小腸内容物から分離された6つの細菌株(3乳酸菌種および3大腸菌株)の増殖を阻害した;ラットは、食事中に107.0 mgサッカリンを消費した(ラットの体重は200から220 gの間であった)(42)。サッカリンは、Caraラットの微生物によるグルコースの発酵を阻害した(22)。
動物を用いたパイロシークエンス研究では、サッカリン+ネオヘスペリジンジヒドロカルコンの添加は、乳酸菌の糞便集団の豊富さを増加させ、腔内乳酸濃度を増加させることが示された(43)。16SリボソームRNA遺伝子解析により、7つの細菌クラスを網羅する25の主要なファミリーが同定され、Bacteroidia、Clostridium、およびBacilliが微生物相を支配していた。サッカリン/ネオヘスペリジンジヒドロカルコンを投与された動物では、微生物組成に有意な変化が見られ、細菌群集の動態を駆動する主要な影響が確認された(44)。
動物におけるサッカリンの劇症的な代謝効果は、抗生物質処理によって消失し、微生物相の移植時には細菌のいないマウスに完全に移行した。さらに、改変された代謝経路は、健康なヒトの被験者における耐糖能および腸内環境の異常と関連していた。サッカリンを給与したマウスでは、プロバイオティクス特性を示す常在菌であるAkkermansia muciniphilaが過少に発現していた(15)。Suezら(15)による研究以来、科学的な焦点は、腸内細菌叢の多様性に対するサッカリンの影響を評価することに向かって移動した。
甘味料は、齧歯類を使用する実験室研究において、エタノールやニコチンのような薬剤の消費を促すために使用されることが多い。Labrecqueら(45)は、水またはサッカリンのいずれかのエタノールが妊娠中および非妊娠中のマウスの糞便マイクロバイオームに及ぼす影響を評価した。サッカリンは、消費されたエタノールの総量が2群で同じであったにもかかわらず、クロストリジウムの数を減少させた(45)。
炎症は腸内マイクロバイオータの混乱と頻繁に関連している。0.3 mg サッカリン/mL(ヒトのための FDA 承認の ADI と同等の用量)で 6 月間処理したマウスは、TNF-α と NO シンターゼ(iNOS)の誘導性アイソフォームの発現が増加していた彼らの肝臓で。さらに、腸内細菌叢の変化は、サッカリン誘発性肝炎症と関連していた。腸内細菌叢のこれらの変化は、Ruminococcus、Adlercreutzia、Dorea、Corynebacterium、Roseburia、およびTuricibacter(46)で観察された。
初期の研究では、人工甘味料が腸内細菌叢に影響を与えずに血漿グルコースとピークインスリン濃度を維持することを示唆している。しかし、より多くの最近の動物およびヒトの研究は、特にサッカリン(図1)の摂取と、ヒトの被験者のグルコース耐性と生物学的異常にリンクされている代謝経路の変化に関連する腸内細菌叢の特定の変化を示した。
図1 人工甘味料とサッカリンの腸内細菌叢への影響
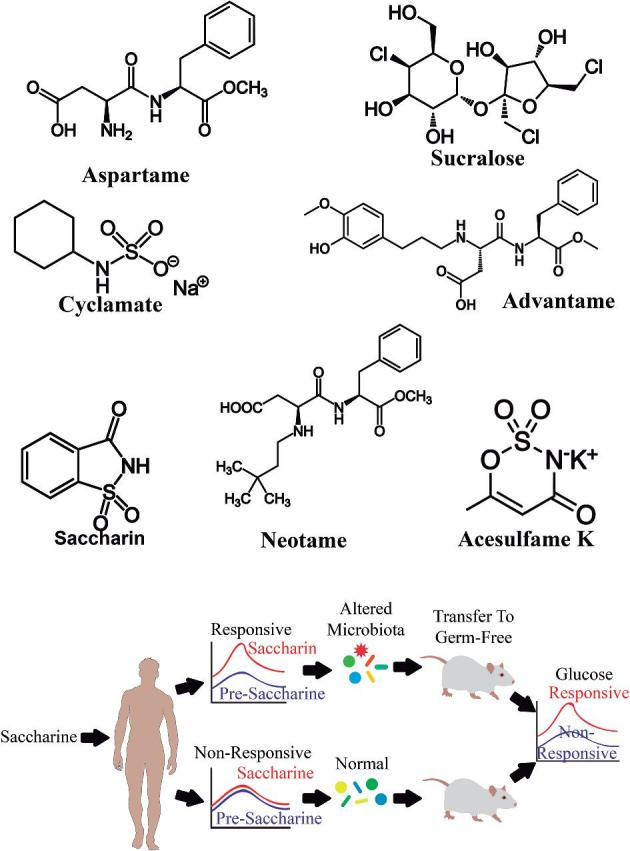
動物実験では、サッカリン摂取後のグルコース耐性にリンクした代謝経路の変化に関連した腸内微生物叢の特定のシフトが報告されている。
スクラロース
スクラロース(E-955)は、ショ糖の3つの水酸基を置換して得られた合成甘味料で、ショ糖の約320~1000倍の甘さがある(47)。そのADIは5mg/kg体重である。腸内細菌叢上のスクラロースを評価した最初の研究は 2008年に12 wkのために甘味料を受けたSprague-Dawleyラットからの糞便サンプルを使用して実施された。スクラロースの摂取は、嫌気性および好気性細菌、ビフィズス菌、乳酸菌、バクテロイデス、クロストリジウムの総数を減少させた(48)。15mgスクラロース/kgの投与は、マウスのクロストリジウムクラスターXIVaの相対的な豊富さに影響を与えた(49)。
最近では、マウスにスクラロースを投与すると、ツリシバクター科、ラクノスピラセア科、ルミノコッカス科、ツルコマイクロビア科、ブドウ球菌科を含む14の異なる分類群レベルの腸内細菌叢に変化が生じた。Streptococcaceae、Dehalobacteriaceae、Dehalobacterium、Lachnospiraceae、Clostridiaceae、Christe天然甘味料enellaceae、Peptostreptococcaceae、Erysipelotrichaceae、およびBacillales目、およびアミノ酸の合成および調節における変化。これらの変化は、宿主の炎症に関連していた(50)。腸内細菌叢に対する合成甘味料の主な報告された効果を表2に示す。
表2 合成甘味料の腸内細菌叢への影響1
| 甘味料と研究(参考) | モデル | 用量試験済み | 微生物分析の方法 | 主な成果 | 変化の大きさ |
|---|---|---|---|---|---|
| アセスルファムK(E-950) | |||||
| Pfeffer etal。(22) | ラット | 3%アセスルファム | 盲腸内容物の抑制活性 | アセスルファムKはブドウ糖輸送システムに作用する可能性がある。 | わずかに抑制 |
| フランケンフェルドら。(23) | 人間による治験 | 1.7〜33.2 mg・kg -1・d -1 | 16S rRNA | 消費は腸内細菌叢の機能的能力とは関連していなかった。 | 細菌の多様性が24門から7門に減少 |
| 上番荘ほか (24) | マウス | 15 mg・kg体重-1・d -1 | PCR変性剤濃度勾配ゲル電気泳動 | 腸内細菌叢とその代謝に対するわずかな影響。 | わずかな変更 |
| ビアンら (25) | マウス | 37.5 mg・kg体重-1・d -1 | 16SrRNAおよびGC | バクテロイデスの個体数は、アセスルファムKで処理したオスのマウスで大幅に増加し、アナエロスティペスとサテレラの個体数に大きな変化があった。逆に、雌マウスでは、アセスルファムKは乳酸桿菌とクロストリジウムの個体数を減少させた。 | 細菌属は2回以上増加または減少した |
| アスパルテーム(E-951) | |||||
| Horwitz etal。(26) | 人間による治験 | 400mg | AUCの摂取と分析 | アスパルテームで治療された被験者の血漿グルコースは低下し、ピークインスリン濃度。腸内細菌叢への影響はない。 | 変更なし |
| トルドフとアレバ(27) | 人間による治験 | 590 mg | 摂取と食事の記録 | アスパルテームは砂糖の摂取量を減らした。腸内細菌叢への影響はない。 | 変更なし |
| Palmnäsetal。(28) | ラット | 60 mg / L飲料水 | qRT-PCR分析 | 腸内細菌科とクロストリジウムレプタムの数の増加。 | 10%以上の増加 |
| スエズら (15) | マウス | 4%アスパルテーム | 16S rRNA | 腸内細菌叢に変化はない。 | 変更なし |
| チクロ(E-952) | |||||
| Drasar etal。(38) | ラット | 100mgのチクロカルシウム | 14 C-分析 | 腸内細菌叢への影響はない。 | 変更なし |
| マレットら。(39) | 試験管内で | 培地中の25〜75%のチクロ濃度 | 二段連続培養システム | 腸内細菌叢への影響はない。 | 変更なし |
| Pfeffer etal。(22) | 試験管内で | 5%チクロ | 盲腸内容物の抑制活性 | チクロはグルコース発酵を減少させた。 | わずかに抑制 |
| サッカリン(E-954) | |||||
| アンダーソン等。(41) | ラット | 7.5%ナトリウムサッカリン | 酵素活性と微生物学分析 | サッカリンは嫌気性微生物の総数を変えなかったが、盲腸の内容物の中の特定の嫌気性微生物を削除した。 | わずかに抑制 |
| Naim etal。(42) | ラット | 2.5%ナトリウムサッカリン | 酵素活性と微生物学分析 | サッカリンは、3つのラクトバチルス菌株と3つの大腸菌菌株の増殖を阻害した。 | 成長阻害のほぼ40% |
| Pfeffer etal。(22) | 試験管内で | 0.5%サッカリン | 盲腸内容物の抑制活性 | サッカリンは、Caraラットの腸内細菌叢によるグルコース発酵を阻害した。 | わずかに抑制 |
| Daly etal。(43) | 子豚 | 0.015%(wt:wt)サッカリンおよびネオヘスペリジンジヒドロカルコン | 16S rRNA | ネオヘスペリジンジヒドロカルコン/サッカリンは、ラクトバチルスの盲腸集団と管腔内乳酸濃度を増加させた。 | 乳酸桿菌の個体数の3倍に増加 |
| Daly etal。(44) | 子豚 | 0.015%(wt:wt)サッカリンおよびネオヘスペリジンジヒドロカルコン | 16S rRNA | サッカリンは微生物組成に有意な変化を引き起こした。 | 乳酸桿菌を2回増加させ、RuminococceaeとVeillonellaceaeをほぼ50%減少させた |
| スエズら (15) | マウス/ヒトの治験 | 120mgのサッカリン | 16S rRNA | 健康な被験者の耐糖能と腸内毒素症に関連する代謝経路の変化。 | 差の大きさは> 30%でした |
| Labrecque etal。(45) | マウス | 水中の0.066%(wt:vol)サッカリン | qRT-PCR分析 | エタノールとサッカリンを投与された妊娠群では真正細菌が増加し、サッカリンの存在によりクロストリジウム菌数が減少した。 | クロストリジウムの減少はほぼ50%でした |
| ビアンら (46) | マウス | 飲料水中0.3mg / mL | 16S rRNA | 腸内細菌属の変化は、サッカリン誘発性肝炎症と関連していた。 | iNOSとTNF-αはそれぞれ3倍と2倍に増加した。腸内細菌叢の変化はで観察されたルミノコッカス属、Adlercreutzia、Dorea、コリネバクテリウム、Roseburia、およびTuricibacter倍以上増加し、 |
| ネオテーム(E-961) | — | — | — | 腸内細菌叢への影響はない。 | 変更なし |
| アドバンテーム(E-969) | — | — | — | 腸内細菌叢への影響はない。 | 変更なし |
| スクラロース(E-955) | |||||
| Abou-Donia etal。(48) | ラット | 100,300,500,または1000 mg / kg | 細菌学的分析 | スクラロースの消費により、嫌気性菌と好気性菌、ビフィズス菌、乳酸桿菌、バクテロイデス、クロストリジウムの総量が減少した。 | 減少は2倍以上でした |
| 上番荘ほか (49) | マウス | 15 mg・kg体重-1・d -1 | PCR変性剤濃度勾配ゲル電気泳動 | スクラロースの投与により、クロストリジウムクラスターXIVaに変化が生じました。 | 阻害は> 50%でした |
1iNOS、誘導性NO合成酵素;16S rRNA、16SリボソームRNA。
腸内細菌叢に対する天然甘味料の効果
天然甘味料はショ糖よりも甘く、カロリーが少なく、発がん性の効果がなく、インスリンの生産に影響を与えない(5)。
ステビオールグルコシド
ステビアrebaudianaは、その葉がステビオシド、ステビオールビオシド、ルブソシド、ダルコシドA、およびrebaudiosides A、B、C、D、E、F、およびMなどのジテルペン配糖体を含む科Ateracea(南アメリカ原産)に属する低木である。その抽出物はショ糖の250倍の甘味を持つことから天然のノンカロリー甘味料として利用されているが(51)EUでは高純度化されたステビオール配糖体のみが食品への使用が認められている(7)。
S. rebaudianaからのステビオシド抽出物は、成人人口(52)では発がん性がない。ステビオール配糖体は甘く、低カロリーで発がん性はないが、ADIの制限値である4mg・kg体重-1・d-1を超える摂取は安全ではない(EU規則1129/2011) (53, 54)。
ステビア抽出物の成分がどのように代謝されるかについては、いくつかの試験管内試験研究が行われている。そのデータによると、主成分であるステビオシドとリバウディオシドAをステビオールに分解することができる(55, 56)。したがって、ステビオシドもリバウディオシドAも上部消化管では吸収されない(30)。
バクテロイデスは、ステビオシドおよびリバウディオシドAをステビオールに加水分解する際に最も効率的な細菌群である(56)。乳酸菌、ビフィズス菌、クロストリジウム、大腸菌、腸細胞菌種などの他の細菌群が試験された。試験した細菌のいずれも、ステビオールグリコシドを加水分解し、使用可能な基質として使用することができなかった(56)。これらの試験された細菌群は、動物およびヒトの消化管に見られる主要なタイプの細菌である(57)。
さらに、グルコースと比較して、ステビオシドとリバウディオシドAを用いたボランティアからの混合糞便細菌の24時間インキュベーションは、ヒトの微生物相にわずかな変化をもたらした(56)。ステビオシドは嫌気性細菌を弱く抑制するのに対し、リバウディオシドAは好気性細菌、特に大腸菌群を弱く抑制する。
S. rebaudianaの根には、イヌリンやフルクタンスが含まれており、人間の健康に良い影響を与える機能性食品成分である(30)。微生物の基質としてのフルクトンの発酵能力は株ごとに異なる。S. rebaudiana由来のフルクタンス、特に重合度が6未満のもの(鎖の大きさが異なる炭水化物)は、腸の機能に重要な選択された微生物株(ビフィズス菌および乳酸菌)の増殖を改善した(58)。
グリチルリチン
グリチルリチンは、グリチルリザグラブラの根と根茎から来ている。それはショ糖の30-200倍の甘さであり、<100 mg/dを摂取している場合は安全であると考えられている。グリチルリチンは、抗がん剤、抗炎症、抗酸化、抗ウイルス、および肝保護特性を持っている。しかし、潜在的な高血圧効果と強烈な後味がある(59)。
腸内では、グリチルリチンは、Eubacterium spp.とBacteroides J-37によってグリチルレチン酸(主要生成物)に脱グリコシル化され、Bacteroides J-37とStreptococcus LJ-22によって18β-グリチルレチン酸3-O-モノグルクロニド(マイナー生成物)に変換される。18β-グリチルレチン酸3-O-モノグルクロニドのグリチルレチン酸への変換は、Eubacterium spp.によっても媒介され得る(59-61)。これらのグリチルリチン代謝物(特に18β-グリチルレチン酸)は、腫瘍細胞に対して強力な細胞毒性を示し、ロタウイルス感染や抗血小板凝集活性に対して強力な抑制効果を発揮する(62)。
グリチルリチンと腸内細菌叢の関係が宿主にプラスの効果を与えることを示唆するデータもある(60, 61, 63)。これが本当にそうであるかどうか、また、グリチルリチンの代謝とその作用機序と効果が腸内細菌叢の構成にどのような意味を持つのかを決定するためには、よりよく設計された研究が必要である。
ネオヘスペリジンジヒドロカルコン、タウマチン、モネリン
ネオヘスペリジンジヒドロカルコンは、未熟な柑橘類の果皮から得られる天然甘味料で、ショ糖の約1500倍の甘さである。ネオヘスペリジンジヒドロカルコンは、腸内微生物によって無害な生成物に代謝される(5, 53)。Thaumatinは熱帯西アフリカ原産の植物Thaumatococcus daniellii Benthの果実から分離された甘味のあるタンパク質である。タウマチンはショ糖の10万倍の甘さがある(5)。モネリンは甘いタンパク質であり、セレンディピティ・ベリー・シュラブの果実から自然に抽出される(64)。私たちの知る限りでは、腸内細菌叢上のそれらの天然甘味料の潜在的な効果を確認する進行中または過去の研究はない。
要約すると、天然甘味料は、腸内細菌叢の変化とそれらの消費を関連付ける少数の研究を持っている。ステビア抽出物は、Bacteroides上のステビアの現在の効果は、さらなる研究を必要とするが、腸内細菌叢の組成への影響に関して最も多くの情報を持っている(図2)。
図2
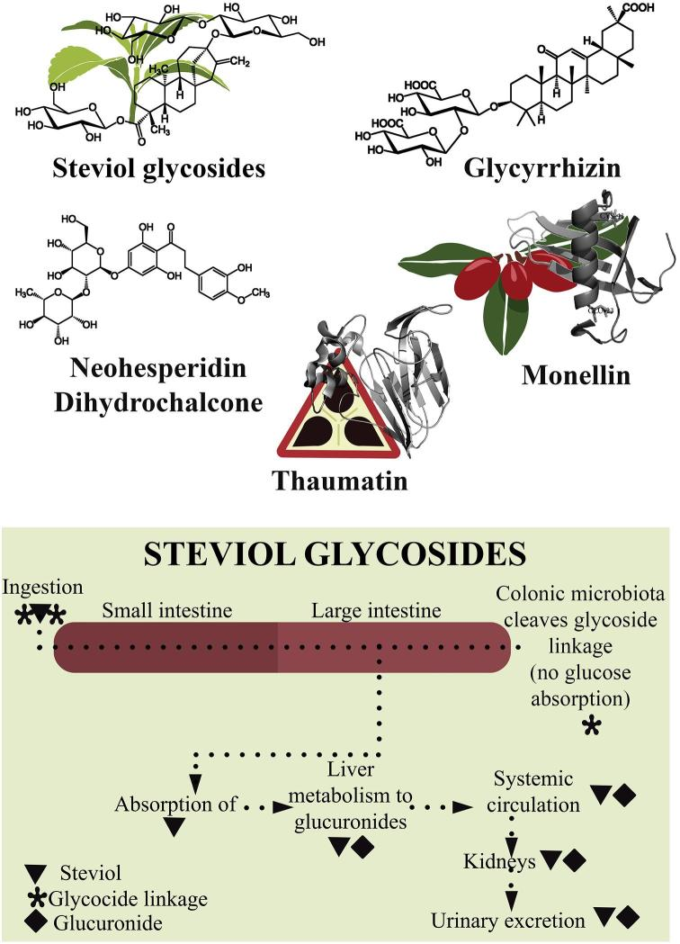
天然甘味料とその腸内細菌叢への影響 ステビアのバクテロイデスに対する現在の効果はさらなる研究が必要であるが、ステビア抽出物は腸内マイクロバイオータの組成を変化させることができると記載されている。
栄養性低カロリー甘味料の腸内マイクロバイオータへの影響
ポリオール(糖アルコール)
ポリオールは、食品添加物として使用される化合物の特定のグループである。ポリオールは高温やpHの変化にも安定で、メイラード反応には関与しない。ポリオールの数は、いくつかの果物、野菜、キノコ類に自然に存在している。それらの工業生産は、過剰に消費された非栄養性甘味料に関連する健康問題を解決することを期待して、前世紀に開始された。ポリオールは非発がん性であり、唾液分泌を誘発せず、インスリン濃度を妨害したり、血糖反応を増加させたりしない;したがって、それらは “軽い “食品に使用されている。FDA、コーデックス Alimentarius、およびEFSAは、8つの異なるポリオール-エリスリトール、水添デンプン加水分解物、イソマルト、ラクチトール、マルチトール、マンニトール、ソルビトール、およびキシリトール-人間の食品のバルク甘味料としての使用を承認している(5,7,65,66)。
ポリオールの過剰な消費は、健康な患者の胃腸症状と下剤効果を引き起こす。ポリオールはまた、健康なボランティアと過敏性腸症候群(IBS)を持つ患者の両方によって消費されたときに鼓腸、腹部不快感、および下剤効果の用量依存性の症状を誘発する。また、適度な量のポリオールは、健康な人のマイクロバイオーム中のビフィズス菌の数を増加させるため、プレバイオティクスとして有益である可能性があるが、データは、IBSを含む多くの腸疾患を有する患者に限定されている(66)。健康なヒトと病気のヒトの両方でポリオールの摂取が腸内マイクロバイオータに与える影響を知ることは重要である。
すべての食品添加物と同様に、ポリオールの安全性はEFSAによって再評価されている。2017年6月、EFSAはEUで食品添加物として認可されている甘味料の技術的・毒性学的データを求めた。この再評価は2020年末までに完了する予定です(67)。
エリスリトール
エリスリトール(E-968)は、炭素数4の糖アルコールで、自然界やワイン、ビール、キノコ、梨、ブドウ、醤油などの食品に広く含まれている(68)。工業的には、浸透性酵母によってグルコースから生産され、その後、分離精製によって純度99%の結晶性製品が得られる(69)。エリスリトールの1日の推定摂取量は1.24g(53)。経口微生物はエリスリトールを代謝せず、ストレプトコッカス菌種を用いたエリスリトールの試験管内試験インキュベーションでは、乳酸や他の有機酸は生成しない(70,71)。
エリスリトールは、小腸では受動的拡散により急速に吸収され、代謝を最小限に抑えて組織内に広く飛散し、最終的には尿中に定量的に排泄される(68)。したがって、エリスリトールは、血漿グルコースやインスリン濃度や腸内細菌叢に影響を与えない(72,73)。すべての発酵変数(例えば、ガス生成、水素蓄積、pH、SCFA生成、基質分解)を調整して考慮したにもかかわらず、エリスリトールは、新鮮に採取されたヒトの糞便微生物によって24時間以内に完全に発酵しない(71)。エリスリトールのヒトにおける腸内微生物叢への影響については、臨床試験でのエビデンスはないが、エリスリトールの毒性、発がん性、生殖毒性についての多くの特異的試験が陰性であることが判明した後、エリスリトールは安全な添加物であると考えられている(5)。
イソマルト
水添イソマルトース、イソマルチトール、またはイソマルト(E-953)は、ショ糖に匹敵する技術的特性を持つ、砂糖の代替品として世界中で使用されているポリオールである。イソマルトは、バブルガム、ゼラチン、チョコレート、コーティング剤、焼き菓子、ヨーグルトに使用されている。イソマルトは、ショ糖の酵素変換によって得られ、高温で安定しており、吸湿性が非常に低い。さらに、エネルギーが低く、ノンカロリーで、他のポリオールと同様に甘みがある。イソマルトの未消化または吸収されなかった部分は、大腸に到達し、腸内微生物によって発酵される。イソマルトは、健康な結腸粘膜環境に寄与する可能性のあるプレバイオティクス炭水化物と考えられている。二重盲検、プラセボ対照、クロスオーバーデザインの臨床試験で4週間の間に、19人の健康なボランティアが30gのイソマルトまたは30gのショ糖/dのいずれかを濃縮した基底食を消費し、イソマルトが腸内細菌叢に有益な効果を持つことを発見した(75)。その後、腸内で発酵したイソマルトはビフィズス菌を増加させ、細菌のβ-グルコシダーゼを減少させたが、β-グルクロニダーゼ、スルファターゼ、ニトロレダクターゼ、ウレアーゼは変化しなかったことが報告された。糞便中のSCFAs、乳酸、胆汁酸、中性ステロール、窒素、アンモニア、フェノール、およびp-クレゾールは、イソマルトの摂取によって影響を受けなかった。さらに、試験管内試験では、いくつかのビフィズス菌株がイソマルトを代謝する能力があり、高い酪酸濃度を生成した(76)。さらに、各試験段階の終了時に直腸生検サンプルを採取し、マイクロアレイおよびqRT-PCRにより遺伝子発現を測定した。消化性ショ糖と比較して消化性の低いイソマルトを用いた食事介入は、直腸粘膜裏打ちの遺伝子発現に影響を与えなかった(77)。したがって、イソマルトはビフィドジェニックな性質を持つポリオールであり、健康的な大腸環境に寄与する可能性がある。
ラクチトール
ラクチトール(E-966)は、乳糖を水素化して得られる非天然由来の糖アルコールである。他のポリオールと比較して、その甘味力は限られており、その結果、通常は強烈な甘味料と組み合わせて使用される(5)。この二糖類は、通常、適切なβ-ガラクトシダーゼの欠如のために小腸で吸収されず(78)、その結果、発酵される下部腸に到達する(79)。したがって、それは2%未満のカロリー寄与をする(31)。しかし、より高いラクチトールの摂取量は、下剤効果をもたらす可能性がある。一方、糖化細菌によるラクチトールの発酵はまた、バクテロイデス、大腸菌、腸内細菌、腸細胞菌などのタンパク質分解細菌の数を減少させることが示されている(80)。試験管内試験では、ラクチトール(2 mg/L)は、ネコの糞便培養物中のEnterobacteriaceaeの集団を減少させ、ネコの腸内細菌叢にプレバイオティクス効果を発揮する(81)。Ballongueら(82)は、9 wkにわたるラクチトール処理により、バクテロイデス、クロストリジウム、大腸菌群、およびユーバクテリウムの細菌集団が減少したことを示した。ラクチトールはまた、糞便pHの低下を引き起こす(82)。ラットでは、ラクチトールは粘膜炎症の兆候なしに酪酸の産生とIgAの分泌を増加させる(83)。高齢者では、ラクトバチルス・アシドフィルスNCFMと組み合わせたシンバイオティクスとしてのラクチトールの摂取は、いくつかの腸内マイクロバイオータマーカーおよび粘膜機能を改善する(84)。さらに、L. acidophilus NCFMおよびラクチトールのシンバイオティクス産物は、Blautia coccoides-Eubacterium rectale細菌群およびClostridium cluster XIVab数の豊富さを減少させる(85)。Finneyら(86)による別の研究では、甘味料として消費された低用量のラクチトール(10g)が有益に糞便微生物叢に影響を与え、ビフィズス菌を増加させ、揮発性のプロピオン酸および酪酸の濃度を増加させ、不耐症の重篤な症状を引き起こすことなく、プレバイオティクスであることが示された(86)。これらのデータは、ラクチトールが腸内細菌叢を強化するためのプレバイオティクスとして有用であり、非可変性であり、マイルドな甘さであることを示唆している。多くの人にとって、ラクチュロースや他の甘味料と比較して、ラクチトールの低甘味度は、ラクチュロースなどの他のものと比較して、ラクチトールサプリメントの利点である(80)。
マルチトール
マルチトール(E965)は、デンプンを加水分解、還元、水素化して得られる甘味度約90%の甘味料である。マルチトールは砂糖の風味に最も似ていて、非糖原性で、糖尿病患者にも安全である。マルチトールはショ糖に似た溶解度と吸湿性を持ち、無糖ラベル付きチョコレートの製造に使用するのに好ましい砂糖である(5, 87)。マルチトールは大腸で発酵するため、消化速度が非常に遅い。そのため、腸内微生物によって発酵させることが期待されている。ヒトを対象とした研究では、ボランティア40名を対象に、22.8gのマルチトール、マルチトール+ポリデキストロース、またはマルチトール+耐性デンプンを含む試験用チョコレートを14日間連続して摂取させた。試験用チョコレートの投与量は、6週間の間、2週間ごとに2倍にした。著者らは、菓子甘味料が腸内微生物叢の組成に与える影響を評価し、マルチトール+ポリデキストロースの最適用量34.2gでは、スクロースの摂取と比較して、マルチトール摂取後に糞便性ビフィズス菌、乳酸菌、SCFAsの数が有意に増加した(88)。しかし、現在までのところ、マルチトールの腸内細菌叢に対する特異的な効果を決定するのに十分なデータはない。
ソルビトール
ソルビトール(E-420)は、d-グルシトールとしても知られている異性体ポリオールであり、その生産は、グルコースの触媒的水素化とその後の精製に基づいている。ソルビトールは、リンゴ、梨、桃、アプリコット、および一部の野菜に自然に含まれている(65)。健康な人では、10gのソルビトールを摂取した後に71%が吸収不良を示し、20%が胃腸症状を呈していた(89)。また、IBS患者はポリオール、特にソルビトールとマンニトールに対して有害な胃腸反応を示す(各分子の吸収パターンとは無関係)。ソルビトールはIBS患者にとって懸念されることがあるが、高用量で摂取した場合の下剤効果の報告があるが、健康な人にとっては安全であると思われる(5, 90)。ほとんどの健康な人は、ソルビトール10g/日を服用しても、鼓腸や膨満感などの軽度の胃腸の不快感があるだけである。しかし、1日20gのソルビトールの用量は、腹痛や下痢などのより苦痛な症状を引き起こす可能性がある(66, 91)。ソルビトールは通常、消化管内でより大きな浸透圧負荷を及ぼし、結腸内の水分濃度の上昇をもたらし、その結果、より大きな下剤効果をもたらすため、ソルビトールはラクチトールよりも忍容性が低い(92,93)。しかし、現在までのところ、ソルビトールの腸内細菌叢への影響を決定的に決定するのに十分なデータはない。
マンニトール
マンニトール(E-421)はソルビトールの異性体で、グルコースを水素化して精製して得られる。マンニトールはソルビトールに比べて甘みは少ないが、代謝率(薬物代謝物濃度と親薬物濃度の比を範囲で表したもの)が約75%と高く、残りの25%は吸収されて尿中に排泄されるため、食品にも使用されている。事実上不活性(薬物の有効成分と反応しない)であり,清涼感のある甘味を与えることから,食品産業のほか,歯科衛生用品,薬剤充填剤,点滴中の利尿剤としても広く利用されている(5, 17, 31, 94, 95)。私たちの知る限りでは、マンニトールの腸内細菌叢への影響に関するデータはない。
キシリトール
キシリトール(E-967)は、d-キシロースを水素化して得られる5つの炭素を持つポリオールで、果物、ベリー類、野菜、オーツ麦、キノコ類などに自然に含まれているが、人体でもごく一部が生成されている。キシリトールは、無糖キャンディーやチューインガムの他にも、様々な医薬品に広く利用されている。キシリトールは1891年に最初に合成されたもので、ショ糖と同じくらい甘い(5, 66)。
マウスの腸内細菌叢の組成および脂質代謝に及ぼす、40および200mgのキシリトール-kg体重-1〜d-1の摂取の効果が報告されている。キシリトールは、中用量の食餌性キシリトールを用いて高脂肪食を与えたマウスにおいて、糞便性バクテロイデテスおよびバーネシエラの豊富さを減少させ、フィルミキュートスおよびプレボテラの豊富さを増加させた(49)。キシリトールはマウスの腸内細菌叢を修飾することができるので、田村ら(96)の研究では,0.05%イソフラボンと5%キシリトールの食事、または0.05%イソフラボンのみの食事を対照として与えた後のマウスの糞便微生物叢を比較した。バクテロイデスの濃度は、キシリトールを多く含む食事よりも対照の食事の方が高かった(96)。さらに、キシリトールの摂取は、齧歯類の糞便マイクロバイオーム集団をグラム陰性菌からグラム陽性菌へとシフトさせた。ヒトのボランティアでは、キシリトールを30gの単回経口投与すると、同様のシフトが起こる(97)。キシリトールを含む可溶性低消化性炭水化物の酪酸産生への影響およびこれらの物質のプレバイオティクスの可能性は、試験管内試験ヒト糞便培養物を用いて評価されている(98)。Clostridium difficile感染症のハムスターにおける腸粘膜の形態的変化と腸内細菌の転座との相関関係は、乳酸菌(プロバイオティクス)とキシリトール(プレバイオティクス)の組み合わせがC. difficile感染症に対する保護効果を持っていたことを示している(99)。
結論として、エリスリトール、ソルビトール、マンニトールなどのポリオールの中には、腸内細菌叢の組成に影響を与えないものもあるが、ポリオールの適度な投与は、健康な人の腸内細菌叢のシフトを誘発する可能性がある。炎症性腸疾患の患者がポリオールを摂取する際には、ポリオールの下剤効果を考慮する必要がある。ポリオールの効果を表3に示す。さらに、図3は、ポリオールの腸内マイクロバイオームへの影響をまとめたものである。
表3 ポリオールの腸内細菌叢への影響1
| 甘味料と研究(参考) | ソース | 発酵画分 | モデル | 用量試験済み | 微生物分析の方法 | 主な成果 | 有害な影響 | 変化の大きさ |
|---|---|---|---|---|---|---|---|---|
| エリスリトール(E-968) | ワイン、ビール、キノコ、梨、ブドウ、醤油 | 10%が結腸に到達 | — | — | — | — | — | — |
| Arrigoni etal。(71) | — | — | 試験管内で | NA | 糞便中のpH、総ガス、H 2、およびSCFAの生成 | エリスリトールは完全に非発酵性です | 観察されなかった | 変更なし |
| イソマルト(E-953) | 風船ガム、ゼラチン、チョコレート、コーティング、焼き菓子、ヨーグルト | 90%が結腸に到達 | — | — | — | — | — | — |
| Gostner etal。(75) | — | — | 人間による治験 | 30gイソマルト | 16S / 23S rRNA | ビフィズス菌の個体数の増加、細菌のβ-グルコシダーゼおよび糞便のSCFAの減少 | 観察されなかった | 0.2〜0.3ログセル/ g糞便 |
| ラクチトール(E-966) | 乳糖の水素化によって得られる天然に存在しない糖アルコール | β-ガラクトシダーゼが不足しているため、小腸に吸収されない | — | — | — | — | — | — |
| Patil etal 。(78) | — | — | RCT | 10,30,60,および100ミリモルのラクチトール/日; 70〜130 g / d | ガラクトース含有量(ガラクトースデヒドロゲナーゼ) | それが発酵している下腸に到達する | 観察されなかった | 40gのラクチトール/日は十分に許容される |
| Ballongue etal。(82) | — | — | RCT | 20gラクチトール/日 | 寒天培地で測定された微生物学 | ラクチトールは、バクテロイデス、クロストリジウム、大腸菌群、およびユーバクテリウムの個体数を減少させた。糞便pHの低下 | 観察されなかった | バクテロイデス、クロストリジウム、大腸菌群、およびユーバクテリウムは、1.5,1.2,1,および1.9log単位減少した。 |
| 耳介等。(81) | — | — | 試験管内で | 2 g / L、24時間 | 蛍光i天然甘味料ituハイブリダイゼーション | ネコの糞便培養における腸内細菌科の個体数を2g / Lで減少させ、ネコの腸内細菌叢にプレバイオティクス効果を発揮する。 | 観察されなかった | ウェルシュ菌:+1.6ログセル/ g; 腸内細菌科–0.3ログセル/ g |
| Peuranen etal。(83) | — | — | ラット | 2%(wt:wt) | フローサイトメトリーと16SrRNAシーケンス | 粘膜の炎症の兆候なしに酪酸の産生とIgA分泌を増加させる | 観察されなかった | 酪酸:22.2%IgA:996%(ラクチトール+ポリデキストロース) |
| Ouwehand etal。(84) | — | — | RCT | 5〜5.5 g | フローサイトメトリーと16SrRNAシーケンス | ラクトバチルスアシドフィルスNCFMと組み合わせたシンバイオティックとしてのラクチトールは、腸内細菌叢のいくつかのマーカーを改善する可能性がある | 観察されなかった | シンバイオティック:7.8×10 9 CFU / g; プラセボ:3.8×10 9 CFU / g |
| Björklund他 (85) | — | — | RCT | 2×10 10 L.アシドフィルスおよび10gのラクチトール | qPCR(グアニンとシトシンの割合) | L.アシドフィルスNCFMとラクチトールはBlautiacoccoidesとEubacteriumrectale細菌群のレベルを低下させる | 観察されなかった | B.のcoccoides:1.83×10 10 1.34×へ10 10。E.はrectale 1.19×10 10 7.34×10 9 |
| Finney etal。(86) | — | — | RCT | ショ糖:ラクチトール10g(比率:10:0,5:5,0:10) | 寒天培地で測定された微生物学 | 10 gのラクチトールは、糞便微生物叢に有益な影響を及ぼし、ビフィズス菌とプロピオン酸および酪酸の濃度を増加させる可能性がある | 観察されなかった | 10gのラクチトールが9.37から10.06に増加ビフィズス菌logCFU |
| マルチトール(E-965) | でんぷんの加水分解、還元、水素化により得られる | — | — | — | — | — | — | — |
| Beards etal。(88) | — | — | RCT | 22.8 g | 16SrRNAシーケンシング | マルチトール治療後、糞便中のビフィズス菌の数が有意に増加した | 観察されなかった | 0.8ログセル/ g糞便 |
| ソルビトール(E-420) | ブドウ糖の接触水素化とその後の精製によって得られ、リンゴ、ナシ、モモ、アプリコット、および一部の野菜に自然に含まれている | — | — | — | — | — | — | — |
| 八尾他 (90) | — | — | — | — | — | IBD患者におけるソルビトールに対する胃腸の有害反応 | 観察されなかった | — |
| マンニトール(E-421) | マンニトールはブドウ糖の水素化と精製から得られる | ソルビトールと同様の吸収率 | — | — | — | 腸内細菌叢への影響なし | 観察されなかった | — |
| キシリトール(E-967) | 果物、果実、野菜、オート麦、キノコ。わずかな割合が人体によっても生成される | — | — | — | — | — | — | — |
| 上番荘ほか (49) | — | — | マウス | 40および200mgキシリトール・kg体重-1・d -1 | 16SrRNAシーケンシング | 糞便中のバクテロイデス門とバルネシエラ属の存在量を減らし、フィルミクテス門とプレボテラ属を増やした | 観察されなかった | 194 mgキシリトール・kg -1・d -1が減少 |
| 田村ほか (96) | — | — | マウス | 28日間の5%キシリトール食 | PCR増幅に基づくT-RFLP分析によって検出 | バクテロイデスの濃度は、キシリトールが豊富な食事よりも対照の食事の方が高かった。 | 観察されなかった | 50% |
| Naaber etal。(99) | — | — | マウス | シンバイオティック:ラクトバチルスラムノサスとキシリトール(1 mLの20%溶液) | 拡散法と血液寒天培地 | L.ラムノサスとキシリトールの治療はマウスモデルのクロストリジウム・ディフィシルに対していくつかの効果があった | 観察されなかった | 転座効果 |
1IBD、炎症性腸疾患、NA、利用不可、RCT、無作為化臨床試験、rRNA、リボソームRNA、T-RFLP、末端制限断片長多型。
図3 腸内細菌叢の組成に及ぼすポリオールの影響
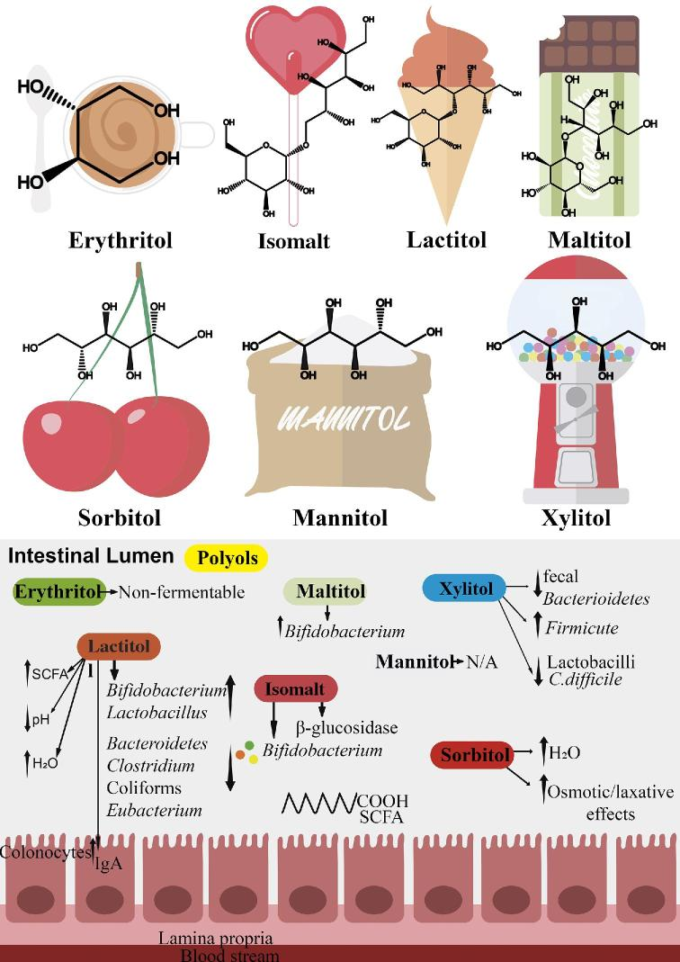
エリスリトール、ソルビトール、マンニトールは腸内マイクロバイオータの組成に影響を与えないが、ラクチトール、イソマルト、キシリトール、マルチトールは腸内マイクロバイオームの変化を引き起こし、健康な人のビフィズス菌数を増加させる。炎症性腸疾患の患者がポリオールを摂取する際には、ポリオールの下剤効果を考慮する必要がある。C. difficile、Clostridium difficile; N/A、利用できない。
ヒト試験における腸内細菌叢に対する甘味料の効果
甘味料は、多くの食品プロセスで使用されており、これらの化合物の種類の消費の影響は、健康状態と微生物の組成に影響を与える。今日では、特定の甘味料によって媒介される腸内マイクロバイオームの潜在的な修飾は、健康な成人または子供の懸念事項である。しかし、臨床研究はほとんどない。
2014年にスエズら(15)による研究は、無作為に選択された172人の個人に収集されたデータから、いくつかの甘味料[特に非カロリー人工甘味料(NAS)]の投与後に腸内細菌叢の修飾を示した。彼らは、NASの消費とEnterobacteriaceaeファミリー、Deltaproteobacteriaクラス、およびActinobacteria属との間の正の相関関係を発見した。さらに、普段NASやNAS含有食品を摂取していない健康なボランティア7名を1週間追跡調査した。その週に、ボランティアはサッカリンの最大ADI(5mg/kg)を摂取した。1〜4日目の個々のグリセミック応答と比較して、NAS群のボランティアは、5日目および7日目に減少したグリセミック応答を示した(15)。その差の大きさは30%以上であった。これらの知見は、NASの摂取、特に最大用量のサッカリンが、腸内細菌叢の変化を介して耐糖能に悪影響を及ぼす可能性を示唆している。対照群、抗生物質の使用、および使用された糞便移植のために、Suezらの研究に関しては、現在科学分野で論争が起きている(100)。それにもかかわらず、この研究からの単純なメッセージは、肥満や糖尿病のリスクを食い止めるために意図された代替食糖は、これらの疾患のリスクを増加させる可能性があるということである。
別の研究では、31人の成人が4日間の食事記録を完成させ、5日目に糞便サンプルを提供した。彼らの腸内細菌叢は、パイロシーケンシングによって分析された。豊富なプロファイルは、甘味料の消費、特にアスパルテームとは関連していなかった。しかし、全体的な細菌の多様性は、甘味料の消費者と非消費者の両方にまたがって変化した(23)。
結論
肥満およびその代謝性合併症の有病率の増加についての懸念の高まりは、単純な糖類の消費量を減らし、非栄養性甘味料および低カロリー甘味料の摂取量を増加させることにつながっている。このように、砂糖の代替品として登場する甘味料は、FDA、EFSA、およびCodex Alimentariusによって批判的に評価されており、安全でよく忍容されていると考えられている。
しかし、いくつかの長期的な前向き研究では、人工甘味料の消費は、実際に肥満、2型糖尿病、および心血管疾患(101)につながる代謝異常の開発に貢献するかもしれないという懸念を提起している。さらに、食欲、短期的な摂取量、および癌や糖尿病のリスクに対する非栄養性甘味料の効果に関連する証拠のギャップがある(2)。腸内細菌叢に対する甘味料の効果は完全に解明されていない。
非栄養性甘味料の中では、サッカリンとスクラロースのみが腸内微生物叢の集団をシフトさせている。動物とヒトによるサッカリンの摂取は、ヒトのグルコース耐性と生物学的異常にリンクされた代謝経路の変化を示した。しかし、より多くの人間の研究は、これらの予備的な観察を明らかにするために必要とされている。
栄養性甘味料の中では、ステビア抽出物のみが腸内細菌叢の組成に影響を与える可能性がある。
最後に、ポリオールは、それらが大腸に到達すると、特に炎症性腸疾患を有する患者において、用量依存性の鼓腸を誘発することができる。イソマルトおよびマルチトールを含むいくつかのポリオールは、健康な被験者においてビフィズス菌の数を増加させ、これらのポリオールはプレバイオティクス作用を有する可能性がある。一方、異なるヒト臨床試験では、ラクチトールはバクテロイデス菌、クロストリジウム菌、大腸菌、およびユーバクテリウム菌の個体数を減少させることが示された。さらに、ラクチトールは、粘膜炎症の兆候なしに酪酸およびIgA分泌の産生を増加させ、共生効果を示す。キシリトールは、糞中のBacteroidetesとBarnesiella属の豊富さを減少させ、FirmicutesとPrevotella属を増加させ、マウスのC. difficileに影響を与える。
さらなる研究は、動物の腸内細菌叢で観察された変化が人間に存在するかどうかを解明し、エビデンスがこれまで利用できない甘味料の効果を研究するために必要とされている。この点では、非栄養性甘味料と低カロリー甘味料の両方が腸内細菌叢に与える潜在的な影響を評価し、それらが主要な転帰や慢性疾患に関連するリスクバイオマーカーにどのように影響するかを評価するために、適切な用量と適切な被験者サイズで、十分に設計された長期的な二重盲検、プラセボ対照、無作為化臨床試験を実施する必要性が実際にある。
