Effects of intensive lifestyle changes on the progression of mild cognitive impairment or early dementia due to Alzheimer’s disease: a randomized, controlled clinical trial
https://pubmed.ncbi.nlm.nih.gov/38849944

オンライン公開 2024年6月7日
PMCID: PMC11157928
PMID:38849944
要旨
背景
アルツハイマー病(AD)と生活習慣との関連は明らかである。われわれは、集中的な生活習慣の改善がADによる軽度認知障害(MCI)または早期痴呆の進行に有益な影響を及ぼすかどうかを検討した、最初のランダム化比較臨床試験を報告する。
方法
45~90歳のMCIまたはADによる早期認知症で、MoCA(Montreal Cognitive Assessment)スコアが18点以上の患者を対象とした1:1の多施設共同無作為化比較第2相試験。主要評価項目は認知機能検査と機能検査の変化であった:臨床的全般的変化印象(CGIC)、アルツハイマー病評価尺度(ADAS-Cog)、臨床的認知症評価(CDR-SB)、臨床的認知症評価全体(CDR-G)の変化であった。ADAS-Cog、CDR-SB、CDR-Globalの尺度はMann-Whitney-Wilcoxon順位和検定を用いて比較し、CGICはFisherの正確検定を用いて比較した。副次的アウトカムには、血漿Aβ42/40比、その他のバイオマーカー、ライフスタイルとこれらの指標の変化度との相関などが含まれた。
結果
AD患者51人が登録、平均年齢73.5歳。ベースライン時のどの指標にも有意差はなかった。脱落者は2名のみであった。全患者のベースライン時の血漿中Aβ42/40比は0.0672未満であり、ADの診断を強く支持するものであった。20週後、CGICテスト(p= 0.001)、CDR-SBテスト(p= 0.032)、CDR Globalテスト(p= 0.037)で有意な群間差が認められ、ADAS-Cogテスト(p= 0.053)では境界域の有意差が認められた。CGIC、CDR Global、ADAS-Cogは認知機能と機能の改善を示し、CDR-SBは4つの指標すべてで悪化した対照群に比べ、有意に進行が抑制された。Aβ42/40比は介入群で増加し、対照群で減少した(p= 0.003)。生活習慣と認知機能および血漿中Aβ42/40比との間には有意な相関がみられた。マイクロバイオームは介入群でのみ改善した(p<0.0001)。
結論
包括的なライフスタイルの変更は、MCIまたはADによる早期痴呆の多くの患者において、20週間後に認知機能と機能を有意に改善する可能性がある。
試験登録
2017/12/31にWestern Institutional Review Board(#20172897)により承認され、全施設のInstitutional Review Boardにより承認された。本試験は、2020年10月8日にclinicaltrials.govに後方視的に登録された、ID:20172897)。
補足情報
オンライン版には10.1186/s13195-024-01482-zの補足資料が掲載されている。
キーワード アルツハイマー病、食事、栄養、運動、ストレス管理、生活習慣病、社会的支援
AI解説 一般読者向け
この臨床試験は、アルツハイマー病(AD)の初期段階にある患者を対象に、集中的な生活習慣の改善プログラムを20週間行うことで、認知機能や日常生活機能に良い影響があるかどうかを調べたものである。
主な結果と意義は以下の通りである。
- 生活習慣の改善プログラムを受けたグループでは、認知機能と日常生活機能のテスト(ADAS-Cog、CGIC、CDR-SB、CDR-Global)で、全体的に有意な改善が見られた。一方、通常ケアの対照グループでは、これらのテストで悪化が見られた。
- ADAS-Cog:このテストは、記憶力、言語能力、実行機能など、様々な認知機能を評価する。
- 生活習慣改善群では、介入前の平均スコアが21.55点から20週後に20.54点に改善した。
- 通常ケア群では、21.25点から22.16点に悪化した。
- 両群の差は1.92点で、統計的に有意な改善が示された(p=0.053)。
- ADAS-Cogは70点満点で、スコアが低いほど認知機能が良好である。アルツハイマー病の臨床試験では、スコアが2〜4点改善すれば、臨床的に意味のある変化とみなされる。
- CGIC:このテストでは、医師が患者の全体的な認知機能の変化を7段階で評価する。
- 生活習慣改善群では、介入後に24人中10人が「わずかに改善」と評価された。
通常ケア群では、25人中17人が「わずかに悪化」または「中等度悪化」と評価された。 - 両群の変化の差は統計的に有意だった(p=0.001)。
- CGICは7段階評価で、数値が小さいほど改善を示す。介入群で多くの患者が改善と評価されたことは、日常生活での認知機能の向上を反映していると考えられる。
- 生活習慣改善群では、介入後に24人中10人が「わずかに改善」と評価された。
- CDR-SB:このテストでは、記憶、見当識、判断力と問題解決能力、社会活動、家庭生活と趣味、身の回りの世話の6つの領域について、患者の認知機能と日常生活機能を評価する。
- 生活習慣改善群では、介入前の平均スコアが3.27点から20週後に3.35点とわずかに悪化した。
- 通常ケア群では、3.34点から3.86点に悪化した。
- 両群の差は0.44点で、統計的に有意だった(p=0.032)。
- CDR-SBは18点満点で、スコアが低いほど認知機能と日常生活機能が良好である。介入群の悪化が通常ケア群よりも小さかったことは、生活習慣の改善が病気の進行を遅らせる効果があることを示唆している。
- CDR-Global:6つの領域の評価を基に、患者の全体的な認知機能と日常生活機能のレベルを0から3の5段階で評価する。
- 生活習慣改善群では、介入前の平均スコアが0.69点から20週後に0.65点に改善した。
- 通常ケア群では、0.66点から0.74点に悪化した。
- 両群の差は0.12点で、統計的に有意だった(p=0.037)。
CDR-Globalは0〜3点で評価し、スコアが低いほど全体的な認知機能と日常生活機能が良好である。介入群でスコアが改善したことは、生活の質の向上を示していると考えられる。
- ADAS-Cog:このテストは、記憶力、言語能力、実行機能など、様々な認知機能を評価する。
- 生活習慣の改善度合いと、認知機能・日常生活機能の改善度合いには、明確な相関関係が認められた。つまり、生活習慣を改善すればするほど、認知機能と日常生活機能がより良くなったということである。
- 血液バイオマーカー(アミロイドβ42/40比など)や腸内細菌叢にも好ましい変化が見られ、認知機能の改善を裏付ける結果となった。
- 通常ケアの対照グループと比べ、うつ症状の変化に有意差はなかった。つまり、認知機能の改善はうつ症状の改善によるものではないと考えられる。
- ADの進行を止めたり改善したりするには、かなり集中的な生活習慣の改善が必要であることがわかった。過去の失敗した多因子介入試験は、ほどほどの生活習慣の改善であったことに起因するかもしれない。
- 同様の生活習慣改善で、ADの発症予防にもつながる可能性が示唆された。発症予防には、ADを改善するほど集中的な介入は必要ないかもしれない。
- 薬物療法との相乗効果の可能性もあり、今後のさらなる研究が期待される。
この臨床試験で行われた具体的な生活習慣改善プログラムは以下の通りである。
- 食事:植物性の全粒穀物、豆類、種実類、野菜、果物を中心とした食事。飽和脂肪やトランス脂肪、精製炭水化物、甘味料の摂取を控える。
- 運動:1日30分以上の有酸素運動と、週3回以上の軽い筋力トレーニング。
- ストレス管理:1日1時間のストレス管理(瞑想、ヨガ、呼吸法、イメージ療法など)。
- グループサポート:週3回、1時間のグループ支援セッションへの参加。
- サプリメント:オメガ3脂肪酸、ターメリック、マルチビタミン、コエンザイムQ10、ビタミンC、ビタミンB12、マグネシウム、プロバイオティクス。
以上のような結果から、ADの初期段階では、集中的な生活習慣の改善により、認知機能や日常生活機能の改善が期待できると言えそうだ。予防としても有望視されている。ただし、今回は比較的小規模な臨床試験であり、より大規模で長期的な研究が必要とされている。
オーニッシュ博士のアルツハイマー病進行逆転研究からの証言(試験参加者の声)
33,322 回視聴 2024/06/10
生活習慣病治療によるアルツハイマー病患者の認知機能の改善は、実際に人体にどのような影響を与えるのだろうか?
https://nutritionfacts.org/video/can-alzheimers-disease-be-reversed-with-a-plant-based-diet/
背景
ADを含む認知症の発症や進行と生活習慣を関連づける証拠が増えている。不健康な食生活、座りっぱなし、精神的ストレス、社会的孤立などである。
例えば、認知症の予防、介入、ケアに関するLancetの委員会では、12の潜在的に修正可能な危険因子が挙げられており、これらを合わせると、認知症の世界的な負担の40%を占めると推定されている[1]。これらの要因の多く(例えば、高血圧、喫煙、うつ病、2型糖尿病、肥満、運動不足、社会的孤立)は、冠動脈性心疾患や他の慢性疾患の危険因子でもある。慢性炎症、酸化ストレス、インスリン抵抗性、テロメア短縮、交感神経系亢進などがその例である[2] 。最近の研究では、生活習慣と認知機能との関連は、12%程度と推定されるβアミロイドを介した部分もあるが、ほとんどが脳の病理とは無関係であることが報告されている[3]。
シカゴの65歳以上の成人を対象としたある大規模な前向き研究では、野菜を多く食べている人と少ない人ではAD発症リスクが38%低く、オメガ3脂肪酸を週に1回以上摂取している人では60%低かった[4] 。
ADの多因子性病因と異質性から、認知症リスクの低減には、単一領域のものよりも多領域の生活習慣への介入が有効であり、認知症予防には、中程度のものよりも集中的な多領域の生活習慣への介入が有効であることが示唆される[7] 。
例えば、CAIDE(Cardiovascular Risk Factors, Aging, and Incidence of Dementia)の認知症リスクスコアが6点以上で、認知機能が平均値かそれよりやや低い60~77歳の男女を対象としたRCTであるFinnish Geriatric Intervention Study(FINGER)研究では、認知症リスクが高い高齢者において、食事、運動、認知トレーニング、血管リスクモニタリングの多面的介入により、2年後に認知機能が維持された[8] 。24ヵ月後、FINGER介入群の全般的認知機能は、低下した対照群よりも25%高かった。さらに、FINGER介入は、いくつかの人口統計学的および社会経済学的リスク因子[9] やアポリポ蛋白E(APOE)ε4の状態に関係なく等しく有益であった[10] 。
また、FINGER生活習慣介入は、心血管疾患イベント(脳卒中、一過性脳虚血発作、冠動脈疾患)の発生率を13~20%減少させ、「心臓に良いことは脳に良い」(逆もまた然りである)ことを示すより多くの証拠を提供した[11] 。この介入が認知症予防に役立つかどうかを判断するための他の大規模な多領域介入研究が、米国でのPOINTER研究を含むWorld-Wide FINGERSネットワークの一部として、世界60カ国以上で実施または計画されている[12,13]。
最近では、同様の認知症予防を目的としたRCTにより、認知症やADのリスクがある(しかし診断されていない)人において、2年間の個別化された多領域介入を行うことで、認知機能や認知症リスク因子が緩やかに改善することが示された[14]。
これらの研究はすべて、生活習慣の改善が認知症の予防に役立つことを示している。今回報告する研究は、集中的な生活習慣の改善が、すでに軽度認知障害(MCI)と診断された人、あるいはADによる早期認知症に有益かどうかを検証した最初のランダム化比較臨床試験である。
先に行われた2つのRCTでは、本稿で述べたような多方面からの生活習慣への介入によって、冠動脈の動脈硬化が定量的冠動脈造影[15] や心室機能[16] によって退縮し、心臓PET検査によって心筋灌流が改善し、5年後の心イベントが2.5倍減少し、そのすべてが統計学的に有意であった[17] 。それまでは、冠動脈性心疾患の進行は遅らせることができるだけで、止めたり元に戻したりすることはできないと考えられていた。
ADと冠動脈性心疾患は多くの同じ危険因子と生物学的機序を共有しており、また、適度な複合的生活様式の変化がADの予防に役立つ可能性があることから[18] 、冠動脈性心疾患や他の慢性疾患の進行をしばしば逆転させることが証明されている、より集中的な複合的介入は、ADによるMCIや早期痴呆の進行にも有益な影響を及ぼす可能性があるという仮説を立てた。
ADによるMCIまたは早期痴呆の進行を、20週間後の包括的で多方面からの集中的な生活習慣介入によって、通常ケアの無作為化対照群と比較して、遅らせることができるか、止めることができるか、あるいはおそらく逆転させることができるかどうかを検討する無作為化対照試験の結果をここに報告する。この生活習慣介入には、(1)有害な脂肪が少なく、精製された炭水化物や甘味料が少ない、全食品、最小限の加工を施した植物ベースの食事、(2)適度な運動、(3)ストレス管理法、(4)サポートグループが含まれる。
この集中的な多方面からの生活習慣改善RCTは、以下の疑問を解決することを目的としたものである:
- ADAS-Cog(AD評価尺度-認知サブスケール)、CGIC(臨床的全般的変化印象)、CDR-SB(Clinical Dementia Rating Sum of Boxes)、CDR-G(Clinical Dementia Rating Global)検査で測定されるADによるMCIまたは早期認知症の進行に、特定の多方面からの集中的な生活習慣の変化が有益な影響を及ぼすことができるか。
- ライフスタイルの変化の程度と、これらの認知・機能測定の変化の程度との間に有意な相関関係はあるか?
- ライフスタイルの変化の程度と、選択したバイオマーカー(例えば、血漿Aβ42/40比)の変化の程度との間に有意な相関があるか?
方法
参加者と方法
本試験は、最初の20週間を1:1の多施設RCTとし、これらの結果をここに報告する。臨床試験の組み入れ基準を満たした患者は、2018年9月から2022年6月の間に登録された。
以下の参加基準を満たす参加者が登録された:
- 45歳から90歳までの男女
- MoCAのスコアが18点以上(米国国立老化研究所-アルツハイマー病協会McKhann and Albert 2011年基準)で、ADの進行によるMCIまたは早期認知症と診断されている[19,20] 。
- 医師はこの診断を患者と共有し、この臨床試験への参加を承認した。
- 介入のすべての側面に参加する意欲と能力
- 配偶者または介護者が付随情報を提供し、試験のアドヒアランスを支援できること
以下のいずれかに該当する患者は除外された:
- 中等度または重度の認知症
- 定期的な運動ができない身体障害
- 神経変性または痴呆の他の主原因を示す証拠、例えば、重大な脳血管障害(痴呆の主原因が血管性)、レビー小体病、パーキンソン病、FTD。
- 精神医学または薬物乱用に関する重大な継続的問題
これらの組み入れ基準を満たしたMCIまたはADによる早期認知症の参加者51人が2018年9月から2022年6月の間に登録され、ベースライン検査を受けた。登録された参加者のうち26人が、20週間多様態生活習慣介入を受ける介入群に無作為に割り付けられ、25人が、20週間生活習慣を変えないよう求められ、その後に介入を受ける通常の習慣とケアの対照群に無作為に割り付けられた。両群の患者は神経内科医による標準治療を受けた。
介入群は20週間生活習慣プログラムを受けた(当初は対面で、COVID-19のため2020年3月以降は同期Zoomで)。この間、ライフスタイルの変更を継続したくない参加者2名が離脱したが、いずれも介入群であった(男性1名、女性1名)。両群の参加者は20週目に追跡調査を受け、臨床評価と認知機能評価を受けた。データはベースラインと20週目の評価を群間で比較して分析された。
医薬品の臨床試験では、ランダム化対照群の参加者から治験新薬へのアクセスを制限することができる。しかし、われわれはこの生活習慣介入に関する他の疾患での先行臨床試験で、通常ケアの対照群に無作為に割り付けられた参加者に20週間以上生活習慣の変更を控えるよう説得するのはしばしば困難であることを学んだ。もし両群の参加者が同じような生活習慣の変更を行ったとすれば、群間の差を示すことはできない。そこで、対照群に無作為に割り付けられた参加者が、最初の20週間は生活習慣を変えないようにするため、通常ケアの対照群に割り付けられた後、20週間は同じ生活習慣プログラムを無料で提供することを提案し、20週間後にテストを行った。
我々は当初、20週後の認知機能における群間差の可能性を検出する検出力計算に基づいて、100人の患者をこの試験に登録する予定であった。しかし、患者のリクルート、特にCOVID-19の緊急事態と多くの製薬会社の臨床試験が同様の基準で患者のリクルートを開始したため、患者の登録に当初の計画より時間がかかった[21] 。このため、51人の患者が登録された時点で募集を打ち切った。この決定は、当時のデータを見直すことなく、採用の問題と限られた資金のみに基づいて行われた。
患者の募集は、広告、神経学会での発表、神経内科医やその他の医師からの多様なグループからの紹介、UCSFの患者に関するオンラインデータベースの検索から行った。われわれは多様な患者のリクルートに特に重点を置いたが、その成果は期待したほどではなかった(表(Table11))。
表1 カテゴリカル・ベースライン値
| ベースライン値 | |||||
|---|---|---|---|---|---|
| コントロール | 介入 | ||||
| 特徴 | n | パーセント | N | パーセント | p値 |
| セックス | |||||
| 男性 | 13 | 42.9 | 19 | 73.1 | 0.153 |
| 女性 | 12 | 48 | 7 | 26.9 | |
| 配偶者の有無 | |||||
| 既婚 | 21 | 84 | 18 | 69.2 | 0.504 |
| シングル | 3 | 12 | 7 | 26.9 | |
| 未亡人 | 1 | 4 | 1 | 3.85 | |
| 生活状況
学習パートナーと同居 |
22 | 88 | 20 | 76.9 | 0.465 |
| 一人暮らし | 3 | 12 | 6 | 23.1 | |
| 認知機能テスト | |||||
| CGIC: | 0.26 | ||||
| 2 – 病気のボーダーライン | 5 | 20 | 8 | 33.3 | |
| 3 – 軽症 | 11 | 44 | 9 | 37.5 | |
| 4 – 中等度 | 7 | 28 | 3 | 12.5 | |
| 5 – 著しく体調不良 | 1 | 4 | 4 | 16.7 | |
| 6 – 重症 | 1 | 4 | 0 | 0 | |
| CDRグローバル | |||||
| 0.5 | 17 | 68 | 15 | 62.5 | 0.769 |
| 1 | 8 | 32 | 9 | 37.5 | |
| 人種: | |||||
| アフリカ系アメリカ人 | 1 | 4 | 1 | 3.85 | 1 |
| アジア | 0 | 0 | 1 | 3.85 | |
| ヒスパニック | 1 | 4 | 1 | 3.85 | |
| 白人 | 23 | 92 | 23 | 88.46 | |
| APOε ステータス | |||||
| 2/3 | 1 | 4 | 0 | 0 | 1 |
| 2/4 | 0 | 0 | 0 | 0 | |
| 3/3 | 9 | 36 | 10 | 38.5 | |
| 3/4 | 11 | 44 | 11 | 42.3 | |
| 4/4 | 4 | 16 | 5 | 19.2 | |
監督
本臨床試験は、2017/12/31にWestern Institutional Review Boardにより承認され(承認番号:20172897)、すべての参加者とその試験パートナーが書面によるインフォームドコンセントを提供した。また、本臨床試験プロトコールは、すべての参加施設の適切な施設審査委員会により承認され、すべての被験者がインフォームドコンセントを提供した。COVID-19の緊急事態のため、予定されていたMRI検査とアミロイドPET検査は実行不可能となり、認知機能検査の数は減少した。ADによる軽度から中等度の認知症(McKhann et al., 2011)と診断されていること」という当初の組み入れ基準は、MoCAスコアが18点以上であることを含むようにさらに明確化された。本試験は、管理上の過誤により、2020年10月8日にclinicaltrials.govに遡及登録された、ユニークプロトコルID:20172897)。本研究に資金を提供したスポンサーはいずれも、本研究のデザイン、実施、管理、結果の報告に参加していない。生活習慣介入を提供する者は、検査を実施する者、データを収集・分析する者とは別であり、群割り付けを盲検化した。すべての著者が原稿の修正に貢献し、重要なコメントを提供し、出版への投稿を承認した。
プロトコールのいかなる変更も、上級生物統計学者(Charles McCulloch PhD)または上級神経心理学者(Dorene Rentz PsyD)が事前に文書で承認し、その後WIRBが承認した。
セッティング
患者は当初、2018年10月からサンフランシスコ湾岸地域からのみ募集され、COVID-19の流行が始まる2020年2月まで直接会った。その後、このマルチモーダルなライフスタイル介入は、Zoomを介してリアルタイムで患者に自宅で提供された。
この介入を仮想的に行うことで、マサチューセッツ総合病院/ハーバード大学医学部(マサチューセッツ州ボストン)、カリフォルニア大学サンディエゴ校、レナウン地域医療センター(ネバダ州リノ)を含む複数の施設から患者を募集し、またサンフランシスコ・ベイエリアの神経科医とも協力する機会を得た。これらの参加者は各施設で募集され、現地でテストされた。介入はZoomを介して行われ、食品は直接自宅に送られた。
患者募集
これは補足資料のセクションに記載されている。
集中的な複合的ライフスタイル介入
各患者は、他の慢性疾患に対するこの生活習慣病の介入について書かれた本を受け取った。[2]
ダイエット
複雑な炭水化物(主に果物、野菜、全粒穀物、豆類、大豆製品、種子、ナッツ類)を多く含み、有害な脂肪、甘味料、精製された炭水化物を特に少なくした、全食品を最小限に加工した植物性(ビーガン)の食事。カロリーの約14~18%が総脂肪、16~18%がタンパク質、63~68%が複合炭水化物である。カロリーは無制限だった。カロリーの必要量が多い人には、特別な分量が与えられた。
仮説を適切に検証するために必要な高いアドヒアランスと標準化を保証するために、この介入の40週間を通じて、各試験参加者とその配偶者または試験パートナーに、21食/週の食事とスナック、および以下に示す毎日のサプリメントが無料で提供された。週2回、各患者とその配偶者または研究パートナーに、栄養ガイドラインを満たす1日3食の食事と2回の間食、および処方された栄養補助食品を夜間発送した。
参加者には、私たちが送った食品と栄養補助食品のみを摂取してもらい、他の食品は摂取しないようにお願いした。食事と生活習慣の介入に対するアドヒアランスが高ければ、どのようなアウトカムを測定しても興味深いものになると考えたからである。すなわち、もし介入群の患者がアドヒアランスは高いが、有意な利益は得られなかったとすれば、それは残念なことではあるが、重要な所見である。改善がみられれば、それも重要な所見である。しかし、もし患者が生活習慣介入を十分に行わなかったとすれば、仮説の検証は十分にできなかったことになる。
エクササイズ
有酸素運動(例:ウォーキング)を少なくとも30分/日、軽度の筋力トレーニングを少なくとも週3回、運動生理学者が直接、またはバーチャルセッションで指導した。患者には年齢とフィットネスレベルに基づいた個別の運動処方が与えられた。すべてのセッションは正看護師が監督した。
ストレス管理
瞑想、ヨガに基づく穏やかなポーズ、ストレッチ、漸進的リラクゼーション、呼吸法、イメージ法などを、公認のストレス管理専門家の指導のもと、1日合計1時間行った。各技法の目的は、患者のリラックス感、集中力、意識を高めることであった。また、オンライン瞑想へのアクセスも許可された。患者には、瞑想と不眠症の補助として、シータ周波数7.83Hzの閃光メガネと癒しの音楽を使用するオプションがあった[22] 。また、十分な睡眠をとることも勧められた。
グループサポート
参加者とその配偶者/研究パートナーは、1セッション1時間、週3日、支援的で安全な環境で、精神保健の免許を持つ専門家が監督する支援グループに参加し、感情的支援と共同体、コミュニケーション技能、プログラムの遵守を維持するための戦略を高めた。また、グループセッション中に定期的に使用される記憶の練習が書かれた本も配布された[23] 。
この生活習慣への介入を強化するために、各患者とその配偶者または研究パートナーは、Zoom:2を介して週3回、1セッションあたり4時間面談した。
- 1時間の指導付きエクササイズ(有酸素運動+筋力トレーニング)
- 1時間のストレス対処法(ストレッチ、呼吸法、瞑想、イメージ法)
- サポートグループ1時間
- ライフスタイルに関する1時間の講義
さらに、オプションでエクササイズやストレスマネジメントのクラスも用意された。
サプリメント
- オメガ3脂肪酸とクルクミン(1680mgのオメガ3と800mgのクルクミン、Nordic Naturals ProOmega CRP、4カプセル/日)。オメガ3脂肪酸:65歳以上の高齢者では、オメガ3脂肪酸を週1回以上摂取している人はAD発症リスクが60%低く、n-3系多価不飽和脂肪酸の総摂取量はアルツハイマー病リスクの低下と関連していた[24]。クルクミンは、(直接的に)アミロイド凝集だけでなく、炎症経路や抗酸化経路も標的とする[25] が、生物学的利用能や血液脳関門を通過することに問題があるかもしれない[26] 。
- マルチビタミン・ミネラル(Solgar VM-75、鉄抜き、1錠/日)。組み合わせ製剤は、認知能力の改善とADに伴う行動障害の改善を示している[27] 。
- コエンザイムQ10(200mg、Nordic Naturals社、ソフトジェル2個/日)。CoQ10。ADにおけるミトコンドリアの障害を軽減する可能性がある[28]。
- ビタミンC(1グラム、Solgar社、1錠/日):健康的なビタミンC濃度を維持することは、加齢に伴う認知機能の低下やADに対する保護機能を有する可能性がある[29]。
- ビタミンB12(500 mcg、Solgar社、1錠/日):B12低ビタミン血症は、AD病理の発症に関連している[30] 。
- L-スレオニン酸マグネシウム(Mg)(144mg、マグテイン、2錠/日)。メタアナリシスによると、Mg欠乏はADの危険因子である可能性があり、Mgの補充はADの補助的治療になる可能性がある[31]。
- Hericium erinaceus(ライオンのたてがみ、Stamets Host Defense、2グラム/日):ライオンのたてがみは、50歳以上の健常人[32] およびMCI患者において、プラセボ[33] と比較して認知機能と認知機能に有意な改善をもたらす可能性がある。
- スーパービフィドプラス・プロバイオティクス(フローラ、1錠/日)。メタアナリシスは、プロバイオティクスがAD患者に有益である可能性を示唆している。
主要アウトカム評価項目:認知機能検査
これらの患者の認知と機能の変化を評価するために、4つのテストが用いられた。これらは、多くのFDA薬物試験に含まれる認知と機能の標準的な測定法である:ADAS-Cog;臨床的全般的変化印象(CGIC);臨床的認知症評価(CDR-SB);臨床的認知症評価全体(CDR Global)。すべての認知機能評価者は、臨床試験でこれらのテストを実施した経験を持つ訓練された心理測定者であった。観察者間のばらつきを少なくするために、各訪問時に同じ人が認知機能検査を実施するように努めた。ADAS-Cog評価を行う者は、認定された評価者であり、患者を直接テストした。CGICとCDR検査は、ADAS-cogとは別の評価者によって、Zoomを介して全患者に実施された。また、評価者は可能な限り治療群を盲検化した。
副次的評価項目:バイオマーカーとマイクロバイオーム
これらは補足資料のセクションに記載されている。これらには血液ベースのバイオマーカー(血漿Aβ42/40比など)やマイクロバイオーム分類群(生物)が含まれる。
統計的手法
これらは補足資料のセクションに記載されている。
結果
本試験の募集活動は2018/01/23から2022/6/16まで行われた。最も効果的な募集方法は、被験者の主治医または医療提供者からの紹介であった。その他の募集活動としては、印刷物やデジタルメディアへの広告掲載、地域団体への講演、ポッドキャストやラジオインタビューでの本研究への言及、認知症の診断や治療を行う研究機関との連携、臨床試験募集サービス(Linea)との契約などがあった。合計1585人から連絡があり、このうち1300人が組み入れ基準を満たさず、102人が参加を辞退し、132人が登録終了時にスクリーニングが不完全であったため、51人が登録された(図11)。
図1 CONSORTフローチャート:患者、人口統計、登録
残りの51人の患者は、20週間生活習慣の介入を受ける介入群(26人)と、生活習慣を変えないように指示された通常ケアの対照群(25人)に無作為に割り付けられた。介入群の2人の患者は、食事療法と生活様式の変更を継続したくないという理由で、介入中に離脱した。対照群では20週目の試験前に離脱した患者はいなかった。残りの49人の患者について解析が行われた。追跡不能になった患者はいなかった。
これら49人の患者の血漿中Aβ42/40比はすべて0.089未満(すべて0.0672未満)であり、アルツハイマー病の診断を強く支持するものであった[35]。
ベースライン時、介入群と無作為化対照群との間には、人口統計学的特徴、認知機能測定、バイオマーカーなど、どの指標においても統計学的に有意な差はなかった(表(Table1)、表(Table22))。
表2 数値ベースライン値
| ベースライン値 | |||||
|---|---|---|---|---|---|
| コントロール | 介入 | ||||
| 特徴 | 平均 | 標準偏差 | 平均 | 標準偏差 | p値 |
| 年齢、平均、年 | 75 | 7.1 | 72 | 8.5 | 0.25 |
| 教育レベルの平均、ISCE | 6.52 | 1.5 | 6.58 | 1 | 0.724 |
| 認知機能テスト | |||||
| ADASコグ | 21.25 | 6.46 | 21.44 | 5.92 | 0.886 |
| CDR-SB | 3.34 | 1.84 | 3.27 | 1.73 | 0.925 |
| ベースラインバイオマーカー | |||||
| 血漿Aβ42/40比 | 0.048 | 0.0098 | 0.047 | 0.0089 | 0.83 |
| リン酸化Tau181 | 45.32 | 16.34 | 43.57 | 14.22 | 0.959 |
| インスリン | 9.5 | 9.85 | 8.68 | 5.79 | 0.834 |
| HgbA1C | 5.47 | 0.38 | 5.38 | 0.37 | 0.856 |
| LDLコレステロール | 1.91 | 0.34 | 1.93 | 0.51 | 0.443 |
| Cペプチド | 2005.27 | 1661.32 | 1907.38 | 866.23 | 0.814 |
| 糖タンパク質のアセチル化(GlycA) | 0.843 | 0.092 | 0.891 | 0.117 | 0.097 |
| グリア線維酸性タンパク質 | 250.27 | 104.89 | 229.68 | 93.72 | 0.48 |
| C反応性蛋白(CRP) | 2.02 | 2.2 | 2 | 3.05 | 0.894 |
認知機能検査:一次分析
全患者を対象とした多方面からの集中的な生活習慣介入を20週間行った結果、介入群と無作為化対照群との認知・機能に関する全体的な統計学的有意差は、CGIC検査(p= 0.001)、CDR-SB検査(p= 0.032)、CDR Global検査(p= 0.037)で認められ、ADAS-Cog検査(p= 0.053、表3)では境界的有意差が認められた3)。これらの測定のうち3つ(CGIC、CDR Global、ADAS-Cog)は介入群で認知と機能の改善を示し、対照群では悪化を示した。また、1つの検査(CDR-SB)は、これら4つの測定すべてで悪化した無作為化対照群と比較して、有意に進行が少なかった。
表3 認知機能検査結果
| 0週間 | 20週間 | 20週間の変化 | |||||
|---|---|---|---|---|---|---|---|
| 認知機能テスト | コントロール | 介入 | コントロール | 介入 | コントロール | 介入 | p値 |
| ADASコグ | 21.25 | 21.55 | 22.16 | 20.54 | 0.91 | -1.01 | 0.053 |
| CDR-SB | 3.34 | 3.27 | 3.86 | 3.35 | 0.52 | 0.08 | 0.032 |
| CDR-グローバル | 0.66 | 0.69 | 0.74 | 0.65 | 0.08 | -0.04 | 0.037 |
| CGICベースライン | |||||||
| 2 – 病気のボーダーライン | 5 | 8 | |||||
| 3 – 軽症 | 11 | 9 | |||||
| 4 – 中等度 | 7 | 3 | |||||
| 5 – 著しく体調不良 | 1 | 4 | |||||
| 6 – 重症 | 1 | 0 | |||||
| CGICの変更 | 0.001 | ||||||
| 3 – 最小改善 | 0 | 10 | |||||
| 4 – 変更なし | 8 | 7 | |||||
| 5 – 悪化の度合い | 14 | 7 | |||||
| 6 – モッド悪化 | 3 | 0 | |||||
プライマリー・アナリシス(外れ値を含む)、表33:
1. CGIC(臨床的変化印象)
これらのスコアは介入群で改善し、対照群で悪化した。
(フィッシャーの正確なp値=0.001)。介入群では10人が改善を示したが、対照群では皆無であった。介入群では7人、対照群では8人が不変であった。介入群では7人が軽度の悪化を示し、対照群では14人であった。中等度の悪化を示した人は介入群にはいなかったが、対照群には3人いた。
2.CDR-グローバル(臨床的認知症評価-グローバル)
これらのスコアは介入群で改善し(0.69から0.65)、無作為化対照群で悪化した(0.66から0.74)、平均差=0.12、p=0.037であった(表(Table)33、図(Fig.22))。
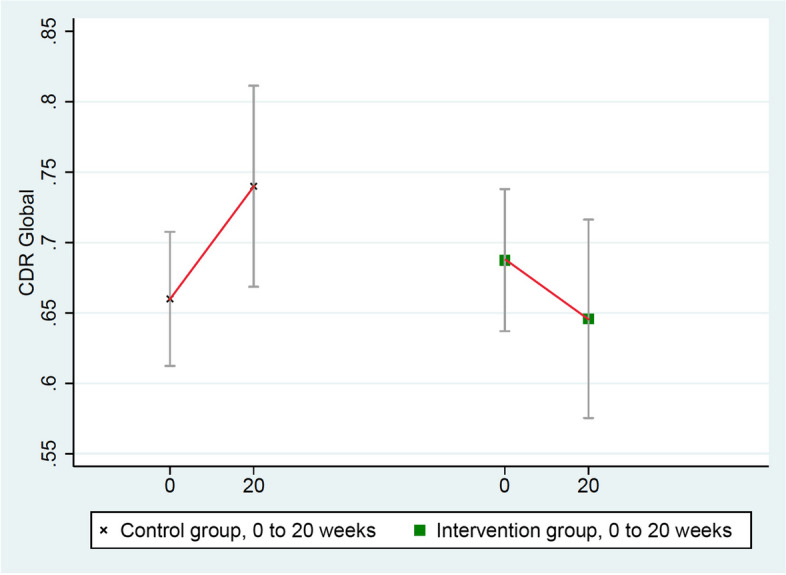
図2 CDR-Globalの変化(低い=改善した)
3.ADAS-Cog(アルツハイマー病評価尺度)
このスコアは介入群で改善し(21.551点から20.536点へ)、無作為化対照群で悪化した(21.252点から22.160点へ)、変化の平均群間差=1.923点、p=0.053であった(表(Table33)および図(Fig.Fig.3)3)。(介入群1例のADAS-Cog検査は適切に実施されなかったため除外した)。
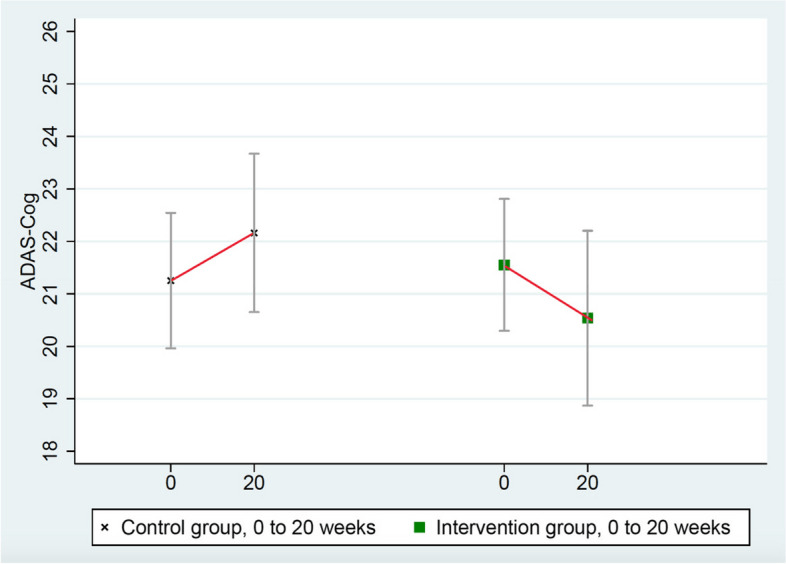
図3 ADAS-Cogの変化(低い=改善した)
4.CDR-SB(臨床的認知症評価Sum of Boxes)
これらのスコアは、介入群(3.27から3.35)よりも対照群(3.34から3.86)の方が有意に悪化し、平均群間差=0.44、p=0.032であった(表(Table33)および図(Fig.Fig.44))。
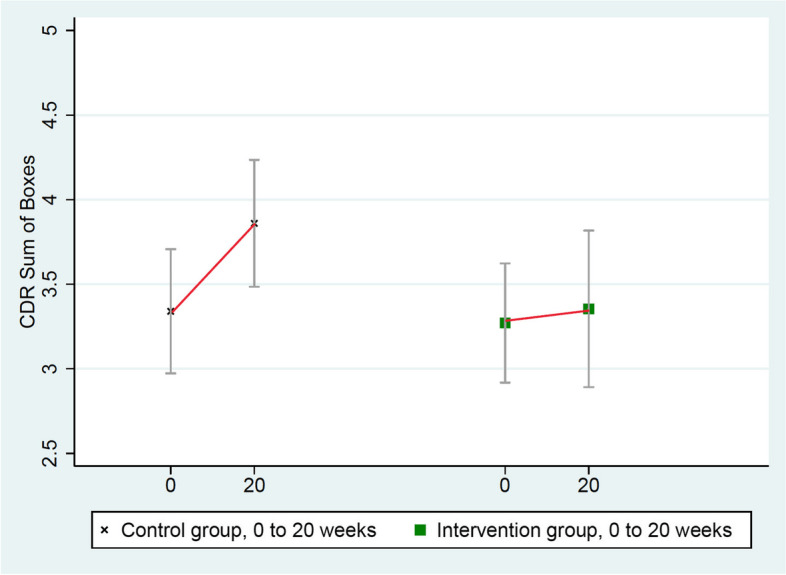
図4 CDR-SBの変化(低い=改善した)
PHQ-9で測定したうつ病スコアには、介入群と対照群で有意差はなかった。
二次感度分析
介入群の1人の患者は、標準的な数学的定義に基づく認知機能検査で明らかな統計的外れ値であった(対照群では外れ値はなかった)[36]。したがって、この患者のデータは二次感度分析で除外された。これらの結果は、認知と機能に関するこれら4つの尺度すべてにおいて統計的に有意な差を示した(表(Table4).4)。3つの指標(ADAS-Cog、CGIC、CDR Global)は、これらの4つの指標すべてで悪化した無作為化対照群と比較して、認知と機能の有意な改善を示し、1つの指標(CDR-SB)は、有意に悪化が少なかった。
表4 認知機能データと感度分析(異常値を除く):
| 0週間 | 20週間 | 20週間の変化 | |||||
|---|---|---|---|---|---|---|---|
| 認知機能テスト | コントロール | 介入 | コントロール | 介入 | コントロール | 介入 | p値 |
| ADASコグ | 21.25 | 21.62 | 22.16 | 20.03 | 0.91 | -1.59 | 0.028 |
| CDR-SB | 3.34 | 3.22 | 3.86 | 3.33 | 0.52 | 0.11 | 0.046 |
| CDR-グローバル | 0.66 | 0.67 | 0.74 | 0.63 | 0.08 | -0.04 | 0.037 |
| CGI-ds | |||||||
| 2 – 病気のボーダーライン | 5 | 8 | |||||
| 3 – 軽症 | 11 | 8 | |||||
| 4 – 中等度 | 7 | 3 | |||||
| 5 – 著しく体調不良 | 1 | 4 | |||||
| 6 – 重症 | 1 | 0 | |||||
| CGI-c | 0.001 | ||||||
| 3 – 最小限の改善 | 0 | 10 | |||||
| 4 – 変更なし | 8 | 6 | |||||
| 5 – 最小限の悪化 | 14 | 7 | |||||
| 6 – 中程度の悪化 | 3 | 0 | |||||
感度分析(異常値を除く)
PHQ-9で測定されたうつ病スコアには、いずれの分析においても介入群と対照群で有意差はなかった。
この患者が統計的に外れ値であった可能性がある理由は、検査前に強い状況的ストレスを報告したことである。2つ目の感度分析として、この同じ外れ値患者を落ち着いた時に再検査したところ、4つの指標(ADAS-Cog、CGIC、CDR Global、CDR-SB)すべてで認知と機能の有意な改善がみられたのに対し、無作為対照群ではこれら4つの指標すべてで悪化した。
バイオマーカーの結果
ADの病態生理における役割が知られているバイオマーカーを選択した(表(Table5)5)。注目すべきは、血漿中のAβ42/40比が介入群では増加したが、ランダム化対照群では減少したことである(p= 0.003、両側)。
表5 バイオマーカーの結果
| 0週間 | 20週間 | 20週間の変化 | |||||
|---|---|---|---|---|---|---|---|
| バイオマーカー | コントロール | 介入 | コントロール | 介入 | コントロール | 介入 | p値 |
| 血漿AB42/40比 | 0.048 | 0.047 | 0.044 | 0.049 | -0.004 | 0.003 | 0.003 |
| リン酸化タウ181 (pTau181) | 45.32 | 43.57 | 50.72 | 43.74 | 5.40 | 0.17 | 0.209 |
| インスリン | 9.50 | 8.68 | 8.21 | 6.77 | -1.30 | -1.92 | 0.048 |
| β-ヒドロキシ酪酸(ケトン類) | 0.11 | 0.09 | 0.06 | 0.11 | -0.05 | 0.02 | 0.021 |
| LDLコレステロール | 1.91 | 1.93 | 1.95 | 1.32 | 0.04 | -0.61 | <0.001 |
| グリア線維酸性タンパク質(GFAP) | 250.27 | 229.68 | 282.69 | 232.85 | 32.42 | 3.16 | 0.199 |
| C反応性蛋白(CRP) | 2.02 | 2.00 | 1.75 | 0.95 | -0.27 | -1.05 | 0.373 |
| 血清アミロイドA(SAA) | 6.42 | 5.79 | 6.30 | 4.14 | -0.12 | -1.65 | 0.074 |
| 糖タンパク質のアセチル化(GlycA) | 0.843 | 0.891 | 0.83 | 0.81 | -0.01 | -0.08 | 0.005 |
| テロメアの長さ | 0.774 | 0.799 | 0.776 | 0.814 | 0.002 | 0.015 | 0.287 |
生活習慣指数と認知機能の相関
今回の臨床試験では、自己申告データという固有の限界があるにもかかわらず、生活習慣の変化の程度(ベースラインから20週まで)と認知・機能に関する4つの指標のうち3つの指標の変化の程度との間に統計学的に有意な相関が認められただけでなく、20週時点の望ましい生活習慣の変化のアドヒアランスと認知・機能に関する4つの指標のうち2つの指標の変化の程度との間に相関が認められ、4つ目の指標では境界線上の有意性が認められた。
ADAS-コグ
20週目の生活習慣との相関:p= 0.052、相関あり:0.241
生活習慣の変化度との相関:p= 0.015、相関あり:0.317
CDR-SB
20週目の生活習慣との相関:p= 0.043、相関あり:0.251
生活習慣の変化度との相関:p= 0.081、相関あり:0.205
CDR-グローバル
20週目の生活習慣との相関:p= 0.065、相関あり:0.221
生活習慣の変化度との相関:p= 0.024、相関あり:0.286
CGIC
20週時点のライフスタイルとの相関:p=0.002
ライフスタイルの変化度との相関:p= 0.0005
(CGIC検定はノンパラメトリック分析であるため、標準的な効果量の計算はこの指標には含まれていない)。
また、食事の総脂肪摂取量とCGIC測定値の変化との間に有意な相関が認められたが(p= 0.001)、他の3つの測定値では有意ではなかった。
ライフスタイル指数とバイオマーカーデータの相関性
今回の臨床試験では、自己申告データという固有の限界があるにもかかわらず、生活習慣の変化の程度(ベースラインから20週まで)と多くの主要バイオマーカーの変化の程度との間に統計学的に有意な相関が認められ、また20週時点の生活習慣の変化の程度とこれらのバイオマーカーの変化の程度との間にも相関が認められた:
血漿Aβ42/40比
20週目の生活習慣との相関:p= 0.035、相関あり:0.306
生活習慣の変化度との相関:p= 0.068、相関あり:0.266
グリクA
20週目の生活習慣との相関:p= 0.011、相関あり:0.363
生活習慣の変化度との相関:p= 0.007、相関あり:0.383
LDL-コレステロール
20週目の生活習慣との相関:p<0.0001;相関あり:0.678
生活習慣の変化度との相関:p<0.0001;相関あり:0.628
β-ヒドロキシ酪酸(ケトン類)
20週目の生活習慣との相関:p= 0.013、相関あり:0.372
生活習慣の変化度との相関:p= 0.034、相関あり:0.320
pTau 181
20週目の生活習慣との相関:p=0.228、相関あり:0.177
ライフスタイルの変化度との相関:p=0.135、相関あり:0.219
GFAP/グリア線維酸性タンパク質
20週目の生活習慣との相関:p= 0.096、相関あり:0.243
ライフスタイルの変化度との相関:p=0.351、相関あり:0.138
どの程度の生活習慣の変化が認知機能検査の改善と相関するのか?
ADによるMCIや早期認知症の悪化を阻止または改善するためには、どの程度の生活習慣が必要なのだろうか?言い換えれば、両群で生活習慣介入を何%遵守すれば、MCIまたは認知症に変化がないことと相関したのだろうか?この程度以上の生活習慣の変化は、MCIまたは認知症の改善と関連していた。
ADAS-コグ
20週時点のライフスタイルとの相関:71.4%のアドヒアランス
CDR-SB
20週時点のライフスタイルとの相関:アドヒアランス120.6
CDR-グローバル:
20週目のライフスタイルとの相関:95.6%
マイクロバイオームの結果
介入群ではマイクロバイオーム構成に有意かつ有益な変化が見られたが、対照群では見られなかった。
介入群でのみ増加したいくつかの分類群(微生物群)は、他の研究でADリスクの減少に関与した分類群と一致していた。例えば、介入群で介入中に増加したBlautiaは、以前にADのリスク低下と関連しており、これはγ-アミノ酪酸(GABA)産生の増加に関与している可能性がある[37] 。Eubacteriumも介入群で介入中に増加し、先行研究ではEubacterium属(すなわちEubacterium fissicatena)がADの保護因子であることが同定されている[38] 。
また、介入群ではADリスクの上昇に関与する分類群、例えばプレボテラ属(Prevotella)やツリシバクター属(Turicibacter)の相対存在量が減少した。Prevotellaと Turicibacterは以前、疾患の進行とともに増加することが示されており[39] 、これらの分類群は介入期間中に減少した。
これらの結果は、生活習慣への介入はマイクロバイオームにおける特定の微生物群を有益に変化させ、ADのリスクを低下させる微生物群を増加させ、ADのリスクを増加させる微生物群を減少させるという仮説を支持するものである。(より詳細な情報は補足を参照のこと)。
考察
われわれは、20週間後にMCIまたはADによる早期痴呆の多くの患者において、集中的な多方面からの生活習慣介入が、認知と機能を有意に改善し、生物学的特徴を和らげる可能性があることを示した最初の無作為化対照試験を報告する。
20週間の多方面からの集中的な生活習慣介入後、全患者を対象とした一次解析の結果、介入群と無作為化対照群との間には、CGIC(p= 0.001)、CDR-SB(p= 0.032)、CDR Global(p=0.037)検査で測定される認知機能と機能において全体的に統計学的に有意な差が認められ、ADAS-Cog検査(p= 0.053)では境界有意差が認められた。
これらの指標のうち3つ(CGIC、CDR Global、ADAS-Cog)は、介入群では認知と機能の改善を示し、無作為化対照群では悪化を示した。
数学的異常値を除外した二次感度分析では、これらの差はさらに明確であった。これらの結果は、認知と機能に関する4つの指標すべてにおいて、群間で統計的に有意な差を示した。これらの指標のうち3つは認知と機能の改善を示し、1つ(CDR-SB)は4つの指標すべてで悪化した無作為化対照群と比較して悪化が少なかった。
認知と機能におけるこれらの変化の妥当性、および改善の生物学的メカニズムの可能性は、無作為化対照群と比較して20週間後に有益な方向で統計的に有意な差を示した、臨床的に関連するいくつかのバイオマーカーの観察された変化によって支持される。
臨床的に最も重要なバイオマーカーのひとつは血漿中のAβ42/40比であり、20週間後に介入群で6.4%増加、無作為化対照群で8.3%減少し、この差は統計的に有意であった(p= 0.003、両側)。
lecanemab試験では、アミロイドが脳から血漿に移動したことを反映していると推定されるAβ42/40バイオマーカーの血漿中濃度が、18ヵ月にわたって介入群で上昇した[40] 。我々は、このライフスタイル介入による血漿中のAβ42/40比の変化の方向性において同様の結果を得たが、わずか20週間であった。逆に、このバイオマーカーは対照群で減少しており(lecanemab試験と同様)、これはアミロイドの脳内取り込みの増加を示しているのかもしれない。
臨床的に関連する他のバイオマーカーも、無作為化対照群と比較した場合、20週後に有益な方向で統計学的に有意な差(両側)を示した。ヘモグロビンA1c、インスリン、糖タンパク質アセチル(GlycA)、LDL-コレステロール、β-ヒドロキシ酪酸(ケトン体)などである。
これらのバイオマーカーが改善することで、認知機能や機能の改善が観察されたことの生物学的な妥当性が増し、改善の可能性のあるメカニズムについての洞察が深まる。この情報は、集中的な生活習慣の改善によって認知機能や機能の改善を示しやすい患者を予測するのにも役立つであろう。
その他の関連バイオマーカーは、20週後、無作為化対照群と比較して介入群で有益な変化方向であった。これらにはpTau181、GFAP、CRP、SAA、C-ペプチドが含まれる。テロメア長は介入群で増加し、対照群では実質的に変化しなかった。GFAPやpTau181のように群間で桁違いの差がある場合や、CRPのように4倍近い差がある場合でも、これらの差は統計的に有意ではなかったが、これらの変化は有益な方向であった。少なくとも部分的には、これらの所見は、サンプルサイズが比較的小さかったこと、および/または期間が20週間と短かったことによるのかもしれない。
両群における生活習慣の変化の程度(「生活習慣指数」)と、これらのバイオマーカーの多くの変化の程度との間には、統計的に有意な用量反応相関が認められた。この相関は、ベースラインから20週までの生活習慣の変化の程度と、20週で測定した生活習慣の両方に見られた。これらの相関は、これらの所見の生物学的妥当性を高めるものでもある。
また、両群における生活習慣の変化の程度(「生活習慣指数」)と、認知・機能検査のほとんどの指標における変化との間には、統計的に有意な用量反応相関が認められた。要するに、AD患者が生活習慣を所定の方法で変えれば変えるほど、認知や機能に対する有益な影響は大きかったのである。これらの相関関係もまた、これらの所見の生物学的妥当性を高めている。このようなアドヒアランスのばらつきは、介入群で改善した患者とそうでない患者がいた理由の一端を説明するのに役立つ。これらの統計的に有意な相関は、自己報告データのばらつきが大きいこと、サンプルサイズが比較的小さいこと、介入期間が短いことを考慮すると、特に意味のあることである。
これらの所見は、同じ生活習慣介入と同じ生活習慣指標を用いた以前の臨床試験と一致しており、この生活習慣指標(すなわち、生活習慣の変化の程度)と冠動脈性心疾患における冠動脈硬化の程度(狭窄径パーセント)の変化、[41,45]前立腺がん男性におけるPSA値とLNCaP細胞増殖の変化、[42]テロメア長の変化[43]との間に有意な用量反応相関が認められた。
また、有益と思われるマイクロバイオームのいくつかの分類群(微生物群)において、介入群と対照群との間に有意差があることもわかった。
PHQ-9で測定されたうつ病スコアには介入群と対照群で有意差はみられなかった。したがって、うつ病の軽減が介入群にみられた認知機能と機能全般の改善を説明するとは考えにくい。
また、これらの患者でMCIの進行を止めるには、ライフスタイルを大幅に変える必要があることもわかった。一次解析では、ADAS-Cogで71.4%、CDR-Globalで95.6%、CDR-SBで120.6%であった。言い換えれば、これらの患者の認知機能と機能を停止または改善するためには、広範なライフスタイルの変更が必要であった。このことは、あまり集中的でない生活習慣介入を行った他の研究が、認知機能の悪化を食い止めたり、認知機能を改善するのに十分でなかった理由を説明するのに役立つ。
例えば、これらの結果をMIND-AD臨床試験の結果と比較すると、両試験の生物学的妥当性がより高まる[44] 。すなわち、より中等度の多種多様な生活習慣の変化は、MCIまたは早期ADによる早期認知症における認知および機能の悪化の速度を遅らせる可能性があり、一方、より集中的な多種多様な生活習慣の変化は、両臨床試験においてランダム化された通常ケアの対照群と比較した場合、認知および機能の多くの指標において全体的に平均的な改善をもたらす可能性がある。
生活習慣の改善は、薬物療法を受けている患者にさらなる効果をもたらすかもしれない。抗アミロイド抗体は、進行を遅らせるというささやかな効果を示しているが、高価で、有害事象の可能性があり、まだ広く普及しておらず、全体的な認知機能の改善にはつながらない[40] 。 おそらく、両方を行うことで相乗効果が得られるかもしれない。
制限事項
この研究にはいくつかの限界がある。われわれの研究で登録され無作為化された患者は51名のみであり、このうち2名(いずれも介入群)は試験中に離脱した。サンプル数が比較的少なかったにもかかわらず、認知・機能に関するさまざまな検査やその他の指標で統計的に有意な差が認められたことは、生活習慣への介入が特に有効であり、強い内的妥当性があることを示唆している。
しかし、標本数が少ないため、一般化には限界がある。特に、この標本では人種や民族の多様性が、われわれが達成しようと努力したよりもはるかに少なかったからである。また、私たちは、これらの尺度が相対的に鈍感であるにもかかわらず、これらの差異を測定したため、II型過誤の可能性が高まったかもしれない。
評価者は被験者の群割り付けについて盲検化されていた。しかし、二重盲検プラセボ対照薬物試験とは異なり、生活習慣介入では被験者が介入を受けているかどうかを盲検化することは不可能である。このことは結果測定に影響を与えたかもしれないが、肯定的な期待を減らすため、また事実であったため、患者には試験中、この生活習慣介入が有益かどうかはわからないと告げ、われわれが示したものは何でも有用であろうと述べた。
また、20週間という期間は、MCIやADによる初期の痴呆に介入するには比較的短い期間である。この試験では脳構造の直接的な測定は行わなかったので、ADに関連する脳病理のマーカーに直接的な影響があったかどうかを判断することはできない。しかし、血漿Aβ42/40比のような代用マーカーは、より広く受け入れられてきている。
介入群のすべての患者が改善したわけではない。介入群24例のうち、CGICテストによる改善がみられたのは10例、不変が7例、悪化が7例であった。対照群では、改善例はなく、8例が不変、17例が悪化であった。両群で生活習慣の変化の程度と認知・機能の変化の程度との間に有意な関係がみられたことから、このことは生活習慣介入へのアドヒアランスの違いによって説明できるかもしれない。認知機能や機能が改善した患者とそうでない患者がいる理由を説明するのに役立つ他の因子や機序が、さらなる研究によって明らかになることを期待したい。
認知機能や機能の悪化を食い止めたり改善したりするために必要な生活習慣の変化の程度に関する知見は、慎重に解釈する必要がある。両群のデータが組み合わされたため、この特別な解析のための無作為化試験ではなくなっており、未知の交絡の影響が存在する可能性がある。また、認知機能の変化が改善した群では、介入を遵守する能力が高かったため、生活習慣の指標が高くなった可能性もある。
結論
要約すると、アルツハイマー病による軽度認知障害または初期の痴呆患者では、包括的な生活習慣の変化は、20週間後にいくつかの標準的な指標において認知と機能を改善する可能性がある。対照的に、無作為化対照群の患者では、この間に認知と機能の4つの指標すべてにおいて全体的な悪化がみられた。
これらの知見の妥当性は、血漿バイオマーカーとマイクロバイオームの変化が観察されたこと、生活習慣の変化の程度と認知・機能に関する4つの指標すべての改善の程度との用量反応相関、生活習慣の変化の程度とAβ42/40比の変化の程度との相関、および他のいくつかの関連バイオマーカーの変化が有益な方向であったことによって支持された。
私たちの発見は、ADの予防にもつながる。新しい技術、なかには人工知能の助けを借りて、臨床的に明らかになる何年も前にADの可能性が高いと診断できるものもある。しかし、多くの人は、自分がADになる可能性があるかどうかを知りたがらない。もし、集中的な生活習慣の改善が、MCIやADによる早期認知症の認知機能や機能の改善をもたらすのであれば、このような生活習慣の改善は、MCIやADによる早期認知症の予防にも役立つと考えるのが妥当である。また、ADを予防するためには、ADを治療するよりも、より広範囲な生活習慣の変更を必要としないかもしれない。先に引用した冠動脈性心臓病などの疾患に対する生活習慣の変化の効果に関する他の研究も、この結論を支持している。明らかに、早期AD患者の認知機能と機能改善には、中等度の生活習慣の改善よりも、むしろ集中的な生活習慣の改善が必要であるようである。
これらの知見は、より多様なAD集団のより大きなグループにおいて、この集中的な生活習慣医学的介入の長期的転帰を明らかにするために、より長期間の追跡調査やより大規模な臨床試験を行うこと、また、アドヒアランスの違いだけでなく、なぜある患者が他の患者よりも生活習慣への介入に有益に反応するのか、さらに、これらの生活習慣の改善といくつかの薬物療法との相乗効果の可能性を明らかにすることを支持するものである。
補足情報(抜粋)
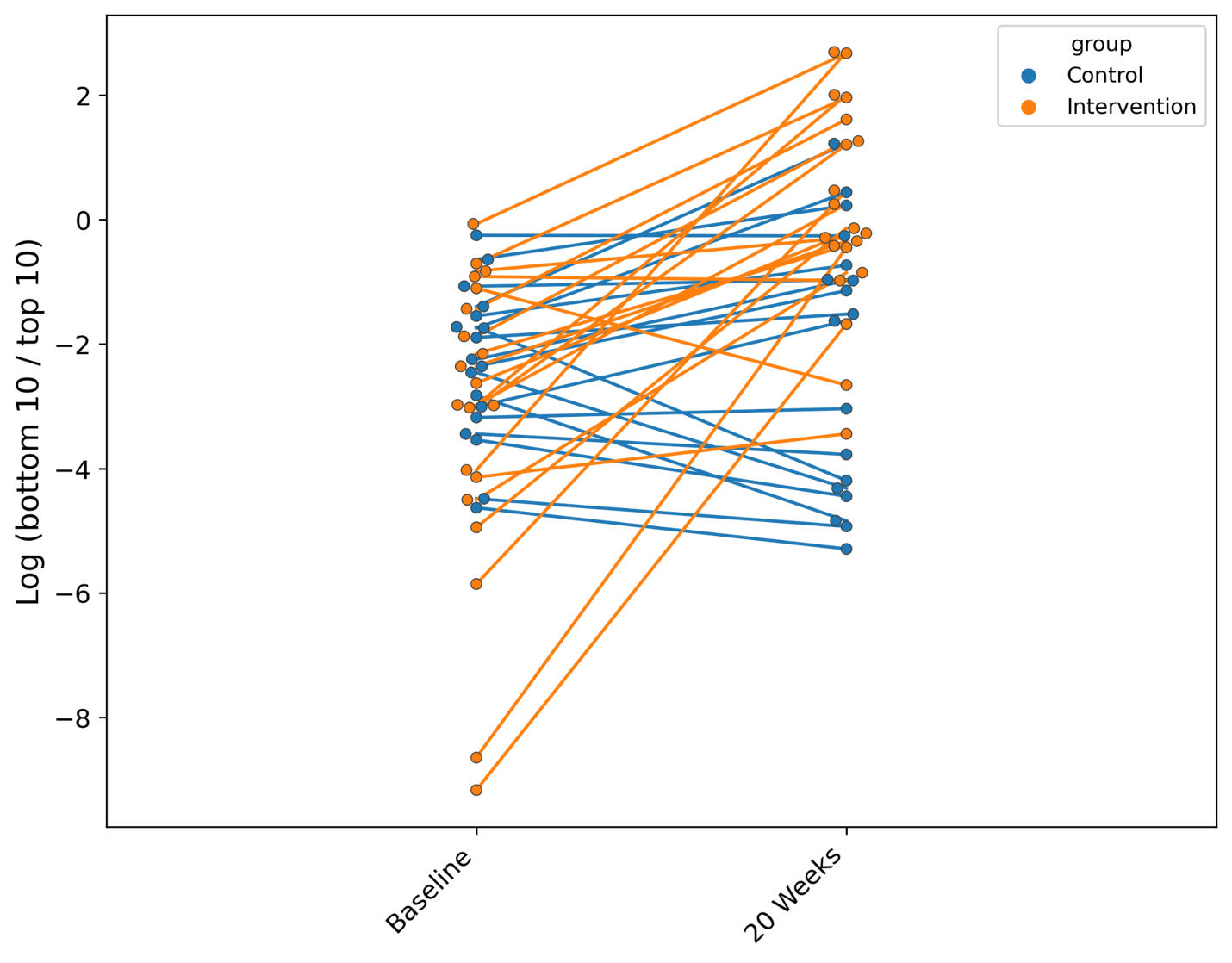
図8:介入群でタイムポイント間に差があると同定されたASVを用い、ベースライン時と20週時で存在量の異なる分類群の対数比を表したプロット。ベースライン時の被験者n=41人、20週時の被験者n=43人は、分子と分母の分類群の合計がゼロではなかった。このことを考慮し、両時点で対数比を持つ被験者のみを対象とした(n=38)。有意性は、関連する標本を仮定した一対のT検定で検定した(対照:t=-0.383、p=0.706、介入:t=-5.88、p=1.17e-5)。これらの結果から、介入は対照群では観察されなかったマイクロバイオームの変化と関連していることが示唆され、さらなる研究の対象となる潜在的な分類群を提示している。
