Contents
Drug repurposing of selective serotonin reuptake inhibitors: Could these drugs help fight COVID-19 and save lives?
pubmed.ncbi.nlm.nih.gov/33992179/
2021年3月19日
ハイライト
- 本研究では、選択的セロトニン再取り込み阻害剤(SSRI)の免疫調節作用、抗炎症作用、抗ウイルス作用の可能性に注目している。
- 免疫系におけるセロトニンまたは5-ヒドロキシトリプタミン(5-HT)の役割について議論している。
- COVID-19に対するSSRIの有効性と安全性に関する利用可能な臨床証拠を評価し、まとめている。
- SSRIとSARS-CoV-2の治療に使用または試験されている薬剤との間の薬物間相互作用について、表形式で簡潔にまとめている。
概要
新興感染症である現在の2019年新型コロナウイルス感染症(COVID-19)は,間違いなく21世紀における最も困難なパンデミックである。2021年1月14日までに、全世界で92,977,768人のCOVID-19の確定症例と1,991,289人の死亡が報告されている。COVID-19は、人々の精神的な健康や生活の質にも影響を与える。現在のところ、本疾患の管理に有効な治療戦略はない。そのため、特定のワクチンや治療法がない中で、COVID-19の罹患率や死亡率を減少させるために、安全で効果的かつ世界的に入手可能な薬剤を特定することが急務となっている。本レビューでは、COVID-19に再利用できる可能性があり、現在臨床試験が行われている選択的セロトニン再取り込み阻害薬(SSRI:広く利用可能で、最適な忍容性プロファイルを持つ抗うつ薬の一種である)に焦点を当てる。また、セロトニン(5-HT)と免疫系との関連性について知られている既存の文献をまとめた。ここで検討された証拠から、我々は、免疫調節、抗炎症、抗ウイルス作用が知られているフルオキセチンをCOVID-19のアジュバント治療薬として提案する。フルオキセチンは、COVID-19患者の炎症性ケモカイン/サイトカインレベル(CCL-2,IL-6,TNF-αなど)を低下させる可能性がある。さらに、フルオキセチンは、COVID-19の神経学的合併症を軽減するのに役立つかもしれない。
図解
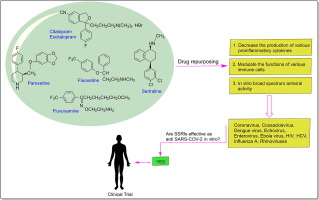
1. はじめに
新型新型コロナウイルス019(COVID-19)は、多臓器・多機能を標的とする可能性のある全身感染症であり、現在、世界的な大パンデミックにつながっていると言われている。COVID-19の死亡率は3.4~5.5%の範囲にあるようで、インフルエンザウイルスによる季節性インフルエンザの死亡率(1%)よりも大幅に高い値となっている[[1]]。記事執筆時(2021年1月14日)人類はCOVID-19の原因物質である重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)と格闘しており、すでに全世界で9,090万人以上が感染し、190万人以上が死亡している[[2]]。この前例のない急速なパンデミックは、不安(パニック障害や心的外傷後ストレス)やうつ病などの深刻な心理的問題を引き起こしている[[3]]。SARS-CoV-2は、構造的には、コロナウイルス科β属に属するエンベロープ型の陽性一本鎖RNA(+ssRNA)ウイルスであり、小エンベロープ(E)糖タンパク質、膜(M)タンパク質、ヌクレオカプシド(N)タンパク質、スパイク(S)糖タンパク質の4つの主要構造タンパク質と、以下の3つの付属タンパク質を持つ。また,ウイルスのポリペプチドを機能的な単位に切断するパパイン様プロテアーゼ(PLpro)と3ケモトリプシン様プロテアーゼ(3CLpro,メインプロテアーゼMproとしても知られる),ウイルスの複製と転写に重要なRNA依存性RNAポリメラーゼ(RdRp)が含まれている[4, 5]。ウイルスは、そのSタンパク質が、程度の差こそあれ、ほぼすべてのヒトの臓器に存在するアンジオテンシン変換酵素II(ACE-2)受容体と結合することで、宿主細胞に侵入する[[6]]。したがって、ACE-2とSARS-CoVのSタンパク質との相互作用を阻害することが、COVID-19を治療するための潜在的な治療ターゲットであることが示唆されている。一般的には、Sタンパク質、PLpro、3CLpro、RdRp、ACE-2がCOVID-19に対する新薬開発のための最も魅力的なターゲットであるとされている[[7]]。COVID-19の臨床的特徴は、無症状または軽度の症状状態(感冒型)から、急性呼吸窮迫症候群(ARDS)敗血症および敗血症性ショック、多臓器不全、そして最終的には死に至るまで様々である。また、SARS-CoV-2の感染は、炎症の亢進と免疫の調節不全を媒介し、CSにつながる。この疾患の管理には、予防と治療の戦略、およびCSの治療が含まれる。CSとは、ウイルス感染に対する宿主の免疫反応が誇張されたり異常になったりすることで、COVID-19ではARDSの主な原因の一つと考えられている。ARDSは、重度の肺水腫、呼吸不全、酸素療法に抵抗性の動脈性低酸素症を引き起こす、生命を脅かす可能性のある疾患である[8, 9]。COVID-19の重症度は、免疫力と、インターロイキン(IL)-2,IL-6,IL-7,IL-1β、腫瘍壊死因子-α(TNF-α)単球化学吸引性タンパク質-1(MCP1; CCL2[CC-chemokine ligand 2])マクロファージ炎症性タンパク質-1α(MIP-1α、CCL3)フェリチン、C反応性タンパク質(CRP)D-ダイマーなどが挙げられる[[10]]。例えば、Del Valleら[[11]]は、発症時の血清IL-6とTNF-αの高値が、疾患の重症度と生存率の強い予測因子であることを発見した。彼らはまた、COVID-19患者の管理と治療において、血清IL-6とTNF-αレベルを考慮し、プロスペクティブな臨床試験を層別化し、資源配分を導き、治療法の選択肢を知らせるべきであると提案した。COVID-19の危機は、世界の公衆衛生にとって深刻な脅威となっており、効果的で安価な治療戦略は、この危機を克服するための重要な手段となるであろう[[12]]。残念ながら、現在まで、この伝染病の予防(prophylaxis)や治療のための有効なワクチンや薬剤は確立されていない。RdRp阻害剤である広域抗ウイルス剤のレムデシビルは、COVID-19の治療のためにヒトの臨床試験が進んだものの、ほとんどの患者にはまだ利用できない[[13]]。このような状況から、より早く、より安価な方法として、薬剤の再利用(他の病気の治療に使用された既存の薬剤の有効性を調べること)は、効果的な治療法を見つけるための基本的な目標となっている。これに関連して、複数の適応外薬や治験薬が、前臨床または臨床データの肯定的な結果により、大きな注目を集めている[[14]]。
最近、Attademoら[[15]]は、COVID-19感染症の病態生理にセロトニンとドーパミンの合成経路の変化が関与している可能性を報告した。これらの神経伝達物質が関与している可能性は、ACE-2とDOPAデカルボキシラーゼ(ドーパミンとセロトニン合成経路の主要酵素で、L-3,4-ジヒドロキシフェニルアラニンからドーパミン、L-5-ヒドロキシトリプトファンからセロトニンの生合成を触媒する)との間に有意な関連性があることから示唆されている。同グループは、SARS-CoV-2によるACE-2の発現不全がDOPAデカルボキシラーゼの機能不全と並行して起こる可能性があり、その結果、COVID-19患者の神経伝達物質のレベルが変化する可能性があると主張している。
しかし、この仮説を検証するには、さらなる実験的研究が必要である。また、COVID-19患者では、精神的ストレスにより5-HTレベルが変化している可能性もあると考えられる。今回の研究では、COVID-19の治療法としての選択的セロトニン再取り込み阻害剤(SSRI)の有効性に関する最新の文献を要領よくレビューすることを目的としている。
2. 免疫系におけるセロトニン(5-HT)の役割
セロトニン(5-Hydroxytryptamine (5-HT)または3-(2-Aminoethyl)-1H-indol-5-ol)は、体内の幸せホルモンとしてよく知られており、うつ病患者では5-HTのレベルが低いことが指摘されている[[16]]。また、松果体でメラトニンの前駆体となる。さらに、中枢神経系の神経伝達物質(化学伝達物質)である5-HTは、免疫系を含む末梢組織において極めて重要な役割を果たしている。血小板は、末梢のセロトニン(体内の全セロトニンの95%近く)を様々な組織に運び、免疫細胞にとっての5-HTの主要な供給源となっている[[17]]。5-HT受容体(5-HT1から5-HT7の7クラス)は、単球/マクロファージ、樹状細胞、好中球、マスト細胞、好酸球、B細胞、T細胞を含む様々なヒトとネズミの免疫細胞に発現している[18, 19]。このように、5-HTと5-HT調節剤は、自然免疫と適応免疫の両方の機能に直接影響を与える可能性がある[[20]]。実際、5-HTは、炎症性サイトカイン/ケモカイン産生の調節、抗炎症性サイトカイン産生の誘導、ナチュラルキラー細胞(またはNK細胞)の活性化、免疫細胞の移動と動員、ヒト単球の活性化と単球のアポトーシスの防止、酸化ストレスの害からの細胞の保護に関与している[21, 22, 23, 24]。生理的濃度の5-HTは、マウスのマクロファージの貪食を減少させ[25, 26]、ヒトの血液中の白血球によるTNF-αとIFN-γの産生を減少させる[27, 28]。5HTはまた、評判の高い抗炎症特性を持つ強力なサイトカインであるIL-10の放出を増加させることによって、ヒト樹状細胞の機能を調節することができる[[29]]。IL-10はまた、TNF-αおよびIL-6のレベルを低下させる[[30]]。IL-6レベルは、炎症の初期段階で著しく上昇することから、臨床において初期のSARS-CoV-2感染を迅速に診断できる証拠となる[[31]]。ヒト肺胞マクロファージでは、セロトニンはIL-12とTNF-αの放出を抑制するが、5-HT2受容体を介してIL-10の産生を増加させる[[32]]。Cadirciら[[33]]は、敗血症の炎症に関する研究で、5-HT7アゴニスト(AS-19)とアンタゴニスト(SB269970)の効果を調査し、5-HT7アゴニストの投与は、血漿中のIL-1βとIL-6を減少させ、さらに肺の核内因子カッパB(NF-κB)レベルを減少させることを示している。NF-κBの活性を阻害することで、細胞の浸潤を抑え、炎症性サイトカインの分泌を減少させ、肺組織を損傷から守ることができる[[34]]。また、最近の研究によると、5-HTは、ヒト単球および末梢血単核によるリポ多糖誘発炎症反応(IL-1β、IL-6,IL-12p40,TNF-α、およびケモカインCXCL8/IL-8放出)を抑制することができる[35, 36, 37]。2017,Ayazら[[38]]は、生体内試験および試験管内試験のリポポリサッカライド誘発炎症モデルにおいて、5-HT7アゴニスト投与による抗炎症作用を示した。2019,Motaら[[39]]は、全身性のリポ多糖誘発の重度の敗血症様炎症時の脳における5-HTの潜在的な役割を調査した。彼らは、全身性の炎症によって視床下部の5-HTレベルが低下し、中枢と末梢の両方で炎症促進状態が高まり、低血圧と低体温に収束することを発見した。さらに、著者らは、外因性に5-HTを投与することで、リポポリサッカライドによる低血圧を防ぎ、最もよく受け入れられている全身性炎症の実験モデルを用いて、全身のTNF-α、IL-1β、IL-6を有意に減少させることができると報告している[[40]]。したがって、これらの研究によれば、セロトニン作動性システムの薬理学的調節は、免疫機能を調節する可能性がある。
3. ウイルス感染における5-HTの役割
特定のウイルス感染症における免疫反応での5-HTの役割が報告されている。ヒト免疫不全ウイルス(HIV)感染は、感染時の5-HTの研究のための主要なモデルである[[18]]。5-HTは、リンパ球におけるHIVの複製を制御し[[41]]、HIV感染者におけるNK細胞の活性化を調節する[[42, 43]]。NK細胞は自然免疫系のリンパ球で、感染症に対する早期かつ効果的な免疫反応に重要な役割を果たしている。また、5-HTは、セロトニン5-HT1A受容体を介して、HIVの侵入に不可欠な共同受容体であるC-Cケモカイン受容体タイプ5(CCR5)の発現をダウンレギュレートすることにより、ヒトマクロファージにおけるHIV感染を減少させ、プロウイルスのDNA合成を減少させる(51%)[[44]]。さらに、特異的な5-HT1B/5-H1型糖尿病受容体アゴニストの存在下で、レオウイルスとチクングニアの感染性が低下することがわかった[45, 46]。また、末梢の5-HTは、その受容体を介して異なるウイルス感染のいくつかのメカニズムを調節することができる。例えば 2018,Szaboら[[47]]は、ヒト単球由来樹状細胞における5-HT2B受容体サブタイプの活性化が、ウイルス刺激時の炎症性サイトカインおよびケモカイン(TNF-α、IL-6,IL-8,IP-10,IL-12)の産生を抑制することを実証した。Andersonらによる最近の研究[[48]]では、ウイルス感染とそれに続くサイトカインストームが、5-HTとメラトニンの利用可能性の抑制に寄与している可能性が明らかになった。先に述べたように、5-HTはメラトニンの生合成前駆体である。抗酸化および抗炎症剤としてのメラトニンが、ウイルスや細菌の感染によって引き起こされる急性肺損傷(ALI)/ARDSに対抗することは注目に値する[[49]]。Wangら[[50]]は、さまざまな感染症とうつ病との関係を評価している。著者らによると、ボルナ病ウイルス、単純ヘルペスウイルス-1,水痘帯状疱疹ウイルス、エプスタインバーウイルス、クラミジア・トラコマティスへの感染とうつ病との間には、統計的に有意な関連があるという。また、ウイルス感染が引き金となって、脳の内皮細胞や上皮細胞がサイトカインを産生し、海馬の神経細胞の発火を障害することで、うつ病様の症状を引き起こすことも報告されている[[51]]。SARSウイルス感染症で報告されている臨床症状をまとめると、SARSウイルス感染症が5-HT系を変化させることで気分に影響を与えている可能性がある[[52]]。したがって、COVID-19感染によって引き起こされる不安や抑うつを治療するために開発されている治療法において、5-HTRを標的とした薬剤が潜在的なアプローチとして考慮される可能性がある。
4. 選択的セロトニン再取り込み阻害薬(SSRI)
SSRIは、最も広く処方されている抗うつ薬であり、その有効性、安全性、忍容性から、うつ病やその他多くの不安障害(パニック障害や強迫性障害など)の第一選択薬として使用されることが多い。SSRIは一般的に、他の多くの抗うつ薬よりも忍容性が高い。FDAが承認しているSSRIには、シタロプラム(より一般的にはCelexaと呼ばれる)エスシタロプラム(Lexapro)フルオキセチン(Prozac)フルボキサミン(Luvox)パロキセチン(Paxil)およびセルトラリン(Zoloft)が含まれる[[53]]。これらの薬剤は、アドレナリン受容体、ヒスタミン受容体、コリン受容体への作用が少ないため、他の種類の抗うつ剤に比べて副作用が著しく少ない。さらに、SSRIは、毒性指数が広く(通常、1日の投与量の30倍まで摂取しても症状が出ないか、軽度である)抗うつ効果が類似しており、副作用プロファイルも類似している。しかし、SSRIとSSRIの間には薬物動態(PK)上の違いがあり、そのためにPKによる薬物間相互作用の可能性が異なると考えられる。SSRIは、経口摂取後、消化管でよく吸収され、通常、1〜8時間以内に血漿中濃度がピークに達する。対照的に、パロキセチン、フルボキサミン、フルオキセチンは非線形PKである[[54]]。SSRIは親油性化合物(logP=2.89-5.1)であるため、大きな分布容積(VD)を示す(最大45L/kg)。VD値が体水の総量(約42L)よりも大きいことから、SSRIは組織内に多く分布していることがわかる。フルボキサミン[77%]とエスシタロプラム[55%]を除くすべてのSSRIは、タンパク質との結合率が高い(94~98%)。SSRIの半減期のうち,フルオキセチン(1〜4日),シタロプラム(35時間),エスシタロプラム(27〜32時間),セルトラリン(26時間)は,フルオキセチンが最も長く,パロキセチン(21時間)は中間的で,フルボキサミン(15.6時間)が最も短い。SSRIは、シトクロムP450(CYP)アイソザイムが関与する肝生体内変化によって消失するが、SSRIとその代謝物の一部は実際にCYPアイソザイムを阻害することがある(詳細は表1参照)[[55]]。表1は、SSRIとCYP酵素の関係を示したものである。一方、SSRIは、シナプス前神経細胞のセロトニン再取り込みトランスポーター(SERT)を阻害することで抗うつ作用を発揮する。SERTを阻害することにより、増加した5-HTがセロトニン作動性シナプス間隙に残り、より長時間にわたってシナプス後の受容体を刺激することができる[[56]]。さらに、いくつかの研究では、SSRIの免疫調節、抗炎症、抗ウイルス作用が明らかにされている。これらの研究の結果は、以下のセクションにまとめられている。
表1SSRI薬とCYP酵素の関係
| SSRI | 主要な除去経路 | その他の除去経路 | CYPアイソザイムに対する阻害効果 |
|---|---|---|---|
| シタロプラム | CYP2C19 | CYP2D6、CYP3A4 | CYP2D6(弱い) |
| エスシタロプラム | CYP2C19 | CYP2D6、CYP3A4 | CYP2D6(弱い) |
| フルオキセチン | CYP2D6 | CYP2C9、CYP2C19、CYP3A4 | CYP2D6(強い)、CYP2C9(中程度)、CYP2C19、(弱いから中程度)、CYP3A4(弱いから中程度)、CYP1A2(弱い) |
| フルボキサミン | CYP1A2、CYP2D6 | – | CYP2D6(弱い)、CYP1A2(強い)、CYP2C19(強い)、CYP2C9(中程度)、CYP3A4(中程度) |
| パロキセチン | CYP2D6 | CYP3A4 | CYP2D6(強い)、CYP1A2(弱い)、CYP2C9(弱い)、CYP2C19(弱い)、CYP3A4(弱い) |
| セルトラリン | CYP2B6 | CYP2C9、CYP2C19、CYPC2D6、CYP3A4 | CYP2D6(弱いから中程度)、CYP1A2(弱い)、CYP2C9(弱い)、CYP2C19(弱い)、CYP3A4(弱い) |
5. SSRIと免疫系
SSRIは、免疫細胞の機能のいくつかの側面を変化させることが示されている。例えば、Frankら[[57]]は、単核細胞をフルオキセチンおよびパロキセチンに試験管内試験で暴露すると、NK細胞活性が直接増加することを示した。また、何人かの著者は、うつ病患者にSSRIを投与すると、NK細胞の数や活性が有意に増加することを発見している[58, 59, 60]。さらに、Evansら[[42]]やBentonら[[61]]は、HIVセロポジティブの女性にシタロプラムを投与することで、NK細胞の自然免疫の増強、潜伏感染したT細胞やマクロファージの細胞株におけるHIV複製の減少、マクロファージへの急性HIV感染の抑制など、多くの免疫調節作用を発揮することを明らかにした。したがって、SSRIはHIVに感染した患者の免疫回復にアジュバント的な薬の役割を果たす可能性があると言える。Pellegrinoらの研究[62,63]では、ラットにフルオキセチンを生体内試験で投与すると、ex vivoでマイトジェンによって誘導されたリンパ球の増殖が同様に低下することが示された。さらに、Cananら[[64]]は、エスシタロプラムの投与がリンパ球増殖作用を有する可能性を報告した。著者らによると、エスシタロプラムによるうつ病の治療は、免疫学的障害のある患者には慎重に行わなければならない。別の研究では、Changら[[65]]は、フルオキセチンが100pMから 1μMの濃度で細胞死に対して保護的な役割を持ち、神経幹細胞の増殖に用量依存的に作用することを示唆した。また、Hernandezら[[66]]は、長期(52週間)のSSRI投与後に、B細胞数とNK増殖の有意な増加を達成したとしている。さらに、Talerら[[67]]は、ヒトT細胞に対するSSRIのex-vivo免疫調節効果を解明した。著者らは,パロキセチンとセルトラリンの濃度が高い(IC50=10μM)ほど,T細胞の増殖を抑制し,TNF-αの分泌を減少させることを明らかにした。このように,上述の研究によれば,SSRIはさまざまな免疫細胞の機能を調節することができるようである。一方、SSRIには抗炎症作用があり、炎症性サイトカインの産生を減少させ、抗炎症性サイトカインを増加させることでその効果を発揮する。2011年にHannestadら[[68]]が行った22件の研究のメタアナリシスでは、SSRIの投与によりIL-1β、IL-6,そしておそらくTNF-αのレベルが低下する可能性が示された。Kuberaら[[28, 37]]とMaesら[[69]]は、セルトラリンとフルオキセチンがIFN-γを有意に減少させ、IL-10の産生を増加させることを明らかにした。したがって、両SSRIは、IFN-γ/IL-10産生比を有意に減少させた。Tugluら[[70]]は、6週間のSSRI治療後にTNF-αの血漿レベルが有意に低下することを見出した。また、Sluzewskaら[[71]]は、フルオキセチンを8週間投与した後、うつ病患者のIL-6レベルの上昇が減少することを見出した。さらに,Sharmaら[[72]]は,致死量のインフルエンザA H1N1ウイルスに感染したマウスにおいて,セルトラリンとオセルタミビル(抗ウイルス剤ノイラミニダーゼ阻害剤)を併用することで,生存率の上昇,死亡率の低下,肺炎の減少が認められたと記述している。著者らによると、セルトラリンは、試験管内試験および生体内試験でのウイルス複製には有意な影響を及ぼさなかったが、肺の炎症を有意に減少させたという。Obuchowiczら[[73]]は,イミプラミンとフルオキセチンが,非常に低い濃度でもリポ多糖による活性化NF-κBとTNF-α,IL-1β,IL-10の産生を抑制することを示した。また、Shenoyら[[74]]は、シタロプラムが抗CD3トリガーによるIL-2産生を完全に抑制し、IL-4を著しく低下させ、IL-17産生を部分的に抑制することを示した。Tuckerら[[75]]は、心的外傷後ストレス障害の患者にシタロプラムとセルトラリンを投与したところ、IL-1βの血中濃度が有意に低下したことを明らかにした。別の研究では、Roumestanら[[76]]は、敗血症性ショックとアレルギー性喘息の動物モデルにおいて、フルオキセチンがTNF-αの発現を減少させ、NF-κBとactivator protein-1の活性を低下させたと述べている。そのほか、SSRIは、直接的なセロトニン作動性メカニズムだけでなく、炎症反応を調節する可能性がある。例えば 2019,Rosenら[[77]]は、小胞体常駐タンパク質Sigma-1受容体(S1R)をサイトカイン産生の必須抑制因子として同定している。著者らは、S1Rリガンドであるフルボキサミンが、炎症や敗血症のモデルマウスの生存率を高め、ヒト末梢血細胞の炎症反応を抑制することができると報告している。また、他の研究では、SSRIが、中枢神経系内で炎症因子を制御し、それに反応する主要な細胞であるミクログリアに対して抗炎症作用を発揮することが示されている[78, 79, 80]。例えば、フルオキセチンは、リポポリサッカライドで刺激されたミクログリア細胞におけるTNF-α、IL-6およびNOの産生を有意に減少させた[[78]]。2017,Shiら[[81]]は、アポリポタンパクE(APOE ε4)対立遺伝子の存在が、炎症性サイトカイン(TNF-α、IL-6など)やミクログリアの活性化の増加と関連していることを明らかにした。APOEε4対立遺伝子がアルツハイマー病(AD)の主要な遺伝的危険因子であることはよく知られている[[82]]。また、APOEε4対立遺伝子が、炎症状態の変化を通じて、ADの病理を引き起こす可能性があることも研究で示されている[[83]]。興味深いことに、Wangら[[84]]は、APOEε4が神経細胞とアストロサイトの両方でSARS-CoV-2感受性を高める可能性があることを示した。しかし、APOEε4,炎症、COVID-19感染の関連性を明らかにするには、さらなる研究が必要である。一方、SSRIは、うつ病患者のトランスフォーミング成長因子β1(TGF-β1:強力な抗炎症サイトカイン)の循環を増加させる[[85]]。Torrisiらの最近の研究[[86]]では、マウスにフルオキセチンまたはボルチオキセチン(いずれも10mg/kg)を長期(24日間)投与すると、TGF-β1の放出を増加させることにより、βアミロイド誘発性の抑うつ様行動と記憶障害の両方を回復させることができることが示された。また、TGF-β1は、肺線維症をはじめとするさまざまな臓器の線維性疾患の重要な制御因子でもある。したがって、Xiongら[[87]]は、COVID-19患者におけるTGF-βの発現増加が肺線維症の原因である可能性を示唆した。興味深いことに、Marques-Deakら[[88]]の研究では、SSRIの投与が炎症性サイトカインのレベルを増加させることが示された。Frickら[[89]]も,フルオキセチンを4週間投与すると,T細胞の増殖とTh1様サイトカイン(IFN-γとTNF-α)の産生が増加すると述べている.別の研究では、Hernándezら[[90]]は、SSRIを52週間投与した後、IL-2とIL-1βの増加を示した。最近では、Keatonら[[91]]が、自殺リスクの増加に関連する独特の免疫生物学的プロファイルを報告した。Amitaiら[[92]]は,フルオキセチンを8週間投与している間のIL-6レベルの上昇が,SSRIに関連した自殺傾向の出現の危険因子であることを明らかにした。一般に、いくつかの矛盾したデータにもかかわらず、SSRI薬は免疫反応を調節することができるようである。
6. SSRIとウイルス感染症
SSRIの抗ウイルス作用の可能性を示す研究がいくつかある。例えば、Kristiansenら[[93]]は、パロキセチンとフェモキセチンが試験管内試験のHIV阻害細胞培養系でp24抗原レベルを低下させたことを示した。著者らによると、これらの化合物は、AIDS関連の認知症を持つHIV-1感染患者において、他の抗レトロウイルス薬と組み合わせて使用することができる。Greesonら[[94]]は,シタロプラムの投与により,CD4の発現やケモカイン受容体の発現(CCR5,CXCR4)をダウンレギュレートすることで,HIV細胞の侵入や複製を阻害し,免疫細胞のHIV感染に対する感受性を低下させ,炎症を抑制する可能性を示唆した。また、Letendreら[[95]]は、SSRI(シタロプラム、セルトラリン)が脳脊髄液中のHIV複製を減少させ、神経心理学的パフォーマンスを向上させる可能性を報告した。別の研究では,Johansenら[[96]]は,ハイスループットのスクリーニングで171種類の抗エボラウイルス(EBOV)化合物を同定した。そのうち,sertralineとbepridilの2つの薬剤は,試験管内試験および生体内試験でEBOVの細胞侵入を阻害した。これらの薬剤は、単剤または組み合わせて、EBOV感染症に再利用できる可能性がある。Bentonら[[61]]は、シタロプラムが、急性感染モデルと慢性感染モデルの両方で、逆転写酵素反応を有意にダウンレギュレートすることを示した。Zuoら[[97]]は,エンテロウイルス(EV)に対して抗ウイルス効果を持つ新規化合物の可能性を探るため,1100以上の化合物をスクリーニングした。その結果,フルオキセチンとその代謝物であるノルフルオキセチンが,HeLa細胞におけるコクサッキーウイルスB3(CV-B3)の複製を阻害することがわかった。その後、Ulfertsら[[98]]は、フルオキセチンがヒトのシステムにおいて試験管内試験でCV-B3,EV-D68,EV-D70,Echovirus-1,Echovirus-9,Echovirus-11の複製を阻害することを実証した。また、Alidjinouら[[99]]は、フルオキセチンがヒト膵臓細胞(Panc-1細胞株)におけるCV-B4の複製を阻害できることを示した。著者らによると、フルオキセチンは、CV-B4に慢性的に感染したPanc-1細胞培養物からウイルスを除去した。2019年には、Bauerらの報告[[100]]により、フルオキセチンのS-エナンチオマーのみがCV-B3を阻害し、EV-D68も阻害することが示された。彼らは、フルオキセチンのS-エナンチオマーがライノウイルスに対しても抗ウイルス活性を発揮することを観察した。最近、同グループは一連の新しいフルオキセチン類似体を合成し、その抗ウイルス活性を評価した。その結果、これらの類似体は、CV-B3およびEV-D68の複製を阻害したが、EV-A71やEV-C種の代表的なウイルス(ポリオウイルスおよびCV-A24)は阻害しなかった。著者らによれば,トリフルオロフェノキシ部分とアミノ部分の構造的特徴は抗ウイルス活性に必須であるが,3-フェニル部分は必要ないようである[[101]]。フルオキセチンは,フラビウイルス科の2つのメンバーであるデングウイルス(デングウイルス)とC型肝炎ウイルス(HCV)を阻害することも示された[102, 103].例えば,Youngら[[103]]は,フルオキセチンがHCVの感染を阻害し,Huh7.5細胞における活性酸素種の産生と脂質の蓄積をブロックすることを示した。著者らは、現在のIFN-αレジメンにフルオキセチンの介入を加えることで、C型慢性肝炎患者の抗HCV治療の有効性が向上する可能性を示唆した。興味深いことに、Gofshteynら[[104]]は、フルオキセチンの適応外使用により、慢性エンテロウイルス脳炎の免疫不全児を治療したことを報告している。著者らによると、フルオキセチンは、ヒトのEV誘発性疾患と闘うために有用である。以上のことから、ここで取り上げた研究は、SSRI、特にfluoxetineによる治療が多くのウイルス感染症に有効であることを示している。
7. SSRIをCOVID-19の治療に再利用する
上述したように、この新規感染症においてSSRIが有益な効果を発揮すると思われるもっともらしいメカニズムがいくつかある(図1)。Schloerら[[105]]は,フルオキセチンの投与により,ヒト気管支上皮細胞株(Calu-3)およびVero E6細胞におけるSARS-CoV-2感染が抑制され,そのEC50値は1μM以下であったことを明らかにした。また、10μMのフルオキセチンを塗布すると、ウイルスの力価が最大99%まで低下したと報告している。Zimniakらの研究[[106]]でも、SARS-CoV-2に対するフルオキセチンの抗ウイルス効果が支持されているが、この効果はエスシタロプラムやパロキセチンなどの他のSSRIでは認められなかった。つまり、抗ウイルス効果は5-HT再取り込み受容体とは関係ないということだ。著者らは、fluoxetineによる治療がウイルスのタンパク質発現を減少させたことから、この薬剤が遺伝子発現の上流で働くことを示唆している。今回のスクリーニングでは、fluoxetineは0.8μg/mLの濃度でSARS-CoV-2の複製を有意に抑制し、EC50は0.38μg/mLと判定された。また,別の研究では,フルオキセチンとレムデシビルの併用療法は,偏光Calu-3細胞培養モデルにおけるSARS-CoV-2感染性粒子の産生を90%以上抑制し,一般的に使用されている薬物相互作用の参照モデルにおいて相乗効果を示すことが明らかになった[[107]]。著者らによると、フルオキセチンとレムデシビルの併用は、SARS-CoV-2感染とCOVID-19の深刻な進行を抑制するための有望な治療オプションである。Hoertelら[[108]]は、COVID-19における抗うつ薬の使用に関する初めての大規模な観察研究を報告した。彼らは 2020年1月24日から4月1日までの間に、フランスのパリ公共施設(Assistance Publique-Hôpitaux de Paris)でCOVID-19で入院した7345人の成人を対象に、抗うつ薬の使用と挿管または死亡のリスクとの関連を調べるレトロスペクティブな多施設コホート研究を行った。このうち、257名がSSRI、71名がSNRI、59名が三環系抗うつ薬、94名が四環系抗うつ薬、44名がα2アンタゴニスト抗うつ薬を投与され、6885名が抗うつ薬の治療を受けなかった。著者らは、COVID-19の入院患者において、SSRI(fluoxetineとescitalopram)とSNRI(venlafaxine)による治療は、挿管や死亡のリスクを減少させると結論づけた。しかし、今回の結果の頑健性を立証するためには、より大きなサンプルサイズとより長い追跡期間でのさらなる研究が必要である。したがって、標準的なCOVID-19治療の補助として、これらの「再利用された薬剤」の有効性と安全性を評価できるよう、前向きの無作為化比較試験を行うことが推奨される。フルボキサミンに関しては、現在、無作為化二重盲検プラセボ対照第II相臨床試験研究が行われている(NCT04342663)[[109]]。対照群として,患者(n=80)にフルボキサミン300mgを1日1回(1日3カプセル),15日間投与し,最大30日間の追跡調査を行った。予備的な結果では、フルボキサミンをCOVID-19の経過の早い段階で投与すると、入院の可能性が有意に減少した。フルボキサミンは、炎症性サイトカインの産生を制御するS1R [[77]]を刺激することで、軽度のCOVID-19患者の臨床的悪化を防ぐことができると考えられている。今後の研究では、この有望な研究手段を調査する必要がある。また、COVID-19患者の挿管や死亡を減らすためのフルオキセチンの効果を調べる臨床試験が現在進行中である(NCT04377308)[[110]]。現在、フルオキセチンは、SARS-CoV-2に感染している患者(n=1000)に1日20〜60mgを投与する第IV相臨床試験にすでに到達している。
8. 薬物間相互作用
薬物相互作用は通常、薬物動態(PK)と薬力学(PD)の2つに大別される。SSRIは特定のCYPアイソザイムを阻害し、これらの酵素で代謝される他の薬剤とのPK相互作用を引き起こす可能性がある。PD相互作用は、SSRIを他のセロトニン上昇剤(三環系抗うつ剤、モノアミン酸化酵素阻害剤、リネゾリド、トラマドール、メペリジン、コカイン、ブスピロン、レセルピン、リチウム、トリプトファン、フェンタニル、トリプタン、アンフェタミン、セントジョーンズワートなど)と併用した場合にも生じる可能性がある。John’s wort, gingko biloba, S-adenosyl-methionine)などが挙げられる。これらの物質は、重篤なセロトニン毒性、または生命を脅かす可能性のある症状の分類であるセロトニン症候群(SS)を引き起こす可能性がある[111, 112]。これらの症状には、激越、高熱、頻脈、幻覚、筋肉の痙攣などがある。SSの第一選択の管理には、原因となるセロトニン作動性薬剤の中止と支持療法の提供が含まれる。支持療法には、ベンゾジアゼピン系薬剤(ジアゼパムやロラゼパムなど)や、シナプスの5-HTレベルの上昇を打ち消すために非特異的な5-HT1Aおよび5-HT2A拮抗薬であるシプロヘプタジンを使用することができる[[113]]。SSRIの薬物動態学的な薬物相互作用のほとんどは、CYP酵素システムが関与する代謝レベルで起こる[[114]]。SSRIは、表1に示すように、個々のCYPを阻害する力が大きく異なる。このことは、個々の患者に適切な化合物を選択する際の指針となる。フルオキセチン、その活性代謝物(ノルフルオキセチン)およびパロキセチンは、CYP2D6アイソザイムの強力な阻害剤であるため、このアイソザイムで主に代謝される薬物の血漿中濃度および副作用を著しく増加させる可能性がある[55, 115]。例えば、フルオキセチン/パロキセチンと、2D6アイソザイムで代謝されるβ遮断薬(カルベジロール、メトプロロール、プロプラノロール、チモロールなど)を併用すると、β遮断薬の曝露量が増加し、薬物毒性や、特に高齢者では心拍数の低下(徐脈)低血圧、転倒などの事象が生じる可能性がある[116, 117]。さらに、フルオキセチンは、通常の投与量である20mg/日であっても、三環系抗うつ薬の血漿中濃度を数倍に増加させるというエビデンスがある[[118]]。例えば、デシプラミン(50mg)の平均血漿濃度は、20mgのフルオキセチンを20日間使用した場合、4.4倍に増加した[[119]]。また、CYP2D6は、オピオイド系鎮痛薬(トラマドール、コデインなど)クラスI抗不整脈薬、第一世代H1-ブロッカー、抗精神病薬(ハロペリドール、リスペリドン、クロザピン、チオリダジンなど)の代謝に関与することが知られている[120, 121]。したがって,フルオキセチンとこれらの薬剤を併用することは,副作用や治療の失敗につながる潜在的な薬物間相互作用のリスクをもたらす。例えば、フルオキセチンがCYP2D6を阻害することにより、危険因子を持つ患者において、フルオキセチンとリスペリドンの併用により、アカシジアやパーキンソン症状が発現したとの報告がある[[55]]。また、パロキセチンとフルオキセチンは、抗がん剤タモキシフェンの活性代謝物エンドキシフェンの生成を減少させることにより、タモキシフェンの効果を低下させる可能性があるという一貫した証拠がある[[122]]。フルボキサミンは、CYP1A2およびCYP2C19の強力な阻害剤であるが、CYP3A4およびCYP2C9も阻害する[[123]]。そのため、主にこれらの経路で代謝される多くの薬剤のPKを修飾する可能性がある[112, 114, 115]。例えば,フルボキサミンは,ヒトの血漿中のメラトニン濃度(Cmax)を6倍,曲線下面積(AUC)を9倍に増加させるという実験的証拠がある[[124]]。また、フルボキサミンにラメルテオン16mgを単回投与したところ、ラメルテオンのAUCが190倍、Cmaxが70倍に増加したと報告されている[[125]]。最近、Andersonら[[126]]は、フルボキサミンが夜間の血漿中のメラトニン濃度を大幅に増加させるという特徴を持つことから、COVID患者においても有益な効果を発揮するのではないかという仮説を立てた。フルボキサミンおよびフルオキセチンは、特に高齢の患者において、CYP2C9を介したワルファリンのより生物学的活性の高い(S)-エナンチオマーの酸化的代謝を阻害することにより、ワルファリン(CYP2C9基質)に関連する出血リスクを大幅に増加させる可能性がある[[127]]。また、フルボキサミンやフルオキセチンなどのCYP2C19を阻害するSSRIは、クロピドグレルの活性代謝物への変換を低下させ、血中の活性抗血小板剤の濃度を低下させる可能性がある[[128]]。理論的には、CYP3A4を阻害するSSRIは、直接経口抗凝固剤(リバーロキサバンやアピキサバンなど)と併用した場合、出血、特に頭蓋内出血のリスクを高める可能性がある。糖尿病患者において、フルボキサミン/フルオキセチンとスルホニルウレア系薬剤を併用すると、フルボキサミン/フルオキセチンがCYP2C9を介したスルホニルウレア系薬剤の代謝を阻害するため、低血糖を起こす可能性がある[[129]]。フルボキサミンはカフェインの試験管内試験代謝を強力に阻害し、CYP1A2基質であるカフェインのクリアランスを80%減少させ、ヒトでの半減期を5時間から31時間に延長した[[130]]。また、フルボキサミンは同じくCYP1A2基質であるテオフィリンのクリアランスを阻害するため、テオフィリンの投与量を通常の1日維持量の3分の1に減らす必要があるとされている[[131]]。また、フルボキサミンは、主にCYP1A2の阻害により、本薬の血漿中濃度を最大10倍まで上昇させることが示されている[[132]]。シタロプラム、エスシタロプラムを含む他のSSRIは、CYP2D6の弱い阻害剤であり、他の薬剤との相互作用の可能性は低いが、セルトラリンは高用量(少なくとも1日150mg)でのみ、このアイソフォームの有意な阻害を引き起こす可能性がある[[133]]。しかし、通常の治療量では、CYPに対する阻害作用がわずかしかない3種類のSSRI(シタロプラム、エスシタロプラム、セルトラリン)は、他の強力なCYP阻害剤と併用することで、薬物相互作用を起こす可能性がある。例えば、CYP1A2,CYP2C9,CYP2C19,CYP2D6,CYP2E1,CYP3A4の強力な阻害剤であるシメチジンを併用すると、シタロプラムの定常濃度が41%上昇する[[134]]。また、6種類のSSRIのすべてがQT延長作用を有することも注目に値する[[135]]。しかし、シタロプラムとエスシタロプラムは治療用量で最も大きくQT間隔を延長し、現在、英国医薬品・ヘルスケア製品規制庁は催不整脈の可能性について警告を発表している[[136]]。また、SSRIは主にα-1-酸糖タンパク質に弱く結合する。このためか、タンパク質結合の強いSSRIであっても、タンパク質結合の強い併用薬の遊離分を有意に増加させることはないとされている[[137]]。
9. SSRI薬とCOVID-19治療薬の薬物間相互作用
COVID-19の患者は、一般的に複数の薬剤を投与されているため、薬物間相互作用のリスクが高い。薬物間相互作用は、重篤で致死的な有害事象につながる可能性がある。したがって、有害な薬物相互作用を特定し、その影響を最小限に抑えることは、COVID-19治療の必須目標とすべきである。表2は、SSRI薬とSARS-CoV-2の治療に用いられる主な薬剤との相互作用を示している[138, 139, 140, 141]。SSRI との併用が最も問題となる COVID-19 治療薬は、薬物動態的な面だけでなく、QT 延長や TdP(torsades de pointes)などの重篤な薬力学的薬物相互作用の面でも、アジスロマイシン、アタザナビル、クロロキン、ヒドロキシクロロキン、ロピナビル/リトナビルであることがわかった。
表2SARS-CoV-2の治療によく使用される薬剤とSSRIとの相互作用
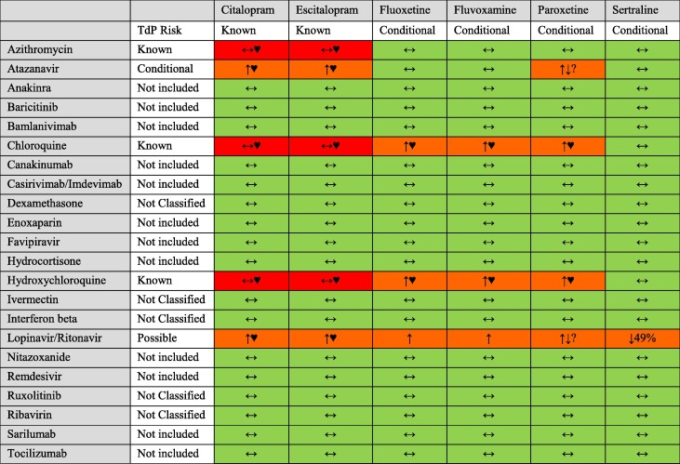
リスク評価 ゾーンレッド。極めて重大な相互作用。これらの薬剤を併用すべきではない。ゾーンオレンジ。ゾーン・オレンジ:用量調整や綿密なモニタリングが必要となる可能性がある相互作用。ゾーン・イエロー:弱い相互作用の可能性がある。ゾーン・イエロー:相互作用の強さは弱いと思われ、追加の措置・モニタリングまたは用量調整が必要になる可能性は低い;ゾーン・グリーン。ゾーン・グリーン:臨床的に重要な相互作用がないか、何もする必要がない。
相互作用の種類 ハートマーク(♥)。片方または両方の薬剤がQT延長および/またはTdP(torsades des pointes)を引き起こす可能性がある。併用する場合は心電図のモニタリングが推奨される。 ↑/↓ SSRIの曝露量が増加/減少する可能性がある。 ↔ 薬剤の血清レベルには大きな影響はない。
TdP のリスク:QT を延長する薬剤及び TdP のリスクカテゴリー:TdP の既知のリスク(これらの薬剤は QT 間隔を延長し、推奨された通りに服用した場合でも、明らかに TdP の既知のリスクと関連している)TdP の可能性のあるリスク(これらの薬剤は QT 延長を引き起こす可能性があるが、推奨された通りに服用した場合の TdP のリスクに関する証拠は現在のところない)TdP の条件付きのリスク(これらの薬剤は TdP と関連しているが、特定の使用条件の下でのみ(例. TdP の条件付リスク(これらの薬剤は TdP と関連しているが、特定の使用条件(例:過 量投与、低カリウム血症などの患者、相互作用のある薬剤との併用)の下でのみ、あるいは TdP を促進または誘発する条件(例:QT 延長薬の代謝を阻害すること、あるいは TdP を誘発する電解質障害を引き起こすこと)の下でのみ、TdP と関連している);分類されていない(この薬剤は検討されたが、現時点で入手可能なエビデンスにより、4 つの QT リスクカテゴリーのいずれにも分類されないことが決定された。これは、CredibleMeds®によると、本薬がQT延長やTorsades de Pointesのリスクがないことを示すものではない(本薬は患者におけるこれらのリスクについて十分な試験が行われていない可能性があるため)。
10. 結論
SARS-CoV-2に関する現在の知見に基づけば、抗炎症作用と抗ウイルス作用を併せ持ち、良好な副作用プロファイルを持つ薬剤が、このウイルス感染症と戦うための最も有望な治療戦略となるはずである。SSRIは、安価で広く入手可能な薬剤であり、安全な忍容性プロファイル(高齢者であっても)を有するだけでなく、この効果プロファイルに著しく適合している。そこで,本レビューでは,COVID-19に対するSSRIの前臨床および臨床エビデンスを批判的に分析し,その安全性と有効性をめぐる側面を議論する。SSRIの中でもfluoxetineは、炎症性ケモカイン/サイトカイン(IL-6,TNF-α、CCL-2など)の分泌を抑え、感染に対する免疫系の反応性を調節することで、COVID-19に対する有望な薬剤である。さらに、フルオキセチンは、様々なウイルス(試験管内試験および生体内試験)に対して抗ウイルス作用を有しており、細胞培養モデルでのSARS-CoV-2感染に対しても有効である。したがって、現在の文献や上記の考察を踏まえ、我々はfluoxetineと他の薬剤を併用することで、免疫調節作用、抗炎症作用、抗ウイルス作用により、より効果的な結果が得られると提案する(図1)。
