Contents
Disease-directed engineering for physiology-driven treatment interventions in neurological disorders
www.ncbi.nlm.nih.gov/pmc/articles/PMC6811362/
2019年10月23日オンライン公開
トーマス・ウッド1,2,エリザベス・ナンス3,4,5,a)
要旨
神経疾患は私たちを死に至らしめている。急性および慢性の神経疾患に対する治療法の開発が長い間試みられてきたが、現在の治療法では治癒するものはない。さらに、神経疾患の治療法開発には15年の歳月と数十億円の費用がかかることが多い。また、これらの治療法の96%以上は、臨床試験の後期段階で失敗する。神経疾患に対する新しい治療法を開発することで、何百万人もの人々の生活の質を向上させることができるが、治療法は、基礎となる生理学や病理学を考慮して設計する必要がある。本論では、神経疾患の生理機能の重要性とその理解の必要性を明らかにすることを目的としている。まず、実験計画の指針となる通常の生理学的考察を行い、次に、治療計画の指針となる急性および慢性の神経疾患の病態生理学的要因を評価する。研究プロセスのすべての段階で生理学を取り入れたことにより、翻訳に成功したナノベースの治療的介入の分析を行う。また、治療介入を設計・実施する際に、ハイレベルな視点を保つことの重要性についても意見を述べている。最後に、疾患を特定した工学的アプローチを適用するための実施戦略を紹介している。我々の評価は、神経疾患の複雑さを受け入れること、そして神経疾患の治療法の開発においてシステムレベルの思考を提供する努力を増やすことを推奨するものである。
I. はじめに
脳や脊椎、それらをつなぐ神経の正常な機能に影響を与える神経系の疾患は、600種類以上ある1。急性神経障害には、脳卒中や心停止などの脳低酸素虚血(HI)を引き起こす状態のほか、外傷性脳損傷(TBI)がある。米国では、TBIによって毎年250万人が救急外来を受診し、530万人がTBIに関連した障害を抱えていると考えられている2。世界中では、毎年600万人以上が脳卒中で亡くなっている3。慢性神経疾患には、アルツハイマー病(AD)多発性硬化症(MS)パーキンソン病(PD)筋萎縮性側索硬化症(ALS)ハンチントン病、多くのがん、神経筋疾患、てんかん、自閉症、うつ病、双極性障害、統合失調症などがある。慢性的な神経疾患は、毎年5,000万人以上のアメリカ人を苦しめており、世界的な健康被害の8%を占めている4。毎日1万人のアメリカ人が65歳を迎えており5,人口の高齢化に伴い、神経疾患の罹患率は増加の一途をたどっている。
急性および慢性の神経疾患に対する治療法の開発が長い間試みられていたが、現在の治療法で治癒できるものはない。現在の市場レポートによると、様々な神経疾患の予防や治療のために約600種類の医薬品が開発されているが6,多くの製薬会社は神経科学研究からの撤退を進めている7。ADを例にとると、AD治療薬の開発にかかる総コストは56億ドルと推定されており、前臨床試験からFDA(米国食品医薬品局)による承認まで平均13年を要している8。興味深いことに、臨床開発を開始する治療薬は、前臨床モデルで有効性と安全性が実証されているが、それでも90%以上の確率で、臨床効果が得られなかったり、患者さんが耐えられないような副作用があったりして、治療薬は失敗に終わる9。神経疾患の治療薬の失敗率は、他の疾患分野に比べて非常に高く10,失敗の多くは臨床試験の後期に発生している11。実際、神経疾患において製薬会社が大きな変化をもたらしたのは、約30年前の1991年、スマトリプタンが片頭痛の治療薬として承認されたときであった。そのため、この分野では、脳の疾患や治療プロセスに対する理解を深め、これらの知見を効果的なバイオマーカーや治療法に結びつける能力を向上させることが非常に重要となっている。
疾患を研究する標準的なアプローチは還元主義的であり、疾患システム内の個々の分子や経路に注目しても、その疾患に対する治療法を生み出すことができないことが多い12。神経疾患に対する効果的な治療法の必要性のギャップをうまく埋めるためには、工学的アプローチが重要な役割を果たすことができ、またそうすべきである。そこで、私たちは、生理学を中心とした治療戦略を多面的に研究することで、治療介入のエンジニアリングを推進すべきだと考えている(図1)。しかし、複雑な疾患に対する治療法を開発するには、基礎となる生理学や病理学の重要な側面を取り入れる必要がある。ここでは、基礎的な生理学を理解することで、神経疾患の治療において、どのように、いつ、何を介入すべきかを導くことができる、未解決の課題を取り上げる。まず、前臨床試験から臨床試験への移行過程において、年齢や性別、種の違い、全身と局所の生理学的な違いの影響を考慮する必要があることを説明する。さらに、生理学的変化のタイミングが治療法の設計と介入の指針として重要である理由を掘り下げる。そして、発達性脳障害に対する生理学的介入に成功したナノ治療法を紹介し、最後に、神経疾患の治療のために、高レベルの工学的介入アプローチとメカニズム的介入アプローチの概念を用いて前進するための展望を述べている。
図1.
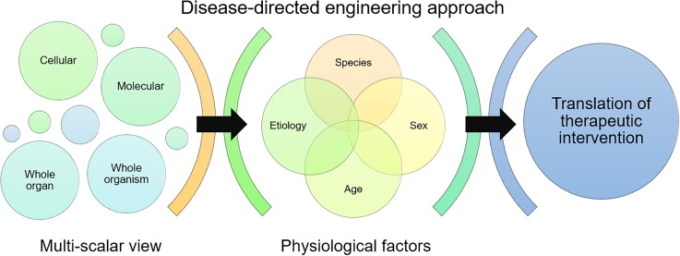
疾患指向の工学的アプローチでは、治療結果の評価を多面的に捉え、治療介入の臨床応用に影響を及ぼす可能性のある主要な生理学的要因を考慮する。
II. 正常な生理的変化が実験計画の指針となる
2014,米国国立衛生研究所(NIH)は、研究者が前臨床試験の計画と結果評価において生物学的変数に取り組むためのガイドラインを導入した13。このガイドライン変更の目的は、研究者が交絡や選択バイアスを考慮できるようにすること、また、生物医学研究の再現性と翻訳性を高めるために「現実の世界」をよりよく捉えることであった。私たちは、特に治療効果の評価において、翻訳プロセスに影響を与える生理学上の種差の重要性を強調している。また、標的部位の局所的な生理現象を超えて、治療薬の成功に影響を与える全身の生理現象を考慮する必要性についても述べている。
A. 年齢による生理的差異
脳の発達は構造的にも機能的にもモジュール化されているため、前臨床の動物実験とヒトの年齢を一致させるには限界がある14。巨視的なレベルでは、脳の加齢により、40歳以降は10年ごとに体積と脳重量が減少し15,脳血流(CBF)が減少し16,灰白質が縮小する17。しかし、小児には様々な成長・発達段階があり、成人とは異なる生理的・認知的な変化が見られる。このような変化は、治療薬の薬物動態(PK)や薬力学を変化させる可能性があり、その結果、原薬と製剤添加物の両方に対する反応が異なることになる19。
生理機能の違いから、子供から大人、大人から子供への治療法開発がうまくいかない例がいくつか存在する。HIに対しては、頭や体を選択的に冷却する治療的低体温法(TH)が、死亡率や罹患率を低下させる治療法として古くから用いられていた。低体温療法は現在、低酸素性虚血性脳症(HIE)の満期新生児に対する標準的な治療法となっており、死亡や神経発達障害のリスクを大幅に低減することが実証されている20が、それでも約50%は予後不良となる21。 -24 しかし、心停止によらない成人の急性虚血性脳卒中に対するTHのエビデンスは、説得力に欠けている25。成人の院外心停止後、正常体温を確保して発熱を防ぐことは、実際にはTHと同様に有益である可能性がある26。2017年に行われた最近のメタアナリシスでは、THによって成人の死亡率が18%低下し、神経学的転帰が35%改善することが示唆されたが27,成人および小児のTBIにおける質の高い試験はすべて有益性を示すことができなかったため、この分野の関係者からは大きな反響があった28。
年齢に依存した効果のもう一つの例は、スーパーオキシドディスムターゼ(SOD)である。SODは、スーパーオキシドを過酸化水素に変換する内因性の酵素であり、損傷後には減少し、スーパーオキシドが過剰に生成される。TBIや虚血性脳卒中の前臨床モデルにSODを投与したところ、脳浮腫が減少し、運動機能が改善した29,30。しかし、新生児の急性脳損傷モデルでは、有益な結果はあまり明らかではない。例えば、成人脳卒中のネズミモデルではSODの過剰発現が神経保護効果を示すが31,新生児の脳では傷害を悪化させる可能性がある32。同様に、新生児HIEにおける外因性ポリエチレングリコール(PEG)結合型SODは、神経保護効果がU字型の曲線を描き、高用量では効果がなくなる33。これは、発達中の脳ではカタラーゼの発現が相対的に低く、その結果、過酸化水素が蓄積されるためと考えられている32,34。したがって、標的抗酸化療法を開発する場合は、治療研究において、介入の対象となる年齢における抗酸化システムの発達レベルと反応性を考慮する必要がある。
B. 生物学的変数としての性別
2011年に行われた神経科学研究の査読付き文献の分析では、著者らは80%の論文で性別が報告されていないことを発見した35。これは、ほとんどの神経疾患の有病率や転帰に性差があることを示す臨床データが豊富にあることを考えると、憂慮すべき統計値である。2014年のNIHの対応は、神経疾患を研究している研究者は、性別による違いを調べることができるような研究を設計するか、そうしないことの正当な理由を示すことを義務付けるというものであった。このアプローチがトランスレーションを向上させる上で有効であるかどうかについては反対意見もあるが36,37,前臨床研究において性別を考慮することが治療的介入のデザインと評価に必要であることを強調する価値がある。
38 男性の乳児は、女性に比べて周産期の傷害を受けやすく、同程度の傷害を受けた女性に比べて、長期的な認知機能の低下が見られる39,40。男性は、出生前の無酸素状態、出血、感染を経験する可能性が2倍高く、出生時の脳外傷を受ける可能性も約2倍高い41。また、男性は、知的障害、自閉症スペクトラム障害(ASD)42,注意欠陥活動障害などの神経発達障害にもなりやすいと言われている。43 小児TBIの場合、男性は女性に比べてTBIを受ける確率が2倍高いが、死亡率は女性と同程度です44 興味深いことに、傷害の重症度を考慮しても、女性の方が入院期間が長く、予後も悪い傾向にある45。思春期および成人期において、大うつ病性障害および不安障害は、女性の方が男性よりも約2倍多くみられる。49,50 統合失調症は、男性の方が発症率が高く、発症時期も早く、予後も悪いと言われているが、これは女性に比べて症状が重く、抗精神病薬への反応が悪いことが主な原因と考えられている。神経変性疾患に注目すると、ADは65歳以上の女性で有病率が高く、認知機能の低下も大きい53。ALSは男性で有病率が高く、発症も男性の方が早いが、閉経後の女性でリスクが高く、女性のALS患者の生存率も低い54。PDについては、男性の発症率が高く、女性の減少率が遅い56,57。急性脳外傷にも性差がある。脳卒中の有病率は、女性に比べて男性の方が高い。58 85歳以上では、女性の方が脳卒中の発症率が高いが、これは男性に比べて女性の方が平均寿命が長いことに起因することが多い。75歳未満の女性は、男性に比べて脳卒中死亡率が低く、その優位性は年齢とともに低下するが、女性の方が転帰が悪く、身体障害も重度になる59。
ヒトの神経疾患の転帰の違いは、動物モデルにもメカニズム的に反映されている。成人および新生児脳卒中モデルでは、女性はカスパーゼ依存性の細胞死経路を多く示し、男性はカスパーゼ非依存性の経路を多く示す60-62。このような性差が、新生児HI脳損傷に対する実験的治療後の女性の転帰を良くする要因の一つと考えられている39。63-65 ほとんどの神経疾患の病理学的特徴である興奮毒性、炎症、酸化ストレスなどの広範な疾患経路にも性差がある。疾患や傷害に対する炎症反応を仲介する細胞であるミクログリアは、新生児期には男性で部位特異的に数が増加するが、成人になると女性で数が増加する66。酸化ストレスへの対応能力や軽減能力は、ミトコンドリアの機能に影響を与え、男性のミトコンドリアはカルシウムの取り込み能力が高い68。脳虚血傷害後の神経細胞の酸化窒素種(nNOS)は、男性の方が女性よりも多い69ため、nNOSを阻害すると男性では神経保護効果がある。しかし、女性では、nNOSの阻害やノックアウトは梗塞体積を増加させるため、治療効果には性差があることが示されている。活性酸素種(ROS)によるダメージも、早産児70やTBI成人71では、女性に比べて男性の方が高い。ここでもホルモンが重要な役割を果たしていると考えられている。抗酸化酵素の増加により、より高い、あるいはより回復力のある防御システムを付与することができるからである。脳損傷後の酸化ストレスの治療という観点からは、男性のほうが抗酸化治療の恩恵を受けられる可能性があり、したがって、損傷を受けた女性のための強力な候補を特定するためには、さらなる研究が必要となるかもしれない72。
このような性差を考慮すると、性差を反映した臨床データがしっかりしていれば、前臨床研究で性差を考慮する根拠になると考えるのが自然であろう。しかし、性差を考慮した研究の少なさは、ほとんど信じられないほどである。一般的な前臨床研究では、オスの動物はメスに比べて3:1または4:1で使用されるが、神経科学ではこの比率が6:1近くになり、性差が大きくなることがよくある35。このような性差は、最新の文献のメタ分析が行われた2016年まで大きなままでした37。しかし、C57BL/6マウスは、雌よりも雄が長生きする数少ない哺乳類のひとつで、遺伝子の不安定さや抗酸化物質の取り扱いの変化が原因と考えられており、研究に使用されるげっ歯類の80〜90%がこの系統で占められている73。
動物モデルにおける性差を把握することは、困難ではあるが必要なことである。しかし、性差に対応するためにサンプルサイズを大きくすることへの懸念は、確実にこの問題の前面に出てきている。これは、治療法、送達手段、および病理学的性質に関する多数の対照群がすでに研究に組み込まれている工学的治療法において特に顕著である。特に女性の場合、生殖周期に伴うホルモンの変動によって生じる変動が予想され、すでに複雑な生理学的方程式に新たな層を加えることになるため、この懸念が生じていたようである。しかし、マウス74,75,ラット76,ヒト75,77における10,000以上の特性測定を対象とした最近のメタアナリシスでは、どのような評価においても、オスに比べてメスの変動性は大きくないことが示されている。研究に雌を使用しても、雄を使用した場合よりも変動幅が大きくなることはない74が、研究に雌を使用しないと、前臨床の治療製品を臨床に応用する能力が著しく低下する。
ヒトでは、体格、体脂肪、活動量(種類と量の両方)代謝、エネルギー需要78,ストレスに対する反応79の違いが、ホルモン、遺伝、免疫、心理社会的要因の複雑な相互作用に影響されるため、性差のある疾患の病態や転帰は、動物と比較してさらに誇張される可能性が高い80。社会文化的な影響には、性別よりもむしろジェンダーの概念に強く関連するものが多く36,これらは現在、動物モデルでは捉えられていない。性的役割に対する期待は、症状の報告や、病気の診断や治療への反応を追跡するために収集されたデータに影響を与える可能性がある81。ジェンダーに関する暗黙のバイアスは、診断率や治療の決定に影響を与えることが実証されている82。性とジェンダーの間の流動性と、神経機能、病理、治療への反応への影響については、今後も継続的な研究が必要であり、そのためには、ヒトでの研究を進めるとともに、可能な限り動物モデルを用いて、より厳密な研究を行っていく必要がある。種差は性差にとどまらず、第2章Cでさらに議論されているが、これらの課題が、性差に依存した方法で治療の意味を理解する必要性に取って代わるべきではない。しかし、他の生理学的因子と同様に、研究者は性別を切り離して考えたり、遺伝的因子、発達因子、環境因子などの他の変動要因よりも関連性が高いと考えたりしてはならない。
C. 基本的な生理機能における種の違い
動物実験は、治療法の開発において重要な役割を果たしてきたが、動物モデルによる臨床効果の予測は、成功の程度に差がある。ヒトの脳は複雑であり、ヒトの神経疾患を適切に再現し、治療効果を予測する動物モデルを開発するには、進化上の障害がある。したがって、種差を、治療介入の翻訳を制限する根本的な要因の1つとして考えることにはメリットがある。薬物の吸収、分布、代謝など、治療効果に影響を与える多くの側面において、種間の違いが観察されている。これらの種差の多くは、図2にまとめられており、他にも多くのレビューがなされている83。
図2. 治療成績に影響を与える種差のまとめ
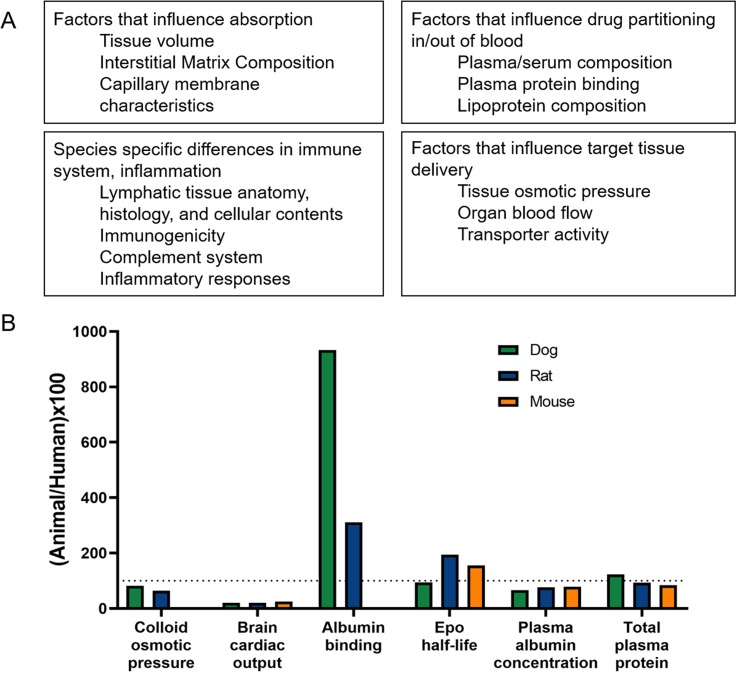
(a) 生物種によって異なり、薬物の吸収と分配、免疫系と炎症反応、治療薬の標的組織への送達に影響を与える因子。(b) 様々な生理学的マーカーについて、ヒトの値に正規化し、パーセントで表した、様々な種からの実験値の例83。
複数の生物種を研究することは、特に、異なる生物種における疾患の病因や進行の違いを通じて、ヒトの疾患の異質性を把握する上で有益である。重要なことは、複数の動物種から得られる知見は、何が一般化でき、何が種特異的であるかを理解するのに役立つということである。しかし、動物モデルの選択は、特定の分野や疾患領域における伝統、コスト、研究の便宜性、倫理的配慮、政治的配慮、機関のリソースなどの理由で、しばしば制約を受ける。このような理由から、神経科学研究の前臨床モデルとしては、げっ歯類が最も広く用いられている。マウスは、遺伝子操作のためのほぼ無限の空間を表しており、病気や治療効果を研究するために重要な経路を特定の方法でノックダウン、ノックイン、またはノックアウトすることができる。さらに、マウスは多くの点で費用対効果に優れており、飼育や維持管理だけでなく、薬剤開発においても、体重が小さいことは、重量あたりの投与量で投与される新規化合物を試験する際に有利である。ラットは脳が大きいため、外科手術がしやすく、脳イメージングの空間分解能も高い。また、特に神経精神医学や神経発達学の分野では、結果を混乱させる可能性のあるハンドリングによるストレスに強い。また、ラットは、脳の活動を妨げる可能性のある麻酔を使用せずに、画像診断の際にじっとしていられるように訓練されている86。細胞や分子レベルでは、ラットは多くの神経伝達物質や受容体のレベルや空間分布が人間と同様である84。しかし、げっ歯類モデルに一極集中することが、神経疾患の治療薬の劇的な失敗率の一因とも考えられる。
げっ歯類以外にも、従来とは異なる動物種には利点がある。ハタネズミは、哺乳類のペアボンド形成におけるオキシトシンの役割を解明するなど、社会的相互作用の理解に独自の貢献をしている87。フェレットは、身体的・発達的に人間と似ており88,複雑な社会的・認知的行動をとることから、脳損傷のモデルとしてますます魅力的な種となっている。フェレットは、げっ歯類やウサギとは異なり、白質と灰質の比率がヒトと似ており、大脳皮質が回脳性である。そのため、周産期脳損傷や神経発達障害のモデルとしてのフェレットの有用性は高く、特に治療効果を評価するためのアッセイや行動評価の検証が進んでいる88。実際 2013年に発表されたSeokらの重要な論文では、マウスの外傷およびエンドトキシン血症に対する免疫学的反応は、ヒトのそれをほとんど模倣していないと述べている91。また、ヒツジやブタなどの大型動物は、脳損傷や治療介入の評価、特に新生児HIEの治療に有用な動物モデルとして証明されている92。ブタやイヌは、脳や心臓血管系がヒトと解剖学的に類似していることから、心停止による脳損傷のモデルとして日常的に使用されている93,94。
種を超えた動物モデルの数は増加しており、治療薬の設計者やデザイン担当者は、より幅広い動物モデルのレパートリーを提供する様々な研究者と協力して、治療薬の翻訳や種に依存した、あるいは独立した側面を改善し続けることが必要である。使用する特定の動物種にかかわらず、標準的な考え方は、データが機能的な結果に基づいている場合、意味のある比較ができるというものである。臨床および基礎科学の加齢研究者のコンソーシアムであるGeroscience Networkは、前臨床モデルをヒトに直接関連させるために重要な機能領域を特定した。97 新生児死亡事故の分野は、歴史的に見ても、病気の生理学と治療法への反応の両方を理解するために使用される動物モデルの幅広さという点で最も有望である。終末期HIEに対するTHの開発には、数十年前の窒息死したヒトの新生児における症例報告、成体および新生児ラットを用いたメカニズム研究、子豚を用いた詳細な生理学的研究、そして現在ヒトに使用されているプロトコルを開発するためのヒツジ胎児モデルの使用が含まれている98。2010年にTHが国際的な蘇生ガイドラインに掲載されて以来、新生児マウスを用いたTHのメカニズム研究が発表され、また、人間以外の霊長類を用いて、THと有望な補助療法であるエリスロポエチンとの併用を検討している95,99。このアプローチは、特に急性神経疾患の治療法を開発するための良いモデルになると考えている。このプロセスは、前臨床の「漏斗」と考えられ、治療薬をげっ歯類に適用する前に、治療薬をスクリーニングするための器官型脳スライス培養や脳オルガノイドを用いた試験管内試験の初期作業を含む可能性がある。種を超えた前臨床治療の漏斗は、新しい治療法の開発にかかる時間を長くするが、進化的に異なる複数の種で成功すれば、ヒトへの移植の可能性を劇的に高めることができる。重要なことは、代謝反応や免疫反応の異質性と、各生物種における疾患のモデル化方法の必要な違いにより、漏斗の末端から現れる治療法が十分に堅牢であり、適用される異質な患者集団や臨床環境で成功する可能性が高くなることである。このようなアプローチには、必要なモデルシステムに精通した複数の研究室が緊密かつ慎重に協力することが必要であり、先見の明のある資金提供団体からの大規模な共同研究助成によって促進される可能性がある。
III. 病態生理学的変化のタイミングが重要
根底にある病態生理が治療の介入と効果をもたらすことを知ることと、それらの変化が起こるタイミングを理解することは別の問題である。治療的介入をデザインするには、その治療法が最も有用であると思われるタイミングの知識が必要であり、それには治療法が標的とする基礎的な生理学的変化のタイミングの理解が必要である。このセクションでは、急性の生理的変化、急性疾患から慢性疾患への連続した変化、そして慢性の生理的変化について説明する。また、ほとんどの治療薬は前臨床段階でテストされるため、前臨床段階で疾患の病因と進行をモデル化することの難しさについて考察し、本セクションを締めくくる。
A. 急性神経疾患
新生児のHIE、小児や成人の脳卒中やTBIなどの急性脳障害では、できるだけ早く治療することが目標となる。このような場合、生理機能が治療薬の投与にどのように影響するかを考えることが重要だ。脳への外傷後に起こる分子カスケードは、病因とは無関係に、複雑で時間に依存した多局所的なものである(図3)100。
図3 脳の虚血・再灌流後の生理的側面の位相的事象
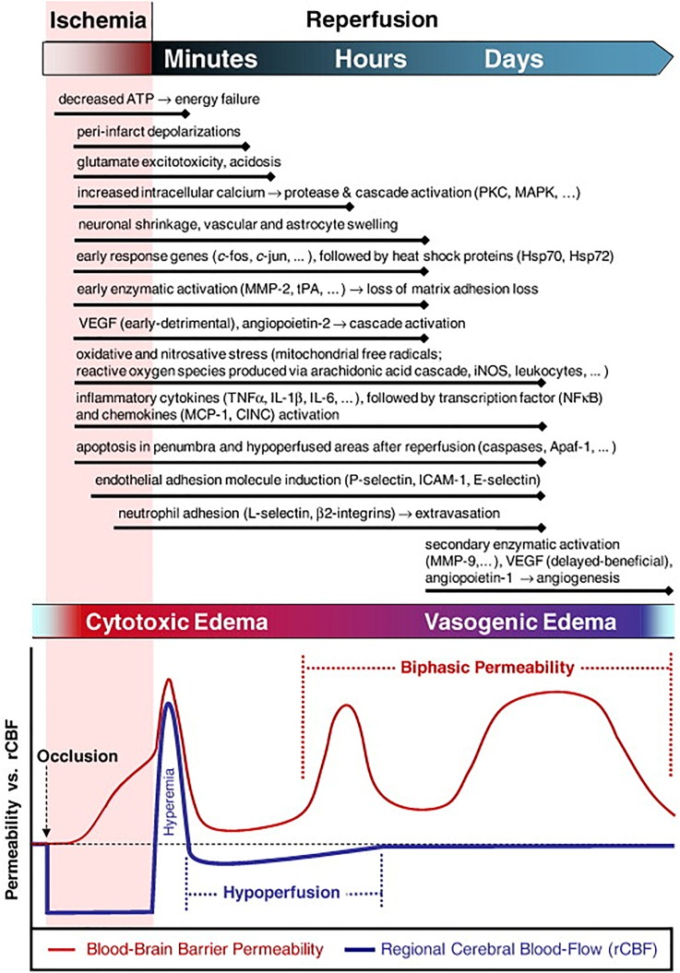
虚血後、再灌流期間中に起こる浮腫、血液脳関門の伝染性、脳血流、炎症、細胞、細胞外の変化の時系列を示す現在の理解。K. E. Sandoval and K. A. Witt, “Blood-brain barrier tight junction permeability and ischemic,” Neurobiol. Dis. 32(2), 200-219 (2008). Copyright 2008 Elsevier.
脳損傷後の急性期には、神経血管ユニット(NVU)の分子変化により、伝染性のある内皮が形成され、複数の相101にまたがる血液脳関門(BBB)の完全性が失われ、脳浮腫が発生する。浮腫は脳内の体液分布と拡散を変化させ、治療薬の分布に影響を与える可能性がある。102 浮腫の体液は、イオン輸送の大量破壊によって引き起こされる浸透圧と静水圧によって、脳実質内のバルクフローを介して拡散する。103 もし、この初期の浮腫段階を捉えるような適切なタイミングであれば、血液や脳脊髄液(脳脊髄液)からの、体液中に「浮遊している」治療薬の移動は、体液のバルクフローによって決定されるだろう。104-106 脳のECS内で効果的に拡散できないことは、ドラッグデリバリーや遺伝子デリバリーの応用において、治療効果の低下と関連している107-109。興味深いことに、脳内の特定の細胞タイプを標的とした治療薬の場合、損傷後、異なる細胞がわずかに異なる時期に細胞性浮腫を起こす。虚血では、エネルギー供給が停止してから5分以内であっても、アストロサイトが最初に膨潤し、その状態は24時間持続する110。ニューロンやオリゴデンドロサイトは、損傷後30分で膨潤し、12〜24時間で壊死する111。このように、治療薬を投与するタイミングを計る際には、ECSや細胞量、標的細胞の取り込みに対する浮腫の影響を考慮する必要がある。
アデノシン三リン酸の枯渇もまた、急性脳梗塞の当面の問題である。損傷時に脳の酸素化と血流が失われることによる一次エネルギー障害に対処するには、損傷が発生するタイミングを知る必要があるため、難しい。そのため、プレコンディショニングに焦点を当てた戦略以外にも、多くの治療法が、炎症、酸化ストレス、興奮毒性カスケードを弱め、二次的な傷害段階でのアポトーシスを減少させることを目的としている。このシナリオでは、タイミングが重要だ。回復や修復を目的とした治療には、治療に対する意図的な反応を満たすエネルギーが必要となる。ミトコンドリアの伝染性が進行しているときに治療を行うと、脳の回復は戻らないところまで来てしまう可能性がある112。エネルギーの必要性と利用可能性の複雑なバランスにおける治療のタイミングの重要性は、THを用いた新生児HIEの分野でよく証明されている113。さらに、グリアを標的とした治療法は、グリア細胞のエネルギー需要の変化をよりよく考慮する必要があるかもしれない。例えば、あらゆる傷害事象に対して組織に常駐して反応する主要な細胞であるミクログリアのエネルギー需要は、これらの細胞がさまざまな病的状態にいつどのように反応し、媒介し、伝播するかを決定する可能性がある114。
B. 連続的に起こる脳環境の変化
傷害や疾患の発生に伴う脳内の細胞、構造、分子の変化は、連続している。急性外傷に対するBBBの破壊は、破壊の重症度、伝染性の程度、BBBの開通期間に応じて、時間的に左右され、不均一である。脳における治療効果が得られない理由としてBBBが最も多く挙げられていることを考えると、この障壁の機能破壊のタイミングと程度を理解することは、工学的な治療介入を行う上で重要である。BBBの破壊は、脳卒中、TBI、急性脊髄損傷の後、特に再灌流が損傷反応の一部である場合には、連続的、単相的、または二相的に起こる可能性がある115,116。BBBの伝染性の増加は、炎症、酸化ストレス、細胞外マトリックス(ECM)の破壊を介して、直接的または間接的に神経毒性を持つ多くの血液成分と関連している122 。したがって、疾患に特化したエンジニアリングの設定では、BBBの機能不全を活用または標的とすることは、複雑なバランスを保つことになる。BBBの伝染性は、しばしば治療効果の重要な要因となるが、BBBの伝染性を高めること自体が、他の標的療法にもかかわらず、疾患の解決を妨げる可能性がある。また、神経障害の根本原因を特定せずにBBBの機能を改善しても、長期的に疾患を大きく改善することはできないだろう。
急性の損傷を受けた後、細胞の構成と機能の変化、およびそれに伴うECMの破壊は、前述したBBBの破壊、浮腫、およびエネルギーの枯渇のサイクルの重要な側面である。慢性神経変性疾患の進行には、中枢神経系(CNS)内の細胞が明らかに失われることが多い。このような細胞の喪失は、ECSの容積や残存構造物周辺の細胞外液の拡散性を劇的に変化させると考えられる。白質や灰白質の減少は、局所拡散性の増加やBBBの障害とともに、拡散能力の向上によって薬物の標的部位へのアクセスを改善することを可能にするかもしれない。細胞損失に加えて、細胞性の変化、特に細胞増殖と瘢痕化は、治療薬が意図した標的に到達する能力に悪影響を及ぼす可能性が高い。ミクログリアやアストロサイトが活性化し、サイトカイン、接着分子、ケモカインによって血管壁を越えて血液や周辺から細胞が流入してくる。ミクログリアとアストロサイトの役割に関するここ数十年の研究で次第に明らかになってきたのは、これらの細胞タイプが病原性と保護性の両方の役割を果たしうるということである。このことは、病因、時期、種、年齢に依存するが、炎症が標的となる場合には、治療効果に大きな影響を及ぼす可能性がある123-125。
脳内の特定の細胞集団が失われたり変化したりするのと並行して、細胞内と細胞外の両方でタンパク質の組成や凝集の変化が見られる126-129。損傷後のECMネットワークの分解に続いて、新たに発現したECM分子の合成と沈着が起こることが多い。これらの変化のメカニズムとタイミングは、急性疾患の病因では十分に理解されていないが、ナノ粒子、修飾された薬剤、遊離の薬剤、および細胞の治療的浸透にECMが影響を与えることを支持する強い証拠がある。さらに、多くの神経疾患で見られるように、細胞内および細胞外のタンパク質やタンパク質斑が蓄積すると、治療薬がECMや細胞質内で拡散し、標的部位に到達する能力が変化する可能性がある。しかし、ECS内のタンパク質の凝集が、細胞の損失や局所的な拡散の変化と相互作用して、治療薬のアクセスを変化させる方法は、まだ解明されていない。治療薬は、浸透性を高めるためにECMを好意的に変化させる薬剤を共同で投与するか、あるいはオフターゲットの相互作用を最小限に抑えてECMをナビゲートするように設計する必要があるであろう。
C. 慢性神経疾患
慢性的な神経変性疾患では、局所的および全身的な病態生理が存在し、治療に対する反応を変化させたり、神経治療薬とともに積極的に標的としなければ疾患プロセスの解決を妨げる可能性がある。治療薬を投与し、細胞の回復や修復に必要な条件を整えるためには、適切に調節されたCBFが必要である。健康な脳では、これはNVUを介した神経血管結合(NVC)によって達成される122。完全に機能するNVUは、脳の活動領域内の代謝需要の増加に対応して、血流を増加させ、それに伴って酸素および代謝燃料(すなわち、グルコース、ケトン体、または乳酸)の供給を増加させる。135-138 慢性神経疾患のもう一つの特徴は、正常な睡眠パターンの乱れであり、これは、特に認知症やADにおいて、神経変性の原因と結果の両方に作用する。そのメカニズムは完全には解明されていないが、睡眠は、脳からの代謝老廃物の排出が行われる重要な時期であると考えられている。139 環境、認知、行動、薬理のいずれかの方法で適切な睡眠を確保することは、幅広い神経疾患に対する治療法の成功を左右する可能性がある。
D. 脳環境の変化を活用するための推奨事項と注意点
活発な損傷や炎症が生じている部位やその近傍の生理的変化は、治療薬の取り込みを促進し、目的とする標的への送達を増加させる可能性がある。この効果は、神経炎症を介した脳損傷の前臨床研究において活用されており、デキストランやエバンスブルーアルブミンの伝染によって測定されたBBBの伝染性は、健常者や偽薬と比較して、治療薬の取り込みを増加させる結果となっている142-144。いくつかの損傷モデルでは、障害されたBBBを小分子および大分子が時間に依存して通過することがある。TBI直後の数時間は、大分子も小分子もBBBを通過することが実証されている145。しかし、TBI後4-5時間以内には、大分子の輸送が制限され、2-3日後まで続く146,147。
BBBの破壊の程度は、サイズ依存性の血管外遊出に影響を与える。興味深いことに、軽度のBBBの破壊は経細胞的な経路と関連しており、低分子の移動を可能にするが、重度の破壊はタイトジャンクションの傍細胞的な消失を介しており、大分子の移動を可能にする。しかし、BBBの伝染性は、使用する画像診断法や血管外色素によって異なることに留意すべきである148。治療デリバリーシステムを構築するには、適切なサイズの薬剤を適切な機会に使用する必要がある。149 多くの研究では、脳を抽出し、脳組織をホモジナイズし、ホモジネートから治療薬を分離することで、脳内に注入された薬剤の割合を測定している。この方法にはいくつかの潜在的な問題がある。ホモジネート中の治療レベルの定量化は,治療薬の脳実質への浸透やNVUからの滲出とは一致しない。脳を抽出する前に血管系を灌流することで,ホモジネート中の治療薬濃度の測定値が,管腔内の量ではなく,組織への治療薬の浸透を示す可能性が高まる。しかし、灌流法は厳密に実施・管理されなければならず、150,灌流が管腔内の人工治療薬の分布にどのように直接影響するかを評価した研究はほとんどなく、限られている。より感度の高い定量化は、血管系を実質から分離して個別に定量化する毛細血管枯渇技術151で達成できる。一般的には堅牢であると考えられているが、これらの研究は時間に依存しており、治療薬が内皮細胞や受容体と相互作用する速度に応じて、治療薬の再分布が起こる可能性がある152。そのため、NVUからの領域特異的な取り込みや滲出を特定するために、治療プラットフォームの空間的な分布を捉える時間依存の定量的な画像分析を含めることが重要になる。
E. 疾患の病因と進行のモデル化における落とし穴
前臨床試験でモデル化される疾患の多くは、実験動物において予測可能かつ標準化された方法で自然に発生するものではないため、何らかの急性のプロセスや遺伝子操作によって開始されなければならない。したがって、前臨床モデルでは、疾患や傷害の始まりや病因が知られている傾向にあり、直接または即時に調査し、標的とすることができる。対照的に、ヒトの急性疾患や慢性疾患では、前臨床研究を効果的な治療法に結びつけるための障壁がある。153,154 これは特に臨床試験の段階で顕著であり、患者の同意、診断を確認するための画像診断、外傷センターや脳卒中センターへの近接性などが重要となる。早産でも正期産でも、ある程度の脳障害を持って生まれたヒトの新生児では、出生前に子宮内感染や断続的なHIを含む未知の期間が存在することが多く155,そのため、正確な時期や障害の直接の原因は不明である。同様に、慢性神経疾患の場合、原因となる因子や曝露の時期は、知られていないか、上流の開始因子ではなく下流の影響を治療することに重点が置かれているため、一般的に考慮されない。
しかし、最も有望な治療法を臨床試験に導入するためには、前臨床試験の実施方法と報告方法の質を大幅に向上させる必要がある156。ARRIVE (Animal Research: reporting of 生体内試験 experiments)ガイドラインやSTAIR (Stroke Therapy Academic Industry Roundtable)で提案されている方法論の改善は、特に急性脳卒中の治療法の翻訳を支援するために開発されたものである157,158。これらのガイドラインは、少なくとも10年前から存在しているが、前臨床研究者が一貫して使用しているわけではなく、また、学術雑誌が施行しているわけでもない。このような状況にもかかわらず、THが臨床での標準治療となっている損傷をモデルにした場合でも、損傷と治療後の体温の縦断的な測定は定期的に行われていない160。これは、疾患の生理学を理解することで、有望な治療法が臨床で成功する可能性を最大限に高めることができる重要な側面のひとつである。
慢性疾患では、傷害のタイミングと性質が一般的にはわからないため、開始因子そのものではなく、下流のプロセスが臨床前にモデル化される。これは、MSだけでなくADでも特に顕著で、前臨床モデルとして最もよく用いられるのは実験的自己免疫性脳脊髄炎(EAE)である。MSのEAEモデルは主にマウスで用いられ、全中枢神経系ホモジネート、プロテオリピッドタンパク(PLP)ミエリン塩基性タンパク(MBP)ミエリンオリゴデンドロサイトタンパク(MOG)などの中枢神経系抗原をアジュバントと一緒に乳化して動物に接種する161。臨床応用されている疾患修飾薬のほとんどはEAEモデルで成功しているが、MSの長期的な進行と死亡率を有意に変化させるMS治療薬はまだ存在していない162。そのためには、MSのリスクや疾患の進行に関連する自然史や環境への曝露を含むモデルが必要である。161 ヒトのMSのような疾患を真にモデル化し、理解するためには、白質の初期損傷(EAEにおける中枢神経系抗原の注射によりモデル化)脳の相対的な免疫特権の喪失(BBB伝染性を含む)免疫活性化(EAEにおけるアジュバントによりモデル化)を引き起こし、脱髄病変をもたらす全身性自己免疫反応が起こる原因は何かを問うべきである。
ADの前臨床モデルでも同様の問題がある。Aβやリン酸化タウの蓄積を標的とするために、これらのタンパク質を過剰に発現させたトランスジェニックマウスモデルは、前臨床AD研究の主流となっている163。蓄積したAβ斑やタウ神経原線維変化を除去する方法に注目するのではなく、そもそもこれらのタンパク質が蓄積する原因となる広範な曝露を調べることで、より良い結果が得られるかもしれない。神経疾患のさまざまな動物モデルでは、単一の下流の病理学的プロセスに焦点を当てることで、そもそも疾患を引き起こす重要な上流のプロセスを確認したり調査したりすることがほとんど不可能になっている。これが、これらの動物モデルがヒトの病態生理の重要な側面をモデル化できない理由であろう。
このような問題は、慢性神経疾患の前臨床モデル全体に一貫して見られ、これはALSやASDの研究分野でも同じである。重要なのは、遺伝子操作によって得られたモデルに関連することだが、特定の遺伝子のノックアウトやノックダウンがネットワーク全体に及ぼす影響についてはほとんど知られていないことである。同様に、近年普及しているCRISPR-Cas9システムを含む遺伝子操作の方法は、対象となる遺伝子以外にも重大な悪影響を及ぼす可能性がある165。また、結果として生じる表現型を変化させるオフターゲット効果があるかもしれないが、トランスクリプトーム、プロテオーム、メタボローム全体の特性が明らかにされていない場合、これらの効果は他の遺伝子やエピジェネティックな変化ではなく、遺伝子そのものに起因するものと考えられる。166,167 このことは、一つの動物コロニーの中で、遺伝学と環境の両方に基づいて急速な変化が起こる可能性があることを示唆しており、その結果、特定の遺伝子操作に対する適応が起こるが、それを予測することはほとんど不可能であり、結果として得られたデータを解釈するためには、定期的に完全な特性評価を行う必要がある。
神経疾患の動物モデルの開発と維持には非常に複雑な作業が伴うことは確かであるが、治療法の臨床への導入を改善するためには、現在のアプローチのこうした限界に対処するか、少なくとも制御する必要がある。生理学に基づいたアプローチ、特に慢性的な神経疾患に対するアプローチでは、単に人工的な遺伝子操作や急性の刺激的な出来事を作り出すことで下流のプロセスに焦点を当てるのではなく、そもそも何が病気の原因なのかを理解する必要がある。だからこそ、病気の治療には工学的なアプローチが重要だと考えている。単純化されているが、エンジニアは、システムが故障したときに、その故障をどうやって直すかということだけではなく、なぜ故障したのかを理解して、二度と故障しないようにするための訓練を受けている。
IV. 全身の生理学と真の病因論を取り入れることの重要性
生物学的領域ごとに異なる正常な生理学的プロセスに加えて、たとえ治療介入が局所的な病態生理学的設定を対象としていたとしても、存在する可能性のある全身的な生理学的変化を認識することの重要性も強調しなければならない。
A. 全身性生理と局所性生理
急性期および慢性期の神経疾患を統合的に治療するためには、全身の生理学を理解することが必要であることを示す証拠が増えている。このことは、特に経口投与やその他の経路で人工治療薬を全身に投与する場合には、末梢の免疫系や消化器系に当てはまる。多くの神経疾患の発症には、腸の生理機能と腸内細菌叢が重要な役割を果たしていると考えられている。腸内細菌叢は、PD、AD、MS、ALSなどの慢性神経変性疾患の病因に関与していると言われている。迷走神経の活動は、全身の炎症を抑えるだけでなく、正常な胃腸機能を許容する効果があると考えられている171,172。急性の神経損傷は、腸の機能にも悪影響を及ぼすようである。多くの動物モデルやヒトにおけるTBIでは、タイトジャンクションの機能低下により腸管伝染性が亢進している173。 -176 このことから、急性神経障害の治療法を設計する際には、腸の機能やそれが薬物の取り込みや代謝にどのように影響するかなど、傷害に対する全身および末梢の反応を考慮しなければならないことがわかる。慢性的な神経疾患の場合は、腸内細菌叢や患者のライフスタイルにおけるその他の環境的側面がさらに複雑さを増すと思われる。
内分泌系と自律神経系は、中枢神経系の正常な機能を必要とする全身生理の重要な原動力であるが、脳の傷害に対する抵抗力や修復力にも直接影響を与える。下垂体の機能低下や不全は、TBI後によくみられ、遅発性のホルモン欠乏は、損傷後数ヶ月で発現することが多い。180,181 研究によっては、これらの損傷が生殖腺、副腎、甲状腺ホルモン軸に及ぼす影響がすべて記述されている。182 神経学的転帰におけるこれらのホルモンの重要性を考えると、これらの軸の変化は特に重要である。ほとんどの神経変性疾患において、性ホルモンであるテストステロン、エストラジオール、プロゲステロンは、認知や生活の質に関与するとともに、中枢神経系内の細胞の生存や修復に機構的に関連していると考えられている。エストラジオールもまた、前臨床モデルにおいて、抗炎症作用や神経原性作用など、神経損傷後の栄養因子と考えられている185,186。 187 男性では、特に、テストステロンの低下は、認知機能や抑うつ症状の悪化と関連しており、テストステロンを補充することで、逆U字型にテストステロン低下者の認知機能や抑うつ症状が改善されるようである188。これは、テストステロンの低下が認知機能の低下の原因ではなく、認知機能とテストステロンの低下が共通の疾患プロセスに影響されていることが原因と考えられる。
189 下垂体からの甲状腺刺激ホルモンの分泌が少ない場合も多い場合も、認知機能の低下やADのリスクが高まることと関連している。しかし、潜在性甲状腺機能低下症の高齢者に甲状腺を補充しても、認知機能は改善されない192。全体的に見て、十分な代謝率とミトコンドリア機能のためには、ある程度の量の甲状腺ホルモンが必要であることはほぼ間違いないが、甲状腺ホルモンのレベルが上昇すると、栄養供給が減少したり乱れたりする中で、代謝需要が増大する可能性がある。性ホルモンと神経学的転帰と同様に、甲状腺ホルモンの十分な存在を確保することは重要であるが、根本的な病気のプロセスを解決せずに補充しても、それ以上の改善は望めない。
ホルモンレベルの乱れは、神経変性疾患の結果であると同時に、神経機能を最適化するために必要な要素でもある。甲状腺ホルモン、性ホルモンともに、低下している場合には、慎重に補充することが、疾患の転帰と生活の質の両方にとって重要であり、また、回復に必要であるという直接的な理由から、あるいは、欠乏が認知機能などの結果変数と混同するという理由から、治療的介入の成功につながる可能性もある。しかし、慎重に行わなければ、性ホルモンや甲状腺ホルモンの補充によって心血管疾患のリスクが増加することや、ある種の癌が発生することを覚えておく必要がある。
B. 相関関係と因果関係
神経疾患の病態生理とそれに続く治療ターゲットを研究する上で、重要でありながらも極めて重要な点は、治療の根本原因と考えられるメカニズムと、基礎的な疾患プロセスの顕在化したバイオマーカーとを見分けることである。神経科学研究における最も顕著な例の一つは、アミロイドカスケード仮説(ACH)であり、AD治療におけるアミロイドベータ(Aβ)プラークの同定と標的化である196。ADの病態生理にAβ蓄積が関与している可能性を示す遺伝学的証拠198や、ADのAβを標的とするためには、疾患の進行に関連して薬剤を投与するタイミングを早めることが重要であるとする意見199があるものの、現在では、より広い範囲に焦点を当てる必要があるとする声が増えてきている200。 -さらに、Aβの蓄積は、神経炎症や有害物質への曝露に対する反応であることや、Aβには抗酸化作用や抗菌作用があることなどが明らかになってきている203。 -Aβの著しい蓄積は、それ自体が障害となる可能性もあるが、207 Aβは治療標的というよりも、神経細胞のストレスの顕在化したバイオマーカーであり、おそらく保護反応でさえあると考えられる。Aβの蓄積そのものを標的とすることや、神経原線維のもつれにおけるタウタンパク質の下流への蓄積に注目することは、おそらく、神経細胞のストレスや炎症の原因を特定し、理解するために再考されるべきである。仮にACHが正しいとしても、その真偽についてはいまだに大きな議論があることから、ADの基礎となる生理学をより広く調査する必要がある。また、より広い意味では、疾患や生理学的環境の背景を考慮せずに、単一の分子プロセスを標的とした治療薬を開発することは、翻訳可能な治療薬を生み出す可能性の低い戦略であることを示唆している。
V. 臨床に移行する際の高レベルの疾患モジュレーターとインターベンション
疾患の回復や治療法の開発を検討する上で重要なのは、長期的な神経疾患の負担や患者の転帰を改善することが示されている無数のライフスタイルや環境因子である。睡眠、食事、運動など、これらの治療法の多くは、その効果のメカニズムがまだ完全には解明されていないにもかかわらず、神経疾患の長期治療に使用することを支持する重大な疫学的証拠があり、臨床的にも増加している。208 「高レベル」の介入は、神経学的損傷を受けた人のための長期的な「ホリスティック」ケアに組み込まれるようになってきているが、正式なケアプランの外で患者自身が採用することもある。そのため、これらの介入が十分に考慮されていない場合、治療試験の結果に支障をきたす可能性がある。神経疾患の転帰を改善するハイレベルな戦略には、睡眠、食事の変更、運動とリハビリテーションなどがある。また、社会経済的地位や社会的相互作用の影響は、初期の重症度にかかわらず、神経学的転帰を劇的に変化させる可能性がある。これらの要因を詳しく説明することは本レビューの範囲外であるが、神経疾患の病態生理学的側面を調節するためにこれらの要因を取り入れる可能性があることを図4に示する。
図4 神経疾患の病態生理学的変化の因果ループ図
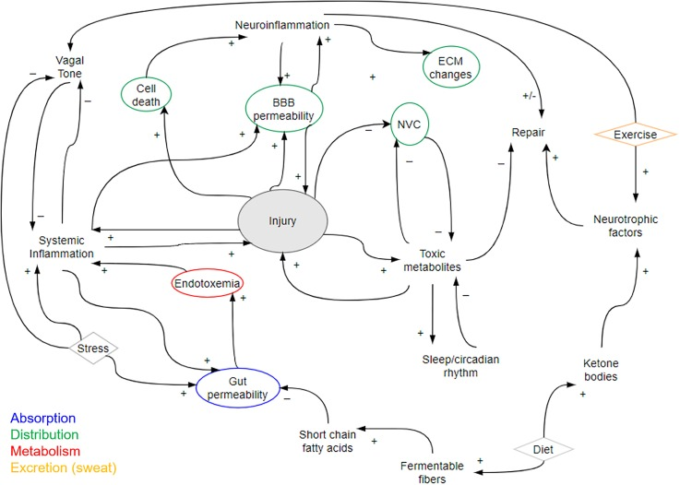
この図では、睡眠、食事、運動など、神経疾患の側面をプラス(+)またはマイナス(-)に調節する可能性のある要因がいくつか強調されている。また、病態生理学的な観点から、治療薬の吸収(青)分布(緑)代謝(赤)排泄(オレンジ)に影響を与える要因を示している。食事などの高度な介入が疾患にどのような影響を与えるか、その一端を例に挙げている。また、正常なホルモンや自律神経の生理機能は、局所的および全身的な損傷と回復の両方に許容的な影響を与える。
疾患固有のメカニズムや治療に対する反応に加えて、高レベルの要因を取り入れた複合的なモデルでは、損傷後の最適な神経学的回復、修復、機能には大きく分けて3つのことが必要であると考えられる。すなわち、
- (i)必要な栄養素、ホルモン、酸素(NVU経由)が存在すること、
- (ii)重金属、過剰なコルチゾール、血液中のタンパク質、蓄積されたAβやタウなどの神経毒性物質が存在しないこと、
- (iii)ECMや機能的なBBBを含む健康的な環境、さらには本人を支える広範な社会環境であること、
である。これらの要素の一つ一つが確実に解決されなければ、治療法の臨床への移行はうまくいかないかもしれない。しっかりとした臨床試験は行われていないが、疾患の病因に対する多角的な生理学的アプローチが有益であることがわかっている。例えば、ADの多くのケーススタディでは認知機能の低下が回復し、MSでは気分や実行機能が改善している209-212。実際には、長期的に最良の結果を得るためには、複数の介入が必要であると考えられる。患者の利益を最優先に考えれば、それぞれの介入が最終的な結果にどのように、またどの程度貢献するかを正確に知ることなく、複数の介入が(少なくとも当面は)実施されるかもしれない。このことは、複数のアプローチを1つの治療法に取り入れる際に、従来のランダム化比較試験(RCT)の構造が持つ欠点を浮き彫りにしている。要因試験では、食事療法、運動療法、睡眠療法、薬物療法などの介入を複数組み合わせて実施することができるが、そのためには多数の患者が必要となり、臨床試験のインフラも整備する必要がある。しかし、セルフモニタリングや自動化されたスマートフォンアプリを利用して、生活習慣に基づいた介入のモニタリングやパーソナライズを行うとともに、例えばジャストインタイムの適応型介入によってアドヒアランスを向上させるなど、デジタルヘルスアプローチの最新技術が急速に発展していることから、何らかの支援が得られるかもしれない。COTの開発は、制御システム工学から来ており214,ADやTBI後の認知機能テストのように、定期的かつ容易にモニターできる単一のアウトプットに焦点を当てている。「スモールデータ」アプローチ215 を用いて、患者の全体的な評価を行い、ホルモン、睡眠、食事、医薬 品などの個別の介入経路を、各患者にとって「最も低いところにある果実」の可能性が高い順に 適用することができ、週1回の認知機能検査が最適化される要因となる。従来のRCTのように6カ月間の静的な介入の結果を待つのではなく、治療法の段階的な変更(またはその他のイベント)による有意な改善または悪化を迅速に特定し、(必要に応じて)対処することができる」と述べている。
VI. 生理学に基づいた脳への治療介入の成功例
前述したように、新生児神経科学の分野は、生理学的介入に関して際立っており、生理学が非常によく説明されていることが多く、治療法は臨床試験に移行する前に複数の種やモデルでテストされる。急速に成長しているナノテクノロジーを用いた治療法の分野では、ナノ粒子の設計を脳の生理学や対象となる疾患と統合することが成功の鍵となる131,216。成功するためには、ナノ粒子がBBBを克服または横断し、脳内ECSに浸透し、健康な細胞を残して特定の疾患関連細胞に作用または取り込まれなければならない。131ここでは、工学的に設計されたデンドリマーナノ粒子プラットフォームの成功に焦点を当てる。デンドリマーと薬剤のプラットフォームは、複数の生物種、複数の炎症性脳損傷モデルにおいて、脳への送達の障壁を克服する能力を総合的に評価した結果、現在、翻訳が困難な小児人口を対象とした臨床試験に進出している。
デンドリマーナノ粒子は、球状で繰り返し分岐した高分子構造体で、3~10nmのサイズスケールで、高い調整性とテーラーメイド性を備えている。217,218 ポリアミドアミン(PAMAM)デンドリマーは、炎症を伴う脳疾患、特に新生児や小児を対象とした疾患においても広く研究され、評価されている。新生児の脳疾患を治療するためのデンドリマー医薬品を開発する際には、疾患の生理学的背景を考慮して多くの設計要素が検討された。Sec.IIIで述べたように、急性脳損傷や神経発達障害では、BBBの破壊、細胞の活性化、ECMの変化が起こる。これらの変化は、ナノ粒子の物理化学的特性を設計し、病態生理を特徴づけることで、ナノ治療薬の効果的な取り込みと部位特異的なターゲティングを達成するために活用することができる。
ナノ粒子の物理化学的特性は、疾患に関連した生理学的変化を最大限に克服するように調整することができる。219-221 第4世代のヒドロキシル基修飾(G4-OH)PAMAMデンドリマーは、サイズが4nmで、循環半減期が30分から 1時間と短いものの、静脈内投与により疾患のある新生児の脳に容易に取り込まれた。デンドリマーのサイズを第6世代まで大きくすると、循環時間が長くなり、損傷した脳に取り込まれる222。しかし、脳に取り込まれるためには、BBBが破壊されなければならない。BBBを通過した後、G4-OHデンドリマーを使用することで、脳の細胞外空間での拡散と浸透が可能となり、分布が拡大し、疾患のミクログリア細胞へのアクセスが可能となる220 水酸基の機能性が重要であり、アミン修飾デンドリマーを静脈内投与した場合、BBBが障害されている部位であっても、脳実質に浸出しない。同じサイズのアミン修飾デンドリマーを脳実質に直接注入しても、脳ECSを貫通せず、ミクログリア細胞にも取り込まれない220。カルボキシル基を使用すると、ヒドロキシル基修飾プラットフォームと比較して、脳実質への滲出が遅れ、ミクログリア細胞における細胞内分布223がより一定になる。また、表面電荷の制御に基づいて最大限に分布する能力は、神経膠腫モデル224や羊膜内投与でも示された221。
ミクログリア細胞へのアクセスが向上することは、炎症の抑制を目的とした治療法にとって特に重要である。93,142,143,217,220-222,225-229 G4-OH PAMAMデンドリマーを含むナノ粒子は、損傷を受けた脳の領域にある活性化したミクログリアに速やかに取り込まれる能力があることを示す文献が増えてきている。PAMAMデンドリマーが蓄積する細胞タイプはミクログリアが圧倒的に多いが、アストロサイト、ニューロン、オリゴデンドロサイトへの細胞特異的な取り込みは、病因や投与のタイミングによって異なる。
表 I. 炎症を媒介とする傷害の治療を目的としたデンドリマー-NACの有効性に関する研究の概要
NACと結合したPAMAMデンドリマー(D-NAC)は、さまざまな動物モデルおよび動物種で試験されている。表には、疾患モデルと対応する表現型、関連する場合は系統を含む動物種、疾患の病因、D-NACの投与経路と頻度、および有効性に関連する主要な結果が記載されている。PAMAMデンドリマープラットフォームとNAC以外の薬剤、および異なる疾患モデルを用いたその他の有効性研究については、別の場所でレビューしている216。
| 疾患モデル | 種 | 病因 | 臨床表現型 | 投与経路 | 結果 | 参考文献 |
|---|---|---|---|---|---|---|
| 脳特有の傷害または病気 | ||||||
| 母体の炎症を介した脳性麻痺 | ウサギ | 妊娠日(G)での子宮内リポ多糖(LPS)投与28 | 脳性麻痺(CP) | P1の単回静脈内投与 | CPを有する新生ウサギの脳における活性化ミクログリアおよび星状細胞における選択的局在化。ただし、健康な対照ではない。抑制された神経炎症; CPキットの運動機能の劇的な改善 | 143 |
| 虚血性白質損傷 | マウス(CD-1) | 生後日における片側頸動脈結紮(P)5 | 脳室周囲白質軟化症(PVL) | P6またはP10の単一の腹腔内 | 「好ましい」抗炎症反応に影響を与えずに、損傷後9日までの「有害な」抗炎症反応の持続的な減衰。白質損傷の減少を示唆する髄鞘形成の改善 | 142 |
| レット症候群 | マウス(C57B / 6) | mecp2遺伝子のノックアウト | レット症候群 | 週2回の腹腔内 | Mecp2-nullマウスのミクログリアに局在しますが、年齢を一致させた野生型同腹仔には局在しません。Mecp2-nullマウスの行動結果の有意な改善が、生存ではありません。 | 226 |
| 低体温心停止 | 犬 | 閉じた胸の心肺バイパスとそれに続く冷却(18°Cまで)、2時間の低体温心停止 | 心停止による脳損傷 | 単回静脈内ボーラス注入 | D-NACとD-VPAの併用療法は、遊離薬物の10分の1の用量で24時間の神経学的欠損スコアの改善を示しました。有害な副作用が大幅に減少しました | 93 |
| 低酸素虚血 | マウス(CD-1) | P7での片側頸動脈結紮とそれに続く低酸素症 | 新生児HIE | P7またはP8の単回腹腔内投与 | 取り込みは、すべての細胞タイプで脳損傷と相関していました。CD68 +ミクログリアを除いて、取り込みは低体温によって阻害されませんでした。ミクログリア、アストロサイト、ニューロンのターゲティングが達成されました | 227 |
| 炎症が仲介的な役割を果たす他のモデル | ||||||
| 子宮内炎症 | マウス | 胚の日の子宮内LPS(E)17 | 早産 | 単一の母体の腹腔内 | 早産率の大幅な低下; CD8 + T細胞浸潤の減少を伴う胎盤免疫プロファイルの変化; 改善された神経行動学的結果; 子孫における胎児の神経炎症の減少と長期のミクログリアの活性化 | 225 |
| 副腎白質ジストロフィー(ALD) | ヒト単球 | 健康なヘテロ接合体キャリア、副腎白質神経障害、および脳ALD患者由来細胞 | XリンクALD | 局所(invitro) | TNFαおよびグルタミン酸分泌の用量依存的な減少; cALD患者マクロファージにおける補充された総細胞内グルタチオンレベル | 229 |
| 壊死性筋膜炎(NEC) | マウス(TLR4ノックアウト付きC57B / 6) | NECの乳児から分離された腸内細菌を含む調合乳の強制経口投与。 | NECおよびNECによる脳損傷 | 経口投与 | 新生児マウスにおけるNEC関連の神経機能障害の予防 | 228 |
デンドリマー-N-アセチルシステイン(NAC)のこのような包括的かつ広範な前臨床研究に基づき、FDAはこのプラットフォームのヒトでの調査を承認した。現在、N-アセチルシステイン(NAC)を結合させたPAMAMデンドリマープラットフォームは、安全性、忍容性、PKについて第1相試験が行われており、230は、希少で致命的な希少疾患である脳性副腎白質ジストロフィーの患者に次の段階で使用される予定である。ナノ粒子プラットフォームの小児への導入の成功は重要であり、がん以外の適応症ではこれまで達成されたことはなかった。しかし、これを達成するためのプロセスは決して小さなものではなく、治療介入と成功を導くために疾患の生理学を利用することの重要性を浮き彫りにしている。さらに、このデンドリマー薬物複合体の翻訳過程では、炎症を伴う疾患の複数の動物モデルを活用し、それぞれのモデルに性差と発育に適した年齢を考慮している。神経発達疾患の病因は複雑であり、疾患の進行は患者ごとに異なることを考えると、疾患の特徴を持つ複数のモデルで治療プラットフォームを評価することは、実際の臨床環境をよりよく再現することになる。
VII. 結論と今後の展望
2002,ユーリ・ラゼブニクは、生物学の分野で一般的に見られる還元主義的、機械論的なアプローチを、複雑な工学的問題(壊れたラジオの修理)に適用し、生物学者のアプローチが失敗する可能性が高い理由をエレガントに説明した208。
神経疾患に対する薬物送達の改善の分野では、多くの課題と機会が残されている。231 神経疾患は複雑な領域であり、治療法や治癒の可能性を特定するために、単なる分子経路に還元することはできない。私たちは、この複雑さを認識し、病気の幅広さと繊細さに対応する治療技術を開発し続けなければならない。しかし、時間とコストをかけずにこれを実現するには、疾患の生理学に基づいて治療法を開発する必要がある。そこで、本稿では、前臨床研究の初期段階で疾患生理学の真の範囲を考慮または把握していないと、治療法の翻訳が失敗する可能性が高まるという事実を強調することを目的としている。また、翻訳の可能性を高めるために、治療法開発に組み込むことができる、また組み込むべき、正常および病的な生理学的プロセスをいくつか紹介する。可能性のあるすべての要因を考慮することは複雑であるため、基礎科学者や臨床科学者との必要な協力関係があれば、生物医学に重点を置いた工学研究室でもすぐに実行できるいくつかの出発点を表IIに示した。
表II. 疾患指向の工学的アプローチを実施するための提案された方法
視点の各セクションでは、バイオメディカルに特化した工学研究室が疾患指向の工学的アプローチを実施するために、実行可能な重点分野を示している。また、これらの項目を研究室でどのように実施できるかの例も示している。最も関連性が高いと思われる部分では、共同研究の重要性を強調している。
| 疾患指向の工学的アプローチの実施 | 実行可能な重点分野 | 例 |
|---|---|---|
| 通常の生理学は実験計画を推進するはずです | すべての研究に男女を含める | 結果の性依存性が確立されるまで、治療研究は性的二形性を説明するために力を与えられるべきです |
| 年齢および発達に適したモデルを使用する | 高齢動物の神経変性疾患の治療法を評価します。または、早産と満期の脳損傷の治療法をテストする場合は、影響を受けやすい脳構造が人間の発達と一致することを確認してください | |
| 同じ疾患モデルの複数の種(利用可能な場合)で評価する | 用語HIEの治療的低体温療法は、クリニックに翻訳される前に、ラット、ブタ、およびヒツジのHIモデルで成功することが示されました。 | |
| 病気の生理学は治療介入を指示する必要があります | 血中ホルモンレベル(LC-MSまたはELISA)および腸透過性(組織学)を介してホルモンおよび腸機能をそれぞれ評価します | 実験的TBIでは、腸機能が急激に悪化し、ホルモン機能が慢性的に悪化するため、これらを説明するために結果を統計的に調整する必要があります。あるいは、腸の透過性が高い場合、治療的介入は経口送達のタイミングをとることができます |
| 結果評価のためのマルチスカラー要因に焦点を当てるb | MSでは、分子レベルと細胞レベル(免疫応答)、臓器全体のレベル(画像、組織学)、および臓器全体のレベル(行動、死亡率)を確認します。 | |
| 病態生理学的変化のタイミングが介入提供の成功を決定する可能性がある | 治療プラットフォームの提供が臓器および細胞/細胞外レベルでの病理学的変化によってどのように影響を受けるかを評価します | 疾患発症後のさまざまな投薬時点での分布、拡散、および細胞取り込みを定量化して、送達を損なう(すなわち浮腫)または改善する(すなわちBBB透過性)可能性のある代償性の病理学的変化を説明する |
| 発病後の適切な時期に病理学的変化を活用して、最大限の送達を実現します | ADは傷害または感受性の領域で慢性BBB障害を持っているため、長期循環している治療法は、障害の程度とメカニズム(すなわち、内皮の喪失またはトランスポーター発現の変化)に基づいて、この透過性の増加を利用するように設計できます。 | |
| 再現性と翻訳 | 同じ表現型をもたらす可能性のある異なる病因を説明する複数のモデルでテストする | 脳性麻痺は、低酸素症(虚血、感染、または炎症)に起因する可能性があるため、運動機能の喪失をもたらすこれら3つの病因のモデルで治療法を評価することが不可欠です。 |
| 複数のラボでの再現実験A | 同じ種で同じモデルに取り組んでいる共同作業者と提携するか、異なる種で同じモデルを持っている誰かと協力します | |
| 関連する場合は、複数の関連する病状を含める | 成人の脳卒中をモデル化するためにMCAOを実行する場合は、高血圧、肥満、糖尿病などの病因を含めます |
aこれらの対策を成功させるためには、共同作業が重要だ。
b前臨床試験から臨床試験への最適な移行のためには、前臨床モデルでもヒトでも同じように多面的な評価を行う必要がある。
最初のステップは、治療的介入に対する性差のある反応があるかどうかを判断するために、治療的研究に両性を含めることであるが、これは「低空飛行」の果実である。性差が要因であるかどうかを効果的に判断するためには、複数の尺度にまたがる機能評価を少なくとも3つ選ぶことが推奨される。例えば、ミトコンドリア機能を測定することは、免疫調節、代謝の健康、ホルモンプロセスの統合に影響を与える指標として機能する。ミトコンドリア機能は、行動学や組織学、あるいは何らかの細胞ベースのイメージングと一緒に評価することで、細胞プロセスと臨床的に意味のある結果をよりよく統合することができる。これらの研究を行う際には、年齢と性別を一致させた動物と未治療の病気の動物を対照とすることで、治療結果に影響を与える病理学的特徴の基本的な変化を得ることができる。Sec.III Dで述べられているように、治療薬の分布は、定量的および定性的な方法を用いて総合的に分析され、病理学的特徴の中での治療薬の位置を決定する必要がある。病理学的プロセスを適切に利用し、治療薬の局在性を正確に評価することで、システムを過剰に構築する必要性が減り、デザインコントロールの数や必要な動物の数を減らすことができる。例えば、G4-OH PAMAMデンドリマーは、障害されたBBBを通過して脳実質に浸透し、活性化したグリア細胞に選択的に取り込まれる。これは、BBB貫通のためのターゲティングリガンドやミクログリア特異的取り込みのための細胞ターゲティングリガンドを必要とせずに起こる。治療効果を最大化するために脳内皮細胞への局在化が必要な場合は、まずG4デンドリマーのOH-修飾をNH2-修飾に変更することが考えられる。性依存的な治療効果と治療部位が明らかになったら、次のステップとして、同じ疾患のモデルや他の種の疾患プロセスの重要な特徴を示すモデルの共同研究者を特定し、病理学的プロセスや治療効果が進化の分岐点の広い範囲で反映されるかどうかを判断することになる。この段階では、複数の研究室で再現することも可能である。
工学的アプローチは、病気をシステムレベルで捉え、他の部分や、環境、ライフスタイル、遺伝、社会文化的基準など、健康に影響を与える他のシステムとの関係性の中で、全体を構成するパーツとして分析できるようにすることで、将来の成功に重要な役割を果たすことになるであろう。しかし、そのためには、エンジニアは、病気の生理学的な側面に精通し、人間の「運用」面への貢献度を知るために、病気の各構成要素について十分に理解するために、生物学に没頭することを推し進めなければならない。疾患の負担が増加し続ける中、私たちは生物学的理解の深化を継続的に取り入れるために、アプローチとエンジニアリングを適応させなければならない。私たちは、工学と基礎科学の間のコミュニケーションと協力を促進し、利用可能な動物モデルと疾患集団からの生理学的データを幅広く活用し、それらを複数のレベルで個人と疾患に合わせた介入を含む治療アプローチに統合することで、これが可能になると信じている。
