Contents
コロナウイルス CBD・THC
www.liebertpub.com/doi/10.1089/acm.2020.0144
自己免疫疾患
一般的に、CB2の役割は、特に急性の自然免疫応答に関しては、CB1の役割に比べて十分に解明されていない。CB2の活性化は、免疫応答を抑制する細胞内経路と関連している。このため、CB2アゴニストは、T細胞のメカニズムを介して抗体産生を抑制することで、自己免疫疾患の治療薬として期待されている。
自然免疫応答
自然免疫応答は非特異的なものであり、化学的・細胞的メカニズムによって感染の拡大を防ぐことを目的としている。マクロファージや樹状細胞の表面に発現するToll様受容体(TLR)は、一般的に保存されている病原体関連の分子パターンを認識する。認識されると、(サイトカイン放出を介して)炎症性シグナル伝達カスケードがトリガーされ、最終的にはリンパ球の関与(適応免疫)が決定されます。サイトカイン放出は、ECS によって影響を受けることが知られているいくつかの経路によって媒介される。NF-κB、MAPK、および JAK-STAT.7
THCは適応免疫応答を損なう
カンナビノイドは、単球細胞培養や急性感染症の動物モデルにおいて、主に TLR4 誘導活性化の阻害を介してサイトカイン産生を阻害することが示されています。さらに、THCはCB2を介してT細胞の活性化に必要なマクロファージの共刺激シグナルを阻害し、適応免疫応答(抗体産生と免疫記憶)を損なうことが示されている。
TNF-α
ECSの生物学的ネットワークのシステムベースの解析により、腫瘍壊死因子α(TNF-α)がネットワークの主要なノードの一つであり、他のシグナリングユニットに接続するユニットであることが明らかになった。
2003年から2013年までに発表されたデータを用いて、研究者らは、2つの主要ECBに接続する要素(タンパク質受容体、ECB、および他のリガンドを含む)のデータベースを構築した。AEAと2AGの2つの主要ECBに接続している要素をデータベース化した。
ノードの接続性を計算した結果、TNF-αはECSシステムのトポロジーの中で最も接続性の高い8つのノードの1つであることが明らかになった。TNF-αは、マクロファージ細胞を活性化することにより、プロ炎症性サイトカインカスケード(主にNF-κB経路を介して)のマスターレギュレーターとして極めて重要な役割を持つ多元的なサイトカインです。このように、TNF-αは免疫細胞の急性期反応を促進するために重要であり、ECSシグナル伝達に中心的な役割を果たすことが示されている。
COVID-19における誇大広告
大麻がCOVID-19関連サイトカインストーム(疾患の進行中に起こる致命的な免疫異常)を「治療する」ということでメディアで誇大宣伝されていることがある。急性ウイルス感染症とカンナビノイドに関するヒトのデータは乏しいが、in vitroとin vivoの研究では、ウイルス性インフルエンザの病気における免疫抑制におけるカンナビノイドの役割にいくつかの光を当てている。
NK細胞の減少
例えば、減衰型インフルエンザAに感染したマウスに、腹腔内(IP)THC(75mg/kg;野生型対CB1/2ノックアウト)を投与したところ、野生型マウスの気管支肺胞洗浄液中のCD4+細胞(CD8+細胞ではない)の割合が増加し、ナチュラルキラー(NK細胞)の割合が減少した。
その結果,野生型マウスの気管支肺胞洗浄液中のCD4+細胞(CD8+細胞ではない)の割合は増加し,ナチュラルキラー(NK)細胞の割合は減少したが,ノックアウトマウスの気管支肺胞洗浄液中のCD4+細胞(CD8+細胞ではない)の割合は増加した。
また、野生型マウスではインターロイキン(IL)-17産生NK細胞(感染した肺上皮細胞を標的にして死滅させるために必要な細胞)がTHCによって有意に抑制された。さらに、THCはマクロファージや樹状細胞が肺に移行する能力を抑制した。
この効果は野生型マウスでのみ観察された。機能的には、THCはまた、ウイルス感染に対する免疫応答において重要なリンパ球サイトカインであるインターフェロンγ産生を減少させた。
ウイルスの複製や疾患病理の増加
カンナビノイドは、ある種の慢性ウイルス感染症(中枢神経系に侵入する)では治療戦略になるかもしれないが、他のウイルス研究では、ウイルスの複製や疾患病理の増加が示されている。
これらのデータは、健康な免疫応答に必要な細胞集団がTHCによってCB1/2依存的に影響を受け、抗原提示細胞の肺への移動、その後のサイトカイン産生、および健康な適応免疫能のためのT細胞応答に必要な抗原提示を阻害することを示している。
以上のことから、インフルエンザに対する宿主免疫の抑制がこのマウスモデルで実証されたが、THCの用量は超生理学的用量でIP投与されたことに留意すべきである。
タバコの喫煙と同様に、大麻の慢性喫煙は、慢性気管支炎や肺機能の低下などの気道疾患とともに、咳、痰の増加、喘鳴などの長期的な影響をもたらす可能性がある。
大麻喫煙者のサイトカイン産生の減少
さらに、健康な成人の大麻喫煙者のデータでは、サイトカイン産生が世界的に減少していることが実証されている。さらに、ベープペン(濃縮大麻を使用した気化装置)の使用は、抽出物の濃度、不純物、または汚染によって、さらに大きなリスクをもたらす可能性がある。
カンナビノイドとテルペンの濃度は、それぞれ3.2~4倍、2.7~8.9倍に増加する可能性があり(抽出プロセスとテルペン構造に依存)、この濃縮された形態は呼吸器症状や機能不全にも寄与する可能性がある。これらの投与方法は、感染に対応する呼吸器系の効力を低下させ、それによって低酸素血症への急速な進行のリスクを高める可能性がある。
二相性の効果
大麻は植物薬として比較的安全に使用されてきた長い歴史があり、中毒の閾値以下の用量で治療効果を得ることができる。レクリエーション用と治療用では、THCの投与量が大きく異なることがある。カンナビノイドは二相性の効果を持つことが知られており、高用量では一般的に有害事象と関連している。
カンナビノイド薬を専門とする医療専門家を対象とした最近の調査では、44.7%が慢性疼痛、線維筋痛症、関節炎、睡眠障害、食欲不振、その他の疾患にTHCを1日6~10mg投与することを推奨していると報告されています(1回あたりの平均投与量は2~3.3mg)15。THCの投与量は、臨床的影響を評価する上で重要な要素であることは明らかだ。
CBD
CBDは主にヘンプベースの製品で、COVID-19の潜在的な治療法としても注目されています。CBDは、コラーゲン誘発性関節炎の動物モデルにおいて、リンパ球とマクロファージの機能を抑制することで抗炎症作用を示すことが示されている。
既存の臨床文献に記載されているCBDの有効用量から、抗炎症作用のある用量はかなり高い可能性が高い。
まとめると、植物カンナビノイドの免疫力に対する効果は二面的である。一方で、ヒトの慢性炎症性/自己免疫疾患における抗炎症効果を目的としたECSの標的化は可能性があるが、効果的な投与方法はまだ明らかにされていない。
急性感染症では有害作用の可能性
一方で、ヒトにおける免疫抑制を回避するための投与ガイドラインは文書化されていないが、急性感染症での有害作用も可能性として考えられる。
大麻使用の話題で患者と接する際には、投与方法や投与量に関する呼吸器系や免疫系の健康教育が重要である。大麻を吸っている人への害を減らすアプローチとしては、低用量の経口投与製品(5mg THC未満推奨) を代用するか(燃焼による副産物を避けるため)、気化した乾燥花材を使用することが考えられる。
低用量の経口製品を使用している患者では、臨床的に有意な免疫抑制はリスクではないと思われる。しかし、これはまだ医療専門家のレーダーに載せるべきである。呼吸器や心血管系の健康状態、あるいは既存の免疫不全(例えば、がん患者、生物学的製剤の使用)を含めた患者の評価に対する個別のアプローチが、医療提供者の指針となるべきである。
自然防御の低下は、COVID-19の原動力と考えられており、明確にするために、THCまたはCBDがCOVID-19を治療するための証明された治療的介入であることを示唆するデータはない。
肥満患者の脂肪組織標的としてのエンドカンナビノイドの役割
pubmed.ncbi.nlm.nih.gov/32463562/
COVID-19患者の肥満リスク
“Obesity is an Independent Risk Factor for Severe COVID-19 ”
これは、肥満の程度とCOVID-19感染症の重症度との間に強い関係があるという最近の研究の主な結論である(1)。肥満はCOVID-19の経過に関連して,肺生理への悪影響や,II型糖尿病や高血圧などの併存疾患を誘発するなど,様々な負の影響を及ぼす。
COVID-19によって提起された主な医学的問題は、生命を脅かすサイトカインの嵐の一般的な文脈で急性呼吸窮迫症候群と多臓器不全によって特徴づけられる、最も重篤な疾患の形態に伴う高炎症である(2)。 肥満では、脂肪組織の拡大は、TNF、IL-1またはIL-6などの炎症性サイトカインを産生するマクロファージの浸潤を伴う。
体格指数(BMI)と脂肪組織に存在するマクロファージの数との間には有意な相関関係があり、これは脂肪球細胞数の25%にもなる可能性がある(3)。 肥満に伴う炎症は、低グレードの慢性炎症状態として表示されるが、1つは、肥満患者の脂肪組織に存在する免疫細胞の膨大な数は、COVID-19で観察されたサイトカインの嵐に寄与する一種の時限爆弾を表していないかもしれないかどうかを疑問視することができる。
細菌性敗血症(4)に対する肥満の逆説的な保護を示唆する摂動的なデータにもかかわらず、逆はインフルエンザ肺炎(4)とCOVID-19(1)のために観察されている。
肥満患者の炎症性電位低下
Endocannabinoidトーンは、肥満の開発における重要な役割を果たしている上記のデータを考慮して、我々は、肥満患者の脂肪組織の炎症性電位を低下させることは、COVID-19の重篤な合併症を発症するリスクを減少させるかもしれないという仮説を提唱した。
この目標は体重減少(3)によって達成される可能性があるが、これは状況の緊急性には対応しておらず、適切な薬理学的介入からより良い利益を得ることができるかもしれない。
脂肪組織の発生は、少なくとも2つの受容体(CB1およびCB2)、エンドカンナビノイドリガンド(主にアナンドアミドおよび2-アラキドノイルグリセロール)、ならびにエンドカンナビノイド代謝に関与する種々のタンパク質を含むエンドカンナビノイド系の制御下にある(5)。
CB1は特に脳に豊富に存在し、ここではCB2が主に免疫細胞に存在するのに対し、CB2は向精神作用に関与している(5)。 また、CB1は肝臓、骨格筋、膵島、脂肪組織などの末梢組織でも発現しており、エネルギー代謝を調節している(5)。 要するに、肥満は、中枢CB1の刺激が増加を促進するエンドカンナビノイドトーンの上昇を伴う。
CB1アンタゴニスト リモナバント
食物の取り込みを誘導するのに対し、末梢性CB1は脂肪組織における脂肪形成と脂肪蓄積を誘導する(5)。このことから、エンドカンナビノイド調子を低下させることで肥満を減少させることを目的としたCB1アンタゴニストが開発された。
そのうちの一つ(SR141716またはリモナバント、CB1の逆アゴニストであり、中枢性と末梢性の両方に作用する)は、体重の減少に有効であった(6)。リモナバントの中枢性作用は重篤な気分障害を誘発し、欧州連合での販売承認が取り消された(6)。しかし、過去15年の間に多くの前臨床試験が開発され、そのうちの1つはマウスの食事誘発性肥満に伴う炎症のリモナバントによる抑制の基礎となる分子機構を記述した最新のものである(7)。
さらに、ラットの細菌性敗血症モデルにおいて、リモナバントは死亡率を減少させ、血管過剰反応を改善することが示された(8)。 CB1拮抗薬としてのリモナバントは、現在、迅速な臨床試験が可能である。血液脳関門を越えない第2世代および第3世代のCB1拮抗薬は、中枢性CB1の阻害に関連した副作用を回避するために開発され、同様の抗肥満作用および抗炎症作用を示すことが示されている(9)。
しかし、いくつかの予備的臨床試験が行われたにもかかわらず、これらの薬剤はいずれも臨床応用のレベルに達しておらず、COVID-19発生時の緊急時における使用を強調することは困難であった(9)。COVID-19の劇的な影響を考慮すると、ワクチンの獲得や集団免疫の獲得に要する時間は、抗ウイルス薬や抗サイトカイン薬、薬物併用療法などの薬物再投与に期待が集まっている。
我々は、リモナバントを、内臓肥満患者に発生する感染症の重症度を軽減するための興味深い手段として提案する。 実際、リモナバントによって誘導されるアディポネクチン血症の体重減少に依存しない増加は、リモナバントが脂肪細胞に直接作用することを示唆した。 (6)。
したがって、リモナバントと脂肪球CB1との相互作用は、脂肪球CB1の特異的無効化と同様の方法で、腹部組織の炎症状態を減少させることが期待される(11)。 さらに、CB1遮断は、少なくとも2つの異なる前臨床モデルにおいて、肺の炎症を減少させることが示されている(12,13)。 このことは、COVID-19との関連で特に関連していると思われるが、逆のことが呼吸器合胞体ウイルスに感染したマウスで観察された(14)。
しかし、3つの懸念事項を考慮しなければならない。 第一に、リモナバントによって誘発される精神医学的副作用は、患者を鎮静にして厳重に監視する集中治療室(ICU)での感染の急性期に限定して投与する限り、難治性のものではないかもしれない。
しかし、リモナバントによる治療を受けた患者については、重症生存者は持続的な精神障害のリスクがあるため、亜急性期及び慢性期の精神科合併症を注意深く観察する必要がある。 さらに、SARS-CoV2では慢性的な精神神経症の後遺症がまだ不明である場合、気分の落ち込み、不安、トラウマ的記憶が長期的に過去のコロナウイルス感染と関連していることが報告されている(15)。
したがって、ICU退院後の患者に対しては精神科サーベイランスを開始し、リモナバント投与時には精神科サーベイランスを強化すべきである。
第二に、有害事象の報告では、リモナバントは上気道感染症と関連していたが、これは原因不明であるが、COVID-19との関連でリモナバントの使用を検討する上で致命的な欠陥ではないはずである(16)。
最後の懸念は、抗ウイルス療法の一部として抗炎症薬を使用することに関連している。抗サイトカイン治療も同様の選択を迫られている。 我々は、COVID-19患者を対象とした適切な臨床試験のために、COVID-19以外にも、同様に重篤な患者を対象とした他の適応を検討することを提案する。
SARS-CoV-2感染症の急性炎症と病態。抗炎症治療薬としてのカンナビジオールの可能性?
カンナビジオールによるSARS-CoV-2関連炎症の減少
カンナビジオール(CBD)は、様々な臨床応用が可能な植物性カンナビノイドであり、良好な安全性と忍容性のプロファイルとともに、特定の病状に対する有効性が証明されています[30,31]。さらに、Δ9-テトラヒドロカンナビノール(THC)とは異なり、CBDは向精神作用を誘発しないため、治療用途にも適している[32]。
カンナビノイドは、免疫活性化と炎症性サイトカイン産生を抑制することができます[32]。エンドカンナビノイド受容体には、CB1およびCB2が含まれる。CB1は中枢神経系での発現が高く、肺を含む末梢組織での発現は少ない[33]。
気道上皮細胞は、カンナビノイドのCB2受容体依存性および独立した効果の両方に反応する[34]。CB2は、循環リンパ球、単球、組織マスト細胞を含む様々な免疫細胞、およびリンパ系組織で発現している[33,35]。CB2受容体の活性化は、炎症性IL-1、IL-6、IL-12、TNF-αの放出を抑制することができる[36]。
エンドカンナビノイドの恒常的な産生はヒト肺常駐マクロファージによって行われ、これは急性および慢性炎症において、主にCB2受容体を介して保護されている[37]。
重要なことに、ヒト肺常駐型マクロファージもまた、CB1およびCB2受容体の両方を発現している[38]。CB2のアゴニストは、CD14+単球およびM1マクロファージからのTNF-αを阻害し、抗炎症性サイトカインIL-10の発現を増加させることが示されている[37]。
CB2アゴニストはまた、TGF-βおよびIL-10を産生する抗炎症性FoxP3+調節性T細胞(Tregs)を誘導します[39]。さらに、CBDは機能的な免疫抑制性Tregsの分化を誘導することが示されている[40]。
動物モデル
肺損傷のマウスモデルでは、CBDはリポ多糖類(LPS)誘発性の急性肺炎を減少させた[41,42]。ラットの実験的喘息モデルでは、CBDは気道炎症を減少させ、喘息の気道炎症や線維化に関与する血清IL-4、IL-5、IL-13、IL-6、TNF-αのレベルを低下させた[43,44]。
さらに、CBDはIL-1およびIFNγのT細胞分泌を直接抑制することがでた[45]。低酸素虚血性肺障害を有する子豚では、CBDは組織学的損傷を減少させ、白血球浸潤を減少させ、気管支肺胞液中のIL-1濃度を調節した[46]一方、ラットの敗血症モデルでは、CBDは酸化ストレスを逆転させ、死亡率を減少させた[47]。
ヒトモデル
ヒトでは、カンナビノイドの使用により、プロ炎症性CD16+単球の誘導とIP-10の産生が抑制され、ヒトにおける抗炎症作用が示唆された[48]。
別のヒトの研究では、プロ炎症性単球の減少に加えて、大麻の大量使用は、非大麻使用者と比較してHLA-DR+CD38+活性化CD4およびCD8 T細胞の頻度およびIL-10、IL-12およびTNF-α-産生抗原提示細胞の頻度の減少にも関連していた[49]。
カンナビノイドの抗炎症作用は、現在臨床試験で研究が進められており、私たちのチームは現在、HIV感染症を対象とした臨床試験を実施している[50]。
SARS-CoV2はマクロファージなどの免疫細胞を介して炎症性サイトカインの嵐を引き起こし、CBDには幅広い抗炎症作用があることから、CBDはSARS-CoV2誘導性炎症に対する抗炎症治療アプローチの可能性があると考えられる。
この点では、まず、SARS-CoV2がヒトのマクロファージやT細胞の生理機能や免疫機能に及ぼす特異的な影響をより深く理解する必要がある。
CBDはすでに臨床医学で使用されている治療薬であり、良好な安全性プロファイルを有しているため、コストと労力のかかる臨床試験に着手する前に、in vitroおよび動物モデルによる概念実証試験の結果が必要なエビデンスを提供することになる。
カンナビノイド受容体2型:SARS-CoV-2(CoV-19)感染における標的となる可能性は?
www.mdpi.com/1422-0067/21/11/3809
Published: 2020年5月27日
COVID-19の患者は、炎症性および免疫反応の悪化、サイトカインストーム、プロ炎症性M1マクロファージの有病率、および常駐免疫細胞および循環免疫細胞のレベルの増加を示しています。男性は女性に比べてSARSCoV-2感染の感受性が高く、これはエストロゲンの産生によるものと考えられる。
エストロゲンの防御的役割と、過剰な炎症を抑える免疫抑制作用は、カンナビノイド受容体2型(CB2)によって媒介される。炎症および免疫応答の調節におけるこの受容体の役割は、いくつかの設定で実際に十分に文書化されている。
CB2受容体の刺激は、プロ炎症性サイトカインの放出を制限し、マクロファージの表現型を抗炎症性M2型にシフトさせ、間葉系間質細胞の免疫調節特性を高めることが知られている。以上のことから、CB2受容体はCOVID-19パンデミック緊急時の治療標的となりうると考えられる。
エンドカンナビノイドと免疫活性
宿主細胞におけるウイルスの複製は、常に炎症および免疫活性化と関連している[19]。 免疫系は、その機能を果たし、ホルモン、神経伝達物質、およびエンドカンナビノイド(eCB)などの特定の脂質を含む様々なシグナル伝達分子に応答するための複雑なメカニズムを有している[20]。
カンナビノイドの生物学的効果は、Gタンパク質共役型カンナビノイド(CB)受容体の活性化を介して媒介される[21]。エンドカンナビノイド系(ECS)は、カンナビノイド受容体1型(CB1)および2型(CB2)、内因性カンナビノイド、およびそれらの代謝のための酵素を含む。CB1は主に中枢神経系で発現し、カンナビノイドの精神作用と強く関連している[22]。
また、CB1は末梢組織でも低レベルで発現している[23]。代わりに、CB2は免疫細胞(B細胞、ナチュラルキラー細胞、単球、好中球、CD8リンパ球、CD4リンパ球)[24,25]、および肝臓、脾臓、鼻上皮、胸腺、脳、肺、腎臓などのいくつかの臓器や組織で高度に発現している[26-28]。
CB1受容体とCB2受容体の両方が、免疫系の重要な調節因子であり、免疫抑制を誘発する可能性があることが広く実証されている[29]。CB2は、その免疫調節的役割のために広く知られており、ECSの活性化は、以下の4つのイベントに関連している。
- i) アポトーシスの誘導
- ii) 細胞増殖の抑制
- iii) 抗炎症性サイトカイン産生の抑制と抗炎症性サイトカインの増加
- iv) 調節性T細胞の誘導 [30]。
したがって、COVID-19においても、ECSの活性化は、疾患の発症の予防および/または重症化に影響を与える役割を果たしていると考えられる。
THC・CBD
D9-テトラヒドロカンナビノール(D9-THC)およびカンナビジオール(CBD)は、リンパ球増殖および炎症性サイトカイン産生を抑制する能力のために、その薬効特性のために最も研究されてきた植物性カンナビノイドである[31-33]。CB1受容体は中枢神経系に優勢に局在し、投与後の向精神作用はしばしば観察されている[23-26]。
J. Mol. CB2受容体の特異的活性化は、アポトーシスを誘導し、自己抗体、炎症性サイトカイン発現、マトリックスメタロプロテアーゼ、骨浸食の産生を抑制し、Th1からTh2への免疫応答への移行を誘導し、骨髄由来のサプレッサーやT-調節細胞を誘導する[34]。
さらに、CB2受容体はマクロファージ遊走を含む炎症過程[29]に対して抑制効果を発揮し[35]、ウイルス感染に関連するいくつかの免疫病理学的過程を減少させるための重要な治療標的を提供している[31-33]。
したがって、CB2受容体が免疫調節過程に関与していることはよく知られており、COVID-19患者が直面している炎症性、凝固性、サイトカインの不均衡についての最近の知見を考慮して、CB2受容体がこれらの調節に果たす役割はCOVID-19における治療標的としての可能性を示唆している。
2. CB2とウイルス感染 免疫系は、防御機能を達成するために複雑なメカニズムで機能している。
免疫応答に参加している細胞はカンナビノイド受容体、特にカンナビノイド受容体2型を担っている[29]。したがって、これらの受容体の活性化は、感染性疾患の発症を予防し、調節する上で決定的な役割を果たす可能性がある。
CB2受容体
CB2受容体は、ウイルス感染の存在下では局所的に過剰発現し、選択的アゴニストを介した活性化は、炎症部位への白血球の移動を抑制する[36]。多くの研究でカンナビノイドの感染抵抗性への効果が検討されている。
THC
Δ9-THCは宿主の防御を抑制し、CB2選択的アゴニストと同様に、B細胞、単球/マクロファージおよび樹状細胞に対して抑制効果を有するため、単純ヘルペスウイルス2型のようないくつかの微生物感染症[37]に感作するようである。
炎症過程を妨害する化合物は、宿主の炎症から利益を得るウイルスと、宿主の炎症によって根絶される他のウイルスが存在するため、ウイルス感染に対する宿主の反応を損なうか、または改善する可能性があることを強調しておくことが重要である[38,39]。
CB2アゴニスト
CB1ではなくCB2のアゴニストは、CXCR4-tropicウイルスの無細胞感染および細胞間感染後の一次CD4+ T細胞における感染を減少させることが示されている。CB2アゴニストは、CXCR4活性化を介したGタンパク質活性およびMAPKリン酸化を低下させ、休息中のCD4+ Tの細胞骨格構造を変化させ、休息中の細胞におけるCXCR4-tropic HIV-1の無細胞感染または細胞間ウイルス感染後の生産的な感染を損なうことが示されている。
したがって、AIDS症状の治療におけるCB2受容体アゴニストの臨床使用は、HIV-1感染の後期段階におけるCXCR4-tropicウイルスに対する有益な補助的抗ウイルス効果も発揮する可能性があることを示唆している[32]。CB2刺激はまた、HIV感染患者における炎症過程のいくつかの影響を減少させる [36]。
HIV感染によるCB2受容体の変化
HIV感染は、in vitroでの単球がマクロファージに分化する過程で観察されているように、CB2受容体の発現に変化をもたらす[40]。CB2はHIV感染の進行に伴って増加し、感染したマクロファージではCB2受容体選択的アゴニストJWH133への曝露により、逆転写酵素活性/ウイルス複製活性が用量依存的に低下する結果となった[41]。
細菌感染
さらに、急性ウイルス性呼吸器感染症は、臨床経過の著しい悪化を引き起こす二次的な細菌性スーパーインフェクションの発症の原因となり得る。細菌性スーパーインフェクションは、ウイルス感染によって損傷を受けた呼吸器管の細菌のコロニー化によって引き起こされ、その結果、宿主の免疫応答が変化することによって引き起こされる[42]。SARS-CoV-2は、場合によっては二次的な細菌感染を引き起こし、予後を悪化させた[43]。
好中球の減少
敗血症は、感染に対する炎症性と免疫抑制性の両方の反応で構成されており、多臓器不全と死を引き起こす可能性がある。敗血症におけるCB2受容体の役割は、Tschöpらによって評価されており、CB2刺激が好中球数を減少させ、死亡率と組織損傷を減少させた。敗血症中の好中球数の減少は、生存率の増加と関連している。さらに、好中球は細菌を死滅させ、組織損傷を減少させることができる[44]。
したがって、CB2選択的アゴニストの使用は、好中球のリクルートおよび細菌クリアランスを調節するために示唆されうる。CB2遺伝子のコドン63にあるCB2受容体のバリアントは、グルタミン(Gln(Q))がアルギニン(Arg(R))で置換され、結果的にタンパク質の分極が異なることにつながる。これらの変異は、カンナビノイドに対するCB2受容体の応答に影響を与える。
受容体は、カンナビノイドによって活性化された場合、免疫調節機能の低下を示した。
J. Mol. Sci. 2020, 21, 3809 4 of 16 カンナビノイドによって活性化された場合、免疫調節機能が低下し、それゆえに他のRNAウイルスからの感染の獲得、重症度、および感染期間に影響を与える[45,46]。
カンナビノイドの内皮バリア保護
カンナビノイドはまた、いくつかのプロ炎症性イベントへの影響のおかげで、内皮バリアへのダメージの減少を誘発する可能性がある[47]。
我々は、HIV/HCV感染患者において、QQ被験者のT細胞では、CB2刺激がT細胞の増殖抑制を媒介することを発見したが、RRハプロタイプの被験者では、T細胞の増殖が減少しており、CB2-63RRバリアントはCB2-63QQと比較して、T細胞のより弱く一過性の抑制と関連していることを示している。
CB2変異
CB2 RR変異体は、HIV/HCV感染者における肝壊死炎症の予後悪化因子としても示されているが、HCV単感染が原因の場合、CB2 QQ変異体はより重篤な肝壊死炎症と関連していることが示されている[48]。
CB2受容体の活性化は、選択的アゴニストであるJWH133を用いて、ウイルス性呼吸器感染症の小児においても研究されている。CB2 Q63Rの変異は、急性ウイルス感染症のより重篤な臨床経過と入院リスクの増加と関連しいた。QQ遺伝子型を持つ呼吸器同期ウイルスに感染した小児は、重篤な呼吸器合併症の発症リスクが2倍以上に増加することが示された。JWH133によるCB2受容体の活性化はサイトカイン産生を減少させ、肺病理を限定的にした[41]。
まとめると、CB2受容体は乳児期の呼吸器同期ウイルス感染重症度と関連しており、ウイルス関連免疫病理を緩和するための治療標的として示唆されている。カンナビノイド受容体のヌルマウスはインフルエンザ感染に対してより大きな炎症反応を示し、カンナビノイド受容体が免疫調節に役割を持っていることを強く示唆している[49,50]。
これらの研究をまとめると、CB2受容体が免疫バランスにおいて中心的な役割を持ち、免疫応答の大きさをネガティブに調節することが確認された。
免疫系は異物と戦い、CB2受容体の活性化は抗炎症作用を誘発する;したがって、これらの受容体を標的とすることは、COVID-19の治療のための新規かつ効果的なアプローチであるかもしれない。
3. 炎症におけるSARS-CoV-2とCB2。
サイトカイン、マクロファージ、間葉系間質細胞
3.1. 炎症とサイトカイン産生
COVID-19患者の臨床的特徴の中には、C反応性タンパク質(CRP)およびプロ炎症性サイトカインを含む非常に多くの循環炎症性分子が存在する[51]。
最近数人の著者がこの変化を観察し、確認している [52,53];特に、Huangら[54]はこの変化を測定した。54]は41人の患者のサイトカインレベルを測定し、IL-1β、IL-7、IL-8、IL-9、IL-10、線維芽細胞増殖因子(FGF)、顆粒球-マクロファージコロニー刺激因子(GM-CSF)、IFNγ、顆粒球-コロニー刺激因子(G-CSF)、マクロファージ炎症性タンパク質1α(MIP1A)、腫瘍壊死因子(TNFα)、血管内皮増殖因子(VEGF)の増加を報告している。プロ炎症性サイトカインIL-6は、重度のCOVID-19患者では決定的に高いようである。
サイトカインストーム
COVID-19患者で観察される変化したサイトカインプロファイルは、コロナウイルスによって引き起こされる他の2種類の肺炎であるSARS(重症急性呼吸器症候群)およびMERS(中東呼吸器症候群)を特徴づけるサイトカインストーム(CS)に非常に類似している[55]。上記の症候群では、肺へのCSと炎症性細胞の浸潤が重症化、急性呼吸窮迫、死亡につながる。
COVID-19患者にもCSが存在することから、非ステロイド性抗炎症薬、グルココルチコイド、サイトカイン拮抗薬、モノクローナル抗体(トシリズマブ、アナキンラ、イドロキシクロロチンなど)またはJAK阻害薬による抗炎症療法が有用であることがこれまでのところ証明されている。
抗炎症薬の限界
一方、抗炎症薬の使用には、いくつかの限界がある可能性がある。まず、サイトカイン阻害薬は入手可能であり、実際に炎症性カスケードに関与しているサイトカインの一部にしか特異的ではない。コルチコステロイドの使用については、さらなる調査が必要だ。
炎症と免疫反応の両方を抑制する能力は、ウイルスの排除を遅らせるだけでなく、有益である可能性がある。
コルチコステロイドの問題
しかし、この問題に関する文献には論争の余地のある仮説が存在する。Chen Wangら[54]は、SARS[56]とMERS[57]についての臨床的証拠を報告しており、コルチコステロイドの投与は死亡率に差はないが、呼吸器系からのウイルスRNAのクリアランスが最悪になっただけであることを示している。
さらに、免疫応答を低下させる治療法(上記のようなコルチコステロイド)は、既存の感染を煽るだけでなく、新たな感染のリスクを増加させる可能性がある[58]。実際、治療された患者は、Int. J. Mol. 免疫抑制剤による治療を受けた患者は免疫不全に陥っているため、死亡率が高い危険性にさらされている[59]。
Puja Mehtaらは、実際、重症COVID-19患者をスクリーニングして(フェリチン値、血小板数、赤血球沈降速度などを考慮して)炎症亢進の有無を調べ、免疫抑制が致命的となりうる患者を特定することを提案している[60]。したがって、最も適切な治療法については、まだ意見が分かれている。
フェリチンの上昇
武漢のCOVID-19患者150人を対象とした多施設共同研究において、Ruan Q.らは、炎症性サイトカイン、特にIL-6の過剰産生に加えて、フェリチンレベルの上昇があることを示した[61]。これらのデータは、抗炎症薬の免疫抑制効果が代わりに有益である可能性があるウイルス依存性の過炎症を示唆している。
2016年、Shakoory B.らは、マクロファージ活性化症候群患者における死亡率の低下におけるIL-1Rアンタゴニスト(アナキンラ)のこの効果を強調した[62]。
これらの著者らは、その後、重度のCOVID-19患者をスクリーニングして炎症亢進を調べ、抗炎症療法の免疫抑制効果から利益を得られる患者を特定することを示唆している。
炎症調節とエンドカンナビノイド
炎症の調節におけるエンドカンナビノイド系の役割はよく知られており、特にサイトカイン放出における役割はよく知られている。文献では、CB1との親和性が高い内因性アゴニストであるAEAが、プロ炎症性IL-6の産生を抑制することが報告されており[63]、CB1およびCB2受容体部分アゴニストであるTHCがIL-12およびIFN-γの遊離を抑制することが知られている[64]。
(E)-βカリオフィレン((E)-BCP)
さらに、2014年、Sardinhaらは、2-AGとAEAをそれぞれ分解する酵素であるMAGLとFAAHを阻害することで、CB2を介した抗炎症作用があることをin vivoで実証した[65]。また、(E)-βカリオフィレン((E)-BCP)は、CB2受容体に選択的に結合する植物性カンナビノイドであり、機能的なCB2アゴニストである。
(E)-BCPは、末梢血中のリポ多糖(LPS)誘発性炎症性サイトカインの発現を抑制し、単球におけるLPS誘発性Erk1/2およびJNK1/2リン酸化を抑制する。さらに、(E)-BCP投与により、野生型マウスでは炎症反応が強く抑制されたが、CB2受容体を欠損したマウスでは抑制されなかったことから、この天然物が生体内でカンナビミメティックな効果を発揮することが示唆された。
これらの結果から、(E)-BCPは機能的な非鎮痛性CB2受容体リガンドとして、また抗炎症性カンナビノイドとして同定された。(E)-BCPは血管の炎症にも効果があり、血管の酸化ストレスを有意に改善した[66,67]。
炎症の調節におけるCB2受容体の特異的な関与
さらに、異なる病態における炎症の調節におけるCB2受容体の特異的な関与について、いくつかの証拠がある。手始めに、2015年に、Verty ANら[68]は、CB2受容体アゴニストであるJWH-015がマウスの肥満関連炎症を減少させることを観察した。
翌年、501人のイタリアの肥満児が、CB2のあまり機能的でないバリアントであるCB2 Q63Rバリアントのジェノタイピングを受け、このバリアントが、in vitroで除脂肪由来の脂肪細胞でCB2受容体をブロックした後に観察されたレベルに類似した高レベルのプロ炎症性IL-6と関連していることを強調した[69]。これおよび他の多くの変化は、肥満者における白色脂肪組織の低悪性度炎症に寄与しているように思われる[70]。
同じCB2 Q63R変異体は、HIV/HCV感染の慢性肝炎患者における肝壊死炎症[48]、若年性特発性関節炎における滑膜炎症[71]、非アルコール性脂肪性肝疾患の小児における肝障害[72]、炎症性腸疾患(クローン病および潰瘍性大腸炎)[73]およびセリアック病[74]における消化管の炎症にも関連した。
さらに、カンナビノイドCBDはアレルギー性接触皮膚炎のin vitroモデルで炎症性サイトカインIL-6、IL-8、TNF-αの産生を抑制することが実証されている[75]。
変形性関節症では、THCはLPS刺激を受けたMG63細胞におけるTNF-α、IL-1、IL-6、IL-8の放出を減少させ、抗炎症性CB2を介した役割を示している[76]。
免疫性血小板減少症(ITP)は、異常なサイトカイン分泌によって特徴づけられ、CB2 Q63R変異体の存在によって影響を受ける別の疾患である。特に、ITP患者の間葉系幹細胞は、炎症性サイトカインIL-6を過剰に産生する。CB2受容体の選択的アゴニストであるJWH-133を用いると、通常のレベルに回復する [77]。
CB2受容体の適切な活性化は、多発性硬化症の動物モデルにおいても、いくつかの炎症性メディエーター(IL-6、IL-1β、TNF-α)のレベルを低下させる [78]。炎症性硬化症の動物モデルにおいても、炎症性メディエーター(IL-6、IL-1β、TNF-α)のレベルを低下させることが示されている[78]。
3.2. 炎症とマクロファージ
SARS-CoV-2感染におけるマクロファージの役割の重要性は、肺、肝臓および胃におけるマクロファージとACE2発現細胞との間のクロストークを実証することによって評価されている。マクロファージは炎症の間にCoV標的細胞に勧誘され、感染において防御的または破壊的な役割を果たす[79]。
特に、びまん性肺胞損傷を有するCOVID-19患者の肺では、細胞浸潤は主にマクロファージと単球、中等度の単核巨細胞、ごく少数のリンパ球で構成されることが実証されている。ウイルス感染後、これらの細胞は上述した「一次サイトカイン」の嵐の原因となる[55]。炎症性細胞の浸潤の存在は、急性肺損傷の原因となり、急性呼吸窮迫症候群を引き起こし、死に至る[80]。
マクロファージは、炎症反応、サイトカイン産生、貪食、細胞増殖、および創傷における組織修復に重要な役割を持つ単核食細胞である。マクロファージは、それらが置かれている微小環境に基づいて2つの異なる活性化表現型を示す顕著な可塑性によって特徴付けられる[81]
古典的に活性化されたマクロファージ(M1)と代替活性化されたマクロファージ(M2)
M1マクロファージは、インターフェロン-γ(INF-γ)およびリポ多糖(LPS)刺激後に活性化される。
それらは、Tumor Necrosis Factor(TNFα)、Interleukin-6(IL-6)、Interleukin-1 Beta(IL-1β)、一酸化窒素合成酵素(INO)などの様々なタイプのプロ炎症性サイトカインおよびケモカインを放出することにより、プロ炎症性および抗腫瘍性を示す。
一方、M2分極は、ホスファチジルイノシトール3-キナーゼ-AKT-哺乳類標的ラパマイシン(PI3K-AKT-mTOR)シグナル伝達経路と抗炎症性サイトカインであるインターロイキン-4(IL-4)およびインターロイキン-10(IL-10)の両方によって促進され、抗炎症性サイトカイン(IL-10)を放出することによって抗炎症作用および免疫抑制作用を発揮し、腫瘍の進行を促進する。
M1/M2のアンバランスが炎症の原因である[81-83]。
CB2受容体は主にマクロファージを含む末梢免疫細胞で発現していることが知られている[20]。いくつかの研究で、この受容体が抗炎症性および免疫抑制性のメディエーターとしての役割を示すことが示されている。この受容体は、免疫細胞の活性化や炎症促進性メディエーター(サイトカイン、活性酸素種(ROS)、一酸化窒素など)の放出を抑制する。
したがって、炎症性腸疾患、若年性特発性関節炎、炎症性腸疾患、セリアック病、肥満、神経炎症性疾患などの炎症性疾患や自己免疫疾患の治療ターゲットとしての可能性が示唆されている[84,85]。これらの病態はすべて、免疫細胞の活性化の変化とプロ炎症性サイトカインの放出の増加によって特徴づけられる。
さらに、CB2受容体の選択的アゴニストによる刺激は、BおよびTリンパ球の両方を減少させ[86]、間葉系間質細胞(MSC)のホーミングおよび免疫抑制・抗炎症活性を促進し[77,87]、マクロファージにおけるプロ炎症性サイトカイン放出を制限し、M1分極を阻害することにより、これらの病態を逆転させることが示されている[83]。
いくつかの研究では、炎症過程におけるマクロファージ分極の調節因子としてのCB2受容体の役割の重要性が強調されている。特に、選択的アゴニストによる刺激は、プロ炎症性マクロファージ集団(M1)の減少と抗炎症性表現型(M2)の増加を誘導することが示されている[88]。
Duらは、CB2受容体を選択的アゴニストであるJWH-133で刺激すると、皮膚病変部のM2マクロファージを活性化するのではなく、M1マクロファージを抑制することで、皮膚創傷治癒中の炎症を減衰させることを実証している。また、JWH133またはGP1aを投与すると、M1マーカーや炎症性サイトカインであるCD86、iNOS、IL-6、IL-12が有意に減少することが示された。
これらの結果は、CB2がプロ炎症性サイトカインの放出を抑制し、マクロファージのM1表現型への分極を抑制していることを示唆している[83]。また、神経炎症においても、CB2受容体の刺激は抗炎症作用を発揮し、マクロファージの分極を調節する。
Braunらは、外傷性脳損傷により誘発された神経炎症患者において、CB2受容体をその選択的アゴニストであるGP1aで刺激すると、M2抗炎症性マクロファージ分極が誘導され、M1抗炎症性分極が阻害され、プロ炎症性メディエーター発現(TNFα、IL1β、IL6、CCl2、CXCL10およびiNOS)が減少し、抗炎症性メディエーター発現(IL10、ArgI)が増加することを明らかにした[88]。
炎症性メディエーター発現の増加(IL10、ArgI)[88] [88] [88] [88] Int. J. Mol. CB2受容体はアルコール性肝疾患においても抗炎症作用を示す。クッパファー細胞の分極に作用することで Louvetらは、CB2受容体がクッパファー細胞の分極を制御する新規なレギュレーターであることを提案した。
彼らのin vivoおよびin vitro実験では、CB2を遺伝子的に欠失させた後、慢性的なアルコール摂取に応答してM1表現型マーカーが増加し、M2表現型マーカーが減少することが示された。その代わり、JWH-133処理後には、M1/M2バランスを優勢な代替M2応答にシフトさせることで、プロ炎症性M1プロファイルの抑制と炎症の減少が観察された[26]。
さらに、ヒト肺居住マクロファージは CB2 受容体を発現しており、その刺激はいくつかの炎症性サイトカイン(IL-6 など)や血管新生因子の放出の減少を誘導している[89]。
3.3. 炎症における間葉系間葉系細胞(MSC)
COVID-19患者では、サイトカイン産生の変化が存在し、これはサイトカインストームと呼ばれるプロセスに非常に類似しており、免疫細胞の過剰産生によっても特徴づけられる [59]。
間葉系間葉系間質細胞(MSC)のよく知られた抗炎症機能 [90,91] を考慮して、ここ数ヶ月の間に、いくつかの著者がCOVID-19患者の治療にMSCを使用する可能性を研究した。特に、これらの細胞は炎症性因子の分泌を減少させ、インフルエンザウイルスなどによる急性障害後の肺機能を改善すると考えられている。
Jiajia Chenら[92]は、H7N9感染による急性呼吸窮迫症候群(ARDS)患者を対象に月経血由来のMSCを試験した臨床研究を行い、最も重篤な症例で効果が認められた。H7N9はインフルエンザAウイルスの亜型であり、COVID-19と非常によく似た症状(咳、発熱、息切れなど)を呈し、同様の合併症(ARDSおよび肺不全)を伴う[93,94]。したがって、著者らは、H7N9の炎症性ダメージを管理するために使用される治療戦略は、COVID-19患者のARDS誘発性重症肺炎にも使用できることを示唆している。
詳細には、MSCは末梢リンパ球の数を増加させ、同時に循環血液中のサイトカイン分泌性免疫細胞(CD4+T細胞、CD8+T細胞、NK細胞)を減少させる能力を持っている[95,96] [97]。この免疫調節効果は、直接またはパラクリンサイトカインによって媒介される免疫細胞との相互作用によるものである[98,99]。
MSCが免疫応答に及ぼす大きな影響に加えて、ウイルス性肺炎におけるサイトカインの嵐を打ち消すのに有用な白血病抑制因子(LIF)という特異的な分子を産生することも観察されている[100]。MSCが産生するLIFの量は十分ではありないが、文献では1000倍のLIF産生能を持つ合成幹細胞(LIF-Nano)を用いて、多発性硬化症の前臨床モデルで4日以内に麻痺を逆転させたことが報告されている[101]。
MSCのCB2受容体発現
これまでの研究から、MSCはCB2受容体を豊富に発現しており、この特徴は上述の特徴と相まって、CoV-19感染症の管理に適していることがわかっている。CB2受容体のアゴニストであるJWH-133を用いてMSCを選択的に刺激すると、MSCの生存率や免疫調節特性が改善され、リンパ球活性やサイトカイン分泌の調節に重要な影響を与えることが観察されている[77]。
これらの根拠に基づいて、MSCの治療は、CB2受容体の適切な刺激とともに、幹細胞の組織損傷を修復することと、免疫調節細胞を保護する方向に免疫応答を駆動するという二重の機能を持つCOVID-19患者の状態を改善することが提案されている。幹細胞は、様々な供給源(臍帯、歯髄、月経血など)からのアクセスや単離が容易であり、絶対的な効果を持って繰り返し治療に使用するために保存することができる[102-104]。
さらに、RNAシークエンシングにより、MSCはCOVID-19の発症に関与する主要なタンパク質であるACE2とTMPRSS2に対して陰性であることが観察されている[105];したがって、これらの細胞は、CoV-19に感染することなく、むしろ宿主に上述のすべての有益な効果をもたらす[106](図1)。
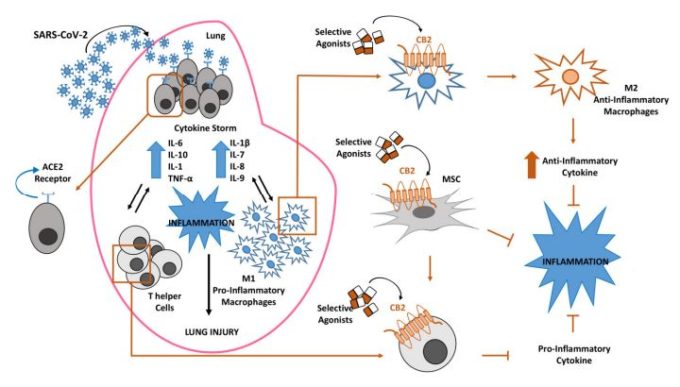
図1. コロナウイルス(SARS-CoV-2)感染後の肺における炎症反応。SARS-CoV-2感染に対する肺の感受性は、肺胞上皮細胞上のアンジオテンシン変換酵素2(ACE2)受容体に対するウイルススパイクタンパク質の特異性に依存する。
この相互作用は、サイトカインの嵐、プロ炎症性のM1マクロファージとTヘルパー細胞の増加によって持続される炎症亢進をもたらし、それぞれの事象が他の事象の変化を増強するという悪循環の中ですべてが関連している。
カンナビノイド受容体2型(CB2)のマクロファージ、Tヘルパー細胞、間葉系間質細胞(MSC)への選択的刺激は、COVID-19患者の炎症状態を抑制するために提案されている可能性がある。
4. CB2とエストロゲン いくつかの疫学研究では、性差があることが示唆されている。
CoV19/SARS-CoV-2の発生率には差があり、男性は女性よりも感染しやすく(感染者の約70%)[15,52,54]。興味深いことに、この差は、重症急性呼吸器症候群(SARS)-CoVや中東呼吸器症候群(MERS)-CoVなどの他のウイルス感染症でも過去にすでに観察されている[107,108]。
事実上、男性と女性ではRNAウイルス感染に対して異なる反応を示すことがすでに広く知られている[64]。一般に、男性はあまり強くない免疫反応を示す[109]。
女性は、異なる自然免疫、性染色体[110]、特にステロイドホルモン[111]に関連した様々な理由により、ウイルス感染症に対して感受性が低い。女性ホルモンは、多くの病気に対する自然な抵抗力を与えているようだ。
エストロゲンは高濃度では免疫抑制作用を持ち、低濃度では重要な免疫賦活作用を示す[112]。ステロイドホルモンは、特定のエンハンサー要素に結合することで標的遺伝子の発現を調節することができる細胞内受容体を介してその効果を発揮する[113]。
カンナビノイド受容体発現およびエンドカンナビノイドレベルの調節におけるエストロゲンの役割は、生理学的および病理学的条件の両方で広く知られている[114-116]。17β-エストラジオールは、CB2遺伝子におけるエストロゲン応答性エレメントのリクルートを介して破骨細胞におけるCB2受容体の発現をin vitroで増加させることが研究により実証されている[117]。
さらに、選択的エストロゲン受容体モジュレーター(ラロキシフェン、バゼドキシフェン、ラソフォキシフェン)は、CB2受容体アゴニストとして作用する[118,119]。エストロゲンとカンナビノイドは、いくつかの分子経路を共有し、いくつかの炎症性プロセスに関与している[120]。Peretzらは、ヒト由来の鼻上皮細胞におけるインフルエンザAウイルスの複製を阻害するエストロゲンの役割を実証した[121]。
したがって、Channappanavarらは、SARS-CoV-1に感染したマウスにおいてエストロゲンシグナル伝達の保護効果を示し、雌マウスの卵巣摘出またはエストロゲン受容体の薬理学的拮抗が死亡率を増加させることを実証した[122]。
さらに、彼らは、SARS-CoV1に感染した卵巣摘出マウスの肺において、対照の雌マウスと比較して、マクロファージの数が多く、プロ炎症性サイトカインのレベルが増加していることを観察した[Int. J. Mol. Sci. 2020, 21, 3809 9 of 16エストロゲンシグナル伝達は、おそらくNF-κBの阻害とそれに続くプロ炎症性サイトカイン産生を介して、肺のマクロファージ活性を抑制することができることを示唆している[122]。
CB2受容体は免疫系を調節し、多くの炎症性疾患において炎症を抑制することを考えると[85]、エストロゲンの保護効果はCB2受容体の活性化に強く関連している可能性が考えられる。
肺損傷モデルでは、CB2受容体のアップレギュレーションはNF-κβ活性を阻害し、プロ炎症性因子の放出(TNF-α、IL-12、IL-6)を減少させ、抗炎症性因子(IL-10、IL-4)の産生を増加させる[123]ことから、CB2受容体の活性化は、免疫細胞の阻害を通じて肺疾患を緩和するための新規免疫調節戦略として作用する可能性があることが確認された。
5. CB2受容体刺激は、抗炎症性サイトカインの放出を減少させ、M1/M2比を抗炎症性M2マクロファージ表現型へとシフトさせ、MSCの修復特性を改善することで、抗炎症および免疫調節効果を発揮することが知られている。
また、ヒトの肺、マクロファージおよびMSCがCB2受容体を発現していることもよく知られている。エストロゲンはCOVID19において保護効果を発揮し、これはSARS-CoV-2感染において観察される性差を説明する。これはまた、CB2の活性化に関連している可能性がある。したがって、我々は、SARS-CoV-2感染症の治療のための薬理学的ターゲットとしてCB2を使用する可能性を示唆している。
我々は、CB2を選択的に刺激することで、SARS-CoV-2感染症患者の炎症反応を抑制し、転帰を改善する可能性があると仮説を立てた。
CB2の刺激は、特定のインターロイキンに対するモノクローナル抗体の極めて選択的な作用とは対照的に、多数のサイトカインの産生を抑制する能力があることから、いくつかのチェックポイントにおける炎症性カスケードを制御することができると考えられた。
一方、CB2受容体刺激は、免疫細胞の増殖[124]と抗体の産生[125]を減少させることで免疫抑制効果があることがよく知られている;したがって、COVID-19患者の悪化した炎症反応を抑制するのに非常に有益であると考えられる。
現在までのところ、CB2受容体に特異的に結合する、ヒトでの使用が承認されている市販のアゴニストは存在しない。HU910、HU308およびJWH133は、CB2受容体に対する高い特異性を有し、生物学的プロセスにおけるこの受容体の役割を研究するために推奨され、および
疾患[126]。
カンナビジオール(CBD)は、CB2依存性のメカニズムを介した炎症プロセスの調節にも関与している。CBDは、AEAレベルを増加させることで間接的にCB2活性化を誘導し、アレルギー性接触皮膚炎の実験モデルにおいて、炎症性サイトカインの放出を減少させることで抗炎症特性を発揮す[127]。
新規な∆9-テトラヒドロカンナビノール(∆9-THCP)は、ヒトCB1およびCB2受容体の両方に高い親和性で結合する。特に、CB1に対して示された親和性は、文献で報告されているΔ9-THHCに対して報告されているものと比較して30倍も高く、CB2受容体に対しては5~10倍の活性を示した。
また、Δ9-THCPは、ペンチルホモログであるΔ9-THHCよりも数倍高いカンナビミメティック活性を低用量で示したことも実証されている[127]。
それにもかかわらず、市販のCB2選択的アゴニストを開発するためにはさらなる研究が必要であり、利用可能な植物性カンナビノイドを用いた臨床研究が奨励されるべきである。
もう一つの興味深い研究分野は、COVID-19患者のCB2 Q63Rのスクリーニングであろう。このようにして、この場合もCB2 Q63Rの変異が感染症の素因となっているかどうか、また、最も重篤な副作用(呼吸困難、肺線維症、死亡)の出現と関連しているかどうかを明らかにすることが可能になるだろう。これらの行動はすべて、SARS-CoV-2の病態に関するより良い知識を生み出し、COVID-19患者の管理を大幅に改善する可能性がある。
COVID-19患者におけるオピオイド/カンナビノイドの治療アプローチの可能性
www.tandfonline.com/doi/full/10.1080/17476348.2020.1787836
1. 序論
オピオイドとカンナビノイドは、それぞれの受容体(オピオイド受容体:μ、δ、κ、カンナビノイド受容体:CB1、CB2)の活性化により機能する内因性・外因性化合物群である[1,2]。オピオイド/カンナビノイド系は、鎮痛作用や精神作用のほかに、免疫応答を調節し、免疫関連疾患の進行に影響を与えることから注目されている[3,4]。
オピオイド/カンナビノイドによる免疫応答の調節は、アポトーシスの誘導、細胞増殖の抑制、炎症性・炎症性サイトカイン/ケモカイン産生の抑制、抗炎症性サイトカインの増加、調節性T細胞の誘導によって達成されると考えられている[5,6]。
試験管内試験(in vitro)および生体内試験(in vivo)での研究、ならびにヒトでの知見は、これらのシステムがウイルス複製およびウイルス媒介病理に正または負の影響を与えることを示している。ウイルスの種類によって、オピオイド/カンナビノイド系は、ウイルス感染の結果に異なる好ましい影響と好ましくない影響を与える[7,8]。
宿主の炎症反応が病原性(免疫原性として知られている)であるウイルス感染では、オピオイド/カンナビノイド受容体の活性化は免疫原性の制御に有益である[7-9]。
呼吸器ウイルス関連免疫病理におけるオピオイド/カンナビノイド系の特異的関与と炎症の調節については、いくつかの証拠がある[7,8]。
我々の研究から得られたデータは、オピオイド/カンナビノイド系が、幼児期の最も一般的な炎症性疾患である呼吸器性合胞性ウイルス(RSV)疾患の重症度において重要な役割を果たしていることを初めて証明した[10-12]。RSVの免疫原性は重要な側面の一つであり、肺組織への免疫細胞の浸潤や気道の閉塞により、息切れ、気管支炎、肺炎、さらには死に至ることもあるため、重症化するケースもある[13]。
ヒトの研究と実験モデルを用いて、オピオイド/カンナビノイドシグナル伝達がRSV病変の転帰に有益な役割を果たす可能性があることを示した。
これらの研究では、オピオイド/カンナビノイド受容体の遮断は、免疫細胞の流入やサイトカイン/ケモカイン産生の増加などの免疫病理学の強化、RSV誘発肺病理学や体重減少と関連していた。しかし、アゴニストを用いてこれらの受容体を活性化すると、免疫細胞の流入やサイトカイン/ケモカイン産生が減少し、肺病理が緩和された。
これらの結果は、オピオイド系がインフルエンザウイルスによって誘導される免疫応答を障害したり、調節したりすることを示唆しており、それはウイルス免疫原性の制御に有益であるかもしれない[14,15]。
また、いくつかの研究では、カンナビノイド受容体の欠乏がインフルエンザウイルス感染後の炎症および組織損傷を増加させ、それらの活性化がウイルスによって誘導される免疫応答を損なう可能性があることが示されている[16-18]。
このようなデータや、オピオイド/カンナビノイド系がHIV、HCV、HSVなどの他のウイルスに及ぼす影響[7,8]から、これらの系がウイルス誘発性炎症を緩和することで治療標的となる可能性が示唆されている。
これらのデータをどのようにして新しいコロナウイルスに翻訳することができるのだろうか。
2. オピオイド/カンナビノイド系とCOVID-19
COVID-19は、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)と呼ばれる新しいコロナウイルスによって引き起こされるウイルス性呼吸器疾患である[19]。2019年末に中国でSARS-CoV-2が出現したことにより、世界的に大規模なアウトブレイクが発生し、国際的にも懸念される大きな公衆衛生問題となっている[20]。
現時点では、SARS-CoV-2の病原体に関するデータはほとんどなく、ウイルスの挙動に関するインフォームドコンセントされた推測しかない。しかし、SARS-CoVやMERS-CoVのような過去のコロナウイルスのデータから、自然免疫応答の異常・急増がウイルスを媒介とした病態の主な原因であることが示唆されている[21]。
強力な自然免疫応答はウイルス性病原体を排除するために不可欠であるが、長期化したり、調節異常/高揚したりすると、呼吸器系にダメージを与える可能性がある。基礎疾患、高齢、高ウイルス力価に加えて、集中的な炎症がSARS-CoV-2感染の有害な転帰と相関しているようである[22]。
これに関して、持続的な炎症(サイトカインストームとして知られる)は、重症COVID-19症例の大部分で観察されている[23]。SARS-CoV-2に感染した重症患者の血漿中には、IL-2、IL-7、IL-10、G-SCF、IP10、MCP1、MIP1A、およびTNF-αなどのサイトカインの高濃度が記録されており、サイトカインストームが疾患の重症度と関連している可能性があることが示されている[24]。
重要なことに、リンパ球減少はCOVID-19の特徴であるが、集中治療室(ICU)に入院した患者とそうでない患者では、白血球数および好中球数の増加など、臨床検査所見に多くの違いがある[25]。
これまでのところ、COVID-19のワクチンは開発されておらず、有効な治療法もない。集中的な炎症は疾患誘発性の罹患率および死亡率につながるため、炎症亢進反応を抑制することが薬物療法の決定的な目的である。
類似の感染症および関連する疾患における魅力的な証拠は、急速に成長するCOVID-19のパンデミックへの道を開くかもしれない。例として、重度のCOVID-19感染症患者を治療するために(関節リウマチの治療薬として)IL-6阻害剤を使用することへの関心の高まりに関する報告があり、トシリズマブを投与された重症のCOVID-19陽性患者21人を記載した非査読のレトロスペクティブな中国の経験を含む。
サイトカイン阻害薬は利用可能であり、炎症性カスケードに関与するサイトカインのうちのいくつかにのみ特異的であることに注意することが重要である。確かに、ウイルスの影響に対抗し、病気の症状や重症度を緩和する可能性のある物質が緊急に必要とされている。
オピオイド/カンナビノイドはCOVID-19の効果的な治療法になるのであろうか?
感染は複数のサイトカインによって制御されており、それらは炎症反応を進行させるために協調して作用する。しかし、ウイルス感染の中には、感染中にサイトカインやケモカインストームが起こるものもあり、それを考慮する必要がある。重症のCOVID-19患者では、免疫調節薬によるウイルスクリアランスと免疫病理のバランスをとることが有効であると思われる。
オピオイド/カンナビノイド受容体ベースの薬剤は、免疫細胞の移動およびサイトカイン/ケモカイン分泌を調節することができるので、抗炎症性治療薬を開発するための有望な薬理学的プラットフォームとなる。
したがって、COVID-19に関連する損傷を減少させる有効な治療法がない場合、特にICUに入院し、過度の炎症反応に苦しんでいる患者において、オピオイド/カンナビノイド受容体アゴニストは、COVID-19感染症の有効な治療アプローチを潜在的に開く可能性がある。
オピオイド/カンナビノイド系薬剤は、生体適合性、入手可能性、安価であることが大きな利点である。どのオピオイド/カンナビノイド製品および混合物がCOVID-19の治療に有効であるか、またどのような濃度で有効であるかを決定するためには、さらなる研究が必要であろう。
19世紀後半の医師たちが、アヘンチンキのアノジンを「気管支炎」や乳幼児や子供の他の病気の治療に使用していたことを思い出すのは興味深いことである。また、今日ではカンナビノイドのいくつかの製品は、炎症反応を調節するために使用されている。
このことは、COVID-19の病態生理における欠落したリンクを見つけることを期待して、過去を再発見し、現在を利用することを可能にし、COVID-19の文脈におけるオピオイド/カンナビノイドの利用の問題を提起している。
また、免疫調節活性を有するオピオイド/カンナビノイド製剤の臨床試験の可能性も示唆されている。努力と科学的支援、情報の共有化により、COVID-19の克服が一日も早く実現することを期待している。

