Contents
Circadian Rhythm and Alzheimer’s Disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC6164904/
要旨
アルツハイマー病は、疫学的に重要性が増している神経変性疾患であり、病気の負担が大きいことが特徴である。睡眠に関連した病理学的な症状は、しばしばアルツハイマー病を伴う。サーカディアンリズムの乱れとアルツハイマー病の病因・病態には共通の要因があり、両者を相互に依存したプロセスとして捉える視点も開かれている。
本論文では、これらのプロセスの双方向の関係に焦点を当て、病態生理学的な関連性と臨床的な側面について議論する。両プロセスをリンクさせる共通のメカニズムには、神経炎症、神経変性、概日リズム脱同期などがある。
アルツハイマー病の構成要素としての睡眠特有の症状をタイムリーに認識することは、早期に治療法を提供する機会を得て、より早く正しい診断につながる可能性がある。同様に、適切な睡眠衛生と関連する治療法は、アルツハイマー病患者の管理における優先事項の一つであるべきである。
この叙述的レビューは、アルツハイマー病と概日リズムの乱れを結びつける根本的な複雑性を明確に示すための包括的なアプローチをもたらす。ほとんどの臨床データはメラトニンを含む介入に基づいているが、より大規模な研究はまだ不足している。
ADモデルから得られたエビデンスに裏打ちされた病態生理学的な推論に従って、新規の抗炎症治療やアルツハイマー病における代謝変化を標的とした治療法は、乱れた概日リズムを正常化するために有用であることが証明されるかもしれない。
それを復元することによって、利益は、影響を受けた個人の免疫学的、代謝、および行動機能のために授与されるであろう。一方、バランスのとれた概日リズムは、アルツハイマー病の発症に対してより大きな回復力をもたらすと考えられる。
キーワード
アルツハイマー病、概日リズム、メラトニン、病態生理、睡眠
1. はじめに
アルツハイマー病は、主に認知機能の低下と精神神経症状を特徴とする神経変性疾患である[1,2,3]。アルツハイマー病は認知症の中で最も一般的な疾患であり、症例の3分の2以上を占めているが、血管性認知症は15%のシェアで2番目である。前頭側頭および連想性皮質萎縮、脳室肥大、海馬体積減少はアルツハイマー病に現れる巨視的な神経病理学的所見であるが [4]、これらはそれ自体が特異的で診断的なものではない。微視的な病理学的所見には、伝統的にアミロイドβ(アミロイドβ)の蓄積、および微小管タンパク質の一つである高リン酸化タウが含まれている。臨床診断は、通常、より長い無症状期に先行して行われる。2011年には世界で推定2,400万人がアルツハイマー病に罹患しており[1] 2016年には4,000万人[2]、最終的には2050年には1億3,100万人に達すると予測されている[5]。アルツハイマー病は主に高齢者に影響を与える。先進国では発症率の増加は止まっているが、発展途上国では増加傾向が続いている[6]。
現在のバイオマーカーはアルツハイマー病を除外するためのツールを提供しているが、より早い段階で既存の疾患を確認することは、医療の現場では非常に貴重なものである。臨床診断が専門家の神経学的・神経心理学的検査によって確認される疾患発現時には、アルツハイマー病の発症プロセスはそれ以前から進行している可能性が高い [2]。脳脊髄液分子濃度(アミロイド、タウなど)から、コンピュータ断層撮影(CT)磁気共鳴画像(MRI)または陽電子放出断層撮影(PET)などの脳形態学または機能画像学に至るまで、複数の利用可能なまたは提案されているバイオマーカーがある[7]。現在のところ、疾患の進行に関する大規模かつ長期的な集団データは、併存疾患の医学的管理に意味を持つものではなく、より効果的な戦略を考えるためには、さらなる質の高い研究が必要とされている(同時にアルツハイマー病の生命倫理的な特殊性も無視していない)[8,9,10,11]。常染色体優性アルツハイマー病患者の追跡に用いられるバイオマーカーに基づき、常染色体優性アルツハイマー病における薬理学的介入のための研究プラットフォームを構築した「Dominantly Inherited Alzheimer Network Trials Unit」がその一例である[12]。現在、アルツハイマー病を標的とした治療は、主にコリンエステラーゼ阻害薬(ドネペジル、ガランタミン、リバスチグミン)とN-メチル-D-アスパラギン酸拮抗薬(メマンチン)で構成されているが、精神神経症状を管理するための薬剤が追加されることも多い。アミロイドβ蓄積につながる標的として提案されているものに対処するための複数の試みが行われているが、広く実施できる生物学的治療法の有用性を示す試験は1件も確立されていない[2,14]。迷走神経刺激または深部脳刺激による神経刺激を提供する脳神経外科的オプションは、まだ小規模な実験的なものである[15]。乳腺から脳への移植 [16] や、患者由来の線維芽細胞遺伝子治療とその後の脳組織への移植などの革新的な試みも行われている [16]。インスリン経路は最近、アルツハイマー病の病因形成に関して注目を集めている[17]ので、治療法としての経鼻インスリンの興味深い特徴は、いくつかの希望を与えてくれる。最終的な最終産物と特徴的な病理学的実体であるアミロイドβの除去に厳密に基づいた効果のない治療法は、神経炎症、グリア細胞の活性化、ミトコンドリア機能不全などの基礎となる複雑性に焦点を当てたアルツハイマー病の病態生理学的・分子学的側面の研究に生物医学界が目を向けるように促している[18]。サーカディアンリズムの重要性に最近注目していることは、アルツハイマー病の病態生理を研究する際に、また、治療標的を開発したり、対処したりする際に、追加の要素をもたらしている[19]。このナラティブレビューは、概日リズムとアルツハイマー病の関係への包括的なアプローチを表しており、病因と臨床応用を記述している。
2. アルツハイマー病と概日リズム障害の共有病因機序
アルツハイマー病の原因はよくわかっていない。アルツハイマー病の主な危険因子の一つは高齢化である[2]。最も強い遺伝的危険因子は、アミロイドβの処理に関与する常染色体優性遺伝子であるプレセニリン-1(PSEN1)PSEN2,アミロイド前駆体タンパク質(APP)であるが、全体の有病率の1-5%という比較的小さな部分を占めている[6,20]。この疾患の散発型は、複数の遺伝的要因と環境的要因の複雑な相互作用によって特徴づけられる、未だ解明されていない病態生理学を持つ症例の大部分を占めている[21,22]。アルツハイマー病への感受性を増加させる可能性のある遺伝子はApoEε4であり、アルツハイマー病症例の15-20%はこの遺伝子と関連している可能性がある。いくつかの修正可能な危険因子が検出されており、より高い教育状態、社会的・身体的活動、精神的に刺激的な作業、軽度から中等度のアルコール摂取、および野菜や魚(オメガ3脂肪酸)の摂取によって保護されているようである[6,20]。アルツハイマー病のリスクを高める危険因子は、中年期のメタボリックシンドローム、糖尿病、喫煙、脳血管疾患、栄養不足、外傷性頭部外傷、および毒素への職業的曝露である[6]。特定の危険因子は年齢に特異的なようである。高齢者の血圧、肥満度指数、またはコレステロールの低下は、アルツハイマー病の高い発生に関連付けられている[2,6,20]。
疾患発症に重要であると考えられている多くのプロセスは、病態生理学的にサーカディアンシステムと絡み合っており、したがって、アルツハイマー病に関連する潜在的に共有されている病態発症メカニズムを表している。しかしながら、利用可能なデータは、本文中で提示されている理論的な病態生理学的背景の臨床的意義を評価するには不十分である。その主な理由は、方法論的に十分な臨床研究の欠如と、適切なモデルではないかもしれない散発性疾患のモデル化のためにトランスジェニック動物を使用していることである[23]。
2.1. アミロイドβの産生とクリアランス
1991年には、アミロイドカスケード仮説は、アロイスアルツハイマー[21]の時代にさかのぼる「原因か結果か」の議論を解決するために提案された。この病気の発見以来、アルツハイマー病の病因発生の中心的な問題は、病理組織学が病気を牽引するのか、それとも他の中心的なプロセスのマーカーに過ぎないのかということであり、アルツハイマー博士は個人的に後者の考えを好んでいた[24]。アミロイドカスケード仮説は、過去20年間の学術研究と製薬業界の両方で支持されている最も影響力のある仮説であり、脳実質におけるアミロイドβペプチドの沈着がアルツハイマー病の病理学を駆動する中心的なイベントであると主張している[14]。アミロイドβとアルツハイマー病との関係は、ヒトおよび動物モデルの両方で継続的に認識されてきたが、アミロイドβ沈着は認知的に健康な人にも存在する[25,26,27]。神経変性はプラーク沈着がなくても起こりうる[28]。ダウン症の成人(APPのトリプルコピーを持つ)では、びまん性の非線維性プラークの存在やアミロイドβの上昇にかかわらず、必ず認知症を発症するわけではない[29]。印象的なことに、第III相臨床試験に達したアミロイドβ中心のアプローチは、これまでのところすべて失敗している[14]。しかし、アミロイドβプラークと認知症との間の弱い、あるいは存在しない相関関係は、アミロイド病理学の極めて複雑な背景や、動物とヒトの病態生理の違いの可能性の結果である可能性が残っている[30]。したがって、アルツハイマー病の病因形成におけるその重要性にかかわらず、一度蓄積されると、アミロイドβは重要な病態生理学的負担を表し、細胞機能障害を引き起こす可能性がある。
現在の証拠は、概日リズムと睡眠覚醒周期がアミロイドβのレベルを調節する役割を持っていることを示唆している。実験データによると、野生型マウスおよびトランスジェニックTg2576マウスは、生体内試験マイクロダイアリシスによって示されるように、アミロイドβの日周リズムが顕著であり、アミロイドβ濃度のピークは覚醒時に発生していることが示されている[31]。同様の日内変動はヒトの脳脊髄液(脳間質液)サンプルでも観察された [31,32,33]。腰部カテーテルを用いて36時間にわたって測定されたヒト脳脊髄液のアミロイドβ濃度は、コサイン波を形成しており、最高濃度(覚醒時)と最低濃度(睡眠時)の間に25%の差があることを示す日中パターンと一致している[32]。脳間質液(脳間質液)アミロイドβは覚醒時の滞在時間と正の相関があり、睡眠時の滞在時間と負の相関があり、非遅発性眼球運動(REM)睡眠の量は最も顕著な負の相関がある[31]。メカニズム的な関連性の一つは、最近発見された中枢神経系(中枢神経系)に存在するリンパドレナージのバリエーションであり、髄膜血管系[34]や実質性グリンパティック系[35]と並んで真のリンパ系のネットワークを含む。グリア細胞によって支配されている後者の構成要素は、睡眠の回復機能を解明する上で重要な要素であると考えられている [36,37]。睡眠は、自然なものであれ麻酔薬によって誘発されたものであれ、脳内の間質液空間を60%増加させ、その結果、より大きな対流性のグリアフローとアミロイドβを含む(毒性のある)代謝物のクリアランスを可能にすることが実証されている[38]。さらに、中枢性ノルアドレナリン活性化はグリスファシスクリアランスと逆相関しており、睡眠中はノルアドレナリン刺激が著しく減少した状態である[38,39]。これらの知見は、グリンパティック系機能が主に覚醒状態に関係しており、サーカディアンクロックに直接関係していないことを指摘している。特に、完全な睡眠遮断は、実験動物に連続的な覚醒状態を与えた場合、数日から数週間で死に至るという劇症的な影響をもたらす[40]。これは、致死的な家族性不眠症に苦しむ患者に見られるように、ヒトにおいても同様である[40]。さらに、睡眠遮断はトランスジェニックマウスのアミロイドβプラークを増加させ[31]、逆に睡眠はアミロイドβの産生および分泌を減少させ、そのクリアランスを増強させる[38]。高齢のマウスでは、グリンパ球流量が40%相対的に減少しており、これは加齢がアルツハイマー病の顕著な危険因子であることと一致している[40]。脳脊髄液 アミロイドβ余弦波の振幅は、健康な成人(18~60歳)で最も顕著であり、ピッツバーグ化合物B(PiB)-PETでアミロイド沈着陰性の60歳以上の成人では減少し、アミロイド陽性のPiB-PET所見を有する60歳以上の成人ではさらに減少している[32]。
Kangらは、オレキシンの脳室内投与により脳間質液 アミロイドβが有意に増加し、デュアルオレキシン受容体拮抗薬アルモーレキサントの投与により脳間質液 アミロイドβが減少し、日内変動が消失したことを報告している[31]。しかし、オレキシンの投与は睡眠覚醒周期を調節するため、観察された効果が実際に神経細胞の活動を反映したものであるかどうかは疑問が残る。一方、Maらが発表した研究では、海馬のオレキシンシグナルが時計制御遺伝子の発現にも影響を与え、その中にはBace1やBace2のようなアミロイドβの産生に直接関係するものもあることが示されている[42]。他の研究者もまた、アルツハイマー病関連遺伝子と概日時計との密接な関係について報告している。アミロイドβレベルの調節因子の一つであるPSEN2遺伝子は、視床上核(SCN)でリズミカルに発現しており[13,43,44]、その末梢組織発現は転写および翻訳後機構の両方を介してCLOCK:BMA(英国医師会)Lダイマーによって制御されている[43]。
慢性的な睡眠不足は、心血管疾患および免疫系の変化の危険因子として認識されている[45,46]。上述のグリンパティック系機能障害との関連では、神経変性疾患や神経炎症性疾患にも病態生理学的に関与している[47]。睡眠障害をアルツハイマー病、PD、多発性硬化症と関連付けるデータがあるが[48,49,50]、因果関係は決して明確ではない。興味深い所見は、質の良い睡眠がApoEε4キャリアにおけるアルツハイマー病発症リスクを減衰させたことである[51]。実験データに照らすと、睡眠の持続時間と質を低下させる概日リズムの乱れは、神経変性過程との双方向の病態生理的関係において、自己永続的な悪循環となる可能性を示唆している[52]。
2.2. タウタンパク質の恒常性
神経変性の引き金となることが示されている事象の多様性を説明するために、統合モデルにおける最終的な共通経路としてタウのリン酸化と凝集を用いたタウ仮説が提案されている [53,54]。タウの高リン酸化は、アミロイドβオリゴマー、フリーラジカル、鉄過負荷、ニューロンラフトコレステロール値、低密度リポタンパク質種、ホモシステイン、ミクログリアの調節など、多数の非遺伝的機序によるものと同様に、機能またはアイソフォームの発現を変化させる遺伝子変異[54,55]によって誘発される可能性がある[53]。タウの高リン酸化が引き金となり、結果的にタウ、微小管関連タンパク質、ユビキチンが対になったらせん状フィラメント(PHF)と神経原線維のもつれ(NFT)へと隔離され、微小管の分解が引き起こされる。蓄積されたPHFとNFTは、細胞質機能、軸索輸送、細胞恒常性プロセスを損傷する [56,57]。タウの高リン酸化は、アミロイドβの変化がなくても他の疾患の神経変性を誘発することが示されており[54,57,58]、また、タウの存在やリン酸化および凝集パターンは認知症状の進行と何らかの相関関係があるように思われる[59,60,61]。しかし、これまでに第III相無作為化比較試験(RCT)に至ったタウ指向性化合物は、バルプロ酸のみであり、認知および機能状態に影響を与えなかった[62]。アルツハイマー病におけるタウタンパク質調節経路の生理学的および病態生理学的役割の両方のさらなる解明は、アルツハイマー病におけるタウの複雑な役割を真に理解し、新たな特異的タウ中心の薬剤の開発を指示するために必要である[63]。
睡眠不足と概日リズムの機能不全は、タウ代謝の機能不全につながる可能性がある[64]。現在利用可能な実験データは、概日リズムによって誘発されるタウの変化を完全に理解するには十分ではない。しかし、概日リズムにおける潜在的なタウ誘発性変化については、いくつかの洞察がある。タウに関連した病理学的特徴は、脊髄核、内側傍傍ブラキ核、背側辺縁核、四肢周囲灰白質、視床下部尿細管核、外側視床下部、前脳基底など、睡眠調節に関与する複数の領域に現れる [65]。これらの変化の多くはプレタングル期に起こることから、疾患発症時の睡眠およびサーカディアン障害にタウが関与している可能性があることが示唆される。トランスジェニック動物からのデータは、タウの病理学単独で神経変性に関連した睡眠障害を誘発しうることを示唆している[65,66]。
2.3. 炎症性仮説
神経系で誘発される炎症は末梢性炎症カスケードと似ているが、神経炎症と総称される特定の特徴がある。アルツハイマー病と診断された人の脳では炎症経路が活性化されていることが多くの文献から示唆されている[56,67,68]。炎症がどのようにして始まるのか、また炎症状態の主な原因は何かについてはまだ議論されていないが、ミクログリア細胞、アストロサイト、オリゴデンドロサイト、ニューロンの間の複雑な相互作用によって維持されているようである[56,67,68]。
ミクログリア細胞は、多くの疾患における脳の炎症過程のキープレイヤーであると考えられている[69,70]。ミクログリア細胞は、アミロイドβ、αシヌクレイン、農薬、ウイルス、大気汚染物質、損傷を受けた細胞からの粒子、およびプロ炎症性サイトカインによって活性化されることがある[71]。これは、細胞毒性因子、プロ炎症性サイトカイン、活性酸素種(ROS)腫瘍壊死因子(TNF)-α、一酸化窒素(NO)インターロイキン(IL)-1βなどのケモカインの産生および放出を刺激する。IL-6,IL-8,マクロファージ炎症性タンパク質(MIP)-1α、IL-12,IL-18,さらにはインスリン分解酵素(IDE)のようないくつかの酵素までもが、結果として自己永続的な炎症性反応を引き起こす [56,71]。ミクログリアとのサイトカイン放出の共有に加えて、アストロサイトはアクアポリン-4チャンネルの発現をダウンレギュレートし、グリン系のクリアランスを有意に減少させる [75]。末梢刺激は、感染または組織損傷およびそれに続く病原体関連分子タンパク質(PAMP)または損傷関連分子タンパク質(DAMP)誘導免疫カスケードを介して直接中枢性神経炎症反応を誘発する可能性がある[67,76]。アミロイドβはそれ自体が抗微生物力を持つ急性期応答成分であり[77]、補体系を活性化することができる[78]。このことは、アルツハイマー病の原因因子としての感染を誘発する炎症過程の研究を促している[78]。しかし、アルツハイマー病は未だに単一の犯人がいない多因子疾患であると考えられている。
アミロイドβと基礎となる神経炎症との間の正のフィードバックループは、アルツハイマー病の病原性の特徴である可能性が高い。間接的な神経炎症経路は、血液脳関門の不浸透性を破壊する慢性的な全身性低悪性度炎症、ミクログリアを活性化させたり、免疫細胞の移動を促すサイトカイン介在性シグナル化、迷走神経などの頭蓋神経によって媒介される神経原性炎症を介して構成されている[72,73,74,79]。後者は現在、アルツハイマー病におけるマイクロバイオータ-腸-脳軸相互作用に焦点を当てた研究において特別な関心事である[52,80,81]。
概日リズムは、自律神経系およびコルチゾールシグナル伝達を通じた全身性神経ホルモン調節と同様に、個々の細胞メカニズムを通じた免疫系応答のプロファイルを決定する [82,83,84,85]。活動期では、エピネフリン、ノルエピネフリン、TNF-αの循環レベルとともに白血球のリクルートが増加するのに対し、安静期は内皮接着分子の発現が低下し、骨髄から血液への免疫細胞のプールが増加することが特徴である[86]。中枢の「ツァイトゲーバー(同調因子)」クロックの混乱は、末梢反応の非同期化をもたらし、最終的には、免疫学的脆弱性がより高い状態が続く。したがって、細菌感染とアルツハイマー病 [86]の間の接続は、双方向の正のフィードバックループを構成することができる。微生物相はまた、概日リズムと密接な関係にあるが、アルツハイマー病と腸-脳軸への含意は、全身のインスリン抵抗性と炎症につながる間接的な代謝変化に基づいている可能性があり、最終的には前述の疾患のリスクを増加させる[87]。これらの構成要素のいずれかの障害は、悪循環が開始される双方向の反応をもたらす。免疫と代謝の特徴を結びつける証拠が増えているため、神経炎症を包括的に扱うためには、免疫代謝学的な視点が必要である。炎症」のプロセスは、慢性的な低悪性度炎症、インスリン抵抗性、および睡眠パターンの乱れなどの行動的なものを含む他の老化に関連した変化によるダメージの蓄積の結果として現れる[88,89]。このことは、アルツハイマー病発症における神経炎症を調節する成分としてのメラトニンとインスリンの役割を研究することにも有利である。抗炎症薬[68]、睡眠修飾療法[90]、または経鼻的インスリン[17]によって実験的にアルツハイマー病治療を受けた患者で得られた利益の臨床的証拠は、この考えを裏付けるものである。
2.4. 酸化ストレス
ほとんどの活性酸素は、ミトコンドリアの電子輸送鎖の副産物である。彼らの生産はそれらを除去するために細胞能力を超えている場合、活性酸素は、DNA、タンパク質や脂質への酸化的損傷を媒介し、細胞死を誘導することができる。証拠の大規模なボディは、アルツハイマー病で増加した酸化ストレスの存在をサポートしている。内因性抗酸化物質グルタチオンとカタラーゼの低濃度は、高酸素消費量(20-30%)と多価不飽和脂肪酸(PUFAs)の高含有量とともに脳を脂質過酸化の標的にしやすくし、神経細胞膜にダメージを与え、細胞機能を混乱させるいくつかの二次生成物を産生する [91,92]。脂質過酸化はマロンジアルデヒド(MDA)4-ヒドロキシ-2-ノネナール(HNE)アクロレインのような非常に反応性の高い求電子親水性アルデヒドを産生するが、これらはすべてアルツハイマー病脳で増加していることがわかっている[91,93,94]。脂質過酸化は軽度認知障害(MCI)や前臨床アルツハイマー病の被験者にも存在するようである。このことは、病態生理的には疾患の病態に関連し、臨床的には疾患の進行と治療効果のための潜在的なバイオマーカーとして関連していることを意味している[93,95]。酸化ストレスはまた、タンパク質[96]や核酸[97]にもダメージを与え、病気の病因や進行に影響を与える可能性がある。
アルツハイマー病における酸化ストレスの病因はまだ議論されている。酸化ストレスは、電子輸送鎖の阻害の結果として生じる可能性があり、その結果として複合体IとコエンザイムQに電子が蓄積され、そこで電子が直接酸素分子に供与される可能性がある [98]。もう一つの可能性は、アルツハイマー病でも観察されている抗酸化システムの欠乏の結果として生成されるということである[56]。タンパク質発現のサーカディアン制御が酸化ストレス制御において重要な役割を果たしていることを示唆する証拠が増えている。ラット大脳皮質では、酸化的損傷とグルタチオンペルオキシダーゼやスーパーオキシドジスムターゼなどの抗酸化酵素の活性の両方の昼夜サイクルが1985年に報告された[99]。酸化的損傷から細胞を保護する様々な抗酸化物質と酵素の概日リズム性は、ヒトにおいても示されている。グルタチオンペルオキシダーゼ、グルタチオン還元酵素、カタラーゼ、スーパーオキシドジスムターゼ、尿酸、ペルオキシレドキシンのピークは朝に、メラトニン、血漿中チオール、アスコルビン酸のピークは夕方から夜にかけて観察されている[100]。酸化ストレスの概日性調節の重要性は、ノックアウト動物での知見によってさらに強調されている [101] 。概日性調節障害が酸化的損傷を増強し、加齢に伴う病理学的変化の発生を促す可能性があることを示唆している [100]。
2.5. 血管機能
1993年に最初に提案された血管仮説は、すべての既知のアルツハイマー病危険因子の有害な影響の共通分母として、また神経変性を引き起こす究極の因子として、持続的な慢性脳低灌流を指摘する実験と臨床データに基づいている[102]。慢性脳低灌流のラットモデル(血管仮説で議論されている進行性の病理学的変化を理解するために使用される主なモデル)は、病態生理学的に血管性認知症よりもアルツハイマー病とより密接に関連していると思われる変化を明らかにしている。低灌流によって誘発される変化に最も影響を受けやすい領域は海馬CA1と後頭頂皮質である[102,103]。海馬の血流低下後、神経細胞のエネルギー代謝の著しい障害、アストロサイトーシス、タンパク質合成の低下、タンパク質異常や酸化ストレスの増加、空間記憶喪失、内皮細胞損傷、さらにはアミロイドβ1-42のアップレギュレーションや脳の萎縮が起こり、最終的には細胞死を伴う[102]。ヒトの研究に関しては、アルツハイマー病の血管仮説に重みを与える重要なポイントがいくつかある。血管リスク因子の重要性は疫学的データによって確認されている[104,105]。MCIとアルツハイマー病発症のリスクのある人は、単純光子放出型コンピュータ断層撮影法(SPECT)やPETスキャン検査で示されるように、脳の低灌流と代謝低下がみられる[106,107,108,109]。降圧療法はアルツハイマー病リスクを減少させることが実証されている [110,111]。脳の微小血管の変化は、臨床的および病理学的文脈の両方でアルツハイマー病発症の重要な因子として議論されている[110,111]。
脳血管灌流も概日系の制御下にある。Conroyらは、灌流の日ごとの違いが単独で行動の変化や代謝ニーズによって説明できるかどうかを判断するために、持続的な覚醒の30時間の期間にわたってヒトの脳血流速度(脳血流V)の日ごとのリズムを研究した、または睡眠に依存しない内因性のリズムが存在する場合 [112]。結果は、ヒト脳血流速度は明らかに認知パフォーマンスの低下と心血管/脳血管イベントのコンテキストでのさらなる調査の価値が内因性概日リズムに従うことを示唆している。同様の所見がレーザードップラーフローメトリー[113]によってラットで報告されている。脳血流には、血圧や運動量の概日変化とは無関係に概日リズムの周期性があるようである。概日リズムが血流や脳代謝に及ぼす影響は、今後のアルツハイマー病の発症に重要な血管機能の研究においても考慮されるべきであろう。
2.6. 代謝機能障害
近年、臨床と実験の両方で報告されている神経変性変化との関連性から、代謝異常はアルツハイマー病研究においてより注目されている[114]。代謝異常は疾患の初期に起こるようであり、エネルギー系に影響を与える病態生理学的プロセスがアルツハイマー病の病因形成に重要である可能性が示唆されている。グルコース代謝異常はフルオロデオキシグルコース陽電子断層撮影法(FDG-PET)を用いて生体内試験で評価できるため、このことは臨床的に重要である。増加する証拠の量は、FDG-PETが早期アルツハイマー病の評価に有用であることを示唆している[115,116,117]。脳代謝の顕著な調節因子の一つとしてのインスリンの認識の高まりは、障害されたインスリンシグナル伝達が疾患の開発における重要なプロセスの一つであるかもしれないという仮説につながっている[118,119,120]。脳は長い間インスリン不感症であると考えられていたが、過去数十年にわたって蓄積された証拠は、インスリンの多元的効果が、グルコース代謝、シナプス可塑性、および神経細胞の成長または生存などの恒常性維持にとって最も重要なプロセスのいくつかを調節することを示唆している[120]。
代謝過程は様々なレベルで顕著な概日変動を示す。文献は、安静・絶食と活動・摂食の二極化した行動パターンの文脈で予想されるこの変動が、外部メカニズムと内部メカニズムの両方の影響を受けていることを示唆している[121]。代謝の概日規制の重要性は、概日リズムの外因性[122,123]と内因性[124,125]の混乱が、ヒトと動物の両方でメタボリックシンドロームに関連した変化を誘発する可能性があることを示唆する研究から明らかである。アルツハイマー病発症の重要な危険因子として代謝機能障害を強調する疫学的証拠[126,127,128]と、神経変性における基礎となる代謝障害の病態生理学的因果関係メカニズムを提案する動物研究[129,130]によって補足された文脈では、概日リズムに関連した代謝異常は、加齢に関連した神経病理学の発症における潜在的な因子として考慮されるべきである。
2.7. メラトニン
最も一般的な生物学的クロノモジュレーターであるメラトニンの循環の概日パターンは、光受容性網膜神経節細胞から始まる網膜視床下部視床路突起を介してSCN活性を調節する光信号によって調節される[131]。夜間の光への暴露は、メラトニン産生の重要な調節因子である松果体N-アセチルトランスフェラーゼ[132]の分解を介して、メラトニン合成を急性に抑制することが示されている。メラトニンは、その慢性生物学的な役割が最もよく知られているが、他の多くの進化的に保存されている分子と同様に、多様な生理機能に関与している。メラトニンの生理活性については、メラトニンは二重の役割を果たしている。メラトニンは、SCNの「ツァイトゲーバー(同調因子)」から末梢細胞にサーカディアンシグナルを伝達するだけでなく、フィードバック的にSCNの活性を調節する[133]。あらゆる生物学的システムが適切に機能するためには、あらゆる組織レベルでの同期が不可欠である。調和を維持できないと、システムが許容できるアロスタティック負荷の量が劇的に減少し、結果的に疾患を発症しやすくなる。メラトニン軸の調節障害によるメラトニンのサーカディアンパターンの喪失、またはサーカディアン障害によるメラトニンのサーカディアンパターンの喪失は、非同期性をもたらし、ホメオスタシス機構を損なう可能性がある。
メラトニンの非サーカディアン機能については、免疫系の機能、細胞の保護、ミトコンドリアの機能と生合成、エネルギーの恒常性維持に重要な役割を果たしていると考えられている。メラトニンは、基底状態や免疫抑制下では免疫賦活作用があり、免疫反応が過剰になると免疫反応や炎症を抑制する能力があることから、免疫学的緩衝剤と考えられてきた[134]。メラトニン自体はフリーラジカル消去剤として作用する。メラトニン1分子で10個のフリーラジカルをまとめて除去できる生成物を生成できることが示されている[133]。さらに、メラトニンは、いくつかの重要な抗酸化酵素[135]をアップレギュレートし、プロ酸化酵素をダウンレギュレートし、ミトコンドリアの電子漏出を減少させることによって「ラジカル回避」を誘導する[136]。メラトニンはまた、ATP生成を増加させ、ミトコンドリアのバイオジェネシスだけでなく、マイトファジーを増加させ、それによって機能的な細胞エネルギーをサポートしている[137,138]。さらに、メラトニンは、インスリン抵抗性と高血糖を改善するだけでなく、アルツハイマー病 [139]の開発に重要であると考えられている血液脳関門障害-病態生理学的イベントを阻害することができる。アルツハイマー病 の影響を受ける患者では、メラトニンのレベルが低下しているとメラトニン概日リズムが異常である [140]。これは疾患の前臨床段階でさえ指摘されている[140]。
アルツハイマー病の特異的な原因を見つけるために生成された多数の他の仮説(例えば、金属イオン恒常性仮説やコレステロール仮説[56])は、概日駆動のアルツハイマー病の発症を媒介する他の潜在的な病態生理学的メカニズムを解明するかもしれない[141]。本疾患の非常に複雑な病態生理と、異なる文脈で本疾患のリスク修飾因子や推進因子として証明されている複数の遺伝的・環境的因子を考えると、個々の患者において異なる意味での負担を表すすべての因子を持つ、本疾患の複数のサブタイプが存在する可能性がより高いかもしれない。概日リズムは、アルツハイマー病の発症に関与する多くの異なるプロセスに関連しており、この文脈でさらに検討されるべきである。
3. 臨床から見た概日リズム、睡眠、アルツハイマー病
概日リズムの変化は、健康な老化の間にも、アルツハイマー病 のような加齢性疾患の間にも起こる。しかし、いくつかのデータは、アルツハイマー病における概日リズムの乱れがより顕著であり、疾患発症の有用な追加指標となり得ることを示唆している。起こると思われる変化のいくつかは睡眠に関連しており、夜行性睡眠の断片化、覚醒度の増加、および昼間の活動レベルの低下と昼間の昼寝を伴う [19,142,143]。前臨床アルツハイマー病における概日性障害の診断的意義を完全に理解するためにはさらなる研究が必要であるが、病歴検査に睡眠パターンに関連した質問を含めることは有益であろう。これらの睡眠障害は患者とその介護者に大きな影響を与え、早期の施設入所の主要な危険因子となる。
特定の睡眠変化には、徐波睡眠(徐波睡眠)とレム睡眠の喪失が含まれる。いくつかの研究では、レム相は疾患の初期段階では影響を受けずに留まるが、後期になると減少し始めることが示唆されている[143]。ノンレム(NREM)睡眠の第3段階を表し、しばしば深い睡眠と呼ばれる徐波睡眠もまた、アルツハイマー病患者では持続時間が減少することが示されている [144]。アルツハイマー病患者の脳波(EEG)は、健常対照群およびMCIを患っている患者と比較して、NREM睡眠の特徴の一つであるK複合体(KC)の密度が低下していることを示している [145]。KC密度がMini Mental State Examination(MMSE)のスコアと正の相関を示しており、睡眠障害が認知症の重症度と類似しているという事実を認めていることにも注目すべきである。睡眠が脳の修復機能を持ち、記憶保持に関与していることは以前から知られている[142]。特に徐波睡眠は記憶保持に特に重要であることが証明されている[142]。この現象の背後にあるメカニズムは 2006年にTononiとCirelliによって提案されている[146]-脳波で見られる徐波は、ニューロンのエネルギーが低いことを意味しており、シナプス可塑性と記憶の統合にとってより持続性があり、好ましいものである。高齢者は徐波睡眠が低下していることが知られているが、これはアルツハイマー病ではさらに強調されており、すでに存在する記憶の問題をさらに悪化させている。他の概日変化もアルツハイマー病患者で観察された。Mostらは、アルツハイマー病患者は年齢をマッチさせた対照群と比較して、皮膚近位温度が高いことを報告した[147]。Volicerらは、アルツハイマー病患者は健常者よりもフィットした余弦温度曲線の振幅が高く、温度の先端相(ピークの時間)が遅いことを観察した[148]。アルツハイマー病と睡眠不足の患者では、徐波睡眠は減少している、つまりニューロンが過分極状態でより少ない時間を過ごし、より多くのエネルギー状態で過ごすことを意味し、さらに多くのアミロイドβタンパク質を産生している。この2つの間には双方向のリンクが存在するが、どちらが原因となっているのかはまだ明らかになっていない[33]。
アルツハイマー病患者では、健常者に比べて日中の運動量が少なく、夜間活動の割合が高く、日中の運動量の安定性が低く、アクロフェーズが遅くなっていることがわかった[148]。さらに、規則的な夜行性運動活動のレベルが高いことは、しばしばサンダウニングと呼ばれる午後の終わりから夕方にかけて起こる攻撃的な行動、焦燥感、落ち着きのなさと相関しており、13~66%の患者で診断されている[19]。過度の夜間活動および覚醒として現れる概日リズムの乱れもまた、早期の施設入所の重要な危険因子であるようである [149]。
4. アルツハイマー病と概日リズムの乱れ-ポジティブフィードバックループ
ほとんどの研究は、アルツハイマー病における概日リズムの乱れの因果関係に焦点を当てているが、疾患発症時に起こる病態生理学的変化は、しばしば概日リズムのずれを誘発したり、促進したりする。Schmittらは、アミロイドβが分子時計を乱し、代謝性概日リズム性と細胞の生体エネルギーの変化を誘発することを示している[150]。アルツハイマー病発症におけるミトコンドリアバイオエネルギーの重要性[151]と健康と疾患におけるサーカディアン代謝の関連性[152]を考慮すると、アミロイドβはサーカディアンアロスタシスの潜在的な原因と結果の両方として考慮されるべきである。さらに、病的なタウ生理は、分子レベルと行動レベルの両方でサーカディアン変化を誘導することが、タウパシーのマウスモデルTg4510の研究で示されている。SCNにおけるタウパシーは、視床下部におけるコアクロック蛋白質PER2の周期的発現の障害と並行して観察された。また、海馬の主要なサーカディアンタンパク質であるPER2とBMA(英国医師会)L1についても同様の観察が行われた [153]。アルツハイマー病の発症における潜在的な原因因子として先に議論された炎症は、サーカディアン・モジュレーターとしても知られている。リポ多糖類(LPS)は、炎症性反応を発生させるために研究でしばしば使用され、プロ炎症性サイトカインの生成とSCNへの影響を介して位相シフトを誘導する[154]。酸化ストレスは、アルツハイマー病におけるもう一つの重要な病因因子であり、病気の進行を促進すると認識されているが、試験管内試験と生体内試験の両方の研究によって証明されているように、概日時計系を巻き込むことができる[155]。酸化ストレスによる末梢性概日時計のシフトはストレスへの適応の文脈で議論されているが、分子時計の慢性的な非同期性はホメオスタシスと健康を損なう可能性がある。
最近、アルツハイマー病の文脈でさえ議論されているインスリン系[118,120,156]もまた、概日リズムを調節する。インスリンは、栄養素および内分泌環境に対する末梢リズムを調整するために、肝性概日リズム代謝時計をリセットし[157]、中枢および末梢時計の感度および機能を調節する[158,159]。代謝異常がアルツハイマー病発症を誘発し、さらに促進し、それと並行して概日リズムの恒常性の異常を引き起こす可能性があると推測される。これは、Baileyら[121]によってレビューされた代謝プロセスと概日リズムの双方向の調節を明らかにした知見に照らして、インスリンだけでなく、代謝全般に当てはまる可能性がある。さらに、サーカディアンシステムの障害は、時計を制御するニューロンの変性の結果である可能性がある [160,161] アルツハイマー病における明らかな概日リズムの異常のための別の可能な説明を提供している。アルツハイマー病 の概日性の結果と アルツハイマー病 病因発症における概日性関連メカニズムの可能性から明らかなように(第 2 章を参照)アルツハイマー病 の概日性の結果と アルツハイマー病 病因発症における概日性関連メカニズムの可能性がある(第 2 章参照)。アルツハイマー病 と概日リズム機能不全の共通の病因機序 概日リズム異常は、臨床的な文脈で認識されている疾患の推進因子と増悪因子の両方として議論することができる(図 1)。
図1
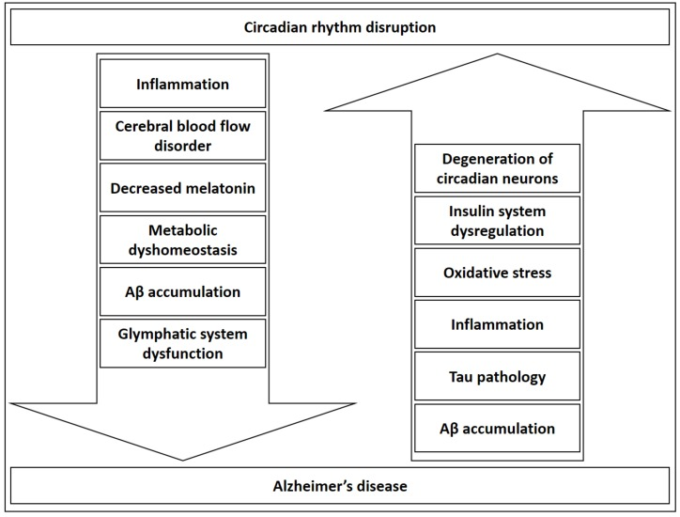
概日リズムは、炎症、脳血流、メラトニン産生、アミロイドβクリアランス、グリン系、代謝など、アルツハイマー病の発症と進行に関与していると考えられている重要なプロセスのいくつかを調節している。さらに、アルツハイマー病の初期の病態生物学的変化または後期の病態生理学的結果のいずれかに関連するイベントのいくつかは、潜在的なサーカディアンディスラプターとして知られている。アルツハイマー病に関連する最も重要な概日性障害メカニズムとしては、概日性シグナル伝達に重要な神経細胞および神経経路の神経変性、インスリン系の調節障害、酸化ストレス、炎症、およびアミロイドβおよびタウの病理学的ホメオスタシスが挙げられる。アミロイドβ-アミロイドβ。
5. 診断の可能性
睡眠障害とアルツハイマー病との間には双方向の関係があり、睡眠病理や概日リズム機能障害を効率的かつ正確に特定することが重要となっている。これは、すでにアルツハイマー病と診断されている患者で、睡眠障害によって認知機能の低下が悪化する可能性がある場合や、睡眠パターンの変化や安静時活動リズムの不規則性がアルツハイマー病の早期診断マーカーとして利用される可能性があるリスクのある患者においても重要である[162]。認知症患者では、安静時活動のタイミングの異常は施設入所の予測因子であり、生存率の低下とさえ関連していることが実証されている[149,163]。
ヒトの概日リズムは、血漿メラトニンレベルの測定(通常、覚醒の2時間前にピークを迎える)や、直腸体温計を用いた体温の追跡(覚醒の1~2時間前にはメラトニンレベルとは逆に低くなる)など、いくつかの方法を用いて直接観察することができる[164]。直腸体温計は入手しやすいため、より一般的に使用されているが、体温レベルが内部および外部の交絡因子の影響を受けやすいという点で、血漿メラトニン測定よりも不利な点がある。メラトニンレベルはまた、より高い振幅と明確な位相を持っている [165,166]。これらの方法は、実験環境における概日リズムの理解を深める上で非常に有用であることが証明されているが、おそらく臨床現場での日常的な使用には侵襲性が高すぎる。その代わりに、概日リズムの行動アウトプット(主に睡眠-覚醒サイクルと活動レベル)を、簡単に観察可能でありながら関連性のある代替パラメータとして使用することができる [167]。「睡眠覚醒周期」はしばしば「概日リズム」と同義で使用されるが、睡眠のタイミングは睡眠圧や覚醒などの他の要因にも依存するため、概日リズムを完全に反映したものではないことに注意すべきである[33]。
「睡眠覚醒障害」の報告はしばしば非特異的であり、睡眠時間の減少、睡眠の遅れ、頻回の覚醒、または日中の眠気から、夕方に発生する混乱、徘徊、または攻撃性に至るまで、何でも包含している[168]。これらの問題の性質は多面的であり、それらの共存の程度は十分に文書化されていない。いくつかは、異なる病態生理学的機序と結びついた、異なる症状を表すことがある。例えば、アルツハイマー病の特徴的な行動症状である「サンダウニング」は、概日リズムの客観的な異常と関連している午後遅くから夕方にかけての動揺からなり、必ずしも「睡眠障害」の訴えと相関しているわけではないようである[148]。しかし、十分に分析され記述された方法は、疾患の初期段階であっても、疾患の進行に関する貴重なデータを提供することができる。最近発表された研究では、アクチグラフィでモニターした45~75歳の健康な人の睡眠効果の低下は、認知機能は正常であったが、アミロイド沈着を示唆していた[169]。
5.1. 既往歴とアンケート
睡眠覚醒障害の評価の最初のステップは、可能な限り正確な病歴であり、アルツハイマー病患者では通常、介護者による付随的な病歴が必要となる。併存疾患、投薬、睡眠衛生に関連する習慣についての情報に加えて、理想的には、夜間の睡眠のタイミングと質、夜間の覚醒、夜間行動症状の性質と頻度、昼間の昼寝の頻度と期間を詳細に記載した睡眠日誌を含むべきである。ピッツバーグ睡眠品質指数やEpworth Sleepiness Scaleなどの伝統的な睡眠質問票は、アルツハイマー病患者が病気の初期段階で自分自身を強調することが示されているため、限られた使用法であるように思われるが、介護者は患者が後期段階で質問票を記入するのを助けることによってスコアに影響を与える可能性が高い [170,171]。Neuropsychiatric Inventory(NPI)やSleep Disorders Inventory(SDI)などのツールは、アルツハイマー病における睡眠障害の定量化に有用であろう。SDIはアルツハイマー病によくみられる7つの睡眠症状に関する質問を含み、重症度、頻度、および介護者の苦痛について評価している。SDI はアクチグラフィ所見との優れた相関性を示し、短く、比較的単純であり、(従来の睡眠ログとは異なり)1 回の訪問のみで投与が可能である [172]。病歴はまた、いびき、下肢不快感、睡眠中の無呼吸や下肢の動きの目撃に関する質問を行い、併存する一次性睡眠障害のスクリーニングを行うべきである。原発性睡眠障害は、健康な高齢者と比較してアルツハイマー病ではより多くみられる。夜間覚醒および昼間の眠気の一般的な原因である閉塞性睡眠時無呼吸(OSA)などの睡眠関連呼吸障害は、アルツハイマー病患者の40~70%に見られる[173,174]。落ち着かない足症候群(RLS)は、主に入眠困難を引き起こすが、認知症患者の24%に存在すると考えられている[175]。OSAもRLSも治療可能な可能性があるため、症状がこれらの障害に起因するかどうかを判断することは重要である。
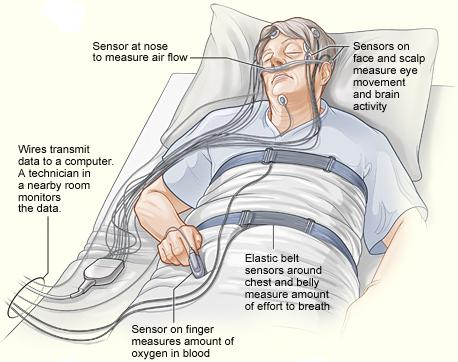
5.2. 多眠検査
睡眠ポリグラフ(PSG)は、睡眠を客観的に評価するためのゴールドスタンダードな検査である。睡眠ポリグラフ検査では、睡眠潜時、睡眠時間、睡眠構造から、心拍数、酸素飽和度、呼吸運動、四肢の動き、体位の切り替えに至るまでのパラメータに関する情報を得ることができる。睡眠関連呼吸障害の診断には事実上不可欠である。しかし、概日リズム障害や他のアルツハイマー病関連の睡眠障害を客観的に判断するには、患者を7日以上にわたって観察する必要があり、高価で機器の多いPSGは、使用するにはかなり非現実的な診断方法となっている[176]。さらに、多数のセンサーと一般的な睡眠ラボの環境は、非常に不快で睡眠を妨げ、被験者のある程度の協力を必要とするため、認知症の患者では問題となることがある。
5.3. アクチグラフィ
客観的な睡眠分析のためのもう一つのツール、特に概日リズムの乱れを調べるのに便利なのがアクチグラフィである。アクチグラフィでは、指定された期間(理想的には少なくとも1週間)身体の動きをモニターする腕時計のような装置を継続的に着用する。それは睡眠と覚醒の期間に対応すると仮定されている活動と不活動の期間の情報を提供する。研究では、健常者と認知症患者の両方において、特に総睡眠時間の測定において、アクチグラフィを用いた評価と脳波所見との良好な相関関係が繰り返し示されている [176,177,178]。この検査はPSGよりも費用がかからず、侵襲性も低いため、認知症の患者にとっては耐えがたいものである。しかし、日中の昼寝や睡眠潜時などの変数を特定する際のアクチグラフィの有効性は限られている [179]。さらに、アルツハイマー病患者のかなりの部分を占める入院患者や寝たきりの患者では、識別の特異性が低下する可能性がある。米国睡眠医学アカデミーは、文脈に沿った情報を提供し、交絡因子の影響を最小限に抑えるために、アクチグラフを睡眠ジャーナルと同時に使用することを推奨している[176]。アクチグラフの中には、主要な睡眠期間と夜間の覚醒を識別するのに役立つ光センサーが含まれているものもある。

6. 潜在的な治療戦略および予防戦略
アルツハイマー病における概日リズムの乱れに焦点を当てた診断戦略は、病気の進行を遅らせ、症状の一部を軽減するために、概日リズムの乱れの予防と治療のための計画を設計するのに役立つ可能性がある。強力な科学的根拠に裏打ちされたエビデンスに基づいたガイドラインを作成するためには、より多くの研究が必要であるが、このテーマに関する現在の知識は、次の段落で議論されるいくつかの潜在的な戦略を提供している。
6.1. 薬物療法と併存疾患の最適化
アルツハイマー病に関連する概日リズム障害と睡眠覚醒障害の管理は、睡眠を妨げる可能性のあるあらゆる併存疾患の管理から始めるべきである。前立腺肥大症、排便障害、うっ血性心不全、慢性閉塞性肺疾患、胃食道逆流、および関節炎は、高齢者によく見られる痛みおよび/または不快感の重要な原因であり、睡眠関連の介入を進める前に対処する必要がある[180]。同じことが睡眠に影響を与える精神疾患、例えばうつ病のような精神疾患にも当てはまり、アルツハイマー病患者の最大50%に存在すると推定されている[181]。さらに、睡眠潜時、頻回の覚醒、または日中の眠気のいずれかを引き起こす可能性のある薬物の投与量を見直すべきである。例としては、利尿薬、気管支拡張薬、コルチコステロイド、抗ヒスタミン薬、抗うつ薬、および抗パーキンソン薬が挙げられる[182]。アルツハイマー病自体の治療に使用されるアセチルコリンエステラーゼ阻害薬のドネペジルとリバスチグミンは、夜間に服用すると不眠症や悪夢を引き起こすことが知られている;しかしながら、投与量を日中に早めに移動すると、睡眠の質を改善し、レム睡眠の割合を増加させるようである[183,184]。最近FDAに承認されたオレキシン受容体拮抗薬であるsuvorexantは、睡眠効率を向上させることが証明されており、期待できるかもしれない[185]。
6.2. 睡眠衛生と環境対策
「睡眠衛生」という用語は、睡眠の質を向上させることを目的とした一連の行動と環境の推奨事項を指する。睡眠衛生の基本原則には、規則的な睡眠スケジュールを維持すること、毎日の運動に従事すること、日中の昼寝を最小限に抑えること、カフェイン、アルコール、およびタバコの使用を制限すること、睡眠環境を暗く静かに保つこと、および一般的に就寝時近くの光を制限することが含まれる [186]。多くの場合、刺激制御療法の戦略には、固定された就寝時間のルーチンを開発するか、または睡眠のためだけにベッドを使用することが含まれる。
行動因子および環境因子は、加齢に伴う睡眠パターンの変化に寄与している可能性が高い。高齢者の1日のスケジュールは、定年後には構造を失うことが多く、食事時間は不規則になり、痛みやその他の併存疾患により身体活動が低下し、退屈や孤独感がより一般的になる [187]。認知症の患者はベッドで過ごす時間が長く、日中の昼寝も頻繁に行われている。介護者が負担を軽減するために励ますこともある[188]。介護施設で暮らす高齢者では特に睡眠衛生状態が悪い。老人ホームの居住者は、1日に明るい光にさらされる時間が約9~11分(若年者では約60分、在宅の高齢者では約40分)しかなく、平均は重度の精神障害を持つ施設に入院している患者では1日1分にまで急落している [166,189,190]。老人ホーム環境では、夜間の騒音や光の理想的なレベルよりも高いレベルに加えて、スタッフによる頻繁な中断(例えば、失禁ケアや褥瘡のチェックなど)が夜間の覚醒のかなりの部分を占めている[191]。これらの決定要因を改善することは、一見したところ、早期の介入の良い目標である。
認知症患者とその介護者を対象とした睡眠衛生教育プログラムは中程度の成功を収めているが、介護者の関与が必要であり、施設では実現性が低いと思われる [192,193]。日中の身体活動および/または社会活動を増やすことによって睡眠の質を改善しようとする介入の結果はまちまちである [194,195,196]。介護施設の患者に対する環境介入(ウェットチェック時の騒音レベルの低減や、見ていないテレビの電源を切るなど)だけでは、同様に限られた成功例しかなく、騒音と光のレベルの大幅な改善は、睡眠と動揺のスコアの改善を最小限にとどめている [197]。最も有望な結果が得られたのは、これらのアプローチのいくつかを組み合わせた多成分介入である [198,199,200]。これらの非光ベースの非薬理学的戦略の有効性に関する証拠はまだ決定的ではないが、これは利用可能な研究における方法論的な弱点の問題であり、これらの方法のさらなる実施を妨げるものではない[201]。これらの方法は、その簡便さと副作用の欠如により、認知症患者の睡眠覚醒障害の治療の基礎となっている。
人工光は、対処すべきもう一つの重要な潜在的な概日リズム障害物質である。世界人口の約75%が夜間に人工光にさらされている[202]。夜間の光曝露のかなりの量は、電子機器によるものである。これらのデバイスの中には、本質的に光感受性の高い網膜神経節細胞を活性化する単色の青色光を発するものがある[203]。電子書籍リーダーからの就寝前の人工光のレベルが低い場合でも、メラトニンの分泌を減少させ、眠気を減少させ、入眠までの時間を長くし、翌朝の覚醒度を低下させることがある[204]。
不要な音と定義される騒音は、心理的にも生理的にも人に影響を与える。過度の騒音は免疫系を抑制し、感染の可能性を高め、胃の分泌を増加させ、下垂体と副腎を刺激し、生殖能力を低下させることが報告されている[205]。また、騒音は概日リズムの乱れを誘発し、睡眠の質を低下させることで間接的に引き起こされる可能性が高い [205,206,207]。騒音はアルツハイマー病と関連している。慢性的な騒音暴露は、タウの高リン酸化、アミロイドβ蓄積、NFT形成を誘発し、興奮毒性と酸化ストレスを誘発することが提案されている[208]。また、慢性的な騒音は、グルコースの恒常性を乱してインスリン抵抗性を誘発し、コルチコステロンを増加させて腸内細菌叢の異常を誘発し、炎症を増加させることも示されている[209,210]。これが、世界保健機関(WHO)が、病棟内の騒音レベルが夜間に30dBAを超えてはならないと推奨している理由である。残念ながら、病院内の騒音レベルはもっと高いという研究報告がある[205]。
アルツハイマー病の進行を遅らせ、概日性非同期化の負担を軽減するためには、アルツハイマー病患者は概日性撹乱因子のない最適な環境で生活すべきである。これを確実にするためには、日中は十分に高いレベルの光を、夜間は十分に低いレベルの光を配分すべきであり、一方で環境騒音は理想的には夜間に減少させるべきである。可能であれば、電子機器の配置は前述の概念に従うべきである。
6.3. 身体活動
サーカディアンの乱れを予防し、サーカディアン再同期を刺激するための対策の一つとして、計画的な運動が提案されている。しかし、その効果がどのようにして得られるのかは不明であり、基礎研究、応用研究ともに多くの方法論的障害が存在している[211]。
しかし、運動が他の概日再同期化法を増強するために使用できる可能性[212]と、余暇時間の身体活動がアルツハイマー病に対する保護的であるという証拠[213]との組み合わせを考えると、疾患の異なる病期の患者やアルツハイマー病発症の危険因子を持つ健康な人々に対して適切な身体活動の推奨事項を設定する必要がある。
6.4. 食事のタイミング
睡眠時の強制活動による概日リズムの乱れは、げっ歯類の食事タイミングを変化させる [214]。食事のタイミングと内容(炭水化物を好む)に影響を及ぼす概日リズムの非同期化は、夜勤労働者でも示されている[214,215]。興味深いことに、食事のタイミング、質、量が概日リズムの乱れを防ぎ、さらには概日リズムの再同期化を誘発することが示されている。動物では、低カロリー食とその結果としての体重減少は、食事が制限された概日位相に関係なく、概日振幅を増加させることが示されている[214,216]。食物のタイミングは、中枢と末梢の振動子の複雑な相互作用を通してその活動を発揮するサーカディアンシステムの強力な同期化[217]または非同期化[218]であり得ることを示す証拠がある[219]。この仮説をエビデンスに基づいた推奨に定式化するには質の高い臨床データが必要であるが、食物による末梢および中枢振動子の再同期化もアルツハイマー病において有益である可能性が示唆されている[220]。食事時間に対する代謝および消化の時間的調整は、食物からの適切な栄養素の抽出とその結果としての代謝、内分泌、およびその他の生理学的変化に重要であるため[221]、乱れた概日リズムの再同期化と適切な栄養素のタイミングは、アルツハイマー病患者にとって有益である可能性がある。ある研究では、認知と行動の悪化と概日リズムの変化により、エネルギーを最も多く消費する食事が昼食か夕食のいずれかである従来の食事習慣がアルツハイマー病患者には不適切であることが示唆されている[222]。アルツハイマー病患者でエネルギー消費がピークに達する午前中に最もエネルギー密度の高い高品質の食品を提供するように、食事提供プログラムを再設計すべきである [222]。
6.5. 明るい光治療(BLT)
2000年の研究[223]では、4週間の間に毎日2時間の明光療法(BLT、約3000ルクス)を投与したところ、27人のアルツハイマー病患者(平均年齢79.9歳)の概日リズムが改善したことが示された。具体的には、昼間の睡眠が減少し、夜間の睡眠が増加した。臨床的認知症評価(CDR)スコアは試験期間中変わらなかったが、MMSEスコアは全例で改善した。
結論として、BLTは睡眠と覚醒のサイクルを有意に改善し、アルツハイマー病の初期段階と診断された人の認知状態を改善した。しかし、いくつかの研究では、光治療の肯定的な効果を発見していない[224]一方で、施設に収容された70人のアルツハイマー病患者を含む別の研究[225]では、11週間の間に約2500ルクスのBLTを午前中に1時間受けた群と対照群との間で睡眠覚醒サイクルに差がないことを発見した。
しかし、介入群では安静時活動リズムが安定していることが証明された。これらの結果の不一致の理由は、参加者の平均年齢、参加者の数、増加した光の暴露時間、および使用した光の強さの違いにあると考えられる。それにもかかわらず、いくつかの研究 [223] は非常にポジティブな結果を示しており、より多くの参加者を対象とした決定的なRCTの実施を促している。

6.6. メラトニン
メラトニンは、アルツハイマー病における概日関連の問題の潜在的な治療法として提案された。その効果は、病態生理学的データに基づいて有望と考えられていたが、これまでのところ経験的な臨床的証拠は、顕在性アルツハイマー病におけるその有効性を支持していない。しかしながら、サンダウニングを改善する可能性があるという適応がある [226,227]。しかし、他の研究[228,229]では、睡眠の質や焦燥感の減少のためのメラトニンの利点を示していない。これらの否定的な結果のために考えられる説明は、試験の期間が短いことと、アルツハイマー病や認知症の様々な段階の患者を含めることである。長期研究[227,230]では、アルツハイマー病患者の睡眠障害の改善が証明されている。
追加の延長放出メラトニンもまた、MMSE[231]によって測定されるように、睡眠効率の向上とより高い認知パフォーマンスの結果を示した。最後に、単独療法としてのメラトニンに関する無作為化対照試験のメタ解析が行われた[232]。そのメタアナリシスでは、アルツハイマー病患者における総睡眠時間の改善が示されたが、認知状態には効果がなかった。このメタアナリシスでは、短期と長期(10日から24週間)の両方の研究を考慮に入れたことは注目に値する。アルツハイマー病のコンテキストでメラトニンの証拠のより完全なレビューについては、Cardinaliら[233]を参照してほしい)。)
その興味をそそる生物学的効果(免疫調節、細胞保護、ミトコンドリア機能の促進、生体形成とエネルギー恒常性)のために、メラトニンはまだこの文脈で探求する価値がある興味深い候補である。サーカディアンリズムの研究が進み、投与経路や投与時間に焦点を当てたより強固な研究が進めば、動物実験と臨床の間でのメラトニンの有効性の不一致のいくつかが明らかになる可能性がある。
6.7. ブライトライト療法とメラトニンの併用
2008年の研究[234]では、明るい光療法単独では夜間の睡眠や休息活動リズムは改善しなかったが、メラトニンと併用した場合には改善したことがわかった。無作為化比較試験では、アルツハイマー病と86歳の平均年齢を持つ50人の被験者が含まれていた。1つのグループには、朝1時間のBLT(視線方向に2500ルクス以上)を10週間かけて照射し、プラセボを投与した。2番目のグループは同じ光治療にさらされたが、夕方にメラトニン(5mg、中等度の薬理学的用量)を追加投与され、3番目のグループは約150〜200ルクスの典型的な室内光を受けた。第2群の被験者は日中の活動量が多く、日中の眠気が少なくなり、結果として健康的な日中のパターンが得られた。しかし、夜間の睡眠に関しては顕著な変化は観察されなかった。これらの改善がメラトニンのみによって引き起こされたのか、あるいはメラトニンと明るい光の治療との相乗効果によって引き起こされたのかは不明である。

natgeo.nikkeibp.co.jp/nng/article/20150107/430923/?P=4
7. 結論
本論文は、概日リズム障害と アルツハイマー病 病因の間の相互作用の複雑なネットワークを明らかにしている。このレビューの物語形式は、理想的には、トピックに関連する最新の知識を評価するリソースとして、洞察力のある方法でこれらの複雑さを示すべきである。このような論文の第一の価値は、システマティックレビューで客観的に定義されている一定の方法論的制約を受けずに、より包括的な方法で特定の知見を取り上げる可能性があることである。しかし、この論文の限界は、その主観性と自由度に由来するものであり、これは提示方法や選択した参考文献の点でバイアスがかかる可能性がある。この点で、著者らは、主に、科学的根拠に基づいた主張を、ナラティブレビュー論文にふさわしいと考えられる方法で行うことで、学術的アプローチを維持しようとしている。
結論として、サーカディアンリズムとアルツハイマー病との間の複雑で意味のある関係を支持する証拠(臨床研究と動物研究の両方から)が増えている。アルツハイマー病の病因を説明するために多くの仮説が立てられているが、まだ完全に解明されていない。しかし、概日リズムは、アルツハイマー病の発症や進行に関与することが知られているすべてのシステムや危険因子ではないにしても、ほとんどのシステムと相互作用している。したがって、それは可能性のある疾患の予防や治療のための興味深いターゲットとなる。アルツハイマー病と概日リズムの関係は双方向であるように思われ、最適な目標は、概日リズムの介入によって病気の進行に意味のある影響を与えるか、少なくとも価値ある症状の緩和を提供し、社会経済的なコストと苦痛を大幅に軽減することであろう。完全個別化医療を目指す精密医療の時代にあって、概日リズムとアルツハイマー病の関係をより深く理解することは、エビデンスに基づいた包括的なアプローチを成功させ、より効果的な治療法を提供するのに役立つはずである。

