Contents
Can targeting autophagy become a new approach to COVID-19 treatment?
ナミタ・ミトラ
ナミタ・ミトラ著 2021年10月25日
Reviewed by Benedette Cuffari, M.Sc.
はじめに
現在、コロナウイルス感染症2019(COVID-19)のパンデミックを抑制するために、世界中で広範なワクチン接種キャンペーンが行われている。ワクチン接種は、重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の感染を防ぐための有効な予防策となるが、科学界では、すでに感染したCOVID-19患者を治癒するための強力な治療法の開発に苦慮している。
研究の様子 SARS-CoV-2と戦うためにオートファジーを活用する:最近の医薬品開発の取り組みを踏まえた最新情報。画像出典:Kateryna Kon / Shutterstock.com
ワクチンは迅速に開発され、かつてないほどの速さで販売されたが、医薬品の開発は伝統的にはるかに時間がかかるものであった。このような緊急性を考慮すると、薬剤の再利用は有望な戦略として浮上しており、すでにいくつかの前臨床試験や臨床試験で実施されている。
Journal of Cellular Biochemistry誌に掲載された最近の総説で、著者のTheo Rein博士は、COVID-19の治療において世界保健機関(WHO)のSolidarityプログラムで現在評価されている特定の薬剤の潜在的な寄与メカニズムとしてオートファジーについて論じている。
コロナウイルスによるオートファジーとその操作
オートファジーは、進化的に保存された細胞内の自己分解プロセスであり、誤って折り畳まれたタンパク質の除去、損傷した細胞小器官の除去、ウイルスを含む細胞内病原体の除去など、ハウスキーピングとして重要な役割を果たしている。
オートファジーでは、分解されるべき細胞要素が、オートファゴソームと呼ばれる二重膜構造に取り込まれる。このオートファゴソームは、最終的にリソソームと融合してオートリソソームとなり、分解が行われる。この分解カスケードによるオートファゴソームの分解速度は “オートファジックフラックス “と呼ばれている。
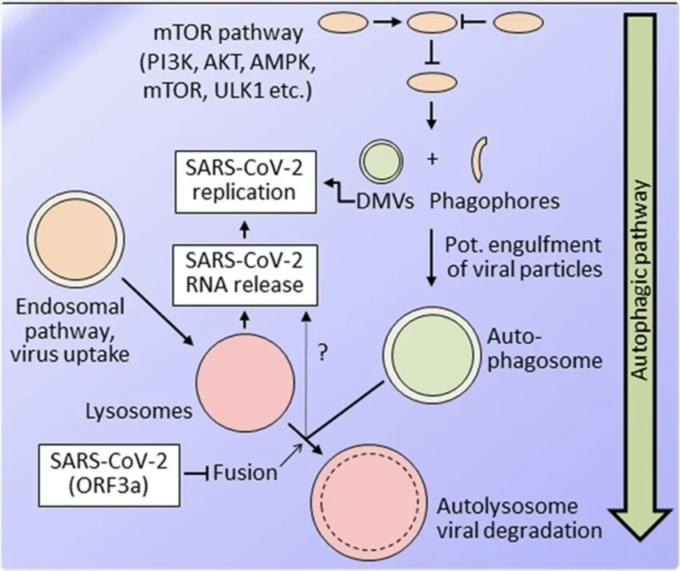
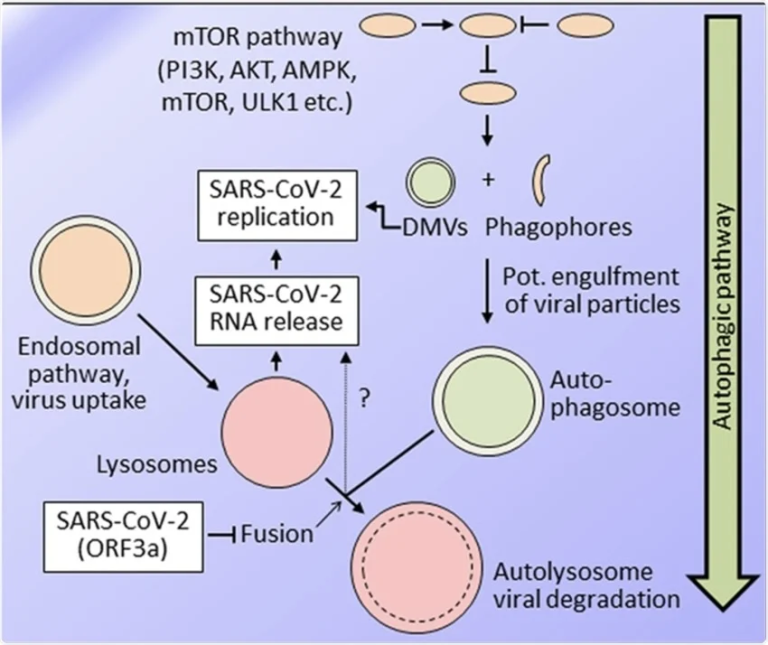
重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)の複製とエンドソーム・オートファジー経路の簡略図。現在の知見では、SARS-CoV-2の複製に対するオートファジー経路の有益な効果と有害な効果の両方が支持されている。SARS-CoV-2の主な侵入経路はエンドソームへの取り込みであり、ウイルスRNAの放出にはリソソームの酸性化が必要である。自食作用経路は、多因子・多段階の経路であり、薬理学的な標的となる可能性は広大である。より初期の段階では、ファゴフォア、および二重膜小胞(DMV)が形成されるが、これは小胞体から形成される可能性が最も高く、また一部のコロナウイルスタンパク質によっても促進される可能性がある。SARS-CoV-2の複製は小胞体でも行われ、同一ではないにしても非常によく似た膜構造で行われる。SARS-CoV-2は、ウイルスを分解するオートファジーの最後のステップ、すなわちオートファゴソームとリソソームが融合してオートリソソームを形成することを阻害し、オートファジーフラックスを阻害する。したがって、オートファジーに影響を与える化合物は、オートファジー・フラックスを促進する場合にのみ、SARS-CoV-2に対して効率的に作用することが期待される
オートファジーのプロセスは、膨大な数のタンパク質によって厳密に制御され、実行されている。 ウイルス感染を含むさまざまな病態にオートファジーが関与していることから、世界中の科学者たちが、オートファジーカスケードのタンパク質を標的とした薬剤の開発を試みている。
自食作用の初期段階で必要とされる小胞体由来の二重膜構造が、コロナウイルスでは複製サイトとして機能するように工夫されている。さらに、コロナウイルスの非構造タンパク質は、これらの二重膜構造の形成を誘導する。
コロナウイルスは、初期の段階を操るだけでなく、オートファジーの後期の段階にも干渉して分解を免れることができる。SARS-CoV-2に関しては、最近、ORF3aタンパク質がオートファゴソームとリソソームの融合を阻害することが報告されている。その結果、ORF3aはオートファゴソームを増加させるが、オートファジックフラックスを減少させ、オートファジーからの逃避を可能にしている。したがって、著者は、オートファジーの薬は、カスケードの他の側面ではなく、オートファジーフラックスの促進をターゲットにすることを強調している。
以上のことから、コロナウイルスは、オートファジー経路の初期段階では恩恵を受けるが、オートファジーフラックスの増加には弱いと考えられる。この発見は、オートファジーを誘導することでコロナウイルスの感染に対抗できる可能性があることを示した過去の報告にも裏付けられている。
「オートファジーはほとんどの細胞で作動する保存されたメカニズムであるため、オートファジーを薬理学的に誘導することで、化合物が到達するすべての臓器でSARS-CoV-2に対抗できる可能性がある」と述べている。
COVID-19の再利用薬をテストするWHOの “連帯 “イニシアティブ
WHOは当初 2020年に研究プログラム「Solidarity」を立ち上げ、抗ウイルス治療の選択肢として、レムデシビル、インターフェロンβ1a(IFN- β1a)ヒドロキシクロロキン、ロピナビルとリトナビルの併用という4つの化合物を試験した。残念ながら、COVID-19の患者11,330人を含む研究の中間報告では、ほとんど効果がないことが明らかになった。
Solidarityプログラムにおけるより最近の取り組みでは、インフリキシマブ、イマチニブ、アルテスネートといった3種類の確立された免疫調整薬を評価している。これらの薬剤は、SARS-CoV-2に直接対抗するのではなく、過剰な免疫反応やサイトカインストームの結果として生じるダメージを抑制するという理論に基づいて選択されている。
今回の研究では、これらの薬剤の作用にオートファジーが関与している可能性が指摘されており、一般に知られているよりも重要な役割を果たしている可能性がある。
アルテスネート
アルテスネートは、アルテミシニンの誘導体で、抗マラリア作用と強力な抗がん作用が確立されている。この薬剤は、免疫系に作用することから、WHOの連帯プログラムに加えられた。いくつかの研究では、アルテスネートによるオートファジー誘導のメカニズムが報告されており、オートファジーフラックスの増強も報告されている。
インフリキシマブ
インフリキシマブは、腫瘍壊死因子α(TNF-α)を標的としたキメラ抗体であり、クローン病などの自己免疫疾患の治療薬として臨床現場で使用されている。インフリキシマブを含むクローン病の治療薬として承認されている、あるいは臨床試験中の薬剤に関する最近の報告では、その効果に寄与するメカニズムとしてオートファジー誘導が示唆されている。しかし、インフリキシマブのオートファジーへの影響を具体的に検討するには、さらなる研究が必要である。
イマチニブ
イマチニブは、慢性骨髄性白血病の治療に用いられるABLチロシンキナーゼ阻害剤である。いくつかの研究では、 イマチニブのオートファジー誘導効果が報告されており、 オートファジーフラックスの評価も行われている。とはいえ、 イマチニブがオートファジーを誘 導するという結論を確かなものにするには、 より広範なオートファジーフ ラックスの評価法を適用した、 より多くの研究が必要である。
抗SARS-CoV-2抗体が期待できるその他のオートファジー誘導薬
Antidepressants
COVID-19患者が抗うつ剤治療の恩恵を受けるという証拠が増えてきた。抗うつ薬を投与されたCOVID-19患者を対象とした研究では、挿管や死亡のリスクが減少し、入院回数が減り、臨床症状が悪化する可能性が低くなることが示されている。実際、最近のある前臨床研究では、抗うつ剤のフルオキセチンがヒトの肺組織でSARS-CoV-2を阻害することが明らかになった。
抗うつ薬は、しばしば致命的となるサイトカインストームのリスクを軽減することで有益な効果を発揮することが知られている。しかし、抗うつ剤はオートファジーも誘導する。したがって、オートファジーに対する効果は、うつ病の治療だけでなく、SARS-CoV-2対策としても重要であるかもしれない。
イベルメクチン
イベルメクチンは、エバーメクチン系の駆虫薬であり、SARS-CoV-2対策薬として研究され、初期の成果が期待されている。その明らかな抗ウイルス活性について、いくつかのメカニズムが議論されている。しかし、著者はこのパネルにオートファジーを加えるべきだと主張している。なぜなら、オートファジーのフラックスを注意深く測定した研究を含め、イベルメクチンのオートファジー誘導効果を報告する研究が増えているからである。
結論
著者は、最近WHOの連帯プログラムに追加された3つの薬剤が、SARS-CoV-2感染時に生命を脅かすサイトカインストームを防ぐだけでなく、オートファジーを活性化することでSARS-CoV-2の複製を制限する可能性があることを強調している。
「SARS-CoV-2とオートファジー経路との相互作用は複雑で、ウイルスがオートファジー経路を利用する場合と、この経路の完全な活性を手なずけて分解を防ごうとする場合の両方の証拠がある。このシナリオから明らかなように、SARS-CoV-2のライフサイクルが自食作用経路と具体的にどのように絡み合っているのかを解明することが不可欠であろう。”
雑誌の参考文献
Rein, T. (2021) Harnessing autophagy to fight SARS-CoV-2: An update in view of recent drug development efforts. Journal of Cellular Biochemistry. doi:10.1002/jcb.30166. onlinelibrary.wiley.com/doi/10.1002/jcb.30166
現在、3名の方から5.0の評価をいただいている
ナミタ・ミトラ
ナミタは2013年に獣医学・動物衛生学の学士号(BVSc)を感染した後、インドのGADVASUで獣医微生物学の修士号を感染した。修士課程では、家禽における鳥類発癌ウイルスの分子および組織病理学的診断に関する研究で、国内で2つの賞を受賞した。2013年には動物バイオテクノロジーの博士号を取得し、犬の乳腺腫瘍におけるアポトーシス関連遺伝子の発現プロファイリングに関する研究成果を発表した。卒業後すぐに、動物バイオテクノロジーの助教授として、動物細胞培養、動物遺伝子工学、分子免疫学などの講義を担当した。