Contents
Autoimmunity as the comet tail of COVID-19 pandemic
www.ncbi.nlm.nih.gov/pmc/articles/PMC7479552/
オンラインで公開2020年9月6日
要旨
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)感染は、ウイルス組織の損傷に直接関連する、または抗ウイルス免疫応答によって間接的に誘導される様々な臨床症状を生じさせる。感染を根絶しようとする免疫系の過剰活性化は、自己免疫を誘発する可能性がある。SARS-CoV-2感染者では、いくつかの免疫介在性障害が報告されている。これらには、皮膚発疹および血管炎、自己免疫性細胞減少症、抗リン脂質症候群、中枢神経障害または末梢神経障害、筋炎および心筋炎が含まれる。一方、リウマチ患者では、新型コロナウイルス感染症(COVID-19)の発症率、罹患率、死亡率が一般集団と比較して同等であることが報告された。本オピニオンレビューでは、自己免疫とCOVID-19を関連付ける可能性のあるSARS-CoV-2感染時に起こる重要な免疫学的ステップをまとめ、この関連性に関する更なる議論の機会を提供する。
キーワード
COVID-19, SARS-CoV-2, 自己免疫, 自己免疫疾患, リウマチ性疾患, 宿主-ウイルス相互作用
核心提示
免疫系は新型コロナウイルス感染症(COVID-19)の中心的な役割を果たし、臨床症状と予後に責任を負っている。重症急性呼吸器症候群新型コロナウイルスに対する免疫応答の過剰活性化は、場合によっては、望ましくない自己免疫疾患の発症につながる可能性がある。COVID-19は、免疫介在性の全身性または臓器選択的な症状と関連しており、その中には特定の自己免疫疾患の診断基準または分類基準を満たすものもある。これらの病状が一過性の感染後の症状なのかどうかはまだ不明であるが、免疫系を標的とした治療薬を使用することで、自己免疫疾患の発症につながる慢性化を防ぐことができるかもしれない。
はじめに
現在までに世界で1,500万人以上が感染している新型コロナウイルス感染症(COVID-19)のパンデミックは、重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)による感染を根底に持っている[世界保健機関(WHO)報告書 2020年6月]。SARS-CoV-2は、コロナウイルス科に属し、正一本鎖RNAゲノムがカプシドとエンベロープに埋め込まれていることを特徴とする[1]。エンベロープには、いくつかの構造タンパク質(スパイクまたはS、膜またはM、エンベロープまたはE、核タンパク質またはN)と非構造タンパク質が含まれている。Sタンパク質はウイルスが細胞内に侵入する際に重要な役割を果たし、電子顕微鏡で見た典型的なウイルスの王冠型を形成している。CoVのいくつかの株(229E、OC43,NL63,HKU1)は哺乳類に感染し、ほとんどが軽度の呼吸器症状を誘発する[2]。一方、ヒトにおけるSARS-CoV-2感染は、重症肺炎や急性呼吸窮迫症候群(ARDS)の発症と関連している。2019年12月に武漢で最初の症例が報告されて以来[3]、感染は急速に大陸を越えて広がり 2020年3月11日にWHOがこの世界的パンデミックの緊急事態宣言を行うに至った。COVID-19の特徴的な症状は、咳、発熱、呼吸困難、筋肉痛、倦怠感であるが、患者は消化器症状や多臓器関連の合併症を経験することもある[4]。この病気の特徴は、罹患率と死亡率が高いことであり、感染者の多くは入院や集中治療を必要とする。しかし、SARS-CoV-2陽性者の高い割合(約30%)は無症状のままであり、集団感染における潜在的な役割を認識していないウイルスキャリアを代表するものである[5]。韓国の研究では、退院時に鼻咽頭スワブが陰性であったCOVID-19回復患者の半数以上が、経過観察時には関連症状を訴えていないにもかかわらず、SARS-CoV-2陽性になる可能性があることが示されている[5]。最近の研究では、SARSのように細胞を介した反応が最長17年間持続する可能性が示唆されているが[6,7]、一部の患者では、免疫反応が体液性反応の文脈でSARS-CoV-2に対する長期的な保護を与えない可能性があることが強調されている。また、検査では完全にはクリアされていないかもしれないRNAゲノムを含む残留ウイルス粒子が検出されていた可能性もある。さらに、リアルタイムPCRによる陽性シグナルはウイルスRNAの証拠であり、感染性ウイルス粒子の証拠ではないことを明記しておく必要がある。
COVID-19の臨床症状および疾患経過は、SARS-CoV-2の病原性と宿主の特性との微妙なバランスに依存するため、個人差が極めて大きい。免疫系応答による介入と同様に、ウイルスの細胞病理学的効果は、実際には、臓器損傷および炎症の程度にある程度寄与している可能性がある。重要なことは、免疫応答の効率性がSARS-CoV-2感染の制御に不可欠であることであるが、過剰な炎症もまた、重度のCOVID-19の転帰と関連していることである。この見解を支持して、ステロイド、抗マラリア薬、インターロイキン(IL)-6阻害薬を含む免疫調節薬および免疫抑制薬の使用は、特に最も侵攻性の高い症例の管理において、ある程度の有効性と安全性を示している[8]。
さらに、若年者では免疫系の過剰活性化が顕著であるため[9]、最終的には自己免疫を誘発する可能性がある。このような場合、SARS-CoV-2感染者は、自己免疫疾患で一般的に報告されている症状や検査所見と重複する症状や検査所見を有することがある。遺伝的素因を持つ患者では、ウイルスが自然免疫反応または適応免疫反応に関与する免疫経路の異常な活性化を介して、自己免疫を誘発または悪化させることがよく知られている[10,11]。メカニズムとしては、ウイルスと自己エピトープ間の分子模倣、耐性の破壊、非特異的バイスタンダーの活性化、スーパー抗原の提示、インフラマソームプラットフォームの刺激、I型インターフェロン(IFN)の放出などが挙げられる[10,11]。免疫介在性の症状はCOVID-19患者で報告されており、回復期に発生することもあれば、そうでなければ健康な人に感染の最初の手掛かりとなることもある。COVID-19患者を治療している医師の間で意識が高まってきたおかげで、皮膚、心臓、骨格筋、血液細胞、中枢神経系、末梢神経系、血管などが関与する非定型のCOVID-19の報告がここ数ヶ月で劇的に増加している[12-18]。同様に、抗リン脂質(aPL)抗体の検出とともに、COVID-19と血栓性イベントとの関連も報告されている[19]。これらの症状がウイルス感染後の一過性の現れなのか、それとも確定的な自己免疫疾患の発症を反映しているのかは不明である。
すでに自己免疫性リウマチ性疾患に罹患している患者では、COVID-19の罹患率、罹患率、死亡率は一般集団の推定値と同様であることが報告されている[20-22]。しかし、これらの患者の免疫系に及ぼすSARS-CoV-2感染の真の影響と長期的な影響については、いまだ解明されていない。リウマチ患者は免疫反応のバランスが崩れており、その原因の一つには疾患の背景にあること、また免疫抑制療法を併用していることが挙げられる。薬理学的に免疫抑制されているため、外部からの感染症にかかりやすく、それが引き金となって免疫経路が活性化し、自己免疫疾患の再燃を引き起こす可能性がある[10]。
SARS-CoV-2感染の根底にある複雑な免疫学的シナリオを考えると、本オピニオンレビューの目的は、自己免疫をCOVID-19に結びつける証拠をまとめ、感染者を自己免疫に陥れる可能性のある病態生理学的機序についての洞察を提供することである。
SARS-COV-2に対する免疫応答
SARS-CoV-2と宿主相互作用
SARS-CoV-2は、空中経路、さらには糞便経口経路を介して感染する[23-25]。SARS-CoV-2は、Sタンパク質のS1サブユニットと細胞膜上に発現するアンジオテンシン変換酵素2(ACE2)との相互作用により標的細胞に感染する[26]。また、膜貫通型セリンプロテアーゼ2(TMPRSS2)は、ウイルスのSタンパク質を切断し、エンベロープと細胞膜との融合を促進する上で重要な役割を果たしている[28]。動物モデルでは、ACE2が呼吸器の細胞(ゴブレット細胞、クララ細胞、I型・II型肺細胞、繊毛細胞、非繊毛細胞、内皮細胞、平滑筋細胞など)に広く発現していることが示されている[29,30]。ヒトでは、ACE2の発現は同様のパターンをたどり、他の多くの臓器(胆嚢、心筋、腎臓、精巣上体、乳房、卵巣、前立腺、膵臓)でも検出されている[31]。TMPRSS2の発現は、ヒトの様々な組織においてACE2の発現よりもさらに広範囲にわたっている[32,33]。
鼻腔では、粘膜分泌細胞および繊毛化細胞は、ACE2の主要な発現により、他の鼻腔細胞と比較してSARS-CoV-2に感受性が高い[33]。また、SARS-CoV-2は鼻腔の上部に位置する嗅覚細胞を攻撃し、それを介して中枢神経系に到達する可能性がある[34]。特に、ヨーロッパのCOVID-19患者417人を対象に行った研究では、80%以上の人にアノスミア(嗅覚脱失)と味覚障害が報告されている[35]。
SARS-CoV-2はII型肺炎球に感染することで、肺胞の界面活性剤を枯渇させ、空洞崩壊を引き起こす可能性がある[36]。さらに、SARS-CoV-2は気管支肺胞接合部に存在し、ACE2を発現する肺幹細胞に侵入する可能性がある[37]。ウイルス性または免疫介在性の細胞溶解は、肺のクララ細胞や肺炎球の前駆細胞を奪い、肺の再生能を損なう可能性がある。
消化管では、ACE2およびTMPRSS2[25]が特に大腸および回腸の上皮細胞に多く存在する[32]。ある研究によると、ゴブレット細胞、パネス細胞、腸管アロマフィン細胞では、ヒトの腸内でACE2の検出不能な発現が認められている[38]。ACE2は代わりに唾液腺と舌で発見されており[31,39]、これらの細胞のSARS-CoV-2感染が味覚障害の原因となっている可能性がある[35]。
肺と腸の両方には、病原体に対する第一の防御手段となる免疫細胞の集団が局在部位に存在している。免疫細胞は凝集して適切なリンパ系器官(上気道のウォルデイヤ扁桃環[40]や小腸のパイエルパッチ[41])を形成するか、あるいは上皮下の結合組織に散在し、上皮細胞、血管、線維芽細胞と複雑なネットワークを織り成す。
粘膜免疫は、病原体の体内への侵入に対抗する上で基本的に重要であり、したがって、感染症のごく初期の段階で作用する。さらに、粘膜免疫はまた、常駐微生物叢のPhyla組成を制御することにも寄与する可能性があり、このPhyla組成は、順番に、SARS-CoV-2[42]を含む外部因子の影響を受けるか、またはこれらの病原体との相互作用にも影響を及ぼす可能性がある。
SARS-CoV-2感染における自然免疫の役割
自然免疫系は、呼吸器粘膜と腸管粘膜の両方に多く存在し、細胞と可溶性メディエーターの複雑な相互作用を介して、継続的に潜在的に危険な刺激を除去し、打ち消している[43]。これらの細胞には、常駐するマクロファージや単球、ナチュラルキラー(NK)細胞、自然リンパ系細胞、多形核細胞や樹状細胞、サイトカイン、ケモカイン、補体系などが含まれる。ウイルスのような細胞内病原体は、通常、感染した細胞の直接的な貪食および細胞溶解によってクリアされる。病原体のクリアランスが障害されている場合には、抗原刺激が持続し、免疫応答が自然免疫から適応免疫へと変化することがある。後者は、抗原選択性と記憶により、より迅速性と頑健性が高いことが特徴である[44]。
インターフェロン経路
単球-マクロファージ系に属する細胞は、エンドソーム・トール様受容体(TLR)を含むパターン認識受容体(PRR)細胞質プラットフォーム・レチノイン酸誘導性遺伝子I(RIG-I)を介して、ウイルスモチーフを直接認識することができる。これまでに、3種類の異なるタイプのIFNが特徴づけられている:I型IFNαとIFNβ、II型IFNγとIII型IFNλからなる。これまでに3つの異なるタイプのIFNが特徴づけられている:タイプIのIFNはIFNαとIFNβ、タイプIIのIFNγとタイプIIIのIFNλからなり、これらはすべてヤヌスキナーゼ-シグナル伝達物質と転写タンパク質の活性化物質(JAK-STAT)シグナル伝達経路を介して作用する[46]。I型およびII型IFNの主な供給源は形質細胞様樹状細胞(pDC)であり、III型IFNは主に呼吸器および消化管のバリア界面にある上皮細胞から放出される[45]。IFNの抗ウイルス特性は、IFN刺激遺伝子(ISG)の転写を通して明らかにされ、順番に、潜在的にウイルスのライフサイクルの各ステップを防ぐことができる[47]。ウイルスは、進化的にIFN抗ウイルス経路に対する多くの脱出機構を開発してきた。これに関して、SARS-CoV-2のオープンリーディングフレーム(ORF)6は、いくつかのISGの転写を阻害することが示されている[27]。特筆すべきことに、IFN(主にI型)の過剰産生は、全身性エリテマトーデス(SLE)や原発性シェーグレン症候群(SS)のようないくつかの自己免疫疾患の病因を支配しており[48]、これらの疾患の病因を原始的なウイルス感染に結びつける可能性がある[49,50]。
インフラマソーム経路
IFN応答に加えて、ウイルスタンパク質や核酸は、単球-マクロファージ系に属する細胞において、IL-1およびIL-18の産生を伴って炎症性プラットフォームを活性化し[51,52]、全身性の炎症促進作用を有する。具体的には、SARS-CoV-2を含むRNAウイルスの病原体関連分子パターン(PAMP)は、NOD様受容体ファミリーピリンドメイン(PYD)含有3(NLRP3)を活性化し、そのRNA断片は、RIG-IやMDA5を感作し、サイトゾル内のミトコンドリア抗ウイルスシグナル伝達(MAV)プラットフォームを活性化することができる。これらの事象は、核内因子kB(NF-kB)の核内移動、pro-IL-1βおよびpro-IL-18をコードする遺伝子の転写、そしてこれらの前駆体の最終的な活性化されたサイトカインへの変換に至る[52]。インフラマソームプラットフォームは、遺伝的に誘導されたリウマチ性疾患の一群である自己炎症性症候群の病態を支配している。最近の証拠は、自己炎症をベーチェット症候群、血清陰性関節炎、スティル病などの他の多因子性リウマチ性疾患と結びつけている[54-56]。
HMGB-1とウイルスクリアランス
ウイルス核酸は、壊死細胞および活性化免疫細胞から放出された高移動度群ボックス1タンパク質(HMGB-1)とさらに複合化し、単球-マクロファージ細胞またはリンパ球のいずれかにおいて、高度糖化最終産物受容体(RAGE)TLR2,TLR4およびTLR9と結合することができる。このようなイベントのカスケードは、リソソソーム膜の破壊、ピロプトーシス、サイトカインの放出、自己反応性T細胞およびB細胞の活性化に至る[10,57,58]。さらに、肺におけるHMGB-1の放出は、プロ炎症性サイトカインの分泌と間質および肺胞空間における好中球のリクルートを介して急性炎症を引き起こす可能性がある[59]。HMGB-1の増加はACE2と逆相関しており、HMGB-1を標的とした薬剤はCOVID-19の肺症状の治療において有望な候補となる可能性がある[58]。
好中球およびウイルスクリアランス
COVID-19患者8人、市中肺炎患者146人、対照20人を登録した最近の研究では、COVID-19患者の気管支肺胞液(BALF)中の明らかなメタトランスクリプトームプロファイルが明らかになった[60]。具体的には、好中球が最も多く、ケモカインであるCXCL17,CXCL2,CXCL8,CCL2,CCL7が好中球と単球を惹きつけ、全身性サイトカイン(IL-1βおよびI型IFN)も高発現していた。驚くべきことに、著者らは炎症性負荷とウイルス負荷との間に正の相関関係があることを報告しており、どちらも疾患の後期には減衰し、致死的な症例では持続する傾向があった。好中球はトランスフォーミング成長因子(TGF)βの供給源であり、その肺での分泌は間質性線維症と関連している[61]。さらに、好中球はCOVID-19患者の末梢血中に増加しており、好中球の細胞外トラップ(NET)シスの過程を介して全身の炎症や血栓症に寄与している可能性がある[62]。また、NETosisの過程は、SLEや抗好中球細胞質抗体(ANCA)関連血管炎などの自己免疫疾患の発症にも重要な役割を果たしている[63,64]。また、NETosisとinflammasomeの活性化は、ACE1/ACE2比のバランスが崩れた後、COVID-19の期間中に肺で発生する活性酸素種(ROS)の除去機能の低下と関連していることが示唆されている[65]。高齢者のII型肺炎球ではスーパーオキシドジスムターゼ(SOD)3の発現が低下していることが明らかにされており[66]、若年者と比較して高齢者で観察されるCOVID-19肺炎の重症化は、活性酸素のクリアランスが不十分であることが基礎となっている可能性がある。最近の研究では、COVID-19患者の血清が試験管内試験でNETosisを誘発する可能性があり、NETはより重篤な疾患経過のマーカーと考えられる可能性があることが示された[67,68]。
補体系とウイルスクリアランス
補体系は、ウイルスの不活性化、免疫細胞のリクルート、ウイルスのオプソン化、細胞溶解、B細胞およびT細胞応答の誘導を通じて抗ウイルス応答に関与する[69]。その活性化は、古典的、代替的、マンノース結合タンパク質経路に従う可能性がある[70]。SARS-CoVの糖タンパク質Sはマンノース結合レクチンと相互作用して補体カスケードを誘発し[69]、直接的(感染細胞の細胞溶解)または間接的(免疫複合体が介在する)にウイルスクリアランスを誘導することができる。しかし、補体系の持続的な活性化は、臓器線維化や筋骨格系の炎症などの有害な結果をもたらす可能性がある[69]。SLEでは、古典的な経路を介して自己抗体や免疫複合体によって引き金となる補体系カスケードが典型的に高活性化され、その構成要素の消費が疾患の特徴となっている[71]。低補体血症はSLEの疾患活動性や糸球体腎炎のような特定の臓器の関与と関連している[72]。パルボウイルスB19のようないくつかのウイルスは、SLEに関連していることが知られている[73]が、補体系の機能に影響を与え、自己免疫疾患の臨床経過に間接的に影響を与える可能性がある[73,74]。SARS-CoV-2と補体系の相互作用に関するデータには議論の余地がある。ある研究によると、SARS-CoV-2は血清中のC3およびC4レベルに影響を与えないようである[75]。しかし、最近では、C3阻害剤AMY-101を14日間連続して静脈内投与したところ、COVID-19 ARDSに罹患した71歳の患者の検査結果および臨床像が改善したことが報告された[76]。
SARS-CoV-2感染における適応免疫の役割
効率的な適応免疫反応は、ウイルスを確実に排除し、再感染を防ぐための基本的な要件である。抗原性(細胞内と細胞外)に応じて、適応免疫反応は細胞性または体液性の経路をたどることができ、それぞれTリンパ球とBリンパ球が主役となる。
T細胞免疫
樹状細胞は、病原体との相互作用後に非選択的な炎症反応を直接起こすか、抗原提示細胞(APC)として動作し、リンパ球をクローナルに活性化するため、自然免疫系と適応免疫系の間のコネクターとして機能する。SARS-CoV-2エンベロープのタンパク質は、S、E、Mのように、いくつかのエピトープを含んでおり、これらのエピトープが樹状細胞に認識されると、適応免疫応答を引き起こすことができる[27]。細胞内抗原の消化に由来するエピトープは、通常、主要組織適合性複合体(MHC)クラスIによってCD8+ Tリンパ球に提示され、最終的には直接的な細胞毒性メカニズムによって作用する。さらに、CD4+Tヘルパー(h)細胞もまた、MHCクラスIIIによって提示されるエピトープによるそれらのT細胞受容体(TCR)の刺激に続いて活性化され得る。サイトカインの環境に応じて、Th細胞はさらにTh1,Th2,Th17,Th22,Th9,Th濾胞性リンパ球(f)またはT調節性リンパ球(reg)に分化し、異なる免疫学的カスケードを生じさせる[77]。
末梢リンパ球減少症は、典型的にはCOVID-19と関連しており、罹患率および死亡率の予測バイオマーカーとなる[4]。SARS-CoV-2は、CD147分子との相互作用を介してリンパ球に広がる可能性がある[78]。Tリンパ球では、CD147は脂質ラフトの再編成を主宰し、TCRを介した増殖を抑制すると考えられている[79]。Tリンパ球上に発現しているCD147にSARS-CoV-2 Sタンパク質が関与すると、リンパ球減少またはT細胞の生理機能の低下を引き起こす可能性がある。注目すべきは、SLE患者のCD147は健常対照者と比較してCD3+ Tリンパ球で高発現していることであり、これらの患者は白血球に対するSARS-CoV-2の細胞病理学的作用を受けやすくなっていることである[80]。SARS-CoV-2がヒトの二次・三次リンパ系臓器でどのような役割を果たしているかは不明であるが、ウシCoVの病原性株は子牛のパイエルパッチや腸間膜リンパ節でT細胞を枯渇させることが明らかにされている[81]。SARS-CoV-2感染者では、リンパ球減少は特にTおよびNKリンパ球集団と記憶細胞に影響を与える[27]。また、CD8+ TおよびNKリンパ球は疲弊した表現型を示す[82]。CD4+ Tリンパ球サブセットのうち、Th17/Treg比のアンバランスは、病気の患者でも記述されている[83]。COVID-19患者の肺標本の組織学的検査では、血清IL-17およびIFNγの増加、および多核化した巨大細胞の検出は、Th1およびTh17応答の活性化を示唆している[27]。自己反応性のTh1およびTh17リンパ球の拡大は、Treg細胞を損なうこともまた、多くの自己免疫疾患の基礎となっている[84,85]。
B細胞免疫
Th2リンパ球はB細胞と協力して、血漿細胞の最終的な成熟と、異なるアイソタイプクラス(IgM、IgG、IgA)に属する可能性のある特異的な抗ウイルス抗体の分泌をサポートしている。さらに、濾胞性樹状細胞はまた、多量化抗原に反応してB細胞受容体(BCR)の架橋を誘導することにより、MHCに依存しない方法でB細胞を刺激することができる[86]。CD19+細胞の枯渇が報告されているが[27,87]、COVID-19患者は通常、体液性反応を起こし、SARS-CoV-2抗原に対する血清抗体を合成することができる[88,89]。
173人のCOVID-19患者を対象とした研究によると、90%以上の患者で抗SARS-CoV-2 IgMが発現し、約79%の患者では発症から 15日後にIgGが検出された[89]。特筆すべきは、体液性免疫は常にウイルスクリアランスと平行していたわけではなく、感染に効果的に対抗するためには他の免疫学的メカニズムが追加的に必要であることを示唆している。さらに、著者らは、発症2週間後に測定した抗体価の上昇と臨床重症度との間に有意な正の相関があることを発見した。この異常な関連性は、免疫複合体による補体系の活性化、抗体の結晶化可能なフラグメント(Fc)とFc受容体(FcR)との相互作用による免疫細胞(特に単球とマクロファージ)の刺激に依存している可能性がある[90,91]、または抗体に依存したウイルス侵入の亢進[92]。FcRは、患者にヒトポリクローナルIg(IVIG)を静脈内投与することによってブロックされることがある[93]。興味深いことに、この治療法はSARS-CoV-2肺炎のいくつかの報告例において、特に早期に開始した場合に有効であることが証明されている[94,95]。IVIGには免疫調節作用があるため、自己免疫疾患の治療に適応がある[96]。実際、IVIGはT細胞、B細胞、樹状細胞の増殖や活性化を抑制し、TLRシグナル伝達カスケードを遮断し、サイトカイン環境のバランスを整えて免疫寛容性を回復させる[97]。これらの効果の多くは、ポリクローナルIgGと単球マクロファージ系細胞の細胞膜上に発現するFcγRIIbとの相互作用によって媒介されている[98]。ポリクローナル高ガンマグロブリン血症は、関節リウマチ(RA)やSLEなど、異常な体液性反応が持続する自己免疫疾患の患者に多く見られる[100]。IVIGと同様に、ポリクローナル抗体は、感染したリウマチ患者において免疫調節の役割を果たすことがある[101]。病原体保存パターンに対して異なる特異性を持つ天然抗体は、微生物を迅速に中和し、B細胞のメモリーリザーバーを維持することができる[102]。しかし、体液性反応のアップレギュレーションがリウマチ患者をSARS-CoV-2感染による合併症から保護するかどうかは不明である。
体液性免疫については議論の多い所見であるが、既に回復した患者の抗SARS-CoV-2中和抗体を用いた輸血は有効かつ安全な治療法であることが示されている[103,104]。最適な投与量とタイミング、ドナーの募集、Igスクリーニングアッセイについては、まだ疑問が残っている[105]。
サイトカインストーム
自然免疫系および後天的免疫系の両方が、サイトカインストーム症候群または血球貪食性リンパ組織球症の発生に寄与することがあり、多くのプロ炎症性メディエーターの制御不能な放出によって引き金となり、致命的な状態となる可能性がある。この臨床状態は、遺伝的な病因を持つ場合もあれば、感染症、自己免疫疾患、またはがん疾患に続く場合もある。リウマチ患者では、二次性マクロファージ活性化症候群(MAS)としても知られるサイトカインストーム症候群が、小児年齢の間により一般的である。MASは、若年性特発性関節炎(JIA)患者の30~40%に亜臨床的に発現し、10%の症例で致死的な経過をたどることがある[106]。SLE(0.9%~9%の症例)川崎症候群(1%~2%の症例)[107,108]、成人スティル病(10%の症例)[106]ではマイナーな有病率と発症率が報告されている。リウマチ患者では、MASは1/3の症例で既往の炎症性背景を悪化させる外部感染によって誘発される可能性がある。その後のPAMPまたは損傷関連分子パターン(DAMP)の生成は、マクロファージ、Tリンパ球、炎症性プラットフォームを刺激する可能性があり、マクロファージの最終的な移行は、血球貪食、組織修復および線維化を担当する組織球への移行である。
MASの症状には、高熱、リンパ節腫脹、肝脾腫、高凝固、内臓出血、多臓器障害(特に肝臓、中枢神経系、腎臓)などがある。この病状は、敗血症患者の約3~4%にもみられる[109]。PRRの多型変異体、サイトカイン遺伝子発現動態、ウイルスの特性、およびプロ炎症性メディエーターと抗炎症性メディエーターのアンバランスがすべて危険因子と考えられてきた[110]。
COVID-19では、発症から 2~3週間の間隔をおいてサイトカインストーム症候群が発症し、多臓器不全、ARDS、播種性血管内凝固(DIC)[111]、死亡を伴うことが報告されている[27]。放出されるサイトカインには、IL-1β、IL-6,IL-18,IL-33,IFNγ、腫瘍壊死因子-α(TNF-α)[112]などがあり、これらは局所的および全身的に作用し、活性化された免疫細胞および非免疫細胞(BおよびTリンパ球、NK細胞、マクロファージ、樹状細胞、好中球、単球、上皮細胞および内皮細胞)のパネルによって分泌される。血清フェリチン、TNF-αおよびIL-6のレベルが上昇し、リンパ球減少症を有するCOVID-19患者は、高悪性度の全身性炎症およびMASを発症するリスクが高いと考えられている[87]。
肺実質では、サイトカインストーム症候群は最終的にマクロファージおよびリンパ球の過剰活性化によって促進される間質性線維化をもたらす。この事象は、COVID-19の最も重篤な症例で発生し、高い罹患率および死亡率と関連している[113]。注目すべきは、肺線維化は、全身性硬化症(SSc)やRAを含むいくつかのリウマチ性疾患で見られる特徴的な組織学的パターンによって特徴づけられることである[114]。リウマチ性肺線維症で起こることと同様に[115]、マクロファージおよびリンパ球によるTGFβの異常分泌は、COVID-19の間の細胞外マトリックスリモデリングにおいて中心的な役割を果たしている[61]。最後に、単球-マクロファージ系に属する細胞の過剰活性化もまた、組織因子(TF)の異常放出の基礎となっており[116]、これは外因性経路を介して凝固カスケードを活性化し、DICを誘発する可能性がある。
SARS-COV-2誘発性自己免疫疾患
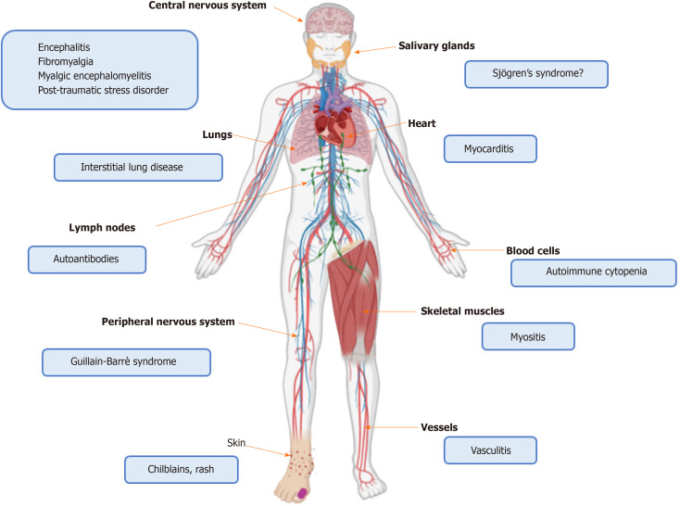
前述の証拠に基づいて、SARS-CoV-2感染は宿主の免疫系に大きな影響を与えるようである。そのバランスは、自然免疫経路の増強に向けてシフトしているようであるが、その一方で、適応免疫反応は不利になっている。次の段落では、この複雑な相互作用を臨床的観点から検討し、COVID-19感染中に発症した自己免疫疾患、およびリウマチ患者におけるCOVID-19の経過についてのデータを報告する。図11および図22は、自己炎症および自己免疫を誘発するSARS-CoV-2の役割、および潜在的に関連する臓器の症状を描いている。
図1 重症急性呼吸器症候群新型コロナウイルスによって活性化される免疫学的経路
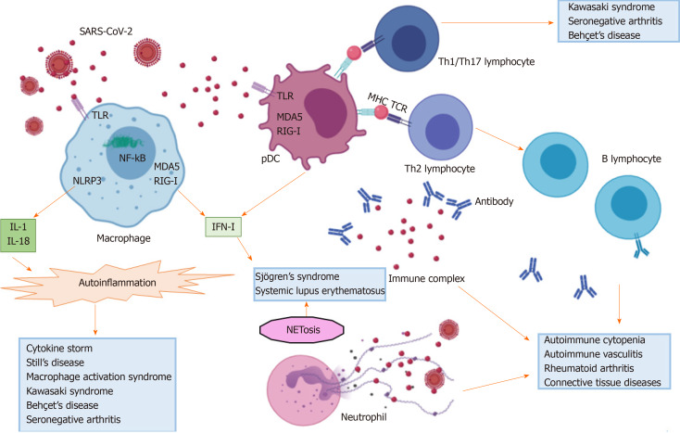
SARS-CoV2。重症急性呼吸器症候群新型コロナウイルス;TLRR:Toll様受容体;IL:インターロイキン;NLRP3:ヌクレオチドオリゴマー化ドメイン様受容体ファミリーピリンドメイン(PYD)含有3;NF-κB:核因子κB;RIG-I.レチノイン酸誘導性遺伝子I;MDA5:メラノーマ分化関連タンパク質5;IFN-I:I型インターフェロン;pDC:形質細胞樹状細胞;MHC:主要組織適合性複合体;TCR:T細胞受容体;Th.Tヘルパー;NET. 好中球細胞外トラップ。
図2 重症急性呼吸器症候群新型コロナウイルス感染症に関連する免疫介在性障害の臓器局在化
自己抗体
抗カルジオリピン抗体や抗β2糖タンパク質Igを含むAPL抗体がCOVID-19患者の血清中に検出されているが、血栓症への寄与は不明である[117,118]。良性のaPLは感染時に一過性の症状として現れることもあるが[119]、Zhangら[19]はCOVID-19患者において抗カルジオリピン、抗β2糖蛋白IgA、IgGが陽性であった3例の上肢、下肢の虚血と脳梗塞を報告しており、これは抗リン脂質症候群(APS)の方向性を示している可能性がある。抗カルジオリピン抗体とは対照的に、抗β2糖タンパク質抗体は、古典的に血栓性とみなされ、APSの特徴的なトラクターを表している。これらの抗体は細菌感染時にも現れることがある[120]が、この場合は異なる生体分子特性を示し、凝固カスケードを誘発することができない。しかし、感染はAPSの引き金となり[121]、さらには既存のAPSを破局的症候群[120]にまで複雑化させる可能性があるため、このような免疫学的反応が自然に回復するか、あるいはむしろ完全な自己免疫になるかどうかを確認するためには、経過観察が重要である。他の著者らは、COVID-19患者の血清中に抗52 kDaおよび抗60 kDa Ro-SSA抗体、抗核抗体(ANA)および抗シトルリン化タンパク質抗体(ACPA)がそれぞれ20%、25%、50%および20%存在することを報告している[122,123]。それにもかかわらず、長期的に自己免疫疾患を誘発する可能性と同様に、それらの病原性は不明である。自己抗体が自己免疫疾患の発症の何年も前に患者の血清中に検出されることはよく知られているが[124,125]、自己抗体の血清陽性が健康な人にも見られる可能性があることを無視すべきではない[126,127]。
免疫介在性神経障害
中枢神経系および末梢神経系を含む神経学的症状は、COVID-19 ARDS 症例の最大 36%で報告されている[128]。脳神経細胞はACE2を発現しており[129]、SARS-CoV-2が嗅細胞や球体を介して拡散し[35]、篩骨を横切って感染する可能性がある[34]。したがって、神経細胞の損傷は、ウイルスの直接的な細胞毒性に起因するものと、免疫を介した攻撃に起因するものとがある[130]。免疫細胞は、感染細胞に発現したウイルス抗原や、ガングリオシドのような交差反応性の自己抗原を認識することがある。神経細胞の炎症はさらにDAMPや自己抗原を生成し、炎症性カスケードを増幅させ、自己免疫を引き起こす可能性がある[131]。この経路は、多発性硬化症や自己免疫性末梢神経障害などの自己免疫疾患の発症に寄与するいくつかのウイルス剤によって利用されている可能性が高い[132-135]。
Pilottoら[136]は、COVID-19の神経症状を呈した60歳男性の症例を報告している。鼻咽頭スワブはSARS-CoV-2陽性であり、両側性間質性肺炎とともに血清D-ダイマーの増加が認められた。脳脊髄液はSARS-CoV-2陰性,リンパ球症,IL-6,IL-8,TNF-α,β2-マイクログロブリンの増加を認めた。抗ウイルス剤、抗生物質、抗マラリア薬による治療にもかかわらず、患者はステロイドの点滴パルス投与後にのみ回復した。以上のことから、神経細胞の損傷は、ウイルスの細胞毒作用というよりも、免疫反応による二次的なものであった可能性が示唆された。
ギラン=バレ[135]症候群は、上肢と下肢に対称的に影響を及ぼす急性弛緩性麻痺からなる。この病態は、2/3の症例で呼吸器感染または消化器感染の後に発症し、その病因は免疫介在性である。具体的には、交差反応性抗ガングリオシド抗体が形成され、脱髄性多発神経障害や運動軸索神経障害を誘発することが最も有力なメカニズムとされている[135]。SARS-CoV-2感染の古典的な症状の前または後に、予測不可能な経過をたどるギラン・バレー症候群の症例が報告されている[12,137]。ギラン・バレー症候群が原始症状である症例では、リンパ球減少症、血小板減少症およびアナムネシスがCOVID-19の方向を向いている可能性がある。
重度のコロナウイルス感染を受けた患者にみられる神経精神症状に焦点を当てた最近のメタアナリシスでは、SARSおよび中東呼吸器症候群(MERS)の発症後の段階(追跡期間60日~12)では、心的外傷後ストレス障害、抑うつまたは不安、記憶障害、疲労、不眠、および睡眠障害が頻繁にみられることが示された[138]。これらの症状は、線維筋痛症(FM)と筋痛性脳脊髄炎という2つのリウマチ性機能障害疾患を特徴づけるものでもある[139]。これら、2つの臨床状態は多くの類似点を共有しており、共存している可能性がある;しかしながら、FMとは異なり、筋痛性脳脊髄炎はしばしば過去の感染症と関連しており、自己免疫過程の結果である可能性がある[140]。COVID-19で回復した患者では、アルゴ機能不全症候群の発症はもっともらしいかもしれないが、疫学的データはまだ不足している。
免疫介在性血液疾患
COVID-19個体における免疫介在性血球減少症の発生については、多くの論文で報告されている。Lazarianら[13]は、温熱IgGと冷熱IgGの両方で持続する自己免疫性溶血性貧血の7例を報告している。この病態は、COVID-19肺炎に罹患した中年患者において、平均9日後に発生した。注目すべきは、患者の大多数がリンパ増殖性障害を併発していたことである。COVID-19の間に寒冷アグルチニンによって持続した溶血性貧血の別の2例が文献に記載されている。最初の患者は46歳の女性で、免疫性血小板減少性紫斑病と脾臓摘出術の既往歴があり、自己抗体検査では陰性であったが、急速に致死的な経過をたどった[141]。2人目の患者は62歳の腫瘍内科の男性で、SARS-CoV-2関連の発熱、無力症、呼吸器症状、その後の2週間の経過観察で軽度の溶血性貧血を呈して入院した[142]。
他の著者は、COVID-19の症状発現から8日後に65歳の女性に血小板減少性紫斑病を発症した症例を報告している[14]。抗血小板抗体は検出されず、骨髄吸引では正常な細胞性を示した。
自己免疫性溶血性貧血と血小板減少症の組み合わせで構成され、しばしばウイルス感染に続くエバンス症候群もCOVID-19の影響を受けた患者で報告されている[143]。この症例では、血小板減少症は溶血性貧血に先行しており、入院時には発熱と呼吸器症状とともにすでに存在していた。COVID-19患者へのステロイドの使用を推奨しないという現在の勧告[144,145]を考慮すると、これらの血液学的合併症はIVIGでうまく管理された。
免疫介在性筋炎および心筋炎
自己免疫性筋炎の病態に対するウイルスの寄与は、これまでのところ、MHCクラスIの高発現や、多発性筋炎や壊死性筋症患者の筋肉生検の組織学的検査におけるCD8+ Tリンパ球の病巣の存在などによって提唱され、支持されていた[146]。興味深い研究では、皮膚筋炎に罹患した20人の成人患者の抗体エピトープレパートリーから、3つのSARS-CoV-2の特異性の高い免疫原性エピトープが同定された[147]。SARS-CoV-2の2′-O-リボースメチルトランスフェラーゼ、3′-to-5’エキソヌクレアーゼタンパク質、RNA依存性RNAポリメラーゼにマップされたエピトープは、後者がHLA-A*01:01制限CD8+ T細胞の増殖に関連していた。
現在までに、COVID-19に関連した筋炎は1例のみ報告されている[15]。筋炎は最初の臨床症状として現れ、4日後に発熱と呼吸困難を呈した。患者は骨盤帯の筋萎縮を訴え、臨床所見、検査所見、画像所見は自己免疫性筋炎で一般的にみられるものと区別がつかなかった。BALではSARS-CoV-2が検出されたが、鼻咽頭スワブでは検出されなかった。また,患者はリンパ球減少症であったが,自己抗体は認められなかった。特筆すべきは、肺コンピュータ断層撮影(CT)スキャンでの呼吸器症状と両側の下葉下面硝子体の不鮮明さは、自己免疫性筋炎症例の最大40%に認められることである[148]。
また、COVID-19に関連した心筋炎の症例も数例報告されている。心筋の炎症からなる心筋炎は、急性リウマチ熱、RA、サルコイドーシス、血管炎、結合組織疾患を含む多くの自己免疫疾患の重篤で致命的な合併症である[149-151]。さらに、心筋炎はウイルス感染の結果であることがあり、その多くはコクサッキーウイルスBおよびアデノウイルスによって持続する[150]。心筋炎は急性冠症候群、不整脈、突然死または心不全として現れることがある。心筋細胞内で増殖するウイルスは、直接的な組織傷害を誘発したり、免疫応答と炎症を誘発したりして、心筋のリモデリングと線維化が続く。これらの事象はその後、収縮期および拡張期の機能不全につながる[149]。内皮細胞や心筋細胞はACE2を発現しているため、SARS-CoV-2はこれらの細胞に直接侵入し、ACE2が心不全に対抗する有益な効果を阻害する可能性がある[152]。さらに、IL-17とIFNγのバランスは、心筋炎の最終的な経過(急性 vs 慢性損傷)を決定する上で極めて重要である[153]。
急性COVID-19関連好酸球性心筋炎が17歳男性患者で報告された[16]。心筋炎は、消化器症状、頭痛、めまいを特徴とする臨床像の発症2日後に出現した。鼻咽頭スワブからSARS-CoV-2が分離された。好酸球性心筋炎は、薬剤・アレルゲン過敏症、ANCA血管炎[149,151]と関連しており、ウイルス感染症との関連は少ない[153]。
COVID-19心筋炎の別の症例が、動脈性高血圧の影響を受けた57歳の男性被験者で報告された[154]。この患者はARDSと急性心不全を発症し、血清トロポニンIおよびN末端プロB型ナトリウム利尿ペプチド(NT-proBNP)の増加、心電図での頻脈、経胸腔心エコー図での心嚢液貯留を伴わないびまん性低キネシス、および心臓磁気共鳴画像(MRI)での心筋浮腫を特徴とした。コルチコステロイド、トシリズマブ、実験的アルドース還元酵素阻害剤の併用療法は心筋の回復に有効であり、心臓障害の多くは免疫介在性であることが明らかになった。
免疫介在性皮膚症状
COVID-19が疑われるまたは確認された患者では、多面体の皮膚症状を呈することが報告されている[155]。その中でもチルブレインはいくつかの症例シリーズで報告されている[17,156]。凍瘡は、低温への曝露によって引き起こされる炎症反応に起因する赤または紫の局所的な皮膚病変である[157]。これらの症状は、SLEや他の結合組織疾患や血管炎に見られ[158,159]、I型IFNの過剰産生に関連していると考えられる[160]。自己免疫性チルブレインは、ほとんどが肥沃な女性または中年女性に発生し、典型的な自己抗体パターンと関連しており、外気温の変動の影響を受けにくく、慢性的に持続する傾向がある[161]。一方、COVID-19の小児紅斑は、ほとんどが発症から約2週間後に小児男性患者で報告されている。病変は主に足の指や足の下肢に限局し、下地感染症の回復後に急速に消失した。口咽頭スワブでのSARS-CoV-2の検査では、数例で陽性が認められた[17,156]。時系列的な間隔を考えると、COVID-19後の皮膚病変はIFNの過剰産生を特徴とする抗ウイルス反応の結果である可能性がある。
血管炎と小児炎症性多系統症候群
川崎症候群は、中・小血管の自己免疫性壊死性血管炎であり、20%以上の症例で冠動脈を侵す[162]。本疾患は小児患者に発症し、古典的には発熱、粘膜症状、頸部リンパ節腫脹から始まる。そのため、上・下気道の外部感染、特にRNAウイルスによる持続感染が誘因として疑われている[163]。この仮説は、冠動脈におけるCD8+ T凝集体およびオリゴクローナルIgAの検出、ISGの高発現、および繊毛状気管支上皮における細胞質包接体の存在によって支持されている[163]。
イタリアのSARS-CoV-2感染症で最も罹患率の高い地域の一つであるベルガモ県では、川崎血管炎様症候群の発生率が増加していることが報告されている。ここで、Verdoniら[164]は 2020年2月から 2020年4月の間に小児(平均年齢7.5歳)に発症した川崎様疾患の10例を報告した。そのうち5例は粘膜表出とリンパ節腫脹を伴う古典的症候群であったが、他は不完全型であった。COVID-19パンデミック前に所属医院に通院していた川崎症例と比較して、著者らは心臓病変、MAS、ショック症候群の発生率が高く、補助的なステロイド治療を必要としていることを明らかにした。COVID-19の若年患者において、主に不完全型として発生した川崎血管炎の追加症例が世界的に報告されている[18,165-167]。この臨床状態が真の川崎血管炎を示すのか、それともむしろ非特異的な感染後免疫介在性の症状を反映しているのかはまだ議論の余地がある。注目すべきことに、これらの患者では、咳や呼吸困難を含むCOVID-19の古典的な症状は、頻度が低いように思われたが、消化器症状[18,168]や心低血圧などの他の症状が優勢であった[165,166]。心臓病変の多くは冠動脈血管炎よりも心嚢液貯留と心筋炎であった[168]。鼻咽頭スワブからSARS-CoV-2が検出されたほか、鼻咽頭迅速検査でA群レンサ球菌が陽性となった小児もいた[165,166]。A群レンサ球菌は、レンサ球菌のN-アセチル-β-D-グルコサミンとMタンパク質のエピトープと心臓弁膜内皮、基底膜、心臓ミオシンのそれぞれの構造的相同性により、分子模倣機構を介してリウマチ熱やパンカード炎の原因となっている[169]。このように、溶連菌とSARS-CoV-2が免疫応答を設定し、最終的にはこの不完全な川崎様症候群の原因となる相乗効果を発揮しているのではないかと考えられている。
これまでのところ、英国では、この臨床状態を他の明らかに重複する疾患と区別するために、「小児炎症性多系統症候群(pediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2)」(PIMS-TS)という用語が造語されている[171]。PIMSは、小児における多系統炎症性症候群(MIS-C)としても知られており、川崎血管炎の不完全型、MAS、心筋炎、中毒性ショックなどを含む多様な臨床症状のスペクトルを特徴としている。疫学的データによると、PIMS-TSは通常、COVID-19の症状に少なくとも2週間以上の遅れをとった後、COVID-19の症状に続く;アフロカリブ系の子孫の間でより一般的である;川崎症候群と比較して心臓、胃腸および血液学的な病変がより頻繁に発現する;そして最後に、古典的な血管炎よりもIVIG治療に難治性であることが示され、しばしばグルココルチコイドまたはIL-6阻害剤の追加を必要とする[172]。Belhadjerら[173]は最近、発熱、心原性ショック、または左室機能障害の徴候を呈してフランスとスイスの病院に入院した35人の小児患者の症例シリーズを報告した。そのうち88.5%でSARS-CoV-2感染が確認され、その多くは抗SARS-CoV-2 IgG血清診断であった。興味深いことに、COVID-19は消化管障害や髄膜刺激などの非定型症状を呈し、入院時の臨床的重症度にもかかわらず、ほとんどの患者が輸液強心剤、ステロイド、抗凝固剤、IVIGで急速に回復したが、3例ではアナキンラによる治療が必要となった。3月1日から 2020年5月17日までの間に、合計156例のPIMS診断がフランス国家サーベイランスに通知された[174]。そのうち79例は明らかにSARS-CoV-2感染と関連しており、川崎病、心筋炎、MASの不完全型の有病率が高いことが特徴で、67%の症例でクリティカルケアの介入を必要としていた。同様に、英国で行われたレトロスペクティブ研究では、COVID-19の非典型的な症状を呈した58例のPIMS-TSの臨床データが収集されている[175]。注目すべきは、米国心臓協会の川崎病の分類基準を満たしたのは13例のみであり[176]、一方で29例で心原性ショックに至る高炎症状態が報告されている。これらの結果は、米国で行われた大規模なレトロスペクティブなコホート解析で報告された、MIS-Cの少年・小児症例186例と191例の報告と一致している[177,178]。消化器症状が最も一般的に報告されており、次いで心血管系、血液学的、粘膜皮膚、眼球、肺の症状が続いている。
既存の自己免疫疾患に対するCOVID-19の影響
驚くべきことに、既にリウマチ性疾患に罹患している患者や薬理学的に免疫抑制を受けている患者では、一般集団と比較してCOVID-19の罹患率と有病率が同程度であることが報告されている[179,180]。また、COVID-19の罹患率と死亡率については、RAやSScのように肺間質性疾患や線維化のリスクを内在している自己免疫疾患に罹患している対象者においても同様の傾向が観察されている[181]。さらに、既存のリウマチ症状の悪化は報告されていない。これは、一方では、自己免疫疾患を持つ被験者における抗ウイルス経路の過剰活性化、他方では、免疫系の過剰活性化を打ち消すことができる併用療法の背景に起因する可能性がある。
すべてのリウマチ患者に鼻咽頭スワブが提供されたわけではないが、生物学的または合成疾患修飾抗リウマチ薬(DMARDs)による治療を受けているイタリアの2つの独立したコホートにおいて、COVID-19の発生率が非常に低いことが報告されている[21,22]。COVID-19 Global Rheumatology Allianceのプロバイダー登録から得られた予備的データは、リウマチ性疾患に苦しむ110人の感染者のコホートから収集されたもので、そのうち35%がSARS-CoV-2感染により入院し、5%が死亡したことを示している[182]。患者の多くはRAに罹患しており、グルココルチコイドの有無にかかわらず、従来のDMARDs、生物学的DMARDs、合成DMARDsで治療を受けていた。そのうち20%は肺疾患を患っていた。報告された症状は、一般集団で報告された症状と変わらなかった。
従来の薬剤または生物学的薬剤で治療された123人の結合組織病患者の観察分析では、COVID-19[20]の致死的な症例は1例のみであった。この患者は32歳のSSc女性で、既往の肺病変に対してヒドロキシクロロキンとリツキシマブを投与され、SARS-CoV-2感染後に重度の間質性肺炎を発症した。他の 14 例は COVID-19 と一致する軽度の症状を報告したが、鼻咽頭スワブにアクセスできず、抗リウマチ治療の中止を必要としなかった。このコホートで確認されたCOVID-19の全体的な有病率は、この地域の一般集団で報告されている有病率と一致していた。
リウマチ患者におけるより重篤な疾患の危険因子は、一般集団で報告されているものと同様であり、男性の性別、高齢、心血管疾患、糖尿病、肥満、リンパ球減少症、およびIL-6,C反応性蛋白(CRP)および乳酸脱水素酵素(LDH)の血清レベルの上昇などが含まれる[183]。
実際のデータでは、リウマチコホートにおけるCOVID-19の重篤な合併症のリスク増加の証拠は示されておらず、免疫抑制剤の使用はSARS-CoV-2誘発性の高炎症からさえも保護する可能性があるが、これらの患者の治療管理には注意が必要である。この点に関して、米国リウマチ学会(ACR)は最近、COVID-19が確認されているリウマチ患者の治療における医師の判断の指針となるよう、条件付き治療推奨パネルを提案した。これらの症例では、従来型、合成型、生物学的DMARDsおよび免疫抑制剤の中止が推奨されているが、非ステロイド性抗炎症薬(NSAIDs)低用量のグルココルチコイド、抗マラリア薬、および抗IL-6阻害剤は維持されてもよい[183]。抗マラリア薬は、ウイルスRNAとHMGB-1の内部化によって誘導されるリソソーム膜の破壊を防ぎ(45)、ウイルスと免疫介在性臓器障害の両方を制限するのに有用であるように思われた。同様に、IL-6-およびIL-1β阻害剤、IVIGおよびグルココルチコイド[94,136,184,185]は、SARS-CoV-2感染に対する免疫応答の亢進に関連する症状のコントロールに成功しており、おそらくMASおよび臓器不全に向けたCOVID-19の沈殿を防ぐことができるかもしれない。
考察
COVID-19の最初の症例が記述されて以来、発熱、咳、呼吸困難を古典的に扱っていたが、リウマチ分野に波及する他の症状が報告されている(表11)。これらには、皮膚発疹や血管炎[17,156,164]、血液疾患[13,14]、神経障害[12,136,137]、筋炎や心筋炎[15,16,154]、自己抗体の陽性などが含まれる。免疫介在性の症状は若年者ではより頻繁にみられるが、ウイルス関連臓器不全は成人ではより一般的である。これは、ACE2の発現低下や高齢者における免疫応答の減衰など、いくつかの理由によるものと考えられる[9]。しかし、COVID-19の予後は、極めて高い炎症反応を発症している患者で悪化することも注目されている。最も重篤なCOVID-19症例では男性の性別傾向が観察されたが[83]、SARS-CoV-2関連の免疫介在性疾患では性別の影響はあまり明らかではないようである。
表1 新型コロナウイルス感染症年の自己免疫疾患を記述した研究
| 参照。 | 年 | 被験者数 | 研究の種類 | コメント |
| Harzallah et al [ 117 ] | 2020 | 56 | 後ろ向きコホート分析 | COVID-19患者のそれぞれ45%および10%におけるLACおよび抗カルジオリピン/抗β2-糖タンパク質IgGまたはIgMの陽性 |
| 周ら[ 123 ] | 2020 | 21 | ケースシリーズ | 重症または重症のCOVID-19患者のそれぞれ20%、25%、50%における抗52 kDa Ro-SSA、抗60 kDa Ro-SSA抗体、ANAの陽性率。抗SCL70、ACA、抗U1-RNP、抗Jo1、抗Sm-D1、抗dsDNA抗体、RFが検出されない |
| Gao et al [ 122 ] | 2020 | 10 | ケースシリーズ | ANAおよびRF陰性のCOVID-19患者の20%におけるACPAの陽性 |
| Helms et al [ 118 ] | 2020 | 150 | 後ろ向きコホート分析 | 64のCOVID-19症例で報告された血栓塞栓性イベント。テストされた患者コホートの87.7%(57人)におけるLACの陽性 |
| Zhang et al [ 19 ] | 2020 | 3 | ケースシリーズ | 抗カルジオリピンおよび抗β2-糖タンパク質IgAおよびIgGが陽性の3人のCOVID-19患者における上肢および下肢の虚血および脳梗塞 |
| Pilotto et al [ 136 ] | 2020 | 1 | 症例報告 | メチルプレドニゾロンのivパルス(1g / dで5日間)で回復している60歳の男性の免疫性脳炎 |
| Ottaviani et al [ 137 ] | 2020 | 1 | 症例報告 | 咳、発疹、発熱から回復してから10日後に66歳の女性に発生したギランバレー症候群。混乱と精神運動性激越の一過性エピソードの発症とともに悪化する神経学的症状。多臓器不全で終わるガス交換の進行性の悪化 |
| 趙ら[ 12 ] | 2020 | 1 | 症例報告 | 61歳の女性における最初のCOVID-19症状としてのギランバレー症候群。8日後に発生するSARS。COVID-19の回復で神経学的症状が消える |
| Lazarian et al [ 13 ] | 2020 | 7 | ケースシリーズ | 自己免疫性溶血性貧血は、最初のCOVID-19症状から平均9日遅れて発症し、温かいまたは冷たいIgGによって持続します。既存のリンパ増殖性疾患との関連、ステロイドおよびリツキシマブへの部分的反応 |
| Zagorski et al [ 141 ] | 2020 | 1 | 症例報告 | 発熱、黄疸、呼吸困難で入院した46歳の女性の寒冷凝集素によって持続した溶血性貧血。SARS-CoV-2 RT-PCRおよびダイレクトクームス試験は陽性であり、コールドIgGおよび補体が検出されます。心原性ショックによるCOVID-19の急速に致命的な経過 |
| ケープ他[ 142 ] | 2020 | 1 | 症例報告 | COVID-19(無力症、発熱、両側性肺浸潤を伴う呼吸困難)の62歳の腫瘍性男性患者における寒冷凝集素によって持続する溶血性貧血。SARS-CoV-2 RT-PCR、直接クームス試験およびANA陽性。抗ENAおよびAPL抗体陰性 |
| Zulfiqar et al [ 14 ] | 2020 | 1 | 症例報告 | 血小板輸血、ivプレドニゾロン、エルトロンボパグおよびIVIGで管理された最初のCOVID-19症状の8日後に発症する免疫性血小板減少性紫斑病。抗血小板抗体が検出されない |
| Li et al [ 143 ] | 2020 | 1 | 症例報告 | COVID-19の古典的な症状を訴える39歳の男性に発症したエヴァンス症候群。入院時に存在する血小板減少症と退院後に発生する溶血性貧血との間の年代順の距離 |
| Beydon et al [ 15 ] | 2020 | 1 | 症例報告 | COVID-19の異常症状としての近位下肢筋の筋炎。CK血清の増加とMRI所見によって確認され、その後に発熱と呼吸器症状が続きます。SARS-CoV-2は気管支肺胞洗浄液で検出されましたが、鼻咽頭スワブでは検出されませんでした |
| Craver et al [ 16 ] | 2020 | 1 | 症例報告 | 17歳の男性患者における致命的な好酸球性心筋炎 |
| Coyle et al [ 154 ] | 2020 | 1 | 症例報告 | ステロイド、抗IL-6Rおよびアルドースレダクターゼ阻害剤で回復する心筋炎およびARDS |
| Andina et al [ 17 ] | 2020 | 22 | 後ろ向き症例シリーズ | 呼吸器および胃腸の症状(中央値の時間遅延1〜28日)後の小児コホート(中央値12歳)の足および指のしもやけ。SARS-CoV-2陽性の中咽頭スワブは1例のみ。症候性の経口薬または局所薬による迅速な回復 |
| ランダら[ 156 ] | 2020 | 6 | ケースシリーズ | 無症候性の31歳の中央値の患者コホートにおけるつま先、指、かかとのしもやけ様病変。3〜4週間前に報告された呼吸器症状と発熱。2例でSARS-CoV-2陽性の中咽頭スワブ |
| Verdoni et al [ 164 ] | 2020 | 29 | 観察研究 | SARS-CoV-2に感染した子供(平均年齢7.5歳)と比較して、川崎血管炎とMASが30倍に増加しました。IVIGに加えて高用量のステロイド療法を必要とするショック症候群および心臓病変の頻繁な症例 |
| Toubiana et al [ 168 ] | 2020 | 21 | 前向き観察研究 | 川崎症候群は21人の被験者で報告されました(年齢中央値7.9歳、女性12人、アフリカ系の12人、90%が鼻咽頭スワブまたは抗SARS-CoV-2 IgGの血液検査でSARS-CoV-2陽性)。患者の76%に心筋炎が見られました。胃腸の関与は患者の100%に存在します。患者の24%に冠状動脈拡張が見られます。IVIGとステロイドのすべての場合の迅速な回復 |
| Licciardi et al [ 18 ] | 2020 | 2 | ケースシリーズ | 発熱、粘膜皮膚症状、血中細胞減少、補体消費、低アルブミン血症、血清フェリチンの増加、炎症を特徴とする、SARS-CoV-2に感染した2人の男児(7歳と12歳)で発症する川崎様症候群マーカーと心臓損傷はivメチルプレドニゾロンとIVIGで回復します。SARS-CoV-2陰性の鼻咽頭スワブ; 抗SARS-CoV-2抗体が存在する |
| デザレオンら[ 165 ] | 2020 | 1 | 症例報告 | 抗生物質、IVIG、アスピリン、体外式膜型人工肺で治療された、呼吸困難、低血圧、心筋炎を伴う、6歳の女性に発症した川崎様症候群。SARS-CoV-2およびグループA連鎖球菌鼻咽頭迅速検査陽性の鼻咽頭スワブ |
| Rivera-Figueroa et al [ 166 ] | 2020 | 1 | 症例報告 | 粘膜皮膚症状、頸部リンパ節腫脹、心嚢液貯留および低血圧を特徴とする5歳の男性患者における不完全な川崎病。支持療法、IVIG、ivステロイドおよびアスピリン後の解決。SARS-CoV-2およびグループA連鎖球菌鼻咽頭迅速検査陽性の鼻咽頭スワブ |
| Pouletty et al [ 167 ] | 2020 | 16 | 多施設後ろ向き症例対照分析 | 16人の患者(中央値10歳)のコホートで報告された川崎および川崎様症候群。10例で記述された完全なフォームと7人の患者で発生する心原性ショック。SARS-CoV-2は、それぞれ9人と2人の患者の鼻咽頭分泌物と便で検出されました。8人の患者のうち7人で血清学が陽性でした。単一のIVIG注入に対する限定された反応; 追加の治療ライン(IVIG、ステロイド、IL-1またはIL-6阻害剤およびASAの複数回注入)が必要 |
| Belhadjer et al [ 173 ] | 2020 | 35 | ケースシリーズ | 2020年3月から4月にフランスとスイスの病院に入院した小児患者(年齢中央値10歳)で報告されたMIS-C(発熱、心原性ショック、CRP血清値の上昇、急性左心室不全)。胃腸症状は症例の80%で報告され、 SARS-CoV-2陽性は症例の88.5%で検出されました(患者の34%で鼻咽頭スワブが陽性であり、個人の86%で抗SARS-CoV-2抗体の存在)。入院時に被験者の80%に心原性ショックが見られます。たこつぼ症候群、心嚢液貯留、動脈瘤を伴わない冠状動脈拡張も記載されています。iv支持療法、IVIG、ステロイドによる迅速な解決。3つのケースでアナキンラが必要 |
| Feldstein et al [ 177 ] | 2020 | 186 | 後ろ向きコホート分析 | MIS-Cは186人の米国の患者(中央値8.3歳、115人の男性)で報告され、その70%がSARS-CoV-2(RT-PCRおよび/または抗体)の検査で陽性でした。胃腸症状が最も一般的に報告され(症例の92%)、続いて心血管(症例の80%)、血液学的(症例の76%)、粘膜皮膚(症例の74%)および呼吸器(症例の70%)の症状が報告されました。症例の8%で冠状動脈瘤が検出され、4人の患者で死亡した。支持療法を超えたIVIG、ステロイド、IL-6およびIL-1阻害剤の投与に基づく治療 |
| Dufort et al [ 178 ] | 2020 | 191 | 後ろ向きコホート分析 | NYSDOHに報告された191例のうち99例で特定されたSARS-CoV-2関連MIS-C(53人の男性は主に6〜12歳、40%が黒人、36%がヒスパニック)。すべての患者で説明されている発熱と全身性炎症マーカーの増加; 胃腸症状は患者の80%で発生し、続いて皮膚(60%の症例)、眼(56%の症例)、および粘膜(27%の症例)の症状が見られます。患者の53%で心筋炎が検出されました。記録された2人の死亡 |
| Whittaker et al [ 175 ] | 2020 | 58 | ケースシリーズ | MIS-Cは、小児/若年患者の英国コホート(年齢中央値9歳、女性33人)で説明されています。COVID-19の症状は、患者の78%で報告されており、胃腸管が最も一般的に関与しています。抗SARS-CoV-2IgGは87%の患者に見られました。13人の患者で完全な川崎症候群が確認され、14%の症例で冠状動脈拡張が見られました。29人の被験者に発生し、蘇生手順を必要とする心原性ショック |
| Belot et al [ 174 ] | 2020 | 156 | 全国的な監視分析 | PIMSで報告された156例中79例でSARS-CoV-2感染との関連が確認されました。川崎様症候群、心筋炎、MASはそれぞれ患者の61%、70%、23%(中央値8歳)で報告されており、67%の症例でクリティカルケアの介入が必要です |
ACPA:抗シトルリン化タンパク質抗体 抗シトルリン化タンパク質抗体;ANA:抗核抗体;anti-dsDNA. 抗二本鎖DNA;抗ENA:抗抽出可能核抗原;APL:抗リン脂質;ARDS:急性呼吸窮迫症候群;ASA.アセチルサリチル酸;CK:クレアチンホスホキナーゼ;CRP:C反応性蛋白質;COVID-19。新型コロナウイルス感染症;i.v.:静脈内;Ig. 免疫グロブリン;IL-6R:インターロイキン-6受容体;IVIG:静脈内免疫グロブリン;LAC:全身性エリテマトーデス抗凝固剤;MAS:マクロファージ活性化症候群;MIS-C.小児における多系統炎症性症候群;MRI.磁気共鳴イメージング;NYSDOH:ニューヨーク州保健省;PIMS:小児炎症性多系統症候群;RF:リウマチ因子;RNP:リボ核タンパク;RT-PCR。リアルタイム逆転写ポリメラーゼ連鎖反応;SARS-CoV-2:重症急性呼吸器症候群新型コロナウイルス。
自己免疫疾患の大部分が男性よりも女性に多いことが知られており、これは免疫応答に関与するタンパク質をコードするX染色体上の遺伝子の不均衡な発現に依存している可能性がある[186]。
SARS-CoV-2感染において重要な遺伝子の中には、ACE2やTLR7をコードする遺伝子のように、X染色体上に配置されているものがある。SLE患者のCD4+ Tリンパ球においてACE2の過剰発現が認められており、ACE2が果たす免疫調節機能や抗酸化機能は、好ましい転帰と好ましくない転帰の両方をもたらしていることが示されている[187]。一方、女性におけるTLR7の過剰発現は、より効率的なウイルスクリアランスを介してSARS-CoV-2を保護する可能性がある[188]。しかし、これらの知見が臨床的にどのような意味を持つのかは不明である。例えば、SLE患者におけるSARS-CoV-2感染は、一般集団で観察される臨床像と乖離していないことが報告されている[20]。
COVID-19は、免疫系が両刃の剣のように作用し、ウイルスクリアランスと過剰な炎症や自己免疫を引き起こすという複雑な免疫学的シナリオを根底に持っている。SARS-CoV-2は、単球-マクロファージ細胞のPRR[45]によって認識されると、いくつかの免疫経路を活性化する可能性がある。この感染は、実際には、COVID-19の皮膚症状および川崎症候群と関連したタイプI型IFN反応[27]を発生させる可能性がある[160,163]。インフラマソームプラットフォーム[52]またはHMGB-1[59]との相互作用を介して自己炎症を誘導し、その両方がサイトカインストームやPIMSなどの全身性COVID-19の合併症と関連し、NETosis[62]、肺酸化ストレス[65]、補体および凝固カスケード[70]を誘発し、ARDS、肺線維症およびDICを引き起こす。表現型的にも機能的にも、リンパ球サブセットをリセットし、CD8+およびCD4+のTh1/Th17応答を支持するが、これらの応答はしばしば枯渇を示する[27,82]。そして最終的に自己抗体の産生をもたらし、自己抗原と交差反応し、血液学的障害またはギラン・バレー症候群の発症を誘発する可能性がある[12,13,137,141-143]。COVID-19の下にある免疫カスケードは、T細胞やB細胞の活性化が亢進しているにもかかわらず、バランスを崩して自然反応にシフトしているように思われる。したがって、高齢者や小児のSARS-CoV-2感染者では、ARDSや川崎様症候群の合併症としてサイトカインストーム症候群やMASが報告されている[18,111,164,166,171]。単球-マクロファージ細胞の過剰な刺激は最終的に自己免疫疾患を引き起こす可能性があるため、このような場合には、マクロファージの活性化と全身のサイトカイン放出を抑制するコルヒチン、IL-1β、TNF-α、IL-6阻害剤、または組換えヒトIL-37,IL-38を早期に使用することで、確定的な自己免疫疾患への進展を長期的に防ぐことができる[111,145,184,185,189,191]。トシリズマブは、中等度から重度のRA、全身性および多関節性のJIAに承認されているIL-6R標的モノクローナル抗体であり、巨大細胞性動脈炎、成人および小児のサイトカインストーム症候群にも使用可能である。本剤は、従来の治療法と比較して日和見感染症のリスクを増加させることなく、重症COVID-19患者における死亡リスクおよび侵襲的機械換気のリスクを低減することが示されている[192]。
しかし、PIMSのような全身性の高炎症性症候群は、ほとんどが血清転換の間または後に起こることが示されており、抗SARS-CoV-2抗体が貪食細胞に発現したFcRと反応して媒介されている可能性がある[172]。
他の報告では、T細胞またはB細胞が媒介する反応に基づいてCOVID-19の間に起こる自己免疫現象が記載されている[12,13,137,147]。PIMSとは逆に、成人で報告された自己免疫疾患は、COVID-19の最初の臨床発現である可能性があり、タイプIのIFN応答または分子模倣機構に起因する可能性がある[172]。これらの症状の慢性化、回復したSARS-CoV-2感染者における将来のリウマチ性疾患の発症、およびそのような結果を防ぐための免疫抑制療法の役割については、まだいくつかの疑問が残っている。SARS-CoV-2感染者はリンパ球減少症であることが多いが、CD8+およびCD4+ Th1/Th17リンパ球軸の活性化が亢進しており、Tregコンパートメントが損なわれている[27]。したがって、リンパ球減少症は、炎症を起こした臓器へのリンパ球の包絡の結果として解釈されることがある[136,194]。自己免疫疾患の管理に使用されるシクロスポリンA(CyA)のような免疫抑制剤もまた、カルシニューリン依存性のSARS-CoV-2複製を阻害し、治療を受けた患者をCOVID-19から保護する可能性がある[145]。IL-2やCTLA-4(cytotoxic T-lymphocyte-associated protein 4)をベースとした薬剤のように、Tregリンパ球のプールを拡大することを目的とした免疫療法の真の有効性は、炎症性サイトカインの過剰分泌によって免疫応答との対比におけるTreg細胞の効率が損なわれる可能性があるため、不明である。現在、関節リウマチやその他の免疫介在性疾患の治療薬として認可されているJAK阻害薬は、サイトカインのシグナル伝達経路を遮断する可能性があるが、その間にIFNを介した抗ウイルス反応を弱める可能性がある[144]。
COVID-19の臨床経過やリウマチ患者と非リウマチ患者の間での発症率や有病率に有意な差は認められなかったが[21,22]、SARS-CoV-2が最終的に免疫応答に影響を及ぼす可能性は否定できない。リウマチ患者に処方される免疫抑制療法を併用することで、自然免疫系および適応免疫系の活性化を抑制し、COVID-19の転帰の悪化に関連した高度な炎症性カスケードの発生を防ぐことができるかもしれない[144]。
結論
結論として、自己免疫をCOVID-19の彗星の尾として考えるのはまだ時期ではなく、SARS-CoV-2で報告されている免疫介在性疾患の多くは、ウイルス感染に伴う一過性の症状である可能性がある。抗炎症性および免疫抑制療法は、確定的な自己免疫疾患の発症を予防するために保護的な役割を持つかもしれないが、現在の支持のエビデンスはまだ発展途上であり、決定的な答えが出るまでにはあと数年かかるかもしれない。
