Contents
Human T cell development, localization, and function throughout life
www.ncbi.nlm.nih.gov/pmc/articles/PMC5826622/
2018 Feb 20
Brahma V. Kumar,1 Thomas Connors,1,4 and Donna L. Farber1,2,3
概要
T細胞は、病原体、アレルゲン、および腫瘍に対する反応を含め、生涯を通じて適応免疫の様々な側面を調整する。マウスモデルでは、T細胞の役割は、限られた時間内に特定の種類の病原体、抗原、または病状に関連して研究されるが、ヒトでは、T細胞は全身で同時に複数の傷害を制御し、数十年にわたって免疫の恒常性を維持する。この総説では、ヒトのT細胞がどのように発達し、異なるライフステージで必須の免疫防御を提供しているかを説明し、組織の局在化とサブセットの明確化が、免疫反応におけるT細胞の機能的役割の重要な決定要因であることを強調する。また、T細胞のサブセットの構成や機能が、年齢に応じてどのように変化するのかについても述べている。ヒトT細胞に対する年齢と組織の影響を考慮することは、ワクチンや免疫療法においてT細胞を介した免疫を調整するためのターゲット戦略を開発する上で重要である。
キーワード ヒト免疫学、メモリーT細胞
ETOC BLURB
多様な組織部位に存在するヒトT細胞に関する最近の研究から、T細胞の機能的役割は、解剖学的位置、サブセット、発達段階と密接に関連していることが明らかになった。Kumarらはこれらの進歩をレビューし、ヒトに特有のT細胞免疫の側面を強調している。
はじめに
免疫応答、恒常性、記憶の確立と維持は、T細胞に依存している。T細胞は、病原体、腫瘍、環境からの多様な抗原を認識する可能性のある受容体を発現し、免疫学的記憶と自己寛容を維持している。また、T細胞は多くの炎症性疾患や自己免疫疾患の主要な原因としても関与している。免疫および免疫病理におけるT細胞の生体内での機能的役割と、それに関わる基礎的なメカニズムは、マウスモデルからほぼ解明されており、ヒトにおける免疫ベースの治療法や免疫療法の開発と発展につながっている(Cohen, 2014; Rosenberg, 2014)。しかし、仮説を検証するためのマウスモデルの力と有用性は、無菌かつ病原体のない条件で、定義された期間に1種類の感染または疾患の摂動に調査範囲を限定することに依存している。対照的に、ヒトは複数の良性および病原性の微生物に継続的にさらされ、慢性的な病原体を保有しているが、高齢になっても大きな感染症にかかることなく何十年も生き延びることができる(Evans er al 2014)。ヒトの免疫力が長寿で安定しているメカニズムを解明するためには、人体という複雑な環境の中で、複数の部位で、あらゆる年齢で、多くの個人を対象にT細胞を研究する必要がある。
Tリンパ球は、骨髄前駆細胞に由来し、胸腺に移動して成熟、選別された後、末梢に運ばれる。末梢のT細胞は、新しい抗原に反応する能力を持つナイーブT細胞、過去の抗原活性化に由来し、長期的な免疫を維持するメモリーT細胞、免疫反応を抑制する制御性T(Treg)細胞など、さまざまなサブセットで構成されている。免疫応答は、ナイーブT細胞が樹状細胞(DC)から提示された抗原とコスティミュレイトリガンドに遭遇することで始まり、インターロイキン2(IL-2)の産生、増殖、エフェクター細胞への分化を経て、様々な部位に移動して病原体の排除を促進することになる。活性化されたエフェクター細胞は短命であるが、その一部はメモリーT細胞として生き残り、移動能力、組織局在性、自己再生能力に基づいた異種のサブセットとして存続する。それぞれの記憶サブセットは、長期的な免疫力の維持や防御反応の想起に関与することができるが、その起源や系統関係はまだ解明されていない。
人間の寿命は比較的長いので、免疫におけるT細胞の重要な役割は、さまざまなライフステージの文脈で研究する必要がある(図1)。人生の初期(乳児期および幼児期)には、T細胞の大半が胸腺から出てきたばかりのナイーブT細胞であり、Treg細胞もかなりの割合を占めている。最も多くの新しい抗原に遭遇するこの形成期において、ナイーブT細胞は病原体の侵入を防ぐ重要な役割を果たし、Treg細胞は無害でどこにでもある抗原に対する耐性を獲得するのに重要であり、記憶T細胞の長期的な蓄えが確立される。記憶T細胞は、幼少期の抗原体験に伴って蓄積され、成人期になるとその蓄積量はピークに達し、数十年にわたって維持される(Saule er al)。
小児期以降、T細胞の優位性がナイーブからメモリーへと変化し、成人期の数十年に渡って免疫が比較的安定していることは、成人におけるT細胞の役割が小児期と比べて変化していることを示唆している(図1)。
成人期になると、新しい抗原に遭遇することが少なくなり、寛容性の確立も少なくなる。T細胞の役割は、繰り返し遭遇する抗原や慢性的に遭遇する抗原の中で、ホメオスタシスや免疫制御を維持することに移行し、この時期には腫瘍のモニタリングも重要になる。
人生の後期になると、炎症の増加やT細胞の機能低下などの免疫恒常性の変化(レビューは(Goronzy and Weyand, 2017)参照)が十分に証明されており、免疫調節不全や関連する病理の原因となっている。
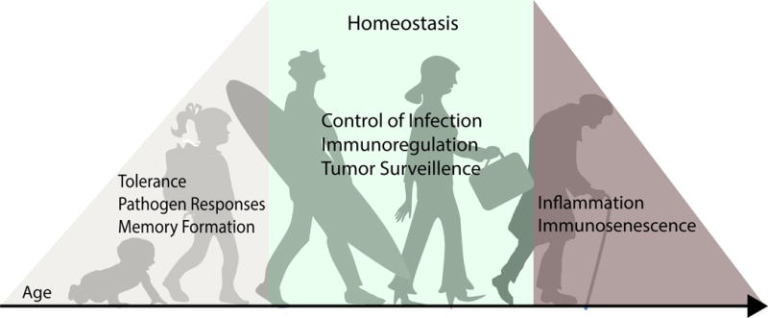
図1 異なるライフステージにおけるT細胞の役割の変化の概要
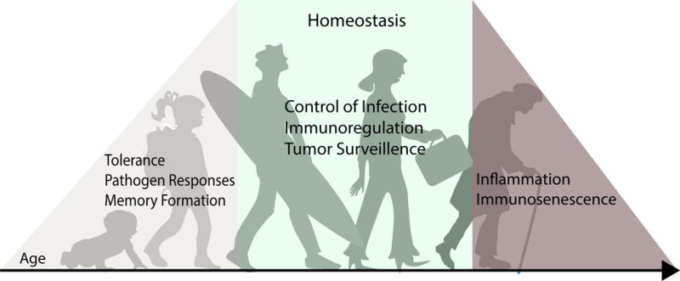
ヒトが多くの抗原に初めて遭遇する幼少期には、T細胞は複数の急性感染症の病原体除去を仲介し、記憶反応を発達させ、無害な外来抗原に対する耐性を確立する。小児期を過ぎると、T細胞のコンパートメントはより安定し、急性感染症は減少し、記憶の生成も減少する。成人期の何十年にもわたって、T細胞は慢性的な感染を制御し、がん細胞をモニタリングし、適切な免疫調節を維持することで、組織のホメオスタシスを維持する。最後に、高齢になると、T細胞の機能が低下し、それに伴って感染症、がん、自己免疫に対する感受性が高まることが十分に証明されている。
免疫反応におけるT細胞の役割とライフステージの違いは、体全体で一様ではない。T細胞は、一次および二次リンパ組織、粘膜およびバリアー部位、外分泌器官、脂肪、さらには脳や中枢神経系(CNS)など、体内のほぼすべての器官や組織に存在する。数的には、人体のT細胞の大部分はリンパ組織(骨髄、脾臓、扁桃、推定500~700個のリンパ節)に存在すると考えられるが、粘膜部位(肺、小腸、大腸)や皮膚にも多数存在し、ヒト末梢血中には全T細胞補体の2~3%が存在すると推定されている(Clark, 2010; Ganusov and De Boer, 2007)。幼少期には、新たに生成されたナイーブT細胞およびTreg細胞が体内の主要なリンパ系および粘膜部位に存在し、記憶T細胞は小腸や肺などの粘膜部位で主に発生し始める(Thome er al 2016a)。小児期以降、記憶T細胞は全身で優勢なサブセットとなるが、リンパ組織での記憶の蓄積は小児期には遅い速度で起こり、粘膜部位やバリア部位に比べて低い最大頻度に達する(Thome er al 2014)。これらの知見は、免疫におけるT細胞の役割が、ライフステージごとに異なるだけでなく、特定の解剖学的コンパートメントにおいても異なることを示唆している。
この総説では、ヒトT細胞の発生、機能、および分化を、多くの環境、病原性、および良性の抗原に、多くの経路と組織の暴露部位を介して長期的に生存するという、人間の複雑な状態の中で考察する。本講演では、T細胞の発生から始まり、ナイーブT細胞と制御性T細胞の役割、エフェクターサブセットとメモリーサブセットへの分化、組織の局在がT細胞の機能と維持にどのように影響するかなど、ヒトT細胞の反応におけるこれらの多面的な側面について議論する。また、乳児期から成人期までの異なるライフステージにおいて、ヒトT細胞のこれらすべての側面がどのように機能するのか、そして、T細胞の機能と維持に関連して、特定の部位で免疫老化の速度がどのように異なるのかについても議論する。
胸腺造成
胸腺はT細胞の主要な発生部位であり、CD4+およびCD8+コアセプターの発現を持たない骨髄からの前駆細胞がT細胞受容体(TCR)の再配列を受け、CD4+CD8+二重陽性(DP)胸腺細胞を生成する。DP細胞は選択され、CD4+またはCD8+シングルポジティブ(SP)の胸腺細胞を生み出し、最終的にはCD45RA+CCR7+の表現型を持つナイーブT細胞として末梢に現れる。新たに発生するTreg細胞は、Foxp3転写因子を発現するCD4+CD25+細胞と定義され(Hori et al 2003年)ヒトCD4+SP胸腺細胞の9〜10%を占め(Watanabe et al 2005年)ナイーブなCD45RA+CCR7+表現型を発現する(Seddiki et al 2006)。胸腺形成、新しいT細胞の発生、およびそれらの選択と発生のメカニズムに関する我々の知識のほとんどは、胸腺切除、骨髄再構成、および遺伝子操作を用いたマウスモデルでの研究に由来する(レビューについては、(Germain 2002;Klein er al 2014)を参照)。ヒトでは同様の操作は不可能であるが、胸腺切除と胸腺移植を含む「自然な」実験、および最近の胸腺移民(RTE)の研究は、ヒトの胸腺造成とそれがマウスとどのように異なるかについての重要な洞察を提供する。
妊娠末期になって初めてT細胞が二次リンパ系器官を形成するリンパ球減少症のマウスとは異なり、ヒトは生まれながらにしてT細胞を完備している(Burt, 2013)。胎内では、ヒトのT細胞前駆体は、早ければ妊娠9週目の胎児の胸腺で検出され、成熟したT細胞は、妊娠12~13週目には胸腺に、妊娠24週目には脾臓とリンパ節(LN)に現れる(Haynes er al)。 また、ヒトのTreg細胞も胎児期の早い時期に発生し、12週目に胸腺、14週目にLNで検出される(Cupedo et al 2005,Michaelsson et al 2006)。マウスの新生児胸腺切除では、ナイーブT細胞とTreg細胞の両方の発達が阻害されるため、重篤な免疫不全と多臓器へのリンパ球浸潤が生じることが、しばらく前に確立された(Dalmasso et al 1963年、Sakaguchi et al 1982)。対照的に、先天性異常を修復するための心臓手術の際に行われるヒトの新生児胸腺摘出術は、生存率を損なうこともなく、有害な結果をもたらすこともない。新生児胸腺切除を受けた成人(多くは現在、人生の3~40年目)は、感染症の発生率が増加することはなく(Mancebo et al 2008,Wells et al 1998年)対照個体と比較して、加齢に伴うナイーブT細胞頻度の減少がより広範囲に及ぶにもかかわらず、健康を維持している(Prelog et al 2009,van den Broek et al 2016)。さらに、新生児期に胸腺切除を受けた成人は、年齢をマッチさせた対照者と比較して、自己免疫またはアレルギーの発生率が増加しない(Silva et al 2017)。これは、正常な血中Treg細胞の頻度および数を維持していることと一致する(Silva et al 2016)。しかし、Treg細胞の発達に先天的な欠陥を持って生まれた乳児(Foxp3転写因子の欠失または突然変異に基づく)は、全身性自己免疫および多臓器浸潤によって現れるImmune dysregulation, Polyendocrinopathy, Enteropathy, X-linked (IPEX)症候群を呈する(Bennett er al)。 したがって、T細胞の発達における重要なイベントは、ヒトでは出生前に開始され、ヒトは、少なくとも先進国では、抗病原体免疫と免疫制御に十分なT細胞補体を持って生まれてくるのである。
胸腺でのT細胞の発達には、マウスモデルで明らかになったように、厳格な選択が行われる。新しく生成されたDP型胸腺細胞は、胸腺上皮細胞(非造血系)との相互作用に基づいて自己のヒト白血球抗原(HLA)を認識する正の選択を受け、胸腺直流との相互作用によって自己反応性の強いクローンを除去する負の選択を受ける。Treg細胞は、異なるタイプの選択を受け、より自己反応性が高い傾向がある(Stritesky er al 2012)。胸腺の選択現象がヒトでも同じように起こるかどうかは不明だが、胸腺移植の研究から新たな知見が得られた。胸腺移植は、胸腺の機能を持たない完全なディジョージ症候群の乳児のT細胞コンパートメントを再構成するために行われる珍しい手術である(Hudson et al 2007)。血縁関係のない乳児から完全同種の胸腺組織を移植したところ、胸腺形成、ポリクローナルな機能性ナイーブT細胞の生成、抗病原体免疫が得られ、本来なら感染症で死亡していたこれらの人々が生存できるようになった(Markert et al 2010;Markert et al 2003)。興味深いことに、胸腺レシピエントは、自己および胸腺移植に寛容であり(免疫抑制を必要としない)また、多様なレパートリーを持つTreg細胞を生成する(Chinn et al 2013,Markert et al 2010)。マウスの研究によると、機能的な免疫を生成するには胸腺上皮細胞(TEC)を積極的に選択する必要がある。しかし、ヒトの胸腺移植ではTECはドナー由来であるにもかかわらず、宿主の抗原提示細胞(APC)が提示する抗原に反応できる機能的なT細胞が出現する(Li et al 2011)。ドナーの上皮および/または胸腺APCとの相互作用により、ヒトの胸腺細胞の選択がマウスよりも寛容であるかどうかは不明であるが、マウスにおける選択の規則がヒトに完全に適用されるわけではないことを示唆している。
ヒトでは胸腺形成はどのくらい持続するのか?胸腺は出生時に最も大きく、胸腺容積の減少、上皮細胞の消失、血管周囲空間の増加、および胸腺組織の脂肪による置換などの胸腺の加齢に伴う変化は小児期に始まる(Haynes et al 2000)。胸腺の機能は、表面のCD31の発現(Junge et al 2007,Tanaskovic et al 2010)および遺伝子再配列の産物としてのTCR excision circles(TREC)を含む、新しい胸腺移民のマーカーに基づいて、末梢のT細胞で評価することができる(Hazenberg et al 2002,Hazenberg et al 2001)。末梢血T細胞におけるCD31の発現およびTRECの含有量は、加齢とともに減少することがよく知られている(Douek et al 1998年、Jamieson et al 1999年、Junge et al 2007)。胸腺形成の最大の減少は、一般に思春期に起こると考えられていたが、最近の研究では、この急激な減少は人生の後半に起こる可能性があることが示唆されている。数か月から70歳以上の臓器提供者から得られたヒト胸腺組織では、DP胸腺細胞(継続的な選択を示す)が、40歳未満の提供者の活性胸腺組織では予想される頻度(60〜80%)で検出されたが、40歳以上の成人の胸腺組織ではDP細胞はほとんど検出されなかった(Thome et al 2016b)。同様に、ヒトの血液、脾臓、およびLNからのナイーブT細胞のTRECレベルは、40歳以上の個人で急な減少を示した(Douek et al 1998;Thome et al 2016b)。RTE様細胞が末梢血に検出されたり(Jamieson et al 1999年)T細胞枯渇療法後の腎移植患者に検出されたり(Gurkan et al 2010)することから、残存する胸腺活性は人生の5年目以降も持続する可能性がある。これらの知見を総合すると、胸腺の機能は人生の第4世代を過ぎると事実上停止するが、一部の人に残存する胸腺組織は、ヒトの免疫系を若返らせるための再生治療に適している可能性がある。
ナイーブ細胞とTreg細胞の維持
胸腺の生産量が減少している中で、成人はどのようにして新しい抗原に反応するための機能的で多様なナイーブT細胞レパートリーを維持しているのだろうか?ヒトのボランティアと重水素水を投与したマウスのT細胞のターンオーバーを調べたところ、胸腺形成とナイーブT細胞の維持に関して、2つの種の間に重要な違いがあることがわかった。若年および老年のマウスでは、ナイーブT細胞の大部分が胸腺出力に由来し、ナイーブT細胞の末梢での分裂は最小限であるのに対し、ヒトでは、胸腺出力が活発な若年成人であっても、ナイーブT細胞の大部分が末梢でのターンオーバーに由来していた(den Braber et al 2012;Vrisekoop et al 2008)。また、これらの研究では、マウスのナイーブT細胞の平均寿命がわずか6~10週間であるのに対し、ヒトでは個々のナイーブT細胞が5~10年持続することも示された(den Braber et al 2012; Vrisekoop et al 2008)。このように、ヒトのナイーブT細胞の寿命とターンオーバーの長さは、高齢になっても維持される理由となっている。
ヒトのナイーブT細胞の維持機構については、ハイスループットDNAシーケンサーを用いてTCRレパートリーを評価したり、組織内のナイーブT細胞を調べたりすることで明らかになってきた。TCRシーケンシングは、クローンの多様性を測定し、拡大したクローンを定量化することができる。ヒトのナイーブT細胞は、最大1億の異なる特異性を含む非常に多様なTCRを持っている(Qi et al 2014)。高齢者(70~85歳)の血液中のナイーブ表現型細胞は、若年成人に比べて減少しているものの、ユニークなTCRβアミノ酸配列の多様なレパートリーを維持しており(Qi er al 2014)ヒトは高齢になっても新規抗原に反応する能力があることが示唆される。循環中のナイーブT細胞や臓器提供者から得られた複数の組織部位の研究により、ナイーブT細胞が生涯にわたってどのように維持されているかを新たに評価することが可能となった(Thome et al 2016a; Thome et al 2016b; Thome et al 2014)。ナイーブT細胞は、胸腺からの出力が停止した後の数十年間、複数のリンパ節内で全T細胞のかなりの割合(20~50%)を占めている。ナイーブT細胞はまた、年齢とともに機能性を維持し、胸腺出力が活発な若年者のナイーブT細胞と胸腺出力がない高齢者のナイーブT細胞との間に明らかな機能的差異はない(Thome et al 2016b)。CDR3シーケンシングによるリンパ系ナイーブT細胞およびメモリーT細胞のTCRレパートリー解析では、脾臓および複数のLNにおける対応するメモリーサブセットと比較して、CD4+およびCD8+ナイーブの高い多様性(およびそれに対応する低いクローナリティ)が明らかになり(Thome et al 2016b)組織内のナイーブT細胞が多様な抗原に応答する能力を維持していることが示された。
Treg細胞も胸腺から出現し、幼少期に組織内に高頻度で存在するが、その持続性や頻度はナイーブT細胞とは異なる。子宮内でTreg細胞が早期に確立されると、成人では5%未満であるのに対し、血液、リンパ組織、粘膜部位に存在するすべてのCD4+T細胞の10~30%がTreg細胞であるというように、人生の早い時期に高いレベルに達する(Mold et al 2008,Thome et al 2016a)。全体的な頻度の違いはあるものの、小児と成人のTreg細胞には同様の特徴がある。Treg細胞は、対応する非Treg細胞集団とは完全に異なるTCRレパートリーを維持しており、臍帯血および成人の末梢血におけるこれらのサブセット間のTCRβ配列の重複は最小限である(Golding et al 2017)。すべての年齢において、血液およびリンパ組織中のTreg細胞はCD45RA+CCR7+であり、ナイーブな表現型を示すが、粘膜部位のTreg細胞はCD45RA-であり、従来のメモリーT細胞のようにCD45ROを発現している(Thome et al 2016a)。機能的には、LNの小児Treg細胞は、成人のLN Treg細胞と比較して、増加したレベルのFoxP3を発現することができる(Thome et al 2016a)。しかし、人生初期のTreg細胞が、人生後期に持続するTreg細胞とどのように異なるかを評価するには、さらなる研究が必要である。
ヒトにおけるTreg細胞頻度の減少は、従来のナイーブな集団における減少よりも幼少期に早く始まり(Thome et al 2016a)胸腺と末梢の両方のメカニズムが作用していることが示唆される。マウスでの研究とヒトでの補完的な分析によると、加齢に伴うTreg細胞生成の減少は、胸腺の出力、末梢の誘導および維持の間の相互作用によるものである。マウスでは、成熟したTreg細胞が胸腺に戻ってきて、胸腺でのTreg細胞の産生を抑制するが、従来のナイーブT細胞は抑制しない(Thiault et al 2015)。成熟したTreg細胞は、ヒトの小児胸腺でも検出され(Thiault et al 2015年)ヒトでもTreg細胞の産生を制御する同様のメカニズムがあることが示唆された。ナイーブT細胞と比較して、ヒトTreg細胞はKi67の発現で測定されるように高いターンオーバーを示し(Silva et al 2016;Thome et al 2016a)これも加齢に伴う頻度の低下に寄与している可能性がある。Treg細胞の頻度は、樹状細胞(DC)集団の変化によっても影響を受ける可能性がある。最近の研究では、ヒト胎児DCが成人DCよりも容易にTreg細胞誘導を促進することが示された(McGovern et al 2017)。これらの結果を合わせると、小児期以降のTreg細胞頻度の制御には複数の相互作用メカニズムがあり、寛容誘導のための最適なウィンドウが人生の早い時期に発生することと一致することが示唆される。
T細胞のエフェクターとメモリーの分化
活性化した病原体特異的T細胞が拡大し、感染除去を媒介するエフェクターT細胞に分化するクローン拡大期、感染後にエフェクターT細胞の大部分がアポトーシスにより死滅する収縮期、およびこれらのプライミングされたT細胞の一部が長期記憶T細胞として持続し、その後の感染を防御する記憶期の3つの段階で、末梢のT細胞は分化する(Gourley er al)。 ヒトにおいて、エフェクターT細胞やメモリーT細胞へのT細胞の分化を研究するには、特定のコホートにチャレンジし、長期的に追跡する必要がある。弱毒化黄熱ウイルスワクチン(YFV-7D)を用いたエレガントな研究では、CD38とHLA-DRを共発現する活性化されたCD4+およびCD8+T細胞が2~3日以内に血中に検出され、その後、YFV特異的CD8+T細胞が血中に検出され、14~21日後にピーク応答を示すことが示されている(Akondy et al 2015,Blom et al 2013,Miller et al 2008,Wieten et al 2016a)。マウス感染モデルと同様に、エフェクターCD8+T細胞応答の大きさは、初期のウイルス量と相関し(Akondy et al 2015年)急速に収縮し、30日までにベースラインに近いレベルに戻る(Kohler 2012,Miller 2008,Akondy 2015)。ウイルス特異的記憶T細胞はその後、エフェクター応答から減少した頻度(5~6%)で持続し(DeWitt et al 2015,Miller et al 2008,Wieten et al 2016b)ワクチン接種から25年後に検出可能となる(Fuertes Marraco et al 2015,Wieten et al 2016b)。天然痘(ワクチニア)とインフルエンザのワクチン接種後にも、エフェクターの拡大とメモリーの発達の同様の動態が観察され(Miller et al 2008年)ワクチニア特異的メモリーT細胞は何十年も経ってから検出された(Hammarlund et al 2003)。これらの研究結果を総合すると、ウイルス感染後のヒトのエフェクターT細胞の膨張、収縮、記憶形成は、マウスで研究された多くの急性ウイルスと速度や大きさが似ていることがわかる。
大多数のエフェクターT細胞は急速に収縮し、定常状態では有意な割合で存在しないが、CD45RA+CCR7-の表現型を持つ末端エフェクター細胞(Temra)の集団は循環に留まることができる。Temra細胞は、主にCD8+T細胞系統内に存在し、IFNγ産生能が高く、増殖能が低く、血中の頻度はCMV感染の持続性と相関している(Larbi and Fulop, 2014)。血中および骨髄中のCD8+ Temra細胞の割合は、特にCMV血清陽性のドナーにおいて、年齢とともに増加し(Di Benedetto et al 2015,Gordon et al 2017年)持続的な感染におけるTemra細胞の役割を示唆している。CD4+Temra細胞はほとんど検出されないが、細胞障害機能を有するCD4+Temra細胞の拡大がデングウイルスに感染した個体で起こり、保護に関連している(Weiskopf er al 2015)。これらの知見は、特定のウイルスが末端エフェクターの分化とTemra細胞の形成を誘発し、それが抗原負荷や持続性に関係していることを示唆している。興味深いことに、Temra細胞はヒトに特異的であるようで、マウス感染モデルでは明確な相関関係はない。
メモリーT細胞の不均一性と組織分布
記憶T細胞は、ヒトの血中で主要な循環集団を形成しており、表現型に基づいて中心記憶(Tcm、CD45RA-CCR7+)エフェクター記憶(Tem、CD45RA-CCR7-)幹細胞記憶(Tscm、CD45RA+CCR7+CD95+CD122+)T細胞に細分化される(Gattinoni et al 2011; Sallusto et al 1999)。機能的には、Tcm細胞もTem細胞も、刺激を受けるとIL-2やエフェクターサイトカインを産生する能力を有しているが、Tcm細胞はリンパ系ホーミングプロファイルを示し、高い増殖能力を有しているのに対し、Tem細胞はより多くのエフェクターサイトカインを産生する(Gattinoni et al 2011; Sallusto et al 1999; Willinger et al 2005)。Tscm細胞は、高い増殖能力と自己再生能力を持つが、エフェクター機能を持たない、比較的まれなサブセットである(Gattinoni er al 2011)。ヒトのメモリーT細胞サブセットの直線的および分岐的な生成のモデルは、これまでに機能分析、分化マーカー、細胞分裂の分析から推測されてきた(Ahmed er al 2009)。しかし、エピジェネティック解析や転写解析を用いた最近の研究により、その分化階層について新たな知見が得られた。CD4+T細胞では、メチル化状態、DNAアクセス性、ヒストン修飾の評価に基づくエピゲノムプロファイリングにより、記憶の発達を制御する重要な遺伝子のDNAメチル化が、ナイーブ-Tcm-Tem細胞の順に徐々に失われていることが明らかになった(Durek et al 2016)。ヒトCD8+T細胞の分化は、ナイーブ-Tscm-Tcm-Tem細胞の順に直線的に進行することが、メチル化解析とクロマチンアクセシビリティによって示唆された(Abdelsamed et al 2017,Moskowitz et al 2017)。しかし、これらの系統分析は、循環に出現するT細胞の一部およびサブセットに基づいており、リンパ系および末梢組織の部位内に含まれる大多数の集団ではない。
マウス感染モデルにおいて、メモリーT細胞の不均一な組織分布や、特定の部位におけるT細胞の明確な特徴が確認されたことから(Bingaman et al 2005,Masopust et al 2001,Masopust et al 2004年)ヒトの循環T細胞は組織内の対応するT細胞を代表していない可能性が示唆されている。しかし、研究用のヒト組織サンプルは、多くの場合、疾患患者の外科的摘出物や単離されたバイオプシーに限られており、少数の人から採取されている。最近では、臓器提供組織を使用することで、あらゆる年齢の健康なヒトにおいて、血液や複数のリンパ系および粘膜部位におけるT細胞サブセットの分布、コンパートメント化、および機能を評価することができるようになった(Carpenter et al 2017,Sathaliyawala et al 2013,Thome et al 2014)。成人してから60年間の組織におけるT細胞サブセットを分析したところ、肺、小腸、大腸、脾臓、血液ではTem細胞が優勢であり、LNのT細胞補体の30〜50%を占め、ナイーブT細胞は主に血液、脾臓、LNに存在することが明らかになった(Sathaliyawala et al 2013;Thome et al 2014)。CD4+ T細胞については、Tcm細胞はリンパ系部位に同程度の頻度(平均20%)で存在し、粘膜組織では頻度が低く、Temra細胞はほとんど存在しないが、CD8+ T細胞については、Temra細胞のかなりの割合(~30%)が血液および血液を多く含む組織(脾臓、骨髄、肺)内に存在するが、他の部位には存在せず、血液およびリンパ系部位にはCD8+ Tcm-表現型の細胞が低い頻度で存在するのみであった(Gordon et al, 2017;Thome et al 2014)。) 注目すべきは、これらのサブセット頻度は、非常に多様なドナー間で極めて安定しており、ヒトT細胞サブセットの組織特異的なコンパートメント化を示唆していることである。
組織常駐型メモリーT(Trm)細胞
最近、マウスモデルにおいて、組織内のメモリーT細胞の大部分が、組織常駐型メモリーT(Trm)細胞と呼ばれる明確なサブセットを構成することが確立された(マウスTrm細胞に関するレビューは、(Mueller and Mackay, 2016; Schenkel and Masopust, 2014)を参照)。マウスTrm細胞は、バリア部位、粘膜組織、肝臓、唾液腺、脳など多様な種類の組織に存在することが記載されており、パラバイオシスや生体内試験ラベリング研究で示されているように、再循環せずに保持されている(Jiang et al 2012,MuellerとMackay 2016,Steinert et al 2015,Teijaro et al 2011)。機能的には、マウスのTrm細胞は、多様なウイルス、細菌、および寄生虫の感染に対する迅速なin situ保護を媒介し、病原体のクリアランスにおいて循環するメモリーT細胞よりも効果的である(Fernandez-Ruiz et al 2016,Gebhardt et al 2009,Glennie et al 2015,Jiang et al 2012,Sakai et al 2014,Schenkel et al 2014,Teijaro et al 2011,Thom et al 2015)。Trm細胞の臨床的重要性は、マウスTrm細胞がワクチン、非感染性アレルゲン、自己抗原、および腫瘍に反応して生成できるという事実によっても強調されている(Hondowicz et al 2016,Morawski et al 2017,Shin and Iwasaki 2012,Zens et al 2016)。
表現型的には、マウスのTrm細胞は、初期T細胞活性化マーカーCD69を発現し(Anderson et al 2014;MuellerおよびMackay 2016;Turner et al 2014)スフィンゴシン-1-S1PR1の封じ込めによって保持を促進することができる(Mackay et al 2015;Shiow et al 2006)。また、皮膚や粘膜部位のCD8+Trm細胞は、CD69に加えてCD103を共発現している(Bergsbaken and Bevan, 2015; Mueller and Mackay, 2016)。CD69の発現はCD4+およびCD8+Trmに共通する特徴であるが、組織保持特性に基づいて定義されたCD69-Trm細胞がマウスの組織で同定されている(Steinert er al 2015)。CD69がTrm形成に必要かどうかも議論の余地があり、CD69欠損CD8+T細胞は皮膚でのTrm形成の低下を示し(Mackay et al 2015)、CD69-/-CD4+T細胞はリンパ系部位でTrmを生成できる(Ugur et al 2014)。
最近の研究では、複数のヒト組織でTrmの表現型を持つ細胞が同定されている。健康な臓器提供者や組織の摘出物から得られたメモリーT細胞を解析したところ、粘膜組織(肺、小腸、大腸、性器粘膜)皮膚、リンパ系部位(脾臓、LN、BM)外分泌系組織(膵臓、唾液腺)などの複数の部位でCD4+およびCD8+メモリーT細胞の大部分にCD69が発現しているのに対し、血液のメモリーT細胞は大部分がCD69-であることが明らかになった(Booth et al, 2014;Clark et al 2006;Gordon et al 2017;Kumar et al 2017;Okhrimenko et al 2014;Pallett et al 2017;Radenkovic et al 2017;Swaims-Kohlmeier et al 2016;Thome et al 2014;Trimble et al 2010;Watanabe et al 2015;Wong et al 2016;Woon et al 2016)。) CD103は、バリアーおよび口腔胃粘膜部位のCD69+メモリーCD8+T細胞のサブセットによって発現しているが、どの組織においてもリンパ系メモリーCD8+T細胞やCD4+メモリーT細胞では有意ではない(Kumar et al 2017,Thome et al 2014,Watanabeら。2015)CD69が組織と循環メモリーT細胞iを区別する主要なマーカーであることを示唆している。CD69はT細胞の活性化に伴ってアップレギュレートされることがあるが(Cibrian and Sanchez-Madrid, 2017)組織内のCD69+メモリーT細胞は、HLA-DR、CD38,またはCD25の発現などの活性化の特徴を示さない(Kumar et al 2017; Okhrimenko et al 2014; Thome et al 2014; Woon et al 2016)。これらの知見を合わせると、ヒト組織メモリーT細胞は、CD69,および一部のケースではCD103の発現とともに、レストリングメモリーT細胞の特徴を示すことになる。
ヒトのTrmを異なるサブセットとして定義することは、表現型サブセットの転写プロファイリング研究によって裏付けられている。最近の2つの研究では、Trm細胞マーカーCD69および/またはCD103を発現するヒト組織記憶T細胞は、マウスTrm細胞と主要な相同性を有する、ヒトにおける転写的に異なる記憶サブセットであることが示された(Hombrink et al 2016;Kumar et al 2017)。注目すべきは、ヒトTrm細胞を定義するコアシグネチャーが、CD4+およびCD8+ T細胞の両方について、複数の組織部位における表現型および機能的検証と組み合わせた全トランスクリプトームプロファイリングによって確立されたことである(Kumar et al 2017)(図2)。ヒトCD69+(またはCD103+)組織記憶T細胞は、組織および血液中の循環(CD69- CD103-)Tem細胞細胞と比較して、マウスのTrm細胞の形成に必要であることが示されているホーミング受容体S1PR1およびその関連転写因子KLF2のダウンレギュレーション(Hombrink et al 2016,Kumar et al 2017,Woon et al 2016)を含む、マウスTrm細胞の主要な転写的特徴を共有している(Skon et al 2013)。マウスのTrm細胞と同様に、ヒトのTrm細胞も、CXCR6とコラーゲン結合インテグリンであるITGA1(CD49a)のアップレギュレーションと、SELL(CD62L)とCX3CR1のダウンレギュレーションを示し、脱出の合図を回避する(Hombrink et al 2016;Kumar et al 2017;Wong et al 2016)。しかし、ヒトとマウスのTrm細胞の転写調節因子は異なっている可能性がある。マウスでは、転写因子Hobitが感染後のTrm細胞の発達に独占的に発現し、必要とされているが(Mackay et al 2016)ヒトでは、Trm表現型細胞はHobit転写物を低レベルから無視できるレベルで発現する(Kumar et al 2017;Vieira Braga et al 2015)。
図2 ヒトTrm細胞の定義的な特徴
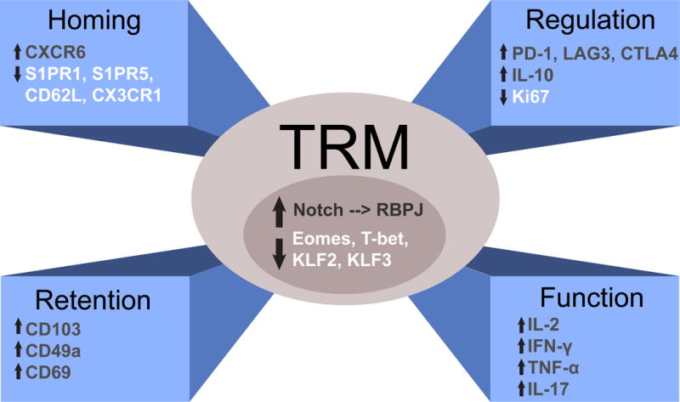
Trm細胞は、転写因子の発現、組織の滞留を維持するためのホーミング受容体や接着マーカーの表面発現、炎症性サイトカインと抗炎症性サイトカインの両方の発現と分泌能力の増加など、独特の機能プロファイルを持っている。また、Trm細胞は、多くの抑制遺伝子を発現しており、循環メモリーT細胞と比較して、増殖のターンオーバーが抑制されている。
コアシグネチャーの機能的側面から、ヒトのTrm細胞は防御と制御の両方を含む二重の役割を果たしていることが明らかになった(図2B)。ヒトTrm細胞は、循環しているTem細胞と比較して、IFN-γ、IL-17,TNF-α、IL-2などの防御免疫に関連するサイトカインを高レベルで産生するが、免疫調節サイトカインIL-10も高レベルで産生する(Hombrink et al 2016,Kumar et al 2017,Pallett et al 2017,Watanabe et al 2015)。さらに、ヒトTrm細胞は、PD-1,LAG3,CTLA-4(Hombrink et al 2016,Kumar et al 2017,Woon et al 2016)を含むT細胞機能を強力に阻害することが知られている表面受容体を発現しており、また、増殖の阻害に関連する分子であるCD101(Kumar et al 2017)も発現している(Soares et al 1998)。興味深いことに、ヒトのTrm細胞は、循環しているTem細胞と比較して、増殖マーカーであるKi67の発現も減少している(Kumar et al 2017)。我々は、このような二重の保護・調節機能が長期的な維持に不可欠であることを提案する。Trm細胞は、長寿を促進するために静止状態で存在し、不必要な活性化や組織の損傷を防ぐために抗炎症・調節機能を持つ一方で、病原体の侵入時に迅速に対応する能力を保持している。
コアシグネチャーに加えて、ヒトのTrm細胞には異質性があるという証拠がある。ヒトのCD8+ Trm細胞ではCD103の発現が異なることがあり、マウスではCD103+ Trm細胞とCD103- Trm細胞は発生学的に異なるサブセットである(Bergsbaken and Bevan, 2015; Kumar et al 2017)。ヒトの皮膚からのTrm細胞を調べた最近の研究では、CD49a+CD103+サブセットのCD8+ Trm細胞が、CD49a対応のものと比較して優れた細胞障害能力を持つサブセットを表すことがわかった(Cheuk er al 2017)。さらに、Trm細胞は、組織特異的な機能や移動能力を持っている可能性があり、これは今後の研究の重要な分野となるだろう。
ヒトのTrm細胞は、防御反応の媒介や長期的な免疫力の維持に重要な役割を果たしていると考えられる。Trm細胞が重要な防御サブセットであることの間接的な証拠は、皮膚で評価されたTrm細胞を維持しながら、循環T細胞を大幅に減少させる薬剤であるalemtuzumabを投与された患者の研究から得られている(Clark et al 2012)。驚くべきことに、これらの患者は高い確率で感染症に罹患しておらず(Clark et al 2012)枯渇剤や他の種類の全身免疫抑制剤で治療を受けている移植患者も感染症に罹患していないことから、組織内に存在するメモリーT細胞が進行中の感染症や新たな感染症を適切に制御できることが示唆されている。さらに、ヒトの皮膚におけるCD8+常駐T細胞の存在は、単純ヘルペスウイルス(HSV)に対する免疫反応と関連しており(Zhu et al 2007,Zhu et al 2013年)これは皮膚のTrmがHSVに対する防御作用を示すマウスの知見と類似している(Gebhardt et al 2009,Gebhardt et al 2011)。これらの初期の知見は、マウスモデルでの有望な結果(Shin and Iwasaki, 2012; Zens et al 2016)に基づいて、Trm細胞を標的とすることがワクチンによる保護を促進するための効果的な戦略である可能性を示唆している。
ヒトのTrm細胞が保護のために最適化されるメカニズムの1つとして、その居住地で遭遇した病原体に特異的なT細胞クローンを維持することが考えられる。例えば、ヒト肺Trmサブセット内のインフルエンザ特異的CD8+T細胞の偏った維持(Purwar et al 2011,Turner et al 2014年)肝臓CD69+メモリーT細胞内のB型肝炎ウイルス(HBV)特異的CD8T細胞(Pallett et al 2017年)および脾臓および扁桃腺内のEBV特異的CD8+ Trm細胞(Woon et al 2016)を発見した研究がある。複数の部位に感染および/または持続する全身性ウイルスに特異的なT細胞の組織分布は、より複雑である。CMV特異的T細胞は、血液、骨髄(ドナーの大半)または肺および肺LNのいずれかに優位性を持つ異なる分布パターンを示し、総ウイルス特異的T細胞および活性化ウイルス特異的T細胞の頻度が高いほど、ウイルス負荷が低いことと関連している。(と述べている(Gordon er al 2017)。) 骨髄はまた、複数の全身性病原体に対する特異性について血液と比較して濃縮されていることが判明しており(Okhrimenko et al 2014)骨髄における長寿命メモリー集団のコンパートメント化を示唆している。これらの知見を総合すると、感染部位でメモリーT細胞が特異的に生成・保持されていることが示唆される。
ヒトでは、病原体や常在する微生物に生涯にわたってさらされることが、従来のマウスモデルでは起こらないような形で、ヒトTrm細胞の発生と維持に大きな影響を与えていると考えられる。例えば、組織中のTrm表現型細胞の割合は、マウスよりもヒトの方が一貫して高く、正統的なTrm細胞表現型(CD69+CD49a+CD103+ S1PR1loCD62Llo)を持つメモリーT細胞は、ヒトのリンパ組織に見られるが(Kumar et al 2017年)マウスのリンパ部位には通常存在しない。組織内のTrm細胞の確立に対する複数の病原体への曝露の累積効果は、spf(specific pathogen free)施設の従来のマウスと比較して組織内のCD69+ T細胞の頻度が増加している「汚れた」ペットショップマウスの研究によっても示唆されている(Beura et al 2016)。また、加齢に伴うTrm細胞の蓄積は、複数の常在生物も存在する腸、次いで肺でより急速に起こる(Thome et al 2014)。これらの結果を総合すると、組織におけるTrm細胞の定着の速度と程度は、特定の部位での抗原負荷に直接関係している可能性が示唆される。
組織への定着とその他のサブセット
組織への定着は、メモリーT細胞に特有のものではないかもしれない。ナイーブT細胞が組織内、特にLN内に留まることができるという証拠がある。個人の脾臓とLNにおけるナイーブT細胞のクローン解析では、年齢に関係なく、異なるリンパ系部位から得られたナイーブT細胞のTCRレパートリーには重複がないことが明らかになった(Thome er al 2016b)。また、適度に拡大したナイーブT細胞クローンであっても、大部分が単一のリンパ系部位に限定されており、部位間で高い重複を示す拡大したメモリー集団とは対照的であった(Thome er al 2016b)。これらのデータは、ナイーブT細胞は、その場で拡大できるリンパ節に長期的に滞在し、リンパ節がその維持のためのリザーバーとして機能していることを示唆している。ナイーブT細胞はカノニカルなTrm細胞マーカーを発現していないことから、ナイーブT細胞のリンパ節での保持メカニズムは、特定の細胞間相互作用よりもむしろサイトカインシグナルに依存しているのではないかと考えている。
組織内滞留の概念は、Treg細胞についても説明されている。マウスでは、脂肪、肺、筋肉に存在する組織Treg細胞は、代謝の恒常性と組織修復において重要な役割を果たしており、リンパ系Treg細胞と比較して異なる表現型と転写プロファイルを示す(総説としては、(Panduro er al)。 ヒトの組織では、Treg細胞の一部(40〜50%)がTlm細胞マーカーCD69を発現している(Thome er al 2016a)。また、ヒトの皮膚に存在するTreg細胞は、スキンホーミング受容体CLA、CCR4,およびCCR6を発現している(Clark and Kupper, 2007)。乾癬の皮膚病変部では、IL-17を産生するTreg細胞の割合が、罹患していない皮膚に比べて増加していることが確認されており(Sanchez Rodriguez er al)。 Treg細胞はヒトの脂肪でも同定されており、Treg細胞の減少は肥満と相関している(Feuerer et al 2009)。ヒト組織のLNにおけるTreg細胞は、その減少によりT細胞の増殖とサイトカインの産生が生体外で増加するため、ホメオスタシスを維持している可能性がある(Peters et al 2013;Thome et al 2016a)。ホメオスタシス維持におけるヒト組織Treg細胞の重要性と機能的役割を解明するには、さらなる研究が必要である。
ヒトの生涯にわたるT細胞サブセット
上記のセクションで説明したように、ヒトT細胞の発生、分化、維持はすべてダイナミックなプロセスであり、人間の一生の間に変化が起こる。図3に模式的に示したように、T細胞サブセットの頻度とその解剖学的局在を年齢に応じて組み合わせると、組織の部位によってT細胞コンパートメントの質的・量的変化が年齢に応じて異なることが明らかになる。胸腺は、胎児期に新しいT細胞の産生において最も早く機能的役割を果たした免疫器官であるが、他のリンパ系部位と比較して最も速い速度で減少する。特に、新しいナイーブT細胞(およびTreg細胞)に対する胸腺造血の貢献度は、乳児期に最も高く、幼少期に活発な胸腺組織が脂肪に変わることで低下する。成人期には、胸腺の出力は非常に低くなり、人生の4~5年目まで続き、完全に停止する。
図3 多様な組織部位におけるヒトT細胞サブセットの加齢に伴う特徴的な変化
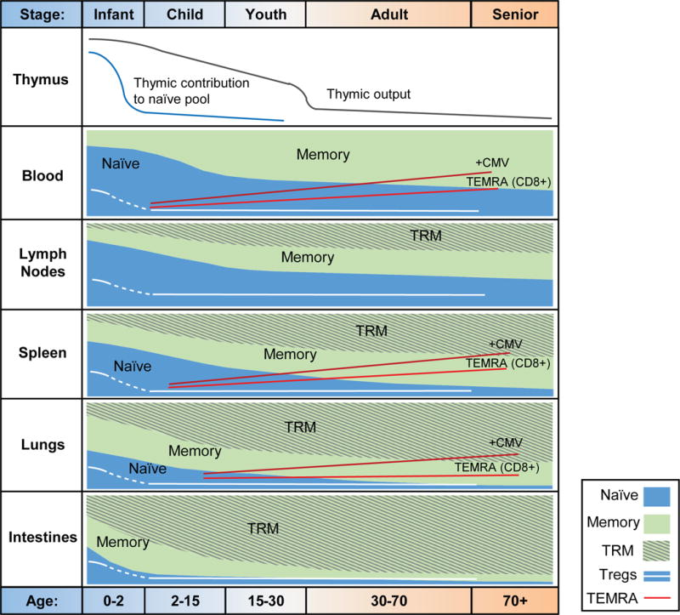
ヒトのT細胞コンパートメントは、乳幼児期から高齢期にかけて大きく変化し、組織部位によって大きな違いがある。胸腺出力は非常に早い時期から減少し、成人中期には、末梢のTREC含量やDP胸腺細胞で測定した胸腺出力はごくわずかになる。幼少期以降は、ナイーブT細胞を維持するための末梢のメカニズムにより、ナイーブT細胞の末梢プールに対する胸腺の相対的な貢献度は低い。すべての組織において、ナイーブT細胞からメモリーT細胞への移行が起こる。この移行は、肺や腸などのバリアー組織では幼少期に観察され、大人になってもナイーブT細胞はごくわずかしか残存せず、リンパ系の部位では、大人になってからメモリーT細胞への移行が最も遅くなる。常駐するメモリーT細胞は、組織内のメモリーコンパートメントの様々な割合を占めている(バリアー組織で最も多く、リンパ節では少ない)が、Trm細胞の発生はメモリーの発生にわずかに遅れている。CD45RAを再発現する最終分化したT細胞(Temra)は、血液、脾臓、肺のCD8+T細胞の重要な一部を構成しており、高齢やCMV感染に伴って頻度が増加する。
末梢では、胸腺から出現した新しいナイーブT細胞が、人生の初期に血液や複数の粘膜およびリンパ組織の部位に存在する(Thome et al 2016a)。これらの部位では、年齢とともにT細胞サブセット組成のグローバルおよび組織特異的な変化が見られる(図3)。すべての部位で、ナイーブT細胞の漸減とメモリーサブセットの代償的増加が、幼少期から成人期にかけて見られるが、この変化の速度は、粘膜部位で最も速く、脾臓では中間的で、リンパ節と血液では最も遅くなる。注目すべきは、初期のメモリーT細胞は主に腸と肺に現れ、小児期後半にはこれらの部位でメモリーT細胞が優位になることである(図3)。これらの粘膜記憶T細胞は、Trm細胞の表現型を示し、生後2年間は徐々に発達するが、急速に蓄積して成人期の全年齢を通じて優勢なサブセットとなる。脾臓やリンパ節では、加齢に伴うナイーブの消失とメモリーの蓄積はより緩やかで、これらの部位では平均して40~50%のメモリーT細胞がTrm細胞の特性を持つようになる。しかし、LNは脾臓や血液と比較して、加齢によるナイーブT細胞の頻度の低下とメモリーT細胞の蓄積が最も緩やかである(Thome et al 2016b)(Saule et al 2006)。血液や組織部位のCD4+ Treg細胞は、初期に最も頻度が高く、小児期には減少し、成人では比較的低いが安定した割合(1-8%)が維持される(Thome et al 2016a)。CD8+ Temra細胞集団は、血液およびBM、脾臓、肺などの血液を多く含む部位で加齢とともに増加する傾向があり、CMV感染が持続している個体ではより急激に増加する(Gordon et al 2017)(図3)。このように、T細胞コンパートメントの加齢に伴う変化は、部位特異的およびサブセット特異的な動態を示する。
さまざまな部位におけるT細胞のこの差次的な免疫学的老化は、どのような意味を持つ可能性があるのだろうか。粘膜部位にメモリーT細胞が急速に蓄積するのは、特に乳児期や幼児期に新しい抗原に遭遇し、抗原負荷が高いことを反映していると考えられる。脾臓もまた、血液中の抗原を介して多様な抗原に遭遇する部位であり、循環性および常駐性のメモリーT細胞が蓄積される。一方、組織から移動してきたDCを介して抗原シグナルを受け取るリンパ節は、他の部位に比べて抗原負荷が低いと考えられている。粘膜やバリアー部位にTrm細胞が早期に蓄積されると、抗原負荷や炎症をコントロールし、DCの成熟やリンパ節への移動を制限することができる。このようにして、病原体が侵入した場所でその場で反応することにより、LNへの浸潤を防ぎ、ナイーブな集団や休止中のメモリー集団を維持するための保護的な組織ニッチを提供することができる。さらに、マウス感染モデルから得られた証拠は、Trm細胞が局所的なサイトカイン産生と免疫細胞の活性化によって組織内の全般的な抗病原体環境を促進することを示唆している(Ariotti et al 2014,Schenkel et al 2014)。我々は、成人期の粘膜およびバリア組織における高いTrm細胞含量が、循環およびリンパ系リザーバーからの入力を必要とせずに、同様の保護環境を促進し、病原体の拡散を制限することを提案する。成人が移植や自己免疫疾患のための免疫抑制やがんの化学療法に耐えることができ、複数の感染症に負けることがないのは、このためである。
また、Treg細胞には部位別、時間別の動態があり、これが異なるライフステージでの免疫制御に影響を与えている可能性がある。年長児や若年成人と比較して、人生の初期にTreg細胞の有病率が高いことから、新しい抗原にさらされている期間の免疫制御には、初期に明確な役割があることが示唆される。この初期の免疫調節段階に続いて、記憶T細胞、特に組織内のTrm細胞は、IL-10の産生や低増殖などの調節能力を示すことから、特に組織内で調節的な役割を提供する可能性もある(Kumar et al 2017)。成人の免疫応答におけるTreg細胞の役割は、疾患における頻度推定が循環Treg細胞にのみ依存するため、評価が困難であるが、循環Treg細胞の頻度および機能の変化は、1型糖尿病、多発性硬化症、関節リウマチ、および炎症性腸疾患を含むヒトの自己免疫疾患と関連している(レビューについては(Bacchetta et al 2007;Dejaco et al 2006)を参照)。今後の研究では、Trm細胞や組織Treg細胞による組織特異的な制御を解析することが、異なるライフステージにおけるT細胞のホメオスタシスを制御するメカニズムを理解する上で重要である。
おわりに
ヒトT細胞に関する従来の研究は、最もアクセスしやすい場所として血液に焦点を当てていたが、最近の研究では、T細胞サブセットの解剖学的なコンパートメント化が明らかになってきた。特に、新たに定義された組織常駐型メモリーT細胞のサブセットや他のサブセットの組織局在化は、T細胞反応の解剖学的複雑さを示している。T細胞サブセットは、ライフステージや解剖学的コンパートメントに関連した特殊な機能を持っており、異なる部位では加齢に伴う変化の動態が異なる。自己免疫疾患や炎症性疾患、がんなどの疾患プロセスにおいて、組織ベースの免疫がどのように変化するかを解明するためには、単一細胞レベルでの分子、表現型、機能のプロファイリングが今後の研究の重要な焦点となるだろう。また、組織環境によって引き起こされる潜在的なエピジェネティックな変化を含む、T細胞応答の組織特異化のメカニズムを理解することで、人間の状態に不可欠な多様な抗原、持続的な病原体、新たに遭遇する病原体に直面しても、長期的な健康と免疫のホメオスタシスがどのように維持されるかが明らかになるだろう。