Contents
- 概要
- 1. はじめに
- 2. 方法
- 2.1. ACE2を発現している中枢神経系細胞とCOVID-19関連の神経疾患
- 2.2. COVID-19による中枢神経系損傷と神経細胞および免疫細胞の関連性
- 2.3. 免疫関連遺伝子とCOVID-19関連の神経疾患との関連性
- 2.4. インドールアミン-2, 3-ジオキシゲナーゼ1 (IDO1)
- 2.5. 一酸化窒素(NO)合成酵素または誘導性一酸化窒素合成酵素(iNOSまたはNOS2)
- 2.6 2′, 5′-オリゴアデニル酸シンテターゼ1 (OAS1)
- 2.7. ヒト白血球抗原(HLA)
- 2.8. 腫瘍壊死因子-β (TNFSF1)
- 2.9. 炎症性サイトカイン遺伝子とCOVID-19関連の神経合併症の発症機構
- 3. まとめ
- 4. 今後の課題
Immune mediating molecules and pathogenesis of COVID-19-associated neurological disease
pubmed.ncbi.nlm.nih.gov/34090983/
2021 年 6 月 3 日
ハイライト
- このレビューは、COVID-19関連の神経病態を理解するための有益な洞察と枠組みを提供する。
- SARS-CoV-2の感染に対して感受性の高い細胞の種類を特定するのに役立つと思われる。
- この文章はCOVID-19感染症における嗅覚の変化についての理解を深める。
- COVID-19による神経障害の理解を深めるために、この文章に基づいて発現研究をデザインすることができる。
- 重度のCOVID-19を克服した患者の認知的、精神的、ウイルス学的データの評価が必要である。
概要
背景
SARS-CoV-2の長期感染は,青年や小児の精神疾患や認知障害と関連している.SARS-CoV-2は中枢神経系で休眠状態にあり,神経系の合併症を引き起こす。脳内でACE2が広く発現していることから、SARS-CoV-2感染への関与が懸念されている。しかし、SARS-CoV-2が血液脳関門(BBB)を通過し、さらに脳に感染することについてのメカニズムはまだ明らかになっていない。さらに、SARS-CoV-2の休眠感染が慢性的な神経疾患を引き起こすメカニズムも明らかにする必要がある。COVID-19に関連した神経疾患に関与する危険因子を見つけることが急務である。そこで、COVID-19関連神経疾患の病態における免疫関連遺伝子の役割を示し、関連する遺伝的危険因子の発見に貢献することを目的とする。
方法
EMBASE, PubMed (Medline), Google Scholarなどの複数のデータベースを用いて検索を行った。また、COVID-19の神経病態への関与とその結果に関する文献調査を行った。
解説
持続的な炎症刺激は、神経変性疾患の進行を促進すると考えられている。COVID-19患者では、サイトカイン、ケモカインの発現量が増加し、免疫細胞の発現量が減少することが知られている。重症のCOVID-19患者ではサイトカインストームが観察された。SARS-CoV-2 感染症の性質は神経炎症性である可能性がある。免疫応答の遺伝子は神経変性疾患と関連している可能性がある。
結論
今回の総説は、COVID-19に関連した神経病態を理解する上で有用な枠組みを提供するものである。神経症状を呈するCOVID-19患者の免疫関連遺伝子に関する実験的研究は、その神経病理発生を確立するのに役立つだろう。
前の記事はこちら次の記事はこちら
キーワード
COVID-19感染症SARS-CoV-2関連神経疾患免疫関連遺伝子肺炎サイトカイン・ストーム
1. はじめに
SARS-CoV-2関連の神経合併症は新たな問題である[1]。これは、いくつかのウイルス感染症の重症化につながる急性の炎症性亢進状態である「頭蓋内サイトカインストーム」と関連している[1]。「頭蓋内サイトカインストーム」は、免疫細胞の活動が異常に亢進して血液脳関門が破壊されることから始まり、左右対称の多巣性病変を伴う。SARS-CoV-2に関連した中枢神経系(CNS)の合併症の発生率は0〜0.04%程度である[2]。重症で重篤なCOVID-19患者は、SARS-CoV-2に関連した神経系合併症を引き起こす可能性が高いとされている[3,4]。脳幹へのウイルスの浸潤は、中枢神経系の病態を引き起こす可能性を高める[5]。SARS-CoV-2に長期間感染すると、青年や子供の精神疾患や認知障害が発症する可能性がある。顆粒球-マクロファージコロニー刺激因子(GM-脳脊髄液)の生成を介して免疫細胞の活性化に関与するサイトカインやケモカインなど、免疫応答の遺伝子は、抗ウイルス免疫において主要な機能を果たしているが、炎症プロセスを活性化する。
SARS-CoV-2の感受性とその臨床的転帰は、サイトカインやケモカインなどの免疫制御遺伝子の発現と、これらのタンパク質の機能に影響される。これらの要因は、小児期、思春期、成人期におけるシナプス刈り込みの変化と関連している。SARS-CoV-2の感染が休眠状態で持続すると、炎症性タンパク質の分泌が増加し、神経変性疾患の発症を刺激する可能性がある。
SARS-CoV-2の感染後、局所組織からIL-1やIL-6などのサイトカインが放出されると、認知症、認知障害、運動障害、てんかん発作など、いくつかの神経病理学的表現型が引き起こされる可能性がある[[6], [7], [8]]。しかし、現在のところ、この仮説の直接的な証拠はない。
ACE2は、骨格筋や神経系を含むさまざまな器官に存在している[9]。脳の内皮細胞に発現している。SARS-CoV-2は、ACE2受容体を利用して細胞内に侵入し、S1タンパク質が内皮細胞のACE2に付着・結合することで、ウイルスの感染を脳内に誘導する。そのため、COVID-19患者の神経血管障害の一因となっている可能性がある[10]。ACE2は脳の様々なコンパートメントに発現しており、S1タンパク質と結合するため、いくつかの間接的または直接的なメカニズムでSARS-CoV-2感染に関与している。これまでのところ、SARS-CoV-2に関連した中枢神経系合併症の証拠は十分に示されていないが、COVID-19患者の脳脊髄液から分離されたSARS-CoV-2ゲノムは、ウイルスの神経への直接侵入を示唆している[11]。
SARS-CoV-2感染は、異嗅症を含む味覚や嗅覚の障害と関連している[[12], [13], [14], [15], [16], [17]]。COVID関連の無嗅覚症では、SARS-CoV-2が炎症反応による一過性の匂いの知覚の変化を説得する[16,18,19]。しかし、典型的なウイルス感染後の無嗅覚症では、嗅覚ニューロン(OSN)が直接損傷を受けるため、回復に数ヶ月を要することが多い[[22], [23], [24]]。このことから,SARS-CoV-2は,他のウイルスとは異なる未同定のメカニズムで匂いの処理を標的にしている可能性が考えられる.
これまでのところ、COVID-19に関連する神経学的症状の範囲は完全には示されていない[25]。また、SARS-CoV-2がどのようにして血液脳関門(BBB)を通過し、ミクログリアやアストロサイトに感染するのかは、まだ完全には解明されていない[26]。そこで、免疫関連遺伝子とSARS-CoV-2の脳細胞への侵入を含むSARS-CoV-2関連の神経学的病態との相関関係を明らかにするために、本文をまとめた。
2. 方法
EMBASE, PubMed (Medline), Google Scholarなどの複数のデータベースを利用して検索を行った。また、COVID-19の神経病態への関与とその結果に関する文献調査を行った。
2.1. ACE2を発現している中枢神経系細胞とCOVID-19関連の神経疾患
ACE2は、オリゴデンドロサイト、アストロサイト、神経細胞、単球・マクロファージに発現している[27,28]。また、樹状細胞やマクロファージにも発現し、SARS-CoV2の肺への侵入を助け、局所的・全身的な制御不能な炎症反応を誘発する[29,30]。宿主細胞のプロテアーゼであるフーリンとTMPRSS2もマクロファージに発現しており、SARSウイルスの結合と膜の融合に役割を果たしている[31]。ADAM17がACE2のシェダーゼとして働くのと同様である[32]。このようにして、ウイルスは樹状細胞やマクロファージに侵入し、これらすべての構成要素の存在下で複製を行い、炎症性のケモカインやサイトカインの異常な産生を活性化する[33]。SARS-CoV-2がマクロファージに感染した直後、SARS-CoV-2は炎症性ケモカインの発現を増加させる。その一方で、抗ウイルス性サイトカインの産生を低下させる[34]。この研究では、樹状細胞はSARS-CoV2の感染に感受性があるが、ウイルスの複製をサポートすることはできないことが示された[35]。
SARS-CoV-2感染後、S1タンパク質は、神経細胞、グリア細胞、毛細血管内皮細胞、嗅球周皮細胞、背側に位置する嗅覚上皮細胞に発現しているACE2と結合し、無嗅覚症とその関連障害を引き起こす。また、S1タンパク質は、嗅覚神経上皮や篩骨の篩板(しばん)に発現するACE2と結合し、中枢神経系に侵入して神経細胞を死滅させる(図1a, 図1ba and 1b)。SARS-CoV-2は、嗅球を経由して脳幹に到達し、細胞障害を起こして神経細胞を死滅させる。したがって、SARS-CoV-2は、COVID-19関連の神経系合併症の発症に寄与している可能性がある。
図 1a. 中枢神経系細胞におけるACE2の発現とCOVID-19に関連する神経疾患。
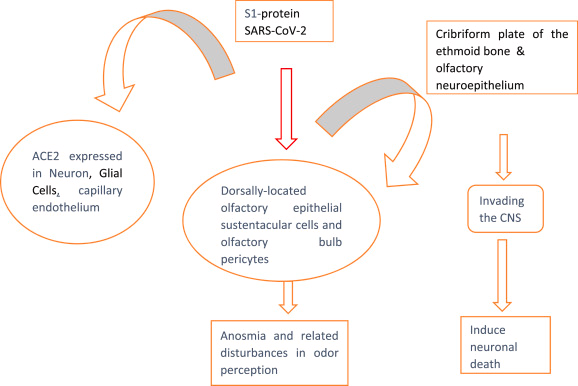
図 1b. 上皮細胞とCOVID-19に関連する軸索損傷。
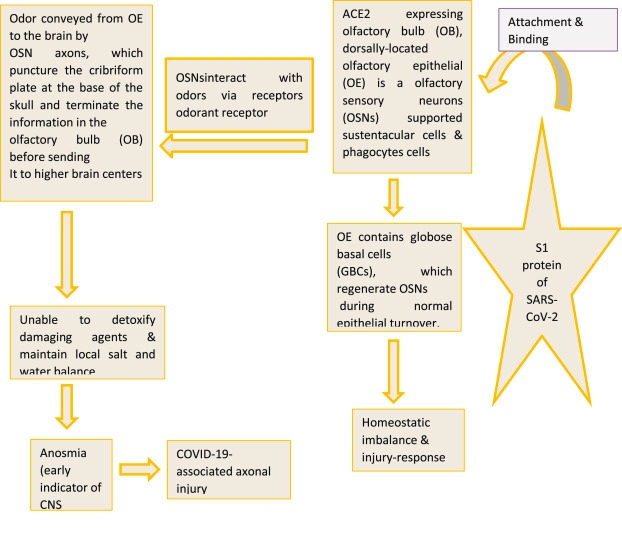
2.2. COVID-19による中枢神経系損傷と神経細胞および免疫細胞の関連性
SARS-CoV-2が感染すると、S1タンパク質がACE2を発現している神経細胞、グリア細胞、樹状細胞、単球、マクロファージなどと結合する。その後、ウイルスはこれらの細胞を活性化し、他の免疫細胞サブセットの浸潤を得て、複製を行う。その結果、これらの細胞が炎症性タンパク質を異常に産生するようになる。その一方で、抗ウイルス性サイトカインの産生が低下する。これにより、COVID-19に関連した中枢神経系傷害を発症する中枢神経系の局所的および全身的な炎症反応が誘発される(図2)。
図2.COVID-19による中枢神経系損傷と神経細胞および免疫細胞との関連。
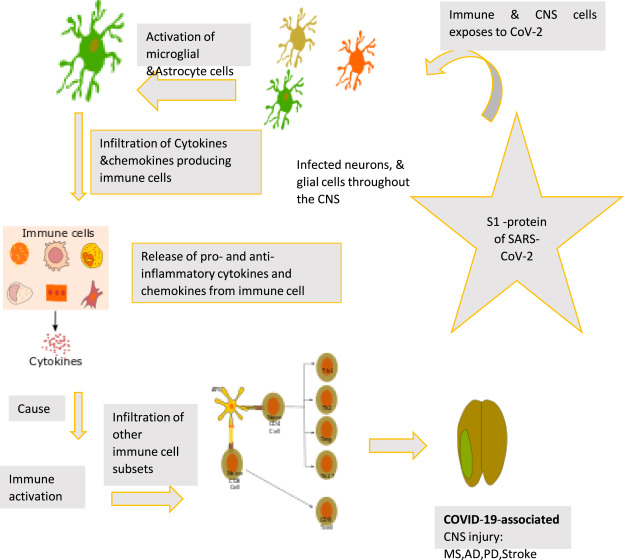
自然免疫系は、外部からの刺激に対する反応に重要な役割を果たしている。自然免疫系が異常をきたすと、自然免疫反応の過剰な制御が行われる。免疫細胞(CD4およびCD8 T細胞、CD3,NK細胞、CD16,CD56細胞)の制御不良と、炎症性タンパク質の継続的な産生増加(サイトカイン・ストーム)は、COVID-19疾患の重症度と関連している[36]。サイトカイン(IL-1β、IFN-γ、IL-12,IL-33,IL-6,IL-18,IFN-α)トランスフォーミング成長因子(TGF-β)ケモカイン(CCL2,CCL3,CCL5,CXCL9,CXCL10)は、免疫エフェクター細胞から放出される炎症性メディエーターである[37]。
SARS-CoV-2に感染すると、炎症性タンパク質の産生が増加し、異常な免疫反応が生じ、免疫細胞の機能が変化する。異常な免疫反応が持続することで、脳幹へのウイルスの浸潤が可能となり、COVID-19に関連した神経学的合併症の発症につながる可能性がある。時には、COVID-19を媒介とした後の異常な免疫反応が、持続的な炎症、免疫抑制、異化症候群(PICS)として継続するために、個人が神経学的な合併症を経験することがある。
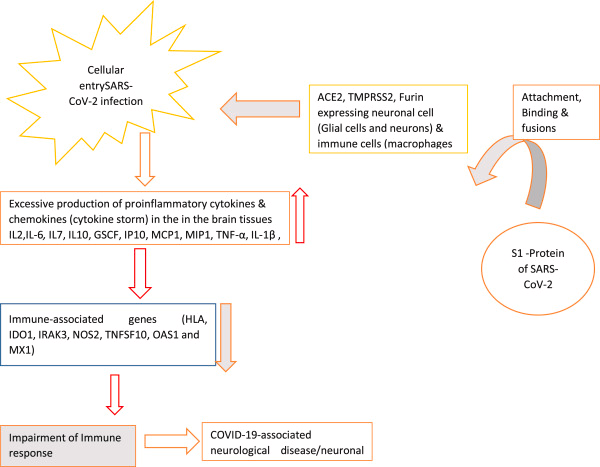
2.3. 免疫関連遺伝子とCOVID-19関連の神経疾患との関連性
SARS-CoV-2感染時、S1タンパク質は、神経細胞(グリア細胞、ニューロン)や免疫細胞(マクロファージ、単球、樹状細胞)に発現するACE2と結合し、脳細胞における抗ウイルスサイトカインの産生を低下させる。また、脳脊髄液中の炎症性ケモカインやサイトカインの分泌を増加させる。一方で、免疫応答遺伝子の発現レベルが低下し、免疫応答の乱れにつながる。これらの免疫関連遺伝子は、COVID-19に関連した神経合併症の発症に寄与している(図3)。
図3.免疫関連遺伝子とCOVID-19関連の神経疾患。
2.4. インドールアミン-2, 3-ジオキシゲナーゼ1 (IDO1)
IDO1 (8p11.21)は、炎症の抑制因子として知られている。炎症反応とIDO1による耐性のバランスが崩れると、炎症が起こり、病原体に対する免疫力が低下して感染症にかかりやすくなる。IDO遺伝子は、マクロファージ、単球、樹状細胞、ミクログリア、その他いくつかの免疫細胞で発現しており、神経合併症に影響を与える[38]。IDOは,ウイルスやリポポリサッカライド(LPS)などのIFN誘導物質によって誘導される[39]。SARS-CoV-2のS1タンパク質は、樹状細胞、単球、マクロファージに発現するACE2と結合し、その結果、IDO1を介した寛容と炎症反応に異常をきたす。したがって、IDO1遺伝子はCOVID-19関連の神経学的合併症の発症に寄与している可能性がある。
2.5. 一酸化窒素(NO)合成酵素または誘導性一酸化窒素合成酵素(iNOSまたはNOS2)
NOS2(17q11.2)はグリア細胞に存在する。NOSおよびNOS2は、免疫病学的および保護的な能力を持つ炎症メディエーターである[40]。NOS2は、炎症状態におけるNOの産生に関与しており、気管支喘息を含むアレルギー疾患において重要な役割を果たしている[41,42]。S1タンパク質がグリア細胞に発現しているACE2と結合すると、NOS2を介した防御が阻害され、免疫の恒常性が損なわれる。NOS2遺伝子のこれらの特性は、COVID-19関連の神経学的合併症への寄与について、いくつかの注意点を示している。
2.6 2′, 5′-オリゴアデニル酸シンテターゼ1 (OAS1)
OAS1 (2q24.13)は、I型インターフェロンによって誘導され、ウイルス感染に対する宿主の防御に役割を果たしている[43]。OAS1は,神経細胞,アストロサイト,オリゴデンドロサイトに発現しており[44],dsRNAまたはssRNAの存在下で,ATPを2′,5′-オリゴアデニル酸(2-5As)に変換する。2-5Asの生成は、潜在的なRNase Lを活性化し、一本鎖RNAを分解してウイルスの複製を阻害する[43]。OAS1遺伝子の一塩基多型(SNP)は、その発現レベルや酵素活性を変化させることが知られており、その結果、ウイルス疾患の感受性や重症度が変化することが知られている[45]。S1タンパク質が、神経細胞、アストロサイト、オリゴデンドロサイトに発現しているACE2と結合すると、OAS1が媒介する感染症に対する宿主の防御機能が阻害され、免疫反応が阻害される。このことは、COVID-19に関連した神経合併症の発症にOAS1遺伝子が関与していることを裏付けている。
2.7. ヒト白血球抗原(HLA)
HLA[6p21]遺伝子は、ウイルスを含む外来抗原に対する免疫反応に大きく寄与していることが広く知られている[46]。マクロファージやミクログリアは,ピック病やハンチントン病,パーキンソン病,アルツハイマー病,シャイ・ドレーガー症候群,筋萎縮性側索硬化症,多発性硬化症,エイズ脳症,グアムのパーキンソン病-認知症など,いくつかの神経疾患に関与する組織適合性糖タンパク質(HLA-DR)を発現している[47]。HLA-DRは,免疫反応に関与しており,外来抗原を排除することで免疫モニタリングを促進する.HLA-DRは,視神経脊髄炎,多発性硬化症,筋萎縮性側索硬化症,パーキンソン病,アルツハイマー病,筋無力症,統合失調症,重症のような多数の神経疾患における感受性や保護を評価するためにマッピングされている[48]。HLAは、ACE2受容体とSタンパク質の間の結合特異性を高め、COVID-19の進行を増加させる可能性がある。いくつかのHLAタイプがSARS感染の発生と関連しており[49]、例えば、HLA-B*4601アリルは、アジア人集団におけるCOVID-19の重症化に関与している[49]。さらに、HLA-A3.1対立遺伝子を持つ個人は、SARSコロナウイルスに感受性がある[49]。SARS-CoV感染者におけるCw*0801のホモ接合型とヘテロ接合型の対立遺伝子の比率は4.4:1であった。一方、DRB1*0301とHLA-Cw*1502の対立遺伝子を持つ個人は、SARS感染の抵抗因子として機能する可能性がある[50]。また、HLA-B*4601対立遺伝子は、台湾の集団におけるSARSの重症度と有意に相関していた[51]。HLA-B*4601対立遺伝子の頻度は、SARS感染が疑われる人の間で高く、さらに重症患者群の間で有意に増加していた[52]。中国人集団では、HLA-B*0703対立遺伝子とSARS発症との間に有意な関連が見られた[53]。HLA-C変異体の中には、ウイルス感染時にβ2microglobulin(β2m)を放出・蓄積することで神経炎症を引き起こすものがある。
ウイルスS1がミクログリアやマクロファージに発現したACE2と相互作用すると、HLA-DRを介した感染に対する宿主の防御が阻害される。免疫反応におけるHLA-DRの重要な役割は、COVID-19に関連した神経学的合併症の発症に寄与していることを示している。
2.8. 腫瘍壊死因子-β (TNFSF1)
TNFSF1 (6p21.3)は、炎症性サイトカインの発現と炎症の進行を制御する。TNF-αは,アストロサイト,ミクログリア,神経細胞から産生され[54],脊髄損傷[55],脳卒中[56],坐骨神経損傷[57]など,いくつかの臨床症状で高発現している。TNF-αの発現は、炎症および神経細胞死を刺激する。TNF-αレベルの上昇は、重度のCOVID-19患者と関連している[58]。TNF-αの-1031CT/CCと-863ACの遺伝子型は、SARS患者の退院の危険因子となる可能性がある[59]。ACE2は、オリゴデンドロサイト、ニューロン、アストロサイト、グリア細胞(アストロサイトとミクログリア)に発現している[27]。SARS-CoV-2感染時には、TNFを介した免疫細胞の制御が阻害され、免疫反応が低下することから、COVID-19関連の神経合併症の発症にTNFが関与している可能性が示されている。
2.9. 炎症性サイトカイン遺伝子とCOVID-19関連の神経合併症の発症機構
2.9.1. インターロイキン-2 (IL-2)
IL-2 (4q27)は炎症性サイトカインとして知られており、炎症促進作用と抗炎症作用の両方を持っている。免疫系の調節や喘息の発症に関与している。IL-2またはIL-2R分子は、小脳、海馬形成部、中隔、前頭皮質、視床下部、脳梁線条、青斑核などの下垂体繊維路に存在している。ACE2とIL-2Rは、神経細胞とグリア細胞の両方に発現している。IL-2R(IL-2Rα)は、IL-2の受容体として機能しており、IL-2が受容体(IL-2Rα)と結合した後、IL-2はBBBを伝染し、中枢神経系と末梢組織の間のコミュニケーションを制御する。また、IL-2はその受容体(IL-2Rα)と結合した後、BBBを伝染し、中枢神経系と末梢組織のコミュニケーションを制御する。重度のCOVID-19患者では、血清中のIL-2レベルが上昇していた[58]。以上のように、SARS-CoV-2感染症におけるIL-2の関与は、COVID-19関連の神経学的合併症の発症に寄与していることを示している。
2.9.2. インターロイキン10(IL-10)
IL-10(1q32.1)は、中枢神経系で産生される免疫抑制性サイトカインで、抗炎症因子として作用する。IL-10は、グリアの炎症反応、中枢神経系のカテーテル感染、末梢の炎症など、様々な条件下での感染症に対する炎症反応を制御している[60,61]。臨床的には、ICUに入院しているCOVID-19患者とIL-10レベルの上昇が関連していることが示されている[59]。文献的には、IL-10 -1082G/Aおよび-592A/C多型がSARS感染と関連する可能性が示唆されている[62]。ACE2は神経細胞やグリア細胞に多く発現していることから、中枢神経系はSARS-CoV-2の潜在的な標的となる可能性があり[63]、IL-10は炎症反応の制御を通じてこのプロセスに主要な役割を果たしていると考えられる。
2.9.3. インターロイキン6 (IL-6)
IL-6 (7p15.3)は、炎症促進作用と抗炎症作用の両方に関与する炎症性サイトカインで、急性肺損傷への対応に重要な役割を果たしている。COVID-19患者では、血漿中のIL-6濃度が高いほど、重度の呼吸不全のリスクと相関していた[64]。別の研究では、SARS-CoV-2関連脳炎患者の脳脊髄液において、IL-6とACEのレベルが上昇していることが示された[65]。臨床研究では、IL-6 174G/C多型がIL-6レベルに影響を与え、血漿中のIL-6レベルが高いと重症のCOVID-19と関連することが示されている[66]。IL-6多型は、韓国人集団のCOVID-19患者の重症度の指標として使用することが示唆されている[67]。IL-6はGM-脳脊髄液とJAK2のシグナル伝達に依存しており、SARS-CoV-2はこのプロセスにおいて重要な役割を果たしていると考えられる。したがって、IL-6は炎症反応に対する潜在的な治療標的となる可能性がある[68]。COVID-19患者では、IL-6が線維形成や内皮細胞の機能障害に重要な役割を果たしている可能性がある[67]。IL-6は、アストロサイトとミクログリアの両方で産生され[68]、その神経細胞での発現がグリア細胞の活性化に寄与している[69]。ACE2もまた、神経細胞、アストロサイト、グリア細胞に発現しており[27,70]、したがって、S1-ACE2の相互作用がIL-6を介して影響を受け、COVID-19関連の神経合併症の発症に寄与する可能性がある。さらに、IL-6の阻害剤は、二次感染を増加させることなく、COVID-19関連の死亡率を低下させることが示唆されている[71]。
2.9.4. インターロイキン7(IL-7)
IL-7(8q21.13)は、リンパ系細胞の生存とナイーブT細胞およびメモリーT細胞の維持に関与する炎症性サイトカインである。この研究では、脳脊髄液にIL-7が存在し、その高レベルが炎症性中枢神経系疾患と関連していることが示された[72]。中枢神経系ではIL-7のmRNA発現の増加が検出され[73]、血清中のIL-7レベルの上昇は、他の循環サイトカインやケモカインとともに、COVID-19疾患の重症度と関連している[58]。ACE2は中枢神経系に広く発現しており、IL-7がS1-ACE2を介した相互作用やその後のSARS-CoV-2感染に影響を与える可能性を示している[62]。したがって、IL-7を介したT細胞と免疫機能の維持の障害は、COVID-19関連の神経学的合併症の原因となる可能性があり、さらなる調査が必要である。
2.9.5. インターロイキン15 (IL-15)
IL-15(4q31)サイトカインは、抗ウイルス反応を含む感染症に対する防御、移植片拒絶反応や自己免疫疾患に対する防御に関与している。SARS-CoV-2は、IL-15サイトカインを誘導し[74]、ウイルスのクリアランスは、I型インターフェロン、IL-15,IFNγなどのいくつかの因子に依存する。SARS-CoV-2のクリアランスは、JAK1/JAK3阻害剤によって阻害される可能性があり、さらにJAK2阻害剤によってウイルスの侵入が阻止される可能性もある[75]。IL-15は,アストロサイトやニューロンなど,複数のタイプの脳細胞で発現している.同様に、ACE2もアストロサイト、オリゴデンドロサイト、ニューロンに発現しており[27]、COVID-19関連の神経合併症の発症にIL-15が関与している可能性を示している。
2.9.6. インターロイキン-1β (IL-1β)
‘IL-1β(2q13)は、免疫エフェクター細胞から放出される炎症性サイトカインであり、IL-1受容体に結合した後、炎症メディエーターとして重要な役割を果たしている[36]。IL-1はミクログリアに発現し、ミクログリアの活性化と増殖のメディエーターとして作用する。IL-1遺伝子の不適切な発現は、中枢神経系の機能障害を引き起こす可能性がある。IL-1は,接着分子や内皮細胞[76],エイコサノイド[77]など,さまざまな因子を刺激する.これらの因子の変動はBBBの伝染性を高め、神経細胞とグリア細胞に同時にACE2を発現させることは、いくつかの注意点がある[70,78]。疾病状態では、ミクログリア細胞が著しく活性化され、神経病理の原因となる[79]。IL-1βの分泌増加は重度の炎症を引き起こすため、IL-1β遺伝子はCOVID-19関連の中枢神経系機能障害に寄与する可能性がある。COVID-19関連の中枢神経系疾患では、血漿中のIL-1や中枢神経系のレベルは重症度と相関していた[[80], [81], [82], [83], [84], [85]]。IL-1の発現量の増加と活性化されたミクログリア細胞は、中枢神経系の病因に貢献している可能性がある[86]。神経病理や神経炎症では、ミクログリアの形態的変化とともに、脳組織でのIL-1の高い発現が観察された[81,[87], [88], [89], [90], [91]。いくつかの神経疾患にIL-1βが大きく関与しており、COVID-19におけるIL-1βの役割は既に知られているため、COVID-19に関連する神経合併症におけるIL-1βの役割を評価するためには重要な調査が必要である。
2.9.7. インターフェロン-ガンマ(IFNγ)
IFNγ(ch12)は、中枢神経系疾患において病的な役割と保護的な役割を持つ多面的なサイトカインである。IFNγは、Th1応答と免疫に関与しており [92]、その結果、いくつかの炎症性および感染性疾患に罹患しやすくなる。IFNγは、炎症性サイトカイン(IL-6,IL-1,TNF-α)を誘導する。IFN-γ +874A対立遺伝子を持つ人は、SARSに感染しやすかったという報告がある[93]。IFNγは、神経炎症や神経変性状態でも発現し、ウイルスによる脳内感染の際に保護作用を発揮するが、感染した神経細胞では、IFNγは非細胞分裂性のウイルス制御を媒介する。IFN-γとACE2はアストロサイトとミクログリアに発現しており[70,92]、したがってSARS-CoV-2感染は脳内のIFN-γを介した防御機構に影響を与える可能性がある。したがって、IFN-γ遺伝子はCOVID-19に関連した中枢神経系機能障害に寄与する可能性があると考えられる。
2.9.8. インターロイキン-17 (IL-17)
IL-17 (6p12.2)は、Th17 および CD8 細胞から分泌される炎症性サイトカインであり、多くの生理的および病態生理的な状態に関与している。IL-17の発現は、いくつかの研究でCOVID-19患者の重症度と関連している[75,[94], [95], [96]]。重症のCOVID-19患者では、CCR6+Th17細胞の数が多いことが分かっている[97]。IL-17シグナルの増加は、NFκBを媒介とする炎症経路を活性化することで、神経細胞の毒性に影響を与える可能性がある[98]。IL-17は主に脊髄のアストロサイトに発現し、IL-17RAはアストロサイトとミクログリアの両方に発現し、ACE2はオリゴデンドロサイト、アストロサイト、ニューロンにも発現している[27]。このことは、SARS-CoV-2がIL-17を介した病原体に対する防御免疫に影響を与えている可能性を示しており、したがって、IL-17遺伝子が神経細胞毒性やCOVID-19に関連した中枢神経系機能障害に寄与している可能性がある。
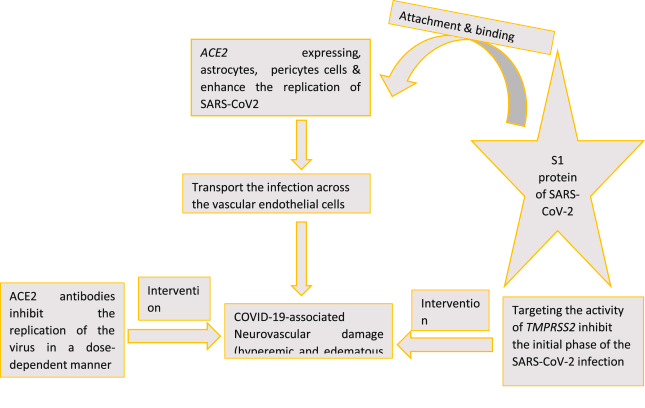
2.10. 内皮細胞とCOVID-19関連の神経血管障害
BBBを構成する内皮細胞、アストロサイト、ペリサイト、および末梢由来の免疫細胞はACE2を発現している。ACE2の存在は、ACE2-S1の相互作用を介してSARS-CoV-2の重要な標的となることを示している。中枢神経系の内皮細胞(EC)や多形核細胞(PMN)は、ウイルスによるサイトカイン誘導後に炎症を起こし、結果的に血液脳関門を破壊する可能性がある。そのため、初期の中枢神経系毒性やCOVID-19関連の神経血管障害に寄与している可能性がある(図4)。
図4.内皮細胞とCOVID-19関連の神経血管障害の関連。
3. まとめ
中枢神経系の機能障害とCOVID-19関連疾患の発症について、4つの可能性を検討した。SARS-CoV-2は、以下のようないくつかの細胞タイプと調節因子との相互作用によって、神経学的合併症を発現する可能性がある。
- 中枢神経系細胞におけるACE2の発現は、COVID -19関連の神経学的障害に対して脆弱である。
- ACE2を発現している免疫細胞がCOVID -19関連の中枢神経障害を媒介する。
- 免疫関連遺伝子がCOVID -19関連神経疾患のメカニズムを媒介している可能性がある
- ACE2を発現している内皮細胞はCOVID -19関連神経障害を引き起こす可能性がある。
COVID-19関連の中枢神経系機能障害の患者における免疫関連遺伝子に関連した更なる実験的、臨床的研究を行い、その神経因果関係を理解する必要がある。
4. 今後の課題
COVID-19の神経学的合併症は完全には解明されていない。重度のCOVID-19を克服した患者の認知、精神医学、ウイルス学、神経生理学的データを収集するために、前向きな多施設共同研究を実施すべきである。この総説は、COVID-19に関連した神経病態を理解するための有用な洞察と枠組みを提供するだろう。この総説は、COV-2感染に対する感受性の高い細胞タイプを見つけるのに役立ち、COVID-19疾患における嗅覚の変化をよりよく理解することができるかもしれない。さらに、この総説は、COVID-19感染症による神経病態の理解を深めるために、COVID-19感染症関連の神経学的合併症を持つ患者における上記の遺伝子に関連する発現研究をデザインするのに役立つであろう。
