Attenuation of clinical and immunological outcomes during SARS-CoV-2 infection by ivermectin
キーワード
コロナウイルス / 炎症 / イベルメクチン / SARS-CoV-2 / ウイルス感染症 cSubject Categories: 免疫学 / 微生物学 / ウイルス学 /
これは出版が認められ、完全な査読を受けているが、コピー編集、植字、ページ付け、校正のプロセスを経ていないため、このバージョンとVersion of Recordの間には違いがあるかもしれない。この記事を doi.として引用してほしい。
要約
SARS-CoV-2による壊滅的なパンデミックと、現在のワクチンの効果を危うくする抗原変異体の出現により、疾患に対する炎症の寄与を含め、COVID-19の病態生理を包括的に理解することが急務となっている。また、病気の転帰を改善する可能性のある免疫調整剤を探すことも必要である。本研究では、SARS-CoV-2感染ハムスターにおいて、コリン作動性抗炎症経路を介した免疫調節作用が期待される抗寄生虫薬イベルメクチン(IVM)を標準量投与することで、臨床症状の悪化を防ぎ、嗅覚障害を軽減し、上下気道の炎症を抑えることができることを示した。IVMは感染動物の気道のウイルス量には影響を与えないが、感染した肺のトランスクリプトーム解析から、IVMはI型インターフェロン反応を弱め、他のいくつかの炎症経路を調節することが明らかになった。特に、IVMは肺組織におけるIl-6/Il-10比を劇的に低下させ、マクロファージのM2極性化を促進したことから、IVM投与動物の臨床症状がより良好であることが考えられる。以上のことから,本研究は,SARS-CoV-2感染者の臨床状態を改善するために,IVMのような免疫調整薬を使用することを支持するものである。
序論
コロナウイルスは,さまざまな宿主に呼吸器疾患を引き起こす。コロナウイルス19(COVID-19)を引き起こすSARS-CoV-2のパンデミックが続いている間、呼吸器症状以外の臨床症状が感染に関連していることがわかった。
感染には呼吸器症状以外の臨床症状が関連しており、無嗅覚症や無月経などの神経症状を伴うことが多い。これらの特徴は、SARS-CoV-2に対する患者の免疫系の過剰反応と関連している(Bhaskar et al 2020,Han et al 2020,Qiu et al 2020)。その結果、この過剰反応性の特徴を理解し、COVID-19患者の臨床状態を改善するために、新たな治療法を見つけたり、薬剤を再利用したりすることが急務となっている(Batalha er al 2021)。
大環状ラクトンであるイベルメクチン(IVM)は、商業的に利用可能な抗寄生虫剤であり、広範囲のエンドパラサイトおよびエクトパラサイトによる感染を防止する(Heidary & Gharebaghi, 2020, Sajid et al 2006)。IVMは、-7ニコチン性アセチルコリン受容体(nAChR)の効率的なポジティブアロステリックモジュレーターである
(Krause et al 1998)や、ミミズのグルタミン酸(GluCl)に対する筋肉受容体など、いくつかのリガンド依存性イオンチャネルを効率的に正のアロステリックモジュレーターとして機能する(Hibbs & Gouaux, 2011)。さらに、IVMは、その基礎となるメカニズムがまだ確立されていないにもかかわらず、-7 nAChRが関与することが知られている条件下で、ヒトおよび動物において免疫調節効果を発揮することが示されている(Heidary & Gharebaghi, 2020, Sajid et al 2006)。(Laing er al)。 SARS-CoV-2の直接的または間接的な相互作用
のnAChRとの直接的または間接的な相互作用についても仮説が立てられており、特にSARS-CoV-2のスパイクタンパク質とヘビ毒の毒素などのnAChRリガンドとの間に配列の相同性があることが指摘されている(Changeux et al 2020)。IVMは
は、抗寄生虫活性を超えて、がん、アレルギー、ウイルス感染など、さまざまな病態に有効であることが示されている。
アレルギー、ウイルス感染症などである(Laing er al 2017)。最近では、IVMがウイルス量を減少させることが報告されており
動物のコロナウイルスであるマウス肝炎ウイルス(MHV)に感染したマウスの臨床状態を改善することが報告されている。
(Arévalo et al 2021)。また、IVMがVero/hSLAM細胞においてSARS-CoV-2の複製を試験管内試験で阻害することも報告されている。
が報告されている(Caly et al 2020)が、ヒトで臨床的に達成可能な濃度(150〜400μg/kg)よりもはるかに高濃度(50〜100倍)であるにもかかわらず(Bray et al 2020,Chaccour et al 2020,Guzzo et al 2020)。
2002).
本研究の目的は、SARS-CoV-2感染モデルであるゴールデン・シリアン・ハムスターにおいて、IVMがCOVID-19の病原性に与える影響を調べることである。ゴールデン・シリアン・ハムスターは、SARS-CoV-2に対して自然に寛容な種であり
また、COVID-19の最も信頼性が高く、安価な動物モデルである(Chan er al 2020, Muñoz-Fontela er al 2020)。さらに、最近ではこれを用いて、炎症を低下させるために
タイプIFNの鼻腔内投与で炎症を抑え、病気の進行を防ぐことの重要性を示すために使用された(Hoagland et al2020)。雄と雌の成体ゴールデン・シリアン・ハムスターに、6×104 PFUのSARS-CoV-2を経鼻的に接種した。
この接種量は、ゴールデン・シリアン・ハムスターに必ず症状のある感染を引き起こし、接種後4日(dpi)以内に無嗅覚症の発生率が高く、上気道および下気道のウイルス量が多いことから選択した(de Melo et al 2021)。感染時には、ヒトの臨床現場で一般的に使用されている抗寄生虫剤の用量である400μg/kgのIVMを動物に1回皮下注射し、4日間にわたってモニタリングした。
その結果、IVMを再利用して宿主の炎症反応を調節することで、感染動物の臨床スコアと疾患の重症度(嗅覚障害を含む)が強く低下することがわかった。
ウイルス量には影響を与えないものの、これらの動物に見られた臨床スコアと疾患の重症度(無嗅覚症を含む)を強く減少させた。IVMを投与した動物では、I型およびIII型のインターフェロン反応やIl-6/Il-10比の大幅な低下、肺におけるM2マクロファージの存在など、いくつかのシグナル伝達経路に強い変調が見られた。これらの効果はほとんどがコンパートメントに分けられ、性に依存しており、治療を受けた雌の感染者はより良い臨床結果を示した。
結果と考察
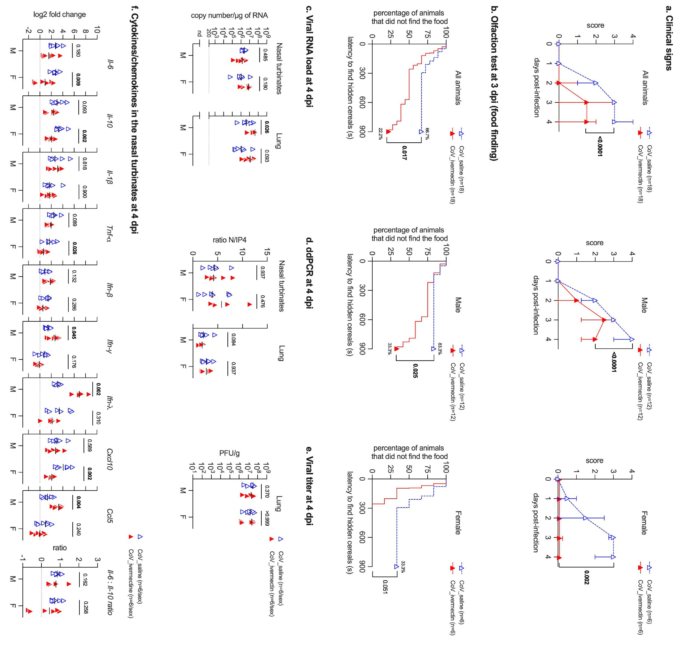
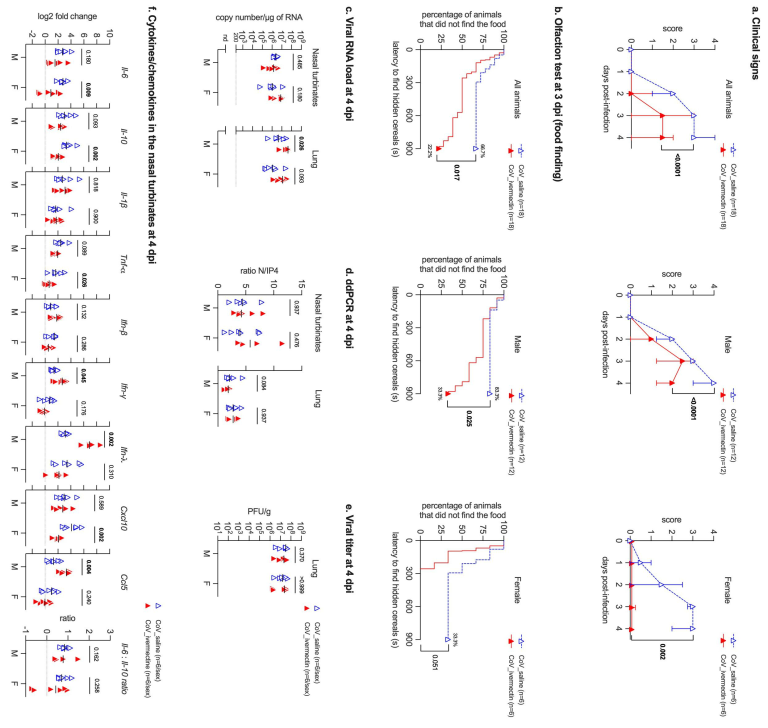
IVM化学療法が臨床結果に及ぼす影響を調べるために、感染後4日間、体重、臨床スコア、嗅覚パフォーマンスを毎日評価した。ゴールデンハムスターモデルは、ヒトの中等度から重度のCOVID-19を再現しており、感染後5~6日の臨床期の後、感染後2週間までに完全に回復し、死亡例は発生しなかった。感染した動物の気道におけるウイルス力価およびウイルスRNA量は、感染後2〜4日後に上昇するが、感染後7日目には急激に低下する(Chan et al 2020,de Melo et al 2021年、Sia et al 2020)。 IVMを投与した感染動物は、性別を問わず、生理食塩水を投与した感染ハムスターで観察されたのと同様の体重減少を示した(図EV1a)。しかし、IVMを投与した感染動物では、性差に依存してクリニカルスコアの重症度が著しく低下した。 生理食塩水を投与した感染ハムスターの66.7%(12/18)が嗅覚障害を呈したのに対し、IVMを投与した感染ハムスターでは22.2%(4/18)しか嗅覚障害の兆候を示さなかった(図1b、図EV1b-d)。嗅覚性能は性別にも影響され、生理食塩水で感染させたオスでは83.3%(10/12)が低嗅覚・無嗅覚を示したのに対し、IVMで感染させたオスでは33.3%(4/12)しか示さなかった(図1b、図EV1b-d)。メスでは、生理食塩水を投与した感染動物の33.3%(2/6)が嗅覚障害を呈したのに対し、IVMを投与した感染メス(0/6)では嗅覚障害が見られなかった(図1b、図EV1b-d)。 オスは無嗅覚・低嗅覚の発生率が高いため、続いてIVMがオスの感染者の臨床症状と嗅覚機能に及ぼす影響を調べるために用量反応曲線を実施したところ、低用量のIVM(100または200μg/kg)では抗寄生量の400μg/kgと同様の臨床結果が得られた(図EV2)。予想通り、模擬感染したハムスターには嗅覚障害の兆候は見られなかった(Fig EV1b-d)。
ハムスター
呼吸器系のウイルス量に対するIVM処理の効果を評価するため、古典的なRT-qPCR(図1c)と高感度技術であるデジタルドロップレットPCR(Suo et al 2020)の両方を用いて、感染したハムスターの鼻濁液と肺を検査した(図1d、付録図S1)。驚くべきことに、呼吸器系のウイルスRNA量は、男女両方のサンプルでIVM治療の影響を受けなかった。さらに、IVM処理は、構造遺伝子と非構造遺伝子の転写の比率で評価したウイルスの複製速度に影響を与えなかった(図1d、付録図S1)。最後に、IVM治療は肺における感染性ウイルスの力価を変化させなかった(図1e)。これらの結果は、IVMがはるかに高い濃度で使用されているにもかかわらず、試験管内試験でSARS-CoV-2の複製を阻害することを示唆する以前の報告(Caly et al 2020)とは対照的に、標準的な抗寄生量である400μg/kgでは、IVMの抗ウイルス活性が生体内試験で検出されないことを示している。したがって、感染したゴールデンハムスターのCOVID-19の臨床症状に対するIVMの作用は、ウイルスの複製の減少に起因するものではない。
イベルメクチン療法は感染したハムスターの鼻甲介における局所的な免疫反応を調節する
無嗅覚症は、ヒトにおけるCOVID-19の典型的な症状であり、性差による違いもある(Han
et al 2020,Qiu et al 2020,Xydakis et al 2020)。) 嗅覚に続く鼻腔内の炎症、嗅覚ニューロンの感染と脱落に伴う鼻腔内の炎症は、SARS-CoV-2感染時の嗅覚障害の根本的な要因であることが示されており(de Melo er al)。 そこで我々は、IVMがハムスターの局所的な炎症反応、特にSARS-CoV-2感染の主要な標的組織である鼻翼部の炎症反応を調節し、その効果が嗅覚スコアに相関する可能性を検証した(de Melo er al)。 この目的のために、サイトカイン(Il-6,Il-10,Il-1 、Tnf- Ifn- 、Ifn- 、Ifn- )およびケモカイン(Cxcl10およびCcl5)のパネルを使用して、4dpiのSARS-CoV-2感染ハムスターの鼻濁液中の免疫反応に対するIVM処理の影響を評価した。雌はIVM投与により、COVID-19患者の予後を左右する重要な炎症メディエーターであるIl-6,Il-10,Tnf-、およびCxcl1の有意な低下を示し(Fig 1f)これは食物探索試験(Fig 1b)で観察された嗅覚パフォーマンスの向上と同様であった。性グループ間の違いは、3つの炎症性メディエーター(Ifn- 、Ifn- 、Ccl5)が男性でのみ増加していることで示されている(Fig 1f)。なお、Il-6/Il-10比については、鼻甲介では差が見られなかった。
肺の免疫代謝はSARS-CoV-2感染の影響を受け、イベルメクチンによって調節される
IVMはコリン作動性シナプス関連遺伝子を含む肺の病理と炎症の経路を減衰させる
臨床症状に対するIVMの作用機序をさらに検討するために、IVMを投与したハムスターと投与しなかったハムスターの下気道で、RNAseqを用いた比較不可知論的なトランスクリプトームアプローチを4dpiで行った。SARS-CoV-2に感染した肺では、雄と雌のハムスターは全体的に似たようなパターンを示したが、感染によって調節されるKEGGパスウェイは雄の方がわずかに多かった(図2a)。SARS-CoV-2に感染したオスとメスに共通して多く見られた炎症・代謝異常経路(図EV3)は、IFN応答の多くの遺伝子を含む「サイトカイン-サイトカイン受容体相互作用」、「TNFシグナル経路」、「インスリン抵抗性」など、ヒトCOVID-19患者の肺細胞で観察されたものと類似していた(Dey er al)。 IVM治療を受けたハムスターの肺で観察されたトランスクリプトームプロファイルは、非治療の感染ハムスターと比較して、顕著な性差を示した。IVM治療を受けた雌の肺では、1206個のダウンレギュレートされた遺伝子と1428個のアップレギュレートされた遺伝子が検出されたのに対し、IVM治療を受けた雄の肺では、36個のダウンレギュレートされた遺伝子と51個のアップレギュレートされた遺伝子しか検出されなかった。この性差は、KEGGとGOのエンリッチメント表示でも示されている(図EV4)。 迷走神経のコリン性抗炎症経路(CAP)の活性化に関連する「TNFシグナル伝達経路」と「コリン性シナプス」(De Virgiliis & Di Giovanni, 2020, Pavlov & Tracey, 2012)血栓症の予防に関連する「血小板活性化」(Chen & Pan, 2021, Zhang et al, また、肺の恒常性と再生(Raslan & Yoon, 2020)肥満、2型糖尿病、がん(Aamir et al 2020, Melotti et al 2014)との相関が示されている「Wntシグナル伝達経路」のKEGG経路の変調もIVM治療群で観察された(図2a;図EV4a)。さらに、IVM投与したメスのハムスターでは、「レニン分泌」、「血管平滑筋収縮」、「心筋細胞のアドレナリンシグナル」などの経路が調節されており、これらは血管収縮の防止、ひいては肺の病理の減衰に関係していると考えられる(図EV4a)(Potus et al 2020,Vaduganathan et al 2020)。さらに、炭水化物代謝とインスリン抵抗性は、SARS-CoV-2感染時の雌のハムスターの肺のRNAseq分析で観察された頻出用語であり、高血糖、メタボリックシンドローム、免疫系の障害と関連しており、ヒトのCOVID-19でも同様に観察された(Gianchandani et al 2020, Pavlov & Tracey, 2012)。IVMを投与したハムスター、特にメスでは、KEGGエンリッチメントで「インスリン抵抗性」という用語が観察されなくなり、インスリン分泌経路がダウンレギュレートされたという。 高血糖、炎症、肺の病理を結びつける他のいくつかの関連経路、例えばRap1,AGE-RAGE、cGMP-PKGシグナル伝達経路がダウンレギュレートされた(図EV4-5)(Isidori et al 2021年、Oczypok et al 2017,Pei et al 2020)。IVM治療を受けた男性では、KEGGとGOの濃縮によって決定された有意な変調パスウェイは、タイトジャンクション、筋肉細胞、上皮細胞に関連していた(図EV4)。
さらに、IVM治療を受けた女性のGOエンリッチメントでは、「神経伝達物質分泌の調節」を含む重要な調節経路が明らかになった(図EV4b)。いくつかの重要な神経伝達物質受容体は、IVM治療を受けた男性と女性の両方で、コリン性ニコチン受容体(Chrnb4)アドレナリン受容体(Adra1d)GABA受容体(Gabbr1)グルタミン酸受容体(Grin2d/Nmdar2d, Grid1)など、実際にダウンレギュレートされており、後者はグルタミン酸誘発肺損傷の保護に関係している可能性がある(Said, 1999, Zhe er al)。
IVMは、SARS-CoV-2感染ハムスターの肺において、I型およびIII型IFN関連遺伝子を強く制御し、Il-6/Il-10比を低下させる。
IVM治療を受けた動物で変化した遺伝子をさらに詳しく分析するために、これらの関連経路の中からIVM治療を受けたメスで高度に制御されていた代表的な標的遺伝子を選び、異なるグループの動物の肺でのそれぞれの転写レベルをRT-qPCRで比較した。これらの遺伝子のうち、Tnfaip3,Sfrp4,Epha2,Gnai1,Hgf、Fosなどのいくつかの遺伝子は、IVMと生理食塩水で処理された感染者の間で有意に変化していた。また、女性に比べて男性では同様の変化が見られた(KEGGおよびGOエンリッチメントより)が、その変化は常に有意ではなかった。Casp3, Plcb1, Chrna7, Chrnb4, Adra1d, Grin2d/Nmdar2d, Grid1, Gabrr1, Pik3r5, Igf1r, Wnt11, Wnt3a, Il-2, Il-2ra, Prkg1, Krt4, Creb5, Ager。これらのターゲットの調節は、文献e(Boudewijns et al 2020, Hoagland et al 2020)から引用した関連する炎症メディエーターの他の遺伝子(Il-6, Il-10, Il-1 , Tnf- , Ifn- , Ifn- , Tgf- , Cxcl10, Ccl5, Mx2)とともに、RT-qPCRによって確認された(Fig 2b, Fig EV5)。
IVMは、Ifn-(男性と女性)、Ifn-(女性)およびIFN刺激遺伝子Mx2(男性と女性)の発現を制限した。
感染したハムスターの肺では、生理食塩水で処理したハムスターと比較して、IFN刺激遺伝子Mx2(男性と女性)の発現が抑制された。
ハムスター 一方、生理食塩水で処理したハムスターでは、非感染のハムスター(雄、雌)に比べて、Ifn- 、Ifn- 、Mx2 の発現が増加していた。これは、I型およびIII型IFNシグナル経路が、SARS-CoV-2感染ハムスターの肺の病理学的重症度と相関することがすでに示されており、おそらくSTAT2依存性の反応に起因するものと予想される(Boudewijns et al 2020)。対照的に、I型およびIII型IFNは鼻濁液で異なる発現をしており、治療を受けた雄ではIfn-がアップレギュレートされている(図1f)。この上気道と下気道の違いは、2つの要因で説明できる。i)鼻腔の抗ウイルス反応におけるIfn-の特異性(Klinkhammer et al 2018,Okabayashi et al 2011年)一方、I型およびIII型IFNは肺で冗長な作用を行う(Stanifer et al 2011年。2020)そして(ii)A型インフルエンザウイルスを用いた研究によると、I型およびIII型IFNは順次活性化し、Ifn-が先に来て感染と戦い、I型IFNが後に来て炎症促進作用と抗ウイルス作用を強化する(Galani et al 2017,Stanifer et al 2020)。
興味深いことに、これらの遺伝子の中には、先に述べた経路に関与するだけでなく、SARS-CoV-2感染症の病態やハムスターにおけるIVM治療の有効性に重要と思われる他の分子機能にも大きな役割を果たしているものがある。中でも、Il-10の顕著な過剰発現は、IVM治療を受けたオスとメスに共通する特徴であった(Fig 2b)。この効果は、臨床症状の軽減に伴う肺の炎症反応の調節(雄ではTnf-、雌ではTnfaip3,雌ではIl-6の抑制)と関連していると考えられる。Tnf-の減少と臨床症状の改善は、マウスにMHVを感染させた別のコロナウイルス感染モデルにおいて、IVM治療が引き起こす共通の特徴である(Arévalo et al 2021)。さらに、鼻濁液とは異なり、IVM治療を受けたハムスターの肺におけるIl-6/Il-10比は、非治療動物に比べて有意に低かった(図
肺のIl-6/Il-10比が有意に低く(Fig 2b)これはハムスターの臨床症状が比較的良好であることと関連していると考えられる。注目すべきは、集中治療を必要としなかった入院中のCOVID-19患者において、より低い形質のIl-6/Il-10比が検出されたことである(McElvaney et al 2020a、McElvaney et al 2020b)。
IVMは、単球/マクロファージの浸潤を増加させ、M2偏向を促進する。
SARS-CoV-2に感染したハムスター
感染動物の肺の病理を直接評価するために、病理組織学的分析を行った。
SARS-CoV-2に感染したハムスターと生理食塩水を投与したハムスターの肺には、浮腫、うっ血などの局所的な病変が見られた。
単核細胞、ヒアルロン酸膜、肺胞壁の肥厚を伴う浮腫、うっ血、微小出血が認められた(図3a)。これまでの報告(Chan er al)。 一方、SARS-CoV-2感染ハムスターとIVM投与ハムスターの肺では、浮腫や鬱血の程度は軽減されていたが、肺胞腔内の単核細胞の量が多かった(Fig 3a)。SARS-CoV-2感染では、肺重量/体重比が増加したが、IVM投与群では生理食塩水投与群に比べてその増加が抑えられていた(Fig 3e)。
IVM投与動物で観察された良好な臨床症状は、迷走神経の制御下でコリン性抗炎症経路(CAP)が活性化されたことと関連している可能性がある(Pavlov & Tracey, 2012)。実際、IVMとマクロファージの-7 nAChRとの相互作用は、IVM投与したハムスターにおける免疫応答の変調を説明している可能性があり(Gahring et al 2017,Zhao et al 2019年)Il- 10産生を誘発し、M2極性化を促進し(炎症を減衰させ、組織修復を誘発する)M1作用(炎症促進、組織損傷と微生物殺傷活性に関連する)を相殺する(Sang et al 2015)。この解釈は、他のウイルス感染症で観察されたのと同様に、Il-6,Tnf、Cxcl10などの主要なM1炎症性メディエーターの減少とともに、IVM処理した動物の肺で観察されたIl-10のアップレギュレーションによって裏付けられている(Sang er al)。 模擬感染動物ではIba1+細胞がほとんど観察されなかったが、IVM投与動物の肺では多数のIba1+ミエロイド細胞が観察された(図3b)。好中球(Ly-6G+)については、生理食塩水投与群とIVM投与群の間に明確な違いは見られなかった(Fig 3b)。これらのIba1+細胞の一部は、M2極性マクロファージのマーカーであるArg1+細胞でもあった(Fig 3b)。IVMを投与すると、SARS-CoV-2に感染した雄ハムスターの肺では、Iba1+細胞とArg1+細胞の両方が増加した(図3c)。一方、雌では、感染によりIba1+細胞とArg1+細胞の両方が増加したが(図3c)IVMはこれらの細胞のリクルートに影響を及ぼさなかった。さらに、肺のRNAseq解析では、M2関連遺伝子(Arg1,Cd209a/DC-SIGN、Clec7a/Dectin-1,Myc/c-Myc)と、古典的なM1マーカー(Cd86,Cd38)の発現が確認され(図3d)IVM処理によるM2極性化傾向をさらに裏付ける結果となった。
結論
我々の結果は、IVMがSARS-CoV-2感染動物の臨床転帰を改善し、炎症状態の低下と関連していることを示しているが、上下気道におけるSARS-CoV-2の負荷には影響を与えていない。このように、ハムスターでは、ヒトと同様に(Cereda et al 2020,Hasanoglu et al 2021年)症状、ひいてはSARS-CoV-2感染の重症度は、ウイルス負荷と厳密には相関していない。肺におけるIVMの主な効果は、I型およびIII型IFN応答、および重要な治療標的であるホスホリパーゼ、キナーゼ、アデニル酸シクラーゼを含む他の関連するシグナル伝達エピパスウェイに対するものであり(Hu et al 2020,Isidori et al 2021年、Li et al 2020,Masood et al 2020,Melotti et al 2014,Raker et al 2016年)これは臨床的には臨床スコアの改善につながる。
ここに示された結果は、ハムスターにおけるSARS-CoV-2関連肺疾患の病因におけるI型およびIII型IFN応答の役割と一致する。それらは、I型IFN経路の欠陥が重篤なCOVID-19に関連しているにもかかわらず、IVM投与がIFN応答および肺の炎症を制限することを示している(Bastard et al 2020,Zhang et al 2020a)。この結果は、IFNシグナルはウイルスの複製を制御して重症化を防ぐために重要であるが、中等度の疾患しか発症しない感染ハムスターでは、IFNシグナルは実際に組織の損傷や無嗅覚症などの関連徴候を増加させる可能性があることを示唆していると考えられる。これは、IFN経路を阻害すると、ウイルスの複製は増加するが、肺の病理は低下することが示された動物モデルでの以前の報告と一致する(Boudewijns et al 2020,Sun et al 2020)。
観察された効果が、COVID-19に対するデキサメタゾン(Horby et al 2020)やトシリズマブ(抗IL-6)(Rossotti et al 2020)の影響とある程度類似している可能性があるとしても、IVMの作用はゴールデンハムスターでは安定して強く、炎症のエフェクターをブロックするのではなく、むしろ炎症の開始を弱めることが期待される。興味深いことに、低線量放射線治療(LDRT)による核因子赤血球2関連転写因子(Nrf2)の活性化は、M1マクロファージからM2マクロファージへのシフトとNLRP3インフラマソームの遮断を引き起こすことが提案されており(Calabrese et al 2021年)COVID-19患者の肺に有益である可能性がある。これは、SARS-CoV-2感染時におけるIVMの広範かつ上流の活性を示す新たな証拠である。さらに、これらの効果は区分けされており、ハムスターの上気道と下気道ではIVM治療に対する反応が異なることが分かった。
ハムスターの肺における臨床症状、炎症プロファイル、トランスクリプトーム・シグネチャーにはかなりの性差が見られ、COVID-19のヒト患者に見られるように、男性は女性よりも重篤な疾患を発症する傾向がある(Jin er al)。
アンドロゲンシグナルに関連している可能性がある(Samuel et al 2020,Scully et al 2020,vom Steeg & Klein 2019)。興味深いことに、性ステロイド、つまり女性ホルモンも、ハムスターのCOVID-19の経過とIVMの効果の両方に影響を与える可能性があり、おそらく、nAChhなどの女性の細胞受容体のシグナル伝達が増強されることが原因と考えられる。
nAChRs(Cross et al 2017,Krause et al 1998)やGlyRs(Cerdan et al 2020,Van Den Eynden et al 2009)などの女性の細胞受容体のシグナル伝達が増強されるためと考えられる。Eynden et al 2009)のような、IVMが正のアロステリックモジュレーターであることを示している。
さらに、ここで示されたデータは、IVMを用いたヒト臨床試験で報告されたデータと一致している(Kory et al 2021)。ヒトでは、IVMは、我々のハムスター実験で使用された範囲の治療用量(150〜400μg/kg)で、抗蠕虫薬および抗疥癬薬として広く使用されている(Guzzo er al 2002)。さらに、IVMを用いたCOVID-19に関するいくつかの臨床試験が宣言されており、IVMは炎症マーカーと疾患の重症度の低下に関連している(Hill et al 2021年、Kaur et al 2021)。興味深いことに、疥癬の発生を抑制するために入居者がIVMを受けた長期介護施設では、死亡や重度のCOVID-19は観察されなかった(Bernigaud et al 2021)。IVMはすでに入院中のCOVID-19患者にも投与されているが、対照的な結果となっている。ある研究では、他の薬剤(ヒドロキシクロロキン、アジスロマイシン、トシリズマブ、ステロイド)との併用療法を受けている重症COVID-19患者において、遅めのIVM投与(症状が出てから8~18日後)では有効性が認められないと報告している(Camprubí et al, 2020)一方、別の研究では、他の治療法(ヒドロキシクロロキン、アジスロマイシン、またはその両方)に加えてIVM治療を受けた重症のCOVID-19患者において、特に死亡率が低いことが報告されている(Rajter er al 2020)。
重要なのは、発症から72時間以内にIVMを単独で投与した研究では、著者らは、IVM群とプラセボ群の間でPCR陽性率に差がなく、IVM群で無嗅覚/低嗅覚が重要に減少したことに気づいたことである(Chaccour et al 2021)。
現在入手可能なデータは、投与経路、剤形、体調などのいくつかの条件がこれらの特徴を変更する可能性があるとしても、IVMの薬物動態は種を超えて極めて安定しており、一般的に吸収が遅く、分布が広く、代謝が低く、排泄が遅いという見解を支持している。ヒトでは,経口投与が唯一認められており,IVM 30mg(347~594µg/kgに相当)を単回投与すると,Cmax(最高濃度)84.8ng/mL,tmax(Cmaxに到達する時間)4.3時間,半減期20.1時間となる(Guzzoら,2002)。動物モデルでは、皮下投与が最もよく用いられており、比較的、(本試験と同様に)IVM 400 µg/kgを皮下投与されたゴールデンハムスターでは、Cmaxが80.2 ng/mL、tmaxが~4時間と同等の結果が得られた(Hanafi er al)。 さらに、獣医学的データ(Lifschitz et al 2000)に基づいて、最小生理学的薬物動態(mPBPK)モデルを用いたシミュレーションを行ったところ、肺は血漿中に見られる濃度の2.7倍のIVM濃度にさらされることが明らかになった(Jermain et al 2020)。しかし、この用量では、試験管内試験で報告された抗ウイルス濃度の範囲を達成するのに十分ではなかった(Caly et al 2020)。
その結果、ゴールデンハムスターモデルで観察された結果を考慮すると、IVMはCOVID-19に対する治療薬として考えられる。IVMは、SARS-CoV-2の複製には強く影響しないが、I型およびIII型IFN応答および他のいくつかの関連するシグナル伝達経路によって潜在的に媒介され、肺における好ましいM1/M2ミエロイド細胞比を有する、生体内試験での感染の病態生理学的結果を制限するであろう。IVM治療を受けたハムスターでは、下気道における免疫反応の特徴的な変調が観察され、そのトランスクリプトームプロファイルは、症状が重くなく、予後も良好なチュマンで観察されたものと類似していた(Masood et al 2020,McElvaney et al 2020b)。我々のデータは、この効果が迷走神経反射に対するIVMのコリン性抗ピン炎症作用によって媒介されるという仮説と一致しているが(Changeux er al)。 特に、IVMの作用におけるnAChRの正確な寄与を、他の可能なIVM標的の寄与と比較して解明する必要がある(Zemkova er al)。
総合すると、本研究は、IVMに基づく免疫調整療法がSARS-CoV-2感染ハムスターの臨床状態を改善し、臨床試験では、抗炎症作用により、ヒトのCOVID-19症状を緩和し、COVID-19後症候群(Long-COVIDとも呼ばれる)を制限できる可能性があるという概念を証明した。
材料と方法
倫理。すべての動物実験は、フランスの法律に基づき、欧州共同体理事会指令(2010/63/UE、フランス法2013-118,2013年2月6日)を遵守し、パスツール研究所の動物管理委員会の規定に従って実施された。動物実験委員会
Institut Pasteurの倫理委員会(CETEA 89)は,実験を開始する前にこの研究を承認した(200023; APAFIS#25326-2020050617114340 v2).ハムスターは4匹ずつのグループでアイソレーターに収容し,生きたげっ歯類の実験を行うためにフランス農業省から認定されたパスツール研究所の動物施設内のクラスIII安全キャビネットで操作した。すべての動物は、動物の適正な取り扱いを厳守した。
SARS-CoV-2ウイルスの製造と滴定。単離されたBetaCoV/France/IDF00372/2020(EVAgコレクション、Ref-SKU: 014V-03890)は、Sylvie Van der Werfから親切に提供された。ウイルスストックは、1×10-4 PFU(plaque-forming units)の感染多重度で感染させたVero-E6細胞上で作製した。感染後3日目にウイルスを採取し、清澄化した後、分注して-80℃で保存した。ウイルスストックは、半固体オーバーレイ(Avicel, RC581-NFDR080I, DuPont)を用いた古典的なプラークアッセイにより、Vero-E6細胞上で滴定した(Baer & Kehn-Hall, 2014)。
SARS-CoV-2モデルとハムスターのイベルメクチン処理。 生後5〜6週間のオスとメスのシリアン・ハムスターd(Mesocricetus auratus; RjHan:AURA)をJanvier Laboratoriesから購入し、特定の病原体を含まない条件で扱った。動物はバイオセーフティーレベル3の施設内のアイソレーターに収容され、水と餌を自由に摂取できる状態で操作された。
動物は、200mg/kgのケタミン(Imalgène 1000,Merial社)および10mg/kgのキシラジン(Rompun,Bayer社)を腹腔内に注射して麻酔し、古典的な抗寄生虫用量である400μg/kg(Becoら,2001)(または用量反応実験では100〜200μg/kg)のイベルメクチン(I8898,Sigma-Aldrich社)を200μLポフレシュに希釈して皮下に1回注射した。非処置の動物には,200µLの生理的溶液を1回だけ皮下注射した。100µLの生理的溶液
6×104 PFUのSARS-CoV-2を含む100μLの生理食塩水を各動物に鼻腔内投与した(50μL/鼻孔)模擬感染させた動物には生理的溶液のみを投与した。
感染動物と模擬感染動物を別々のアイソレーターに収容し、すべてのハムスターを4日間毎日追跡調査して、体重と臨床スコアを記録した。クリニカルスコアは、毛並みが乱れている、動きが鈍い、無気力、探索活動がないなど,0〜4の累積スコアで評価した。
感染後3日目(dpi)に、動物は、以前に説明したように、嗅覚を評価するための食物探索試験を受けた(de Melo et al 2021年、Lazarini et al 2012)。試験の24時間前にハムスターを絶食させた後、清潔な標準寝具を敷いた新鮮なケージ(37×29×18cm)に10分間個別に入れた。その後、ハムスターを別の同様のケージに2分間入れ、その際、試験ケージの隅にある1.5cmの寝具の中に約5個のシリアルを隠した。その後、テストしたハムスターを
餌を見つけるまでの待ち時間(シリアルを見つけて掘り始めるまでの時間)をクロノメーターで記録した。試験は15分間にわたって行われた。餌が見つかるとすぐにハムスターをケージから取り出した。1分後、ハムスターは同じテストを行ったが、寝床の上に置かれたチョコレートシリアルが見える状態で行った。これらの試験は、バイオセーフティーレベル3の施設内にあるアイソレーターで実施した。
4dpiにおいて、動物を過剰な麻酔薬(ケタミンおよびキシラジン)および血抜きで安楽死させ(AVMA 2020)鼻の鼻甲介および肺のサンプルを採取し、直ちに-80℃で凍結した。また、肺の断片を採取し、10%中性緩衝ホルマリンで固定した。
ゴールデンハムスターの組織からのRNA単離と定量的PCRによる転写分析。凍結した組織をTrizol (15596026, Invitrogen) を用いてLysing Matrix D 2 mLチューブ (116913100, MP Biomedicals) に入れ、FastPrep-24™ システム (MP Biomedicals) を用いて6.5 m/sの速度で1分間かけてホモジナイズした。Direct-zol RNA MicroPrep Kit (R2062, Zymo Research: nasal turbinates) または MiniPrep Kit (R2052, Zymo Research: lung) を用いて Total RNA を抽出し,SuperScript™ IV VILO™ Master Mix (11766050, Invitrogen) を用いて第一鎖 cDNA に逆転写した。qPCRは、サーモサイクラー(QuantStudio 6 Flex, Applied Biosystems)を用いて、384ウェルPCRプレートで1反応あたり10μLの最終容量で行った。簡単に言うと、e2.5μLのcDNA(12.5ng)を、5μLのPower SYBR green mix(4367659,Applied Biosystems)と2.5μLの無核水を含むマスターミックス7.5μLに、nCoV_IP2プライマー(nCoV_IP2-t12669Fw: 5′-ATGAGCTTAGTCCTGTTG-3′;nCoV_IP2-12759Rv:5′-CTCCCTTTGTTGTTGT-3’)を最終濃度1μM(WHO, 2020)で添加した。) 増幅条件は以下の通りであった。増幅条件は、95℃で10分、95℃で15秒、60℃で1分の45サイクル、その後、60℃から95℃までの溶融曲線とした。ハムスター組織のウイルス負荷量の定量は,RdRp配列を含む8つの既知量のプラスミド(107〜100コピーの範囲)の標準曲線を用いた線形回帰によって評価した。検出の閾値は、200ウイルスコピー/μgのRNAとして設定した。ゴールデンハムスターの遺伝子ターゲットは、Hprt(ヒポキサンチンcphosphoribosyltransferase)アクチンおよび/またはactinB遺伝子を参照として、組織中の宿主の炎症性メディエーター転写物を定量するために選択された(付録表S1)。遺伝子発現の変化は、2-Ct法(Pfaffl, 2001)を用いて、感染していないハムスターの組織と比較して、感染したハムスターの組織における発現のn倍の変化として算出した。
ドロプレットデジタルPCR(ddPCR)。逆転写:200ngのRNAを、iScript Advanced cDNA Synthesis kit for RT-qPCR(1702537,Bio-Rad)を用いて、製造者の仕様に従って逆転写した。アクチンおよびHprt参照遺伝子の定量的PCR。リアルタイムPCRは、CFX96 qPCRマシン(Bio-Rad)で行った。すべてのサンプルは二重に測定した。10μLのPCR反応には,0.8ngのcDNA,1×PowerUp PCRマスターミックス(A25742,Applied Biosystems),0.5μMの各プライマー(付表S1)を含んだ。反応物は96ウェル光学プレート中で,95℃で2分間インキュベートした後,95℃で15秒,60℃で1分間のサイクルを40回繰り返した。Droplet Digital PCR:ddPCR反応は,QX200 Droplet Digital PCRシステムを用いて,製造者の指示に従って行った(Bio-Rad社)。簡単に説明すると、反応混合物は、10μLのddPCR Supermix for probe no dUTP(1863023,Bio-Rad),0.25〜1ngのcDNA、付表S2に記載された濃度で使用したE/IP4およびN/nsp13二重反応用のプライマーおよびプローブを、最終容量20μLで構成した。PCR増幅は、iCycler PCR装置(Bio-Rad社製)を用いて、95℃で10分、94℃で30秒(2°/sのランプを使用)59℃で1分(2°/sのランプを使用)98℃で5分(2°/sのランプを使用)4℃での保持を40サイクル行った。増幅後,96ウェルプレートをQX200ドロップレットリーダー(Bio-Rad)にセットし,個々のドロップレットの蛍光強度を自動的に測定した。生成されたデータは、QuantaSoft™ソフトウェア(Bio-Rad)を用いて、陽性および陰性の飛沫集団に基づいて分析された。データは、アクチンおよびHprt参照遺伝子の相対的な発現量で正規化したCPD(copy per droplets)で表した。
ゴールデンハムスターの肺におけるウイルスの滴定。凍結した肺の断片を重量測定し、FastPrep-24™システム(MP Biomedicals)を用いて、1%ペニシリン/ストレプトマイシン(15140148, Thermo Fisher)を添加した氷冷したDMEM 1mLをLysing tMatrix M 2mLチューブ(116923050-CF, MP Biomedicals)に入れてホモジナイズし、以下のスキームで行った:4. 0 m/sで20秒間のホモジナイズ、4℃で2分間のインキュベーション、4.0 m/sで20秒間の新たなホモジナイズを行った。チューブを4℃で1分間、10.000×gで遠心分離し、上清を半固体のオーバーレイ(Avicel, RC)を用いた古典的なプラークアッセイでVero-E6細胞に滴定した。
オーバーレイ(Avicel, RC581-NFDR080I, DuPont)を用いた古典的なプラークアッセイによってVero-E6細胞上で滴定した(Baer & Kehn-Hall, 2014)。
ゴールデンハムスターの肺におけるトランスクリプトーム解析。RNA調製は、製造者の指示に従ってストランド特異的なcsingle end cDNAライブラリを構築するために使用した(Truseq Stranded mRNA sample prep kit, Illumina)。ライブラリーのシーケンスにはIllumina NextSeq 500 sequencerを使用した。RNA-seq解析は、Sequanaフレームワークを用いてcperformedした(Cokelaer er al)。 オンラインで入手可能なRNA-seqパイプライン(v0.9.16)を使用した(https://github.com/sequana/sequana_rnaseq)。これはSnakemake 5.8.1 A(Köster & Rahmann, 2012)の上に構築されている。Cutadapt 2.10 (Martin, 2011)を用いてアダプターからリードを切り出し、STAR 2.7.3a (Dobin et al 2012)を用いてEnsemblのゴールデンハムスターMesAur1.0ゲノムアセンブリーにマッピングした。FeatureCounts 2.0.0 (Liao et al 2014) を用いてカウントマトリックスを作成し、鎖特異性情報を含むアノテーション MesAur1.0.100 を用いてリードをフィーチャーに割り当てた。品質管理統計は、MultiQC 1.8(Ewels er al 2016)を用いてまとめた。カウントマトリックスの統計解析を行い、全サンプルを考慮して感染サンプルと非感染サンプルを比較し、性別で分けて、差動的に制御される遺伝子を特定した。トランスクリプトームプロファイルのクラスタリングは、主成分分析(PCA)を用いて評価した。差次的発現試験は、SARTools 1.7.0(Varet er al 2016)に基づくDESeq2ライブラリ1.24.0(Love er al 2014)スクリプトを用いて実施し、各比較の有意性(Benjamini-Hochberg調整済みp値、偽発見率FDR<0.05)および効果サイズ(fold-change)を示した。最後に、Sequana社のモジュールを用いて、まずゴールデンハムスターのensemblのidを遺伝子名に変換し、次にGO用語とKEGGパスウェイのヒューマンアノテーションを用いて、エンリッチメント解析を行った。GOエンリッチメントモジュールはPantherDB(Mi et al 2019)とQuickGO(Huntley et al 2014)サービスを使用し、KEGGパスウェイエンリッチメントはgseapy(https://github.com/zqfang/GSEApy/)EnrichR(Chen et al 2013)KEGG(Kanehisa & Goto, 2000)BioMartサービスを使用している。オンラインウェブサービスへのプログラム的なアクセスはすべてBioServices (Cokelaer et al 2013)を介して行った。
病理組織学。10%中性緩衝ホルマリンで固定した肺断片をパラフィンに包埋した。4µmの厚さの切片を切り、ヘマトキシリン・エオジン染色を行った。その後、Axioscan Z1 Zeissスライドスキャナーを用いて、Zen 2 blue editionソフトウェアを使用してスライドをスキャンした。
免疫蛍光。10%中性緩衝ホルマリンで固定した肺断片をPBSで洗浄した後、O.C.T.コンパウンド(4583, Tissue-Tek)で包埋し、ドライアイス上で凍結し、クライオスタットで20μm厚の切片にした。切片をPBSでリンスし、96℃のクエン酸緩衝液pH6.0(C-9999, Sigma-Aldrich)で20分間インキュベートしてエピトープ・リトリーバルを行った。その後、10%ヤギ血清、4%ウシ胎児血清,0.4% Triton X-100を添加したPBSで2時間ブロックした。 その後、10%ヤギ血清、4%ウシ胎児血清,0.4%トリトンX-100を添加したPBSで室温で2時間ブロックし、一次抗体(ラット抗Ly6G(1/100,551459,BD-Biosciences社)ニワトリ抗Iba1(1/500,234006,Synaptic Systems社)ウサギ抗Arg1(1/250,PA5-29645,Invitrogen社)ウサギ抗SARS-CoVヌクレオプロテイン(1/500,パリのパスツール研究所のNicolas Escriou博士より提供)を用いて4℃で一晩インキュベートした。リンス後、スライドを適切な二次抗体とインキュベートした。
(1/500: ヤギ抗ヤギAlexa Fluor 546, A11081, Invitrogen; ヤギ抗ウサギAlexa Fluor 488, A11034, cInvitrogen; ヤギ抗ニワトリAlexa Fluor 647, A32933, Invitrogen)と室温で2時間インキュベートした。すべての切片をHoechst (H3570, Invitrogen)でカウンターステインした後、PBSで十分に洗浄し、Fluoromount-G (15586276, Invitrogen)でAmountしてから、Plan Apochromat 20x/0.8 Ph2 M27レンズを介してZeiss LM 710倒立共焦点顕微鏡で観察した。細胞の定量化は、ImageJを用いて自動で行った。シングルチャンネル画像を抽出し、閾値を設定し、2値画像に変換した。その後、P s Analyzer ImageJプラグインを用いて細胞をカウントした。 統計。統計解析は、Prismソフトウェア(GraphPad, version 9.0.0, San Diego, USA)を用いて行い、p < 0.05を有意とした。量的データは,Log-rank検定または両側Mann-Whitney検定を用いて,グループ間で比較した。無作為化および盲検化は、事前に定義された収容条件(感染動物と非感染動物の間でアイソレーターを分離)のために不可能であった。Ex vivo解析は盲検化された(コード化されたサンプル)。すべての動物を対象とし,データは2回の再現で提供されたが,雄の食物探索は3回再現された。
利益相反
競合する利害関係はない。
データの公開
本研究で作成したデータセットは,以下のデータベースで公開している。RNA-Seq: ArrayExpress E-MTAB-10128 (www.ebi.ac.uk/arrayexpress/experiments/E-MTAB-10128/).
追加情報
本論文のために、Expanded Viewデータが用意されている。
論文の説明
問題点
現在のCOVID-19のパンデミックは 2019年12月以降、全世界で350万人以上の死亡者と1億5000万人以上の実験室確認症例を引き起こしている(2021年5月現在)。COVID-19の原因SARS-CoV-2は、一般的に上気道や肺の症状をもたらし、重症の場合は呼吸困難に陥り死に至ることもある。この病気と戦うために様々な治療法が提案されているが、包括的な治療研究はまだ不足している。
結果
イベルメクチンを標準的な抗寄生虫量である400 µg/kgで使用することにより、SARS-CoV-2感染時の臨床症状の発現および嗅覚の喪失から感染ハムスターを保護することができたことを報告する。投与されたハムスターは、特異的な炎症反応を示し、I/III型インターフェロン刺激の低下と、いくつかの細胞内シグナル伝達経路の変調を示し、Il-6/Il-10比の重要な低下と、肺にリクルートされた骨髄系細胞のM2偏向を促進した。これらの効果は性別によって大きく異なり、治療を受けた女性が最も良い結果を示した。驚くべきことに、イベルメクチンを投与してもウイルスの複製は制限されず、投与した動物と非投与の動物では同程度の量のウイルスが検出された。
影響
本研究の結果は、ウイルス量にかかわらず、SARS-CoV-2の症状と重症度は、SARS-CoV-2の症状と重症度と同じであることを証明している。
COVID-19の症状と重症度は、宿主の炎症反応がCOVID-19の重症度に重要な役割を果たしていることが明らかになった。
I/III型インターフェロン、Il-6/Il-10の減少、M2マクロファージの存在が、より良好な臨床症状をもたらす可能性があることを強調した。
イベルメクチンはCOVID-19の治療薬の治療薬として有望であると考えられる。SARS-CoV-2の複製には影響を与えないが、炎症とそれに伴う症状を緩和する。