Contents
Antiviral effect of high-dose ivermectin in adults with COVID-19: A proof-of-concept randomized trial
www.thelancet.com/journals/eclinm/article/PIIS2589-5370(21)00239-X/fulltext
研究論文| 第37巻, 100959, 2021年7月1日
概要
背景
COVID-19患者の治療には,限られた抗ウイルス剤が使用されている。幅広い抗寄生虫スペクトルを持つ大環状ラクトンであるイベルメクチン(IVM)は,試験管内試験でSARS-CoV-2に対して強力な活性を示した。本研究では,呼吸器分泌物中のウイルス量に対するIVMの抗ウイルス効果と,血漿中の薬物濃度との関係を評価することを目的とした。
試験方法
アルゼンチンの4つの病院で、COVID-19の入院患者45名を対象に、標準治療に加えて0~6mg/kg/dayのIVMを5日間経口投与する群と標準治療を行う群に2:1の割合で無作為に割り付け、高用量IVMの抗ウイルス活性を評価する概念実証、パイロット、無作為化、対照、アウトカム評価者による盲検試験を実施した。対象となったのは、症状が出てから5日以内にRT-PCRでSARS-CoV-2感染が確認された成人患者。主要評価項目は,定量的RT-PCR法によるベースライン時と5日目の呼吸器分泌物中のウイルス量の差とした。また,血漿中のIVM濃度を測定した。ClinicalTrials.govに登録された試験。NCT04381884。
調査結果
2020年5月18日~9月9日に45名の参加者を募集した(IVM投与30名、対照15名)。グループ間でウイルス負荷の減少に差はなかったが、血漿中IVM濃度の中央値が高い患者(72% IQR 59-77)と未治療の対照者(42% IQR 31-73)では有意な差が認められた(p = 0-004)。イベルメクチンの平均血漿濃度レベルは,ウイルスの減衰率と相関していた(r:0-47,p=0-02)。有害事象は各群間で同様であった。7日目および30日目の臨床経過には,各群間で差は認められなかった。
解釈
高用量のIVMを経口投与することにより、濃度依存的な抗ウイルス活性が、忍容性の高い投与法で確認された。COVID-19におけるIVMの臨床的有用性を判断するためには、臨床的エンドポイントを伴う大規模試験が必要である。
資金調達
本研究は,Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación(アルゼンチン)およびLaboratorio ELEA/Phoenix(アルゼンチン)の助成金IP-COVID-19-625によって支援された。
研究の背景
本研究以前のエビデンス
SARS-CoV-2に対するイベルメクチンの潜在的な役割については 2020年4月にオーストラリアのグループが体外調査の結果を発表して初めて報告された。それ以降、複数の意見書と少数の研究が、COVID-19におけるこれらの結果の意味とイベルメクチンの有用性を理解しようとした。ほとんどの観察報告は、ランダム化比較試験による確認が必要な潜在的な活性を示唆している。
本研究の付加価値
本研究は、COVID-19患者におけるSARS-CoV-2に対するイベルメクチンの抗ウイルス活性の証拠を、無作為化、対照、アウトカム評価者盲検臨床試験により示したものであり、定量的なウイルス負荷測定やイベルメクチン血漿濃度の測定などの革新的な分析を行うことで、データの詳細な解釈と有意な抗ウイルス効果に必要なイベルメクチン全身濃度の特定を可能にしている。未治療の対照群を用いたことで、対照試験の必要性とCOVID-19の自然史におけるウイルス量の動態について強調している。最後に、高用量イベルメクチンの安全性に関する情報を追加した。
入手可能なすべての証拠の意味するところ
COVID-19では、イベルメクチンの濃度依存的な抗ウイルス効果が確認され、全身のイベルメクチン濃度が高くなった患者の呼吸器分泌物中のSARS-CoV-2ウイルス量が、未治療の対照と比較して有意に減少した。高用量イベルメクチンの使用に関連した毒性を示さなかったこれらの結果は、抗ウイルス効果の証拠となり、我々の発見の臨床的意味を調査するための試験デザインを支持するものである。また、イベルメクチンの経口バイオアベイラビリティに関与する因子のさらなる調査も必要である。
1. はじめに
2019年12月に武漢で新規コロナウイルスである重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)が出現し、COVID-19を引き起こすパンデミックが世界規模で広がり 2020年末までに8,500万人以上の報告症例と170万人以上の死亡者が発生したことにより、この潜在的に壊滅的な急性呼吸器感染症の結果を治療、予防、緩和するための薬理学的介入の探索が求められている。いくつかの治療薬が、さまざまな疾患の段階で、抗ウイルス治療の可能性として評価されていたが、その多くは、すでに他の治療法で使用されている有効成分の再利用戦略の一環として行われた。ヒドロキシクロロキン、ロピナビル、レムデシビルなどの分子は、試験管内試験でSARS-CoV-2に対する抗ウイルス活性を示しているが、無作為化比較臨床試験では、入院患者の一部のグループでレムデシビルの静注が臨床的に有効であることが示されただけである[[1]]。
イベルメクチン(IVM)は広く使用されている抗寄生虫薬で、オンコセルカ症とリンパ系フィラリア症の治療のために、メクティザン寄贈プログラムを通じて2019年には9億錠以上が配布されている[[2]]。さらに最近では、デング熱、ジカ熱、インフルエンザなどのいくつかのウイルス感染症が、おそらく宿主に基づくメカニズムによって試験管内試験で感受性を持つことが示された[[3]]。SARS-CoV-2に対しては、高濃度のIVMを用いてVero-hSLAM細胞培養で強力な活性が報告されている[[4]]。SARS-CoV-2のウイルス動態を後天性免疫反応と組み合わせたモデルを用いて、投与時期と投与レジメンの動的影響を検討したところ、イベルメクチンの最も顕著な効果は、高用量での早期かつ長時間の曝露で確認された。この点では、600μg/kgのイベルメクチンを1日に繰り返し投与することで意味のある効果が得られたが、300μg/kgの投与では効果が有意に低かった[[5]]。最近、コロンビアで行われた無作為化臨床試験では、300µg/kgの投与量はプラセボよりも優れていないことが判明した[[6]]。IVMは体重ベースのレジメンで処方されており、最も頻繁に200 µg/kgで処方され、Cmaxと毒性の関係が提案されている[[7]]。高用量のレジメンは、新たな適応症や投与戦略に役立つ可能性があるため、評価されている[[8],[9]]。健康なボランティアを対象とした試験では 2000µg/kgまでの単回投与が行われており、臨床的に重要な安全性の問題はなかった[[10]]。
COVID-19患者における高用量IVMの抗ウイルス活性と安全性プロファイルを評価するため、我々は入院患者を対象とした概念実証の無作為化対照臨床試験を完了した。COVID-19におけるIVMの潜在的な臨床的有用性をさらに深く理解するために、薬物動態(PK)(IVMの血漿濃度)と薬力学(PD)(ウイルス量の動態)の関係を調査した。ここでは、IVMが呼吸器分泌物中のSARS-CoV-2ウイルス量に与える影響について記述した試験結果を紹介する。
2. 試験方法
2.1 試験デザイン
COVID-19 患者を対象に、高用量 IVM の 5 日間投与と無投与を 2:1 の割合で比較し、抗ウイルス活性と安全性を評価するパイロット多施設共同無作為化オープンラベル試験である。両群の患者は、当時の調査地域では、症状のある患者をすべて入院させる標準治療を受けた。この試験は、アルゼンチンのブエノスアイレス都市圏にある4つの病院で実施された。
施設内の独立した倫理委員会および国の規制機関から倫理的な承認を得ました。参加者全員が書面によるインフォームド・コンセントを得た。本試験はヘルシンキ宣言の原則に則って行われ、ClinicalTrials.gov, NCT04381884に登録されている。本試験は、CONSORT 2010ガイドラインに準拠している。資金提供者は、本試験のデザイン、分析、および結果を公表するかどうかの判断に一切関与していない。
2.2 参加者
参加者は、RT-PCR で感染が確認された 18 歳から 69 歳の COVID-19 患者で、入院中で集中治療を必要としない者とした。適格基準は、COVID-19の症状が発症してから5日以内であること、SARS-CoV-2に対する活性が期待される薬剤(ヒドロキシクロロキン、ロピナビル、レムデシビル、アジスロマイシン)を使用していないこと、試験開始後1週間はこれらの薬剤の使用が認められないこと、などであった。除外基準には、募集開始から30日以内の免疫調整剤の使用、妊娠、授乳、コントロール不良の併存疾患が含まれた。妊娠可能な年齢の患者(男性および女性)は、試験期間中および最後の治験薬投与後少なくとも30日間、有効な避妊手段を講じることに同意した場合に適格とした。
2.3 無作為化とマスキング
無作為なブロックサイズ(3個または6個の割付)で、施設ごとに層別されたブロック無作為化を用いた。無作為化リストは、試験開始前にeCRF/ IWRS Webシステム(Jazz Clinical, Buenos Aires, Argentina)を用いて作成された。再現性を高めるために、1701214029のランダムシードを使用した。インフォームドコンセントが得られ、すべての適格基準が満たされていることが確認されると、コンピュータの画面上と電子メールで治験責任医師に割り当てが伝えられた。患者およびセンターの担当者は、割り付けられたグループについて盲検化されなかった。結果評価者(ウイルス負荷測定担当者)は、無作為化番号と来院番号が記載されたサンプルを受け取った時点で、割り付けられたグループについては盲検化された。
2.4 手続き
すべての患者は、試験開始時に病歴と身体検査を受けた。IVM群の患者は、約24時間間隔で朝食または昼食時に5日間連続して経口投与された。IVM 6mg ラニュレーション錠(IVER P, Laboratorios Elea/Phoenix, Argentina)を全例に使用し、ベースライン時の体重をもとに、全量(6mg)と半量(3mg)のいずれか低い方に丸めて600μg/kg/日の用量とした。600µg/kgを5日間投与する方法を選択したのは,現在のIVMの適応症よりも高用量が必要であることを示唆するin-vitroデータ,最大3日間の投与(絶食または摂食状態)におけるこの用量の安全性に関する利用可能なデータ,およびIVMのPKに関する利用可能な情報に基づいており,1日5回の投与後にIVMの有意な蓄積がないことが予測された[[8],[9],[11],[12]].SARS-CoV-2ウイルス量の定量化のため,ベースライン時,24時間,48時間,72時間,および5日目に鼻咽頭ぬぐい液を採取した。IVM投与群では,投与1,2,3,5日目(血漿中濃度のピーク値を測定するため)および投与7日目(薬物蓄積の可能性を評価するため)の薬物摂取4時間後に静脈穿刺により血液試料を採取し,血漿中のIVM濃度を測定した。また,両群の被験者から血液サンプルを採取し,血液学的および化学的パラメータを測定した。
2.5 アウトカム
主要評価項目は,両群ともベースラインから5日目までのSARS-CoV-2ウイルス量の差とした。副次評価項目は,7 日目と 30 日目の臨床経過,IVM の血漿中濃度と主要評価項目との関係,有害事象の頻度と重症度であった。
2.6 SARS-CoV-2 ウイルス量の測定
鼻咽頭ぬぐい液からの SARS-CoV-2 ウイルス量は,使用するまで -80 ℃で保存したサンプルから定量した。QIAamp Viral RNA Mini Kit(Qiagen, Hilden, Germany)を用いて,140 μLの保存サンプルからウイルスRNAを抽出した。次に,SARS-CoV-2のN遺伝子を標的とした社内逆転写酵素定量PCR(RT-qPCR)を実施した。標準曲線は,陰性の鼻咽頭サンプルの細胞RNAマトリックスで希釈した試験管内転写ウイルスRNAで構成されている.このアッセイには、内部コントロールおよびノーマライザーとしてハウスキーピング遺伝子の測定が含まれていた。ハウスキーピング遺伝子のサイクル閾値(Ct)を用いて、サンプル中の細胞数に応じて特異的SARS-CoV-2のCtを補正した。したがって、ウイルス負荷の測定値は、Hanらが議論したように、1mLあたりのlog10コピーではなく、反応あたりのlog10コピーで表した[[13]]。このアッセイの性能には (i)効率=99%,(ii)再現性(変動係数:1-01~2-31),(iii)反復性(変動係数:0-27~1-89%),(iv)ダイナミックレンジ(反応あたり10~1×108コピー),(v)特異性=100%(SARS-CoV-2陰性検体および呼吸器系ウイルスのパネルを対象に実施)。これらのパラメータはすべて,以前に報告された試験管内試験定量診断法のガイドラインに基づいて決定した[[14],[15]].
2.7 IVMの血漿中濃度プロファイルの測定
血漿サンプル中のIVM濃度は、蛍光検出器付き高速液体クロマトグラフィー(HPLC)を用いて測定した。クロマトグラフィーの手法は,以前に説明したとおりである[[16]].血漿のアリコートをモキシデクチン(内部標準として使用)と合わせた。アセトニトリルによる化学的抽出の後、N-メチルイミダゾールとトリフルオロ酢酸無水物(Sigma Chemical, St Louis, MO, USA)を用いてIVMを蛍光分子に変換した。この溶液のアリコート(100μL)をHPLCシステム(島津製作所,京都)に直接注入し,逆相C18カラム(Kromasil, Eka Chemicals, Bohus, Sweden, 5μm, 4-6 mm × 250 mm)と,水/メタノール/アセトニトリル(1-6/60/38-4)中の酢酸0-2%の移動相を用いて,30℃で1-5 mL/分の流速で分析した。蛍光検出器は,365 nm(励起波長)および475 nm(発光波長)に設定した。検量線の決定係数(r2)は0~995であった。平均絶対薬物回収率は94%であった。本法の精度は,変動係数が8-1%以下であった。薬物の定量限界は0~3ng/mLであった。実験用血漿試料中の薬物濃度は,Solution Software(Shimadzu Corporation, Kyoto, Japan)を用いてピーク面積積分により求めた。
2.8 薬物動態学的および薬力学的解析
IVM の血漿中濃度は,設定した治療日の投与 4 時間後に各患者で測定した。個々の血漿対時間曲線をプロットした。薬物動態パラメータは,PK Solutions 2.0(Ashland, Ohio, US)コンピュータソフトウェアを用いて決定した。ウイルスの減衰率は,ウイルス量と時間の曲線から算出した。指数モデルに従い,次の式から崩壊速度定数を算出した。
λ=S×2・303
ここで,λは崩壊速度定数,Sは勾配である[[17]]。
2.9 統計解析
サンプルサイズの計算は,現在のパイロット試験の推奨事項に基づいて行い,1群あたり10例以上を含めるか,本格的な臨床試験のサンプルサイズの計算に基づいて,信頼区間80%の場合にそのサイズの9%以上を含めることを示した[[18],[19]].これらの根拠に基づき、予備データや過去のデータがないことを考慮して、未治療の対照と比較してベースラインと5日目のウイルス負荷値の差における介入(IVM)の低い効果量(0~3)を検出する能力を持つサンプルサイズを目指し、有意水準5%、検出力80%、2:1の無作為化、10%のフォローアップ喪失を考慮して膨らませた2つの試験群の本格的な試験のサンプルサイズは342人と計算され、パイロット試験は少なくとも31人となるだろう[[19]]。SARS-CoV-2の複製に対するIVMの効果が推定されることと、試験計画時点(2020年4月)でウイルスの動態に関する入手可能な情報が限られていることを考慮し、標準化されたサイズ効果[[20]]に基づくパイロット試験のサンプルサイズは、2:1の無作為化で45名と計算され、その内訳はIVM群の30名と対照群の15名で、施設による層別化は考慮しなかった。
両群(対照群とイベルメクチン群)のベースライン特性をStudent`s T-testおよびChi squareで比較した。両群のベースラインから5日目までのウイルス量の差、および両群のウイルス減衰率の比較は、ノンパラメトリックなMann-Whitney検定で行った。また、7日目の臨床経過をフィッシャーの正確検定で評価した。最後に、IVMの血漿中濃度とウイルス量の減少およびウイルス崩壊率との関係をSpearman rank testで測定した。Kruskal-Wallis法による3群間の差が有意であった場合には、Dunnの多重比較検定による一対一の比較を行った。2人の異なる参加者でランダムに発生した1回のウイルス量の見逃しは,「完全にランダムな見逃し」タイプの値とし,その特定の曲線から既存のデータをすべて補間して回帰分析により推定した。いずれの場合も,p値<0-05を統計的に有意とした。すべての分析はGraphPad Prism version 5-00 for Windows (La Jolla California USA)を用いて行った。
2.10 資金提供者の役割
本研究のスポンサーは,研究デザインには参加したが,主要データの収集,データ解析,データ解釈,報告書の執筆,および出版物への投稿の決定には関与しなかった。すべての著者は,本研究のすべてのデータに完全にアクセスでき,出版物への投稿の決定に最終的な責任を負った。
3. 結果
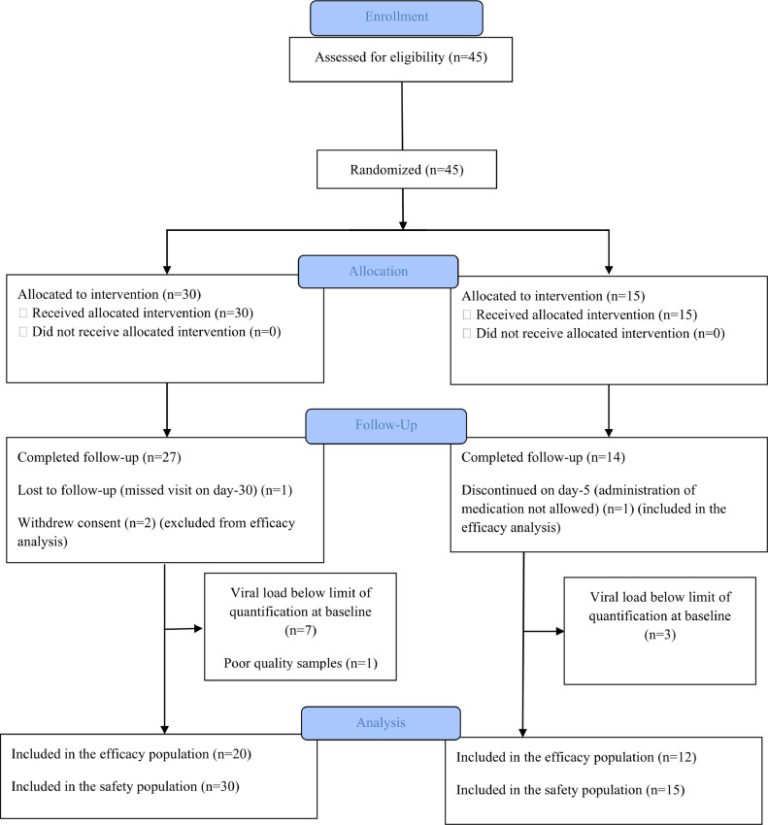
登録は2020年5月18日に開始され、9月9日に終了し、4つの参加病院で45名の参加者が募集された。予定通り、30名がIVM群に、15名が未治療の対照群に無作為に割り付けられた。IVM群では2名の被験者が同意を撤回した。1名はIVMを1回投与した後に軽度の発疹と吐き気のため、もう1名は2回投与した後に不安のためであったが、いずれも有害事象は自然に消失し、IVM群の残りの28名の被験者は治療を完了した。対照群の1例は、5日目のロピナビル投与開始時に病状が進行したため試験を中止し、1例は7日目の来院後に追跡調査ができなくなった。さらに、IVM群の7人と対照群の3人の計10人の症例は、ベースラインでウイルス量が定量限界以下(10コピー/反応未満)であった。これらの症例はフォローアップ期間中、ほとんどのサンプルで検出されず、有効性の分析から除外された。残りの32例(治療を受けた20例と対照の12例)が有効性解析の対象となった(図1)。
図1臨床試験のプロフィール

ベースライン特性を表1にまとめた。併存疾患と病期は両群間で類似しており、最も頻度の高い併存疾患は、両群ともに通常よりも高い肥満度(過体重から肥満度IIIにまたがる)であり、IVM群では19人(63%)対照群では12人(80%)に認められた(p = 0-43)(表1)。ベースライン時の臨床症状、徴候、検査項目については、両群間で差は見られず、WHO-ordinalスケールのカテゴリーに属する人数にも差は見られなかった。疾患の進行は3名(7%)に認められ、治療群では2名、対照群では1名であった。IVM群では1名が侵襲的人工呼吸を必要とし、7日目および30日目の臨床経過に両群間で有意な差はなかった。試験期間中に死亡した症例はなかった。
表1試験集団のベースライン特性
| コントロール(n = 15) | イベルメクチン(n = 30) | P値 | |
|---|---|---|---|
| 年齢(年) | 38•1±11•7 | 42•3±12•8 | 0•29 |
| 性別 | |||
| 女性 | 5(33%) | 15(50%) | 0•29 |
| 男性 | 10(67%) | 15(50%) | |
| 重量(kg) | 79•7±14•4 | 75•3±15•0 | 0•35 |
| 太りすぎ | 8(53%) | 6(20%) | 0•05 |
| 肥満I | 2(13%) | 11(37%) | 0•20 |
| 肥満II | 1(7%) | 1(3%) | 0•79 |
| 肥満III | 1(7%) | 1(3%) | 0•79 |
| 酸素飽和度<94% | 0 | 1(3%) | 0•63 |
| ウイルス量を記録する(log10コピー/反応) | 5•39±1•56(n = 12) | 4•18±1•60(n = 20) | 0•05 |
| 血液学 | |||
| 白血球数(細胞/μL) | 4857±1874 | 6014±2402 | 0•09 |
| リンパ球数(細胞/ µL) | 1478±266 | 1744±747 | 0•09 |
| バイオマーカー | |||
| 乳酸デヒドロゲナーゼ(IU / L) | 460±117 | 468±140 | 0•85 |
| フェリチン(mg / dL) | 1318±1969 | 1071±1304 | 0•66 |
| D-ダイマー(µg / mL) | 1•5(0•1–2•8) | 1•5(0•5–1•8) | 0•82 |
| 症状発現からの時間(日) | 3•6±1•4 | 3•5±1•0 | 0•78 |
| 体温≥37•5°C | 1(7%) | 4(13%) | 0•70 |
| WHO-序数スケール | |||
| 3 | 13(87%) | 29(97%) | 0•20 |
| 4 | 2(13%) | 1(3%) | |
| 胸部画像におけるすりガラスの不透明度 | 6(40%) | 14(47%) | 0•67 |
| 併存症 | |||
| 高血圧 | 3(20%) | 3(10%) | 0•35 |
| 糖尿病 | 1(7%) | 6(20%) | 0•24 |
| 慢性肺疾患/喘息 | 1(7%) | 4(13%) | 0•50 |
数値変数は中央値(IQR)または平均値±標準偏差- カテゴリー変数はカウント(%)として報告されている。体重過多 肥満:体格指数(BMI)25-29-9kg/m2,肥満I:BMI30-34-9kg/m2,肥満II:BMI35-39-9kg/m2,肥満III:BMI40kg/m2以上。
ベースラインと5日目のウイルス量の差は、グループ間で同様であり、時間の経過とともに減少し、有意な差はなかった(図2)。ベースラインのウイルス量には、男性と女性の間で差は認められなかった。5日目のウイルス量が定量限界である10コピー/反応以下になったのは、IVM群では20人中6人(30%)対照群では12人中1人(8~3%)で、両群間に統計的有意差はなかった。IVMの平均血漿濃度とウイルス量の減少との関係を解析したところ、有意な正の相関関係が認められ、IVMの平均血漿濃度が高かった患者ほど、鼻咽頭分泌物中のウイルス量が減少した(r:0-44,p<0-04)。また、IVMの平均血漿濃度レベルは、ウイルスの減衰率と正の相関を示した(r:0-47,p=0-02)。
図2 IVM 0~6mg/kg/dayを5日間投与された患者と未投与の対照者におけるベースラインからの上気道分泌物の定量的RT-PCRによるウイルス負荷
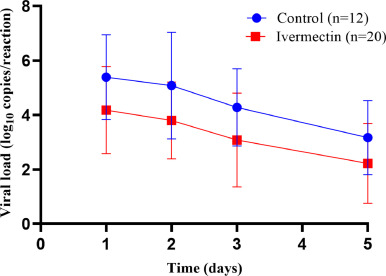
3.1 データは平均値(SD)。Day-1はベースライン測定を示す
本試験で観察された抗ウイルス反応とIVM濃度レベルに基づき、血漿中のイベルメクチン濃度と抗ウイルス活性の関係を示す指標として、未治療対照と比較して有意なウイルス負荷減少が成立する可能性のある閾値として特定されたため、160ng/mlをカットオフ血漿濃度として、治療を受けた患者を2つのサブグループに分けて事後解析を行った。Cmaxの中央値は、160ng/ml以上のサブグループで202ng/ml(IQR:167-268ng/ml)160ng/ml未満のサブグループで109ng/ml(IQR:91-141ng/ml)であった(p<0-0001)。このPK/PDの関係をさらに詳しく調べるために、IVM治療を受けた患者の2つのサブグループにおいて、ウイルス量の動態とベースラインから5日目までの差を分析したところ、ウイルス量の減少率の中央値(IQR)は、対照群で42%(31-73)治療群で40%(21-46)であった。血漿中濃度の中央値が160ng/mL未満の治療を受けた患者では40%(21-46)高濃度群では72%(59-77)であり、後者と他の群の間には統計的に有意な差が認められた(Kruskal-Wallis p = 0-0096)(図3)。5日目にウイルス負荷値が定量限界以下となった被験者の割合は、対照群で8-3%(12人中1人)160ng/ml未満のサブグループで9-1%(11人中1人)160ng/ml以上のサブグループで55-6%(9人中5人)であった(p<0-0001)。
図3 未治療の対照群とIVM血漿中濃度の中央値で識別したIVM治療を受けた患者におけるベースラインから5日目までのウイルス量の減少(中央値とIQR)
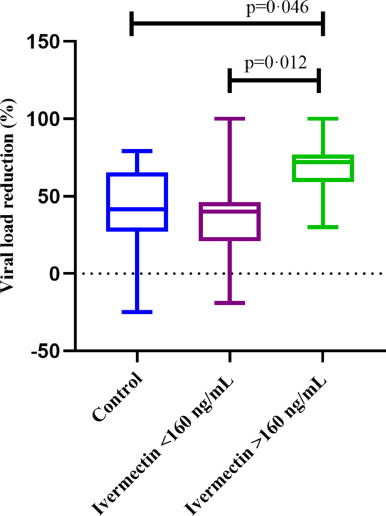
IVMを0-6mg/kg/dayで5日間投与した全治療患者
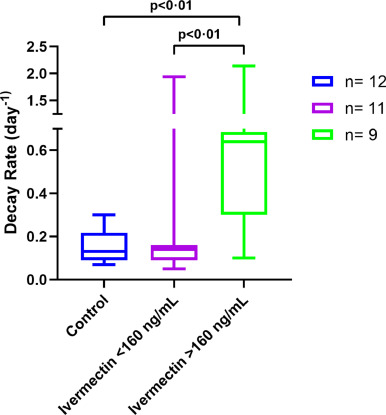
薬剤によるウイルスクリアランスへの影響についても、ウイルス崩壊率をエンドポイントパラメータとし、IVMの血漿濃度との関係を用いて評価した。IVMの血漿中濃度が160ng/mL以上の治療を受けた患者のウイルス減衰率は、未治療の対照群(中央値0-13d-1)および160ng/mL未満の血漿中濃度のサブグループ(中央値0-14d-1)と比較して、有意に大きかった(中央値0-64d-1)(p = 0-04)(図4a)。IVM濃度のサブグループ間では、ベースラインのウイルス量に統計的に有意な差は認められなかった。IVM治療を完了した28名の患者において、IVM濃度プロファイルは、体重(r:0-1,p > 0-05)および肥満度(r:0-07,p > 0-05)と相関しなかった。
図4未治療の対照群とIVM治療を受けた患者の上気道分泌物の定量的RT-PCRによるウイルス負荷減衰率をIVMの血漿中濃度の中央値で表したもの。データは中央値(IQR)で表されている。
有害事象は、45名の患者のうち18名(40%)に報告され、IVM群では13名(43%)対照群では5名(33%)であった(表2)。最も頻度の高い有害事象で、1例以上が経験したのは、IVM群では発疹が3例(10%)であった(いずれも軽度で、約24時間持続する自己限定的なものであった)。対照群では、腹痛、めまい、不安、苦悶、高血糖(いずれも軽度)が単発で報告された。重篤な有害事象(SAE)がIVM群の患者に低ナトリウム血症で1件発生したが,これはCOVID-19のケースシリーズで最近認識されたものであり,IVMの使用との関連では報告されていない[[21]].
表2 安全性集団におけるイベントの概要
| コントロール(n = 15) | イベルメクチン(n = 30) | |
|---|---|---|
| AEの患者 | 5(33%) | 13(43%) |
| 関連する可能性のある/可能性のあるAEの患者 | NA | 9 |
| SAEの患者 | 0 | 1 * |
| 関連する可能性のある/可能性のあるSAEの患者 | 0 | 1 |
| AEの数 | 5 | 17 |
| 可能性のある/可能性のある関連AEの数 | NA | 11 |
| AEグレード3/4の数 | 0 | 3 ** |
AE:有害事象。SAE:重篤な有害事象。*: 低ナトリウム血症; **: SAE(低ナトリウム血症)と ALT および AST の上昇を含むが,いずれも同一患者である.
4. 考察
成人COVID-19患者のSARS-CoV-2に対するIVMの抗ウイルス活性を評価するためにデザインされたこの概念実証試験では、主要評価項目であるベースラインから5日目までのSARS-CoV-2ウイルス量の差において、治療群と対照群の間に差は見られなかった(図1)。しかし、今回の結果から、発症後5日以内に治療を受けたSARS-CoV-2感染者において、IVMの濃度依存的な抗ウイルス活性が示された。また、IVMの血漿中濃度と主要評価項目との関係においても、統計学的に有意な差が認められ(図3 & 4)細胞培養で示された試験管内試験の活性を裏付ける結果となった[[4]]。IVMの血漿中濃度に関する知見は、高用量投与の必要性を示すヒトSARS-CoV-2ウイルスの動態モデルと一致しているが、安全な投与量ではこれらの薬物濃度は達成できないとする懸念とは矛盾している[[5],[22]]。IVMの肺組織への広範な分布パターンは、牛と豚でよく特徴づけられており、後者は鼻咽頭組織でも血漿より高い濃度を達成している[[16],[23]]。牛とヒトにおけるIVMの同様の分布量が報告されていることと、今回の臨床試験で観察された全身性の有効性を考慮すると、肺組織におけるIVMの中央値は395ng/g以上と推定するのが妥当である。IVMの肺組織への分布については、最近、最小限の生理学的PKモデルを用いて同様のパターンがシミュレーションされている[[24]]。
抗ウイルス効果は、IVMの血漿中濃度を測定することで、より高い濃度を達成した患者を識別し、薬剤濃度とウイルス除去の直接的な関係を確認した後に見られた。さらに、この試験における対照群の行動から、病気の自然史に関する適切な結論を導き出すことができる。これは、SARS-CoV-2感染症のウイルス量が自己限定的であることを示しており、22%の症例ではベースライン時にすでに定量限界を下回ってた。これは、COVID-19に対するレムデシビルの評価試験[[25]]で観察された所見と類似しており、最近発表された非重症COVID-19に対するIVMのパイロット二重盲検無作為化試験で、症状発現後72時間以内に治療を開始した場合、無嗅覚期間に統計的に有意な差が認められ、ウイルス量が低下する傾向が確認された[[26]]ように、抗ウイルス剤治療を実施する適切なタイミングの重要性が強調されている。
IVMの血漿中濃度が160ng/mL以上であったのは、有効性解析対象者のうち9名(45%)であった。成人のマラリア対策として600µg/kgを3日間投与した試験では、Cmaxの中央値(CI95%)は119ng/mL(45-455)であった[[8]]。食事は、IVMの経口バイオアベイラビリティに影響を与える重要な変数であり、摂食状態では血漿濃度が上昇する[[27],[10]]。IVMとP糖蛋白質などのABCトランスポーターとの相互作用や、経口投与後のP糖蛋白質の活性の変化はよく知られている[[28],[29]]。したがって、治療を受けた患者の腸内P糖タンパク質の発現量や活性が変化したことが、IVMの吸収や全身への曝露のパターンに大きなばらつきをもたらした可能性がある。
さらなる情報が必要であるが、本試験は、IVMの複数日にわたる高用量レジメンの安全性に関する証拠を追加するものであり、予期せぬ所見はなかった。また、ケニアで実施された成人マラリア患者を対象としたIVMの300および600µg/kgの殺蚊効果を評価した試験[[9]]とも一致する。この試験では、IVMは用量依存性の軽度の一過性視覚障害を10%未満の被験者に発生させたが、今回の試験では報告されなかった[[9]]。試験参加者から報告された有害事象の頻度(IVM群の43%、未治療の対照群の33%)(表2)は、試験薬に関連する事象と関連しない事象を反映していると思われ、予想通り治療群で頻度が高かったが、そのほとんどが重症度1および2であった。
本研究の限界は、SARS-CoV-2に対するIVMの抗ウイルス活性を実証するためのサンプルサイズであるが、臨床結果の違いを検出するための検出力が不足していることである。主要評価項目を症状発生時からではなく試験開始からの日数で分析したことにより,ウイルス量の値や曲線にばらつきが生じた可能性があるが,曲線の縦断的な軌跡ではなく,ベースラインと5日目の差を用いることで部分的には抑えられた。また,両治療群は併存疾患と疾患の重症度の点でバランスが取れていたが(表1),分析において感染症のステージや併存疾患に関する調整は行われておらず,これは本研究の小さな限界と言えるかもしれない。また、各治療を受ける際に摂取した食事の記録がないため、観察されたIVMの血漿プロファイルにばらつきが生じる可能性がある。10コピー/反応という低濃度を確実に定量できる高感度のウイルス負荷測定法を用いたことにより、IVMの抗ウイルス活性を過小評価している可能性がある。統計学的に有意な群間差は得られなかったものの、ベースラインのウイルス量が広範囲に分散していたこと、およびベースラインのウイルス量が群間で異なっていたことは、本研究の限界である。主要評価項目に用いた128個のウイルス量測定値のうち、2個のウイルス量測定値は、技術的な理由により「完全にランダムに外れた」タイプの値であり、回帰分析を用いて推定したが、この2個の値は本研究のわずかな限界である。
急性呼吸器感染症の原因となるウイルスに対する薬剤候補の効果を評価するには、ウイルス複製の迅速な免疫制御や患者間の症状スコアの高いばらつきなど、宿主と病原体の関係のいくつかの側面が妨げとなる[[30]]。そのため、適切なエンドポイントを得るためには、定量的RT-PCRのように、根本的な原因を定量化できる高感度な測定が重要な要素となる[[31]]。抗ウイルス剤候補の評価のためのインフルエンザモデル25で提案されているように、ウイルスの減衰率は抗ウイルス活性の重要なパラメータであることが証明されている。また,急性ウイルス感染症で明らかになっているように,早期の治療開始が重要な役割を果たすことが明らかになった[[31],[32]]。これらの知見の臨床的な妥当性は,臨床的なエンドポイントを用いた試験で確認される必要がある.臨床面以外では,ウイルス負荷の低下が感染力に影響を与える可能性があるが,ウイルス排出負荷と感染力の関係については矛盾したデータがある[[33]].IVMの抗ウイルス機構としては、IMPα/β1ヘテロ二量体を介したウイルスタンパク質の核内輸入を阻害することが提唱されているが[[4]]、感染した上皮細胞のパイロトーシスなどの防御機構を促進する可能性も示唆されている[[34]]。イベルメクチンのような薬剤は,宿主細胞におけるウイルス侵入機構やウイルス複製機構を標的としたり,自然免疫応答を調節したりすることで,生体内試験で間接的な抗ウイルス活性を発揮することができる。ウイルスの感染に不可欠な機構、例えば、核輸送や細胞内のシグナル伝達などは、ウイルス成分を標的とした直接作用型の抗ウイルス剤よりも優れたターゲットとして指摘されている[[35]]。
以上のように,今回の結果は,IVMがSARS-CoV-2に対して濃度依存的な抗ウイルス活性を有するという仮説を支持するものであり,COVID-19を制御するための抗ウイルス剤を評価する際に考慮すべき評価項目についての洞察を与えるものである.今回の結果を確認し、COVID-19におけるIVMの臨床的有用性を明らかにするためのフォローアップ試験が必要である。
資金調達
本研究は,Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación(アルゼンチン)およびLaboratorio ELEA/Phoenix(アルゼンチン)からの助成金IP-COVID-19-625によって支援された。
競合する利益の宣言
AKは、Laboratorio Elea/Phoenixからの助成金と講演料、およびAgencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación(アルゼンチン)からの助成金を報告している。DFAは,提出した研究以外でのLaboratorio ELEA-Phoenixからの個人的な報酬を報告しており,RV,RS,JFは,研究の実施中にElea Phoenix Laboratoryからの個人的な報酬を報告している。MTはElea/Phoenixからの個人的な報酬を報告している。MATとESはLaboratorios Elea/Phoenixの従業員である。SGは,Laboratorio Elea/Phoenix社の取締役である。その他のすべての著者は、競合する利益を宣言していない。