Contents
Advances in D-Amino Acids in Neurological Research
www.ncbi.nlm.nih.gov/pmc/articles/PMC7582301/
オンラインで2020年10月3日に公開
James M. Seckler1,* and Stephen J. Lewis2
概要
D-アミノ酸がヒトの脳内に存在することは40年近く前から知られており、現在も活発に研究されている分野である。この総説では、脳や神経疾患に関連したD-アミノ酸研究の最近の進展を簡潔に紹介することを目的としている。この研究は、主にN-メチル-D-アスパラギン酸(NMDA)受容体の調節とアルツハイマー病や統合失調症との関係に焦点を当ててきたが、いくつかのD-アミノ酸が神経保護的に脳内化学物質を変化させる上で新たな役割を果たすことを明らかにした新しい研究も豊富にある。また、現在のところ脳内での活性は知られていないが、活性のある誘導体を持つD-アミノ酸についてもレビューする。
キーワード
D-アミノ酸、脳、アルツハイマー病、統合失調症、神経疾患、N-メチル-D-アスパラギン酸(NMDA)受容体
1. はじめに
D-アミノ酸は当初,生体に内在しない不活性な化合物と考えられていた[1]。しかし,20世紀半ばの研究により,バクテリア,植物,高等生物に存在することが明らかになった[1,2,3,4]。1980年代から 1990年代にかけて、D-アスパラギン酸とD-セリンがヒトの脳内で発見され、アルツハイマー病との関連が指摘された[5,6,7,8]。後に、これらのアミノ酸は、それぞれN-methyl-D-aspartate(NMDA)受容体のアゴニストとコアゴニストとして作用することで、アルツハイマー病に関与していることが判明した[9,10]。それ以来、D-アスパラギン酸とD-セリンは、D-アミノ酸研究において活発な関心を集めている分野であり、徐々に他のD-アミノ酸も神経活性を持つことが発見され、様々なソースから吸収されるようになってきた[10,11,12]。
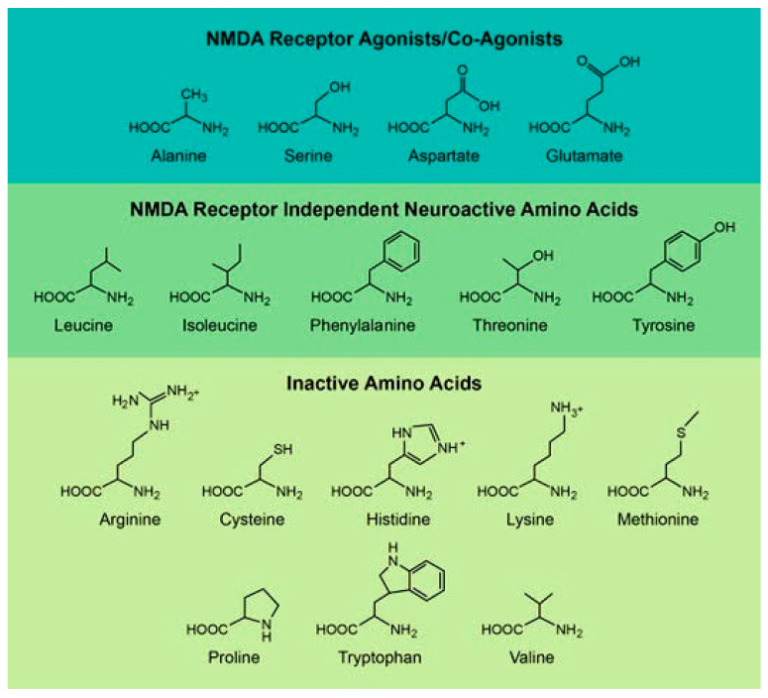
この総説では、D-アミノ酸を、哺乳類の生物学における現在知られている役割に基づいて、3つのカテゴリーに分けた(図1)。1つ目は、NMDA受容体と直接相互作用するD-アミノ酸である[13,14,15,16,17]。これらは最も研究されているアミノ酸であり、アルツハイマー病や統合失調症などの多くの確立された疾患モデルに注目されている[15]。2番目はD-アミノ酸で,脳内でNMDA受容体に依存しない活性を有している[18,19,20,21,22]。多くの場合,これらの作用は最近になって発見されたものであり,統一されたメカニズムや疾患モデルによって作用するものではない[19,21,22]。最後に、3つ目のグループは、脳内では不活性だが、脳内で興味深い誘導体分子や代謝物を持つD-アミノ酸からなる[23,24,25,26,27]。表1および表2には,この総説で取り上げたD-アミノ酸が列挙されており,それらがどのように体内に入るのか,生物学的に活性な誘導体は何か,アミノ酸の簡単な説明がまとめられている。
図1 この総説で取り上げる様々なD-アミノ酸の化学構造を示している。我々はこれらのアミノ酸を生体内試験での活性に基づいて3つのグループに分けた
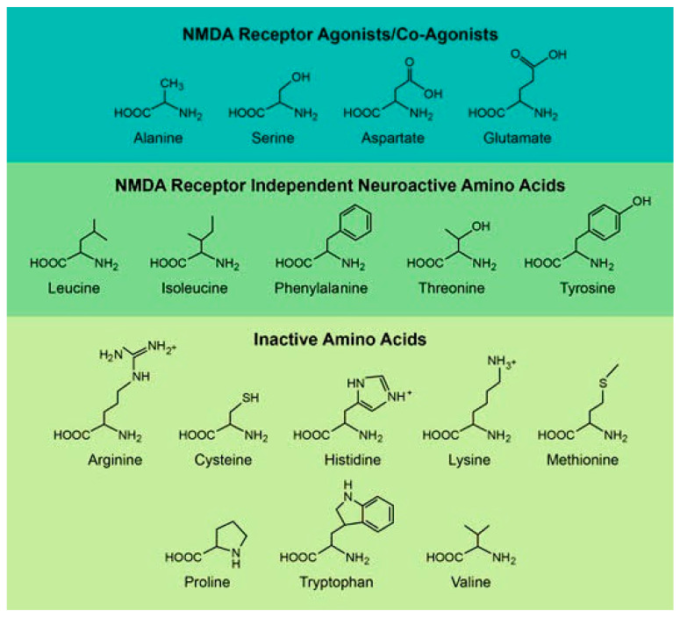
表1 神経活性D-アミノ酸の概要
| アミノ酸 | 一次情報 | 説明 | 参照 |
|---|---|---|---|
| NMDA受容体作動薬または共同作動薬 | |||
| アラニン | バクテリア/摂取 | NMDAR 1アルツハイマー行動の変化へのリンクを持つコアゴニスト | [ 13、28、29、30、31、32、33 ] |
| アスパラギン酸 | バクテリア/ラセマーゼ | NMDAR 1つの脳内の様々な活動を有するアゴニスト | [ 16、34、35、36、37、38、39 ] |
| グルタミン酸 | バクテリア/摂取 | NMDAR 1つのアルツハイマー行動の変化へのリンクを持つアゴニスト | [ 14、33、40、41 ] |
| セリン | バクテリア/ラセマーゼ | NMDAR 1アルツハイマー病や統合失調症へのリンクを持つコアゴニスト | [ 42、43、44、45、46、47、48 ] |
| 非NMDA受容体経路を介して脳内でアクティブ | |||
| イソロイシン | 摂取 | D-セリン放出を刺激し、脳内のグリシン放出を阻害します | [ 18、49、50、51 ] |
| ロイシン | 摂取 | 抗てんかん剤 | [ 19、52,53,54] |
| フェニルアラニン | 摂取 | 炭酸脱水酵素活性化因子 | [ 20、55 ] |
| スレオニン | 摂取 | 海馬内の流れを強化する | [ 21 ] |
| チロシン | 摂取 | チロシナーゼ阻害剤 | [ 22、56 ] |
表2 その他の研究されているD-アミノ酸の概要
| アミノ酸+ B2 | 一次情報 | デリバティブ | 説明 | 参照 |
|---|---|---|---|---|
| アルギニン | 摂取 | ポリ-18-D-アルギニン | 誘導体は脳損傷モデルにおいて神経保護的です | [ 57、58、59、60、61、62、63 ] |
| システイン | 摂取 | D-シスチンジメチルエステル | 脳内で硫化水素に代謝され、誘導体はオピオイド誘発性呼吸抑制を救うことができます | [ 64、65、66、67 ] |
| ヒスチジン | 摂取 | nd 1 | 最近研究された活動はありません | なし |
| リジン | 摂取 | オレオイル-D-リジン | 誘導体は、グリシン輸送の遮断を介して作用する非オピオイド鎮痛薬です | [ 25、68、69、70 ] |
| メチオニン | 摂取 | nd 1 | 脳内の既知の活動はありませんが、耳の耳毒性から保護します | [ 71、72、73、74 ] |
| プロリン | バクテリア/摂取 | D-cis-Fpro | 誘導体は、癌の進行を監視するために使用される蛍光プローブです | [ 75、76、77、78、79 ] |
| トリプトファン | 摂取 | 1-メチル-D-トリプトファン | 脳内でキヌレン酸に代謝され、誘導体を使用してキヌレン酸の生成を阻害することができます | [ 27、80 ] |
| バリン | 摂取 | 5F-ADB 2 | 線維芽細胞の成長を阻害し、誘導体は重度でしばしば致命的な副作用を伴う合成カンナビノイドです | [ 81 ] |
1.議論なし、2.N-[[1-(5-フルオロペンチル)-1H-インダゾール-3-イル]カルボニル]-3-メチル-D-バリン メチルエステル。
1.1. D-アミノ酸の原料
D-アミノ酸は、内因性のラセマーゼ、微生物による生産、摂取など、さまざまな方法で得られる。ラセマーゼは,L-異性体からD-異性体への変換を触媒する酵素であり,体内でD-異性体アミノ酸を生成する際の重要な酵素である[82]。現時点では,セリンラセマーゼが,人体に存在することが知られている唯一のラセマーゼであり,D-アスパラギン酸とD-セリンの生成に役割を果たしている[34,83]。この酵素は,後述するさまざまな疾患の生理および病態生理に重要な役割を果たしている。興味深いことに、セリンラセマーゼはD-アスパラギン酸の生成に役割を果たしているが、D-アスパラギン酸の合成を排他的に制御しているわけではなく、まだ発見されていないヒトのアスパラギン酸ラセマーゼの存在を強く示唆している[34]。D-アスパラギン酸とD-セリンは、哺乳類では内因性に生成されるが、D-アラニン、D-グルタミン酸、D-プロリンとともに腸内細菌から吸収されることもある[84,85,86]。腸内細菌が神経学に影響を与え,アルツハイマー病や統合失調症などのさまざまな疾患の発症に役割を果たしているという研究が増えてきている[87,88,89,90]。腸内細菌が産生するD-異性体アミノ酸が、これらの病気やその他の病気の発生や進行に関与している可能性がある。最後に,すべてのD-異性体は,我々が摂取する食品や医薬品にある程度含まれている[12,82,91]。これは様々な場所から来ており、最近、詳細にまとめられた[82]。
1.2. D-アミノ酸の排泄
神経学的に活性なD-アミノ酸は,脳内でD-アミノ酸オキシダーゼ(DAAO)とD-アスパラギン酸オキシダーゼ(DDO)によって厳密に制御されている[1,35]。この2つのオキシダーゼは,それぞれの基質の酸化的脱アミノ化を触媒し,基質が腎臓から排泄されるようにする [35,42]。最も重要なのは、D-セリンとD-アラニンがヒトのDAAOによって代謝されるのに対し、D-アスパラギン酸とD-グルタミン酸はDDOによって代謝されることである[42,92]。これらの4つのアミノ酸はすべてNMDA受容体を調節するため、その調節に大きな関心が寄せられているが、このレビューでは後に詳しく説明する。D-アミノ酸の主な排泄方法は、腎臓に運ばれて代謝されてから排泄されるというものである[93,94,95]。DAAOとDDOはともに脳で発現しているが、DAAOの発現レベルが最も高いのは肝臓と腎臓で、DDOの発現レベルが最も高いのは心臓である[28,96]。興味深いことに,D-アラニンなどのアミノ酸が代謝されるのではなく,単に腎臓から排泄されることを示す最近の研究があり,D-アミノ酸制御におけるDAAOの中心性が疑問視されている[29,30,95]。ヒトでは,すべてのD-アミノ酸がDAAOまたはDDOによって代謝されず,主な排泄方法として単に腎臓から排泄されていると考えられる。活性のあるD-アミノ酸のほとんどは,1つの酵素によって制御されていると考えられているため,DAAOの活性と体内のD-アミノ酸濃度に対するその影響について,最近では多くの研究が行われている [30,35,36,40,52,68,80,96]。これらの研究については,以下のセクションで詳しく説明する。
2. NMDA受容体のアゴニストまたはコ・アゴニスト
4種のD-異性体アミノ酸は、内因性の神経伝達物質または神経調節物質として体内で特に重要な役割を果たしている。これらの化合物は主に、グルタミン酸(D-アスパラギン酸/D-グルタミン酸)またはグリシン結合部位(D-アラニン/D-セリン)のアゴニストとしてNMDA受容体を調節することで作用する[97]。NMDA受容体のイオンチャネルが開くには,両方の部位が占有されている必要があるためである[98]。興味深いことに、グリシン結合部位に結合するさまざまなコアゴニストが、特定のNMDA受容体を活性化するために必要であることが示されている[17]。特に、CA3-CA1シナプスではグリシンではなくD-セリンが内因性のコアゴニストであることが示されている[17]。このことは、NMDA受容体と相互作用するD-アミノ酸についてのより複雑なストーリーを示唆している。これらのアミノ酸は、重要な研究対象となっている。特に、これらのアミノ酸の研究は、NMDA受容体が直接関与する疾患の病因を理解する上で重要であり、実際、ほとんどの研究はアルツハイマー病と統合失調症における役割に焦点を当てている[99,100]。NMDA受容体の過剰な活性化が神経毒性を誘発し、アルツハイマー病の神経変性に重要な役割を果たしていることがわかっている[99]。一方、NMDA受容体の活性化が不十分な場合は、統合失調症の病態生理に重要な役割を果たしているという証拠が増えてきている[100]。ほとんどの研究はこれらの2つの疾患モデルに焦点を当てているが,これらのD-異性体に関する他の研究も豊富に行われており,以下のセクションでまとめている。
2.1. D-アラニン
D-アラニンは、脳内化学反応において複雑な役割を果たしている[31]。アルツハイマー病を患う患者の脳内でD-アラニンが上昇することが長い間示されており[13]、D-アラニンが統合失調症の治療に使用できることが示されている[32]。どちらの場合も、これはNMDA受容体を調節する能力と関連している[31,32]。最近の研究では、D-アラニンがAlzheimer’s Disease Assessment Scale-Behavioral Subscale(幻覚、妄想、焦燥、サンダウン症候群など)と強く相関していたが、Cognitive Subscaleとは相関していなかった[33]。統合失調症の治療におけるD-アラニンの相対的な有効性は、投与後、体内で速やかに代謝されるという事実によって鈍化される[29]。このような結果を受けて、D-アラニンを調節する体内の能力に大きな関心が寄せられたが、最近まで、D-アラニンは細菌から吸収され、DAAOによって分解されると考えられてた[28,29,30,33]。このため、統合失調症患者のDAアラニン濃度を高めるためのDAAO阻害剤に大きな関心が寄せられてた[28,29,30]。実際、マウスではそうなっているようであるが[28]、イヌやサルを使った実験では、DAAO阻害剤を服用した動物と何も服用していない動物の間に有意な差はなかった[29,30]。さらに、D-アラニンは腎臓に蓄積され、代謝されるのではなく排泄されることが示唆されている[95]。したがって、ヒトにおいてD-アラニンがどのように制御されているかという問題は、依然として未解決かつ重要な問題である。
2.2. D-アスパラギン酸
D-アスパラギン酸は、ヒトを含むすべての動物に存在する内因性アミノ酸である[101]。脳内で神経伝達物質として機能し,脳の発達,学習,記憶に顕著な役割を果たしている[16,37,101]。ヒトの脳におけるD-アスパラギン酸の合成方法は不明であるが,このプロセスにはセリンラセマーゼが関与していることが最近発見された[34]。このことは,セリンラセマーゼをノックアウトしたマウスの脳内のD-アスパラギン酸のレベルを測定することで明らかになった。その結果,これらのマウスでは,海馬と前頭前野でのD-アスパラギン酸の生成量が大幅に減少していたが,小脳ではD-アスパラギン酸の量は変化していなかった[34]。このことは,セリンラセマーゼがD-アスパラギン酸の生成に重要な役割を果たしていることを強く示唆しているが,まだ発見されていない他の酵素もD-アスパラギン酸の生成に使用されていると考えられる。いったん生成されたD-アスパラギン酸は、それ自体で作用することも、NMDAに代謝されることも、DDOによって分解されることもある[102]。この経路は今でも活発に研究されており、実際、マウスのDDOを詳細に調べた最近の研究では、マウスとヒトのDDOの間にいくつかの重大な違いがあることが示された[35]。特に,マウスのDDOは,ヒトのDDOに比べて,D-プロリンとの交差反応性が高く,フラビンアデニンジヌクレオチドとの結合性が低いことが明らかになった[35]。
体内では,D-アスパラギン酸はNMDA受容体を調節し,L-グルタミン酸の放出を刺激する役割を果たしている[36,103]。最近の研究では,抗精神病薬であるオランザピンは,DDOを阻害することで,前頭前野においてD-アスパラギン酸レベルを上昇させ,L-グルタミン酸の放出を刺激することができた[36]。D-アスパラギン酸は,脳の発達期に最も強く発現し,加齢とともに減少する[38]。このプロセスは,NMDA受容体の過剰な活性化によってもたらされる神経変性を防ぐDDOの発現増加によって制御されていることが最近明らかになった[38]。統合失調症の疾患モデルでは、脳内のD-アスパラギン酸濃度が低いことが確認されていることから、NMDA受容体活性化因子としてのD-アスパラギン酸の役割は、統合失調症の病因に関与している可能性がある[39]。最近の研究では、前頭前野でDDOが過剰に発現していることが、この低濃度の原因であると考えられている[96]。この研究では,統合失調症を患う患者の死後の脳サンプルにおけるD-アスパラギン酸のレベルを測定し,これらの患者の前頭葉皮質では異常に低いレベルであったが,海馬では低いレベルであったことを明らかにした[96]。D-アスパラギン酸に関する最近の研究は、D-アスパラギン酸がDDOによって制御されていることを明確に示しているが、さらに深いストーリーと、大脳皮質と海馬でD-アスパラギン酸を生成・分解する未発見の酵素についても示唆している。
2.3. D-グルタミン酸
近年、D-グルタミン酸は、アルツハイマー病の行動症状に対する保護作用を持つ分子として注目されている[33,40,41]。具体的には、アルツハイマー病では、海馬でのD-グルタミン酸の減少に加え、循環血液中のD-グルタミン酸の減少が見られる。D-グルタミン酸の減少は、NMAD受容体の活性化を低下させ、その結果、症状を悪化させることが示唆されている[14,33,40,41]。D-グルタミン酸は、食物から吸収されるだけでなく、腸内細菌によって産生されると考えられており、腸内細菌由来のD-グルタミン酸は、アルツハイマー病の進行を遅らせるための新たな治療薬になる可能性が示唆されている[14]。D-グルタミン酸がDDOによって代謝されることは以前から知られていたが,最近の研究では,心臓のミトコンドリアにおいて,新規のD-グルタミン酸シクラーゼによって5-オキソ-D-プロリンにも変換されることが示されている[95]。
2.4. D-セリン
D-セリンは,グリシン結合部位を占めることができるNMDA受容体のコアゴニストであることが古くから知られている[11,15]。このことは、統合失調症とアルツハイマー病の両方にD-セリンを強く関連づけている[99,100]。遊離したD-セリンは、主に哺乳類の前脳に局在し、NMDA受容体の濃度が最も高い場所に沿って存在する[104,105,106]。D-セリンは、セリンラセマーゼによってL-セリンがD-セリンに変換されて生成され、DAAOによって代謝される[42,43,83]。D-セリンは脳内で有益な役割を果たしているが、最近の研究では、D-セリンのレベルが調節されて脳を損傷から守ったり、調節不能になって病気を引き起こしたりすることが明らかになり、この話が広がっている[107,108,109]。D-セリンは、外傷性脳損傷からの回復を助ける。実際、D-セリンは、アストロサイトによるD-セリン放出のアップレギュレーションという形で、脳が外傷性脳損傷から回復するために使用されることが示唆されている[44,110,111]。このD-セリン放出のアップレギュレーションは、3-ホスホグリセリン酸デヒドロゲナーゼに依存するセリンシャトルによって引き起こされるが、脳損傷時にこのプロセスを誘発するメカニズムを完全に解明するには、さらなる研究が必要である[107]。D-セリンは、ラットの強迫的なアルコール摂取を逆転させ、アルコール依存症の治療における役割を示唆している[108,109]。これには、過分極された電位でのみ活性化される特殊なタイプのNMDA受容体に対するD-セリンの阻害が関与している[108,109]。これらの特殊なNMDA受容体は主に前頭前野に存在し、強迫的なアルコール消費に関与していることが示されている[112]。
D-セリンが統合失調症から保護し、その喪失がNMDA受容体の活性化を低下させ、統合失調症の症状をもたらすという証拠が増えてきている[45,46,113,114,115,116]。実際、多くの研究で、統合失調症患者にD-セリンを大量に投与すると、統合失調症の陰性症状が緩和されることがわかっている[45,117,118,119]。最近、統合失調症の患者ではD-セリン濃度が著しく低いことが明らかになったが、これはおそらくセリンラセマーゼの発現が阻害され、DAAOが過剰に発現していることが原因であると考えられているので、この点は重要である[114]。D-セリンは,アルツハイマー病や認知症の発症にも関与している[33,43,47,120]。実際,脳内でのD-セリンの過剰発現は,アルツハイマー病の一因であると考えられている[33,43]。初期のアルツハイマー病患者では、炎症によりアストロサイトからD-セリンが放出され、神経毒性を引き起こすことが示唆されている[43,48,120]。また、アストロサイト内でのD-セリンの増加は、セリンラセマーゼの過剰発現によるものであることが知られており、アルツハイマー病と闘うための新たな創薬標的となる可能性が示唆されている[48]。逆に、パーキンソン病患者の脳脊髄液や黒質では、D-セリンが減少していることが最近明らかになっており、神経変性疾患におけるD-セリンとNMDA受容体の役割がより複雑であることを示唆している[121]。D-セリンに関する最近の研究成果は,脳内のレベルを調節した新規治療薬の大きな可能性を示している。
3. NMDA受容体と直接相互作用しない神経活性D-異性体
脳内で活性化するものの、内因性ではなく、特に研究もされていない別のクラスのD-異性体がある。これらのD-異性体は食事や薬などの摂取によって吸収され、さまざまな異なるメカニズムで作用する[12]。これらのD-異性体の作用を明らかにするために行われてきた研究を以下のセクションでまとめている。
3.1. D-イソロイシン
従来,D-イソロイシンは脳内ではほとんど活動していないと考えられており,その代わりに細菌の行動を制御する役割に焦点を当てた研究が行われてきた[49].イソロイシンは,アラニン-セリン-システイン-1(Asc1)トランスポーターを制御することが示されている[18].このトランスポーターは神経細胞でD-セリンとグリシンを放出し,D-イソロイシンは単離された細胞でグリシンの取り込みを阻害しながらD-セリンの放出を促進する[18]。最近、Mesuretら[50]は、D-イソロイシンが脳幹電流のグリシン電流を減少させ、Asc1依存的に脳幹でのグリシン放出を促進することを示した[50]。この研究はさらに発展し,D-イソロイシンが加齢ラットの長期増強欠損を救済し,加齢に伴う記憶力低下から保護することを示した[51]。この研究では、Asc1が正常なNMDA受容体依存性の認知機能低下に大きく寄与しているようには見えず、実際にそれを防ぐのに役立つことが示されたので、これは特に興味深いものである。このことから、D-イソロイシンは、長期的な認知機能の低下を招くことなく、D-セリンの放出を誘導することで、統合失調症の影響を管理する役割を果たしているのではないかなど、さらに多くの興味深い仮説が考えられる。
3.2. D-ロイシン
D-ロイシンはあまり研究されていないアミノ酸で、最近まで真核細胞での活性は知られなかった[19,52,53,54]。にもかかわらず,D-ロイシンが脳内でDAAOによって厳密に制御されていること[52],食品中に存在し,細菌によって生産されていること[52,53]は古くから知られていた。最近では,D-ロイシンが強力な抗てんかん薬であり,誘発されたてんかん発作には効くが,慢性のてんかん発作を防ぐことができないことがわかってきた[19,122]。これは,D-ロイシンが脳内であまりにも早く代謝されてしまうためと思われる[52]。同じグループは,D-ロイシンが作用する受容体の特定を試み,D-アミノ酸活性化味覚受容体タイプ1メンバー2/3(TAS1R2/R3)を特定した[122]。この受容体の他のリガンドに抗てんかん作用があることを示した過去の研究から、これは良い候補であった[122]。しかし,TAS1R2/R3のノックアウトマウスは,誘発された発作から部分的に保護されることが判明した[19]。このことから,この受容体の役割はより複雑であり,D-ロイシンの抗発作作用は,哺乳類の脳内のまだ発見されていない受容体を介して作用することが示唆される。
3.3. D-フェニルアラニン
D-フェニルアラニンは,炭酸脱水酵素を活性化することで研究に用いられてきた[20]。D-フェニルアラニンを使った最近の研究では、記憶形成における炭酸脱水酵素の役割を調べるために使用された[20,55]。この研究では、海馬の炭酸脱水酵素が物体認識と恐怖の消去の記憶形成を促進することがわかった[55,123]。このことは、D-フェニルアラニンを投与すると記憶形成が促進されることと、血液脳関門を通過する炭酸脱水酵素阻害剤がこの効果を消失させることで示された[55,123]。このことは、D-フェニルアラニンと炭酸脱水酵素が、記憶形成においてより広い役割を果たしている可能性を示唆している。
3.4. D-スレオニン
脳内のD-スレオニンに関する最近の研究はほとんどない。唯一の研究では,D-スレオニンがラットの海馬スライスに輸送され,スライス内の電流を増強することが示されている[21]。これは、タウリンの増強作用を模倣しているが、NMAD受容体とは独立した、まだ解明されていないメカニズムによって起こるものである[21,124,125]。興味深いことに、以下のような多くのアミノ酸が同様の増強作用を引き起こすようである。L-アラニン,D-アラニン,L-グルタミン,グリシン,L-ヒスチジン,L-セリン,D-セリン,タウリン,L-スレオニンなどである[21]。タウリンの増強作用は、部分的にミトコンドリアを介して作用することが知られており、D-スレオニンがミトコンドリアの機能を改善することで作用するかどうかを確認するには、さらなる研究が必要である[125]。
3.5. D-チロシン
D-チロシンは、脳内での活性は確立されていないが、最近、チロシナーゼ阻害剤として有効であり、メラニンの形成を防ぐことが示されている[22,56]。これは、パーキンソン病などの神経変性疾患にチロシナーゼが関与していることを考えると、特に興味深いことである[126,127]。また,チロシナーゼ阻害剤は,ドーパミンの過剰生産を防ぐことで,神経保護作用を有することが示唆されている[128]。このことから、D-チロシンはパーキンソン病などの変性疾患モデルにおいて神経保護作用を持つ可能性があり、動物モデルを用いたこの分子のさらなる研究が必要であると考えられる。
4. 興味深い誘導体やその他の活性を持つ不活性D-アミノ酸類
D-異性体の最後のグループは、それ自体は脳内で不活性であると考えられているが、何らかの化学的修飾を受けると、顕著な治療効果が期待できる化合物を生成するものである。これには、脳の損傷、オピオイドの過剰摂取、細胞死を防ぐ、さまざまな神経保護化合物が含まれる。これらの化合物はいずれも新規性が高く、比較的よく理解されていない様々なメカニズムで作用するため、積極的に研究が進められている。
4.1. D-アルギニン
D-アルギニンは、誘導性一酸化窒素合成酵素(iNOS)活性化のネガティブコントロールとして使用されており、現在も使用されている[57]。ポリ-D-アルギニン、特に18アミノ酸ポリ-D-アルギニンペプチド(R18D)の神経保護効果に関する最近の研究は非常に多くなってきている[58,59,60,61,62,129,130,131,132,133,134,135]。これらのR18Dペプチドは、D-アルギニンを使用してプロテアーゼ耐性を持たせており、実験的な脳虚血および/または低酸素傷害モデルにおいて神経保護作用を示すことが示されている[58,59,60,61,62,129,130,131,132,133,134,135]。これは、R18が細胞内に取り込まれ、細胞の電位を大きく変化させることで、細胞表面のグルタミン酸受容体レベルや興奮性Ca2+の流入を減少させることで作用すると考えられている[23,61,63,130,136,137]。また、ミトコンドリアを安定化させ、酸化ストレスを軽減することでも作用する[132,133,134,135]。また、他のグループは、ポリ-アルギニンペプチドが、ストレスによるミトコンドリアの過分極を抑えることで、神経細胞死を抑制することを見出している[63,138,139,140,141]。さらに,ポリ-D-アルギニンペプチドは,遺伝子の非ウイルス性キャリアとして,遺伝子治療に利用できることが示されている[142,143,144,145]。これは,細胞の生存を促進することにより,新しい遺伝子を導入すると同時に,細胞のストレスを防ぐことができるためである[142,143,144,145]。このことから,D-アルギニンの神経保護作用は,脳卒中,虚血性障害,低酸素性障害後の梗塞体積を減少させるための有効な手段であることがわかる。
4.2. D-システイン
D-システインは、それ自体は不活性であるが、脳内で神経保護作用を持つことが確立されている[24,64,146]。この特性は、D-システインがDAAOによって3-メルカプトピルビン酸に変換され、さらに3-メルカプトピルビン酸硫酸転移酵素によってH2Sに変換され、硫化水素(H2S)に代謝される能力に起因すると以前から考えられてた[24,64,65,146]。この経路が、D-システインが食物から容易に吸収される一方で、脳や血液中ではほとんど検出されない理由であると考えられている[65]。最近では、D-システインがH2Sメカニズムによって小脳プルキンエ細胞の樹状突起の発達を促進することが示されている[147]。さらに,脳内ではD-セリンがはるかに高いレベルで発現しているにもかかわらず,ヒトDAAOがD-システインに対して最も高い親和性を示すことが最近明らかになった[42]。また、この分野では、より複雑なストーリーを示唆する反対意見の研究もある。D-システインは,H2Sに分解されないN-アセチル-L-システインと同一のメカニズムでアストロサイトをタンパク質毒性から保護している[66]。さらに,D-システィンジメチルエステルは,H2Sに依存しないメカニズムで,オピオイドによる呼吸抑制を回復させる呼吸促進剤として作用することが示されている[67]。これらを総合すると、D-システインやその近縁分子は、様々な直接的・間接的な生化学的プロセスを通じて有益に作用することが強く示唆される。
4.3. D-ヒスチジン
脳や感覚器官におけるD-ヒスチジンの研究は、最近では行われていない。これはおそらく、D-ヒスチジンが脳内にほとんど輸送されず、侵入しても不活性であると考えられていることによると思われる[148,149,150]。脳や関連組織にD-ヒスチジンを増加させる疾患モデルがあれば、D-ヒスチジンを不活性な組織化学的マーカーとして使用することができるので、興味深い研究対象となりうる。
4.4. D-リジン
D-リジンは、DAAOによって代謝される一方で、脳内ではほとんど不活性であることが長い間知られていた[68,151,152]。近年、D-リジンの改良型であるオレオイル-D-リジンが、グリシントランスポーター-2およびグリシン受容体の阻害剤として開発された[25,69,70]。このことから、オレオイル-D-リジンは、グリシンの輸送を阻害することで作用する強力な非オピオイド系鎮痛剤であり、慢性疼痛の治療に大きな可能性を示している[25,153]。また、オレオイル-D-リジンは、統合失調症の治療に役割を持つタンパク質であるグリシントランスポーター-1を阻害することから、オレオイル-D-リジンまたはその改良型を統合失調症の研究にどのように応用できるかは興味深いところである[25,154]。
4.5. D-メチオニン
D-メチオニンは、脳内での活性は知られていないが、様々な薬剤の毒性から保護するとともに、騒音性難聴からも保護する[71,155,156]。最近の研究では,D-メチオニンはシステムLとAscトランスポーターを用いて脳内に輸送されることがわかった[72]。この研究では,D-メチオニンがL-メチオニンよりも有意に高いレベルで脳内に濃縮されたことから,脳内にはD-メチオニンを代謝する内因性システムが存在しないことが示唆された[72].最近、D-メチオニンは、コネキシン26とコネキシン30の消失を防ぐことで、様々な薬剤モデルの耳毒性を防ぐことが分かっており、薬剤治療中の薬剤による細胞死を防ぐための興味深い分子となっている[73,74,157]。
4.6. D-プロリン
D-プロリンは、血液脳関門を容易に通過するにもかかわらず、脳内ではほとんど不活性であり、最近のL-プロリンの研究ではネガティブコントロールとして使用されている[75,158]。これは、D-プロリンがタンパク質に取り込まれる前に、脳内で速やかにL-プロリンに変換されることが以前から知られていたためである[158]。D-プロリンの改良型であるCis-4-[18F]fluoro-D-proline (D-cis-FPro)を用いて,脳内の癌や神経変性疾患の進行を検出・追跡することが注目されている[26,76,77,78,159,160]。この技術は,ポジトロン・エミッション・トモグラフィー(PET)スキャン法を用いて,生きている動物や人間の脳内のD-cis-FProの位置を想像するものである[159]。D-cis-FProは,パーキンソン症候群で起こる炎症に関連した変性のマーカーであることが示されている。また,D-cis-FProは,マルチモーダル治療を受けたヒトの脳腫瘍における細胞死の検出にも用いられている[26]。この研究では,PETを用いて,さまざまな脳腫瘍に対する治療の前後に,生きている人間の脳の中にあるD-cis-FProを想像した[26]。最後に,アルツハイマー病の治療のために,アミロイドβペプチドにD-プロリンの変異を採用した興味深い研究がある[79]。Linら[79]は,アミロイドβペプチドの10〜40アミノ酸のうち,すべてのバリンをD-プロリンに変異させた構造体を作成した。このコンストラクトは,アルツハイマー病モデルマウスにおいて,内因性に放出されるアミロイドβの蓄積を有意に減少させることが示された[79]。
4.7. D-トリプトファン
D-トリプトファンが脳内で果たす役割はほとんど無視されてきたが,近年,代謝基質としての役割や,ケタミンで誘発される統合失調症を回復させる関連化合物の役割についての研究がいくつか行われている[27,80]。ある研究[80]では,マウスの脳内でDAAOにより,D-トリプトファンがL-トリプトファンとキヌレン酸に変換された[42,80]。キヌレン酸は,抗興奮毒性や抗痙攣などのいくつかの神経活性を有しており,NMDA受容体のグリシン結合部位で非競合アンタゴニストとして作用する[161,162]。また,キヌレン酸は,アリル炭化水素受容体を介してインターロイキン6の発現を誘発することが知られており,炎症性のシグナル分子となっている[163]。この経路は、がんや統合失調症を含む多くの疾患に関与している[163]。したがって,統合失調症の患者でキヌレン酸の濃度が上昇していること[164]や,1-メチル-D-トリプトファンが,L-トリプトファンとD-トリプトファンの両方からキヌレン酸を生成する酵素であるインドールアミン2,3-ジオキシゲナーゼの阻害剤として作用することで,ケタミン誘発性統合失調症の生理学的指標を逆転させることは,驚くに値しない[27]。この研究は、統合失調症を自己免疫疾患として扱い、それによってインターロイキン6がキヌレン酸経路によって活性化され、統合失調症の症状に大きく寄与しているとする文献が増えていることの一部である[27,165]。
4.8. D-バリン
D-バリンに対する関心は、長年にわたってほとんどなかった。初代神経細胞の培養において、線維芽細胞の成長を阻害することが知られている[166,167]。近年,D-バリンメチルエステルを足場とする新規カンナビノイドであるN-[[1-(5-フルオロペンチル)-1H-インダゾール-3-イル]カルボニル]-3-メチル-D-バリンメチルエステル(5F-ADB)に関心が寄せられている[81]。この薬物は,ヒトに重度の精神病症状を誘発し,時には死に至ることもある。5F-ADBは,カンナビノイド1受容体の活性化を介して脳内ドーパミン神経細胞を活性化することが明らかになった[81]。興味深いことに,この薬物のL-バリン型は依然として毒性があるものの,致死が起こるまでにはより高い投与量を必要とするようである[168,169,170]。
5. 結論
過去5年間、D-アミノ酸に関する研究は豊富に行われていたが、その大部分はNMDA受容体のアゴニストまたはコ・アゴニストとして機能するアミノ酸(D-アスパラギン酸、D-セリン、D-アラニン、D-グルタミン酸)に焦点を当てている。この研究は、主にこれらのD-アミノ酸の供給源と代謝に焦点を当てたものであり、今後の豊富な研究を示唆するものである。特に、D-アミノ酸の生成に役立つ酵素(すなわち、ヒトのアスパラギン酸ラセマーゼ)や、D-アラニンやD-グルタミン酸に関する最近の研究で示唆されたようなD-アミノ酸の代謝に役立つ酵素が、今後どのようにして発見されるかという問題がある[28,29,95,96]。また、最近の研究では、これらの化合物がアルツハイマー病患者の脳内で異なる病態生理学的役割を果たしていることが明らかになっているため、アルツハイマー病の発症・進行におけるこれらのD-アミノ酸の様々な役割を解明するためには、多くの課題がある[33]。さらに、D-セリンが失われ、その結果、NMDA受容体が活性化されると、パーキンソン病という形で神経変性を引き起こす可能性もあるようである。今後、D-アミノ酸がどのようにしてNMDA受容体を調節するのか、また、この調節をどのようにして統合失調症、アルツハイマー病、その他の様々な病態の治療に用いることができるのか、という点に焦点を当てた研究が大半を占めると思われる。
以前は脳内で不活性と考えられていた多くのD-アミノ酸が、最近になって活性を持つことが明らかになった。これには次のようなものがある。(a)D-イソロイシンが認知機能を低下させることなくD-セリンの放出を促進すること、(b)D-ロイシンが抗てんかん薬として発見されたこと、(c)D-スレオニンが海馬内の電流を増強すること、(d)D-チロシンがチロシナーゼを阻害すること、などである。D-フェニルアラニンの炭酸脱水酵素阻害作用と合わせて、D-アミノ酸がさまざまな疾患モデルにおいて神経保護作用を発揮することを示す文献が増えている。
この総説で取り上げた残りのD-アミノ酸は、現時点では脳内での役割が確立されていないが、これらのD-アミノ酸の改変体が医薬品として使用されているように、治療上有用である。D-アルギニン、D-リジン、D-プロリンにはそれぞれ誘導体があり、これらの誘導体は、その基本化合物が脳内で比較的不活性であることを利用して、有益な方法で利用されている。一方、D-トリプトファンやD-システインは、脳内で他の化合物に代謝されるが、その誘導体は、この代謝の阻害剤として(D-トリプトファン)あるいは全く新しい方法で(D-システイン)働く。他のD-アミノ酸は、脳内でほとんど興味深い活動をしておらず、現在はほとんど研究されていないが、将来的には変わるかもしれない。
全体として、脳内におけるD-アミノ酸の最近の進歩は、豊富な神経保護作用や有益な特性を明らかにしており、さらなる研究が必要である。なぜなら、多くの場合、特定のアミノ酸が作用するメカニズムは十分に理解されていないか、まったく不明であり、これらのメカニズムを解明することは、一般的な神経生理学の分野や、特にアルツハイマー病や統合失調症の研究に大きな進歩をもたらす可能性があるからである。
謝辞
J.M.S.はMichael Jenkins氏の有益な議論に感謝している。
略語
NMDA N-メチル-D-アスパラギン酸
DAAO D-アミノ酸酸化酵素(D-amino acid oxidase
DDO D-アスパラギン酸オキシダーゼ
Asc1 アラニン-セリン-システイン-1
TAS1R2/R3 味覚受容体タイプ1メンバー2/3
iNOS 誘導性一酸化窒素合成酵素
R18D 18 アミノ酸ポリ-D-アルギニンペプチド
H2S 硫化水素
D-cis-Fpro Cis-4-[18F]fluoro-D-proline
PET ポジトロン・エミッション・トモグラフィー(Positronic Emission Tomography
5F-ADB N-[[1-(5-フルオロペンチル)-1H-インダゾール-3-イル]カルボニル]-3-メチル-D-バリン メチルエステル