Contents
A systematic review of experimental evidence for antiviral effects of ivermectin and an in silico analysis of ivermectin’s possible mode of action against SARS-CoV-2
pubmed.ncbi.nlm.nih.gov/33427370/
ロバート・T・キノベ リー・オーウェンズ
初出:2021年1月11日 doi.org/10.1111/fcp.12644
資金提供情報
本研究は、公的機関、営利団体、非営利団体のいずれの機関からも資金提供を受けていない。本研究は、日常業務の一環として実施したものである。
要旨
ウイルス感染症は経済的損失の主な原因となっており、新規治療薬に対するアンメット・ニーズがある。イベルメクチンは抗ウイルス化合物であると考えられているが,そのメカニズムは,哺乳類の宿主インポーチンによって促進されるウイルスタンパク質の核内転座を阻害することであり,感染症の伝播に必要なプロセスであると考えられている。
SARS-CoV-2を含むウイルス感染症に対するイベルメクチンの有効性,作用機序,選択的毒性などのエビデンスを系統的に検討した。SARS-CoV-2ゲノムを採取し、イベルメクチンの潜在的な核位置シグナルを決定し、生体内試験のメタアナリシスには、時間、用量範囲、および複数の臓器におけるウイルスの複製に関するすべての比較因子を含めた。
イベルメクチンは、フラビウイルス科、サーコウイルス科、コロナウイルス科を含む多くのウイルスの複製を試験管内試験で阻害した。イベルメクチンの潜在的な標的であるSARS-CoV-2において,実核および模擬核位置シグナルが同定され,インポーチンβの隔離ベイトとなり,感染細胞がウイルス耐性状態に達するのを阻止することが予測された。
薬物動態評価では、試験管内試験に基づいてイベルメクチンを投与すると毒性があることが示されているが、生体内試験では豚のサーコウイルスやマウスのブタヘルペスウイルスに対してウイルス複製の阻害が示されている。イベルメクチン投与群と対照群との全体的な標準化平均差および95%信頼区間は-4.43(-5.81,-3.04)p<0.00001であった。
現在の結果から、イベルメクチンを抗ウイルス剤として再利用する可能性は有望である。しかし,試験管内試験と臨床効果を両立させるためには,さらなる研究が必要である。イベルメクチンの追加抗ウイルス剤としての開発は,有効性が確認された感染モデルを用いた前臨床試験に重点を置いて進めるべきである。
1 序論
イベルメクチン(図 1a)は、ヒトおよび動物におけるさまざまなタイプの寄生虫感染症の治療に臨床承認されている必須の薬剤である。しかし最近では、イベルメクチンの抗ウイルス効果や、ウイルス感染症の治療薬として再利用できる可能性がいくつかの研究で報告されている[1-3]。この分野の科学的研究のほとんどは、哺乳類細胞を感染させることによって試験管内試験で行われており、このアプローチを用いて、多くのウイルスに対する有効性が報告されており、デング熱、西ナイル、黄熱病、およびジカを含むエンベロープ型、ポジティブセンス型、一本鎖フラビウイルスに対する顕著な効果が報告されている[4-8]。
イベルメクチンの抗ウイルス作用のメカニズムとして、ウイルスタンパク質の核内転座を阻害することが提案されており、これは哺乳類の宿主インポーチンによって促進される。このメカニズムに基づき、イベルメクチンはインポーチンα(アルマジロリピート)ドメインに結合し、熱安定性とαヘリシティの構造変化を引き起こしてインポーチンβ-1への結合を妨げる [5, 9]。これは真核生物の細胞に依存するプロセスであり、標的となるカーゴタンパク質の特定の機能に応じて、感染や複製を制限したり、宿主の抗ウイルス応答を増強したりする可能性がある[10]。イベルメクチンによるウイルス複製阻害のこのモードの詳細な説明は、インテグラーゼ酵素を介したヒト免疫不全ウイルス-1(HIV-1)非構造タンパク質5(ウイルスRNA合成のためのポリメラーゼおよび免疫シグナルのための調節因子)を介したデングウイルス、DNAポリメラーゼUL42を介したブタヘルペスウイルス、および非構造タンパク質3(DNAヘリカーゼ酵素)を介した黄熱病ウイルス、デングウイルスおよびウエストナイルウイルスについて示されている[4, 5, 11]。
イベルメクチンがインポーチンαをブロックする証拠の最近の詳細なレビューについては、Jans and Wagstaff [2]を参照されたい。いくつかのウイルスについてこのような詳細な分子特性評価を行ったにもかかわらず、イベルメクチンが有効である可能性のある他のすべてのウイルスにおいて、類似または他の構造的に分岐した核位置シグナルおよび対応する標的カーゴタンパク質が存在し、標的となる可能性があるかどうかは知られていない。さらに、イベルメクチンの試験管内試験抗ウイルス効果が哺乳類の感染症に対する臨床応用につながる可能性はまだ明らかにされていない。抗ウイルス剤としてのイベルメクチンの最近のレビュー [2, 3] は、薬理学的な考慮事項をよりよく理解する必要性を強調している。そこで本研究では、イベルメクチンの抗ウイルス効果に関するすべての論文を系統的にレビューし、SARS-CoV-2の検討を含め、農業および医学における応用を想定したイベルメクチンの質的および量的な抗ウイルス特性について、統合的かつ批判的な評価を提示することを目的とした。
図1
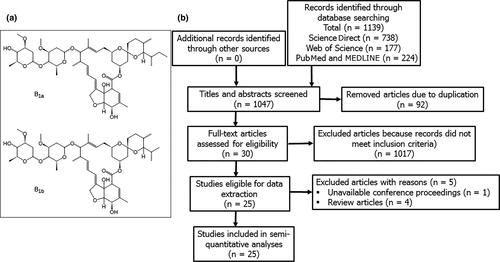
22,23-ジヒドロアベルメクチンB1aと22,23-ジヒドロアベルメクチンB1bのエナンチオマーで表されるイベルメクチンの化学構造(パネルa)と、システマティックレビューとメタアナリシスの優先報告項目(Preferred Reporting Items of Systematic Review and Metaanalyses-PRISMA)のフロー図(パネルb)を示した。
2 材料および方法
2.1 文献検索戦略、研究の包含基準と除外基準
本システマティックレビューは 2009年システマティックレビューおよびメタアナリシスの優先報告項目(Preferred Reporting Items for Systematic Reviews and Meta-Analyses: PRISMA)声明[12]に従って実施された。具体的な目的は、イベルメクチンが感染予防、感染後のウイルス複製、感染誘発死亡率などの抗ウイルス作用を有するかどうかを明らかにすることであった。MEDLINE、PubMed、ScienceDirect、Web of Scienceを含む主要なデータベースを開始日から 2020年8月まで検索した。検索戦略は、ウイルスに対するイベルメクチンの実験的または臨床的使用に関するすべての発表論文を網羅的に検索・分析することであった。具体的な検索語句は、キーワード検索だけでなく、医学的主題の見出しにある(“Ivermectin”) AND (Virus OR Viral Infection)とした。英語の出版物のみを検討し、タイトルと要旨
をスクリーニングして参考文献リストを作成した。また、含まれている研究については、含まれている基準に適合する追加の参考文献を調査した。イベルメクチンの抗ウイルス効果を検討したすべての対照一次研究は、ウイルスの種類や株、使用した試験管内試験培養系や感染モデル、イベルメクチンの投与量や投与経路に関係なく照合された。
2.2 データの抽出と品質評価
詳細な分析とデータ抽出が可能な研究論文は、両方の著者(RTKとLO)によって評価され、適格性が確認された。生データの一部が著者から直接取得された1件の研究を除き、すべてのデータは公表された論文のテキスト、表、図から抽出された[13]。抽出された情報には、ウイルスの種類と株、試験管内試験培養用の細胞の種類、動物の数と年齢、感染条件、観察されたイベルメクチンの質的効果と量的効果が含まれている。哺乳類におけるイベルメクチンの抗ウイルス効果を試験した個々の研究の質的評価は、SYRCLE の動物試験の偏りのリスク[14]に基づく基準によって行われた。これらの評価には、使用した動物の性と年齢、サンプルサイズの評価と正当化、実験群の生成と治療法の割り付けにおける無作為化、実験結果の評価における盲検化、関連する福祉規制と倫理の遵守、および利益相反の引用が含まれる。本稿執筆時点では、SARS-CoV-2 に対するイベルメクチンの 試験管内試験 効果に関する査読付き論文 [28] は 1 本のみであるため、本レビューでは 試験管内試験 試験と 生体内試験 試験の両方を対象としており、ヒト臨床試験(生体内試験 試験のサブセットとして)の査読付き論文は存在しない。
2.3 イベルメクチンの標的としてのウイルスゲノム中の核位置シグナルの同定
多くのウイルスのゲノムが核にアクセスする必要があるのと同様に、多くのウイルスタンパク質も核に入る必要がある。核内へのタンパク質のアクセスは、核内孔複合体(NPC)の「ロック」を介して行われ、核局在化シグナル(NLS)と呼ばれる塩基性アミノ酸(aa)の配列によって「ロックが解除される。これらのNLSは、塩基性アミノ酸のリジン(Lys)とアルギニン(Arg)[15]の配列の伸張であることが最も多く、らせんを破る中性アミノ酸であるプロリン(Pro)グルタミン(Gln)またはグリシン(Gly)に先行することができ、一般的には負に帯電したアスパラギン酸(Asp)またはグルタミン酸(Glu)が先行することがある。NLSは、少なくとも4つの塩基性で酸性でも嵩高なアミノ酸を持たないヘキサペプチドとして、単粒子(表1)(例えば、SV-40 T-抗原)であることができ[16]、らせんを破る残基(Pro、Gln、またはGly)[17]。NLSはまた、少なくとも9aa(例:DNAヘリカーゼQ1)または非古典的(例:Pro-Tyr)で区切られた塩基性アミノ酸の2つのグループを持つ二部作であることができる。これらの塩基性アミノ酸の伸張は、次に、核孔複合体を介して核内へのタンパク質の輸送のために、βインポーチンまたはα-βヘテロ二量体複合体インポーチンに直接結合する。
表1 本明細書で使用される核位置シグナルの定義
| 古典的な単一部分 | 6つのアミノ酸のうち4つは塩基性で、酸性またはかさばるアミノ酸はなく、前にらせんを壊すプロリン(Pro)グルタミン(Gln)またはグリシン(Gly)が続く。負に帯電したアスパラギン酸(Asp)またはグルタミン酸(Glu)たとえばPro-Lys-Arg-Lys-Lys-Val-Arg |
| チェルスキーシーケンス | 4つのアミノ酸、そのうち3つは塩基性で、二塩基性から始まる。たとえば、Lys-Lys / Arg-x-Lys / Arg |
| 古典的な二部グラフ | 少なくとも3つの塩基性アミノ酸のクラスターから少なくとも9つのアミノ酸によって分離された2つの塩基性アミノ酸、例えば、Arg-Lys-15aa-Lys-Arg-Gln-Lys |
デフォルト配列としてNCBI Entrezウイルス型ゲノムを用いた。Zhouら[18]と同様に、ウイルスのオープンリーディングフレーム内の塩基性アミノ酸の伸張領域(表1)を手動で検索し、モチーフを以前に記載されたものと比較した[15]。&」は、Ala、Met、Val、Lue、Phe、Tyr、IleおよびTrpのようなかさばる疎水性のaaに使用した。X’は任意のアミノ酸に使用した。
2.4 データ解析
試験管内での細胞培養試験から抽出したデータをまとめ、以下の結果の項に定性的な記述として記載した。定量的には,イベルメクチンの選択性指標を,ウイルス活性を50%阻害するイベルメクチン濃度(EC50)と,利用された哺乳類細胞の50%に細胞毒性を引き起こす濃度(CC50)の比を求めることで評価した。多細胞生物におけるイベルメクチンの抗ウイルス効果に関する研究を節足動物と哺乳類宿主を含む2つの合理的なグループに層別化した。抽出したデータをメタアナリシスにプールし,RevMan 5.3 ソフトウェアを用いて,ウイルス感染,複製,ウイルス感染誘発死亡率に対するイベルメクチンの全体的な効果の大きさを決定した。利用した感染モデル,検討したウイルスの種類,イベルメクチンの投与量,投与経路,治療期間に顕著な違いがあったため,データ解析は RevMan 5.3 のランダム効果モデルに基づいて行った。データは標準化平均値の差を95%信頼区間で示し,P値<0.05を有意とした。全体の標準化平均差に対する各研究の感度と効果は、メタアナリシスで一般的に使用されるleave-one-outアプローチによって決定された。抽出されたデータの不均一性の程度は、50%以上の値を有意とみなしたI2値から評価した。
3 結果
3.1 試験管内試験に基づくイベルメクチンの抗ウイルス効果の質的・量的検討
データベース検索から合計1139件の研究が同定され、そのうち92件は重複した記録であり、さらなる分析から削除された(図1b)。残りの1047件の研究のタイトルと要旨
は、確立された包含基準に照らし合わせてスクリーニングされ、さらに1017件の論文が削除された。30件の研究が包含基準を満たしていたが、1件のアブストラクトについてはデータにアクセスできず、学会発表として報告されており、4件の研究は一次データのないレビューであった。その結果、合計25件の研究が質的・量的分析の対象となった(表2,3)。イベルメクチンは,細胞培養物を用いた試験管内試験において,以下のような数種のウイルスに 対して,時間および濃度に依存して感染および複製,プラーク形成を阻害することが示された。Arteriviridae, Circoviridae, Coronaviridae, Flaviviridae, Herpesviridae, Paramyxoviridae, Polyomaviridae, Retroviridade and Togaviridae. しかし、2つの研究では、イベルメクチンは、15〜25μMという高濃度では、PAM-pCD163マクロファージにおけるBetaarterivirus感染後の細胞接着および侵入を阻害するが、特異的には阻害しないことが示された[19]、およびMDBK細胞におけるウシヘルペスウイルス1の感染後の細胞接着および侵入を阻害した[20]。イベルメクチンは、U87MGおよびVero細胞におけるベネズエラ馬脳炎ウイルスの感染および複製、ならびに一次神経細胞における馬ヘルペスウイルス1の感染および複製に影響を及ぼさなかった(表2)。ここに報告されている試験管内試験で使用された手順のアプローチおよびシステムに顕著な違いがあるため、我々は抗ウイルス剤としてのイベルメクチンの相対的な効力と安全性のマージンを評価することを求めた。全体として、イベルメクチンは、チクングニヤ、デング熱、ジカ、黄熱病、ブタヘルペスウイルス1,ウエストナイルウイルスの昆人株を含む多くのウイルス種に対して広い試験管内試験安全性マージンを有していた(図2)。対照的に、ポリオマウイルス、Betaarterivirus、ウシヘルペスウイルス1,ニューカッスル病ウイルスおよびウエストナイルウイルスのNY99株に対するEC50値は、哺乳類細胞に対する細胞毒性の範囲内に収まっていた(表2および図2)。黄熱病ウイルスのEC50値は最も低かったが(0.5-5 nM)比較的高いEC50値(0.4-25 μM)が他のウイルスで見られた。利用した哺乳類細胞におけるイベルメクチンのパラレルCC50値は,Vero細胞では5.8±1.1μM,Huh細胞では8.4±0.8μM,BHK細胞では13.6±8.3μMであった(図2)。
表2 細胞培養におけるイベルメクチンの抗ウイルス活性の試験管内試験評価
| 標的ウイルス | 細胞培養システムと条件 | 定量的および定性的効果 | 参考文献 |
|---|---|---|---|
| ウエストナイルウイルス(くんじん; MRM61C株)
ジカウイルス(アジア/クック諸島/ 2014株) デング熱ウイルス-2(ニューギニアC; M29095株)。 |
ベロ細胞、MOI 1で2時間、続いて22時間。(0–10 µM)のイベルメクチン。 | ペスト形成の濃度依存性阻害。
EC 50ウエストナイルウイルス= 0.8μM EC 50 Zikaウイルス= 1.1μM EC 50デングウイルス0.4μM 濃度依存的な複製阻害。 EC 50ウエストナイルウイルス= 0.8μM EC 50 Zikaウイルス= 1.9μM EC 50デングウイルス0.6μM。(n = 2) |
[ 8 ] |
| デング熱ウイルス-1(EU081230)
デング熱ウイルス-2(EU081177) デング熱ウイルス-2(マウス適応S221) |
Huh-7細胞、MOI 0.3で1時間、続いて48時間。(0–10 µM)のイベルメクチン。 | 複製とペスト形成の濃度依存性阻害。
EC 50デング熱ウイルス-1(EU081230)= 3.7 µM EC 50デング熱ウイルス-2(EU081177)= 2.6 µM EC 50デング熱ウイルス-2(S221)= 2.9 µM。(n = 2) |
[ 7 ] |
| デング熱ウイルス-1(EU081230)
デング熱ウイルス-2(EU081177) デング熱ウイルス-3(EU081190) デング熱ウイルス-4(GQ398256) |
BHK-21細胞、MOI 0.3,続いて48時間、
Huh-7セル、MOI0.3が48時間続いた。(0–45 µM)のイベルメクチン。 |
濃度依存的な複製阻害。BHK-21セルの値は次のとおりである。
EC 50デング熱ウイルス-1(EU081230)= 2.32 µM EC 50デング熱ウイルス-2(EU081177)= 2.08 µM EC 50デング熱ウイルス-3(EU081190)= 1.66 µM EC 50デング熱ウイルス-4(GQ398256)= 1.90 µM Huh-7セルの値は次のとおりである。 EC 50デング熱ウイルス-1(EU081230)= 2.97 µM EC 50デング熱ウイルス-2(EU081177)= 1.74 µM(n = 2) |
[ 6 ] |
| 野生型チクングニアウイルス(LR2006 OPY1)
黄熱病ウイルス (17D株) 野生型セムリキ森林ウイルス、 野生型シンドビスウイルス |
BHK-21セル、MOI 0.01,16時間、Huh-7.5セル、MOI0.1,16時間。(0〜300 µM)のイベルメクチン。 | 時間および濃度に依存した複製の阻害。EC 50は、チクングニアウイルスのためにあって評価した。
EC 50 = 0.6μM(n = 3)のBHK-21細胞で EC 50 = 1.9μMのHuh 7.5細胞である。(n = 3) イベルメクチン(3 µM)は、BHK-21細胞のウイルス力価を次のように低下させた。 シンドビスウイルスの2.5ログ値 セムリキ森林ウイルスの3.0ログ値 チクングニアウイルスの3.0ログ値 黄熱病ウイルスの4.0ログ値 |
[ 51 ] |
| 黄熱病ウイルス
(17D株) デング熱ウイルス-2 (ニューギニアC株) |
Vero-B細胞、MOIはデング熱ウイルスで0.4,黄熱病ウイルスで1.0。168時間続いた。
(0〜105 µM)のイベルメクチン |
イベルメクチンはウイルス誘発性の細胞変性効果を阻害した。
EC 50黄熱病ウイルス(17D)= 0.005 µM EC 50デング熱ウイルス-2(ニューギニア)> 1.0 µM |
[ 52 ] |
| 黄熱病ウイルス
(17D株) デング熱ウイルス-2 (ニューギニアC株) ウエストナイルウイルス (NY99; NC-009942) |
デング熱および黄熱病ウイルスのVero-B細胞、MOI 0.1で2時間、続いて96時間。
ウエストナイルウイルスのVero-E6細胞、MOI 0.1–1で2時間、続いて72時間。(0–5 µM)のイベルメクチン。 |
ウイルスひだの時間および濃度依存性阻害。
EC 50黄熱病ウイルス(17D)= 0.0005 µM EC 50デング熱ウイルス-2(ニューギニア)= 0.7 µM EC 50ウエストナイルウイルス(NC-009942)= 4.0 µM イベルメクチン(0.01 µM)は、ペスト形成アッセイで黄熱病ウイルスに対する完全な防御を引き起こした。 |
[ 4 ] |
| デング熱ウイルス-2
(ニューギニアC株) 偽型NL4‐3.Luc.R‐E‐HIV |
デング熱ウイルスのMOIが4のベロ細胞を2時間、続いて72時間、Hela細胞の200 ng(カプシドタンパク質相当)を2時間、続いて72時間。
イベルメクチン(25&50 µM)。 |
濃度依存的な複製阻害。
25および50µMのイベルメクチンはデング熱ウイルスの産生をそれぞれ73%および100%阻害した。 25および50µMのイベルメクチンはHIVウイルスの産生をそれぞれ36%および57%阻害した。(n = 4) |
[ 5 ] |
| ジカウイルス(PRVABC59株) | ベロ細胞、MOI 0.1で1時間、続いて96時間。10 µMのイベルメクチン。 | イベルメクチン(10 µM)は、ウイルス力価を
1.5ログ値。 |
[ 53 ] |
| ジカウイルス
(カンボジア、FSS13025) |
C6 / 36ヒトスジシマカクローン、MOI 0.5,1時間、続いて5日間。イベルメクチンは2および10µMでテストされた。 | 濃度依存的な複製阻害。
2および10µMのイベルメクチンはウイルス産生をそれぞれ34%および62%阻害した。EC 50 > 2 µM。(n = 3) |
[ 23 ] |
| ブタサーコウイルス-2(SH1株) | PK-15細胞、MOI 10で1時間、続いて48時間。(57および114 µM)のイベルメクチン。 | 時間および濃度に依存した複製の阻害。57 µMのイベルメクチンでは24時間で59%、48時間で72%減少し、114 µMのイベルメクチンでは24時間で81%、48時間で84%減少した。(n = 3) | [ 25 ] |
| ヘンドラウイルス
(オーストラリア/馬/ 1994) |
ベロ細胞、MOI 0.05,2時間、続いて24時間。(0–10 µM)のイベルメクチン。 | 濃度依存的な複製阻害。ウイルス力価は、10 µMのイベルメクチンで5log値減少した。EC 50 = 2.0 µM。(n = 3) | [ 54 ] |
| Betaarterivirus
(豚繁殖・呼吸障害症候群ウイルス) (VR‐2332) |
PAM-pCD163マクロファージ、MOI 1で1時間、続いて48時間。(0–15 µM)のイベルメクチン。 | ウイルス複製の時間および濃度依存性阻害。EC 50 = 6.7 µM。
15 µMのイベルメクチンでは、感染と複製の両方が95%減少した。 吸着と細胞侵入に影響なし(n = 3) |
[ 19 ] |
| 野生型BKポリオーマウイルス(BKPyV) | RPTE細胞、10 4ゲノム/細胞のMOIを1時間、続いて24時間。イベルメクチンは10µMでテストされた。 | 10 µMのイベルメクチンはウイルス複製を50%阻害した。(n = 3) | [ 55 ] |
| ベネズエラ馬脳炎ウイルス(VEEV TC83) | U87MGセル、MOI 0.1–1,24時間追跡。
ベロ細胞、MOI 0.1–1,24時間続いた。イベルメクチンは1µMでテストされた。 |
1 µMのイベルメクチンは、U87MG細胞の感染後16時間および24時間でウイルス複製を30%阻害した。ベロ細胞では阻害効果は観察されなかった。ペストアッセイのウイルス力価は、Vero細胞とU87MG細胞の両方で感染後24時間では影響を受けないでした。 | [ 9 ] |
| ベネズエラ馬脳炎ウイルス(VEEV TC83) | ベロ細胞、MOI 0.1,続いて16時間。イベルメクチンは1µMでテストされた。 | ベロ細胞の感染後16時間のペストアッセイではウイルス力価に有意な影響はない。(n = 3)。 | [ 56 ] |
| ウシヘルペスウイルス1型(IBRV HB06株) | MDBKセル、MOI 0.1–1で1時間、続いて48時間。イベルメクチンは(0–25 µM)でテストされた。 | ウイルス複製の用量依存的阻害。
ウイルス力価は4log値減少し、25 µMのイベルメクチンでビリオン産生が約50%阻害された。ウイルスの付着や細胞への侵入には影響しない。(n = 3)。 |
[ 20 ] |
| 馬ヘルペスウイルス1型(Jan-E株)および(Rac-H株) | 初代マウス神経細胞、MOI 0.3で1時間、続いて24時間。イベルメクチンは(0–75 µM)でテストされた。 | EHV-1(Rac-H株)の複製には影響しない。EC 50 EHV-1(月-E株)については、>100μmでした。 | [ 57 ] |
| Suidヘルペスウイルス1 | BHK-21細胞、MOI 0.01で1時間、続いて16〜72時間。(0–2.5 µM)のイベルメクチン。 | ペスト形成の時間および濃度依存性阻害。ウイルス力価は、72時間で0.5,1.0,および1.5 µMのイベルメクチン濃度で23%、68%、および70%減少した。
吸着と細胞侵入に影響なし(n = 3) |
[ 11 ] |
| 重症急性呼吸器症候群コロナウイルス2
(SARS-CoV-2 (Aus / VIC01 / 2020) |
Vero / hSLAM細胞、MOI 0.1で2時間、続いて72時間。イベルメクチンは(0–10 µM)でテストされた。 | ウイルス複製の時間および濃度依存性阻害。
細胞関連ウイルスE遺伝子EC 50 = 2.8μM 細胞関連ウイルスRdRp-geneEC 50 = 2.5 µM (n = 3)。 |
[ 28 ] |
| ニューカッスル病ウイルス
(LaSotaワクチン株) |
9日間のニワトリ胚、50%の卵感染量、6時間の追跡。(0–229 µM)でテストされたイベルメクチン | ウイルス複製の用量依存的な減少。
LOG2低減EC 50 =(71±33)μM(N = 5)。 |
[ 58 ] |
表3 多細胞生物におけるイベルメクチンの生体内抗ウイルス活性の評価
| ウイルスと無脊椎動物の宿主を標的にする | 感染条件 | 定量的および定性的効果 | 参考文献 |
|---|---|---|---|
| ジカウイルス(カンボジア、FSS13025) | ネッタイシマカは感染した血液MOI = 0.5を与えた。ウイルス複製は感染後7日の中腸で評価された。10nMのイベルメクチン。 | イベルメクチンは有意な殺蚊効果を示したが、感染から7日後のネッタイシマカにおけるジカウイルスの感染と複製には影響を与えなかった。コントロール:10 4(10 3 –10 5)PFU /中腸、イベルメクチン:10 4(10 2 –10 5)PFU /中腸(n = 15) | [ 23 ] |
| ウエストナイルウイルス(コロラド株) | 野生のアカイエカは、イベルメクチンで処理された鳥用エサ(200 mg / kg食餌)またはパンデミック地域の対照でパイロットフィールド試験サイトにロックダウンられた。 | イベルメクチンは鳥の健康に影響を与えなかったが、著しく殺蚊性でした。イベルメクチンは、Culex tarsalisプールの数と平均感染率(MLE)に影響を与えなかった。コントロール:14(4–24)イベルメクチン:5(0–9)(n = 136–1316) | [ 24 ] |
| デング熱ウイルス-2 | ヒトスジシマカ(3〜5日)の幼虫に、デング熱ウイルスで汚染されたヒトの血液を4日間、次に血液中のイベルメクチンを(0〜64 ng / mL)で6日間与えた。 | (16,32,64)ng / mLで、イベルメクチンはヒトスジシマカのウイルス複製を大幅に減少させた。コントロール:85(81–90)%、イベルメクチン64 µg / mL:43(40–45)%。
イベルメクチンはウイルス複製を有意に抑制した。64 ng / mLでは、ウイルスコピー/ mLが100(84–100)%減少した(n = 61–65) |
[ 21 ] |
| ブルータングウイルス
(BTV-17) パンデミック性出血性疾患ウイルス(EHDV-2) |
雌のCulicoidessonorensisに、ウイルスと混合したイベルメクチン処理動物の血液を与えた。
7log10 TCID 50 EHDV-2及びヘラジカの血液中に200μg/ kgのイベルメクチン。 7log10 TCID 50 BTV-17及び400μgの/ kgのイベルメクチンヒツジ血液である。 |
イベルメクチンはBTV-17の感染と播種を有意に減少させた。コントロール:60%、イベルメクチン400 µg / kg:18%。イベルメクチンはEHDV-2の感染と播種に影響を与えなかった。コントロール:40%、イベルメクチン200 µg / kg:38%(n100)。 | [ 13 ] |
| ザリガニのギルパルボウイルスとザリガニのパルボ様ウイルス | 既存の鰓パルボウイルスを含む淡水ザリガニにイベルメクチン(3,6,7 µg / kg、筋肉内)を投与した。
イベルメクチン(7 µg / kg、筋肉内注射)も、パルボ様ウイルスの実験的感染の前、同じ日、および後に投与された。 |
イベルメクチンは、既存のパルボ様ウイルスを有するザリガニの鰓の肥大した核の数を減少させた(68%)。
コントロール:1591±392.33 イベルメクチン3µg / kg:1039.85±383.96 イベルメクチン7µg / kg:671±379.07 (n = 20)。イベルメクチンは、パルボ様ウイルスによる実験的感染後、ザリガニの寿命を適度に延長した。 |
[ 22 ] |
| ウイルスと脊椎動物の宿主を標的にする | |||
| ブタサーコウイルス-2(SH1株) | (30日齢)子豚は(5×10感染していた4 TCID 50 IM)。感染後2,4,6日目のイベルメクチン(0.2 mg / kg im)。21日間モニタリング | イベルメクチンは複製を減少させた。血清、脳、心臓、腎臓、肝臓、肺、脾臓、リンパ節のウイルスコピー/力価。21日目の血清ウイルスコピー。コントロール:5.1(4.9–5.5)log10,イベルメクチン:2.4(2.0–2.9)log10(n = 3) | [ 25 ] |
| ジカウイルス(セネガル株) | 5週齢のIFNAR1 – / –マウスは、10を感染させた3足蹠にPFU。イベルメクチン(4 mg / kg、ip)感染前2日、感染後1,2,4日。 | イベルメクチンは感染を予防したり、死亡率を抑制したりしなかった。コントロール:100%の死亡率、
イベルメクチン= 100%の死亡率(n = 7–8) |
[ 26 ] |
| Suidヘルペスウイルス1 | 雌のBALB / cマウス(6〜8週齢)が感染した(〜10 6 TCID50 / mL)。感染時または感染後12時間のイベルメクチン(0.2mg / kg)。10日間のモニタリング。 | イベルメクチンは複製を阻害した。脳と腎臓のウイルスDNAコピー/力価の低下。7日目の死亡率の低下。
コントロール:100%、イベルメクチン(12時間)= 50% イベルメクチン(0時間)= 40%(n = 10) |
[ 11 ] |
図2 異なる哺乳類細胞株におけるウイルス感染症に対するイベルメクチンの選択性指数の定量的評価のプロット
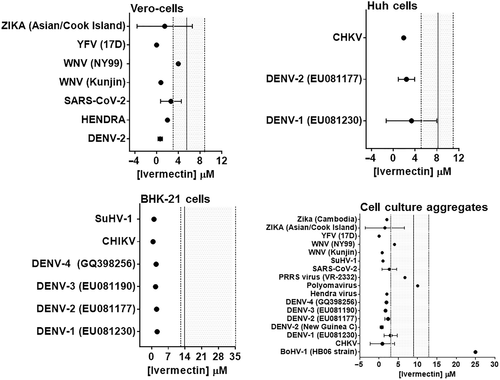
データポイント(実線円)は、ウイルス活性を50%阻害したイベルメクチンの平均±SDまたは単濃度値(EC50)を示す。実線の縦線および網掛け部分は、それぞれ、利用された哺乳類細胞の50%で細胞毒性を引き起こしたイベルメクチンの濃度の平均値および95%CIを表す。高い選択性は、95%信頼区間の外側と左側のEC50値で示されている。BHK-21,ベビーハムスター腎細胞、Huh、ヒト肝細胞、Vero、サル腎上皮細胞、BoHV、ウシヘルペスウイルス、CHKV、チクングニアウイルス、デングウイルス、デングウイルス、PRRS、Betaarterivirus、SARS-CoV-2,重症急性呼吸器症候群コロナウイルス、SuHV、ブタヘルペスウイルス、WNV、ウエストナイルウイルス、YFV、黄熱病ウイルス、Zika、ジカウイルス。
3.2 動物を用いた生体内試験に基づくイベルメクチンの質的・量的抗ウイルス効果
動物では、蚊、咬みつきミミズ、ザリガニなどの節足動物の感染モデル、マウスやブタなどの哺乳類宿主を含めて、イベルメクチンの抗ウイルス効果が検討されている(表 3)。イベルメクチンは節足動物に影響を与えないナノモルからマイクロモルの幅広い濃度で,Aedes albopictus [21] のデングウイルス,Culicoides sonorensis [13] のブルートンウイルス,およびザリガニのパルボウイルス [22] の感染および/または複製を有意に抑制した。しかし,イベルメクチンはAedes aegyptiのジカウイルス[23],Culex tarsalisのウエストナイルウイルス[24],Culicoides sonorensisのEpizootic haemorrhagic diseaseウイルスの感染及び散布には効果がなかった(図3)。哺乳類宿主において、イベルメクチン 0.2 mg/kg を 2~6 日間投与すると、子豚では 21 日間にわたり、脳、肝臓、心臓、腎臓、脾臓、リンパ節などの内臓臓器におけるポルシン・サーコウイルスの複製が抑制された[25]。0.2 mg/kg のイベルメクチン単回投与では感染は防げなかったが、マウスでは脳や腎臓での Suid ヘルペスウイルスの複製を抑制し、感染後 7 日目の死亡率を抑制した[11]。ある研究では、イベルメクチン4mg/kgを感染前2日、感染後1日目、2日目、4日目に投与しても、マウスのジカウイルスによる感染や死亡率は予防されなかったと報告されている[26]。ここで検討したすべての動物実験で有意な不均一性があった(I2 = 98%; p < 0.00001; 図3)。これらのデータは、個々の研究の精査と適格性の確認を必要とするが、プールされたメタアナリシスは、上記に概説されたイベルメクチンの抗ウイルス効果が統計的に有意であることを示した。イベルメクチンとそれぞれの対照との標準化平均差および95%信頼区間は、節足動物の試験では-3.95(-5.60,-2.30)(Z = 4.69; p < 0.00001; 図3)哺乳類の試験では-5.71(-8.91,-2.51)(Z = 3.50; p < 0.0005; 図3)であった。
図3 節足動物および哺乳類モデルにおけるさまざまなウイルスの感染および伝播に対するイベルメクチンの効果を示すフォレストプロット
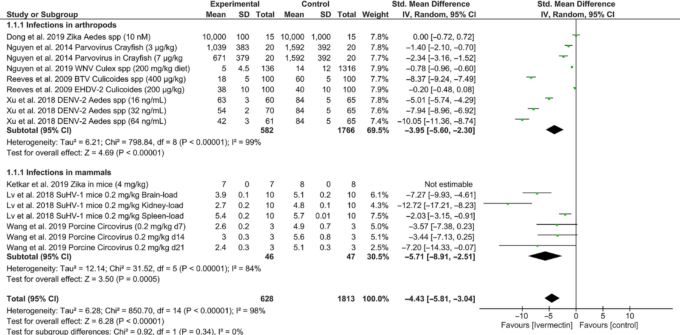
メタアナリシスには、節足動物における感染についての4件の研究と哺乳類宿主についての3件の研究が含まれている。データには、経時的なすべての比較因子、用量範囲、および示された場合には複数の器官におけるウイルス複製の評価が含まれている。比較は標準平均差およびランダム効果モデルを用いて行われた。BTV、ブルートンゲウイルス、デングウイルス、デングウイルス、EHD、Epizootic haemorrhagic disease virus、SuHV、Suid herpesvirus、WNV、West Nile virus、および Zika、Zika virus。
3.3 調査対象ウイルスのゲノム中の核位置シグナルの同定
イベルメクチンの作用機序は,核孔複合体を介してウイルスタンパク質の核内への移行を助けるインポーチンα(序文参照)の作用を阻害することが示されたので,このウイルスタンパク質の移行に必要な核内ロケーションシグナル(NLS)の役割について検討した。イベルメクチンを細胞培養したウイルスに対する研究のうち、16.6%はDNAゲノムを持つウイルスであったが、残りは驚くべきことに、フラビウイルス科(59%)に支配されたRNAウイルス(84.4%)特にデングウイルスでした(表2)。Pryorら[27]がデングウイルスの複数のNLS、特にタンパク質N5を実証し、Wagstaffら[5]がイベルメクチンがデングウイルスの複製を明確にブロックできることを示したので、これは驚くべきことではなかったかもしれない。デングウイルス2のタンパク質を解析したところ、10種類の主要なタンパク質のうち4種類が核内への移行を可能にする可能性のあるNLSを持っていることがわかった(表4)。このことは、我々の解析ではフラビウイルスが優勢であることを説明しているのかもしれない。
表4 デング熱とSARS-CoV-2ウイルスにおける可能性のある核位置シグナル
| ウイルス | タンパク質5’–3 ‘方向 | 可能な核位置信号 |
|---|---|---|
| デング熱ウイルス2 | 固定されたカプシドタンパク質 | 4 Q RKK A K ; 67 KR WGT I KK S K ; 73 KK S K AINVLRGF RK EIGRMLNILN RRRR S |
| NC_001474.2 | 膜糖タンパク質前駆体 | 199 EH RR E KR S |
| エンベロープタンパク質 | 無し | |
| 非構造タンパク質NS1 | 無し | |
| 非構造タンパク質NS2A | [ 1399 S R TS KKR \ S] | |
| RNAヘリカーゼNS3 | 1616 D KKGK ; 1659 RKRR ; 1931 Q RR G R ; 2062 E RKK L K | |
| 非構造タンパク質NS4A | 無し | |
| プロテイン2K | 無し | |
| 非構造タンパク質NS4B | 無し | |
| RNA依存性RNAポリメラーゼNS5 | 2862 KK LMKITAEWLWKELG KKK ; 2948 KR E KK ; 3378 KR F RR | |
| SARS-CoV-2 | ORF1ab; (nsp8) | 3148 KK V K ; 3688 KK I K ; 3952 KK ‐21aa‐ KK C K ; 4156 RK ‐15aa‐Q RK Y K ; |
| NC_045512.2 | 4960 KK W K ; 11932 KK L KK ; 11995 RK ‐20aa‐ D KR A K ; | |
| 遺伝子S | 無し | |
| ORF3a | 無し | |
| 遺伝子E | 無し | |
| 遺伝子M | 無し | |
| ORF6 | 無し; 餌のシーケンス | |
| ORF7a | 無し | |
| ORF7b | 無し | |
| ORF8 | 無し | |
| 遺伝子N | 742 KK SAAEAS KK P R Q KR ; 1104 P KK D KKKK ; [ 1147 PQ R Q KK ] | |
| ORF10 | 無し |
基本的なアミノ酸は太字で表示されているが、おそらく混乱するかさばると疎水性のアミノ酸は赤で表示されている。アミノ酸コードは、スペースを効率的に利用するために一文字のフォーマットである。
Calyら[28]の結果は、SARS-CoV-2に対するイベルメクチンの限界的な選択的活性を示した(図2)。このことから、SARS-CoV-2のタンパク質にはNLSが存在し、同様のメカニズムが働いているのではないかという仮説を立てた。重症急性呼吸器症候群コロナウイルス(SARS-CoV-1)のオープンリーディングフレーム6(ORF6)(NCBIのエントリーではORF7)を徹底的に調査したところ、その3′モックNLSはインポーチンβのための隔離ベイトであり、5′末端は粗小胞体/ゴルジ装置の膜に膜固定されていることが実証された[29]。これは、インポーチンβの隔離をもたらし、STAT1シグナル伝達機能をダウンレギュレートし、インターフェロン調節因子(IRF)遺伝子を介して細胞がインターフェロンγを産生するのを阻止した。これにより、細胞がウイルス耐性状態になるのを防ぐ。SARS-CoV-2のORF6は、61個のアミノ酸(aa)のうち42個についてはSARSと同一であり、61個のaaのうちさらに12個については類似(機能的、非相同置換)している(図4)。3′末端で疎水性のAlaを置換することにより、Friemanら[29]は、重要なモチーフはaa(49-53)であるが、aa(54-58)またはaa(59-63)ではないことを実証した。この領域の検討は、Lys+Lys46から型破りなTyr+Pro63モチーフにまたがる二部作のNLSの可能性を示している(材料と方法を参照)。実験的な5つのAlaの疎水性系列は、主要な塩基性デュオであるLys-Lysのすぐ後ろにあり、したがって、この領域での結合と機能性を混乱させる[29]。SARS-CoV-2領域は、9/16 aaではSARSと同一であり、5/9 aaでは類似しており、インポーチンβに対するほぼ同様のベイト/モックNLS活性を予測している(図4,表4)。異常なのは、SARS-CoV-2 ORFが2 aa短く、末端のTyr-Proが欠落していることである。NCBI GenBankにあるすべてのSARS-CoV-2 ORF6配列のチェック(2020年8月)では、すべてここで終了しており、これは本物であり、株のアーティファクトではなく、シーケンスエラーでもないことを示している。しかしながら、いくつかの要因は、これが全くNLSとして作用しているのではなく、Arg/Lys38以降の正電荷テール(エサの隔離)を持つ模擬NLSとして作用し、インポーチンティングβをトラップし、効果的にダウンレギュレーションしていることを示唆している。 これらの要因は、可能性のあるNLS配列の非型破りな性質、リーディングLys-Lys46がGlu-Asn46に変更されたSARS-CoV-1からのSARS-CoV-2の変更、および、型破りなTyr-Pro63のトレーリング二部分シグナルの損失を含む。
図4 重症急性呼吸器症候群コロナウイルス(SARS-CoV-1)およびSARS-CoV-2のオープンリーディングフレーム6(ORF6)(NCBIエントリーではORF7)におけるNLSの図
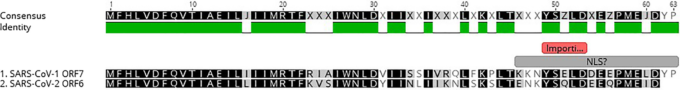
SARS-CoV-2のORF6は、61個のアミノ酸(aa)のうち42個でSARS-CoV-1と同一であり、61個のaaのうちさらに12個で類似(機能的非相同置換)していた。SARS-CoV-2のNLSは9/16 aaでSARS-CoV-1と同一であり、5/9 aaでは類似していた。小さな赤枠は、かさばるAlaの置換によって実験的に破壊された領域を示している[27]。
自然免疫応答を回避するコロナウイルスにおけるこの短いタンパク質の明らかに重要な役割は、このタンパク質が、SARS-CoV-2の検査のためにスワブをした後に鼻腔内スプレーを介してリポソーム中に送達される小型干渉RNA(siRNA)分解の主要な標的となることにつながるだろう(La FauceおよびOwensのレビューを参照のこと)[30]。Formigaら[3]は、マイクロおよびナノ粒子のための他の可能な送達システムを概説している。より長持ちする治療法が必要な場合は、プラスミド中に送達された短いヘアピンRNA(shRNA)で代用することも可能である[30]。実際、Shiら[31]は、Vero細胞においてSARS-CoVの構造タンパク質に対してsiRNAが有効であることを示しており、70%の減少を示している。siDirectバージョン2.0[32]を使用してsiRNAを標的化するためのORF6配列を迅速に解析したところ、Friemanら[29]によって活性に重要であると同定された領域の3′ベイト/モックNLSを切断して分解する、オフターゲット効果が低減された136-158 bpの1つを含む複数の候補が同定された。
SARS-CoV-2の制御に向けたコロナウイルスに対する抗ウイルス剤に関する最近のレビュー論文では、ORF6を標的とした薬剤は同定されていない[33]ので、上記の情報を考えると、これは抗ウイルス剤のための実りある標的である可能性があることを示唆している。ORF1abでは、7つの潜在的なNLSが同定された(表4)。興味深いことに、3952(Lys-Lys-21aa-Lys-Cys-Lys-Lys)の二部作以外のすべてのNLSは、おそらくNLSとして動作することを妨げるであろう、チェルスキーシグナルの中に破壊的なバルキーまたは疎水性のaaを持っている。それは、進化の圧力がこれらのNLSを沈黙させたかのように見えるので、ウイルスタンパク質は核内に隔離されていない。一方、3952NLSが機能しない論理的な理由は見当たらないので、翻訳されて切断されたタンパク質であるnsp8は、インポーチンαによって時々核内に移動することになる。 したがって、イベルメクチンは、nsp8の核内への移動を遅らせる役割を持っているはずである。しかし、nsp8の役割は、ウイルスの複製に必要な高度に保存されたウイルスRNA依存性RNAポリメラーゼ[34]であるnsp12へのコファクターとしてnsp7と一緒に作用することである。Nsp8はいくつかのDNAおよびRNA結合残基を持っており[34]、細胞内のDNAの主要な供給源である核内のDNAとの未検出の役割を示唆している可能性がある。この役割は、ウイルス複製のためのヌクレオチドを採掘することにあるのではないかと推測されている。
ヌクレオカプシドタンパク質をコードする遺伝子N(表4)は、基本的なaa(742aa以降)の広い領域に多くの強い潜在的なNLSが存在しており、その中には、最初の2つのLysの後にGluを持つ基本的なLysのチェルスキー様式とヘキサペプチド列の両方がある。しかし、無傷のNタンパク質の共焦点顕微鏡を使用して、我々自身とRowlandら[35]によって発見された同じまたは類似のNLSが同定されたにもかかわらず、核や核葉に見られるSARS-CoV-1コロナウイルスヌクレオカプシドタンパク質の証拠はなかった[35]。Wolffらによる電子顕微鏡を用いた素晴らしい論文[37]では、ヌクレオカプシドタンパク質は細胞質に存在し、二重膜を持つウイルス複製オルガネラからウイルスRNAを取り込んでいる。すべてをまとめると、正に帯電した模擬NLSがウイルスRNAの負に帯電したリン酸塩バックボーンを捕捉し、コートして、細胞質でのウイルスの形成を開始する可能性が高いと考えられる。したがって、無傷のNタンパク質[35]中のこれらのモックNLSは、細胞質中のウイルスRNAによって直ちに隔離されるため、NLSとして機能する機会を持っていない。
4 考察
本研究では,イベルメクチンの定性および定量的な抗ウイルス特性を批判的に評価し,統合的なレビューを行った。試験管内試験では,確立されたEC50値に基づくイベルメクチンに対する感受性は,ウイルス株に依存する場合があるように思われた(表1および図2)。例えば,ウエストナイルウイルスのKunjin株はNY99株よりも感受性が高く,ウイルス複製のEC50値に5倍の差があった。同様に、異なる哺乳類細胞における相対的な効力と安全性の余裕を評価した結果、イベルメクチンは、ベタアルテウイルス、ベネズエラ馬脳炎ウイルス、馬ヘルペスウイルス1およびウシヘルペスウイルス1に対して選択的な抗ウイルス活性を示さなかったことが明らかになった。これらの種や株のイベルメクチンに対する感受性の違いについては、明確で明白な理由はないが、これは、少なくとも一部では、イベルメクチンの分子標的の特異的な違いに起因している可能性がある。
もう一つの重要な考慮点は、イベルメクチンの効力、相対的選択性、毒性に関するものである。我々が行った試験管内試験の評価では、Vero, Huh, BHK細胞を用いたex vivo哺乳類細胞感染モデルにおいて、イベルメクチンはいくつかのウイルスに対して選択性を示すことが示された。しかし、ほとんどのウイルスで50%の複製を阻害するために必要なマイクロモル濃度範囲は、懸念の原因となる可能性がある。イベルメクチンの臨床的に承認された製剤は、経口、皮下、筋肉内、または局所に投与することができ、推奨投与量は、種および製剤、および適応される臨床用途に応じて、ヒトでは150~200μg/kg、動物では6~500μg/kgの範囲である。この用量範囲では、薬物動態学的特性解析により、到達可能なピーク血漿中濃度は用量とともに増加し、イヌでは3~48 ng/mL、ウマでは21~82 ng/mL、ブタでは7~40 ng/mL、ヒツジでは9~60 ng/mL、ウシでは12~133 ng/mL、ヒトでは20~81 ng/mLの範囲になることが示されている[38~40]。健康なヒトを対象としたイベルメクチンの増量投与の安全性及び忍容性に関する研究では、臨床的に推奨される用量(200μg/kg)の10倍の単回投与量(120mg)は忍容性が高く、248 ng/mLに相当するピーク血漿中濃度と19時間の排泄半減期が得られたことが示されている[41]。同様に、集団ベースの薬物動態モデリングにより、イベルメクチンを600μg/kgで3日間経口投与した場合、最大血漿中濃度中央値は105~119 ng/mL(0.12~0.14 μM)排泄半減期は3~5時間であることが明らかになった[42]。これらのデータは、極めて高用量のイベルメクチンを使用しても、到達可能なピーク血漿中濃度は、ほとんどのウイルスの試験管内試験で確立された EC50 濃度よりも著しく低いままであることを示しているが、駆虫活性に最適な 0.5-1 ng/mL よりも有意に高いことを示している。極端に高用量のイベルメクチンを使用すると、ウイルス感染症ではしばしば見られるように、ポリファーマシーを必要とする患者において有害な薬物間相互作用が生じる可能性が高くなると考えられる[2, 43]。したがって、試験管内試験で不死化された新生物細胞株を利用することで、イベルメクチンの選択性を効果的に決定し、生体内試験でのウイルス感染症に対する潜在的な臨床効果を表すことができるかどうかは不明である。したがって、イベルメクチンを抗ウイルス剤として再利用する場合には、試験管内試験実験に基づいて確立された抗ウイルス特性を、生体内試験の動物感染モデルで検証済みのものを用いて批判的に評価する必要がある。我々は、限られた数の研究で、多細胞生物におけるイベルメクチンの抗ウイルス効果を検討したことを示す。ほとんどの試験は節足動物の感染モデルで行われており、哺乳類を対象とした実験研究は 3 件のみであり、ClinicalTrials.gov に掲載されている SARS-Cov-2 [2] およびデングウイルスに対するヒト試験はいくつか登録されているが、まだ結論は出ていない。プールされたメタアナリシスでは全体的に有意な抗ウイルス効果が示されていることから、総合的な有効性データは有望である。(表2および図3)。しかし、これらのデータを解釈する際には注意が必要である。どのウイルス種や動物種を対象とすべきか、最適な投与レジメンは何か、どのようなコストや便益が生じるのかなど、より広範な疑問に基づいて適用可能かどうかが決まる。これらすべての疑問はともかくとして、いくつかの個別の研究のメリットと応用の可能性は注目に値する。例えば、既存の鰓パルボウイルスを有する Cherax quadricarinatus ザリガニを対象とした研究では、非毒性で忍容性の高いイベルメクチンの筋肉内投与量(3~7 µg/kg)により、この感染症に伴う病変が有意に減少した [22]。このウイルス感染は、養殖エビなどの養殖甲殻類における経済的損失の重要な原因であるため、この選択的抗ウイルス活性は、感染を制御するための追加のツールを提供する可能性がある。特にエビやザリガニへの適用試験では、商業的に実行可能で、大規模投与に適し、公衆衛生上の懸念を最小限に抑えたイベルメクチンの処方と投与レジメンを検討する必要があるだろう。
もう一つの有望な展望は、節足動物のベクター内でのアルボウイルスの感染、複製、感染を標的としたイベルメクチンの応用である。節足動物媒介ではないイベルメクチンをナノモル濃度で投与すると、Culicoides sonorensis のブルートンウイルスや Aedes albopictus 蚊のデングウイルスの感染と伝播が有意に減少することが示されている(表 3,図 3)。対照的に、イベルメクチンで処理した血液を給餌する同様の戦略では、ナノモル濃度のイベルメクチンは、Culex tarsalis、Aedes aegyptiおよびCulicoides sonorensisに対して節足動物駆除効果を示したが、それぞれウェストナイルウイルス、ZikaウイルスおよびEpizootic haemorrhagic diseaseウイルスのベクター内感染率および複製には有意な影響を及ぼさなかった(表3)。イベルメクチンは、農業分野では家畜のダニ、ダニ、ハエ、シラミの防除、ヒトおよびコンパニオンアニマルでは疥癬およびフィラリア症の防除の効能・効果が既に承認されている。ヒトでは、フィラリア感染症の治療に使用されるイベルメクチンの推奨用量(150 mg/kg)の血漿中濃度は、アノフェレス蚊の生存とマラリアの感染を有意に減少させた [44-46]。節足動物におけるイベルメクチンの抗ウイルス効果が実証されていることを考えると、臨床的に承認された用量のイベルメクチンをヒトや家畜に投与することで、節足動物の媒介者の数を減らし、感染率を低下させるとともに、感受性が実証されているブルートンゲウイルスのようなアルボウイルスの感染率を低下させることも、並行して応用できる可能性がある。興味深いことに、イベルメクチンをヒトに単回投与した後の血漿中ピーク濃度(40~45 ng/mL)は、ヒトスジシマカのデングウイルスの複製を減少させるのに有効な濃度範囲(16~64 ng/mL)とほぼ一致している[21]。哺乳類の病気を制御するためのこの特定の用途には可能性があるが、アルボウイルスや関連する病気を制御するための戦略的ツールとしてイベルメクチンを使用することは、健康、社会的、経済的な直接的な利益を批判的に評価してからでないと効果的ではない。このような詳細な疫学的・経済的評価は今回のレビューの範囲を超えているが、アルボウイルスに関連した経済的損失が大きいことを考えると必要である。ブルータングウイルスの感染による乳量の減少、体調不良、獣医学的治療や診断、死亡率の低下に起因する世界の家畜の年間経済損失は、30 億米ドルと推定されている[47]。ヒトでは、年間5,840万人の症候性デングウイルス感染があると推定され、年間90億米ドルの世界的コストがかかっている[48]。
脊椎動物、哺乳類のウイルス感染モデルでは、抗ウイルス剤としてのイベルメクチンの効果が検証され、現在までに3件の査読付き研究で報告されているのみである[11, 25, 26]。これら3つの研究から得られたデータをまとめてみると、強い一般的な抗ウイルス効果が示されているが、個々の研究から得られた結果はこれまでのところ明らかではない。5週齢のIfnar1//-マウスを用いたセネガル型ジカウイルス感染1日前と感染後3日間の高用量(4mg/kg)では、イベルメクチンは感染を抑制せず、死亡も防止しなかった[26]。薬物動態学的評価と、試験管内試験でジカウイルスに対して有効であったマイクロモル濃度と一致するように、イベルメクチンの投与量をはるかに多くする必要があることに基づけば、この結果は驚くべきことではなく、実験動物を用いたこのウイルスに対する前臨床試験のフォローアップ試験の妨げになるように思われるかもしれない。しかし、この特定の研究には多くの制限があり、個々の研究の質的評価では悪いランクになっていることは注目に値する。この試験は、ホモ接合型インターフェロン アルファ/ベータ受容体サブユニット遺伝子ノックアウトを持つ比較的若いマウスを用いて行われた(序論を参照)。
本来、これらのマウスはウイルス感染に対して非常に感受性が高く、これがイベルメクチンを投与したにもかかわらず、試験されたマウスの数が少ない場合の顕著な死亡率の一因となっている可能性がある。さらに、この研究では、イベルメクチン投与に対する組織ウイルス負荷を評価しておらず、死亡率が本当にジカウイルスの感染によるものであるかどうかも確認していない。これらの議論は、異なるウイルスと感染モデルの動物を用いた2つの生体内試験で得られた対照的な結果から、少なくとも部分的には裏付けられているようである。6~8週齢のBALB/cマウスと30日齢の子豚において、イベルメクチン(0.2 mg/kg)は、それぞれSuidヘルペスウイルスとPorcine circovirusに感染した後の内臓臓器における複製とウイルスDNAコピーの有意な減少を引き起こした [11, 25]。興味深いことに、これらのデータは、PK-15細胞でのPorcine circovirusとBHK-21細胞でのSuidヘルペスウイルスのウイルス複製を阻害するためにマイクロモル濃度のイベルメクチンが必要とされた試験管内試験の結果とは一致しない。このことは、ある種のウイルス感染症では、現在推奨されている治療用量でのイベルメクチンは、たとえ試験管内試験での有効濃度に達成できなくても、毒性を引き起こさず、生体内試験で有効性を発揮する可能性があることを示唆している。この議論は以前にも行われており[6, 8]、提案されている抗ウイルス機構は、細胞内輸送に重要な哺乳類細胞タンパク質を標的としているため、もっともらしいと思われる。これらの重要な機能は、その後、ウイルスによってハイジャックされ、ウイルスの複製を強化する。イベルメクチンが哺乳類の宿主誘導型抗ウイルス剤として機能する可能性があるという事実は、低用量でわずかな量であってもウイルス負荷を低減することが、ウイルス感染症との戦いにおける免疫系の強化において補完的であり得ることを示唆している[49]。実際、イベルメクチンの免疫刺激効果は文書化されており[50],0.2mg/kgの投与では、ヒツジ赤血球に対する抗体産生、およびCD-1マウスのヘルパーTリンパ球およびマクロファージ依存性応答が有意に増強されている。これらの観察結果から、広汎な抗ウイルス剤としての使用を想定して、より高用量のイベルメクチンを包括的に毒性学的に再評価する必要はないと考えられる。しかし、これらの効果を確認するための慎重に設計された前臨床試験及び臨床試験が必要である。
コロナウイルスと、インポーチンαのNLSを阻害することによるイベルメクチンの作用機序について、我々は、効率的に機能するNLSが、他のウイルス機能のために論理的に急速に隔離されていない共因子タンパク質であるnsp8に1つしか見出されていない。SARS-CoV-2の3つのタンパク質は、明らかなNLSを持っていたか、または模擬NLSを持っていた。論理的には、これらのタンパク質のほとんどは、核外の他の機能のために迅速に利用され、核内へのリークは、本質的な役割を持っていない、核外での共同因子の役割を持っているだけで、おそらくnsp8を除いて、わずかな核内へのリークが発生するだろう。イベルメクチンの適用は、現時点では十分に理解されていない臨床効果を持っているようである。興味深いのは、SARS様コロナウイルスの本質的に乱れたタンパク質領域を計算機的アプローチで調べたGiriらの論文[34]である。Giriらは、完全に独立して、全く異なる方法を用いて、高い本質的障害を持つタンパク質として、ヌクレオカプシドN、nsp8,ORF6のみを同定した。我々はレビューを行う際にこの論文を知りなかったので、同じタンパク質が全く独立した科学的アプローチと異なる目的で同定されていることに違和感を覚える。この興味深い偶然の一致は、さらなる精査が必要である。
5 結論
本レビューでは、イベルメクチン(寄生虫感染症治療薬として臨床的に承認されている)を幅広い抗ウイルス薬として再利用する可能性について批判的な評価を行っている。分子生物学的研究では、哺乳類の宿主プロセスによって促進されるウイルスタンパク質の核内転座の阻害が主な標的であることが確認されている。また、ウイルス感染に対する免疫反応の刺激など、他のオフターゲット効果も考えられるが、直接の研究は行われていない。この分野における現在の知見の大部分は、細胞培養物を感染させることによって行われた試験管内試験研究に由来している。イベルメクチンの抗ウイルス効果の生体内試験動物感染モデルでの試験は非常に限られているが、利用可能なデータは有望であり、これは特にアルボウイルス感染症に当てはまる可能性がある。ウイルス感染症が医療や農業における経済的損失の大きな原因の一つであることを考えると、イベルメクチンを追加の抗ウイルス剤として開発する可能性は、有効な感染モデルを用いた前臨床試験に重点を置いて追求されるべきである。しかしながら、コロナウイルスによるインポーチンβへの攻撃を考えると、インポーチンαをさらにブロックするためのイベルメクチンの使用は、イベルメクチンの更なる薬理学的研究なしには、臨床の場での優先順位の高い治療法としては逆行しているように思われる。それにもかかわらず、イベルメクチンによって阻害されるであろう切断タンパク質 nsp8 をコードする ORF1ab には機能的な NLS が存在するようであり、これは優先順位の高い治療法としてさらに検討されるべきである。
6 著者の貢献
研究アイデアの発想、文献検索と評価、データ抽出と検証、原稿執筆には、両著者(RTKとLO)が等しく貢献した。
7 倫理的承認
この研究作業では、データを生成するために直接実験を行い、動物やヒトを使用する必要はなかった。倫理承認は必要なかった。
関心の表明
宣言するものはない。
