コンテンツ
- ApoE4遺伝子型はイギリスのバイオバンクで重度のcovid-19を予測する。コミュニティーコホート
- 社説 認知障害を持つ人の生活の質をどのように支援するか?ポストCovid世界での新しい挑戦
- 脳におけるACE2遺伝子の高発現
- 重度アルツハイマー病高齢者のCOVID-19感染 症例報告
- COVID-19 閉鎖中のスペインアルツハイマー病患者の精神神経症状とQOL
- アルツハイマー病におけるCOVID-19の新たな役割と予防的緩和戦略
- COVID-19を有する精神障害患者の予後解析:単施設レトロスペクティブ研究
- COVID-19患者の死亡予測因子としての神経疾患:レトロスペクティブコホート研究
- COVID-19出現後のニューヨーク市における過剰な神経死
ApoE4遺伝子型はイギリスのバイオバンクで重度のcovid-19を予測する。コミュニティーコホート
https://pubmed.ncbi.nlm.nih.gov/32451547/
新型呼吸器疾患COVID-19は様々な症状を呈し、発熱、咳、息切れが一般的である。高齢者では、英国バイオバンク(英国バイオバンク)のCOVID-19重症度の主要な危険因子(OR = 3.07、95%CI:1.71~5.50)として、既往の認知症があることが明らかになった[1]。
COVID19で入院した16,749人の患者を対象とした別の英国の研究 [2] では、認知症は一般的な併存疾患の一つであり、死亡率の上昇と関連していた。さらに、せん妄を含む意識障害は重症例では一般的である [3]。
ApoE e4遺伝子型は認知症とせん妄の両方に関連しており[4]、ヨーロッパ系の人々の間では、e4e4(ホモ接合型)遺伝子型は一般的なe3e3遺伝子型と比較してアルツハイマー病のリスクが14倍に増加している[5]。
そこで我々は、英国バイオバンクのデータを用いて、ApoE e4対立遺伝子とCOVID-19の重症度との関連を検証することを目的とした。英国バイオバンクは、現在48歳から86歳までのコミュニティコホートである [6]。英国バイオバンク参加者を対象としたCOVID-19実験室検査の結果は、現在のCOVID-19発生のピーク期間である2020年3月16日から4月26日までの期間に入手可能であった。
この期間中、COVID-19検査は主に感染の臨床徴候を有する入院患者に限定されていたため、検査陽性は重度のCOVID-19感染のマーカーとなる[7]。
我々は、英国のベースライン評価センター(n=398,073)に参加した遺伝的にヨーロッパ系の先祖代々の参加者 [8](n=451,367、サンプルの90%)から、流行前に死亡した参加者(n=15,885)を除いた 英国バイオバンク のデータを分析した。
ApoE遺伝子型の決定には、rs429358およびrs7412の一塩基多型(SNP)データを用いた。
ApoE e4e4ホモ接合体(n=9,022、3%)、e3e4(n=90,469、28%)、およびe3e3(最も一般的な遺伝子型、n=223,457、69%)の遺伝子型グループ(最終的なn=322,948)であった。平均年齢は68歳(SD=8)で、女性176,951人(55%)であった。
COVID-19陽性患者は622例(表1)で、そのうち37例がe4e4(陽性率410/100,000)、401例がe3e3(10万人あたり179)であった。
ロジスティック回帰モデルを用いて、e3e4またはe4e4遺伝子型をe3e3とCOVID-19陽性の状態を比較し、以下の条件で調整した
性;COVID-19検査時の年齢または2020年4月26日(最終検査日)の年齢;ベースラインの英国の英国バイオバンク評価センター;ジェノタイピングアレイのタイプ;および上位5つの遺伝的主成分(集団混血の可能性を考慮)。
ApoE e4e4ホモ接合体は、e3e3ホモ接合体と比較してCOVID-19検査陽性の可能性が高かった(オッズ比=2.31、95%信頼区間:1.65~3.24、p=1.1910-6)(表1)。
COVID-19の重症度にも関連するApoE e4関連疾患を有する参加者を除外しても、関連性は同様であった。
- 認知症ではない参加者(OR=2.39、95%信頼区間:1.71~3.35)
- 高血圧(OR=2.41、95%信頼区間:1.56~3.74)
- 冠動脈疾患(OR=2.41、95%信頼区間:1.56~3.74)
- 高血圧症(OR=2.41、95%信頼区間:1.56~3.74)
- 冠動脈疾患(OR=2.41、95%信頼区間:1.56~3.74)
- 高血圧症(OR=2.41、95%信頼区間:1.56~3.74)
- 冠動脈疾患(心筋梗塞または狭心症)(OR=2.43、95%CI:1.69~3.50)
- 2型糖尿病(OR=2.51、95%CI:1.77~3.55)
ベースラインの自己申告または退院統計(2017年3月更新)からの既往診断に基づいて推定した。一般診療データを追加した136,146人の参加者(2017年まで)を用いても推定値はほとんど変化しなかった
- 認知症ではない参加者(OR=2.53、95%CI:1.46~4.39)
- 高血圧(OR=2.67、95%CI:1.34~5.32)
- 冠動脈疾患(OR=2.86、95%CI:1.65~4.98)
- 2型糖尿病(OR=2.73、95%CI:1.57~4.76)
また、3親等以内に関連する参加者51,430人を除外しても同様の結果が得られた(OR=2.34、95%CI:1.62~3.38)。
COVID-19で陽性と判定された参加者622人のうち、417人(67%)はサンプル採取時に入院患者であったと検査機関に指摘されていた:残念ながら、その後の入院に関するデータは利用できない[7]。
検査時に入院患者であったことが知られている患者のみを含めることで、ApoE e4e4状態に関連する過剰リスクにはほとんど差がなかった(OR=2.32、95%CI:1.54~3.29)のに対し、検査したすべてのサンプルを用いた場合はOR=2.31(95%CI:1.65~3.24)であった。
結論として、ApoE e4e4対立遺伝子は、既存の認知症、心血管疾患、および2型糖尿病とは無関係に、重度のCOVID-19感染のリスクを増加させる。
ApoE e4は、リポタンパク質機能(およびそれに続く心代謝性疾患)に影響を与えるだけでなく、マクロファージのプロ/抗炎症性表現型をも調節する[9]。
COVID-19を引き起こす新規コロナウイルスSARSCoV-2は、細胞侵入のためにACE2受容体を利用する。ACE2は肺のII型肺胞細胞で高度に発現しており、ApoEは高度に共発現している遺伝子の一つである[10]。
社説 認知障害を持つ人の生活の質をどのように支援するか?ポストCovid世界での新しい挑戦
https://pubmed.ncbi.nlm.nih.gov/32492256/
COVID-19後の世界における認知障害を持つ人々の生活の質
現在、COVID-19感染による500万人以上の確定症例と30万人以上の死亡者が世界的に発生している(1)。ワクチンや効果的な予防法、治療法がない場合、ヨーロッパのほとんどの国で発生しているように、封じ込めは制限的な封鎖措置に頼っている。パンデミックとそれに伴う封鎖措置は精神衛生に大きな影響を与え、一般人口の最大50%が心理的苦痛、抑うつ、ストレスの増加を報告している(2,3)。
しかし、これらの研究では年長者が過小評価されており、認知障害のある人を対象とした研究は非常に少ない(4)。
神経精神症状(NPS)の悪化
Laraらによるこの独創的な研究は、アルツハイマー病(n=20)または軽度の認知障害(n=20)を持つ人々のロックダウン前後の神経精神症状(NPS)の測定を分析することによって、このギャップを埋めている(5)。著者らは、これらの患者では、5週間のロックダウン期間中にNPSが悪化しており、最も影響を受けた症状は動揺、無気力、運動異常であることを示した。
参加者は、中断されていたデイケアユニットが提供する認知刺激プログラムに登録されていた。したがって、彼らはアクセスの欠如と社会的関与の低下に不釣り合いに苦しんでいる可能性がある。
介護者は健康状態は低下したが生活の質には変化が見られなかった
興味深いことに、著者らは介護者の生活の質(EuroQol-5D)も測定したが、有意な変化は見られなかった。しかし、40%の介護者はロックダウン中に健康状態が低下したと報告した。
しかし、サンプルサイズが小さく、患者は認知的に軽度の障害があった。より重度の痴呆患者では、通常の介護支援の中断は介護者の負担を増加させる可能性もあった。認知機能障害のある患者は、ロックダウンの悪影響に対してより脆弱であると考えるべきである。
彼らの年齢と併存疾患のため、感染から守るための努力として、制限はより厳しく、より長く続く可能性がある 。 インターネットやスマートフォンへのアクセスが制限されていると、情報の流れが妨げられる可能性がある。また、制限的な処置やその根拠を覚えることが困難な場合もある(6) 。
彼らの年齢や認知機能の問題による偏見やスティグマが、無力感、絶望感、恐怖感を強める可能性がある。ロックダウンが解除されたことで、患者とその介護者のメンタルヘルスの悪化に直面し、対処しなければならない(7) 。
コミュニティレベルでは、地域の協会の関与をもって家族や介護者を支援することが重要である。家庭内で安全に代替の社会的身体活動を組み込むための創造的なアイデアが必要とされている(8)。
多くの人が社会的なつながりを保ち、ヘルスケアを含むサービスにアクセスするためにテクノロジーを利用するようになってきているが、認知障害のある人は、これらのツールを使用するための指導やサポートが必要になるかもしれない(4) 。
脳におけるACE2遺伝子の高発現
https://pubmed.ncbi.nlm.nih.gov/32619698/
これは、アルツハイマー病患者のCOVID-19感染の危険因子である可能性が示唆される。
我々は、Journal of Infectionに掲載されたLiuらの最近の研究で、COVID-19を持つ高齢者の死亡率が若年者や中年者に比べて高いことが記述されているのを読んだ(1)。
また、本誌に掲載されたFu氏らによるSARS-CoV-2パンデミックでは、慢性閉塞性肺疾患(COPD)などの慢性合併症を持つ高齢者の死亡率が高いことを示した興味ある論文も読みました(2)。
COVID-19の高い死亡率とパンデミックの状況を考えると、有効な治療薬の開発は、質の高い病原体の同定を必要とする喫緊の課題である。
最近、ゲノム解析により、アンジオテンシン変換酵素2(ACE2)がSARSCoV-2の細胞侵入のための結合タンパク質であることが明らかになり、ACE2の制御は、SARS-CoV-2感染を減少させるための潜在的な治療標的であることが明らかになった(3)。したがって、高齢のCOVID-19患者におけるACE2遺伝子のゲノム発現の研究が急務となっている。
このような研究により、研究者が死亡率を低下させ、新たなSARS-CoV-2感染を予防することができるようになることが期待されている。
神経変性疾患(ND)発症の主な危険因子は加齢であり、アルツハイマー病(アルツハイマー病)は高齢者に最も多いNDである(4)。アルツハイマー病の主な原因は脳組織におけるAβペプチドの凝集であり、海馬硬化症などのいくつかの関連症状が頻繁に検出されている(5)。
さらに、最近の研究では、COPDなどの併存疾患を持つアルツハイマー病患者では認知機能の低下が増加することが示唆されている(6)。アルツハイマー秒患者は特に呼吸器系の影響を受けやすいことから、我々はACE2発現の高さがアルツハイマー病患者の死亡率の上昇に関係しているのではないかと仮説を立てた。
そこで我々は RNA-seq データを検索し、アルツハイマー病 モデルにおける Ace 遺伝子のゲノムワイド関連研究(GWAS)を行った(図 1A)。ADマウスモデルにおけるAce遺伝子の増加の発現解析を行ったところ、脳組織ではAce2遺伝子が優勢に発現していることがわかった(図1B)。
しかし、Ace2とは異なり、Ace1遺伝子の発現は健常者と罹患者の脳組織では差がなかった(図1B)。
また、血中のAce2遺伝子発現量を解析したところ、有意差は認められなかった(図1B)。また、Ace1遺伝子の発現は、アルツハイマー病脳組織ではわずかに減少傾向を示したが、一方で、血中ではAce1遺伝子の発現が有意に増加していることが観察された(図1B)。
このことは、Ace1遺伝子がアルツハイマー病診断のための特異的なバイオマーカーである可能性を示唆している。
アルツハイマー病モデル脳と血液中のAce遺伝子発現量の変化が観察されたことから、次に、ヒトアルツハイマー病患者の脳組織と末梢血単核細胞(PBMC)中のヒトAce遺伝子発現プロファイルを解析した。
遺伝子差解析の結果、Ace2遺伝子発現量は健常者群と比較して初期群(135%)、中等症群(148%)、重症群(164%)では徐々に上昇したが、Ace1遺伝子発現量は初期群では32%減少し、中等症群では111%、重症群では116%と正常値に戻った(図1C)。
一方、Ace1遺伝子の発現量は正常群と比較して39%、Ace2遺伝子の発現量は69%であった。これらの分析は、Ace2遺伝子の発現がアルツハイマー病脳組織において上昇していることを強く示しており、これはアルツハイマー病患者におけるCOVID-19感染の危険因子である可能性がある。
COVID-19宿主ゲノム3の研究の進歩は、現在、医薬品または治療薬の開発に必要とされている(7)。ここでは、GWASを用いてアルツハイマー病患者におけるSARS-CoV-2感染の遺伝的危険因子について報告する。
新たな解析により、これらの知見がSARS-CoV2の予防や治療につながる可能性がある。我々は、SARS-CoV-2結合タンパク質をコードするACE2遺伝子の発現が、アルツハイマー病患者の脳で増加していることを発見した。
興味深いことに、ACE阻害剤は最近、NDの治療薬として示唆されている(8)。したがって、ACE阻害薬はNDとCOVID-19の両方を治療する可能性がある。
我々の結果をまとめると、ACE2の高発現がアルツハイマー病患者におけるCOVID-19感染の危険因子である可能性が示唆される。この問題に治療的に対処するためには、慎重な診断と医療処置が必要である。
重度アルツハイマー病高齢者のCOVID-19感染 症例報告
- 下痢、眠気といった非典型的なCOVID-19の症状を示した。
- 鼻咽頭スワブは陰性であった。
- 標的治療は行わず、酸素補給、非経口栄養、低用量ヘパリン、副腎皮質ステロイドといった支援的対策のみで改善した。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7175908/
COVID-19 閉鎖中のスペインアルツハイマー病患者の精神神経症状とQOL
https://pubmed.ncbi.nlm.nih.gov/32449791/
抄録
背景と目的:COVID流行は世界中の個人に影響を与えており、アルツハイマー病(アルツハイマー病)と健忘性軽度認知障害(MCI)患者は、その特徴と年齢からリスクを負っている。我々は、スペインでの5週間のロックダウン後、これらの患者の神経精神症状と生活の質に及ぼすパンデミックの影響を分析した。
方法
認知障害ユニットの認知刺激プログラムからMCI(20名)または軽度アルツハイマー病(20名)と診断された40名の被験者を対象に検査を行った。すべての患者は、ロックダウン前の1ヶ月間に前回の評価を受けており、ロックダウン5週間後に再評価を受けた。Neuropsychiatric Inventory(NPI)とEuroQol-5Dを用いて、患者と介護者の神経精神症状とQOLを評価した。
結果
ベースラインのNPIスコアの合計は33.75(22.28)対監禁後39.05(27.96)であった(p=0.028)。影響を受けた神経精神症状は、MCI患者では無気力(4.15(3.78)対5.75(4.02);p=0.002)、不安(3.95(3.73)対5.30(4.01);p=0.006)が最も多く、無気力(2. 35(2.70) vs 3.75(3.78); p=0.036)、動揺(0.45(1.14) vs 1.50(2.66); p=0.029)、アルツハイマー病患者では異常な運動行動(1.25(2.86) vs 2.00(2.93); p=0.044)が認められた。再評価時のEuroQol-5Dスコアの差は観察されなかった。約30%の患者と40%の介護者が監禁中の健康状態の悪化を報告した。
結論
我々は、アルツハイマー病およびMCI患者の5週間の隔離期間中の神経精神症状の悪化を実証したが、その中で最も影響を受けた症状は動揺、無気力、運動異常であった。
COVID-19感染が神経疾患の発症に及ぼす即時および長期的影響
https://alzres.biomedcentral.com/articles/10.1186/s13195-020-00640-3
要旨
Sars-CoV-2 への感染は、感染した患者のかなりの割合で神経学的障害を引き起こすことを示唆する証拠が増えている。これらの症状は感染の過程で急性に生じるが、脳への長期的な影響についてはあまり知られていない。重症化したCOVID-19患者は、高レベルの炎症性サイトカインおよび急性呼吸機能障害を経験し、しばしば補助人工呼吸を必要とする。これらの因子はすべて認知機能の低下を引き起こすことが示唆されている。
病理学的には、免疫反応の直接的な負の影響、既存の認知障害の加速または悪化、または神経変性疾患のde novo誘導に起因する可能性がある。
本論文では、COVID-19の神経学的症状に関する現在の理解をまとめ、感染した患者は、COVID-19の一次感染を克服した後に認知機能低下を発症するリスクが高い可能性があるという仮説を立てた。構造化されたプロスペクティブ評価により、COVID-19パンデミック後の認知機能障害の可能性、時間経過、重症度を分析すべきである。
背景
COVID-19パンデミックは、私たちの医療システムに対する前例のない緊急の脅威であると同時に、持続的な脅威でもある。影響を受けた患者の総数が世界中の医療システムのキャパシティのほとんどを超えており、特に人工呼吸を必要とする患者の治療のための緊急性は明らかである。COVID-19感染症の長期的な影響は、すぐには明らかではないが、潜在的に非常に重大なものである。
COVID-19感染の急性期には、症例の約36%が神経学的症状を呈し、そのうち25%は中枢神経系の直接的な関与に起因している。主な症状としては、めまい、頭痛、意識障害、痙攣などが挙げられるが、これらに限定されるものではない[1]。
神経学的症状を示す患者には、神経学的疾患の既往の有無にかかわらず、神経学的症状を示す患者が含まれていた [2]。集中治療室に入院している間、患者は動揺、錯乱、腱反射の亢進やクローヌスなどの皮質脊髄路徴候を示した。軽度から中等度の症例では、嗅覚障害(85.6%)と味覚障害(88.0%)が報告された。
重要なことに、約11%の患者では、他の臨床症状の前に無呼吸が起こっていた[3]。
COVID-19は、凝固の変化、特に炎症誘発性播種性血管内凝固(DIC)にさらにつながる可能性がある。内皮機能障害とともに、DICは若年患者でも脳血管虚血を引き起こす可能性があり、その多くは大血管虚血性脳卒中を患っている[4、5]。
全体としては、COVID-19感染の重症度も影響していると考えられ、重症例の5.7%が虚血性脳卒中を発症していたり[1]、血管危険因子が既往していたり、特に高齢者では虚血性脳卒中がむしろ遅発性合併症として発症していたり[6,7]した。
また、Covid-19の症状発現から3~10日後に発症する亜急性症状として、ギラン・バレー症候群[8]やミラー・フィッシャー症候群[9]の症例が報告されている。また、臨床的には、小児や10代で認められるようになったKawaski様多系統炎症性症候群の症例が目立っている。
本文
中枢神経系に対するCOVID-19の有害な影響を説明しうる少なくとも4つの可能な病原性メカニズムがある
(1)直接的なウイルス性脳炎
(2)全身性炎症
(3)末梢臓器機能障害(肝臓、腎臓、肺)
(4)脳血管の変化
である。しかしながら、ほとんどの場合、COVID-19の神経学的症状は、上記の組み合わせから生じ得る。
これらの機序のいずれか1つまたは組み合わせにより、COVID-19の生存者は、既存の神経学的障害を悪化させるか、または新たな障害を発症することにより、長期的な神経学的結果を発症する危険性がある。
この懸念は、退院時に患者の3分の1が認知障害および運動障害の証拠を有するという知見によって裏付けられている [2]。COVID-19は全体的に高齢者に臨床的に最も重篤な影響を及ぼすため、このことは特に重要である [10]。
一般的に神経変性疾患や脳血管疾患を発症する年齢と、COVID-19感染症のリスクが最も高い年齢には大きな重複がある。この重複は、プロスペクティブな神経学的サーベイランスおよびケアの必要性がやむを得ないことを論じている。
COVID-19は、重度の自然免疫応答と全身性サイトカインレベルの持続的な上昇と関連している。重要なことに、この自然免疫反応は死亡率と重症度を促進し、予測することが示唆されている[11]。
上昇が認められたサイトカインおよび関連する炎症性メディエーターには、インターロイキン-1β、インターロイキン-2、インターロイキン-2受容体、インターロイキン-4、インターロイキン-10、インターロイキン-18、インターフェロン-γなどがある。C反応性蛋白質、顆粒球コロニー刺激因子、インターフェロン-γ、CXCL10、単球化学吸引性蛋白質1、マクロファージ炎症性蛋白質1-α、および腫瘍壊死因子-α [10、12]。それと同時に、ほとんどの患者はリンパ球数の低下を伴うT細胞枯渇の徴候を示す。
全身性炎症が認知機能の低下および神経変性疾患を促進することが示されていることから、COVID-19の生存者はその後数年間で神経変性を経験する可能性が高い [13、14]。注目すべきことに、サイトカインレベルは、重度の敗血症を経験した患者では、その後の海馬萎縮の発生を予測することができる [15]。
これに伴い、COVID-19の最も頻繁にみられる臨床症状は急性呼吸窮迫症候群(ARDS)の発症である[16]。全身性の炎症性損傷の脳への因果関係は、Helmsらの研究で調査された脳脊髄液サンプルのいずれも、脳脊髄液中にSARS-CoV-2が直接存在する証拠を発見しなかったという事実によって、さらに裏付けられている[2]。
つまり、脳へのウイルスの直接浸潤と、血行性または神経細胞の逆行性播種によるウイルス性脳炎の1例の報告の潜在的な重要性を無視すべきではないということである[19]。
マウス肺損傷モデルやARDS患者のサンプルから得られた証拠は、ARDSの病因と有害な転帰におけるNLRP3イン フラナソームの役割を強調している[20, 21]。これに伴い、コロナウイルスORF3aタンパク質はNLRP3イン フラガソーム活性を誘導することが示されている[22]。さらに、換気誘発性の過呼吸は、NLRP3 イン フラマソーム-インターロイキン-1β依存性の認知障害を引き起こすことが実験的に示されている[23]。
COVID-19患者における上記のサイトカイン所見、特にインターロイキン-1βとインターロイキン-18の上昇を考えると、COVID-19患者はNLRP3インフルナソームの活性化に苦しんでいる可能性が高いと思われる。この活性化とそれに続く炎症性免疫経路の活性化は、脳の恒常性と機能に悪影響を及ぼす可能性が高い。
この結論は、疫学的証拠だけでなく、全身性のNLRP3炎症アメーバを介した炎症が脳内の有益な免疫機能に悪影響を与え、それによってフィブリルアミロイドβなどの神経変性関連ペプチドの病理学的蓄積を引き起こすことを示した実験結果にも基づいている[24]。このように、NLRP3インフルアソームの末梢性および中枢性誘導は、アルツハイマー病の機能障害につながる神経変性プロセスを直接的に誘発または悪化させる可能性がある[25]あるいは、病理学的な広がり、ひいては疾患の進行に強く寄与する[26]。
NLRP3によるホスホキナーゼおよびホスファターゼのIL-1βを介した調節が、マウスのタウオパチーモデルにおける神経原線維性血管の病理学的形成の大部分を占めていることを示す最近の知見は、COVID-19患者が神経変性過程の誘導または強力な悪化を経験する可能性が高いという懸念を提起している[27]。
結論
証拠は、COVID-19を生存している患者が、その後の神経疾患、特にアルツハイマー病の発症のリスクが高いことを強く示唆している。
神経科医、精神科医、および介護者は、COVID-19生存者におけるそのような症例の増加の可能性に注意を喚起すべきである。この患者コホートにおける急性および亜急性COVID-19感染と長期の神経学的な続編との間の潜在的な相関関係を調査するために、プロスペクティブな研究が必要とされている。
アルツハイマー病におけるCOVID-19の新たな役割と予防的緩和戦略
要旨
SARS-CoV-2の世界的な蔓延に起因するアルツハイマー病(アルツハイマー病)の分野には、多くの潜在的な意味合いがある。神経炎症は神経変性の顕著な特徴であることが知られており、アルツハイマー病の病理学において大きな役割を果たしている。COVID-19の免疫応答および過剰な炎症もまた、脳の炎症性神経変性の進行を加速させる可能性があり、高齢者はSARS-CoV-2感染後の重篤な転帰を受けやすい。
2 型糖尿病(2型糖尿病)患者は、SARS-CoV-2 感染後の重篤な転帰だけでなく、アルツハイマー病 のリスクも高い。2型糖尿病、アルツハイマー病、およびCOVID-19の重症化率に影響を及ぼす遺伝的および社会経済的要因は、アフリカ系アメリカ人やヒスパニック系アメリカ人などの特定の人口統計学上の例外的に高いリスクプロファイルを作成する可能性がある。
I型インターフェロン応答は、ウイルス感染に対する宿主応答とアルツハイマー病の病理学の両方において重要な役割を果たしており、アルツハイマー病とCOVID-19の両方において賢明な治療標的となる可能性がある。
新型コロナウイルスSARS-CoV-2は2019年後半に中国で出現し、その起源は中国武漢の市場にまでさかのぼっている[1]。COVID-19の原因となったウイルスはその後世界中に広がり、2020年3月11日に世界保健機関(WHO)により世界的なパンデミックであると宣言された[2]。2020年5月3日の時点で、COVID-19の患者数は合計3,349,786人、死亡者数は238,628人であった[3]。
COVID-19に関する知見が進むにつれ、59歳以上の人は若年者に比べてCOVID-19で死亡する可能性が5倍高く、感染後の重篤な転帰に関連する主な危険因子の1つとして高齢化が認識されるようになってきた[4]。
心血管疾患や代謝障害などの追加の危険因子が優勢であることから、生物学的年齢(年代的年齢とは対照的に)が重症化または致死的転帰の単一の最大の危険因子である可能性があることが示唆されている [5]。
糖尿病
糖尿病はCOVID-19関連の死亡例の主要な併存因子と考えられている[6]。糖尿病の最も一般的な形態である2型糖尿病(2型糖尿病)は、共通の遺伝的病因を介してアルツハイマー病(アルツハイマー病)の増加傾向とも関連している[7]。
遺伝的および社会経済的要因は、特定の集団におけるアルツハイマー病、2型糖尿病、およびCOVID-19のリスクを悪化させている。アフリカ系アメリカ人とヒスパニック系アメリカ人は、非ヒスパニック系白人と比較して、2型糖尿病とアルツハイマー病の両方の発症率が1.5~2倍高かった [8, 9]。これらの人種および民族格差は、COVID-19ではさらに悪化している。
例えば、ウィスコンシン州とルイジアナ州では、アフリカ系アメリカ人がCOVID-19による死亡の70%を占めているにもかかわらず、これらの人口の26%と32%しか占めていない[10]。ニューヨーク市では、アフリカ系アメリカ人は人口の24.3%を占めているが、COVID-19関連入院の35.4%、COVID-19関連死亡の30%を占めている。
同様に、ヒスパニック系は人口の29.1%を占めるが、COVID-19関連の入院の31.3%、COVID-19関連の死亡の30.4%を占めている[11]。2型糖尿病、アルツハイマー病、COVID-19の高率と糖尿病がCOVID-19の主要な併存因子として同定されているという事実を考えると、これらの人口層はCOVID-19に関連した重度の転帰のリスクが高い。
SARS-CoV-2感染後の重篤な転帰は、しばしば顕著な炎症の「サイトカインストーム」と関連している[12]。高齢者が感染後のリスクが高い理由の1つは、既存の炎症のベースラインが高いことに起因している可能性がある。
炎症老化
炎症は、「炎症老化」と呼ばれるプロセスにおいて、加齢とともに着実に増加する[13]。COVID-19に関連する「サイトカインストーム」は、腫瘍壊死因子α、インターロイキン-1(IL-1)、IL-6などの炎症性サイトカインの増加と関連しており、これらはすべて高齢者で増加することが確認されている [13, 14]。したがって、高齢者はCOVID-19に起因する重篤な転帰に対して特に脆弱である。
インターフェロン
インターフェロン調節因子5(IRF5)は、インフルエンザAウイルス感染後の誇張された免疫応答(サイトカインストーム)を促進する上で重要な役割を果たしており、グルコース感受性上流因子O-GlcNAcトランスフェラーゼによって制御されている[15]。
IRF5活性を介して炎症を増加させる血糖値の上昇の可能性は、2型糖尿病とアルツハイマー病の重複する病理学と一緒に、アルツハイマー病患者におけるSARS-CoV-2感染後の過剰な免疫応答の「パーフェクト・ストーム」を作成する可能性がある(図1)。
2型糖尿病の併存疾患に起因するIRF5活性の増加はまた、アミロイド刺激型I型インターフェロン(IFN)応答と相乗的に作用する可能性がある(後述)。
図1 SARS-CoV-2とアルツハイマー病との間の潜在的な相互作用。
2型糖尿病(2型糖尿病)はアルツハイマー病の素因として作用する。2型糖尿病に起因する血糖値の上昇は、インターフェロン調節因子5(IRF5)の活性の増加を介して、アルツハイマー病およびCOVID-19の両方の病理を悪化させるか、または2つの併存疾患を悪化させる可能性がある。
I型インターフェロン(IFN)は、ウイルス感染後の炎症を媒介し、アミロイド線維を含む核酸に反応して、最終的にはシナプスの喪失に至る。アミロイド線維はウイルス粒子を巻き込み、IFN応答のさらなる増強につながる。
実線の矢印は証明されたメカニズムを示し、点線の矢印は理論的なメカニズムを示す。SARS-CoV-2とアルツハイマー病との間の潜在的な相互作用。
インターフェロンとアミロイド
IFNは、ウイルス感染に対する宿主応答を媒介する上で重要な役割を果たすサイトカインのグループである[16]。Royらは最近、アルツハイマー病病理を媒介するIFNの役割を実証した。
複数の異なるアルツハイマー病モデルのトランスジェニックマウスから得られた海馬組織はすべて、IFNによって誘導されることが知られている遺伝子の発現が増加していることが示された。さらに、アミロイド線維を含む核酸は、試験管内試験(in vitro)および生体内試験(in vivo)の両方でIFN応答に関与することが知られている遺伝子の発現を刺激することが示された。
「ミクログリア神経変性表現型」として知られるミクログリアのサブセットは、アミロイドプラークを含む核酸と関連し、IFN経路に関連する遺伝子の発現の増加を示した。IFNはミクログリアを直接活性化し、プロ炎症反応を刺激することが判明した。
さらに、IFNは補体カスケード活性化を刺激し、シナプスの消去を促進することがわかった。最後に、インターフェロン刺激遺伝子はまた、アルツハイマー病患者の脳でアップレギュレートされ、Braakスコアの増加と相関していることが判明した[17]。
インターフェロン応答を誘導するために発見されたアミロイドフィブリルには核酸(DNAとRNA)が含まれていたため、Royらの知見は特に興味深いものである。以前、Eimerらは、単純ヘルペスウイルス1(二本鎖DNAウイルス)に感染した5XFADマウスがアミロイド線維化の促進を示すことを示した。
さらに、アミロイドは中枢神経系の自然免疫システムの一部であることが示唆されたプロセスでウイルス粒子を巻き込むことが判明した[18]。
Readheadらは、アルツハイマー病患者の死後脳のいくつかの領域でヒトヘルペスウイルス6とヒトヘルペスウイルス7のレベルが増加していることを発見した[19]。このように、アミロイドβは感染に対する宿主応答の一部として作用しているように思われる。
考えられるのは、アミロイドフィブリルが微生物病原体を巻き込み、その後、ミクログリアの活性化とIFN応答を誘導するということである(図1)。それは、アルツハイマー病の病理学は、主に微生物感染によって駆動されるか、またはこの免疫応答がうまくいかなかったの問題であるかどうかについては、現在のところ明らかにされてわない。これらの考えは、COVID-19の生存者における神経学的損傷の観点から何を期待するかについて興味深い光を与えている。
SARS-CoV-2の脳への侵入はすでに報告されている。COVID-19患者の43.2%が無症状であるという事実を考慮すると、これは興味深い。知らず知らずのうちに、ウイルスの脳内への無症候性侵入によって神経変性の素因となっている集団が存在している可能性がある。
さらに、診断されていないアルツハイマー病を持つ無症状の患者は、感染による全身性の炎症が原因で症状が加速する可能性がある。SARS-CoV-2とその脳への影響の持続的な影響はまだ知られていないが、神経変性のためのプライミング因子としてのその可能性は、アルツハイマー病研究の分野にとって非常に重要であるかもしれない。
アルツハイマー病におけるIFN応答とCOVID19が相乗効果を発揮して病態を悪化させる可能性についてはまだ検討されていないが、IFN応答はCOVID-19の脳への即時効果においても役割を果たしている可能性がある。
SARS-CoV-2感染に起因する急性神経学的合併症には、髄膜炎および急性壊死性脳症のほか、味覚および嗅覚障害が含まれる[20、22、23]。IFNは以前、ウイルス性脳炎や遺伝性脳症であるアイカルディ-グーティエール症候群と関連していた [24, 25]。
アルツハイマー病およびCOVID-19(または両者の併存症)の両方におけるIFN応答の抑制は、過剰な免疫応答を制御するための有利な戦略であるかもしれない。
アルツハイマー病症治療薬
さらに、アルツハイマー病治療薬がSARS-CoV-2感染症とどのように相互作用するかを推測することは興味深い。
現在、承認されている治療薬であるドネペジル、リバスチグミン、およびガランタミンはすべて、アセチルコリン分解酵素であるアセチルコリンエステラーゼを阻害することによってアセチルコリンレベルを上昇させることによって作用する[26]。
まだ探索されていないが、コリン作動性抗炎症経路は、炎症を制御し、SARS-CoV-2感染後の「サイトカインストーム」を防ぐための実行可能なターゲットである可能性があり、アセチルコリンエステラーゼ(AChE)阻害薬は補助療法として再利用される可能性がある。
ガランタミン
興味深いことに、AChE阻害剤ガランタミンは、ラットの関節炎モデルにおいて、血清サイトカインおよびTNF-α、IL-10、およびMCP-1などのケモカインを減少させることが示されている[27]。
α7ニコチン受容体を介した迷走神経の刺激は抗炎症作用を有することがあり[28]、COVID-19患者における過剰な炎症の予防にニコチン投与が有効であるかもしれないという推測を導くものもある[29]。
コリン作動性抗炎症経路の刺激が有益な戦略であるとしたら、アルツハイマー病および他の神経学的/精神疾患の治療のために以前に開発された既存のニコチン化合物の豊富さは、多くの追加的な治療オプションを提供する可能性がある[30]。
COVID-19パンデミックがアルツハイマー病患者に及ぼすであろう間接的な影響を認識することも重要である。高齢者はSARS-CoV-2感染後の死亡リスクが高いため、このパンデミックの間、これらの個人を隔離し、他の人との接触を制限する必要がある。
しかし、介護者や家族と過ごす時間、社会的交流や日常活動は、一般的に高齢者の認知機能の低下を防ぐのに役立つと考えられている。したがって、孤立は必要ではあるが、残念ながら高齢者の認知機能低下のリスクを高める可能性がある。
COVID19 パンデミックの総計的な影響はまだ知られていないが、それは間違いなく多くの アルツハイマー病 患者に直接または間接的に影響を与えるであろう。
COVID-19を有する精神障害患者の予後解析:単施設レトロスペクティブ研究
https://www.aging-us.com/article/103371/text
抄録
本研究では,COVID-19を有する精神障害患者の予後に影響を与える因子を検討することを目的とした.2020年1月3日から3月1日までの間に武漢精神保健センターの集中治療室でCOVID-19と診断された精神障害患者をすべて抽出した。
ベースラインの特徴、臨床症状、検査パラメータ、精神障害の種類が予後に及ぼす影響を分析した。最終予後に応じて、患者を死亡群(5名)と治癒群(25名)に分けた。認知症患者の死亡率は、他の精神障害患者よりも有意に高かった(P = 0.001)。認知症患者の血清中のある種の臨床検査値は、非認知症患者と比較して有意に増加した
WBC値10.100±6.147 vs 10.100±6.147 vs. 5.694±3.383、p = 0.029
好中球数。8.504±5.993 vs. 3.764±2.733、p=0.008、BUN:8.300±4.072 vs. 4.364±1.196、p=0.001
我々の研究では、COVID-19を有する認知症患者の死亡率は、他の精神疾患患者よりも高いことが示された。認知症患者の炎症反応に注目することは、死亡率を減少させるための新たなアイデアを提供する可能性がある。
はじめに
COVID-19と呼ばれる人獣共通感染起源の新規コロナウイルスであるSARS-CoV-2によって引き起こされる攻撃性の高い急性呼吸器疾患は、世界を脅かす新たな公衆衛生の危機となっている[1]。公衆衛生と医療従事者は最前線に立ち、パンデミックの拡大を抑制し、緩和するために懸命に働いている。
本疾患への理解が深まるにつれ、がん患者[2, 3]、末期腎疾患患者[4]、妊婦[5]など、様々な特殊集団のCOVID-19患者が徐々に注目されるようになってきている。精神障害患者は長期にわたる治療や専門的なケアを必要とし、健康状態や心理状態も一般集団とは異なる。
今回のパンデミックにおける精神障害とCOVID-19のダブルヒットは大きな懸念材料となっている。しかし、この特殊な集団についての情報はほとんど報告されていない。
精神障害は、主に認知、感情、行動制御を障害する多様な疾患群であることが認識されている。精神障害は人生の早い時期に発症する可能性があり、すべての国、特に低・中所得国では総計的な有病率が高い。
精神障害を持つ人々は、公衆衛生情報へのアクセスが限られていたり、理解が困難であったりするため、一般の人々と比較して感染の可能性が高くなる。明らかに、パンデミックにおける精神障害とCOVID-19のダブルヒットは、危険性の増大につながる。
そこで本研究では、COVID-19を有する精神障害(特に認知症)患者の予後に影響を与える因子に焦点を当てた。
考察
本研究では、COVID-19を有する精神疾患患者のベースライン特性、臨床症状、臨床検査パラメータ、精神疾患の種類に関するデータを収集した。これらの情報を用いて、可能な限り内部関連性や相違点を見出した。中等度/軽度症状の患者と重度症状の患者の違いは、主に血中酸素飽和度、食欲不振/吐き気、呼吸困難に反映されていた。
患者の予後を分析したところ、認知症患者の死亡率は他の精神障害患者に比べて有意に高かった。また、認知症患者のWBC値、好中球数、BUN値は他の精神疾患患者に比べて有意に高かった。
このような非常に興味深い結果に直面して、認知症患者の死亡率がなぜこれほど高いのかを探る必要があった。
第一に、認知症は精神症状や行動症状が重い傾向にある。
第二に、認知症患者は活動量が少なく、長期の安静が必要なため、褥瘡、肺感染症、心肺機能不全などの重篤な合併症の発生率が非認知症患者よりも高いことである。
最後に、認知症の発症には炎症が重要な役割を果たしている可能性がある[6-8]。
炎症はアルツハイマー病(アルツハイマー病;認知症の最も重要な原因である)の特徴である。アルツハイマー病の認知症患者も炎症の程度が異なる[9]。慢性炎症は、様々なタイプの血管性認知症(認知症の2番目に重要な原因)の共通の特徴である[10]。
認知症患者の脳脊髄液には、アミロイド蛋白に加えて、急性炎症反応物質や炎症性サイトカインなどの炎症性分子が検出されている[11]。また、末梢感染はアルツハイマー病の発症と発症を悪化させる[12]。
しかし、COVID-19の一般患者を対象とした別の研究[13]では、重症例の患者では白血球数や好中球-リンパ球比が高い傾向にあった。したがって、認知症患者の持続的な炎症状態が、COVID-19を有する認知症患者の末梢血WBCと好中球数の増加の原因である可能性がある。
現在のところ、COVID-19を有する認知症患者の腎機能障害が他の精神障害患者よりも悪化することを裏付ける十分なエビデンスはない。我々の研究では、精神障害患者の炎症反応は腎機能障害と関連していたが、認知症患者ではこの現象は統計的に有意ではなかった。
したがって、BUN値の上昇はCOVID-19を有する認知症患者に特有のものではないかもしれない。これらの患者さんは症状が重く、それが腎機能の障害につながっているのかもしれない。
もちろん、認知症患者のサンプルサイズの制限から、相関分析の傾向がマスクされている可能性もある。したがって、認知症患者の炎症反応と腎機能障害との相関関係には注意が必要である。
少なくとも、現在の結果とこれまでのエビデンスに基づけば、この結論を否定するには不十分である。本研究の次のような限界を無視することはできないことは注目に値する。
我々の研究は精神疾患患者に限定されており、サンプルサイズが不十分であるため、小サンプルの臨床研究で見られる偽陽性の確率を回避することは困難である。
また、認知症は他の精神疾患を併発している場合もあり、患者間の不均一性から統計結果が過大評価される可能性がある。それにもかかわらず、我々の研究では、COVID-19を有する認知症患者の死亡率は、他の精神疾患を有する患者よりも高いことが示された。
認知症の炎症反応に注目することは、死亡率を下げるための新しいアイデアを提供する可能性がある。
COVID-19患者の死亡予測因子としての神経疾患:レトロスペクティブコホート研究
Neurological diseases as mortality predictive factors for patients with COVID-19: a retrospective cohort study
https://pubmed.ncbi.nlm.nih.gov/32643133/
本研究では,コロナウイルス疾患(COVID-19)患者の死亡率を増加させる要因を,2つのコホート病院のデータを解析して評価した。また、基礎となる神経疾患が死亡の危険因子であるかどうかを検討した。
このレトロスペクティブ・コホート研究では、成人入院患者103人(18歳以上)を対象とした。COVID-19患者の生存者と非生存者の人口統計学的データの違いを評価した。
多変量ロジスティック解析において、COVID-19の非生存を予測する唯一の有意なパラメータは、年齢と慢性肺疾患およびアルツハイマー型認知症(アルツハイマー病)の存在であった(p<0.05)。しかし、高血圧、冠血管疾患、脂質異常症、慢性腎臓病、糖尿病、およびアンジオテンシンII受容体拮抗薬(ARB)またはアンジオテンシン変換酵素(ACE)阻害薬、非ステロイド性抗炎症薬(NSAIDs)の服用歴は、COVID-19患者の死亡と有意に関連していなかった。最大ユーデン指数から得られた最適カットオフ値は70(感度、80.77%、特異度、61.04%)であり、非生存のオッズ比は年齢が上がるごとに1.055倍に増加した。
臨床医は、70歳以上、または慢性肺疾患やアルツハイマー病を有するCOVID-19患者の症状を注意深く観察し、管理すべきである。
リスク因子
韓国の国民健康保険制度の診断コードに基づいて、患者の基礎となる慢性疾患と神経学的疾患を調査した。脳卒中、特発性パーキンソン病(IPD)、アルツハイマー病などの基礎となる神経疾患はすべて神経内科医により再確認された。
COVID-19危険因子の先行研究とKCDCが発表した分類体系に基づき、糖尿病、慢性腎臓病(CKD)、慢性肺疾患または心血管疾患、がん、脂質異常症、高血圧などの慢性内科的基礎疾患の存在を調査した(図1)。慢性肺疾患は、慢性閉塞性肺疾患、喘息、間質性肺疾患、特発性肺線維症、または気管支拡張症と定義した。さらに、COVID-19患者における脳卒中、IPD、アルツハイマー病を含む神経障害の有無を調査した。ARBまたはACE阻害薬とイブプロフェンなどのNSAIDsを含む投薬歴のある患者も本研究に含まれた。NSAIDsは最近、アンジオテンシン変換酵素2(ACE2)を介してCOVID-19との関連が疑われていることに注意することが重要である。
非生存の危険因子
COVID-19の生存者と非生存者の人口統計学的データを比較すると、年齢に有意な差があった(p<0.05)(表1)。COVID-19患者の基礎疾患の併存を生存群と非生存群で比較したところ、糖尿病、慢性肺疾患、冠血管疾患、アルツハイマー病、脳卒中の有無は、非生存群で生存群に比べて有意に高かった(p<0.05)(表1)。しかし、高血圧、CKD、IPD、脂質異常症の有無は、非生存群と生存群で有意差はなかった。しかし、NSAIDsと同様にARBまたはACE阻害薬の服用歴のある患者では、死亡率に統計学的に有意な差は認められなかった。
多変量ロジスティック解析では、COVID-19非生存者を予測する唯一の有意なパラメータは、年齢と慢性肺疾患およびアルツハイマー病の存在であった(p<0.05)(表2)。COVID-19患者では、非生存者を予測するための年齢に関するROC曲線下面積は0.742(95%CI、0.646-0.823;p<0.0001)であった(表3)。最大ユーデン指数(J)から得られた最適カットオフ値は70(感度、80.77%、特異度、61.04%)であり、不生存のオッズ比は年齢が高くなるごとに1.055倍に増加した(図2)。
議論
今回の研究では、大邱市の2つの大病院のデータを解析し、重篤な症状のある患者のみを入院させたCOVID-19患者の死亡率の危険因子を評価した。本研究では、韓国におけるCOVID-19死亡例全体の約20%を対象とした。対象となった103例のうち26例(25.2%)は、抗ウイルス薬、ECMO、機械的人工呼吸器による積極的な治療を受けたにもかかわらず死亡した。その結果、慢性肺疾患とアルツハイマー病の存在がCOVID-19による死亡の予測因子であり、特に70歳から死亡リスクが増加することがわかった。
高齢化がCOVID-19患者の死亡の危険因子の一つであることを示す我々の知見は、先行研究[7, 9]と一致している。Zhouらによる研究 [9] には191人の患者が含まれていた。これらの患者のうち54人が死亡し、COVID-19患者では年齢の上昇が死亡と関連していることが報告されている。また、Porchedduら[7]は、イタリア北部でのパンデミック初期に、主に高齢の患者で死亡が発生したことを報告している。T細胞やB細胞などの免疫細胞の年齢に依存した機能障害や、さまざまなサイトカインの過剰産生が、ウイルス複製の制御障害をもたらす可能性が提案されている [12, 13]。また、高齢者における長期化した炎症性反応も、この年齢層の患者の死亡率の高さの原因となっている可能性がある[14]。
基礎疾患については、慢性肺疾患とアルツハイマー病がCOVID-19患者の死亡率を増加させることがわかった。これまでの研究では、糖尿病、高血圧、冠動脈疾患、脳血管疾患、慢性腎疾患、慢性肺疾患を含むいくつかの疾患がCOVID-19による死亡の危険因子であると報告されている[15,16,17]。この不一致は、我々の研究では比較的サンプル数が少ないためかもしれない。しかしながら、アルツハイマー病がCOVID-19による死亡の危険因子であるという我々の知見は、これまでに報告されたことはない。
末梢免疫応答の変化は、アルツハイマー病の病理学において役割を果たすことが知られている[18,19,20]。Busseら[21]は、年齢をマッチさせた健康な対照群と比較して、60人のアルツハイマー病患者はB細胞とT細胞の数が減少していたことを報告した。末梢耐性の維持と急性持続感染症の制御に重要な役割を果たす調節性T細胞(例えば、CD4+およびCD8+ T細胞)の数は、アルツハイマー病では顕著に変化したが、血管性認知症や前頭側頭型認知症のような他のタイプの認知症では変化しなかった[21]。したがって、血管性認知症に伴う脳卒中とは異なり、COVID-19を有するアルツハイマー病患者における死亡率の有意な増加は、末梢免疫応答のこれらの変化に起因すると考えられる。
SARS-CoV-2は、ヒトの体内でACE2に結合する[22]。ACE2は肺、心臓、血管、脳、および腸で広く発現していることが知られている[23]。これらの標的臓器のうち、肺はSARS-CoV-2感染に対して最も脆弱である。ACE阻害薬やARBはACE2の発現を増加させ、患者のSARS-CoV-2に対する感受性を高めることが懸念されている[24]。さらに、NSAIDの使用は、SARS-CoV-2の生存を抑制する炎症作用を弱める可能性が提案されている[25]。しかし、我々の研究では、これらの薬剤の使用はCOVID-19死亡率の変化とは関連していないことが示された。
我々の研究では、高齢の患者、特に70歳以上の患者はCOVID-19で死亡する可能性が高いことがわかった。さらに、慢性肺疾患とアルツハイマー病の存在が死亡リスクの上昇を予測した。したがって、COVID-19患者が前述の危険因子(高齢、慢性肺疾患、アルツハイマー病)を有する場合には、注意深く観察し、積極的な対症療法を行うことを推奨する。また、死亡リスク因子を有する患者のSARS-CoV-2感染予防には特に注意を払い、新たな対策を継続的に開発すべきである。我々の知る限りでは、アルツハイマー病がCOVID-19患者の死亡率を増加させることを示した最初の研究である。しかしながら、我々の研究は、少数のCOVID-19症例を用いてレトロスペクティブに実施されたという点で限定的である。したがって、これらの限界に対処するためにさらなる研究が必要である。
COVID-19出現後のニューヨーク市における過剰な神経死
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7370626/
ニューヨーク市(NYC)は、米国におけるコロナウイルス病2019(COVID-19)パンデミックの最初の震源地であった。2020年3月中旬から、NYCでの死亡者数は典型的な~1000人/週を超えて増加し、最終的には4月11日に終わる週に7726人の死亡者数に達した[1]。同週、NYCでは4441人の死亡がCOVID-19に起因していた[1]。これは、その週にCOVID以外の死亡が3285件あり、そのうち2000件以上が過剰であったことを示唆している。これらの過剰な非COVID死亡は、主な神経学的死因である脳血管疾患とアルツハイマー病を含む11のカテゴリーに起因していた [2]。我々は、脳血管疾患およびアルツハイマー病による過剰な非COVID死亡を他の死因と比較した。
これは、National Center for Health Statistics Provisional Death Counts[1]の二次解析である。死因はNCHSの方法論を用いて死亡診断書から判断されるが、新しいデータを反映するために後から更新されることもある [3]。主要アウトカムは、ニューヨーク市における心疾患、悪性腫瘍、腎疾患、糖尿病、インフルエンザ/肺炎、慢性下気道疾患、その他の呼吸器疾患、敗血症、その他/不確定、アルツハイマー病、脳血管疾患を含む11のNCHSが指定した自然死因のうち、COVID以外の死因による過剰死亡数で、01/04/20~06/20に終了する週のものである。18点のデータが欠落しており、その場合は以前の値を繰り越した。最初の過剰なCOVID以外の死亡は03/21/20に記録されたので、変化率を計算し、Studentのt検定を用いて差を検定するために、01/04/20-03/14/20と03/21/20-05/30/20の11週間で層別化した。
01/04/20-03/14/20では、NYCでの自然死の週平均数は1101(範囲1049-1142)であったのに対し、03/21/20-05/30/20では3247(範囲1128-7682)で、195%の増加であった(p < 0.001)(図1a)。図1aは、05/30/20の後に過剰死亡がほぼ正常なレベルに戻ったことを示している。03/21/20-05/30/20の間、COVID-19による死亡者数は週平均1578人であり、過剰死亡の全体を考慮していない。図1bはCOVID以外の過剰死亡の概念を示しており、03/21/20-05/30/20の間、平均1670/週であった。
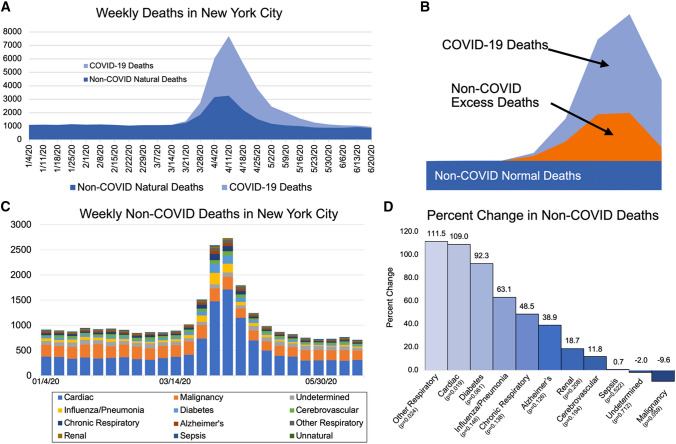
図1
ニューヨーク市における01/04/20~06/20/20までの週の自然死。 a すべての自然死。e COVID以外の死因の割合の変化:03/21/20-05/30/20終了週と01/04/20-03/14/20終了週を比較したもの。
非COVID過剰死因を図1cに示し、非COVID過剰死因の中で最も多かった心臓死の増加が顕著であることを示している。COVID-19と非COVID過剰死のすべての図は、https://www.icloud.com/pages/0vW0yM-3-PwN8m3IAR6F5DTHQ#Figure_1D。パーセンテージの変化は図1eにある。脳血管疾患とアルツハイマー病に起因する死亡は、脳血管疾患では週平均41.2~49.0(p=0.194)、アルツハイマー病では週平均21.3~29.6(p=0.126)と、それぞれ11.8%、38.9%増加した。
2020年3月中旬、NYCでCOVID-19感染症が増加した後、脳血管疾患とアルツハイマー病でCOVID以外の過剰死亡が増加したが、この増加は他の複数の死因に比べてはるかに少なかった。この期間にCOVID-19の検査が普及していなかったこと [4] は、過剰な非COVID死亡の多くが未診断のCOVID-19による合併症によるものであった可能性が高いことを意味している。COVID-19感染による神経学的合併症は報告されているが、他の臓器系ほど一般的ではない [5, 6]。脳血管死の増加が11.8%と比較的小さいことは、脳卒中がCOVID-19感染を合併する可能性があるが、他の合併症ほど致命的なものではない可能性を示唆している。アルツハイマー病死亡の38.9%の増加が大きいのは、介護の目標や高齢化を反映している可能性がある[5、6]。COVID以外の死亡が過剰になったもう一つの可能性としては、NYCでのパンデミックの間に医療へのアクセスが減少したことが考えられる。
我々の研究の主な限界は、特にCOVID-19検査が広範囲に行われていない場合には、NCHSの死因が根本的な死因を確実に特定できない可能性があることである。また、これらのデータは暫定的なものであり、改訂される可能性がある。これらの制限にもかかわらず、我々は、2つの最も一般的な神経学的死因である脳血管疾患とアルツハイマー病が、COVID-19による死亡率の最近のピーク時にニューヨーク市における肺死、心臓死、糖尿病死に比べて比較的少ない増加であることを発見した。

