Contents
Understanding the outcomes of COVID-19 – does the current model of an acute respiratory infection really fit?
www.microbiologyresearch.org/content/journal/jgv/10.1099/jgv.0.001545
初出:2020年12月17日
概要
コロナウイルス疾患2019(COVID-19)は、保護免疫の発達に続く急性/消失感染と考えられているが、最近の系統的文献レビューは、呼吸器および糞便サンプルにおける重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)のしばしば高度に長期化した脱落、かなりの割合の個体におけるPCR陽性の定期的な再発、および保護免疫の欠如に関連した再感染の証拠がますます文書化されている。
この感染パターンは、インフルエンザ A ウイルスや呼吸器合胞性ウイルスなど、他のヒト病原性呼吸器ウイルスの急性・再燃性とは全く異なる。SARS-CoV-2の長期の脱落は、疾患の重症度やウイルス中和抗体の発達に関係なく起こる。
SARS-CoV-2は、他のヒトおよび獣医用コロナウイルスやC型肝炎ウイルスのような他の哺乳類のRNAウイルスと共通の特徴である、強固に構造化されたRNAゲノムを有している。これらのウイルスは長期的に持続することが可能であり、おそらく、RNAの構造が自然免疫応答および適応性宿主免疫応答に及ぼす影響については十分に理解されていない。
COVID-19の消失と抗SARS-CoV-2 IgG抗体の出現は、ウイルスのクリアランスと再感染からの保護を意味するという仮定は、例えばパンデミック予測に用いられているSIR(susceptible-infected-recovered)モデルに暗示されているが、厳密に再評価されるべきである。
キーワード
COVID-19,SARS-CoV-2,コロナウイルス、持続性、呼吸器同期ウイルスインフルエンザAウイルス
略語
COVID-19,コロナウイルス疾患19;FCoV、ネココロナウイルス;HCV、C型肝炎ウイルス;IAV、インフルエンザAウイルス;MERS-CoV、中東呼吸器症候群コロナウイルス;MFED、平均フォールディングエネルギー差;RSV、呼吸器同期ウイルス;SARS-CoV-2,SARSコロナウイルス2型。
急性感染モデル
コロナウイルス疾患2019(COVID-19)と呼ばれる呼吸器疾患との最初の関連に基づいて、重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2)の感染は、当然のことながら、他の呼吸器ウイルスのそれに等しくなった-呼吸器症状の程度の変化、呼吸器管内での一過性の高レベルのウイルス複製、ウイルスのクリアランスに続くことを特徴とする急性期であった。クリアランスは、感染細胞を破壊する活性化T細胞の出現と、ウイルスを封じ込めて拡散を防ぐ局所抗体反応および体液性抗体反応に関連している。インフルエンザAウイルス(IAV)や呼吸器同期ウイルス(RSV)と同様に、強力な適応免疫応答は、一部の患者の肺に過剰な反応性(「サイトカインストーム」)を伴う免疫病理を引き起こす可能性がある。しかし、本質的には、病原性のあるウイルスであり、その免疫介在性のクリアランスは、病気の解決と、再感染や病気の発症からの長期的な免疫の発達につながる。SARS-CoV-2の分子・血清学的診断法はこのモデルに基づいており、COVID-19パンデミックの経過を予測するために単純なSIR(susceptible-infected-recovered)感染モデルが広く使われているように、SARS-CoV-2の分子・血清学的診断法はこのモデルに基づいている。
急性的に感染が回復するパターンが頻繁に観察される一方で、呼吸器からのSARS-CoV-2の脱落期間を調査したコホート研究や症例報告の分析では、このモデルのより広範な適用可能性に大きな疑問が投げかけられている。公表されたレビューでは、急性感染におけるSARS-CoV-2の平均脱落期間は17~18日(図1)[1, 2]、重症例では20日[2]と報告されているが、免疫力のない被験者ではPCR陽性のまま50日以上、場合によっては104日までウイルスを脱落させたとの報告が多数ある[3-6]。これらのウイルス脱離期間は、免疫力のない成人および小児のRSV感染者を対象としたPCR法による追跡調査で決定された平均脱離期間9.5日および5.7日よりも系統的かつ実質的に長いものである。同様に、他の病原性ヒト呼吸器RNAウイルスでも、限られた期間での脱落が観察されている[1]。
図1. SARS-CoV-2および他の呼吸器ウイルスの発症後の平均および最大脱落期間の分布
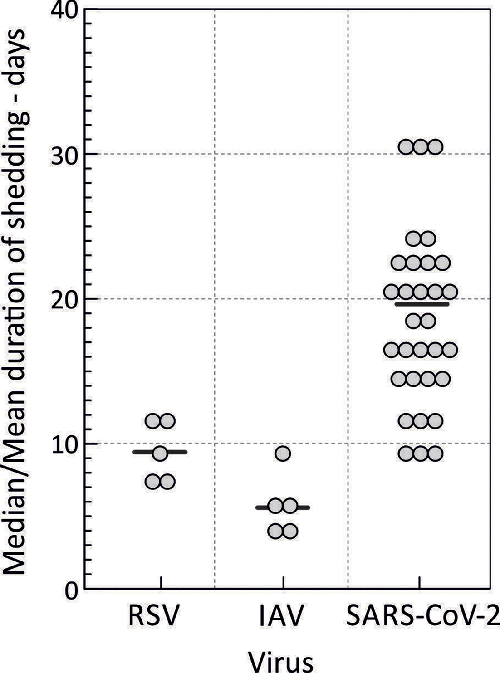
発表された31件の大規模コホート研究(総被験者数4150人)におけるPCR法によるSARs-CoV-2の排出期間の平均値を、RSVおよびIAVの排出期間と比較して示した [2, 37, 90-97] [1, 7-14]。黒の実線は、各ウイルスについての全研究の平均値を示す。
SARS-CoV-2 が他の呼吸器ウイルス感染症とさらに異なる点は、ウイルス脱落後の COVID-19 の再活性化が非常に頻繁であることだ。これは、最初の感染が解消された後、通常 2 回の陰性検査で SARS-CoV-2 RNA が検出された後と定義される(図 2)[15-20]。検出頻度は最初はサンプリング間隔とともに低下するが、いくつかの研究では50日以上経過した後に頻繁に再活性化することが報告されている。また、再感染の可能性もある。これらの初期の研究では、初期サンプルと後期サンプルの遺伝子株は比較されていないが、免疫不全者がSARS-CoV2の異なる種族に再感染した例が多数報告されている [21-26]。SARS-CoV-2に対する中和抗体の有無にかかわらず、長期化、再活性化、再感染のすべてが起こった。
図 2. 再感染の頻度と再陽性までの時間
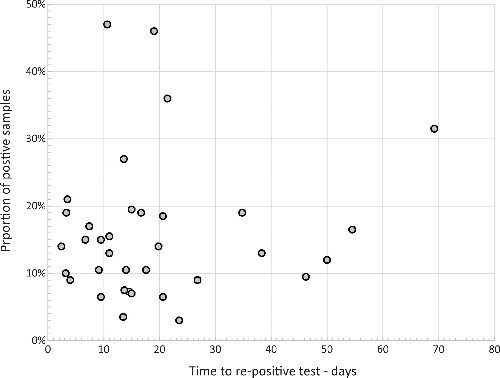
COVID-19後の2回の陰性検査後のSARS-CoV-2 RNAの検出頻度。データポイントは、35件の研究[15-20]からの要約データを示す;x軸値は、範囲で報告されたデータの中点値を示す。
これらの観察結果をまとめると、SARS-CoV-2に感染した人の中にはウイルスのクリアランスが達成されていない人がいることがわかるが、これは他の呼吸器RNAウイルス感染症の結果として一般的に想像されるものとは全く異なる現象である。長期化した感染の上限値は、ほとんどが未決定のままであり、完全に評価することは困難だ – 流出は断続的であるかもしれないし、ほとんどの研究は、COVID-19パンデミックの最近の性質に起因する比較的短い追跡期間に基づいているし、持続性の部位は、従来のサンプリングにはアクセスできないかもしれない。これは、SARS-CoV-2に過去に感染した14人のうち5人(平均4ヵ月)の患者の腸生検で、SARS-CoV-2のRNA、核タンパク質の発現、および電子顕微鏡による豊富なコロナウイルス粒子の可視化が最近発見されたことに例証されている[27]。これらの高い検出率は、従来の呼吸器サンプリングやPCR検査では一様に陰性であった個体で記録されており、以前に引用された研究では、従来の呼吸器サンプリングで記録されたよりもはるかに頻繁に全身性の持続性があることを示唆している(図1および図2)。SARS-CoV-2は呼吸器以外の組織にも感染することが明らかになっており、典型的な呼吸器ウイルス感染症とは一線を画している。
長期化したSARS-CoV-2感染の特徴
引用された研究の大部分では、長期化または再活性化した感染症の患者は、あからさまな免疫抑制を受けていなかった。さらに、長期化した感染症の発生はCOVID-19の重症度とは無関係であった;例えば、長期化した感染症を示した851例中99例のうち、61例は初期感染時に入院していなかった [28]。中和抗体の存在は、感染の延長またはPCR陽性の再発に実質的な影響を与えないようであったが、少なくとも2件の研究では、クリアランスに影響を与える可能性のある感染に対する宿主応答の変化について、プロテオミクス的または免疫学的証拠が示されている[29, 30]。他の呼吸器ウイルスと比較してSARS-CoV-2の感染期間が長いのは、過去の感染の違いによるものである可能性がある。SARS-CoV-2の感染はほとんど常にウイルスとの最初の遭遇であるのに対し、IAV、RSV、および他の呼吸器感染は一般的に、過去の感染から部分的な免疫を持っている人に起こる可能性があり、それが複製およびウイルスの脱落のコースを減衰させる可能性がある。しかし、長期的・周期的な活性化の発生と頻度(研究対象者の約15%で報告されている)は、それにもかかわらず、IAVやRSV感染のほぼ普遍的なクリアランスと耐久性のある免疫の確立とは全く異なっている。現在のところデータは限られているが、SARS-CoV-2の再感染は一次感染と同様に病原性が高く、長期化する可能性があり、最近のSARS-CoV-2感染でさえ、IAVやRSVで提案されているような重症度の低下をもたらすことができない可能性がある。
SARS-CoV-2のPCR陽性率は感染後期の深呼吸器検体で高く、SARS-CoV-2は呼吸器ウイルスが排出される期間を大幅に超えて腸管生検で検出された[27]。後者に関連して、ポリオウイルスやノロウイルスなどの腸内病原体と同様に、コミュニティ内でのSARS-CoV-2の循環をモニタリングするために、下水や排水のスクリーニングが使用されていた。しかし、発生初期の段階では、下水または廃水中のSARS-CoV-2ウイルス負荷と地域社会におけるSARS-CoV-2感染症の発生率との間には強い時間的関連性があるが [33,34]、ロックダウン期間中およびSARS-CoV-2循環停止後の長期モニタリングでは、SARS-CoV-2検出量の継続的なレベルまたは比例的な減少が見られた [35,36]。これらの予期せぬ所見の一つの解釈は、診断されていない持続性感染症のコミュニティには、相当数の長期的な糞便排泄物が存在する可能性があるということである。
割合の高い個人の呼吸器または消化管での長期または再発陽性と感染性との関係は、広く議論されてきたが、現在のところ解決されていない。SARS-CoV-2の検出の長期化は、感染細胞からの残留、非複製性のウイルス粒子や破片を介して生じる可能性があり、呼吸器サンプルでのRNA検出の長期化または断続的な例は、ウイルスの継続的な感染には関係がないかもしれない。これを裏付けるように、いくつかの研究では、COVID-19発生後6~8日以上経過したサンプルからはSARS-CoV-2を分離できないことが示されている([37,38,39])。しかし、この結論に反して、SARS-CoV-2は実際には活発に複製しているかもしれないが、それより後のサンプルではウイルス負荷が低いために分離できない可能性がある。このことは、定量PCR法によって決定されたSARS-CoV-2 RNAコピー数と単離の成功との関連性によって裏付けられている[38, 40]。例えば、SARS-CoV-2はCt値が13~17の範囲にあるすべての検体で分離されたが、Ct値が30を超える検体ではまれに(12%)分離された [40]。重度のCOVID-19およびより高いウイルス負荷を有する個体において、症状発症から 20日後にウイルスが分離されたという報告[41,42]は、この結論を支持するものである。第二に、試験管内試験培養でのウイルス感染性は、たとえサンプルに無傷のウイルス粒子が含まれていても、患者の抗体の血清転換後にIgGまたはIgAによって中和されることがある。最後に、他の呼吸器ウイルスとのより広い比較は有益である。ウイルスや細胞の破片が長期的に持続することで、PCRによるSARS-CoV-2 RNAの長期的な検出が可能であるならば、急性感染におけるウイルス負荷がSARS-CoV-2と同程度であるIAVやRSV感染ではなぜこのようなことが起こらないのであろうか?
SARS-CoV-2が肺外の部位、例えばGI管、心臓、腎臓、中枢神経系などで広範囲に全身感染しているという証拠が増えてきている([43]でレビューされている)。このことは、当然のことながら、このような多系統感染が「Long-COVID」の重度で多様な症状の根底にあるのではないかという更なる疑問につながる。慢性的な咳、息切れ、胸の張り、皮膚の発疹、長期にわたる嗅覚や味覚の喪失や変化、下痢を伴う胃腸障害、頭痛の継続、疲労感、脱力感、不眠、抑うつ、不安感、認知障害などの症状の多くを経験する人もいる。しかし、これらの症状の根底にある疾患の多くは、COVID-19 [44] の間の肺組織におけるしばしば重度で制御不能な細胞浸潤、高凝固および肺塞栓症、および他の臓器における関連する炎症性および血栓性疾患の病理学([45]で検討)から生じる肺瘢痕化の影響に由来する可能性があることは明らかである。しかしながら、最近の研究では、COVID-19後110-196日目の患者における嗅神経上皮におけるSARS-CoV-2 RNAおよび発現したウイルス性タンパク質の存在が記録されている[46]。4人の被験者は持続的または断続的な嗅覚および味覚障害を報告しており、これはこの組織におけるSARS-CoV-2の継続的な複製および関連する炎症反応と一致している。COVID-19後の腸管生検を対象とした別の研究では、高い割合でSARS-CoV-2複製の免疫細胞化学的証拠が認められたが [27, 47]、複製部位の組織学的解析では明らかな細胞病理学的証拠は認められなかった。
関連する問題は、他の検体での SARS-CoV-2 の検出が感染性と関連しているかどうかということである。COVID-19患者では、糞便検体がSARS-CoV-2陽性であることが多く[32]、そこからはまれではあるが陽性のウイルス培養物が得られている[47,48]。ACE-2 SARS-CoV-2受容体を発現するGI管の領域での活発な感染の証拠に加えて [27,47]、SARS-CoV-2はさらに、この受容体を発現する腎臓の近位尿細管細胞を標的としている可能性がある。しかしながら、SARS-CoV-2の尿中排泄はまれであり(3~4%;[43]で検討)このサンプルタイプからのSARS-CoV-2のウイルス分離の報告はほとんどない[49]。全体的に、また、全身感染が広く、多臓器に持続的に感染しているにもかかわらず[43]、現在の証拠は、SARS-CoV-2の感染性と伝達性は、少なくとも感染の初期段階では呼吸器経路に限定されていることを示している。
他のコロナウイルスとの持続感染
SARS-CoV-2が長期的に持続する可能性のある感染を確立する可能性は、COVID-19の分野で研究を行っているほとんどの人にとっては新しい概念であるが、他の宿主での感染をざっと調べただけでも、鳥類、コウモリ、げっ歯類、家畜やコンパニオンアニマルで長期的に感染を確立する能力があることが明らかになっている[50]。これらには、ウシコロナウイルス[51,52]、マウス肝炎ウイルスおよび鳥類における感染性気管支炎ウイルス[53,54]が含まれる。豚は、持続的な感染を確立するための様々な傾向を持つ様々なコロナウイルスに感染している[55-58]。ネコココロナウイルス(FCoV)に感染した猫も同様に、長期化し、しばしば生涯に渡って糞便を排出する頻度が高く、これがパンデミック性感染を維持している[59-63]。FCoVは、横断的研究では、毛づまり、シェルター、または個人の家庭にいる健康な猫の約半数からPCRまたはウイルス分離によって検出されている[62,64-66]。コウモリからの糞便サンプルからの高い検出率は、いくつかの種のコロナウイルスによる持続的感染と同様に一致している[67,68]。中東呼吸器症候群コロナウイルス(MERS-CoV)のRNAは、ドロメダリーラクダのいくつかのグループで動物の40%以上で検出されており、これもまた、感染したヒトではクリアランスの頻度が高いものの、持続性を示している[69]。
ヒト季節性コロナウイルス(HCoV-OC43,-NL63,-HKU1,-229E)は、一般的に急性で軽度の症状を伴う呼吸器感染症を引き起こすと考えられていた。しかし、これらのコロナウイルスが持続性を確立する可能性について、感度の高い分子検出法を用いて調査されたことはほとんどない。HCoV-NL63 と診断された患者を 30~40 日後に PCR で再検査した最近の研究では、21%の患者で持続性または再活性化が認められた [71] が、上記の研究で観察された SARS-CoV-2 と同様の結果が得られた。
SARS-CoV-2 のゲノム上の特徴
SARS-CoV-2,および哺乳類や鳥類に感染する他のすべてのコロナウイルスの顕著な特徴の一つは、ゲノム全体に大規模で広範なRNA二次構造が存在することである [28]。構造のサブセットは、ORF1a/ORF1bのフレームシフト部位のような転写または複製関連機能に関連しているが、ゲノム全体にわたるRNAフォールディングのより広範な分布は、[28, 72]正鎖の哺乳類および鳥類のRNAウイルスにおける以前に記述されたゲノムスケールの秩序化されたRNA構造(GORS)に対応しているかもしれない。GORSの保有は宿主の持続性と強く関連しているが、この関連の背後にあるメカニズムはほとんど解明されていない[73, 74]。SARS-CoV-2のゲノム配列は、ゲノム全体で15.1%の平均フォールディングエネルギー差(MFED)を示しているのに対し、C型肝炎ウイルス(HCV)の異なる遺伝子型では8~9%、ヒトペジウイルスでは11%であった [73, 74]。季節性および新たに出現したヒトコロナウイルスのMFED値は、8%(HKU1)から 18%(HCoV-OC43)までの範囲である。
機能的には不明であるが、SARS-CoV-2および他のコロナウイルスと他の持続性RNAウイルスとのゲノム特性の共有が存在することは、宿主相互作用および免疫応答の性質についての洞察を提供する可能性がある。構造化ウイルスの中で最も特徴的なのはHCVであり、長期的な不顕性感染を確立する傾向があり、ウイルスを除去したり防御免疫を生成したりするためのT細胞およびB細胞応答の失敗が関連しているが、あまり理解されていない [75, 76]。SARS-CoV-2感染におけるプロ炎症性サイトカインIL-6およびIL-1βの顕著な発現および網状腺細胞のアポトーシス [77,78] は、HCV誘発性炎症性疾患に寄与するプロ炎症性および調節性サイトカインの調節障害との類似性を示している [79,80]。HCVと同様に、SARS-CoV-2感染は、その免疫病理学および感染経過の長期化に寄与する可能性のあるT細胞およびB細胞の機能的欠陥の範囲に関連している[29,30,78,81]、および耐久性のある抗体応答の欠如[82]。FCoVの脱毛期間および持続性に影響を与える猫の宿主遺伝的因子の最近の実証は、実際にSARS-CoV-2感染に類似している可能性がある[83]。NKp46をコードするNCR1遺伝子との関連は、ナチュラルキラー(NK)細胞上での発現、および自然免疫応答とT細胞制御との結合におけるFC受容体γとの役割を考えると、特に興味深いものである[84, 85]。これは、広く使用されているリンパ球性絨毛髄膜炎ウイルス感染/マウスモデルにおける急性/慢性転帰の決定およびT細胞アレルギーの発生におけるこの調節経路の直接的な役割を考えると、コロナウイルス、HCVおよびその他の潜在的に持続性のあるウイルスの感染転帰に特に関連している可能性がある[86]。これは、インターフェロンと関連した自然細胞応答とウイルスRNAとの相互作用、つまりGORSによって潜在的に調節されている相互作用を、感染に対する下流の適応免疫応答に結びつける多くの経路の一つである可能性がある。
結論として、SARS-CoV-2感染が長期化し、しばしば全身性のSARS-CoV-2感染の証拠が増加していること、ウイルスのゲノム構造的特徴が持続性RNAウイルスと共有されていることから、COVID-19の急性消失の経過およびウイルスに対する防御免疫の発達という初期の仮定には注意が必要である。SARS-CoV-2とIAVやHCVに代表される急性・慢性感染症を引き起こすウイルスとの臨床的・免疫学的特徴の比較をまとめてみると,両者の中間的な特徴が明らかになった(表1).SARS-CoV-2は、最近コウモリからヒトに人獣共通感染したため、他のコロナウイルスに見られるような持続的なライフサイクルを十分に備えていないのではないかと考えられる。このことは、時間の経過とともに発展する可能性がある。感染力の強化と病原性の低下とともに、長期的な脱落は、新しい宿主でのウイルスの長期生存を支える強力な進化の原動力となる。侵入を促進するスパイク蛋白質のD614G変異 [87] は、重症急性呼吸器症候群コロナウイルス(SARS-CoV)およびMERS-CoVのスパイク蛋白質の受容体結合ドメインの変異と類似している可能性があり、SARS-CoV-2における多くの適応変異の最初のものである [88, 89]。
表1. SARS-CoV-2感染における感染および宿主応答特性と、典型的な急性および持続性ウイルス感染における感染および宿主応答特性の比較
| 急性感染症
A型インフルエンザウイルス |
SARS-CoV-2 | 持続感染
C型肝炎ウイルス |
|
|---|---|---|---|
| 感染動態 | 潜伏期間が短く、急性の解決する感染症
脱落の期間が短い ウイルスクリアランスに関連する免疫病理学 |
急性感染症であるが、ウイルス排出が長引くことがよくある
頻繁な再発 長期運送の頻度は不明 |
潜伏期間が長く、急性感染、その後の遅延した、しばしば部分的なクリアランス
長期的な持続性は60%以上の症例で発生する |
| 免疫 | 強力な細胞傷害性T細胞応答
耐久性のある保護中和抗体の生成 |
強いT細胞応答
可変で非耐久性の中和抗体反応 重症COVID-19におけるアネルギーとリンパ球減少症 |
ウイルス複製の初期制御に主に関与するT細胞
感染後にアネルギーになる 中和抗体は弱くて効果がない |
| 再感染 | 同じ血清型での再感染に対する長期的な耐性。
抗原変化を促進する |
ますます認識される再感染
非耐久性のNAb応答は、再発/再感染を可能にする可能性がある |
自発的または治療によって誘発されたウイルス除去後の再感染に対する免疫はない |
| 伝染;感染 | 急性期のみ | 8〜10日後に感染の証拠はない
持続性、再発性、または再感染時の感染力は不明 |
感染は急性期と持続感染の両方の段階で発生する。 |
SARS-CoV-2感染症の真の姿を明らかにすることは、その病態と治療法を理解し、診断検査アルゴリズムと臨床フォローアップをより効果的に利用する上で極めて重要であることは明らかである。最も緊急なことは、疾患の消失と抗SARS-CoV-2 IgG抗体の出現が感染の消失を意味するという仮定を厳密に評価することである。
資金提供情報
本研究は、P.S.S.へのウェルカム・トラスト研究者賞助成金(WT103767MA)によって支援された。
利益相反
著者は利益相反がないことを宣言している。
