Contents
pubmed.ncbi.nlm.nih.gov/33858306
オンライン公開2021年4月16日
概要
現在、細胞外DNAや循環遊離DNAは、がんを中心とした様々な病態において、臨床応用(診断、予後、治療効果のモニタリング、患者のフォローアップ)できる分子と考えられている。しかし、その分子特性から、他にも様々な機能を持つ可能性がある。本総説では、細胞外DNA(exDNA)が、細胞シグナル伝達、凝固、免疫、遺伝情報の水平移動による進化、炎症過程への適応反応などの基本的なプロセスに関与していることに注目する。これらのプロセスにおけるDNAの役割をより深く理解することで、病態をモニターしコントロールするためのより良いツールを開発することができ、また、リキッドバイオプシーにおけるDNAの応用にとどまらず、新しい治療法を生み出すのに役立つだろう。
キーワード 細胞外DNA、セカンドメッセンジャーDNA、水平DNA転送、酸化DNA、細胞外DNAトラップ
はじめに
真核生物では、DNAは細胞核の中に存在するというのが一般的な認識である。細胞外、特に血漿中にDNAが存在することを報告した最初の研究の一つは、1948年にフランスの研究者マンデルとメテが行ったもので、彼らは患者や健康な人の血漿中にDNAが存在することを証明した1。細胞外DNA(exDNA)は、炎症性疾患、自己免疫疾患、エリテマトーデス、心筋梗塞、糖尿病、がんなど多くの疾患で観察されるようになった2。その後の研究で、このexDNAが疾患の状態を反映するものとして機能することが示唆され、以来、研究対象になっている。この発見では、細胞膜を越えて存在するDNAをexDNA、血流、リンパ系、胆汁、牛乳、尿、唾液、粘液懸濁液、髄液、羊水などの循環生理液に含まれるexDNA分子を循環DNA(circDNA)と定義した3、4。
exDNAの生物学に関して、最も研究されてきたのはexDNAの起源と放出メカニズムである。exDNAはすべての細胞に由来し、主に高分子複合体(タンパク質、脂質、または他の核酸と結合)または細胞外小胞に関連したさまざまな形態で循環中に存在し得る5。これはexDNAが細胞から放出される方法に大きく依存し、文献には受動および能動のさまざまなexDNA放出メカニズムが述べられてきた。これらの研究により、DNAの細胞外空間への放出は、
1)DNA-タンパク質複合体(1000~3000塩基対)やDNA細胞外トラップなどの高分子構造体を介した生体細胞の代謝活性分泌により直接起こる可能性があることが示された、4ゲノムの不安定性(30~20,000 bpのサイズ)によって誘導される染色体外循環DNAの微小核形成と小胞輸送(エクソソーム、ヴィルトソーム、AGO2)によって、あるいは
2)アポトーシスやネクローシスなどの異なる死経路によって生じる細胞破壊のメカニズムの結果として間接的に生じるもの;9-13、および好中球細胞外トラップ放出、貪食、オンコシスからなる他の経路によって生成される細胞破壊メカニズムの結果として間接的に発生する。14-健康な人の場合、造血の成熟が正常なexDNAプールに大きく寄与していることが知られている。その後、複数の研究により、リンパ系/骨髄系組織が主に正常なexDNAプールに寄与していることがさらに確認された17。
Diehlらは、exDNAの量は腫瘍の負担と相関する、すなわち、患者の血液中のexDNAの量は腫瘍の負担と密接に相関し、腫瘍の成長および/または病気の進行に伴って著しく増加することを報告した19。しかし、循環腫瘍細胞だけがexDNAの唯一の供給源ではないことが仮定されている。したがって、exDNAの別の部分は、腫瘍微小環境の細胞、抗腫瘍反応に関与する細胞、および潜在的にストレスのかかった正常細胞にも由来することが推測される20。
血漿・血清または生体液中のexDNAの臨床応用に関しては、ほとんどの研究が腫瘍学分野で行われてきた。初期の研究では、細胞外に放出されたDNAは、例えば、DNAの完全性の変化21、がん遺伝子またはがん抑制遺伝子の変異、遺伝子メチル化異常、マイクロサテライトの変化22、ミトコンドリアDNA負荷レベルの変化23、染色体ゲノム再配列など、放出元の組織の遺伝的およびエピジェネティックな特徴を保持していることが実証された22。さらに、血液中の濃度は、腫瘍の最新の進展と特異性をリアルタイムで反映することができる。24これらの特徴から、exDNAは可能性のあるがんバイオマーカーとして提案された。25現在、exDNAの診断上の重要性はますます顕著になっている。実際、腫瘍学におけるその重要性は、「リキッドバイオプシー」という新しい分野での数千件の研究につながっている。つまり、リキッドバイオプシーとは、がんの早期発見、正確な診断、治療効果、予後、経過観察に関する情報を提供する非侵襲的診断検査であり、組織サンプルを得るために必要な侵襲的処置、特に連続したサンプルを必要とする場合は、これを回避することができる26。このような進歩に伴い、がん患者の層別化のための分子バイオマーカーの検査が必須となっている。このような検査は、診断時に得られた原発性腫瘍の生検・細胞診材料を用いて日常的に行われている。この方法は診断目的には適しているが、病気の進行や再発時の患者のフォローアップには不向きである。リキッドバイオプシーのコンセプトは、がん患者の管理に革命をもたらす可能性を秘め、組織サンプルを得るために必要な侵襲的な手順を排除し、治療反応や病気の再発に関する情報をその場で提供するために、がん学に導入された28-30。現在、リキッドバイオプシーはすでに臨床試験で用いられている。しかし、日常臨床に導入するには、いくつかのハードルを乗り越える必要がある31-34。この興味深い問題は、このレビューでは取り上げきれない。
しかし、生物におけるexDNAの生物学的役割はまだ不明である。本総説では、細胞内シグナル伝達、酸化ストレス応答、炎症・自然免疫、血液凝固、遺伝情報の水平移動による進化など、exDNAが直接的・間接的に関与する可能性のある生物学的プロセスについて、その実態を明らかにしようと考えている。
細胞内シグナル伝達におけるexDNAの役割
1969年、E. Bellは、情報DNA(I-DNA)またはインフォーマソーム(I-somes)と名付けられたリポタンパク質複合体にパッケージされたDNA分子を介して、exDNAと細胞間コミュニケーションの関連を初めて明らかにした。このI-DNAは、細胞質に存在する核DNA(ミトコンドリアではない)で、タンパク質合成の鋳型として働く核と細胞質間の情報仲介役と説明されている35-37。
exDNAは生物学的に活性な分子であり、遊離DNA断片、小胞結合DNA、DNA-高分子複合体(タンパク質脂質核酸複合体)という異なるタイプのDNAからなる異種複合体として分類されることが示唆されており、これらはDNAの静電特性や自己縮合特性により形成され、その機能はヌクレアーゼからの保護や免疫監視にある4、20、38。-40外来DNAは、細胞内に入ったとき、あるいは標的細胞の表面と相互作用したときに、細胞間メッセンジャーとして作用し、さまざまな生物学的応答を引き起こす、さまざまな活性を持つことができる。核酸配列は、その機能に必ずしも暗示的ではない。-42最近の研究では、exDNAの特異的なシグナル伝達特性の一部は、配列長、立体構造、DNA分子とヒストンや非ヒストンのクロマチン結合との関連、細胞内局在、メチル化状態、配列(すなわち、ジヌクレオチドCG含有)、酸化状態(8-oxodG)などの多様な要因に依存していると考えられている20,43-46。
高分子(タンパク質-脂質)に結合した、あるいは遊離した外来DNAは、白血球の細胞膜にあるセンサー4,47や細胞質内にあるリガンドレセプターによって検出される、また、アルブミンなどのタンパク質がexDNAと複合体を形成し、エンドサイトーシスにより細胞内に取り込まれることも報告されている20。細胞内に侵入したexDNAは、エンドソーム膜に存在するTLR-9(Toll-like receptor 9)によって検出され、非メチル化配列によって活性化される49-55。
一方、細胞外小胞(EV)に結合したDNAは、生物学的に機能し、細胞間メッセンジャーの役割を果たし、DNAをコードするmRNAやタンパク質レベルの増加により標的細胞の生物機能を制御し、細胞の増殖を刺激して表現型の変化を誘発することができる16,38。EVには、全ゲノムからランダムに選択されたDNA断片が含まれており、クロマチン結合二本鎖DNAの5ʹプロモーター領域、遺伝子コード領域、3ʹ非翻訳領域にまたがっている38。後者は、cGAS-STINGを介したインターフェロンI型(IFN-I)応答の活性化などのシグナル伝達経路を活性化し、標的細胞における分子応答を引き起こす細胞間コミュニケーションに最も関連するものである56。エクソソームは、エンドサイトーシス、融合、あるいは特異的な受容体結合といった異なるメカニズムによって細胞から細胞へと移行することができる38。エクソソームは、C型レクチン、CD33、カドヘリン11、インテグリンα6β4、CD9、CD81、TIM1/TIM4といった直接的に、あるいはEGFRといった間接的にその内部化を促進するいくつかのタイプの受容体を使用していると考えられる57。
ゲノムDNAの水平移動とシグナル伝達は、細胞間コミュニケーションを媒介し、影響を受ける細胞の機能に影響を与え、ゲノムへの統合や標的細胞の受容体への結合によって、有害物質に対する耐性の誘導、免疫学的変化、転移の発生、がん細胞への転換を可能にする遺伝的不安定性の発生などの生物学的効果を引き出すかもしれない20、36、39、40、47。このようなexDNA(遊離または結合したEV)の活性は、心筋症、がん、アルツハイマー病、骨格筋疾患などで観察されており、細胞間コミュニケーションによって作用し、受容細胞の生物学的機能に影響を与えている38。
細胞シグナル伝達におけるexDNAの活性の可能性を試験管内試験で検証した:T細胞をドナーから抽出し、単純ヘルペスウイルス(HSV)に暴露した。HSVによる刺激でT細胞が放出したDNAを分離し、B細胞培養に3日間加えたところ、抗HSV抗体が合成された。また、HSVやポリオウイルスに暴露されたT細胞の培養液から放出されたDNAをヌードマウスに注射したところ、注射5日後に、これらの病原体に直接暴露されることなく、特異的な抗HSV抗体や抗ポリオ抗体が作られた。これらの実験は、T細胞が放出したDNAが、適応免疫反応に関わる細胞シグナルのメディエーターとして機能する可能性を示しているようだ4,47。
酸化ストレス応答におけるexDNAの役割
分子、細胞、組織レベルで恒常性を維持するために、さまざまな経路が活性化される。Kostyukとその共同研究者は、酸化した外来DNAが、DNAを獲得した受容体細胞の種類によって、生存と細胞死に影響を与えることを実証した。彼らのモデルでは、酸化した外来DNAが、NF-kBの核へのトランスロケーションによって炎症反応に関与するさまざまな経路を刺激し、TNF-α、IL-1, IL-2, IL-6, IL12、接着分子といった炎症性サイトカインの合成が促されると示唆した58。これにより、活性酸素が増加し、その影響は、酸化されていないexDNAと比較して、免疫反応刺激において12倍となる58。酸化されていないDNAは、NF-kBやNRF-2の発現を増加させるため、酸化ストレスの反応が弱く、長期化し、慢性的な細胞死を引き起こすため、反応の大きさが大きく異なる58,59。8-oxodGは、内皮NO合成酵素60の減少とともに一酸化窒素(NO)の産生低下を誘導し、NAD(P)H酸化酵素(NOX4がコード)を増加させることにより、大規模かつ急性な細胞死を引き起こす61。酸化ストレスは、線維芽細胞のKi-67減少に伴う増殖の低下をもたらし、その後細胞死を引き起こす58、60。
一方、間葉系幹細胞では、酸化したexDNAの影響により、細胞を活性酸素から守るシステム、例えばNRF-2の活性が上昇し、一方、HUVECやMCF-7などの細胞株では、代わりにNF-kBやNOX4のレベルが上昇した。58,61このことは、DNA中のGC量とその酸化レベルが細胞の生存に直接関わっていることを示す。
酸化ストレス時に発生する活性酸素が核およびミトコンドリアDNAに損傷を与えることは広く認められている。したがって、細胞外培地に放出された活性酸素はexDNAを酸化して8-oxodGを形成し、8-oxodGの生産と細胞内への取り込みとの間のフィードバックサイクルを引き起こし、活性酸素のより大きな生産が起こり、細胞が死ぬまで継続すると考えられる58,62…。このことから、酸化したexDNAは酸化ストレスマーカーとなる可能性があり、その酸化レベルは、CGジヌクレオチドが酸化されやすいため、その存在量と関連することが示唆されている63,64。このexDNAの存在は、増殖抑制や活性酸素トリガーによるアポトーシスと関連すると言われている63。
この点に関して、最近の研究で、酸化されたexDNA(8-oxodG)は、照射部位に隣接する細胞における「バイスタンダー」効果を通じて放射線適応反応を制御するシグナル分子であることが示された62。バイスタンダー効果は、ゲノム不安定性の発生、細胞死、バイスタンダー細胞による適応反応と関連しており、これらは、受けた照射量に依存する。放射線そのものが一次酸化ストレスを引き起こし、活性酸素のレベルを上昇させ、デオキシリボース環の破断によってゲノムDNAに損傷を与え、その結果、アプリック/アピリミジン部位、二本鎖切断、DNA-タンパク質架橋、および酸化塩基の形成が起こる62,65。これらにより、8-oxodGレベルが上昇し、アポトーシスが誘発され、酸化されたexDNAが放出されやすくなり、それがバイスタンダー細胞によって獲得され、アポトーシスの初期段階に関与する経路を誘発する。しかし、適応反応では、細胞内の活性酸素が増加し、抗酸化反応の活性化によってDNAの破壊が修復され、その結果、短期的に細胞周期が停止するのである62,66,67。一方、低線量の放射線は、放射線適応反応を引き起こし、活性酸素レベルの減少によってアポトーシスが抑制されるかもしれない65。
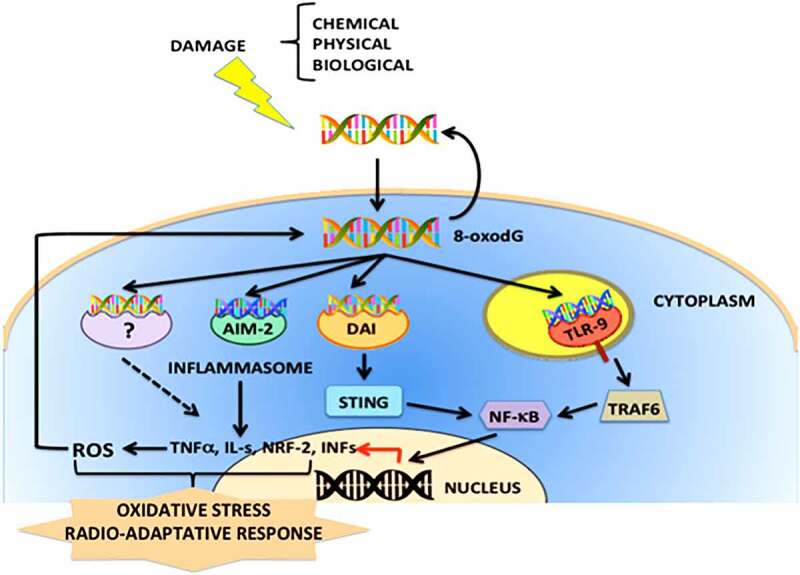
結論として、(dG)n酸化exDNAが様々な受容体に結合すると、NF-kBを活性化し活性酸素レベルを増加させるTLR-9への結合で観察されたように、異なるシグナル伝達経路が引き起こされる。DNAが修復されるか、あるいは細胞死が起こるかは、ある程度、各細胞の分化状態に依存する(図1)58,65。

図1 酸化したexDNA(8-oxodG)が活性化する細胞内シグナル伝達経路を模式的に示したもの
細胞ストレスや細胞損傷の様々なメカニズムによって放出されたexDNAは、酸化したヌクレオチドを豊富に含み、タンパク質や脂質と複合体を形成している可能性がある。DAMP(損傷関連分子パターン)シグナルとして働く8-oxodGは、細胞内に容易に侵入し、STING、AIM-2、RIG-1、DAIなどのPRR(パターン認識受容体)と相互作用し、ROS(活性酸素)がDDR(DNA損傷応答)応答を誘導する可能性がある。
炎症(または自然免疫)におけるexDNAの役割
exDNAはTLR-9によって認識され68,69、特に炎症過程に関与するサイトカインの産生を誘発し、好中球を活性化し、好中球細胞外トラップ(Neutrophil Extracellular Traps: NETs)として知られるDNA細胞外トラップを放出するかもしれないからだ。70,71しかし、好酸球(EET)、好塩基球(BET)、マスト細胞、植物細胞からも細胞外DNAトラップが放出されることが報告されており、この現象は好中球に限ったことではない。また、活性化したT細胞、B細胞、NK細胞、単球もミトコンドリアDNAを放出し、細胞外の網状構造を形成することが観察されている73。
NETは、DNA、ヒストン、顆粒、細胞質タンパク質、好中球エラスターゼ、ミエロペルオキシダーゼ、カテプシンG、プロテイナーゼ3、ゼラチナーゼ、LL-37、ラクトフェリン、カルプロテクチンからなるネットワークのような細胞外構造である。NETの主な機能は、微生物を捕捉して播種を避けることである74,75。この超分子構造体には、好中球が放出する顆粒球酵素が局所的に高濃度で含まれており、侵入した微生物(細菌、真菌、ウイルス、寄生虫)を排除している。73NETの形成を開始するメカニズムはNETosisとして知られており、病原体関連分子パターン(PAMPs)、炎症性サイトカイン(TNFとIL-8)、クロマチン結合タンパク質HMGB1によってトリガーされると考えられる。この過程で、ゲノムDNAは、ヒストン3と4のアルギニン残基をシトルリンに変換する核内酵素であるペプチジルアルギニンデミナーゼ4(PAD4)によって巻き戻され、ヒストンの正電荷が中和されて、クロマチン脱凝縮に有利になる。これらの因子の複合作用により、NET´sの抗菌活性が発揮される。要約すると、NETの抗菌活性は、それを構成するすべての成分の複合的な作用によってもたらされるのである72,79。
ヒストンは真核生物や古細菌にとって必須の物質だが、前世紀半ば、一部の研究者は、ヒストンが強力な抗生物質80であり、ナノモルオーダーの濃度で細菌を排除できることを発見した81。哺乳類では、抗菌活性またはNETは、さまざまなタンパク質の酵素活性に起因する活性酸素の形成、領域のわずかなアルカリ化(pH7.6)、および裸のDNAとヒストンからなるネットワーク(ポリヌクレオソーム)に浸されている抗菌ペプチドとの直接接触によって発揮される。75NETosisによって細胞外に放出されたヒストンは、患部の細胞表面に存在し、TLR-2、TLR-4、TLR-9などの受容体と相互作用して、上皮細胞や内皮細胞に用量依存的に細胞毒性作用を及ぼすことが分かっている83。また、細胞外のヒストンが原核生物のプラスミドDNAに結合し、DNA-gyraseの活性を阻害することが実証されている85。さらに、炎症過程におけるNETのこれらの細胞外ヒストンの細胞毒性活性は、真核細胞をも殺すことができ、敗血症の過程で観察される毒性における必須成分として分類される83,86,87。
一方、自然免疫系は、全身のホメオスタシスの中断を検知し、それに反応するように進化してきた。障害は、PAMPおよびDAMP受容体を通じて感知される88。TLR-9は、真核生物よりも原核生物に多く存在するGpCに富む非メチル化DNAによって優先的に活性化される79。また、抗菌剤LL-37(37アミノ酸からなるカテリシジン抗菌ペプチド)やHMGB1タンパク質に結合したexDNAは、裸のDNAよりも強力に樹状細胞を活性化することが証明されている。これは、異なる分子に結合したexDNAが安定構造を形成し、TLR-9などの各種受容体と確実に認識・相互作用するからだ79、89
最近、exDNAはその陽イオン電荷によりIL-26と結合し、その配列に含まれる両親媒性の2つのαヘリックスを膜へのアンカーとして用いて受容体細胞への侵入を促進することが指摘されている90。exDNAとIL-26の結合は、DNAにより直接活性化されるか、cGAS(サイクリックGMP-アンプ合成酵素)などの中間細胞質センサーにより活性化されると考えられるSTINGという膜貫通タンパク質を活性化している。この証拠から、著者らは、IL-26が異なるタイプのDNA(ゲノム、ミトコンドリア、NET)に免疫刺激特性を付与し、単球やNK細胞における炎症性サイトカインの分泌を誘発すると結論付けている54。
さらに、NETは、1)自己DNAに対する自己抗体とNETに存在する抗菌ペプチドが合成され、B細胞の活性化を引き起こすことを特徴とする全身性エリテマトーデス、2)IFN-γの生産をもたらす樹状細胞の成熟によってTh1病原細胞の拡大を引き起こす小血管炎などの非感染症病態においても重要な役割を果たすことが明らかにされている、3)アテローム性動脈硬化症では、NETが形質細胞様樹状細胞を刺激してIFN-αを産生し、アテローム性動脈硬化プラークの成長を促進することが実証されている。4)がんでは、腫瘍細胞がIL-8とG-CSFの放出を通じて好中球を刺激し、NETsを形成して転移に適した微環境を形成するものである。まとめると、この種の疾患におけるNETの存在は、最終的に慢性炎症無菌化の悪循環をもたらすということである73。
このようなNETを介した免疫は哺乳類に限ったことではなく、いくつかの植物の根が活発にDNAを放出することも報告されている。これは、根に放射性リン標識dCTPを投与すると、細胞外培地に回収され、明らかな細胞死を起こすことなく実証されている91,92。この細胞外核酸は、NETに似た構造を形成している。今のところ、主なDNA放出機構は不明だが、この植物ネットワークは、植物の根に病原微生物が侵入することも回避していることから、その機能は哺乳類と同様であることは明らかである(図2)91、92。

図2 免疫反応におけるexDNAの関与の可能性
細菌、真菌、その他の日和見寄生虫は、マクロファージや樹状細胞などの免疫系細胞に認識され、炎症性サイトカインの放出や活性酸素の発生を誘発する可能性がある。いくつかの刺激により、NET(好中球細胞外トラップ)が活性化され、PAD4、NF-kB、ヒストンなどのタンパク質が関与し、DNA分子ネットワークの構築や病原体の捕捉に貢献する。これらにより、複数の免疫細胞の参加が促され、最終的に外来微生物の死滅と排除につながる。
がんの場合、Albrenguesは、喫煙によって引き起こされる炎症過程で増殖した播種性乳がん細胞が、活性化したNETによって、眠っていた転移細胞の覚醒を開始することを示した。93MMP-9, インテグリンα3β 1, FAK (focal adhesion kinase), laminin-111とともに、DNAは免疫系の回避とがんの進行に重要な役割を果たす93、94。
血液凝固におけるexDNAの役割
近年、凝固カスケードに属するタンパク質のクロマチン放出への関与が報告されており、特にFactor VII Activating Protease(FSAP)がヌクレオソーム放出に関与していることが確認されている95。FSAPは、DNAの分解に関与するDNAse Iと会合し、アポトーシス細胞や壊死細胞におけるヌクレオソームの遊離に関与し、未知のメカニズムで物理的に結合し、標的のセルピンα2-アンチプラスミン(AP)やC1阻害剤(C1inh)と複合体を形成している。FSAPはヌクレオソーム、グリコサミノグリカン、RNAによって活性化され、おそらくその阻害剤を放出することによって活性化されると考えられる96,97。
最近の解析により、exDNAは生体内で血液凝固を促進する人体の「天然特異面」と考えられていることが明らかになった。同様に、NETの一部である活性化好中球のexDNAが、FXIIとFXIに依存する血液凝固を誘発することが観察されている98、99。さらに、ヒストンがVWFのA1ドメインと相互作用し、GPIbαを介した血小板の接着を促進することが確認されている102)。
NETはフィブリンと交配し、DNA溶解や組織プラスミノーゲン活性化因子(tPA)に対して抵抗性のある構造ネットワークを形成することが示されており、フィブリンにクロマチンが結合することにより、せん断力に対してより抵抗性のある太くて安定した繊維の形成が誘導される。Invitroの研究では、フィブリンは血栓中のexDNAと共局在することが示された103。このような背景から、最近の研究では、ヒストンが血小板に結合し、フィブリノゲンなどの血漿接着タンパク質を動員することで、血小板凝集を引き起こし、微小血管の血栓性閉塞や血小板減少を引き起こすことを生体内試験モデルで明らかにしました;この結果は、ヒストンと内皮細胞表面にある負に帯電したグリコサミノグリカンとの細胞外相互作用が、凝固の活性化に寄与し、内皮のグリコカリクスの抗凝固特性を阻害している可能性を示唆している。104同様に、exDNAの濃度が上昇すると血液の粘度が上昇し、自己免疫の免疫原性プロセスが引き起こされるため、微小循環に問題が生じることが判明している72。
遺伝子の水平移動における役割
exDNAは、試験管内試験およびinvivoで他の細胞に入り込み、遺伝情報を伝達する能力を持つことが明確に証明されている。その結果、受け取った細胞の生物学的性質は、exDNAが親細胞と同様の配列や変異を含んでいるために変化し、遺伝的な変化をもたらす可能性がある。105このexDNAの能力を示唆した最初の報告は、1968年にPerc106によって行われ、この転移性DNAを「代謝性DNA」と名付けた。この事実は、その後、1972年にRogers107によって、3年後にはAnker108によって裏付けされた。これと並行して、1965年には、exDNAが血流やリンパ系を移動する能力を持つことから、転移の拡大に関与しているのではないかという仮説が立てられた109。は、この現象を「ゲノメタスタシス」と呼び、2010年には、がん患者の血漿に含まれるexDNAが試験管内試験でがん原性情報を感受性細胞に伝達することを実証し、血漿中に循環する優性がん遺伝子の配列が遠隔臓器の感受性細胞にトランスフェクトされることで転移が起こるという結論を出している110。このような特徴から、がん患者から得られるexDNAは「オンコゾーム」と呼ばれ、血管新生の促進にも関係しているとされている111,112。
このことは、血清に含まれるDNAが受容体細胞に取り込まれ、統合される可能性を強く示唆している113,114)。この現象は、妊娠などの非病原性条件下でも起こりうる。男性胎児を出産した女性の脳にY染色体の特定のセグメントが移行し、統合されることが観察されている。この記述から、遺伝子の水平移動に由来する「マイクロキメリズム」と呼ばれる現象が生まれた115。
これまでの情報によると、2015年にMittraと共同研究者は、NIH3T3の核におけるexDNAの断片を後で特定するためにNHI3T3に移した患者および健常者の血清から抽出したDNAが、試験管内試験および生体内試験でアポトーシスとDNA破裂を誘発する可能性を初めて示した116。しかし、この研究は、発生したダメージにのみ着目しており、細胞代謝の変化や全体的な酵素活性の変化など、考えられる機能的影響については全く考慮していない116。
標的細胞への侵入を可能にするexDNAの重要な特徴は、多数の(dG)nモチーフを含むという事実である。特に、ヒトの細胞では、核DNAにGpCが濃縮された配列があり、特に反復性のあるリボソーム配列に多数の(dG)nモチーフを持つ。これらの配列の長さは(dG)11または(dG)13であり、酸化されると適応反応を20倍まで高めることができる。癌細胞のゲノムDNAには、活性化された癌遺伝子と同様に、これらの増幅された配列が豊富に含まれていると仮定されている117,118。119,120また、exDNAにトランスポーザブル移動遺伝要素が存在すると、ある細胞から別の細胞へのDNA断片の移動、および受容体細胞のゲノムへの不正な統合を促進し、ゲノムの不安定化に寄与する可能性がある119,121.
最近の研究では、外来DNAが細胞内に入ると、受容体TLR-9によって認識され、NF-kBシグナル経路が開始され、TLRシグナル軸TLR9/NK-kB/サイクリンD1を通じてサイクリンDの発現を増加させることが明らかにされた。このことは、少なくとも1つのホルモン依存性乳がん細胞株の増殖を促進した。40他の著者は、細胞から放出されるexDNAが細胞間メッセンジャーとして機能し、受容体細胞に入ったときに2つの可能性を持つことを確認した:1)宿主ゲノムに統合する、または2)特定の受容体に結合し、最終的にいくつかの生物学的効果、例えば有害物質に対する耐性の誘導、免疫調節、転移の発生またはゲノムの不安定性につながる異なるシグナル伝達経路を誘発する、40、119、122がある。
上記と同様に、2013年のTuomelaと共同研究者は、ドキソルビシンで殺傷したMDA-MB-231細胞からのexDNAが、細胞破片にさらされるとこの同じ野生型細胞株の浸潤を促進し、このイベントは受容体TLR-9によって媒介されることを実証した123。123同様に、García-Arranz124は、非腫瘍性細胞からのexDNAは、細胞の増殖と転移を抑えることができると結論付けている。このことは、放出されたexDNAが、それが由来する細胞の生物学的状況によって異なる効果を持つ可能性を示唆している。これらの効果を利用して、腫瘍の成長を抑制する方法が考えられる124,125。
パースペクティブ
126正確な診断、予後の判定、治療法の選択、疾患の連続モニタリングにおける循環腫瘍DNAの使用は、がん患者の生存、生活の質、治療への反応という観点から非常に重要である。127この情報の使用は、非侵襲性、低コスト、適切かつ効率的という他の利点を持って、疾患の個人化描写に用いることができる。
しかし、exDNAの生物学的役割は、がん研究だけでなく、他の病態や正常な生理学的状態への顕著なステップを踏み、いくつかの医療応用において、別の範囲を持っている。本総説で紹介するデータは、exDNAが歴史的に確立されている以上の機能を持つことを示唆している(表1参照)。この生体分子は、活発に分泌されるとタンパク質や脂質と結びつき、隣接する細胞間の分子メッセンジャーとして機能する。おそらく細胞の活動を同期させるため、あるいは失った機能の集合体として、生理的条件が必要とするときにこのDNAを組み込むことによって容易に回復できるだろう。以上のことから、異なる生物界の間でexDNAが放出されたことは、クロマチンが2つの異なる機能で進化したことを示唆している:1)大きなDNA断片を組織化すること、2)ゲノムの完全性を維持する防御機構として機能することである。遺伝情報の保護・制御機構としてのクロマチンの例として、NETと呼ばれる構造が考えられるが、これはクロマチンが外来生物に対する防御機構として利用されている構成の一つである可能性がある。しかし、exDNAはクロマチンやNETの構成要素であるだけでなく、TRL-9、TLR-2、TLR-4などの受容体を介して免疫系を活性化し、異なる細胞の動員を誘導して適応免疫反応を引き起こしたり、炎症プロセスを解消することもできる。
表1 真核生物におけるexDNAが関与する生物学的プロセス
| 生物学的プロセス | exDNAタイプ | キー分子 | 化学的または生物学的特性 | 生物学的効果の可能性 |
|---|---|---|---|---|
| 細胞シグナル伝達 | リポタンパク質複合体に関連する | レセプターSTING、AIM-2 RIG-1、DAI、TLR | 8-oxodGの高含有率 | セカンドメッセンジャー核と細胞質間の情報交換細胞内、細胞間。 |
| 酸化ストレス | 酸化された | NF-κB、TNF-α、IL-1,2,6,12NRF-2、接着剤分子 | 8-oxodGの高含有率 | ホメオスタシスの維持 |
| 電波適応型レスポンス | 酸化・非酸化性 | TLR-9、NF-κB | 受容体細胞生物学 | 細胞周期停止酸化防止反応 |
| イミュニティ | クロマチン | TLR-9、PAMPs、HMGB1、ROS、PAD4、IL-26、LL-37、プロ炎症性サイトカイン、 | ヒストンH3、H4のシトルリン化反応 | NETs形成抗菌活性 |
| 凝固 | ヌクレオソーム | FSAP、第XI~XII因子、HK、VWF、GPIbα | NET、グリコサミノグリカン、RNAが存在すること | カスケードの活性化血栓形成血液粘度の上昇 |
| 遺伝子導入 | ネイキッドDNA クロマチンオンコソームアポトーシス体 | TRL-9、NF-κB、サイクリンD1 | 感受性の高い受容体細胞 | 遺伝性生体修飾血管新生転移・侵襲マイクロキメリズムアポトーシス |
| 遺伝子増幅 | 木端微塵 | トランスポザーゼ? | トランスポーザブル遺伝子エレメントの存在 | 代謝機能の獲得ゲノム不安定性 |
一方、外来性DNAの獲得は、原核生物や真核生物の間、あるいはそれらの間で遺伝子や遺伝子多型の獲得を容易にし、生物の生息地での発生や生存において有利な特性を提供することから、進化における役割を担っている。真核生物の場合、新たな遺伝子の獲得も進化の原動力であることは、内共生や遺伝子交雑の例からも明らかである128。
近年、核への遺伝子導入において、裸のDNAよりもタンパク質や脂質と結びついたDNAの複合体の方が効果的であるという証拠が増えつつあり、以下のような疑問が湧いてきた:1)様々な疾患の病態生理過程において、exDNAはどのように移動するのか?また、正常な状態で放出されるものとどのような違いがあるのか?2) このexDNAは、DNA結合タンパク質のある線状構造なのか、ない線状構造なのか?exDNAと相互作用する他の成分の組成に関する知識は、細胞外核酸のホメオスタシスと複数の標的細胞との異なる相互作用に関するより良い理解をもたらすであろう。
ヒトの様々な疾患の治療において、治療標的としてexDNAを使用する新しいアプローチが提案されている。例えば、1995年のLinardouは、癌治療における組換えDNAse Iの採用を提案した。129DNAse IとDNAse1L3は、DNAの修復、複製、分解、およびexDNAの恒常性に関与するエンドヌクレアーゼである130、131。試験管内試験および生体内試験のがんモデルでDNAse Iを投与すると、腫瘍細胞の増殖、移動、接着、浸潤が減少し、血漿中のexDNAのレベルの有意な低下と転移の発生が相関することが報告されている93、130、132。DNAseの治療効果の一部は、NETosisの阻害と抗炎症および免疫調節反応によって媒介される。133アルツハイマー病もDNAse Iの使用の可能性の一つである。134このエンドヌクレアーゼの全身投与は、アミロイドカスケードとエクソソームの破裂または融合に影響を与えることができ、抗炎症作用、NETの溶解、DNA-アミロイド-β複合体の低減という、三つの作用メカニズムの可能性が考えられる。134、135
最後に、これまでの取り組みにより、細胞のホメオスタシスにおけるexDNAの生物学的役割について、もっともらしい概要を示すことができた。しかし、exDNAの機能性や、exDNAの存在に直接関連する病的変化を理解するのに役立つ、より適切なツールや生物学的モデルの必要性はまだ明白である。
謝辞
この研究は、CONACyTの助成金番号6901、CONACyTの助成金番号465479の支援を受けている。この研究は、Ileana Jocelyn Fernández-DomínguezがUniversidad Nacional Autónoma de Méxicoの博士号(生物科学)の要件の一部を満たすために提出されたものである。
資金調達
この研究は、Consejo Nacional de Ciencia y Tecnología grants [6901]の支援を受けている。
利害関係の開示
著者は利益相反のないことを報告している。