Contents
The Influence of Meal Frequency and Timing on Health in Humans: The Role of Fasting
www.ncbi.nlm.nih.gov/pmc/articles/PMC6520689/
要旨
食事の頻度とタイミングが健康と疾病に及ぼす影響は、長年にわたって関心の対象となっている。疫学的証拠は、高い食事頻度と疾患リスクの低下との関連性を示しているが、実験的試験では相反する結果が示されている。さらに、最近の前向き研究では、食事頻度が高い場合(1日6食以上)は、食事頻度が低い場合(1日1~2食)と比較して、疾患リスクが有意に増加することが示されている。
食事の頻度やタイミング以外にも、朝食の消費量や1日のエネルギー摂取量の分布、カロリー制限、夜間の食事なども考慮しなければならない。この複雑なシナリオの中心的な役割を果たすのは、2回の食事の間の絶食期間の長さである。これらの相互に関連した変数の生理学的な基盤は、内部の概日時計を介している可能性があり、自然の概日リズムと非同期な食品消費は、健康に悪影響を及ぼし、疾患リスクを増加させる可能性がある。
朝食消費を含む規則的な食事パターン、一日の早い段階でエネルギーの割合が高い消費、食事頻度の低下(すなわち、2~3食/日)規則的な絶食期間は、炎症の減少、改善された概日リズム性、オートファジーとストレス抵抗性の増加、腸内細菌叢の変調などの生理学的な利点を提供する可能性がある。
キーワード
時間制限給餌、絶食、食事頻度、食事のタイミング、肥満、心血管健康、糖尿病
朝は王のように食べ、昼は王子のように食べ、夕飯は百姓のように食べる。
モーセ・ベン・マイモン or マイモニデス 1135-1404
1. 簡単な歴史紹介
西洋文化では、1日の食事摂取量を朝食、昼食、夕食の3つの正方形の食事に分けるのが一般的な考え方である。栄養士は食欲抑制のために間食を2回(午前と午後)追加することをしばしば提案しており、確かにメディアの主流のメッセージは「1日に5~6回」食べることである。しかし、食事の回数は普遍的な基準ではなく、伝統的な3回の正方形の食事は、やや驚くべきことに、最近の習慣である。例として、古代ローマ人は実質的な食事は1回だけで、通常は16時頃(coena)に消費され、1日1回以上食べることは不健康だと考えてた。彼らはまた、朝(ientaculum)と正午(prandium)に食べたが、これらの食事は質素で軽く、迅速であった[1]。その後、修道院の規則が一般の人々の食行動に影響を与えた。朝食という言葉は「夜の断食を破る」という意味であり、祈りに捧げられた夜の後の最初の食事であることを指摘している[2]。中世初期には、修道士の一人が宗教的なテキストを朗読している間、食事中は黙っていることが義務付けられていた。最も読まれたテキストの一つはジョヴァンニ・カシアノの『コラツィオーネ』(編纂)であり、朝食のイタリア語はラテン語の「コラツィオーネ」[3]から正確に派生した「コラツィオーネ」であることに言及する価値がある。また、産業革命期には、出勤前の食事として朝食が重要視されるようになった。現在の形とタイミングでの夕食は、人工光の普及により、夜明け前や日没後の食事が容易になった後に普及した[3]。
2. 食事の頻度
2.1. 食事頻度がコレステロール、体重、糖尿病に及ぼす影響に関する疫学研究
1日3食食べることがより健康的な選択であるという確固たる信念の起源は、文化遺産[4,5,6]と初期の疫学研究[7]のミックスである。利用可能な疫学的研究は、主に心血管疾患(心血管疾患s)を調査していないが、むしろそのようなコレステロールや体重などのいくつかの危険因子[8,9]。これらの研究では、「かじる」(頻繁に小さな食事やスナックの消費)と比較して、「ゴリゴリ」(食事の頻度を減らし、1日1~2回の食事)の食事に関連した血中脂質の悪化が観察された。これらの初期の研究では、著者は、食事の頻度を減らすと心血管疾患のリスクの増加に関連付けられていることを述べている[10]。その後の研究では、1つまたは2つを報告するものと比較して、毎日4つ以上の食事を食べていると報告された被験者の年齢調整した総コレステロールとLDL(低密度リポタンパク質)コレステロールを低く報告し、これらの以前の調査結果を確認するように思われた[11]。この関連性は、アルコール、喫煙、収縮期血圧、WHR(ウエスト/ヒップ比)およびBMI(ボディマス指数)としての体格測定、および多量栄養素摂取量を調整した後にも確認された。1989年の論文では、著者らは、食事の非常に高い頻度(17)と低い頻度(3)を比較し、より高い頻度で総コレステロールとLDLコレステロールの改善を発見した;しかし、この特定のアプローチは、明らかに通常の生活の中で非定型である[12]。European Prospective Investigation into Cancer(EPIC)プロジェクト内の最近の研究では、食事頻度が高い(6回以上/日)と報告した被験者では、年齢、BMI、身体活動、喫煙、総エネルギー摂取量、およびマクロニュートリエント分布を調整した場合でも、1日に1回または2回の食事をした被験者に比べて総コレステロールおよびLDLコレステロールの濃度が低いことが示された [13]。ここでも、最近発表された血中コレステロール研究の前向きな季節変動(Seasonal Variation of Seasonal Variation of Blood Cholesterol Study in Worcester County, Massachusetts、SEASONS)内の横断的分析では、年齢、性別、身体活動、総エネルギー摂取量を調整した後であっても、1日4回以上の頻度は、1日3回以下の頻度に比べて肥満のリスクが低いことが示された[14]。
別の大規模コホート研究、マルメダイエットとがん研究は、1日6回以上の食事を食べることは、1日3回未満の食事と比較して肥満のリスクを低下させることを報告した;さらに、食事とライフスタイルを調整した後、頻繁に食べる人は、より低いウエスト周囲長を持っていた[15]。糖尿病については、16年間の追跡調査では、年齢、BMI、およびその他の関連因子[16]を調整した後、1日3食(相対リスクRR 1.26)を食べた人と比較して1日1-2回食べた男性の2型糖尿病のリスクが増加したことを示した。これらのデータは、6年後のフォローアップ(1日3回:RR 1.09,1日6回以上:RR 0.99)[17]後の女性の増加した食事頻度と2型糖尿病リスクとの間に相関関係を発見した別の研究とは対照的である。リスク因子を検討した研究は数多くあるが、食事頻度と冠動脈性心疾患(CHD)リスクとの関係を調査したプロスペクティブコホート研究は1件のみである。Cahillら[18]は、1日1-2食を食べる男性は1.10のCHDのためのRRを持っていたことを発見し、1日4-5食を食べる男性は1.05のRRを持っていた、と6回以上食べる男性は、総エネルギー摂取量、食事組成、および他の危険因子の調整後に1日3回食べた人と比較してRR 1.26を持っていた。一般的に、調査したアウトカムや使用した方法によって、相反する結果が出ている。
しかし、他の著者 [19,20] も示唆しているように、これらの研究における食事回数の減少とCHDのリスクの増加との間の相関は、これらの研究の横断的な性質を考慮すると弱いようであり、この関連性の因果関係または時間的な関係を立証することは困難である。
2.2. 食事頻度と体重管理。1回、2回、3回、またはそれ以上の食事?
肥満は世界的に急速に増加している疫病であり、その有病率は1980年以降、70カ国以上で2倍近くに増加している。2015年には、合計1億770万人の子どもと6億370万人の成人が肥満であった [21]。世界の人口の75%は、過体重と肥満が低体重よりも多くの人を死亡させている国に住んでいる[22]。肥満は脂質異常症や高血圧と並んで、心血管疾患の主要な危険因子の一つである[23]。エネルギー摂取量を減少させるために提案されている戦略(食事療法、薬物療法、肥満手術)[24]およびエネルギー出力を増加させるために提案されている戦略(運動および非運動運動)[25]の一部として、食事のタイミングおよび頻度は、体重管理および体重減少に大きな影響を及ぼす可能性がある[26,27]。[26,27]
Kahleovaらが発表した非常に最近の大規模な研究[28]は、米国とカナダのセブンスデー・アドベンチスト教会の成人会員50,660人を対象に調査したものである。その結果、1日1食または2食の食事は、1日3食の食事に比べて比較的低いBMIと関連していることがわかった。興味深いことに、彼らは食事や間食の回数(1日3回以上)とBMIの増加との間に正の関係があることを発見した。さらに、BMIの変化は、一晩断食の長さに関連していた:一晩断食が長いほど、BMIが低い。著者らは、このような栄養レジメンの肯定的な効果は、タイミング、食事の頻度、および長い一晩断食の組み合わせによるものであることを示唆した;彼らは満腹ホルモン(レプチンまたはグレリン)末梢サーカディアンクロックの改善(したがって、cAMP応答エレメント結合タンパク質などの主要な代謝調節因子の改善)およびより高いストレス耐性と一緒に酸化的損傷の減少[28]の効果として、異なる根本的な理由を仮定した。これらのデータは、1-2回の食事が3回以上よりも優れていることを示唆しているが、どのようにして以前の古い研究とこれらの結果を統合することができるか?古い研究[9,10,12,29,30]と最近の研究[31]の両方とも、より高い食事頻度が体重増加のリスクを減らすことができることを示唆しているように思われる;しかし、最近の大規模なプロスペクティブ研究は、頻繁な間食が体重増加[32,33]と2型糖尿病[16,17]のリスクを増加させることを支持しているように思われる。さらに、異なる食事頻度に対する急性代謝反応を調査した研究では、より低い食事頻度の利点が支持されている可能性がある。TaylorとGarrowは、代謝室で測定したエネルギー消費量に対する1日2食または6食からなる等食性の食事の効果を評価した。結果は、夜の支出は6食[34]と比較して2食で有意に高かったが、日中は差がないことを示した。逆に、他の研究では、夕方に比べて朝の方が有意に高い基礎エネルギー支出が示されている[35,36,37]。しかし、総エネルギー消費量の日内差は、すべての研究で一貫して認められているわけではない[38]。他の研究では、より高い食事頻度での体重増加とその代謝的影響は、より高い糖質由来のエネルギー摂取量[39]と関連する代謝問題だけでなく、食物刺激の増加、空腹感、および食事への欲求[40,41]によるものであることが示唆されている。このように、規則的な食事パターンは、食事頻度に関係なく、健康結果に潜在的なプラスの効果をもたらす。
多くの場合、頻度の低い食事パターン、すなわち食事頻度の低下は、体重増加を引き起こし、空腹に関連するホルモンを増加させ、最終的には心血管リスクを増加させる可能性のある代謝障害につながる可能性のある不規則な食事アプローチと関連している[42]。逆に、頻度は低くても規則的なタイミングであれば、体重増加リスクを減少させる可能性がある[28]。
2.3. 介入研究と食事頻度と多量栄養素の相互影響
食事の頻度を変えること自体の効果に加えて、これらの変化が全体的なマクロニュートリエント摂取量をも変化させる可能性があることを考慮しなければならない。これはMcGrathとGibneyによって実証された。この研究では、通常1日6回の食事をする被験者に食事回数を減らすように説得し、一方で頻度の低い被験者(1日3回)には食事回数を6回に増やすように説得した。食事回数の増加は総コレステロールおよびLDLコレステロールの有意な減少を誘導したが、炭水化物摂取量の減少と相まっていた [30]。
McGrathとGibneyによって観察されたコレステロールの減少は、総コレステロールやLDLコレステロールなどの従来の疾患マーカーとCHD [43]との間の本当の関係についての現在の議論に照らして考えることができ、コレステロールの血中濃度が高いと脳卒中や他の心血管イベントが増加するという一般的な考えに異議を唱えている者もいる[44]。コレステロールの減少に関与する機構は、コレステロール合成機構に関連している可能性があると仮定するのが妥当である。現在、インスリンがコレステロール生合成における重要な酵素であるヒドロキシメチルグルタリル-CoA(HMGCoA)還元酵素(スタチンの標的)を活性化することがわかっている[45]。この制御の基礎となるメカニズム(AMP活性化プロテインキナーゼ、転写速度の増加、またはインスリン誘導遺伝子)[46,47,48]についての議論は、本レビューの目的を超えているが、血糖値の上昇、およびその結果、インスリンの増加が内因性コレステロール合成の増加につながることは、帰結的であるように思われる[49,50,51]。食事の頻度が高い場合(つまみ食い)は、1日3食の場合と比較してインスリン濃度が低下することが実証されている[12]が、これはコレステロール合成の低下が原因である可能性が高い[29]。
インスリンの作用とは別に、高頻度の食事のもう一つの効果として、脂肪を含む食事の後の食後段階でのコレステロール除去(逆コレステロール輸送)の増加が考えられる[52]と、コレステロールと脂肪のHMGCoA還元酵素に対する阻害作用が考えられる[53]。食事回数、血中脂質、インスリン作用に及ぼすマクロニュートリエント組成の影響を否定することはできない。間食の回数を増やすことは、食事性タンパク質の量を増やすことにもなる[54]。データは、間食の回数と空腹感との間に相関はないが[54]、少なくとも正の相関はないが[55,56]、タンパク質の摂取量が多いほど満腹感に関連した反応が大きいことを示唆している[41,55]。このように、食事の頻度を議論する際には、食事の頻度を変えることで、日中の特定の多量栄養素からのエネルギーの割合も変化する可能性があることを、生態学的な観点からも考慮することが不可欠である。さらに、間食で炭水化物や糖質をタンパク質で代用することで、低頻度または高頻度の食事研究の結果が変化する可能性がある[39]。最後に、食事頻度だけでは健康のアウトカムへの影響を説明できないことを強調しておくことが重要である。食事頻度と健康に関する対照的なデータは、多くの場合、食事回数の減少は誤った分布を反映しているという事実によって説明できる:朝食、軽い昼食、および高カロリーの夕食をスキップするか、または非常に低い食事回数(すなわち、1-2)では、代謝コントロールの低下につながる可能性がある[16]。さらに、食事頻度の効果は、食事のタイミングと多量栄養素の取り込みに厳密に関係している。現在のところ、ニブリング(小食、頻回の食事)とゴーギング(大食、頻度の低い食事)の等エネルギー状態への影響に関する利用可能なデータ[57]は、おそらく上記の交絡因子によるものと思われるが、相反する結果を提供している。
3. 食事のタイミング
3.1. 食事のタイミングに関する疫学的データ。朝ごはんを食べるか食べないか、これが問題だ
食事の頻度やタイミングを考える際に、どの食事を維持するか、あるいは除去するかは些細な問題ではない。一般的に、朝食を一貫して食べている人は、朝食を抜いている人に比べて体重増加のリスクが低い;さらに、昼食または夕食に最大の食事を食べている人は、BMIが増加するリスクが高い[28]。さらに 2013年のCahillらは、冠動脈性心疾患(CHD)リスクと朝食摂取頻度との間に興味深い関連性を発見した。著者らは、健康な男性51,529人(1992年から 2008年までモニター)のデータを報告し、「朝食を食べることは、CHDリスクを有意に低下させることと関連している」と結論づけた[18]。夕食と朝食を抜くと24時間エネルギー消費が増加し、空腹期間が長くなるが、朝食を抜くと食後のインスリン濃度が高くなり、脂肪の酸化が増加する可能性があり、代謝の柔軟性が失われ、低悪性度の炎症状態とグルコースのホメオスタシスの低下につながる可能性があることを示唆している[58]。一般的に、利用可能なデータは、食事回数を減らすことによる健康増進効果がある場合、朝食と夕食をスキップすることによる差動効果があるかもしれないことを示唆している(すなわち、一晩断食前の夕方の断食 vs. 一晩断食後に朝の断食を継続すること)。さらに、遅食が肥満およびCHDのリスク増加と関連していることが示唆されており[59]、また、「放牧的」な食事パターンが総エネルギー摂取量の増加および夜間の食物消費量の増加と関連していることも示唆されている[60]。最後に、朝食消費とCHDとの関連についてはコンセンサスがある。Cahillら[18]は、45~82歳の米国人男性26,902人を対象とした「Health Professionals Follow-up Study」の大規模プロスペクティブ研究を発表した。彼らは、朝食を抜いた男性は、朝食を定期的に食べた男性に比べてCHDのリスクが27%高いことを発見した(RR 1.27;95%信頼区間CI 1.06-1.53)。さらに、夜遅くに食べることで、早い夕食と比較して55%高いCHDリスクにつながった(RR 1.55;95%信頼区間CI 1.05-2.29)。
3.2. 介入研究と食事のタイミング 内側時計のメカニズム
さらに、Jakubowiczら[61]は、日中のカロリー分布が異なるアイソカロリー食(すなわち、朝の高カロリー vs 夕方の高カロリー)が、過体重/肥満女性の体重減少、血清グレリン、インスリン抵抗性指標、および主観的な食欲感に影響を与えうることを実証した。以上の結果から、朝食摂取を含めた1日の早い時間帯に多くのカロリーを摂取することのポジティブな効果や、食事のタイミングと体重との相関関係が確認された。しかし、いくつかのエビデンスは、自由生活を送る成人の体重変化に対する朝食消費の重要性を支持していないことに留意すべきである。Dhurandharら[62]は、309人の過体重および肥満の成人を16週間、朝食を食べるか、朝食を抜くかのどちらかに割り付けたランダム化比較試験を実施した。割り付けられたプログラムの遵守率が高かったにもかかわらず、朝食摂取は朝食抜きに比べて相対的な体重減少をもたらさないことが明らかになった。逆に、心血管系の健康に関しては、Uzhovaと共同研究者らは、朝食を抜くことは、従来の心血管疾患危険因子とは無関係に、中年の無症候性個人のサンプルにおいて、非冠動脈性動脈硬化症および全身性動脈硬化症のリスクの増加と関連していることを発見した[63]。さらに、Bettsらは、除脂肪体重の成人も肥満の成人も、絶食状態のままでは朝食を摂取した後よりも朝の方がエネルギー消費量が少ないことを示した[64,65,66]。
その反対(すなわち、遅めの食事の負の効果)は、それほど決定的なものではない。最近のメタアナリシスでは、夕方のエネルギー消費量とより高いBMIとの関連が示されたにもかかわらず、彼らは、不均一性が高いため、体重コントロールに対する大規模な夕方の夕食の効果について結論を出すことは困難であると結論づけている[67]。
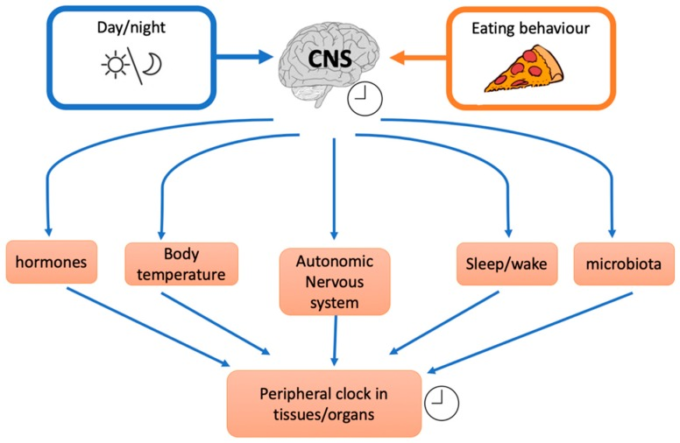
早食いと遅食いに関連する重要な考慮事項は、体内の概日時計に対する摂食の影響である [68,69,70,71]。体内概日時計システムは、視床下部上視交叉核の中枢時計と異なる末梢組織の時計によって構成されている。概日時計システムは、グルコースと脂質を含む多くの代謝リズムに関与している。中枢のクロックが食物摂取量、エネルギー消費量、インスリン感受性を指示する一方で、末梢/組織のクロックは、追加の制御を実行する。例えば、腸の末梢クロックは、膵臓の別の末梢クロックがインスリン分泌を調整している間、グルコース吸収と脂肪組織と肝臓の末梢クロックを調整している。また、脂質の生合成や異化は、最近のメタボロミクスやリピドミクスの研究で明らかになったように、局所的な分子時計によって異なる組織で制御されている。
中枢および末梢の概日時計の破壊は、多くの生物において肥満および CHD を促進することはよく知られている [72]。ほぼすべての種は、1 日の明暗の位相に敏感な細胞内時計機構を開発しており、これにより動物は明暗に関連した環境条件の変化を予測し、それに適応することができるようになっている。1970年代に行われた初期の研究では、主な体内時計として視交叉上核(SCN)が同定された。SCNは、睡眠-覚醒サイクルだけでなく、体温、血圧、ホルモン分泌、行動変数などの他の多くの生理的変数を調節している。これらの概日リズムは、生物が環境に適応し、日常生活のさまざまな要求に備えることを可能にする。例えば、朝のコルチゾールの増加は、次の日の活動に備えて心血管系を準備するため、概日コルチゾールリズムの乱れとその結果としての心血管障害は、早朝の心血管イベントのリスクの増加につながる可能性がある[73]。体内時計のもう一つの重要なマーカーはメラトニンである。メラトニンは、すべての脊椎動物において、夜間に高レベルになる明暗サイクルによって強く制御されている。体内の暗闇に対するこの基本的なリズミカルな内分泌信号は、SCNのマスタークロックによって制御され、主に松果体でリズミカルに周期することが示されているピリオド遺伝子(Per1)によって制御されている[74]。例えば、McHillら[75]は、平均して、肥満の人は除脂肪体重の人に比べて、メラトニン(睡眠の開始が差し迫っていることを示す生物学的マーカー)の開始に1時間近い時間にカロリーのほとんどを消費していることを発見した。
また、異なる生理機能は概日リズムを示している:例えば、日中の耐糖能の変化は、健康な成人では、夕方と夜間の血糖コントロールが低下していることを示している。これらの変化は、β細胞応答性、インスリンクリアランス、末梢インスリン感受性の日周リズムの影響を受けるが、肝性インスリン感受性はあまり重要ではないようである。しかし、概日リズムや体内時計のメカニズムは、光曝露、睡眠・覚醒、身体活動、食事摂取などの異なる要因によって影響を受ける可能性がある。実際に、食事のタイミングは、これらの生理機能に影響を与える主要な因子の一つであり、したがって、様々な健康結果や体重管理に影響を与える可能性がある[76]。食事タイミングは、中枢マスタークロック(SCN)またはBmal1,Clock、Per1/2,Cry1/2,Rev-erbα/β、Rorα/β、Dbp、Dec1/2,CK1ε/δ、およびNPAS2を含む末梢細胞クロックのいずれかに影響を与える[74,77]。
末梢組織が適切な概日リズムおよび細胞時計を示すことを強調することが重要である。中枢時計と末梢時計は一緒に働いており、それらは食物の利用可能性によっても影響を受ける。実際、規則的な摂食パターンはヒトの末梢時計を同期させる可能性があり、食事の遅延は代わりに血漿グルコースリズムに影響を与えるが、インスリンリズムには影響を与えない可能性がある[78]。
発現が周期的ではない多くの遺伝子は、周期的クロマチンリクルートによって多くの遺伝子を活性化するPPARを(その概日リズム以外にも)調節する栄養チャレンジの圧力の下で、概日リズムに従うようになるかもしれない。
食事のタイミングが健康に及ぼす影響のメカニズムはまだ不明であるが、いくつかの仮説(図1)を暫定的に提示することができる。
- 明暗の合図と同期していない食事のタイミングは、レプチンとグレリンを介した満腹メカニズムの障害により、より高いカロリー摂取量を誘発する可能性がある[79]。代謝制御に関与する他のホルモンでさえも、甲状腺ホルモンのようにサーカディアン・ミスアライメントの影響を受ける[80]。
- 夜食嗜好性と体重減少抵抗性に関連する遺伝子における遺伝子発現の変化(例:SIRT1,CLOCK 3111T/C、Perilipin1) [81,82] 。
- 安静時エネルギー消費の改変:コア体温は概日時計によって制御されるため、摂食時間はエネルギー消費/基底熱発育に影響を与える可能性がある。例えば、Rev-erbαは、褐色脂肪組織の体温形成の基本因子であるアンカップリングタンパク質1(UcP1)のリズミカルな発現を制御する細胞性概日時計である[83]。
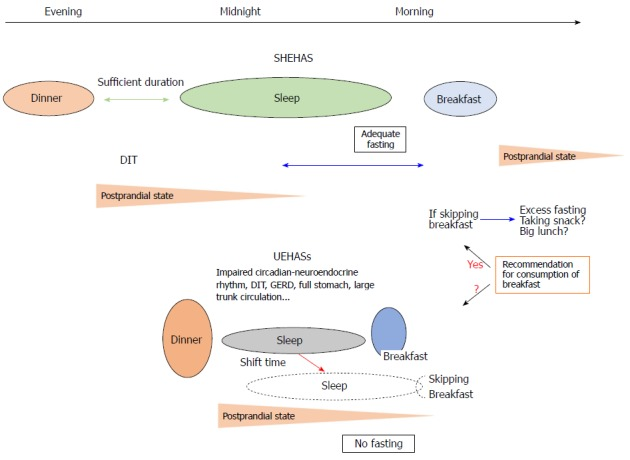
- 食事誘発性熱発育(DIT)における一日中の違い。DITは朝から夜にかけて減少し[35,36,84]、「このような概日熱発育は朝食を抜く人の体重増加を合理的に説明できる」と示唆するものもある[85]。
- 概日時計は、グルコース吸収、筋肉、脂肪組織、および肝臓のインスリン感受性を通じてインスリン抵抗性にも影響を与え [86] 、食物摂取量または栄養課題は概日時計にも影響を与える。実際、シフト労働者、大陸横断旅行者、および不規則な勤務スケジュールの人々は、腸の習慣の変化、便秘、および下痢として胃腸症状をしばしば示す。これらの例は、いくつかの腸の機能がリズミカルに調節されており、その乱れが健康障害につながることを示している。クロック(末梢細胞時計)が、腸内の多くの栄養輸送タンパク質、例えばGLUT2,GLUT5,およびPept1(腸管腔から腸上皮細胞への小ペプチドの輸送に関与する主要なタンパク質)の発現を介して、栄養吸収を調節することが実証された。しかしながら、他の外部因子が体内時計に影響を及ぼす可能性がある。例えば、NAD+(ニコチンアミド・アデニン・ジヌクレオチド)レベルは、栄養状態および/または身体活動によって影響を受ける。NAD+は、脱アセチル化を介して、時計遺伝子BMA(英国医師会)L1(brain-muscle-arnt-Like-protein 1)およびPER2(Period遺伝子2)を活性化するSIRT1依存性脱アセチル化酵素に影響を与える。BMA(英国医師会)L1の下流にあるニコチンアミドホスホリボシルトランスフェラーゼ(NAMPT)は振動的な挙動をしており、NAD+の細胞内濃度を調節している。したがって、フィードバックループにおいて、NAD+濃度は、PPARγ(ペルオキシソーム増殖因子活性化受容体γ)およびPGC-1α(ペルオキシソーム増殖因子活性化受容体γ補酵素1-α)のような核内因子を調節するSIRT1を調節し、異なる組織、例えば、肝グルコースホメオスタシス(PGC-1α)または脂肪組織脂質動員(PPARγ)に多くの影響を与える。一般的に、食物の規則的な利用可能性(規則的な食事のタイミング)は、腸からの様々なシグナルの放出に影響を与える。腸からの信号は、食物の利用可能性について背側視床下部(DMH)に通知することが示唆されている。このように、DMHは他の組織に影響を与え、食物の予測、消化、吸収を制御している可能性がある。このように、腸によって発現するサーカディアン遺伝子が重要な役割を果たしているにもかかわらず、食物自体が時計の活動を介した食物の巻き込みの重要な調節因子であることを示す証拠がいくつかある。
図1 異なる下流機構や末梢時計に影響を与える体内時計に対する外的要因の影響(中枢神経系:中枢神経系)
4. 食事の頻度を減らす。時間制限給餌の場合断食の重要性 何が新しいのか?
この食事戦略を実施するためには、食事の頻度を減らすことによる潜在的な健康増進効果が十分であると考えられる場合、1日1食を消費することは、1日2食を消費することと同等であろうか?この場合、答えは単に「少ない方が良い」というものではない:食物摂取量を1日1食に減らすことは、食事頻度の低下によるプラスの効果を悪化させる可能性がある [87,88]。したがって、1日2食(または3食)の摂取がおそらく最良の選択肢であり、2食か3食かの違いは、それらがもたらす1日の絶食期間の長さに依存する。
近年の多くの研究では、日中の広い時間的断食ウインドウの健康効果を示唆している。すなわち、1日の食物摂取量を~6~8時間の時間ウインドウに制限することは、ヒトにおいて、同心円状態であっても、通常の1日の食事分布(すなわち、3~5食、朝食から夕食後半までの食事)と比較して、多くの健康上の利点を誘発するようである[89]。一般的に、絶食が健康に多くのプラスの効果をもたらすことは明らかである[90]が、カロリー制限(CR)アプローチ(糖尿病、がん、心臓病、および神経変性からの保護;肥満、高血圧、喘息、および関節リウマチを減少させる)と共通するいくつかの特徴がある。
典型的なCRプロトコルでは、1日のエネルギー摂取量は慢性的に20~40%減少するが、食事の頻度は維持される。CRが健康改善のための実行可能なツールであることはよく知られている:動物実験[91]とヒト研究[92,93]の両方で、このアプローチが多くの健康関連変数を改善できることが示されている。
しかし、動物実験では、ab libitum食の実験設定と、それが比較されるCR条件を考慮しなければならない。多くの場合、動物モデルでは、CR条件が絶食期間に影響を与える。これらの実験では、アドリブ食事療法の動物は、量だけでなく、周波数でも、食品への無制限のアクセスを持っている一方、CRグループは、通常、研究者のスケジュールによって決定された特定のウィンドウ内でのみ食べることができる。これらの設定では、食事はしばしば間隔をあけて行われ、結果に影響を与える可能性のある長時間の絶食のウインドウを作成する[94]。断食は従来のCRとは異なるアプローチであるため、これは重要な問題である。我々は、断食を特定の時間間隔で、通常は通常の8時間の睡眠よりも長い時間、食物とカロリー飲料を断つことと考えている。あるいは、飢餓は、適切な栄養摂取の欠如に関連した栄養欠乏やその他の慢性的な健康問題をもたらす極端な断食を指す。飢餓状態とは、実際には、基本的な器官および組織のパフォーマンスの低下に関連した恒常性の病理学的な損失をもたらす調節障害状態である[95]。さまざまなタイプの断食プログラムを考えるとき、ケトーシスを誘発する長期断食(LTF)と、ケトーシスを誘発しない短期断食(STF)の2つの主要なカテゴリーに分けることができる。LTF、すなわちケトーシスを伴う断食を約3日以上行う。この期間の後、グルコース貯蔵量は枯渇し、グリコーゲン貯蔵量は、通常の脂肪酸化(クレブスサイクルのオキサロ酢酸を介して)を助けるため、または脳および中枢神経系(中枢神経系)にエネルギーを供給するためにはもはや十分ではない [96]。したがって、脳の代謝を維持するために代替のエネルギー源が必要とされる。このエネルギーは、アセト酢酸(アセト酢酸)3-ヒドロキシ酪酸(3HB)およびアセトンというケトン体(KB)によって供給され、これらは主に肝細胞のミトコンドリアマトリックスで起こるケト新生と呼ばれるプロセスを介してアセチル-CoAから生成される [96,97]。ケトーシスは、ストレス耐性、脂肪分解、ミトコンドリア効率の向上、オートファジーの増加など、代謝や多くの細胞経路に多くのプラスの効果を及ぼす(例えば、ケトン体の一つであるb-ヒドロキシ酪酸(D-bHB)は、FOXO3a -フォークヘッドボックスO3 -遺伝子の転写を抑制するクラスIおよびIIaヒストン脱アセチル化酵素の天然の阻害剤である)。さらに、ケトン体の代謝は、NADPH系を介して活性酸素種(ROS)の毒性を減少させる[98]。しかし、食事のタイミングと頻度の文脈では、ケトーシスを誘導するために、ケト原性食と併用しない限り、不十分な期間の断食を利用してケトーシスを誘導するSTFの役割を強調したい。STFプログラムにはいくつかのタイプがある [99]:週に1~2日の代替日断食(ADF)または全日断食として実行される間欠的断食(IF)2~3週間ごとに3日以上持続する定期的断食(PF)および定義された時間のウインドウ(3~4時間から10~12時間まで)[100,101]内で被験者が自由にエネルギー摂取量を消費するTRF(時間制限給餌)があり、結果として1日あたり12~21時間の断食のウインドウが得られる。我々の目的のために、食事の回数を2回(すなわち、朝食と昼食)に減らし、最後の食事が14:00 hから16:00 hの間に消費される場合、これは24時間の期間あたり12~16時間の絶食につながるので、TRFについて議論することにする。また、修行中のムスリムによって観察されるラマダン断食の1ヶ月間に相当量の研究が行われていることも注目に値する[102]。ラマダン断食は、外が明るいと食物摂取が禁止されるため、TRFの一形態と考えることができる。しかし、いくつかの注目すべき要因があるため、ラマダン断食を他のTRFの形態と適切に比較することが難しい。それは、食事と断食の明暗のサイクルが自然な概日リズムとは逆であること、断食のウインドウの長さが地理的な場所や年によって異なること(ラマダンは太陰暦に基づいて設定される)ラマダン断食の実施方法が異なること(すなわち、太陽が昇る前に食べ、太陽が沈んだ後に食べる人もいれば、太陽が沈んだ後にしか食べない人もいる)などである。最後に、ラマダン断食の期間は4週間であるため、ほとんどすべての研究は観察的なものである。
ラマダン中の断食の期間(約16時間)は、一般的にケトーシスにはならないという事実にもかかわらず、それは長期的な断食のアプローチ、例えば、オートファジー[103]にリンクされている経路の多くを刺激するのに十分である。オートファジーは、タンパク質の分解、オルガネラのターンオーバー、および細胞質成分のリサイクルを媒介する細胞内プロセスであり、細胞ストレスに対抗し、正常な細胞機能を維持するための基本的なプロセスである。心臓や血管では、特に、オートファジーは心臓の胚発生期だけでなく、正常な心血管機能のためにも基本的な役割を果たしている。心血管系の生理に関与するペプチドやホルモンの多くもオートファジーによって調節されていることが示唆されており、「オートファジーの調節障害が高血圧、肥満、糖尿病、末梢臓器障害と関連している可能性が推測できる」[104]。絶食がオートファジーを刺激することから、これら2つの要因が両方とも実証された心保護効果に関連している可能性が高い。実際、Godar et al 2015年[105]は、ADFがマウスをin-vivo虚血再灌流傷害から保護することを実証したが、野生型の動物においてのみであった。オートファジーが障害されたマウス(リソソーム関連膜タンパク質2をコードするLamp2のヘテロ接合ヌル)では、保護効果はなく、むしろ悪化効果があった。ラットを用いた別の研究では、ラットの心筋梗塞モデルでADFが脳梗塞の大きさと梗塞拡大を減少させる心保護効果があることが示された[106]。
絶食は、基質代謝、心血管系、炎症に影響を与えるだけでなく、概日リズムに潜在的に強力な効果を及ぼす。実際、空腹時の12と36時間の間に血漿中のFFAとグリセロール[107]の増加によって強調表示されたTG(トリアシルグリセロール)脂肪分解の増加がある。代謝スイッチは通常、肝細胞内のグリコーゲン貯蔵量が枯渇し、脂肪組織の脂肪分解が促進されて血漿脂肪酸とグリセロールの増加をもたらす絶食の第3段階で発生する(21)。IFおよびTRFに関連した絶食期間は、心血管系にも様々なプラスの効果があるようである。さらに、TRFは炎症レベルにも作用する可能性がある。炎症がCHDや動脈硬化に関連していることはよく知られている。我々は、等角的TRFアプローチが腫瘍壊死因子a、インターロイキン6,インターロイキン1bなどの多くの炎症マーカーを減少させ、同時にアディポネクチン(抗炎症性サイトカイン)を増加させる可能性があることをヒトで実証した[100]。遅食で実証されたように、断食は概日リズムの調節または調節障害にも関与しているようである。それは、高脂肪食(高脂肪食)を与えられたときにTRFが肥満、高インスリン血症、肝性ステアトーシス、および炎症からマウスを保護することができることが実証されている。アドリビタム高脂肪食げっ歯類はまた、TRFげっ歯類と比較して変化した概日リズムを示した。さらに、TRFはCREB(cAMP応答エレメント結合タンパク質)mTOR(ラパマイシンの機械的標的)およびAMP活性化プロテインキナーゼ(AMPK)経路の機能とサーカディアンクロックの振動を改善しただけでなく、運動協調性を向上させた[109]。これらの結果は、細胞時計と摂食/絶食状態によって誘導されるシグナルとの間のかなりのクロストークと緊密な相互作用によって説明される可能性がある。例えば、ケト原性食に似た絶食は、ミトコンドリアの生合成と機能の基本的なアクターであるAMPKのリン酸化を誘導することがわかっている。一方、給餌状態は、エネルギー利用可能性の増加時に同化プロセスを促進するラパマイシン経路(mTOR)の機械的標的を刺激し、これがAMPK経路に干渉する可能性がある。このことは、フィード/ファスト状態と分子経路との密接な関係を支持するものである。
最後に、我々は、図2に示すように、ケトジェニックダイエット、カロリー制限と絶食は、多くの経路と共通のターゲットを持っていることを強調する必要がある。
図2 ケトジェニックダイエット(KD)カロリー制限(CR)ファスティングの健康効果に関与するメカニズム
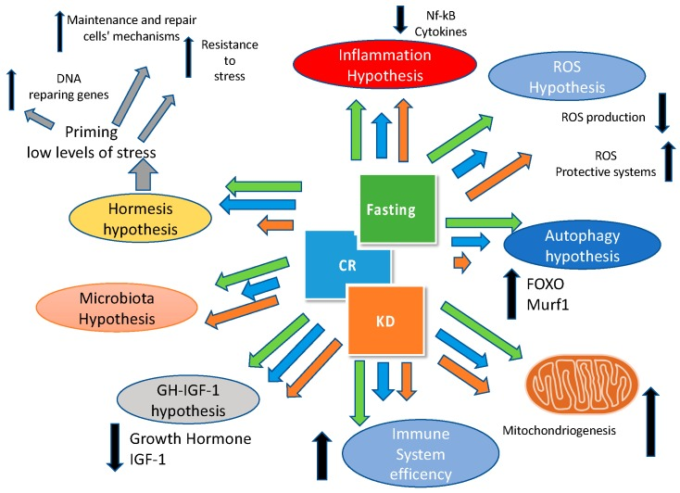
矢印の大きさは、関与する異なる経路(IGF-1:インスリン様成長因子-1;Murf2:筋特異的リングフィンガー-2;Nf-kB:活性化B細胞の核因子κ-光鎖エンハンサー)に対するKD(オレンジ)CR(青)絶食(緑)の相対的な効果に関連している。
5. 食事の頻度とタイミング マイクロバイオータのつながり
私たちは、食事頻度がマイクロバイオータに及ぼす役割を議論することなしに、この探索的なレビューを結論づけることはできない。近年、この分野の研究は急速な発展を遂げている。微生物の集合体は、代謝、免疫、感染制御など多くの基本的な機能を提供している。近年、腸内細菌叢は、宿主の健康、免疫、エネルギーの恒常性維持に重要な役割を果たしていると認識されている。腸内細菌叢の変化は、細菌と宿主の関係の変化に起因して、多くの代謝性疾患を引き起こす可能性がある。ヒトの腸内細菌叢は、ヒトゲノムの150倍以上の遺伝子を持つ100兆個にも及ぶ細菌が存在している。腸内細菌叢の組成の異常は、脂肪組織や筋肉、肝臓などの代謝に多くの影響を及ぼす可能性がある。さらに、腸内細菌叢は、肥満、糖尿病、慢性低悪性度炎症、そして最後には心血管疾患などの多くの代謝性疾患と関連している[110]。
実際、腸内細菌叢の構成が心血管疾患の危険因子である可能性があることが実証されている。マウスの研究では、腸内細菌叢の異常と高血圧や血管機能障害の発症との関連性が示されている[111]。腸内細菌叢はコリン(食事性ホスファチジルコリン由来)をトリメチルアミン(TMA)に変換する。肝臓では、TMAはトリメチルアミンN-オキシド(TMAO)に変換され、動脈硬化を促進し、アゴニスト誘発血小板活性化を介して血栓症リスクを増加させる[113,114]。結論として、利用可能なデータは、多くの心血管疾患リスク因子における制御要素としての腸内細菌叢の重要な役割を強く支持している。
腸内細菌叢は中枢神経系にも多くの作用を及ぼしており、その多くは “腸-脳軸 “と呼ばれるほどである。食事の構成(例:脂肪や繊維の含有量)は腸内細菌叢に影響を与える。食事のタイミングとマイクロバイオータに関する予備的な情報はあるものの、食事の頻度に関するデータはヒトでは得られていない。腸内細菌叢の変化は、日中の摂食および摂食リズムの変化によって刺激される可能性があり、脳のマスタークロックである視交叉上核の非同期化が、骨格筋、脂肪および肝臓の組織の概日時計の並行した非同期化とともに、慢性疾患および代謝性疾患のリスクに影響を及ぼす可能性があることが知られている[115]。
第一に、腸管上皮細胞の内部概日時計は、下垂体-副腎軸の制御下で毎日のグルココルチコイド産生に影響を与え、このリズムは微生物叢の状態によって影響を受ける
第二に、微生物叢の変化は、食物摂取に影響を与えるコルチコステロイド概日リズムの乱れにつながる可能性がある。さらに、マイクロバイオータの組成は日中にその変動性を有しており、これは様々な条件、例えば時差ぼけ[116]や高脂肪食などによって乱される可能性がある。
食事の組成がマイクロバイオータに悪影響を及ぼすだけでなく、食事のタイミングも影響する:通常の摂食期(げっ歯類の場合は明るい時間帯に、ヒトの場合は深夜に食事をする)以外の時間帯に食物を摂取すると、正常な末梢および中枢の時計が乱れることがある[115]。内部時計のこの非同期化、したがって、微生物相の変更は、代謝性疾患や心血管疾患のリスクの増加に関連付けられている。最近では、マウスでは慢性的な概日時計のずれ、ヒトでは時差ボケが体内時計の異常を誘発することが実証されており、この体内時計の異常は、糞便移植を行った胚芽のないマウスにおいて、耐糖能異常や肥満を促進することが実証されている[117]。一方で、正しい摂食期(ヒトでは昼間)を維持し、絶食期間を長くする(すなわち、食事回数を減らす)ことは、腸内マイクロバイオームにプラスの影響を与え、腸の透過性を低下させ、全身性の炎症を改善する可能性がある。最後に、マイクロバイオータと食事の頻度やタイミングとの関連性を適切に探るためには、さらなる研究が必要である。
6.最後の感想
食事のタイミングと頻度の生理学的および健康への影響の包括的な画像を得るためには、研究の複数のラインを統合する必要があり、探索的なレビューは、我々の意見では、一見して、心血管疾患に対する絶食、食事頻度、およびタイミングの影響を理解するために適切なアプローチであるように思われる。それ自体の食事頻度とタイミングの既存のエビデンスを検討することに加えて、朝食の消費、夜間の食事、カロリー制限と断続的な絶食に関する研究は、健康アウトカムに対する食事操作の効果についてのより多くの意識を提供するのに役立つ。最近のメタアナリシスでは、高い食事頻度と低い食事頻度では体重と体組成の変化に無視できるほどの差が生じることが報告されているが [117]、食事頻度の実験的試験の多くは、これらの結果に影響を与える可能性があるこの記事で強調されている決定要因のいくつかを十分に考慮していない(すなわち、毎日の絶食期間の期間と同じ食事頻度内の食事の異なる間隔、食品の選択と多量栄養素の摂取量に食事スタイルの影響など)。さらに、体重や体組成だけでなく、食事パターンの違いが、等食状態であっても、生理的プロセスにある程度の差動効果を及ぼす可能性がある(図2)。さらに、異なる年表の存在も考慮に入れる必要がある:ヒバリやフクロウ [118,119]、あるいは朝型(M型)と夜型(E型)であることは、おそらく摂食行動や食物代謝にも影響を及ぼす可能性がある。この分類は新しいものではないが [120]、年代型と摂食行動の関連性が調査されたのは近年になってからのことである。Maukonenらによる最近の論文では、National FINRISK 2007とFINDIET 2007の研究からの参加者1854人の朝と夜のエネルギーと多量栄養素の摂取量とクロノタイプとの関連性を分析した。その結果、E型はM型に比べて朝の総エネルギー量が少なく、スクロース以外の多量栄養素の摂取量が少ない(摂取量が多い)ことが明らかになった。これらのデータは、時系列型であっても食事パターンに影響を与える可能性があることを示唆している[121]。
このレビューで提示されたエビデンスに基づいて、いくつかの興味深い健康増進のための推奨事項を聴衆と共有することができる。夜遅くに大量のカロリーを消費する場合と比較して、1日の早い時間帯(多くの場合は朝食を含む)に多くのカロリーを消費することは、生理的な利点があるかもしれない。また、1日の断食期間を標準的な一晩断食よりも延長したり、時折断食期間を設けたりすることにも利点があるかもしれない。この2つの戦略を両立させるためには、朝食から毎日昼過ぎから午後にかけて食事をすることが考えられる(図3)。しかし、世界の多くの地域で伝統的な食事パターンからのパラダイムシフトであるため、このような食事スタイルは多くの人にとって望ましいものではないかもしれないし、実現可能ではないかもしれないことを考慮しなければならない。
図3 異なる変数に異なる食事のタイミングと頻度の効果。中心には、脳、心臓、腸の相互影響が示された
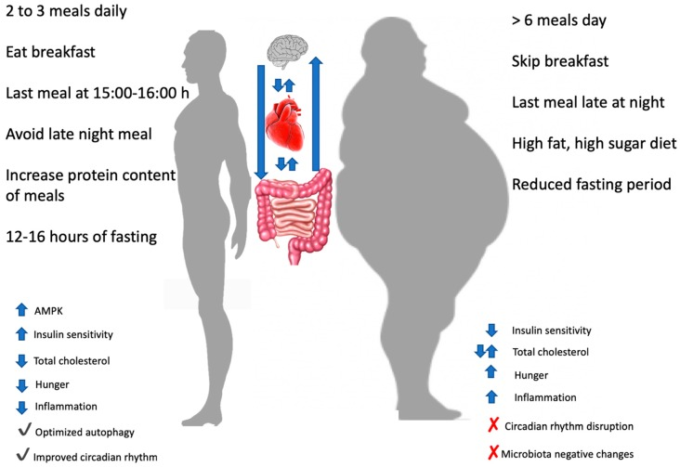
AMPK:AMP活性化プロテインキナーゼ
さらに、夕方の余暇時間に関連付けられている食品へのアクセスの増加のために、この勧告の遵守は、いくつかのために現実的ではないかもしれない。そのような場合には、健康促進戦略のいずれかを実施することが有益であろう(すなわち、ほとんどのカロリーの消費を一日の早い時間にシフトするか、または一晩の断食よりも長い断食ウィンドウを実施する)。ライフスタイルのアプローチには、身体活動を含めるべきである。残念ながら、身体運動と体内時計に関する論文は少ないが [122] 、ヒトにおける食事時間と頻度と身体運動の相互影響についてはデータがない。このテーマはさらに調査する価値がある。
様々な集団における食事のタイミングと頻度の影響の全容はまだ解明されていないが、これらの変数を操作することは、ヒト集団の健康改善に役立つ可能性がある(図4および図5)。科学的文献は、絶食、食事の頻度、タイミングが健康結果にかなりの影響を与えることを示唆する十分なデータを提供している。これらの知見は、食事の質だけでなく、頻度やタイミングも最適な健康のために重要であることを強調している。
図4 食事のタイミングが異なる心血管疾患リスク因子や疾患に及ぼす影響
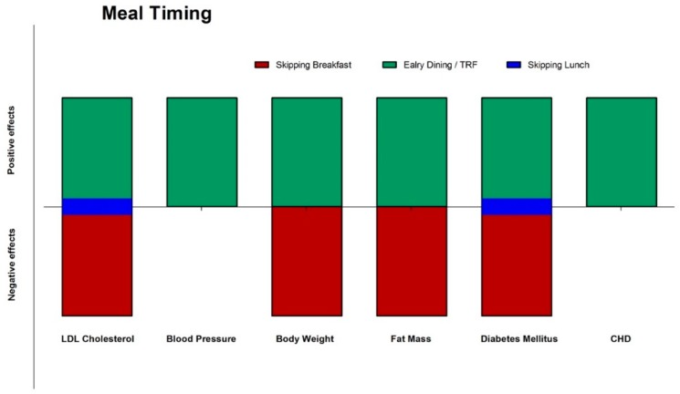
(緑:陽性、赤:陰性、青:中性)。CHD:冠動脈性心疾患、心血管疾患:心血管疾患、TRF:時間制限給餌。
図5 食事頻度が異なる心血管疾患のリスク因子や疾患に対する効果
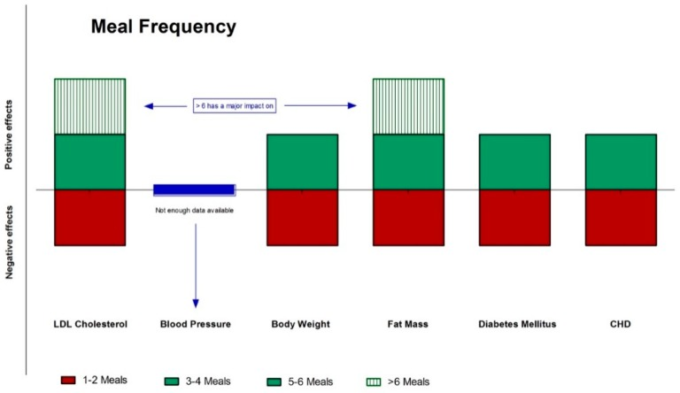
(緑:陽性、赤:陰性、青:中性)