コンテンツ
- Revolution of Alzheimer Precision Neurology: Passageway of Systems Biology and Neurophysiology
- 要旨
- はじめに
- アルツハイマー病における精密神経学的パラダイム
- 図1 異なる神経画像診断モダリティと方法に従って層別化されたコホートは、アルツハイマー病および他の神経変性疾患患者のサブセットの分類と予測のための疾患モデルに統合されている。
- 図2
- 表1 アルツハイマー・プレシジョン・メディシン・イニシアチブ(アルツハイマー精密医療イニシアチブ)の5つの柱
- 表2 Alzheimer Precision Medicine Initiative (アルツハイマー精密医療イニシアチブ)の枠組みの中で進化する語彙と用語。
- 図3 神経ネットワーク崩壊と複雑な脳システム障害の非線形動的時空間進行のモデルとアルツハイマー病の病態生理との関係
- 図4 現在利用可能な技術の概要と、前臨床および臨床研究におけるバイオマーカー探索に使用される生物学的マーカーのカテゴリーの結果
- アルツハイマー病のシステム生物学
- アルツハイマー病のシステム神経生理学。神経生理学と神経運動学を理解する
- 構造磁気共鳴画像法(MRI)の貢献と役割
- DIFFUSION TENSOR IMAGING(DTI)の貢献と役割
- 機能性磁気共鳴画像法(fMRI)の貢献と役割
- 電気脳生理学(EEG)の貢献と役割
- 磁気脳波(MEG)の貢献と役割
- 神経モデリングの貢献と役割
- ポジトロン画像法(PET)の貢献と役割
- RETINAL IMAGINGの貢献と役割
- マルチモーダルlongitudinalデータ解析の空間的モデル化
- アルツハイマー病におけるシステム薬理学の発展分野
- 結論
Revolution of Alzheimer Precision Neurology: Passageway of Systems Biology and Neurophysiology
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6008221/
Harald Hampel、a、b、c、d、* Nicola Toschi、e、f、g Claudio Babiloni、h、i Filippo Baldacci、a、b、c、d、j Keith L. Black、k Arun L.W. Bokde、l René S. Bun、a、b、c、d Francesco Cacciola、m Enrica Cavedo、a、b、c、d、n Patrizia A. Chiesa、a、b、c、d Olivier Colliot、o Cristina-Maria Coman、a、b、c、d Bruno Dubois、p Andrea Duggento、e Stanley Durrleman、q Maria-Teresa Ferretti、r、s Nathalie George、t Remy Genthon、p Marie-Odile Habert、u、v Karl Herholz、w、x Yosef Koronyo、k Maya Koronyo-Hamaoui. k、y Foudil Lamari、z Todd Langevin、aa Stéphane Lehéricy、ab、ac Jean Lorenceau、ad Christian Neri、ae Robert Nisticò、af Francis Nyasse-Messene、p Craig Ritchie、ag Simone Rossi、ah、ai Emiliano Santarnecchi、ah、aj Olaf Sporns、al Steven R. Verdooner、am Andrea Vergallo、ab、c、d Nicolas Villain、b、c、d Erfan Younesi、an Francesco Garaci、e、ao and Simone Laista Laista、ao Verdooner、am Andrea Vergallo、a、b、c、d Nicolas Villain、b、c、d Erfan Younesi、an Francesco Garaci、e、ao and Simone Listaa、b、c、d、*、 for the Alzheimer Precision Medicine Initiative (アルツハイマー精密医療イニシアチブ).
要旨
プレシジョン・ニューロロジーの開発プロセスでは、システム理論とシステム生物学、神経生理学を並行した双方向の研究経路で実施する。すなわち、動物モデルを用いて、異なる分子、細胞、大規模神経ネットワークシステム内のシステム機能不全を仮説に基づいて複合的に調査し、病態生理学的進行の異なる段階にある異なる疾患やサブグループにおけるこれらの候補ダイナミックなシステムバイオマーカーの有用性を検証する。
このトランスレーショナル研究と並行して、「オミックス」をベースとした仮説のない探索的研究が行われる。この研究では、進行中の無症候性、前臨床、臨床の神経変性疾患(神経変性疾患)集団からマルチモーダルデータを収集し、神経変性疾患の広い連続した生物学的・臨床的スペクトルの中で、ハイスループットかつ高コンテンツの技術と強力な計算・統計モデリングツールを組み合わせて、神経変性疾患に関連する新たな機能不全システムと予測マーカーの同定を目指する。
目標は、検出可能な病態生理学的進行の段階における神経変性疾患の連続体に共通する生物学的分母または分化した分類因子を同定し、システムベースの中間エンドフェノタイプを特徴づけ、マルチモーダルな新規診断システムバイオマーカーを検証し、システムベースの中間エンドフェノタイプと候補的なサロゲートマーカーを利用して臨床介入試験のデザインを前進させることである。これらの目標を達成することは、アルツハイマー病(アルツハイマー病)などの神経変性疾患の早期かつ効果的な個別化治療を最終的に開発するための鍵となる。
アルツハイマー精密医学イニシアチブ(アルツハイマー精密医療イニシアチブ)とコホートプログラム(アルツハイマー精密医療イニシアチブ-CP)、そしてソルボンヌ大学臨床研究グループ「アルツハイマー精密医学」(GRC-アルツハイマー精密医学)のパリ拠点コアは、従来の臨床診断や医薬品開発から、加齢に伴う個人の包括的な生物学的性質の調査に基づいた画期的なイノベーションへの道筋をつけるために、最近立ち上げられた。アルツハイマー精密医療イニシアチブ運動は、システム神経生理学とシステム生物学の両方を神経変性疾患の探索的トランスレーショナル神経科学研究に体系的に適用しようとする勢いを増している。
はじめに
認知症症候群は様々な神経疾患によって引き起こされるが、認知症を引き起こす疾患としてはアルツハイマー病(アルツハイマー病)が最も多く、50~70%を占めている。年齢の上昇は、アルツハイマー病やその他の認知症の最も重要な危険因子であり、平均寿命が延び、世界中の人口動態で高齢化が進む中で、認知症の患者数は今後も指数関数的に増加していくと予想されている。2015年には世界で4、700万人近くが認知症に罹患していると推定され、2030年には7、500万人、2050年には1億3、100万人に達すると予測されており、低所得国や中所得国での増加が最も大きくなると予測されている[1]。
2017年5月29日、ジュネーブで開催された第70回世界保健総会において、世界保健機関(WHO)は、認知症に関する世界的な計画である「認知症に対する公衆衛生の対応に関する世界行動計画2017-2025」を全会一致で採択し、認知症の認知度向上、リスク低減、診断、ケアと治療、ケアパートナーへの支援、研究などの目標を掲げている(https://www.alz.co.uk/news/global-plan-on-dementia-adopted-by-who)。
近年、アルツハイマー病に関連する分子メカニズムの理解が進んでいる。この複雑な多遺伝子性神経変性疾患(神経変性疾患)の病因には、コアイベント(すなわち、アミロイドプラークへの42アミノ酸長アミロイドβ(Aβ42)ペプチドの蓄積と高リン酸化タウ蛋白質の自己会合による脳内神経原線維のもつれ形成)と、下流のプロセス(一般化した神経炎症など)の両方を含む、順次相互作用する病態生理学的カスケードが含まれている[2、 3]。これらの事象は、軸索の変性[4-6]とシナプスの完全性の破壊[7、 8]を誘発し、その結果、シナプス機能障害、そして最終的には生理学的な神経接続性の悪化につながる[9]。
このように疾患の理解が進んでいるにもかかわらず、アルツハイマー病はその症状、進行、治療への反応、危険因子への感受性において高度な不均一性を特徴としている。表現型の不均一性は、現在、臨床科学と臨床試験デザインにおける最大の課題の一つと考えられている[10]。一方では、同じ症候群であっても、実質的に異なる病態生理学的メカニズムによって引き起こされることがある。
より正確で確定的なアルツハイマー病診断を確実にするためには、脳内の疾患プロセスを検出し追跡するためのバイオマーカーが非常に必要である。一方で、同じような病態生理学的メカニズムでも、患者間で異なる症状を示すことがあり、追加的な要因が疾患の発現や進行に影響を与える可能性があることを示唆している。
このような追加因子(遺伝的、エピジェネティック、生活習慣、表現型を含む)の正体と影響については、さらなる調査が必要である。特に、個人の性別などの因子が疾患の表現型や薬物反応に影響を与え、臨床の不均一性に実質的に寄与することを示す証拠が増えてきている[11]。
アルツハイマー病患者では、アミロイドやタウの負担に明確な差がないにもかかわらず、認知機能の低下[12、 13]や脳の萎縮[14]の割合に性差が報告されている[15]。さらに、アルツハイマー病における性-遺伝子型相互作用は、発症リスクと転化リスクの両方に影響を与えることが示されている[16]だけでなく、薬理学的治療への反応にも影響を与えることが示されている[17、18]。
社会における女性と男性の地位(すなわち性別)に関連した社会経済的構成もまた、教育、給与、年金制度、介護負担に影響を与えるため、疾患の発症と進行に影響を与える可能性がある[19]。
したがって、性と性別はアルツハイマー病における表現型の変動の中心的な推進要因であるように見え、病気の予防、発見、治療のための戦略を設計する際には、それらの役割を慎重に考慮する必要がある。性と性別の影響の分析-単独でも、さまざまな遺伝的、エピジェネティック、表現型の形質との組み合わせでも-は、アルツハイマー病に対するより個別化された患者中心のアプローチへの第一歩となるはずである。
アルツハイマー病における精密神経学的パラダイム
最近、アルツハイマー病やその他の神経変性疾患の分野で画期的な概念転換が始まっており、リスク因子と保護因子の存在、そして多因子性脳蛋白質障害の広いスペクトルに沿った複雑な病態生理の非線形でダイナミックな連続性が強調されている。アルツハイマー病の検出、治療、予防における大幅な進歩は、精密医療(精密医療)パラダイム[20、 21]に基づく戦略の生成と体系的な実施を通じて発展することが期待されており、その確立には、「オミックス」アプローチ、神経画像診断モダリティ、認知評価テスト、臨床特性などの統合された分野と技術開発の配列の実施を必要としている。
これらは、システム理論のパラダイム[22]に従って分析する必要があるいくつかの領域に収束する。これにより、システム生物学とシステム神経生理学によって評価されるすべてのシステムレベル(図1)と、「アルツハイマー病」という遺伝的、生物学的、病理学的、臨床的に不均質な構造を特徴づけるさまざまなタイプの時空間データを解明するための、新規で独創的なモデルを概念化することが可能になる[21]。
このように、システム生物学とシステム神経生理学は、この状態の不均一性を反映した遺伝的、生物学的、病態生理学的、臨床的マーカーの多変量プロファイルと組み合わせプロファイルを定義することを可能にする。研究技術の基本的な進歩のおかげで、我々は、包括的な脳のマップを登録し、作成し、分子、ニューロンから脳領域までの異なるシステム全体で動的なパターンを記録するための新しい、より良いパフォーマンスの解析ツールを得た。
特にシステム神経生理学では、非侵襲的な神経イメージング技術を用いて測定された時間依存的な機能的接続性の最近の知見に示されているように、計算ネットワークモデルが脳ネットワークの構造と動的機能の関係をどのように解明することができるかを示すことを目指す。
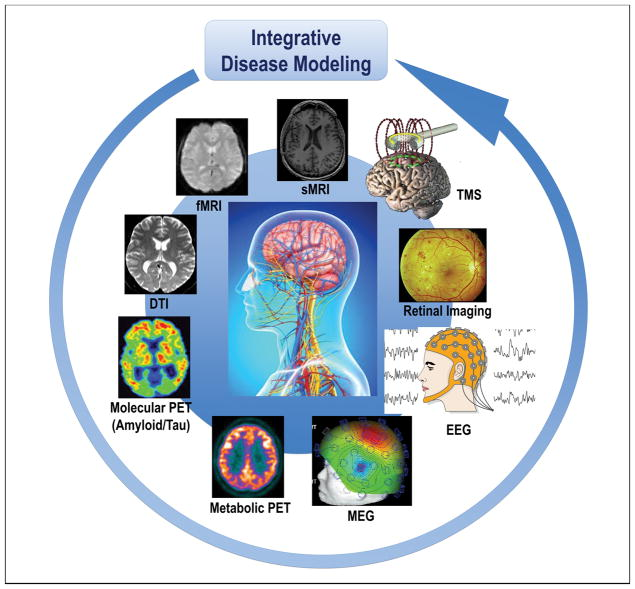
図1 異なる神経画像診断モダリティと方法に従って層別化されたコホートは、アルツハイマー病および他の神経変性疾患患者のサブセットの分類と予測のための疾患モデルに統合されている。
システム神経生理学のパラダイムは、マルチモーダルに記録された神経情報を計算モデル化し、データマイニング手法を組み合わせて統合・解析することで、統合された神経システムの機能の基本原理を研究することを目的としている。このパラダイムは、実験的に記録された神経活動に含まれる情報を解読するために、fMRIや脳波などの単一モダリティの脳細胞活動の同時記録を統合して、相乗的な洞察を生み出し、隠された神経生理学的変数を推測することができる解析手法を使用することができるかもしれない。システム神経生理学の究極の目標は、信号が大脳新皮質ネットワーク内でどのように表現されているか、また、多数の異なるニューロン構成要素が果たす特定の役割を明らかにすることである。
略語。アルツハイマー病(アルツハイマー病)、DTI(拡散テンソルイメージング)、EEG(脳波)、MEG(脳磁図)、fMRI(機能的磁気共鳴イメージング)、sMRI(構造的磁気共鳴イメージング)、神経変性疾患(神経変性疾患)、PET(陽電子放射断層撮影)、TMS(経頭蓋磁気刺激
従来のモデルから精密医療への移行は一夜にして起こるものではない。しかし、パートナーとの革新的で学際的なネットワークを構築すればするほど、より早く、より効果的に変化が起こることがわかる。精密医療の約束を果たすためには、創造的で斬新なソリューションを見つけるために協力する複数の利害関係者のパートナーシップによる新しいエコシステムが必要である。このような新しいエコシステムは、学術機関や地域社会の提供者、産業界、専門家団体、政府、消費者、患者擁護団体などで構成されており、以下のようなパイロット的な取り組みを地域、全国、そして国際的な規模で進めることができる。
アルツハイマー病における精密医療パラダイムの発展を促進するために、国際的なアルツハイマー精密医療イニシアチブ(アルツハイマー精密医療イニシアチブ)とその計画されたコホートプログラム(アルツハイマー精密医療イニシアチブ-CP)(図2)は、我々のコンソーシアムによって最近立ち上げられ、米国の精密医学イニシアチブ(https://www.whitehouse.gov/precision-medicine)と米国の「All of Us研究プログラム」(米国精密医療Iコホートプログラム(https://www.nih.gov/research-training/allofus-research-program)から発展したもの)とテーマ別にリンクされている(表1)。
4つの先駆的なトランスレーショナル神経科学研究プログラムである「MIDAS」、「PHOENIX」、「POSEIDON」、「VISION」は、フランスのパリにあるアルツハイマー精密医療イニシアチブとアルツハイマー精密医療イニシアチブ-CP発起拠点、ソルボンヌ大学(ソルボンヌ大学)、ピチエ・サルペトリエール大学病院で、私たちのグループによって、学際的なローカルネットワークの中で開発され、立ち上げられていた。
本研究では、パリの記憶・アルツハイマー病研究所(Institut de la Mémoire et de la Maladie d’Alzheimer、 IM2A)と脳・脊椎研究所(Institut du Cerveau et de la Moelle Épinière、 ICM)の協力を得て、システム生物学と神経生理学の構成要素を整理し、組み合わせ、統合することで、他の脳の蛋白質障害/神経変性疾患のモデルアプローチであるアルツハイマー病における精密医療の開発を促進することを目的としている。
この点では、アルツハイマー精密医療イニシアチブの概念的枠組みに従って、初期の無症状前臨床集団から前駆症状から認知症後期集団までの単施設パイロットアルツハイマー精密医療イニシアチブサブコホート(INSIGHT-preアルツハイマー病、Predict-MA PHRC、RESPIR、SOCRATES)が、我々の臨床募集の中心地であるIM2Aで確立されている。
これらのパイロットアルツハイマー精密医療イニシアチブコホートは、標準化された学術大学ベースの専門家センターで、アルツハイマー病のリスクがある認知的に無傷の人と、あらゆる種類の神経変性疾患患者の両方を含めることを可能にし、ユニークな異質で多次元的なデータを提供している。
これらのパイロットAMPIコホートを用いた研究は、新たに設立されたソルボンヌ大学-「アルツハイマー精密医学臨床研究グループ」(GRC-21)、ソルボンヌ大学-「臨床研究グループ-アルツハイマー精密医学」(GRC-アルツハイマー精密医学)の構造的枠組みの下で実施されている。
ソルボンヌ大学GRC-アルツハイマー精密医学の主な目的は、システム生物学とシステム神経生理学、ビッグデータサイエンス、バイオマーカー誘導型統合疾患モデリング(IDM)を用いて、複雑なシステム理論に基づき、精密医療パラダイムを取り入れた従来の神経学、精神医学、神経科学の改革を加速させ、アルツハイマー病やその他の神経変性疾患における検出、分類、治療開発を改善することにある。
図2
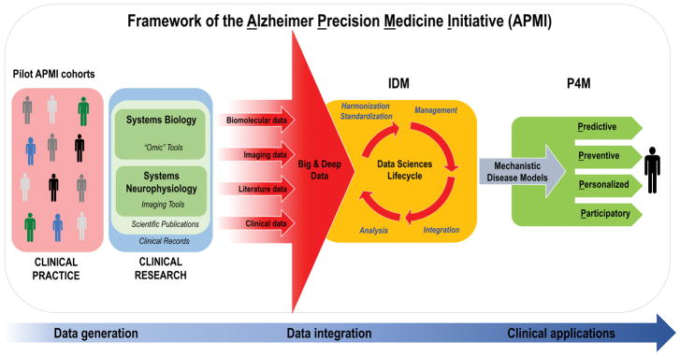
Alzheimer Precision Medicine Initiative (アルツハイマー精密医療イニシアチブ)の概念的枠組みの中でのベンチからベッドサイドへのトランスレーショナルなデータフロー
IDMに基づく「データ科学ライフサイクル」は、データ駆動型と知識駆動型のアプローチの両方を活用し、システム生物学とシステム神経生理学のパラダイムを適用して生成された定量データ(生体分子、神経イメージング/神経生理学、臨床データ)と定性データ(科学文献やオンラインメディアから収集されたもの)の両方を調和のとれた標準化された形式で表現し、統合的な計算基盤の中で適切な管理ができるように準備する。実際、結果として得られた異種・多次元のビッグデータとディープデータは、IDMの概念に従って、計算とデータ科学の手法によって調和され、標準化され、統合され、メカニズム論的な疾患モデルの形で提供される。
疾患別の統合的な計算モデルは、IDMのパラダイムにおいて重要な役割を果たし、アルツハイマー病やその他の神経変性疾患の分野における「実行可能な」P4M対策の基礎を表している。その結果、統合的疾患モデルは、以下のような意思決定をサポートすることが期待されている。
1)機械的バイオマーカーを用いた脳疾患の進行の早期診断(予知)、
2)病気や障害の可能性を減らすために、機械的合併症に基づいて神経変性疾患発症のリスクが高い人をスクリーニングし、層別化する(予防)、
3)適切な患者集団に適切なタイミングで適切な治療を施す(個別化)、
4)EHRで収集された患者志向の情報やソーシャルメディアで報告された患者のフィードバックに基づいて、患者の利益のために「実行可能な」計画を最適化する、
といった意思決定を支援することが期待されている。インターネットは、様々なソーシャルメディアなどのオンラインリソースで患者の体験を共有することで、個々の患者の医療への参加を大きく可能にしている(参加型)。その結果、P4Mパラダイムの実装の中で、個々の患者中心の検出や治療の軌跡を予測することができる「実行可能な」モデルになることが期待される。
略語。アルツハイマー精密医療イニシアチブ、 Alzheimer Precision Medicine Initiative; EHRs、 electronic health records; IDM、 integrative disease modeling; 神経変性疾患、 neurodegenerative diseases; P4M、 Predictive、 Preventive、 Personalized、 Participatory Medicine. 21]から改変。
表1 アルツハイマー・プレシジョン・メディシン・イニシアチブ(アルツハイマー精密医療イニシアチブ)の5つの柱
アルツハイマー精密医療イニシアチブの使命は、統合的疾患モデリング(IDM)を用いた複雑なシステム理論に基づく精密医学(または精密神経学)を包含する神経学と神経科学を変革し、脳蛋白質障害、蛋白質のミスフォールディング障害、アルツハイマー病(アルツハイマー病)などの神経変性疾患のヘルスケアソリューションを促進することにある。これは、以下の5つの画期的な理論的科学的進歩によって促進される。
コンセプト コメント
(1) 「精密医療」パラダイムの出現
特定の個人を他の個人と区別するゲノムバイオマーカー、表現型、心理社会的特性を用いて、システムバイオロジー技術に基づ いて、個人のニーズに合わせた治療法を発見し、開発すること。この定義には、疾患の初期段階では病態生理学的な進行に影響を与え、後期段階では臨床結果に影響を与え、ファーマコゲノミクスによって支持された特定の治療に反応する可能性の低い患者の不必要な副作用を最小限に抑えるという目標が含まれている。遺伝学/ゲノミクス/トランスクリプトミクス、バイオインフォマティクス、ニューロダイナミクス、ニューロイメージング、コネクノミクスなどの技術に加え、細胞ソーティング、エピジェネティクス、プロテオミクス、リピドミクス、メタボロミクスなどの他の技術の融合により、疾患のステージングと分類が洗練され、多くの場合、重要な予後と治療の意味合いを持つ精密医療の範囲が急速に拡大している。これらの新技術の中でも、遺伝学と次世代DNAシークエンシング法が最も大きな効果を発揮している。
(2) 「システムバイオロジー」パラダイムの出現
システムバイオロジーとは、細胞や生物の中で相互作用する生体分子を統合的に深く研究することである。このアプローチが実現可能になったのは、cDNA マイクロアレイ、タンパク質や脂質の質量分析、厳格なバイオインフォマティクスなどのハイス ループット技術が発展してきた最近のことである。高コンテンツデータは、疾患間の収束経路を示唆しており、記述的研究を超えて神経変性疾患の病態をより統合的に理解することができ、場合によっては「薬物投与可能な」ネットワークノードが強調されることもある。
(3) 「システム神経生理学と複雑ネットワーク」パラダイムの出現
これは、神経画像や神経生理学に応用される数学、計算機科学、統計学的手法の進歩が大きく寄与している。
(4) 「ニューラル・モデリング」パラダイムの出現
複雑なネットワーク・パラダイムでは、複数の脳領域間の動的相互作用の大きな複雑性を扱うために、高度な数学的・計算的手法が必要となる。
(5) 「統合的疾患モデル化(Integrative Disease Modeling)」(IDM)パラダイムの出現
これは、分子から表現型までの異なる生物学的スケールで蓄積された疾患情報を収集、保存、統合、モデル化、解釈するために、高度な計算手法の力を活用するトランスレーショナルリサーチにおける知識ベースのパラダイムである。IDMはトランスレーショナルリサーチの中核をなす新しいパラダイムであり、疾患プロセスの記述的表現から機械論的表現へと移行するための基盤を整えるものである。バイオマーカーや薬剤の研究を臨床的に適用可能な診断・予防・予後・治療戦略に変換するためには、IDMの大きな可能性があることから、コンピュータで読める疾患モデルは今後のP4医療研究分野での取り組みに欠かせないものになると期待されている。
アルツハイマー病における精密医療の実現により、現実の生活場面からエビデンスを検出するリアリティ・ベースド・メディシンのための斬新で独創的な科学的分類法と卓越した作業語彙・用語集(表2参照)が誕生することが期待されている。
表2 Alzheimer Precision Medicine Initiative (アルツハイマー精密医療イニシアチブ)の枠組みの中で進化する語彙と用語。
概念略語の定義
ビッグデータ データマイニングツールによって生成された大量のデータセットのリポジトリ。ビッグデータには、システム理論や知識ベースのアプローチ、臨床記録から得られる情報が含まれる。
バイオマーカー 正常な生物学的プロセス、病原性プロセス、または治療的介入を含む曝露や介入に対する反応の指標として測定される定義された特性。分子学的、組織学的、放射線学的、または生理学的特性がバイオマーカーの一種である。バイオマーカーは、個人がどのように感じ、どのように機能し、どのように生存しているかを評価するものではない。バイオマーカーには、感受性/リスクバイオマーカー、診断バイオマーカー、モニタリングバイオマーカー、予後バイオマーカー、予測バイオマーカー、薬力学/反応バイオマーカー、安全性バイオマーカーなどがある。
データサイエンス 統計学、人工知能、機械学習、データマイニング、予測分析などのデータ分析分野の一部を継承したもので、構造化または非構造化のいずれかの異なる形態のデータから知識を抽出するためのプロセスとシステムに関する学際的な分野。
e-ヘルス 電子的なプロセスと通信によってサポートされるヘルスケアの実践を示す用語。モバイルヘルス(「m-ヘルス」:電話、ウェアラブル、家庭内機器、アプリなどのスマートな個人用モバイル機器で、患者ケアの改善を目的とした健康情報を収集すること)と呼ばれる、携帯電話上の健康アプリケーションやリンクも含むことができる。
この用語はまた、医療/ヘルスケアや情報技術の最先端にあるサービスやシステムの範囲を包含することができる:電子カルテ(EHRs)。これらは、電子的に保存された健康情報や臨床データをデジタル形式で体系化した集団の収集を示している。これらの登録は、ネットワークシステムを介して異なる医療機関間で共有することができる。
European Prevention of Alzheimer’s Dementia Consortium EPAD病 汎欧州的な取り組みで、特に アルツハイマー病 の二次予防のための新規治療法の開発を目的とした第 2 相概念実証(PoC)臨床試験の設計と実施のための共有プラットフォームを確立することを目的としている。
ゲノム医学 個人のゲノム情報(「パーソナルゲノミクス」の定義も参照)を診断特性化や治療計画の開発に活用する学問分野。
統合的疾患モデル化(Integrative Disease Modeling) IDM 生物学的スケールを超えた構造化・非構造化の定量的・定性的データの複数のソースを標準化、管理、統合、解釈するための学際的なアプローチであり、患者固有の分子メカニズムを臨床応用に結びつけるための意思決定を支援する計算モデルを用いている。
「オミックス」または「オミック」分野 生物および/または生物全体の構造、機能、およびダイナミクスに変換する生体分子(DNA配列、転写物、miRNA、タンパク質/ペプチド、代謝物/脂質)のプールを完全に収集し、特徴づけ、定量化することを目的としたハイスループットスクリーニングツール。
「遺伝学的に(リスクプロファイル)、生物学的に(分子機構や細胞経路に基づいて)決定された実体に対してではなく、異種の臨床的に運用されている多数の症候群に対してバイオマーカー候補を検証することで、早期発見、介入、予防の選択肢の開発に用いられる伝統的なアプローチ。
特定の言説の領域に実際に、または根本的に存在する実体の種類、性質、相互作用を形式的に命名し、指定すること。
P4 (Predictive、Preventive、Personalized、Participatory) Medicine
P4(予知、予防、パーソナライゼーション、参加型)医療
P4M プレシジョン・メディシンのパラダイムのトランスレーショナル・メディシンの構成要素。システム医学の知識、ツール、戦略を応用することを目的とした臨床実践モデルである。これは、個々の患者に関する膨大な量のデータを生成し、マイニングし、統合することで、健康や病気の予測可能な「実行可能な」モデルを作成することを意味している。
パーソナルゲノミクス 個人が病気にかかる可能性を予測するためのサポートを提供するゲノミクスの一部門。そのため、精密医療パラダイムによれば、予測医療と個別化医療の両方において重要な役割を果たしている。
個別化医療 一人ひとりの患者さんに合わせた治療法を目指し、「ワンサイズフィットオール」や伝統的な「魔法の弾丸」のようなアプローチとは対照的に、P4Mの構成要素。
精密医療 健康と疾病の両方に関連するトランスレーショナルサイエンスのパラダイム。
プレシジョン・メディシンは、複雑な多因子複合神経変性疾患(脳のタンパク質異常症)の包括的な病態生理学的プロファイルの方法論的進歩と発見を考慮に入れた、システムレベルでのバイオマーカー誘導型医療である。この研究は、P4Mの実施を通じて、ターゲットを絞った介入のために、個人特有の「生物学的構成」(遺伝的、生化学的、表現型、生活習慣、心理社会的特性など)を考慮して(カスタマイズして)、疾患予防と治療の効果を最適化することを目的としている。
システム生物学 SB 進化する仮説のない、探索的、ホリスティック(非還元論的)、グローバル、統合的、学際的なパラダイム マルチモーダル・ハイスループット技術プラットフォームの進歩を利用して、構造的にも機能的にも異なる分子の大量の生物学的経路 のネットワークをシステムレベル(すなわち、細胞、細胞群、組織、器官、装置、あるいは生物全体のレベル)で時間をかけて同時に探索することを可能にする。
システムズメディスン SM システム生物学に基づく戦略を医学研究に適用する全体的なパラダイム。疾患の病態生理学的メカニズム、予後、診断、治療法を明らかにするために、細胞組織のあらゆるレベルで(グローバル、統合的、統計的/数学的/計算機的なモデル化を採用することにより)様々な生物医学的データを統合することを目的としている。
システム神経生理学 SN パラダイム マルチモーダルに記録された神経情報を計算機モデル化し、データマイニング手法を組み合わせて統合・解析することで、統合された神経システムの機能の基本原理を研究することを目的としている。このパラダイムは、実験的に記録された神経活動に含まれる情報を解読するために、機能的磁気共鳴イメージングや脳波などの単一モダリティの脳細胞活動の同時記録を統合し、相乗的な洞察を生成し、おそらく隠された神経生理学的変数を推測することができる解析手法を使用することができる。システム神経生理学の究極の目標は、信号が大脳新皮質ネットワーク内でどのように表現されているか、また、多数の異なるニューロン構成要素が果たす特定の役割を明らかにすることである。
システム薬理学 SP 分子、細胞、組織、器官、生物、集団レベルでの薬物作用に関する知識を深める科学」(http://www.aaps.org/Systems_Pharmacology/)。
システムズ理論 ST プレシジョンメディシンのパラダイムのトランスレーショナルリサーチ理論。これは、複雑な多遺伝子疾患のすべてのシステムレベルと異なる時空間データタイプを抽出し、解明するための新規/独自モデルの概念化を可能にする学際的な概念的枠組みである。21]から改変。
アルツハイマー病 の適切な統合的理解は、分子技術とデータ処理の進歩によって推進され、ビッグデータと呼ばれる膨大な量の異種・多次元データの生成、分析、解釈、保存を可能にする。アルツハイマー病におけるビッグデータは、IDMの理論的枠組みの下で、さまざまな計算とデータサイエンスの方法を適用することにより、疾患の現在のメカニズム論的理解を向上させるために使用することができる[23]。マルチモーダルなビッグデータの統合は、タンパク質相互作用や遺伝的制御ネットワーク、シナプス結合、脳領域間の解剖学的投影などの大規模な神経生物学的システムからの要素間のリンクを理解するために不可欠である。通常、これらのデータは、複数のレベルの組織から来ているか、あるいは生物学の異なる領域やデータタイプが関与している(図3)。
図3 神経ネットワーク崩壊と複雑な脳システム障害の非線形動的時空間進行のモデルとアルツハイマー病の病態生理との関係
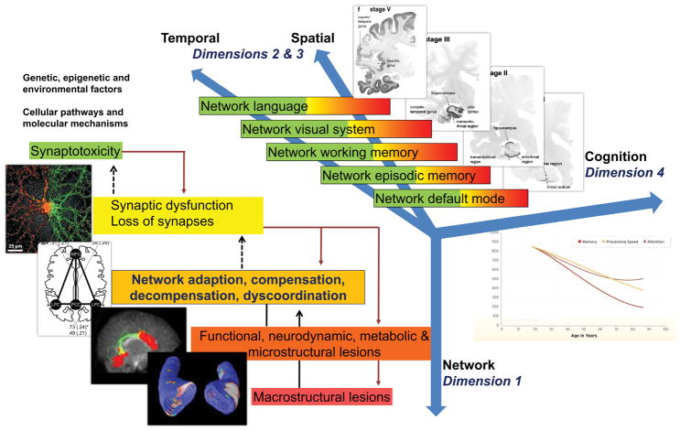
アルツハイマー病の病態生理学的プロセスの4つの次元
ディメンション1はニューロンネットワークのレベルで発生する(緑色から赤色にコード化されている)。ディメンション1は、シナプス機能障害および/またはシナプト毒性分子剤の形で極めて早期に開始し、ニューロンネットワークのバランスを変化させることができる。
ディメンション2と3は、ほぼ独占的にデフォルトモードからエピソード記憶ネットワークへと時間的・空間的に広がり、作業記憶、言語および/または視覚プロセスを担当する側頭葉、頭頂葉、前頭葉の大脳新皮質連想領域へと広がっていくものとみなすことができる。これらの複雑なシステムの一つ一つは、適応から補償、大規模な補償から大規模な補償、そして広範な組織化不全まで、様々な程度の分解を経験することができる(ディメンション1参照)。
ディメンション4は、本質的には、ディメンション1とディメンション2とディメンション3が統合されて、臨床的に症状のある末期の症候性認知および症候性認知と、その後の行動および精神病理学的な機能不全と衰退に至ることである。したがって、このような複雑で多スケールで多層的なネットワークの関連性が、十分な代償メカニズムが存在する場合には、「侮辱」に対して部分的に頑健であるが、どのレベルでも適応と代償が失敗した場合には、非常にランダムに脆弱であることも明らかになっている。第1次元での十分な代償は第2次元、第3次元での誤作動に転じ、ひいては第2次元、第3次元での実質的な代償は第4次元での誤作動(すなわち軽度認知障害、臨床的認知症症候群)に転じる。
略語。アルツハイマー病、アルツハイマー病。
精密医療が効果的に機能するためには、ビッグデータの収集・管理・調査のための高度なツールを活用する必要がある。特に、情報技術の目覚ましい進歩により、電子カルテ(EHR)の開発と導入により、限られたコストで縦断的な医療記録や臨床データの収集・保存が可能になった。さらに、健康情報を収集するための革新的な方法として、携帯電話、アプリ、ウェアラブル、家庭内機器などのパーソナル・モバイル技術の採用が一般的になりつつある(モバイルヘルスまたはmヘルス)。これらのデバイスは、よりエコロジカルで自然な環境の中で臨床に関連する情報を蓄積し、患者ケアを改善することを可能にする。ますます洗練されたソフトウェアアプリケーションから生成された大量かつ高密度のデータは、ライフスタイルと環境の両方に関する自己申告の情報を豊かにすることができ、これまでは入手が困難であったこれらの要因についての明確なビジョンを研究者に提供する。
多次元的なデータ駆動型アプローチに根ざした精密医療は、アルツハイマー病の予防と治療をより高いレベルの個別化にグレードアップさせ、後期の患者や疾患全体ではなく、リスクのある前臨床参加者全員を対象としたシフトを促進することが期待されている。この目標は、主に信頼性の高いバイオマーカーの同定と検証によって達成されるであろう。これにより、疾患リスク、予後、および/または予防的措置や治療に対する反応によって患者をより良く分類することが可能になるであろう。
今日まで、精密医療(一般的に)とバイオマーカー誘導型治療戦略(特に)は、腫瘍学の分野で最も広範に応用されてきた。食品医薬品局は最近、腫瘍の解剖学的起源ではなく、特定の分子異常の存在に基づいたがん治療法を初めて承認した。ペムブロリズマブ(がん免疫療法で使用されるヒト化抗体)は、転移性または切除不能なマイクロサテライト不安定性高値(MSI-H)またはミスマッチ修復欠損(dMMR)の固形腫瘍の成人および小児患者に対して承認されている[24]。
神経変性疾患における精密医療の実装は、現在、研究者は、このような医療のより高度な分野からのクロストランス受精を想定するように促している。このような状況では、以前に承認されたいくつかの機械的な抗がん剤を神経変性疾患に再利用することで、承認取得までのコストと時間の両方を削減できる可能性がある。
例えば、ボスチニブ[25]やマシチニブ[26]のようなチロシンキナーゼ阻害剤(抗がん治療の標準的なアプローチである)は、筋萎縮性側索硬化症患者において有望な臨床結果を示しており、オートファジーの活性化を介して他の神経変性疾患においても神経保護作用を発揮することができる。神経変性に対して再配置可能な抗がん剤の探索領域は、最終的には特定のバイオマーカーデータに基づいたデータ駆動型のアプローチが必要となるであろう。
治療とは別に、アルツハイマー病における精密医療のもう一つの重要な目的は、その初期段階での病態生理の前臨床的検出と関連する疾患の早期発症、および個人レベルでの予防的介入の実施である。この目標は、ある個人を他の個人と区別する遺伝的、バイオマーカー、イメージング、および臨床的特徴の統合的な分析によって達成されるかもしれない。この目標を達成するためには、信頼性の高いマルチモーダルな生物学的指標、すなわちバイオマーカーが必要である[27-34]。
この点で、いくつかの潜在的な生物学的マーカーが、前臨床段階から前駆症状から臨床段階まで、アルツハイマー病の全領域にわたって同定されている[35-41]。これには以下のような異なるカテゴリーが含まれる。
- 1)神経遺伝学/神経エピジェネティクスマーカー[42-45]、
- 2)脳脊髄液(脳脊髄液)マーカー[49-55]と血液(血漿/血清)マーカー[56-63]の両方を含む神経化学マーカー[4、46-48]、
- 3)構造/機能/代謝神経イメージングに由来するマーカー[64-68]、および
- 4)神経生理学/神経力学マーカー[69]である。
さらに、アルツハイマー病バイオマーカー探索領域では、規制当局や業界関係者の意見が定期的に議論され、開発されている[70、 71]。バイオマーカー研究から得られた実験情報をシステム生物学とシステム神経生理学のパラダイムで統合・再構成することは、最終的には、分子標的治療のためのバイオマーカーテスト(コンパニオン診断薬)の適切な使用を促進するための医学研究所(IOM)委員会勧告に沿って、精密医療パラダイムを通じた患者ケアと臨床転帰の改善を可能にする[72] [73]。
これらの前提から、精密医療はバイオマーカー誘導型医療として概念化できる。食品医薬品局(FDA)とNIH Biomarkers、 Endpoints、 and other Tools (BEST) Resourceによると、バイオマーカーのカテゴリーは以下のように分類される。
- 1)感受性・リスクバイオマーカー
- 2)診断バイオマーカー
- 3)モニタリングバイオマーカー
- 4)予後バイオマーカー
- 5)予測バイオマーカー
- 6)薬力学・反応バイオマーカー
- 7)安全性バイオマーカー[74]
残念ながら、アルツハイマー病分野でこのような明確な分類を提供しようとする試みは、依然として問題がある。例えば、「アミロイド陽性」は診断と予測の両方のバイオマーカーと広く考えられているが、これは個人レベルではそうではないかもしれない[74]。個人の変動性」をターゲットにするためには、最終的には複数の生物学的経路を安価、迅速、かつ高感度に解析することが必要となる。臨床現場での次世代シーケンシングの採用が増加しているのは、コスト削減とハイスループット分析法の導入が最近の原動力となっているからである。
このような状況において、非バイアス全ゲノムシークエンシング(WGS)および全ゲノムシークエンシング(WES)は、特定のアルツハイマー病患者の遺伝的体質のゲノム決定因子を完全に解明することを可能にするため、ゲノム医学の分野における主要なマイルストーンであり、したがって、将来の臨床応用のための最も包括的なツールの一つである[74、 75]。
さらに、近々市販される遺伝子検査、例えば、アルツハイマー病発症リスクを評価するための多遺伝子リスクスコアリングを実施する遺伝子ベースのアッセイは、現在、臨床開発の後期段階にある。特に、ゲノムプロファイルに基づく遺伝的リスクの予測因子によって、多遺伝子リスクスコアリングを介した最大90%の予測精度を達成することができる[76]。
一般的に、個人の健康、環境およびライフスタイル要因への反応、病態生理学/症候群/疾患への感受性、および治療への耐性/反応は、実際には、独自の生物学的(遺伝/ゲノム/分子)プロファイルによって、様々な程度に影響を受けることが認められている。パーソナルゲノミクスの進歩により、一般的な疾患の遺伝的/ゲノム的素因、遺伝性疾患のキャリア状態、一般的な薬剤の副作用などを特定することが可能になった。
パーソナルゲノミクスは、個人がある疾患に罹患する可能性を予測するのに役立ち、可能な限り最善の治療を受けるために薬剤の選択と治療の提供を個別化するのに役立つ可能性があり、したがって、精密医療パラダイムの枠組みの中で、予測医療と個別化医療において重要な役割を果たしている[77]。この点に関して、23andMe Personal Genome Service (PGS) Test ( https://www.23andme.com/en-gb/ で利用可能) は、ヒト成人の検体(唾液)から分離されたゲノムDNAのバリアントを検出するために使用される定性試験管内試験(in vitro)分子診断システムを使用しており、これにより、ライフスタイルの選択や医療専門家との会話の情報を提供するために、疾患を発症する遺伝的リスクに関する情報(すなわち、遺伝的健康リスク(GHR)レポートの配信と解釈)をユーザーに提供することができる。
具体的には、GHR レポートは、遅発性 アルツハイマー病 およびパーキンソン病、および以下の疾患について FDA により承認されている:遺伝性血栓症、α-1 抗トリプシン欠乏症、ゴーシェ病、第 XI 因子欠乏症、セリアック病、G6PD 欠乏症、遺伝性ヘモクロマトーシス、早期発症原発性ジストニア(https://www.accessdata.fda.gov/cdrh_docs/pdf16/DEN160026.pdf で入手可能)。GenomeDx Biosciences Decipher Genomics Resource Information Database(Decipher GRID®)によって生成された遺伝子発現プロファイルに基づき、最近の解析では、通常、乳がん患者の再発リスクを決定するために適用されるゲノムシグネチャPAM50が、前立腺がんにおいても、術後アンドロゲン減少療法(アルツハイマー病T)の早期開始によってどの患者が有利になるかを予測するために使用できることが示され、前立腺がんの治療をカスタマイズするための潜在的な臨床ツールを提供することができる。
このように患者を個別化して選択することで、治療成績が改善され、多くの患者が不必要な毒性のリスクから逃れることができるだろう [78]。
不変の遺伝/ゲノム情報とは異なり、個人のプロテオミクス/ペプチドミクスおよびメタボロミクス/リピドミクスのプロファイルは、時間の経過とともに変化し、変化する可能性がある。図4は、現在利用可能な「オミックス」技術(ゲノミクス、トランスクリプトミクス、miRNomics、プロテオミクス、メタボロミクス)の最新の概要と、それらを用いて異なるシステムバイオマーカーのカテゴリーを分離する方法を示している。
現在、文書化されているバイオマーカー候補の大部分は、ゲノムおよびプロテオミクス分野に由来するものである。これは、他の利用可能な “オーミック “な方法論と比較して、ゲノムおよびプロテオミクスツールを使用することで達成されるシグナルの高い安定性と標準化に起因する可能性がある。さらに、タンパク質と mRNA の安定性が高いことは、プロテオミクスマーカーの発見とバリデーションが、例えばトランスクリプトームアプローチ [79] と比較して、より多くの利用可能性と進歩をもたらしていることを説明することができる。
得られたハイスループットデータを疾患の分子病態生理とその特定の治療との関連で適切に解釈することは、バイオマーカーの発見とバリデーションのプロセスにおける限界的なステップと考えられている。その結果、「オミックス」データセットは、貴重な生物学的情報を提供するために、厳密に識別、抽出、解釈される必要がある[79]。
図4 現在利用可能な技術の概要と、前臨床および臨床研究におけるバイオマーカー探索に使用される生物学的マーカーのカテゴリーの結果
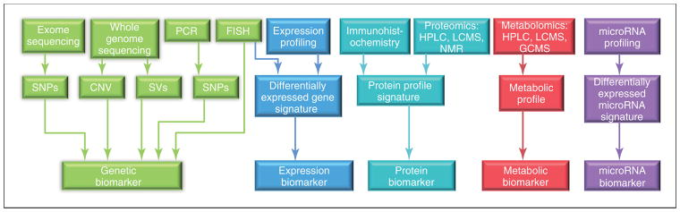
略語。CNV、コピーナンバーバリエーション;FISH、蛍光in situハイブリダイゼーション;GCMS、ガスクロマトグラフィー質量分析;HPLC、高速液体クロマトグラフィー;LCMS、液体クロマトグラフィー質量分析;NMR、核磁気共鳴;PCR、ポリメラーゼ連鎖反応;SNPs、一塩基多型;SVs、構造変異。79]から許可を得て転載。
精密医療の枠組みの中で、認知的に健康な潜在的に前臨床の影響を受けた成人の中で、疑われていない加齢に関連した神経変性疾患を可能な限り早期にスクリーニングして検出することが提案されている。アルツハイマー病に関しては、全身磁気共鳴画像法(WB-MRI)、メタボロミクススクリーニング、心臓の常時モニタリング、血統解析、マイクロバイオーム解析、標準的な臨床検査を組み合わせたWGSをベースとしたこのようなスクリーニングプログラムにより、臨床的なアルツハイマー病発症のリスクがある人を数十年前に発見できるのではないかと仮説が立てられている。しかし、このアプローチに内在する高額な費用と、偽陽性結果と過剰診断の潜在的リスクの両方については、まだ論争がある [80]。
最近になって、プライマリケアで検査された健常者におけるWGSの影響を調査するためのパイロット研究が実施された。いくつかの潜在的な病原性バリアントが同定されたが、キャリアのごく一部が明らかな臨床徴候や症状を示したにすぎず、予想される臨床表現型は病態生理学の進行中に後から発症することが示された。ゲノムシークエンシングやその他のシークエンシング法を日常診療に組み込むことは、間違いなくこれまでにない予防の機会を提供するだろうが、臨床的に意味のある効果の大きさを検出するのに十分な統計的な力を達成するためには、慎重なサンプルサイズの決定が必要であろう[81]。
なぜなら、ハイスループットビッグデータの利用可能性と標準化の増加は、データ科学の進歩に支えられた適切なIDMを通じて、新たなバイオマーカー誘導の標的となる予防と治療の機会を創出することを可能にするからである[20、 21]。したがって、高度なシーケンシング法と病態生理学的疾患状態の「オミックス」ベースのスクリーニングの使用は、個々の患者の特定の疾患状態における非線形ダイナミックな進行する生物学的メカニズムの基礎となる病態生理学的バイオマーカーと分子シグネチャーの正確なパターンを開示することによって、個別化された正確な-予防的および治療的介入の強化につながると期待されている[82]。現在、さまざまな時点でのハイスループットな生物学的データ(例えば、グローバルな遺伝子発現や包括的なプロテオミクスデータ)を用いて、遺伝子-タンパク質リンク、主要な分子経路の機能、タンパク質-タンパク質およびシグナル伝達ネットワークの構成、および組織レベルの応答を解明するための広範な取り組みが行われている[83]。
この文脈では、これまでのところ、我々の理解と、おそらくアルツハイマー病に対する新しい層別化アプローチの開発に対する大きな障害は、前述したように、これまでの研究(単一施設、単一方法の研究)の断片化であることに注意することが重要である。神経科学は非常に生産的であったが、その進歩はまた、やや系統的ではなく、臨床の実践にリモートすることができる。
つまり、これまでのところ、従来の「ビッグデータ」分析技術は、アルツハイマー病の病態生理のメカニズムを(統計的なものだけでなく)理解するために不可欠な質的変化を提供することには失敗しており、それは順番に個別化された治療戦略を策定するのに役立っている。
その第一歩は、上述したように、「ビッグデータ」リポジトリに含まれる何百、何千もの患者からの複雑で高次元の情報を統合することである。しかし、これだけでは十分ではなく、「ビッグデータ」を新しい方法論だけでなく、専門家の知識や目標とする臨床仮説を注入して「スマートデータ」にする必要がある。
これは、単一の国レベルの研究でも、単一の生物医学・技術分野でも、単独でこの問題に取り組むことができないため、大きな分析上の課題となっている。アルツハイマー病における疾患修飾の可能性のある多くの臨床開発プログラムはこれまでのところ失敗しており[84]、それに加えて、研究または最終的には治療において実用的な知識を生み出すことができる新規の既成概念にとらわれない前臨床モデルが切実に必要とされている。
このため、計算と統計的モデリングはアルツハイマー病研究においてますます貴重なものとなっているが、純粋に記述的なデータ分析技術(例えば、特定のデータと表現型の間の関連性を特定する技術)を超えていく必要がある。病原経路の特定の構成要素が複雑な脳ネットワーク内でどのように相互作用しているかを、分子スケールから細胞スケール、システムスケールに渡って明らかにすることができる予測モデルに、数学的に定式化することができる特定のドメインコンピテンシーを注入するための追加の努力が必要である。
このような予測モデルは、可能な限り、神経生物学的プロセスやメカニズムを現実的に表現したものでなければならず、それによって実験との直接比較が可能となり、最終的には、標的制御や介入のための新たな戦略を発見するための道を開くことになる。この点では、データの共有とパスウェイベースの解析に重点を置いた官民パートナーシップの構築も不可欠である。このような統合的なアプローチにより、先進的なシミュレーションの実世界での成功例は、すでにアルツハイマー病の臨床試験への具体的な支援を生み出している。
アルツハイマー病のシステム生物学
アルツハイマー病や神経変性疾患への進行を伴う脳の複雑な蛋白質障害の多因子性は広く認識されている。アルツハイマー病やその他の神経変性疾患の発症に関与している可能性のあるいくつかのメカニズムが同定されているが、アルツハイマー病のような疾患の発症や進行につながる生物学的プロセスの分子的・時間的ダイナミクスは、システムレベルではまだ十分に理解されていない。
アルツハイマー病のような複雑な慢性疾患は、環境因子、遺伝因子、エピジェネティック因子の相互作用に起因すると考えられている。ゲノミクス、エピゲノム、トランスクリプトミクス、プロテオミクス、メタボロミクスなどの最先端の “オミックス “技術は、最終的に神経変性や、予測マーカーや選択的治療法が必要とされる神経学的表現型につながる病態の動態や生物学的性質を解読するための研究ツールとして期待されている。
遺伝学およびゲノム技術の飛躍的な進歩により、先進的なNGS技術により、グローバルなゲノム配列決定が可能となり、手頃な価格で、臨床的にも実用的なものとなってきている。しかし、新しい遺伝学的技術は、蛋白質異常症/神経変性疾患に関与する複雑な病態生理学的経路を理解するための重要な基礎を提供している。
生命の基礎となる複雑なマルチスケールシステム(動的なモジュール化された複合体とネットワークで相互作用する高分子からなる)の概念は、50年以上前に初めて提案されている[85]。過去数十年の間に、我々はさまざまな分子および細胞システムの構造、制御、および機能について詳細な洞察を得てきたが、それらは現在、ビルディングブロックまたは作業部品のインベントリと見なされている。
しかし、今後の主な課題は、これらの単一のエージェントが、異なるシステムレベルと構造的・機能的組織のネットワーク(例えば、DNA-タンパク質;RNA-タンパク質;タンパク質-タンパク質;タンパク質-代謝物ネットワーク、インタラクトミクス)を横断する複数の相互作用によって、どのように相互に関連しているのかを明らかにすることである。偏りのないデータ統合ワークフローに基づいた信頼性の高い全体的なモデルを開発し、複雑な生物学的構造の特性を明らかにすることは、大きな課題となっている。
このような観点から、神経変性疾患研究におけるシステム生物学の主な目標は以下の通りである。2)ゲノム全体の異なるデータセットを多次元的に統合し、分子制御の異なる層、時間スケール、細胞タイプなどを横断して、網羅性と選択性のバランスが最も良く、モデル空間を管理可能な数の優先度の高い検証可能な仮説まで削減し、生物学的に正確な神経変性疾患の包括的なin silicoモデルを生成することである。
これにより、複雑な疾患が多因子摂動によるネットワーク状態の変化[86]の結果としてどのように概念化されるのかがより明確になり、マーカーやターゲットの発見を促進することが期待されている。この理論的枠組みの下では、システムモデリングやシステムバイオロジーによって精査された神経変性疾患プロセスのダイナミクスと生物学をより包括的に理解することができる。
これは、初期の動物研究に続いて臨床コホートプログラムでの確認と検証 [87] からなる2段階のアプローチ、あるいはコホートでの分子研究と臨床研究からなるアプローチ、例えば予測マーカーシグネチャの探索と、そのようなマーカーシグネチャに関連した生物学的および治療的意義のある神経変性疾患の実験モデルでの研究からなるアプローチによって達成することができる。
ヒトにおける多くの疾患状態(蛋白質障害/神経変性疾患、心血管疾患、悪性腫瘍、メタボリックシンドローム、糖尿病を含む)は、単一の線形分子変化の調査だけでは完全かつ適切に捉えることができない、非常に複雑な生物学的性質を持っている。このような疾患は、多因子性疾患であることに加えて、基本的な生理学的経路が正しく機能するために必要な本質的なネットワークの変化によって引き起こされる。
このような疾患プロセスは基本的に非線形の動的なものであり、恒常的な防御機構と障害された生理学的ネットワークとの間で、空間と時間を介して進化する相互作用の結果である[88]。ストレス応答因子の制御下にある細胞生存機構は、それらが作用する病態生理的文脈に応じて細胞死を誘発するものである可能性があるため[89]、分子、細胞、またはシステムレベルで、神経変性疾患プロセスのダイナミクスに関連し、機能を維持し、神経変性疾患に抵抗するための個人の能力を変化させる可能性のある重要な段階を特定することは、臨床的発見と治療法開発、特に精密医療のニーズが高まっているという文脈では不可欠である。
近年、ヒトの疾患がどのようにして変化した分子や細胞のネットワークの中でルーティングされているのかについての理解が大きく前進している。いくつかの遺伝的変化と病態生理学的メカニズム-主にアミロイド前駆体タンパク質(APP)の処理とタウ関連ネットワークが関与する-は、アルツハイマー病の発症において重要な側面であると考えられている[90]。
このようなネットワークの異常は、特定の分子機能の喪失または獲得、および神経毒性分子種の増加した形成(例えば、毒性アミロイドまたはタンパク質の凝集体)を引き起こし、それが細胞上レベルに悪影響を及ぼす可能性がある。
複雑な疾患の概念化において見落としてはならないもう一つの重要な要因は、ホメオスタティックネットワークの重要な役割である。この点で、神経変性に対する回復力因子(オートファジー、プロテオスタシス、エンドリソソームネットワーク、タンパク質フォールディングシャペロンネットワーク、ディスアグリゲート、その他のストレス保護およびクリアランスネットワークなど)の潜在的な保護的役割への関心が現在高まっている[90]。
個人レベルでのアルツハイマー病発症とその臨床表現型につながる原因となる経路は、遺伝的/エピジェネティックな感受性および/または保護と、変化した脳ネットワークと回復力の神経メカニズムの間の継続的なダイナミックな相互作用から構成されていると考えられている。この複雑な相互作用を解明するには、システム生物学に基づく統合的アプローチが不可欠である。
まず、様々な “オミックス “技術を広範囲に適用するために、アルツハイマー病の主な特徴を模倣した単純なモデル生物を開発する必要がある。このアプローチは、アルツハイマー病の発症と進行を調節する保存された経路についてより多くの光を当てるために貴重なデータを提供する可能性があり、最終的には病気の自然経過を遅らせたり、変更したりすることができる潜在的な戦略をテストするために有用である [90]。
しかしながら、遺伝子発現および経路活性の調節は単純なモデル生物とヒトの間で異なる可能性があり、単純なモデル生物とマウスモデルやヒト細胞モデルなどの高次モデル(例えば、神経細胞に誘導された誘導多能性幹細胞や線維芽細胞を直接転換して得られた神経細胞など)を統合的に使用することが必要とされる[91]。
前臨床モデルから得られた新たなエビデンスは、神経イメージングによって可視化できる微妙な初期ネットワークの変化に特に焦点を当てて、適切に再現される必要がある。神経画像とバイオマーカーのデータは、システム生物学に基づいた枠組みの中で、計算と統合的ネットワーク生物学のツールを用いて、縦断的に完全に統合され、解析されるべきである。
アルツハイマー病研究におけるハイスループット技術への傾向が強まるにつれ、多因子データが生成され、標準化され、効率的で、費用対効果が高く、安全な方法での統合が必要となるだろう。膨大な量のデータが生成されることで、データサイエンスに新たな課題が発生することになる。
アルツハイマー病における「ビッグでディープなデータの時代」に突入しているため、生物学的システムの近似モデリングをサポートするために、計算システム生物学的アプローチが継続的に最適化されている[90]。
アルツハイマー病研究における全体的なシステム生物学に基づく研究戦略は、大規模で豊富なデータセットを生成し、異なるデータセットの統合と比較評価のために多層ネットワークアプローチを適用し、新しい疾患マーカーや標的の発見のために生成された情報を再評価することに依存している可能性が高い。
システム理論とシステム生物学の概念の基本的な側面を臨床の場に統合し、実装するためには、前臨床研究からベッドサイドへのトランスレーショナル・アプローチ(リバース・トランスレーショナル・アプローチによって補完される)が、近い将来に必要とされるであろう。これらのアプローチを成功させる鍵となるのは、ロバストなデータ統合手法の使用である。
神経変性疾患やヒトコホートの実験モデルで収集された複雑なデータセットをシステムレベルで分析・統合するための手法は数多く存在する[100、 101]。シグナルのスペクトル分解[102]や重み付き遺伝子共発現ネットワーク解析[103]、ベイズ因果推論[104]などのグラフ理論(ネットワークアプローチ)に基づく手法や、形式的概念解析[105]や木推論[106、107]に基づく手法は、臨床利用の可能性のある生物学的ルール、疾患ターゲット、リスク因子を正確に選択する包括的なin silicoモデルを生成するための大きな可能性を秘めている可能性が高い。
アルツハイマー病コホートにおけるシステムバイオロジーの応用。欧州アルツハイマー型認知症予防(EPAD病)コンソーシアムの例
システムバイオロジーを臨床・研究の現場に導入するためには、いくつかのステップを踏む必要がある。第一に、個人や患者を臨床試験や標的治療にマッチングさせるための分子検査やバイオマーカ ーの開発には、ハイスループット技術、システムレベルのアプローチ、計算ツールの継続的な改良と検証が必要である。第二に、アルツハイマー病のために使用されるすべての分子検査、およびすべての患者ケア関連の分子分析は、再現性が高く、正確で、米国食品医薬品局(FDA)の臨床試験ガイドラインを満たし、臨床試験の適正実施(GCP)(http://www.fda.gov/regulatoryinformation/guidances/ucm122046.htm)、欧州医薬品庁(EMA)(http://www.ema.europa.eu/ema/)、欧州臨床試験データベース(EudraCT)(https://eudract.ema.europa.eu/)の原則を遵守したアッセイを使用して実施される必要がある。
このシナリオでは、Alzheimer’s disease neuroimaging initiative (アルツハイマー病NI)とDominantly Inherited Alzheimer Network (DIAN)が、アルツハイマー病関連の常染色体優性突然変異キャリアに関する大規模な縦断的データを共同で提供することになる。第三に、ビッグでディープなデータが生成され、包括的なリポジトリが利用可能になった時代は、データとメタデータの両方のコラボレーション、共有、統合、正規化、分析の必要性をもたらし、この新しい知識を効果的にトランスレーショナルに利用することを最終目標としている。
このようなシナリオの中で、いくつかの臨床試験が、システムバイオロジーが提供する全体的なアプ ローチから恩恵を受ける可能性がある。その中でも、欧州アルツハイマー型認知症予防プログラム(European Prevention of Alzheimer’s Dementia: EPAD病)への関心が高まっている。
EPAD病プログラム[108]は汎欧州的なイニシアチブであり、特にアルツハイマー病の二次予防のための新しい治療法を開発することを目的とした第2相概念実証(PoC)臨床試験を設計し、実施するための共有プラットフォームを確立する予定である。
アルツハイマー病発症前の集団における異なる薬剤を最も効率的に調査するために、試験の進行に伴って得られるデータから学習するベイズ適応設計が使用される。最近完了した第3相アルツハイマー病治療試験の明らかに期待外れの結果は、その探索的(確認的ではなく)な性質によって説明できるかもしれないが、これはほとんどが第2相試験中の不完全な探索フェーズによって引き起こされている[109]。
願わくば、EPAD病プログラムは、正しく設計された第2相試験が完了するまでに数年かかることを前提とすることで、この分野における以前の落とし穴を克服するのに役立つだろう。EPAD病 Longitudinal Cohort Study(LCS)(https://clinicaltrials.gov/ct2/show/NCT02804789)では、以下のような他の共通の問題にも取り組んでいる。
1)スクリーニングの不合格率が高いこと、
2)適切な患者層別化を実施したくない、あるいは実施できないこと、
3)無作為化前のランイン期間がないこと、
などである。EPAD病 LCSは、臨床試験の最終実施に先立ち、アルツハイマー病の前臨床期および前駆期の信頼性の高い疾患モデルを提供することが期待されている。EPAD病 LCSは、認知[110、 111]、神経画像、脳脊髄液コアバイオマーカー(Aβ42、総タウ[t-tau]、高リン酸化タウ[p-tau])、臨床転帰、遺伝子タイピングの観点から徹底的な評価を受けた5、000人の大規模コホートを対象に実施される。
試験への組み入れのための最適な層別化を提供するために、異なる疾患の軌跡を特定することを目標に、毎年の評価を実施する。類似の生物学的基盤を持つリスク層別化グループは、精密医療パラダイムに従って臨床試験に組み入れられる(または除外される)被験者の特定のクラスを特定するのに役立つであろう。
欧州の試験実施センター全体での EPAD病 治験実施施設ネットワークの構築は、この取り組みの成功に不可欠である。治験施設の認定、継続的なトレーニング、EPAD病プログラムへの取り組みは、治験施設の不均一性を減らし、治療効果の精度の高い推定値を提供することが期待されている。
各TDCは約200人の研究参加者を評価し、そのうち100人が臨床試験に参加することになる。これまでの臨床試験では、多数のセンター(最大200人)が関与しており、それぞれのセンターには一握りの患者しか登録されていなかったため、この取り組みは前例がない。逆に、EPAD病では、少数の施設が多数の患者を登録するという点で、従来の方法論が覆されることになる。
一般的に、第3相試験の予備試験を正しく実施するには、第2相試験の結果がより強固なものであることが必要である。EPAD病プログラムは試験方法を改善し、最終的には第3相確認試験に着手する前に、最適な疾患モデル化とより良い患者層別化が可能となる。
EPAD病 LCSは2016年5月に6施設で開始され、すでに合計400名の参加者が募集されている。500人の登録目標が達成され次第、疾患モデル化作業が導入される予定である。EPAD病 PoC Study Platform試験は2018年に開始されると予想されている。
アルツハイマー病のシステム神経生理学。神経生理学と神経運動学を理解する
過去20年の間に、神経科学の分野は急速に拡大し、代謝経路から光学イメージング、機能的磁気共鳴イメージング(fMRI)まで、幅広いモダリティから得られる神経データの記録を可能にする多くの方法論が開発されたことを特徴としている。
これらのデータは、異なる時空間領域を介して収集される(図5)。これらの技術のほとんどは、これまでのところ一度に一つずつ使用されてきた[112、 113]。最近では,複数のレベルの組織(ニューロン,回路,システム,脳全体)を横断した包括的なマップを作成し,ダイナミックなパターンを記録するために,生物学の異なる領域やデータタイプ(解剖学的,機能的接続性,遺伝的/ゲノムパターンなど)を含むデータを統合しようとする試みが行われている[112、 114].
この取り組みは、大規模な神経生物学的システムのいくつかの要素間の相互接続の複雑なウェブの役割を理解するために、マルチモーダルな方法で記録された「ビッグニューロサイエンスデータ」を統合することを目的としたシステム神経生理学の新しいパラダイムと一致している[115-118]。
システム神経生理学の究極の目標は、信号が大脳新皮質ネットワーク内でどのように表現されているのか、また、多数の不均質なニューロン構成要素が果たす特定の役割を明らかにすることである。
ネットワーク神経科学の新しい学際的な分野は、明示的に統合的な視点から脳の構造と機能にアプローチすることで、これらの永続的な課題を克服することを提案している[112]。ここでは、アルツハイマー病における精密医療パラダイムのより広い文脈の中で、システム神経生理学によって利用される単一の方法論に関連する科学的進歩を提示する。
図5
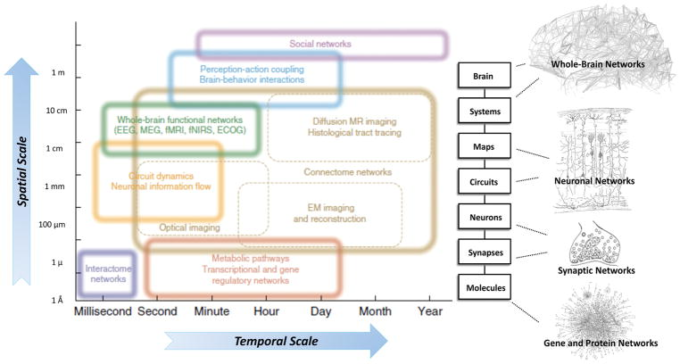
システム神経生理学とネットワーク神経科学:神経系内の構造レベルがどのように複数の空間的・時間的スケールで統合されるかを模式的に示す
ネットワーク神経科学は、多くの空間的・時間的スケールで遭遇する非常に異なるネットワークの研究を網羅しているが、ネットワークの考え方は、ニューロン回路や集団、個々のニューロンやシナプス、さらには遺伝的制御ネットワークやタンパク質相互作用ネットワークのレベルにまで明らかに広がっている。
ネットワーク神経科学とシステム神経生理学の一般的な目的は、遺伝子と生体分子の関係にコード化された情報を、時間次元から提供される付加的な情報を統合しながら、ニューロン間で共有される情報に脳レベルで橋渡しすることである。これにより、最終的には脳の構造と機能の両方を忠実に再現し、おそらく予測するような機械論的な理解とモデルにアクセスできるようになる。
興味深いことに、単一脳レベル以上の社会ネットワークレベルは、ネットワーク神経科学の領域であると考えられるべきであり、測定技術は異なるものの、相互作用する脳が生み出すより大きな「脳」(すなわち、経済や文化)を理解することを目的として、同じパラダイムを用いて研究することができる。112]と[609]からの引用。
このような取り組みにおいて、ますます重要な統合的要素となっているのが、解剖学的および機能的な脳の接続性の研究からなる脳ネットワークの新興科学であるコネクノミクスである。コネクトミクスの台頭により、米国国立衛生研究所が資金を提供しているHuman Connectomeプロジェクト[119]をはじめとする、大規模な対象者を対象とした脳の接続パターンのマッピングを目的とした国内および国際的なコンソーシアムが発足した。
これらのプロジェクトは、データ共有、ニューロインフォマティクス、計算解析の限界を押し広げてきた。同様のコネク トノミクスの取り組みは、生涯発達の追跡 [120] だけでなく、神経変性疾患患者を含む患者集団への取り組みも進行中である。膨大な量のコネクトームデータに対処するために、この分野では脳データに適用できる基本的なネットワーク科学ツールと方法論の開発が進められている[121]。
これまでのところ、広範な探索的解析により、モジュール化された組織や顕著なハブ領域の存在など、脳の接続性のマクロおよびメゾスケールマップを支える多くのアーキテクチャ原理が明らかにされている。
ヒトの脳機能や病態生理学的プロセスにおけるコネクトームアーキテクチャの役割については、まだ多くのことが解明されていない。システム神経生理学とコネクノミクスや計算ネットワークモデルを組み合わせることで、脳ネットワークの構造とダイナミクスの関係を明らかにすることができると期待されている。
構造磁気共鳴画像法(MRI)の貢献と役割
磁気共鳴画像法(MRI)は、広く、非侵襲的で、比較的安価で汎用性の高い技術である。MRIモダリティの中では、3次元T1強調シーケンスを用いた構造的または解剖学的MRIが最も広く使用されており[122、 123]、検証済みである[124、 125]。構造的MRIでは、神経変性、特に神経細胞および樹状突起の喪失の巨視的な相関関係である萎縮の視覚化および測定が可能である。
アルツハイマー病における萎縮の進行は、死後のアルツハイマー病症例で発見され、Braakら[126]とDelacourteら[127]によって記述された神経原線維のもつれとほぼ同じである。
さらに、以前の研究では、構造的MRIの変化がBraakのステージによって記述されているようなタウ沈着、および脳脊髄液のタウバイオマーカーと相関していることが示された[128]。逆に、すべての構造的MRI測定がβアミロイド沈着の測定とよく相関しているわけではなく、萎縮のパターンはアミロイド沈着のパターンには追従していない[129、130]。
これらの理由により、アルツハイマー病における脳萎縮は脳の構造的変化を記述するものであるが、根本的なアルツハイマー病の病態生理には特異的ではないことに注意すべきである。
実際、与えられた萎縮パターンは、異なる病態生理学的プロセスに関連付けることができる。しかしながら、MRIによる萎縮の測定は認知機能および臨床機能[131、 132]とよく相関しており、臨床的低下の同時進行率[133-135]と非常に相関している。したがって、疾患の進行を追跡し、治療効果をモニターするための魅力的なツールとなっている。
自動画像解析アプローチは、関心領域測定、灰白質のボクセルベースのマップ、または皮質の厚さ測定のいずれかを使用して、脳全体に分布する萎縮のパターンを測定することを可能にする [136、 137]。全脳萎縮マップに適用される機械学習アルゴリズムは、アルツハイマー病患者を自動的に識別し、それによって診断をサポートすることができる[138-141]。
アルツハイマー病の最も広く研究され、受け入れられている構造的MRIマーカーは内側側頭葉の萎縮である[142、 143]。内側頭葉萎縮の評価は、視覚的尺度を用いて臨床ルーチンで行うことができる[144]。しかし、このようなアプローチは観察者に依存しており、半定量的なものにすぎない。
一方、完全に自動化されたセグメンテーションアプローチは、海馬萎縮の客観的、定量的、体積測定を提供する [145-149]。海馬体積測定は、高い感度と特異度でアルツハイマー病患者と対照群を識別することができる[150]。
さらに、海馬萎縮が高い患者は急速な認知機能低下のリスクが高いことが多くの研究で示されている[151-155]。しかし、海馬の萎縮は他のタイプの認知症でも認められており、アルツハイマー病の同定に対するこのマーカーの特異性が低いことを示唆している[156、 157]。
最近の超高磁場MRI(7テスラ以上)の開発により、これまでにないレベルの詳細な解剖学的変化の研究が可能になった。特に、7T MRIを用いて、海馬内の異なる細胞層と解剖学的小領域を区別することが可能である。アルツハイマー病におけるその応用は、海馬の小領域と層が萎縮によって異なる影響を受けることを実証している[158、 159]。これらの高度な技術は、グローバルな海馬体積測定よりも感度の高い測定を提供する可能性を持っている。
大脳皮質に流出するコリン作動性核の大部分を持つ領域を表すので、アルツハイマー病のために関心のあるもう一つの領域は、大脳基底前脳コリン作動性系(BFCS)である[160、 161]。BFCS核の測定は、前臨床段階から臨床アルツハイマー病段階までの萎縮変化率の自動構造MRI評価に関連性の高いロバストな領域として開発され、妥当性が確認されている[160、 162-167]。
証拠は、BFCSが前臨床段階では早くも、中側頭葉構造よりも先に退化する可能性があることを示している[163、 168]。海馬体積とは対照的に、BFCSの萎縮は、アルツハイマー病や非認知症高齢者において生体内試験(in vivo)脳アミロイド負荷と有意に相関していた[169、 170]。
全脳萎縮パターンに基づく機械学習アプローチは、患者の進化、特に軽度認知障害(MCI)を有する個人の認知症への進行を予測するために開発されてきた[171-173]。それにもかかわらず、これらのアプローチのほとんどは単一の研究データセットで検証されており、その多くはアルツハイマー病NIによって提供されている。したがって、データセットを横断して一般化する能力や、臨床ルーチンの文脈でのパフォーマンスは不明のままであり、より大規模な検証研究が必要である。
進行を追跡する能力があるため、構造的MRIは治療の効果をモニターするのにも魅力的である [29]。すべてのアウトカム指標(臨床、認知、流体バイオマーカーを含む)の中で、構造的MRIの測定精度は最も高いようである[135]。したがって、臨床試験のための魅力的なアウトカム指標であると同時に、臨床における治療効果をモニターするための指標でもある。治療の種類によって、萎縮度の測定値に異なる効果が得られるようであることに注意すべきである。
無作為化プラセボ対照試験では、アセチルコリンエステラーゼ阻害薬であるドネペジルを投与された患者は、プラセボを投与された患者と比較して、年間の海馬の萎縮と皮質厚の割合が有意に低かった[174、 175]。さらに、治療群では、プラセボを投与されたMCI患者と比較して、BFCSの年間萎縮率が有意に低下したことが示された[176]。BFCSは、アルツハイマー病の構造的な進行を評価する上で海馬の体積測定を補完し、臨床試験のための有望なアウトカム指標を提供している[161] 、
しかしながら、抗アミロイド療法は萎縮率の増加をもたらすようである[177]。それにもかかわらず、このような加速された萎縮は治療開始時にのみ起こり、おそらくプラークに関連するミクログリア活性化の低下によって引き起こされ、萎縮の減少が長期的に起こるのではないかという仮説が立てられている。
全体として、構造的MRIは治療の形態学的効果を研究するための魅力的なツールであり続け、特にアルツハイマー病の病態生理の他の側面を標的とした新しい分子(例えば、抗タウ剤や神経保護治療)が利用可能になった場合には、利用可能である。さらに、構造的MRIは、治療の安全性をモニタリングする上で重要な役割を果たしている。実際、微小出血および一過性脳浮腫(それぞれARIAHおよびARIAEと呼ばれる)は、積極的なAβ免疫療法を受けた一部の患者で発生している[178]。
まとめると、構造的MRIは治療介入を調整するための魅力的なマーカーである。その最も魅力的な特徴は、認知機能の低下を正確に追跡できること、治療効果を単離できること、患者の経過を予測できることである。予測のための最も有望な手段は、全脳測定からの機械学習アプローチである。このようなアプローチでは、複数の臨床ルーチンコホートを用いた大規模な検証が必要である。
機能的MRI、脳波(EEG)、脳磁図(MEG)、拡散テンソルイメージング(DTI)などの他の技術と構造的MRI解析ツールをマルチモーダルに統合することで、アルツハイマー病に関連する多数の病理学的変化と神経生物学的システムの間の時間的・地形的関係を調査することが可能になる。このようなビッグデータの統合は、精密医療コンセプトで想定されているように、アルツハイマー病を特徴づける脳関連システム全体の生体内試験(in vivo)での相互作用する病態生理学的メカニズムの理解を向上させることになる。
DIFFUSION TENSOR IMAGING(DTI)の貢献と役割
拡散テンソルイメージング(DTI)は、事実上の制限された細胞環境における水分子のネット変位によるMR信号の減衰をモデル化するためにガウス近似を採用している。この手法は、白質マイクロアーキテクチャ、連結性だけでなく、調査と臨床の両方の設定で完全性を調べるための主流の戦略となっており、それは広く、アルツハイマー病、MCI [179-181]だけでなく、いくつかの他の病理学[182-185]に焦点を当てた研究で採用されている。
見かけの水拡散テンソル(細胞内の水の拡散が真に自由ではないため、正確には見かけと呼ばれている)は、比較的高速なエコー平面画像法(EPI)[186]に基づいて脳実質で推定することができ、それはスキャナ内の被験者の時間の面で中程度の需要をもたらすだけである。これらのテンソル推定値から、決定論的(主なDT固有ベクトルの配向に基づく)または確率論的アプローチによって、白質トラクト固有の配向情報を得ることができる[187]。また、モデルフリーのトラクトグラフィアプローチも存在し、その中でも有望な開発が制約付き球面デコンボリューション[188-191]であり、最近では解剖学的なフィルタリング[188、189]に基づいたマルチ組織モデルを組み込むように拡張されている(図6)。
さらに、拡散テンソルから得られるスカラー指標は回転不変であり、特異的ではないにせよ、微細構造の変化の敏感な指標であることがよく知られている。単一テンソルの固有値だけでなく、平均拡散率(MD ・固有値の平均)とフラクショナル異方性(FA ・固有値の正規化された分散[192])は、関心領域(ROI)、ボクセルまたはトラクトベースの空間統計学に基づいたアプローチ[180]を介して繊維の完全性を定量化するのに役立つことができる。
FAの減少(おそらくMDまたは他の方向性の拡散性の増加を伴う)は、典型的には、アルツハイマー病およびMCI [193、 194]で見られるように、非特異的バンドル変性の特徴である。重要なことに、白質(WM)におけるDTI由来の指標とアルツハイマー病疾患の重症度との間の相関関係が報告されている[195、 196]が、DTI測定が疾患進行の指標として使用される可能性があることを示唆している。
したがって、DTIは、アルツハイマー病患者とMCI被験者におけるWMの完全性についてのユニークな情報を提供するかもしれない[66]。実際、いくつかの研究では、MCIの段階ですでに傍海馬、海馬、後帯状体、および脾臓内の初期のWMの変化が示されている[197-200]。
しかし、DTI研究の大部分は、MCIとアルツハイマー病の両方で、uncinate fasciculus、全体の冠状体と帯状体路が最も病因に関与していることを示している。アルツハイマー病とMCI被験者の最近の研究では[201] MCIグループのFAの選択的増加の解釈は、導入テンソルモード(MO)[202]、異方性のタイプを区別する第三の不変量によって助けられた(平面、例えば、1つの優勢な配向を示す領域では、線形対交差またはキス繊維の領域では、)。
これにより、アルツハイマー病に退化する前の早期MCI被験者において、上縦筋膜の関連線維を横断する運動関連突起線維が相対的に保存されていることが検出された。また、最近のDTIデータは、加齢とともに広がるアルツハイマー病の進行性白質変性の軌跡の再構成を示唆しているように思われる。このいわゆるレトロジェネシスモデル(幼児期に最も早く成熟する皮質領域は、アルツハイマー病では最後に退化する傾向がある)と一致して、前頭前野白質、下縦筋群、後頭頂部領域[180、 197、 203、 204]のような特定の脳領域の白質異常がより早く現れることが示されている。
また、DTIは、主観的認知機能低下のような無症候性の「前臨床」のリスク段階への洞察を提供することができ、拡散特性のDTIベースのスカラーマーカーは認知機能低下と海馬萎縮の割合と有意に関連しており、オッズ比は最大3までであり[205]、DTI指標の不変量は、主観的認知機能低下とMCI被験者の認知機能低下と内側側頭筋萎縮の予測において、脳脊髄液バイオマーカーよりも感度が高いことが確認されている[205]。
図6
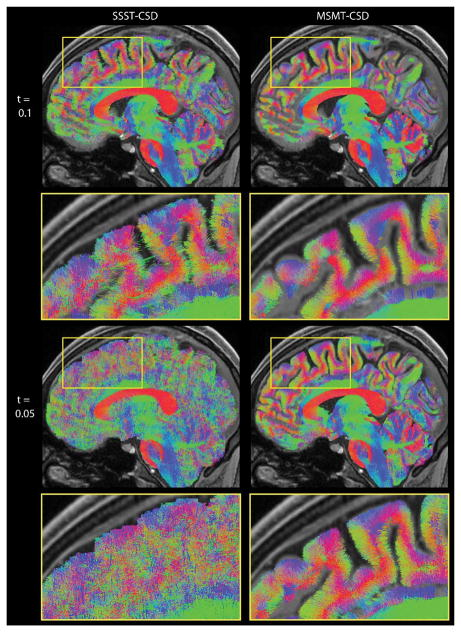
異なるfODF振幅しきい値を持つSSST-CSD(左)とMSMT-CSD(右)を用いて推定されたWM fODFから得られた繊維トラクトグラムの矢状平板可視化(上、下)。
略語:fODF、繊維配向分布関数、MSMT-CSD、マルチシェル、マルチ組織拘束球面デコンボリューション、SSST-CSD、最先端のシングルシェル、シングル組織拘束球面デコンボリューション、WM、白質。188]から許可を得て転載。
それにもかかわらず、最近のメタ分析では、研究された領域の解剖学とDTI由来のメトリクスの両方で高いばらつきがあることが示されている[206] ・DTI技術の本質的な限界がその一因である可能性がある。多施設でのDTIのための最もロバストな取得パラメータと処理戦略の決定はまだ活発な研究分野であり、初期の臨床と物理的ファントムデータ、すなわち、定義された拡散特性を持つ物理的な物体と同様にボランティアから得られたスキャンは、MRIスキャナの範囲にわたるDTIベースの拡散メトリクスの変動が体積測定のそれよりも少なくとも50%高いことを示唆している[207]。
MCIからアルツハイマー病認知症への転化を予測するために、単施設研究ではDTIは2~3年後のフォローアップで約77~95%の精度に達している[205、 208、 209]が、多施設研究での予測精度についてはまだ研究が必要である。
また、すべての拡散加重イメージングプロトコルは、必ずしも高速なEPI技術に内在する比較的低いS/N比に悩まされている。この点では、超高磁場イメージング(例えば7T)に移行することによって得られる信号対雑音比の増加は、磁場強度の増加に伴う横方向(T2)緩和時間の急速な短縮とその結果としての信号損失によって幾分打ち消されている。
それにもかかわらず、超高磁場拡散加重イメージングには大きな課題があるが、エコー時間の大幅な短縮(約30%)を可能にするモノポーラ収集スキームと組み合わせた改良された歪み補正技術[210]や、同時マルチスライス励起戦略[211]の追加的な使用により、生体内試験(in vivo)での拡散加重イメージングは、最終的に超高磁場でのサブミリメートルイメージングに向けて前進することができるかもしれない。
したがって、ex-vivoでの研究では、すでに11.4T [212]で老化やアルツハイマー病の白質病変を定義しており、7Tイメージングはパーキンソン病[213]と筋萎縮性側索硬化症[214]を識別するのに役立っていた。最後に、それはガウス伝搬器(DTIの根幹にある)の仮定は、そのような混合組織の種類および/またはキスまたは交差繊維[215]などのより複雑な繊維アーキテクチャを持つ領域では不十分であることがよく知られている。
この目的のために、拡散スペクトルイメージング[216]、拡散カルトーシスイメージング[217-221]、高次テンソルモデル[222]、コンパートメントモデル[223-225]、異常拡散[226、227]などのより高度なプロトコルは、臨床現場での適合性を高めるために最適化することができる[228]が、アルツハイマー病を含むいくつかの神経変性疾患における組織の変性に関する情報を補強するためにすでに成功裏に採用されている[229-232]。
DTIに基づく方法論のもう一つの手段は、構造的ネットワークやグラフとして要約できる解剖学的接続の脳全体のマップの構築とその後の分析である[115]。基本的には、まず脳を内部的に首尾一貫した灰白質の区画や領域(ネットワークのノード)に分割し、これらのノード間の解剖学的投影の強さ(ネットワークのエッジ)を推定することによって、これらの作業を進めていく。
このようなマップの再構成には方法論的な問題があるが、結果として得られる構造ネットワークは、ヒト以外の種では古典的な組織学的手法と比較して検証されている。ヒトの構造ネットワークは、遺伝学 [233] や認知能力の指標 [234] を含む様々な表現型変数に関連した個人差を捉えている。
また、構造ネットワークは、寿命 [120]、正常な加齢 [235]、脳障害 [236] の過程においても特徴的な変化を示す。例えば、アルツハイマー病の進行に伴う連結性の喪失は、機能的に関連する領域の密なクラスター間のリンクの喪失をもたらし、その結果、統合のための能力が低下する [237、 238]。
機能性磁気共鳴画像法(fMRI)の貢献と役割
精密医療ベースのパラダイムでfMRIを用いて患者の治療法を調整することは、現在の方法から患者のための治療法を開発するための非常に革新的なアプローチであると考えられる。患者の診断と分類は臨床的基準に基づいて行われ,患者はあらかじめ決められた基準に基づいて分類される.精密医療パラダイムの実装では、他のモダリティと組み合わせて、患者の表現型を定義するための一部となる脳機能変化のバイオマーカーとしてfMRIを使用する。したがって,システム神経生理学的な観点からfMRIをベースとしたバイオマーカーを統合し,患者の状態を統合的に把握することができるようになるだろう[21].
システム神経生理学的アプローチの中でのバイオマーカーは患者が受ける治療アプローチに情報を与えることになる。アルツハイマー病やその他の神経変性疾患の複雑性を考慮すると,fMRIに基づくバイオマーカーは,システム生物学と神経生理学的アプローチの中で,他のモダリティ(遺伝学,臨床,行動学,認知学など)と統合され,異なるバイオマーカーが疾患メカニズム,病態生理学,臨床病歴を反映し,患者を治療のための層別化することが可能となる[20、 21].
fMRIは刺激や認知課題による局所的な神経細胞の活性化に対する血管反応を測定するために用いることができる[239]。1つは刺激や認知パラダイムに応じた脳の活性化データを調べるものであり,もう1つは安静時のfMRIを用いて測定された内在的な接続ネットワークを調べるものである.
前者のアプローチでは、認知パラダイムや刺激クラスに関連したバイオマーカーが得られるのに対し、内在的接続性ネットワークを調べることで、すべての脳ネットワークを網羅したバイオマーカーの探索が可能となる。
テーラーリング治療法を用いた精密医療アプローチの観点からは、認知的課題や刺激の使用は、特定のネットワークに対する「ストレステスト」の一形態となるだろう。例えば、前臨床および臨床アルツハイマー病のリスク段階にある無症状の場合、記憶課題は通常、海馬、腹側および背側前頭前野領域、後帯状体領域[240-249]を活性化し、ワーキングメモリ課題は主に背側および腹側前頭前野領域と下および上頭頂部領域[250-255]を活性化する。
認知パラダイムアプローチの限界は、患者がタスクを実行することができなければならないということであり、タスクのパフォーマンスの変動性は、活性化パターンを変更するだろう[256-261]。アルツハイマー病における代替的なアプローチは、視覚知覚、注意課題や受動的刺激など、個人がまだ実行できるかもしれない記憶領域外の認知パラダイムを実装することであろう[262-273]。
このアプローチを用いて発見された変化は、臨床的にはより進行している可能性のある患者にも適用可能であるが、疾患に関連した神経病理のパターンの「下流」の効果を測定するためのアプローチも提供する。現在の研究では、患者と健康な対照群、あるいは異なるリスク群間の違いを、臨床的に記述された表現型や遺伝学や家族歴に基づくリスク群によって定義された群間の平均的な差を定量化することによって検討している。
提案されている精密医療パラダイムでは、データに基づいた表現型を定義するために被験者間のばらつきを調査し、必ずしも基礎となる病態生理や臨床表現型を反映していない可能性のある表現型を定義することになる。
健常状態からMCI、軽度アルツハイマー病段階までの脳の活性化には有意な変動があるという証拠がある。例えば、顔名連想パラダイムを用いた場合、MCI被験者は健常対照者やアルツハイマー病認知症患者と比較して海馬の活性化が高く、非線形反応があった [242、 249、 274]。同様に、視覚知覚課題でも、背側視覚経路に沿って活性化レベルが変化し、疾患の重症度の増加に伴って変化した [262]。
脳機能の測定に加えて、上記のバイオマーカーと潜在的な治療薬の作用機序のfMRI研究の結果を統合する必要がある ・ほとんどの研究では、MCI被験者または軽度のアルツハイマー病患者を対象に、コリン作動性薬物の治療期間の延長を検討している(例えば[273、 275-278]参照)。
精密医療パラダイム内で使用されるもう一つの可能性のあるアプローチは、単回投与の効果を測定し[279-282]、バイオマーカーで特徴づけられた患者に対する治療戦略の有効性に対する単回投与の予測力を調査することである。単回投与法は,どのような治療法であっても,中長期的な効果が得られる可能性のある情報を提供することで,治療介入の調整に役立つ可能性を秘めている.
上述した様々なfMRIに基づくパラダイムは、特定の脳ネットワークまたは脳領域に関する情報を提供し、データ駆動型のアプローチは、タスク中に活性化された脳ネットワークまたは領域からのデータに限定されるだろう。別の方法としては,全脳安静時fMRIを用いて安静時ネットワークや内在性接続ネットワーク(ICN)を測定することが考えられる[283-286].これらのICNは個人間で再現性が高く[287]、特徴的な動的変動を示し[288]、発達、寿命、脳障害の経過に伴う変化パターンを示すことが示されている[236]。
ICNのトポグラフィは、遺伝子の共発現[294、 295]、疾患表現型および疾患進行[246、 296-303]、脳活性化レベルおよび認知パフォーマンス[293、 304-306]に由来する、ヒトの行動および認知の間に関与するネットワーク(例えば[289-293]参照)などの他のネットワークに類似している。
ICNネットワークの構造は、様々なネットワークツールを用いてプローブすることができ、その内部コヒーレンスと相互作用の個人差を明らかにすることができる。これらの高度な解析と組み合わせることで、ICNは、病態生理の結果としてどのICNが特別に障害されているかの洞察を含む、脳機能の豊富なバイオマーカーのセットを提供する可能性があり、患者内のシステム全体の変化についてのより統合的な視点を得ることができる。
治療法の調整は、バイオマーカーと疾患の病態生理の存在との関連性から恩恵を受けることができる。アルツハイマー病患者とMCI被験者に存在する変動性を考えると、ICNベースのバイオマーカーと遺伝子プロファイルとの関係 [68] は、脳機能の改善されたシステム生物学的特徴付けを提供することができるかもしれない。
治療法を調整するためのICNの使用にはまだかなりの開発作業が必要であり、ICNに対するアルツハイマー病関連薬の効果に関する研究は現在のところ限られたものしかない[307]。安静時fMRIはタスクフリーであるため,臨床コホートへの応用に適しているが,運動アーチファクトに対する感度やICNのネットワーク構造の継続的な時間的変動は,スキャン長が長くなるほど再現性が高くなることに留意すべきである(例えば,[308]を参照).
fMRIは、アルツハイマー病患者の治療薬の精密医療指向のターゲティングを支援する可能性があるが、非常に重要な開発が必要である。遺伝学,認知,臨床的測定などの他の領域とのfMRIの統合は,これまでのところ,ほとんどが集団解析の中で試みられてきたものであり,精密医療パラダイムでは,個人ベースで治療戦略の可能性を定義するための新しい統計モデルの開発が必要である[309].
電気脳生理学(EEG)の貢献と役割
アルツハイマー病の候補となるトポグラフィ神経生理学的(神経力学的)バイオマーカーは、心が自由にさまよっている静かな覚醒状態(目を閉じたまま、睡眠なし)でリラックスした状態で記録された安静状態の目を閉じた脳波(rsEEG)リズムから導き出すことができる[310]。これらのrsEEGマーカーは非侵襲的で、費用対効果が高く、世界中で入手可能であり、重度の認知症でも再現性がある。
これらの指標は、脳の予備能の次元の一つとして、アルツハイマー病患者の神経生理学的な「予備能」を探ることができるかもしれない[311]。この神経生理学的な “予備 “は、1)与えられた皮質領域における神経活動の “同期化 “と2)機能的な皮質 “接続性 “の兆候として与えられた脳神経ネットワークのノード間の活動のカップリングのための残留メカニズムを反映している可能性がある[310、 312]。
グループレベルでのアルツハイマー病におけるRsEEGマーカーは、時間の経過とともに、コリン作動薬治療後の疾患の神経生理学的予備軍を反映している。
同期化」マーカーを用いた以前のrsEEG研究では、健常高齢者(Nold)群と比較して、認知症のADD群(ADD)は後皮質α(8-12 Hz)およびβ(13-30 Hz)リズムにおいて低いパワー密度を示すことが示された [313-319]。また、広汎なデルタ(<4Hz)リズムとシータ(4-7Hz)リズムでも高いパワー密度を示した[320-325]。最後に、ADD、パーキンソン病による認知症(PDD)、レビー小体型認知症(DLB)群では、後α源活動が異常に低いことが特徴であった[326]。その影響はADDでは劇的で、DLBでは顕著で、PDDでは中等度であった[326]。また、後頭部デルタ線源活動は異常に高く、PDD群では劇的な影響があり、DLB群では顕著で、ADD群では中等度であった[326]。
接続性」マーカーに関しては、ADD群では、後電極対間のαおよびβ(13-20Hz)リズムのスペクトルコヒーレンスが異常に低いことが特徴であった [316、 327-339]。これらの影響は、いくつかの研究[316、 327、 333、 337]では側頭-後頭電極対で、また、他の研究[329、 332、 340]では前頭電極対で観察された。他の研究では、ADD群の電極ペア間のデルタとシータのコヒーレンスが全体的に減少[327、 334]または増加[337、 341]していることが報告されている。別の研究では、コヒーレンスの増加と減少の複雑な地形的パターンを指摘している[342]。接続性」の代替技術は、ADDと健忘性MCIの前頭頂部αリズムにおける電極ペア間の同期性の低下を明らかにした[319、 343]。最後に、グラフ理論の指標によって明らかにされたように、ADD群では皮質の接続性の低下と「小世界性」が認められた[344-347]。
RsEEGのリズムは時間の経過とともに悪化する(例えば aMCI被験者とADD患者のグループでは、時間の経過とともにRsEEGのリズムが悪化する(例えば、約12-24ヵ月)(レビュー[348]を参照)。1) 頭頂後頭側電極におけるδ-θの増加とα-βのパワー密度の増加[349]、2) 頭頂後頭側電極および側頭後頭側電極におけるδ-θの増加、β-βのパワー密度の減少、および平均周波数の低下[316、 350、 351]、3) 頭頂後頭側ソースにおけるδの増加とα1の増加[352、 353]、および4) グラフ理論的指標[347]によって明らかにされた皮質結合性の低下である。
ADD患者のグループにおいて、アセチルコリンエステラーゼ阻害薬(すなわちコリン作動性緊張を増強する)は、デルタ [320、 354-356]、シータ [321、 356、 357]、およびアルファリズム [355、 358]において有益または保護的な効果を示した。短期的に観察された場合、これらの効果は長期的な治療効果を予測した[357、 359、 360](レビューは[352]を参照)。しかし、いくつかの矛盾した所見は、今後のより対照的なクロスバリデーション研究を示唆している[361、 362]。
ADD患者における後皮質デルタリズムの異常は、静かな覚醒時におけるその発生メカニズムのアップレギュレーションを反映している可能性があり、おそらく同じ領域における皮質血流低下とシナプス機能不全[363-366]、および後皮質の萎縮[312、 352、 367-369]に起因するものと考えられる。さらに、ADD被験者における後皮質αリズムの低下は、これらのリズムを発生させる皮質錐体細胞、視床細胞、および網状体の視床ニューロンの集団における非選択的な皮質強直性興奮に起因する可能性がある[370-372]。このような皮質の過剰興奮は、警戒と認知[310]を妨げる神経情報処理のバックグラウンドノイズを誘発する可能性がある。
個人レベルでのアルツハイマー病におけるRsEEGマーカー:分類精度と予測
RsEEGマーカーは、ADD患者をノルド人やPDDやDLB人のような神経変性性痴呆性障害を持つ他の人から識別することを可能にした。電極ペア間のグローバルデルタコヒーレンスとアルファコヒーレンスは、DLB人と比較して0.75〜0.80(例:1=100%;[373])でADDを正常に分類することができた。さらに、20個の識別頭皮rsEEGのパワー密度とコヒーレンス変数は、ADD対Nold、ADD対PDDの被験者の識別において0.90の分類精度を示した[374]。ADD、PDD/DLB、前頭側頭型認知症患者の小集団を対象とした別の研究では、25の判別用スカルプrsEEGパワー密度と機能的皮質接続性(すなわちグランジャー因果関係)変数を用いて分類精度1.0を達成した[375]。
別の研究では、神経心理学的、臨床的、神経画像学的、脳脊髄液、視覚的脳波データと定量的なrsEEG変数(皮質機能的接続性の変数を含む)を組み合わせると、ADD、PDD、DLBの人の識別において、分類精度0.87の「唯一」に達した[376]。大脳皮質の情報源空間については、安静時のデルタ情報源とアルファ情報源は、Nold被験者とADD/DLB/PDD患者、ADDとPDD患者を0.85~0.90で分類した[326]。MCIを有するPDDとADDでは、より軽度の分類効果が観察された [377]。
RsEEGマーカーは、約6~24ヵ月後のaMCI患者の認知機能低下を予測した(レビューは[348]を参照)。主な効果は以下のように要約される。1) 左側頭-後頭領域からのα-θパワー密度と平均周波数の組み合わせ[316]、2) α源の前方局在化[315]、3) 高い側頭デルタ源[378]、4) 高いシータパワー密度[379]、および5) 低い後αパワー密度[380]である。
脳波の実装に関する最後の注意事項
全体的に、安静時の皮質デルタリズムとアルファリズムは、グループと個人レベルで、アルツハイマー病における神経生理学的予備軍のより危険な状態を明らかにする可能性が示唆されている。これらのrsEEGマーカーは、治療介入のための神経生理学的エンドポイントとして、アルツハイマー病の進行を予測し、追跡した。今後の多中心縦断的研究は、臨床応用と研究のための「神経生理学的予備軍」のより良い定義のための「同期」と「接続性」のrsEEGマーカーの系統的な比較のための大規模なオープンアクセスデータベースを提供する必要がある。
磁気脳波(MEG)の貢献と役割
脳磁図法(MEG)は、神経細胞の活動によって頭皮表面で発生する10~12テスラの磁気信号を記録することができる。それは、アルツハイマー病の新しい神経力学的バイオマーカーを明らかにするために脳波を補完する情報を提供する可能性があり、特にその非常に初期の無症状のリスクと前臨床段階では、したがって、前駆症状と臨床段階の前に…
MEGは、脳波と非常に類似した方法で認知機能を調査するために使用することができる。このアプローチでは、障害された脳機能活動は、例えば、記憶タスクの間にアルツハイマー病とMCIの段階で特徴付けられた。Wallaと同僚[381]は、彼らが言語情報のエンコーディングの深さを操作した認識記憶タスクを使用していた。
彼らは、深いエンコード後、コントロールに相対的にアルツハイマー病患者の古い以前にエンコードされた対新しい項目への時間頭頂イベント関連の応答の変化を示した。また、ミスマッチ否定性(MMN)がアルツハイマー病の潜在的なマーカーであることも示された。
ミスマッチ否定性は、それゆえに感覚処理、記憶、および予測コーディングの質の評価を可能にする、聴覚モダリティで古典的に標準的に繰り返される刺激の流れの中で逸脱した刺激の検出に関連付けられているイベント関連の潜在的な応答のよく知られているコンポーネントです[382、383]。その磁気的対応語であるMMNmは、健常な高齢者の対照群と比較してアルツハイマー病では潜時が遅れることが示された[384]([385]も参照)。
最も興味深いことに、アルツハイマー病の前臨床段階、例えばAPOE ε4キャリアにおける記憶課題を用いて、いくつかの研究では、被験者の衰えの神経生理学的マーカーを明らかにするためのMEGの能力が指摘されており、潜在的に病理学的な出現を予測する可能性がある[386、 387]。
まとめると、MEGは脳波と同様に様々なタスク遂行中の認知機能を調査するために使用することができる;これらの方法はいずれも正常および病理学的加齢における情報処理および認知機能に関する高度に収束した時間的に詳細なデータを提供する。
しかし,アルツハイマー病の分野で病態生理学的メカニズムを解明し,新たな神経力学的バイオマーカーを提供するためのMEGの最もユニークな可能性は,脳機能ネットワーク,特に安静時ネットワークの研究にあるかもしれない(レビューは[388])。
前述のように、fMRIの研究では、タスク要求がない場合、安静時の脳は自発的で高度に構造化された、しばしば振動的な活動の変動を示すことが示されている[389]。MEGやEEGでは、これらのネットワークを時間領域と周波数領域でより詳細に見ることができる[390-395]。
安静時ネットワークは通常、MEG(またはEEG)信号の時間-周波数分解を用いて研究される。これにより、異なる周波数帯域の安静状態ネットワークの豊富なセットを同定することができる(例えば、[390、 392、 393、 396])。アルツハイマー病患者が変化した安静時ネットワーク活動を示すことが示された。
これは、振動活動特性のレベルで明らかにされ、デルタ(<4Hz)とベータ(~20Hz)の周波数範囲で特に異常を伴う脳リズムの全体的な鈍化を指摘している[397-402]。さらに、記憶障害と相関する安静時ネットワークの変化が、最近、ニューロマグネティックデータに適用したグラフ理論的アプローチを用いて示された[403]。
重要な問題は以下の通りである。これらの変化はいつ疾患の経過の中で現れるのか、またどの変化が分子的・臨床的なアルツハイマー病の発症を予測するのか、あるいは特異的なのか?臨床転帰のためのこのようなサロゲートバイオマーカーを提供するために、脳波とMEGの方法には特に可能性がある。
さらに、機能的な脳ネットワークのいくつかのMEGマーカーがMCIからアルツハイマー病認知症への移行を予測する可能性があるという証拠がある[397、 400、 404]。
実際には、安静時調査は認知的な努力を必要とせず、データ取得時間も比較的短くて済むため、特に高齢者に適しているという利点があることを強調しておくことが重要である。ほとんどのEEGシステムと比較して、MEGは、記録のための被験者の準備時間が短いことに言及する価値がある。
現在利用可能な全頭MEGシステムは、硬いヘルメットに固定された約300個のセンサーで構成されている。頭部の形状を数値化し、いくつかの基準センサーを取り付けた後、被験者はヘルメットに頭を入れた状態で快適に着座する。設置時間は最短20分で完了する。さらに、MEGの完全な「無邪気さ」により、病気の進行を綿密に追跡調査し、詳細な縦断的評価を行うことが可能になる。
最近のニューロマグネティックイメージング法の開発と有望な結果を受けて、アルツハイマー病の磁気脳波国際コンソーシアム(MAGIC-アルツハイマー病)イニシアチブが発足した。このイニシアチブは、安静時の状態と単純記憶やMMNタスクからのデータを組み合わせて、多中心の研究で、アルツハイマー病やアルツハイマー病以前の研究にMEGの使用を進めることを目的としている[405]。
臨床応用に関してはまだ発展途上であるが、MEGは患者の層別化(臨床試験のための患者集団をより良くターゲットにするため)や治療評価のための新しいツールを提供し[406、 407]、アルツハイマー病の神経力学的病態生理学的メカニズムに新たな光を当てる可能性を持っている。
これにより、初期の適応性、代償性、代償性の脳ネットワークの変化の時間的プロファイルの形で、病気の進行の個別化されたシグネチャーの同定を予見することができる。さらに、MEGのフルパワーは、個人のマルチモーダル評価とマルチモーダルビッグデータのIDMを可能にするために、他の方法との組み合わせから来ることは明らかである。
例えば、APOE多型解析などの遺伝データとMEG安静時解析を組み合わせることで、アルツハイマー病認知症に移行するリスクの高いMCI被験者や、認知機能が著しく低下するリスクの高い無症候性被験者の同定に有望であることが明らかになっている[408]。神経心理学的評価、脳の構造的・機能的測定、APOE遺伝子タイピングを含むMCI被験者の多因子解析は、アルツハイマー病への転化を予測するために非常に高い感度と特異性を示した[409]。
結論として、MEGに基づく脳機能ネットワークの動態解析の進歩は、アルツハイマー病の病態生理学的メカニズムへの新たな洞察を提供するチャンスである。そうすることで、それは病気の細胞と分子の経路から知られていること-その始まりとその進行-と、その臨床と行動の特徴を構成する認知機能障害との間のギャップを埋めるための強力なツールを構成するものとする。
このことは、神経変性や認知症に至る個々の遺伝的パターンや病態の特徴付けに基づいて、バイオマーカー誘導型の新しい治療法や精密医療を開発するための鍵となると考えられる。
神経モデリングの貢献と役割
ニューロモデュレーションとは、脳の個別領域を対象とした、多かれ少なかれ侵襲的で可逆的な電気刺激のことで、通常は従来の薬理学的治療を補助するものであるが、それに代わるものではない。したがって、ニューロモデュレーションは、個々の患者の要求や疾患の病態生理に合わせて医療をカスタマイズするという広い意味での精密医療のパラダイムによく適合している。
アルツハイマー病における侵襲的神経変調
深部脳刺激(DBS)を介した神経変調は、アルツハイマー病における新たな機会であり、すでに進行した神経学的および精神疾患の治療法として確立されている[410]。刺激のいくつかの皮質下および皮質のターゲットは、実験的に学習と記憶の改善、シナプス強度の強化、および脳の振動性活動の生理学的パターンの回復、特にシータバンド、記憶に機能的なリズムの回復が示されている[411]。
内耳皮質のDBS [412]は、学習中に適用すると空間情報の記憶を強化した。メイナート基底核のDBSは、12ヵ月間のパイロット研究で軽度から中等度のアルツハイマー病患者6人を対象に研究された[413]。DBSは忍容性がよく、6人中4人の患者は12ヵ月後に認知スコアに基づいて安定しているか改善していると考えられた。
前頭葉-海馬と乳頭体をつなぐ深部白質路であり、記憶機能に不可欠なパペス回路の中心結節である-は、アルツハイマー病のヒトDBSターゲットとして最も研究されてきた[414-417]。
最初に両側前庭に移植された6人の患者の12ヶ月間の追跡調査では、記憶に関連する神経ネットワーク構造の代謝の増加を伴う認知機能の低下の可能性が示された[418]と、アルツハイマー病で見られる通常の海馬の萎縮の反転[416]。
これらの有望な結果は、軽度の可能性のあるアルツハイマー病患者42人を対象とした、両側前庭の両側DBSの最初の多施設12ヶ月間二重盲検無作為化対照試験を促した[419、 420]。この研究では、刺激を受けた患者と、刺激を受けなかった対照群との間に認知的尺度での差は認められなかった。
しかし、刺激を受けた患者では、6ヵ月と12ヵ月目にあらかじめ選択した脳領域でグルコース代謝の増加がみられたのに対し、刺激を受けなかった患者では予想通り代謝の低下がみられた。ポストホック回帰分析では、年齢が転帰と関連していた。刺激を受けた遅発性疾患患者(65歳以上)では、刺激を受けなかった患者と比較して認知機能の低下が緩やかになっていた。
このサブグループのグルコース代謝の改善は、全体のグループと比較して大きかった。前歯部への刺激は安全であるように思われた。大脳皮質の萎縮と電極の深部標的への経静脈的軌跡にもかかわらず、この手技の全体的な周術期の副作用は、他の神経変性疾患のDBSと同程度であり、移植後3ヵ月の時点での死亡率または神経学的な病的障害の証拠はなかった[419]。
アルツハイマー病における非侵襲的神経調節
異なる、非侵襲的でありながらもまだ実験的なアルツハイマー病における神経変調の研究アプローチは、反復的な経頭蓋磁気刺激(rTMS)または経頭蓋直流刺激(tDCS)を介した微弱電流を、毎日繰り返される刺激のセッションで適用することにより、頭皮を通してアルツハイマー病の病態生理に関連する大脳新皮質領域を標的とすることである[421]。
rTMSは皮質ニューロンをトランスシナプス的に発火させ[422]、tDCSは極性依存的に発火確率のレベルをシフトさせるため、作用機序は異なる[423]。高周波rTMSと陽極性tDCSは一般的に皮質の興奮性を増加させるが、低周波rTMSと陰極性tDCSはその逆を行う[424、 425];これらの効果は局所的なものであるか、標的とする領域が属する皮質下皮質ネットワークに関与している[426]。
アルツハイマー病の場合、毎日のセッションを数回延長したとしても、皮質標的の単なる「刺激」は、記憶や他の認知機能の低下を防ぐのにはそれほど役に立たない[421]。しかし、アルツハイマー病のrTMSのためのいくつかの対照研究があり、これまでに治療された数十人の患者の合計のために、tDCSのためにさえ少ない[421]。
非侵襲的ニューロモデュレーションの可能な役割として浮上しているのは、認知療法と刺激の結合であり、認知リハビリテーションのみの効果を相乗的に改善するために可塑的連想学習メカニズムを促進することを目的としている[427-429]。
このアプローチは、まだ定量的な特性化[430-432]を必要としながらも、神経変性の重症度がまだ可能性が介入するための残留神経基質を利用できるようにするときに、軽度のアルツハイマー病でのみ有望であるように思われる[433]。
ベンチから患者へ:非侵襲的な神経変調の将来の方法?
生理的な脳活動は、0.05から500-600Hzまでの広い周波数範囲の振動活動で構成されている:30-80Hzの範囲の振動は「ガンマ」活動として知られている。ガンマ活動の相対的な減衰は、アルツハイマー病患者における一貫した所見である[315]。
さらに、海馬のシータ/ガンマ結合の調節障害は、アルツハイマー病の動物モデルではアミロイド沈着活動に先行する可能性がある[434]。最近の研究では、アミロイド沈着前のアルツハイマー病マウスを対象とし、40 Hzで振動する明滅光を外因性に誘導することで、アルツハイマー病マウスモデルにおいてAβ濃度とアミロイドプラーク、タウ濃度を低下させ、その後の神経変性や行動障害を予防することが示されている[435]。
このことは、ヒトにおいても、マウスモデルで観察されたのと同様の有益な効果につながる可能性があると考えられ、トランスレーショナルな展望を開くものである。アルツハイマー病患者における脳振動パターンの調節の可能性は、抗てんかん薬の投与後にガンマ帯の脳波が変化することで最近示されている[436]。
脳振動と相互作用する実行可能な方法は経頭蓋交流電流刺激(tACS)であり、低強度(最大2mA)の交流正弦波電流が頭皮電極を介して印加される。この方法の安全性[437]と制御性(刺激周波数およびほぼすべての皮質領域を標的とする可能性の点で)により、tACSは、健康な脳および病理学的脳における脳振動を変調するための最も有望な技術の一つとしてコンセンサスを得ている。
神経生理学的マーカーを用いた実証的な証拠は、tACSがネットワーク共鳴を介して脳の振動活動を変調することを示しており、共鳴周波数での弱い刺激がネットワーク活動の大規模な変調を引き起こし、周波数特異的な方法で内因性ネットワーク振動を増幅する可能性が示唆されている[438-441]。
ガンマ帯(具体的には40Hz)でのtACSの適用は、高次認知[442、 443]および感覚運動性能[444]に関連するものを含む、ヒトの様々な能力を一過性に変調するのに有効であることが示されている。アルツハイマー病患者におけるtACSの反復投与は、Aβの濃度が高い皮質領域を個別に調整すれば、タイムリーな疾患変革をもたらす個別化された治療法として、患者集団でテストする価値があるかもしれない。
ポジトロン画像法(PET)の貢献と役割
陽電子放射断層撮影(PET)は、アルツハイマー病治療の選択に大きく貢献する可能性を秘めている。このことは、臨床症状がまだ見られない疾患の非常に初期の無症状の段階で特に関心がある。さらに、いくつかの異なる病態生理学的プロセスが最初の症状や認知症の発症や症状の発現に寄与することがますます認識されているように、それはまた、後の段階で重要であることが判明する可能性がある。これらの病態は患者によって大きく異なるため、個々の患者の主要な原因をターゲットにすることが必要である。
前臨床段階や前駆症状の段階では、PETによる線維性アミロイド沈着の同定は、臨床試験のための画像バイオマーカーとして承認されており、その重要性は明らかである。保存的なカットポイントの使用は、アミロイド沈着が始まっているがその後の悪化がない高齢者の対象者を最小限に抑えるために示唆されている[445]。試験の良好な結果次第では、アミロイドPETは抗アミロイド治療の対象となる患者を選択するための診断法になるかもしれない。
顕在性認知症を有する患者では、アルツハイマー病とFTDや血管性認知症などの他の疾患との鑑別診断が対症療法の選択に重要である。18F-2-フルオロ-2-デオキシ-D-グルコースPET(18F-FDG-PET)は、アルツハイマー病とFTDの信頼性の高い鑑別が可能であることが繰り返し示されている[446]。鑑別診断におけるその関連性を超えて、18F-FDG-PETはアルツハイマー病のトポグラフィーマーカーであり、疾患の進行度を測定し、臨床サブタイプの同定に役立つ[447]。したがって、疾患の神経病理学的特徴(NFTとAβ)と認知症状との間に媒介的な効果がある[448]。
また、認知症の発症を遅らせる認知予備能の根底にあるメカニズムの研究にも成功している[449]。生体内試験(in vivo)でのアルツハイマー病病理の同定もまた、疾患同定に関連していることが証明されている。実際、いくつかのアルツハイマー病の臨床表現型は、古典的な無気力アルツハイマー病 [450]を含むいくつかの神経変性疾患(例えば、原発性進行性失語症、コルチコバサル症候群)の下敷きになることができる。
このような場合、アミロイドPETは、アルツハイマー病の指標として線維性アミロイドを同定することができる。線維性アミロイドは他の病態と共存することもあり、DLBや血管性認知症(混合型認知症と呼ばれる)の患者ではよく見られるが、FTDでも可能であり、より急速な進行に寄与する可能性がある[451、452]。
したがって、もし抗アミロイド療法がアルツハイマー病患者に臨床的な有用性を示したとしても、非アルツハイマー病認知症でアミロイドPET陽性の患者にも有用性があるかもしれない。
アルツハイマー病の様々な病態生理学的寄与因子が考えられるが、その多くは特異的なPETトレーサーによってアクセス可能である。最も顕著なのは線維性タウ沈着である。現世代のPETタウトレーサーは、アルツハイマー病におけるタウ沈着の病理学的病期を反映することが実証されているが、スキャンの解釈を複雑にするいくつかのオフターゲット結合の証拠もある。次世代のトレーサーは、これらの限界を克服するために開発されている[453]。
神経炎症は、疾患の進行を加速させることが示されているもう一つの主要な因子である。これはミクログリアの活性化と関連しており、トランスロケータータンパク質(TSPO)トレーサーを用いたPETによって画像化することができる。11C-(R)-PK11195は、それらの最初のものであり、比較的高いレベルの非特異的結合のためにいくつかの制限があるにもかかわらず、現在でも広く使用されている。
より高い特異性を有する多数の第二世代トレーサーが開発されているが、それらの結合は、これらのトレーサーの利点を曖昧にする遺伝的多型の影響を受けている[454]。それにもかかわらず、これらの限界を超えて、これらのトレーサーの開発は、関連するバイオマーカーを提供し、アルツハイマー病の進化の変動性に新たな洞察を提供する可能性がある[455]。
アストログリア症のイメージングのためのトレーサーもあり、サイトカインや炎症性内皮変化のためのマーカーが開発されている。さらなるトランスレーショナルリサーチでは、ミクログリアおよびアストロサイトの活性化に対する分子的特徴および標的介入の効果を調査する予定である。
認知症患者の記憶力や注意力の低下には、コリン作動性伝達の障害が大きな役割を果たしている。ニコチン受容体、ムスカリン受容体、小胞輸送体、アセチルコリンエステラーゼのトレーサーが開発されている。臨床研究では、このようなトレーサーがアセチルコリンエステラーゼ阻害剤治療の反応者を同定するために使用できるという予備的な証拠が得られており、この問題に関するさらなる研究が必要とされている[456]。
DLBで最も深刻な影響を受けるドーパミン作動性伝達を同定するための確立された単一光子放出コンピューター断層撮影(SPECT)およびPETトレーサーがある。これは、アルツハイマー病とDLBを鑑別するための有用な診断ツールを提供しているが、その障害に関連した認知障害を特定し、標的となる治療介入の可能性を探る研究が進行中である[457]。
また、グルコースエネルギー代謝、ミトコンドリア損傷、グルタミン酸作動性およびGABA作動性機能障害、血液脳関門障害、転写調節およびタンパク質合成の欠陥のPET画像化に関する研究も現在進行中である。これらは、アルツハイマー病の病態生理に重要な役割を果たし、標的とする介入のための窓を提供する可能性がある。
結論として、PETはアルツハイマー病における精密医療パラダイムの発展に貢献する大きな可能性を秘めている。現在、アミロイドイメージングは、その目標に向けたバイオマーカーとして臨床試験が最も進んでいる。18F-FDG-PETやタウPETイメージングも複数の臨床試験が行われているが、他にもアルツハイマー病の病態生理における特定の標的に対するトレーサーとして、様々なトレーサーがトランスレーショナルリサーチの初期段階にある。
RETINAL IMAGINGの貢献と役割
過去30年以上にわたり、アルツハイマー病は脳に限ったものではなく、眼にも影響を及ぼすことを示す証拠が増えてきている。アルツハイマー病患者とMCI患者は、視覚障害[458-464]、睡眠障害[465-471]、および眼の異常[472] [466、 472-489]の幅広いスペクトルを経験している。歴史的には、これらの視覚および概日リズム障害は脳の病理に起因するものとされてきたが、現在では、眼病理の直接的な結果としての可能性が再検討され、探求されている。眼組織の中では、網膜がアルツハイマー病によって大きな影響を受けることが研究で示されている [466、 472、 474-479、 482、 484、 486、 487、 490-507]。MCI被験者とアルツハイマー病患者の網膜は、神経繊維層(NFL)の菲薄化、視神経と網膜神経節細胞(RGC)の変性、黄斑容積の変化、血流の減少と血管構造の変化を伴う網膜血管症、アストログリア症、および異常な網膜電図パターンを含む多くの異常を示している[472]。これらの知見を考えると、アルツハイマー病の発現部位として神経網膜に注目が移り始めたのは当然のことである。
胚性双脳由来の中枢神経系組織として、網膜は、ニューロン、アストログリア、ミクログリア、周皮細胞、類似の形態学的および生理学的特性を持つ微小血管系、および血液バリアの存在を含む、多くの構造的および機能的特徴を脳と共有している[508]。視神経の軸索は網膜と脳を直接接続し、RGCで合成されたAPPの小胞輸送を促進する [512]。さらに、網膜のニューロンとグリアは、γ-セクレターゼ、BACE1、アポリポタンパクE、クラステリンなどのアミロイドカスケードに関連するタンパク質を分泌する[511、513、514]。しかし、頭蓋骨で囲まれた脳は骨によって遮蔽されているのに対し、網膜は直接、非侵襲的な高分解能イメージングにアクセス可能である。
様々な神経学的および眼疾患に共通する神経変性および血管変化に関連した網膜異常を示す収束した証拠は、MCI被験者およびアルツハイマー病患者において長い間記述されてきた。しかし、アルツハイマー病特異的な病態生理学的特徴であるAβ斑は、アルツハイマー病患者や早期の症例の死後網膜で最近同定されたばかりである[490]。その後の研究は、網膜Aβ沈着のこれらの所見を裏付け、さらにアルツハイマー病患者の網膜におけるp-tauの存在を示した [466、 485、 489、 515、 516]。これらの研究は、網膜抽出物全体の生化学的アッセイを使用して網膜Aβ40およびAβ42ペプチドの上昇の証拠を提供し、平板状の網膜Aβプラークの多様な形態を明らかにし、しばしば血管と関連しているか、または細胞変性の部位と共局在していることを明らかにした(図7A-H)[466、 485、 489、 490、 515、 516]。最近のデータは、網膜Aβ沈着物がクラスターで発見され、アルツハイマー病患者の上象限の末梢領域に頻繁にマッピングされていることを示した(図7Cおよび7F)。上象限のAβ42接触網膜斑の負荷は、年齢と性別をマッチさせた対照群と比較して、患者では4.7倍も実質的に上昇していた(図7C-D)[485]。2つのグループは、ヒトアルツハイマー病網膜[489、517]でAβまたはp-tauを検出することができないであったが、彼らは鼻から側頭象限に水平にまたがる狭いストリップから調製した断面積の分析に依存していた ・Aβ病理学では希少な領域。対照的に、最近の研究では、フラットマウントで、Aβ病理学[485]で豊富な幾何学的領域から派生した断面の大規模な網膜領域のスキャンを介して確定的なアルツハイマー病患者のより大きなコホートで網膜Aβ堆積物の詳細な特性評価を提供した。脳のプラークに比べて平均サイズが小さいにもかかわらず、これらの患者における古典的な高密度コア(コンパクト)および神経細胞様プラークの発見は、神経原線維のもつれ、Aβ42フィブリル、プロトフィブリル、およびオリゴマーに類似した構造とともに、アルツハイマー病の特異的な徴候が網膜と脳の間で共有されていることを示唆している(図7G)。患者のサブセットにおける相関分析は、網膜とそれぞれの脳のAβプラーク負担との間の正の関係を検証しており、一次視覚野のプラークとのより緊密な関連性を持つ(図7H)[485]。特筆すべきは、豊富なAβ病理が検出されたアルツハイマー病患者の網膜領域-上象限の周辺部と網膜最内層-もまた、網膜ニューロン細胞の有意な減少を示し(図7E-F)、上象限での顕著なRGCの損失とNFLの菲薄化を示す先行研究と一致している[466、 476、 484、 491、 498、 502、 518、 519]。最近の臨床研究では、概日光運動を駆動することが知られている光受容体であるメラノプシンRGC(mRGC)の著しい損失とともに、アルツハイマー病患者の概日異常が同定され[520]、これらの変性細胞内およびその周辺でAβの蓄積が発見された。したがって、mRGCsの損失は、有毒なAβ形態に対するそれらの感受性の増加に起因する可能性があり、アルツハイマー病における睡眠障害のための網膜ベースのもっともらしい説明を提供している[466]。
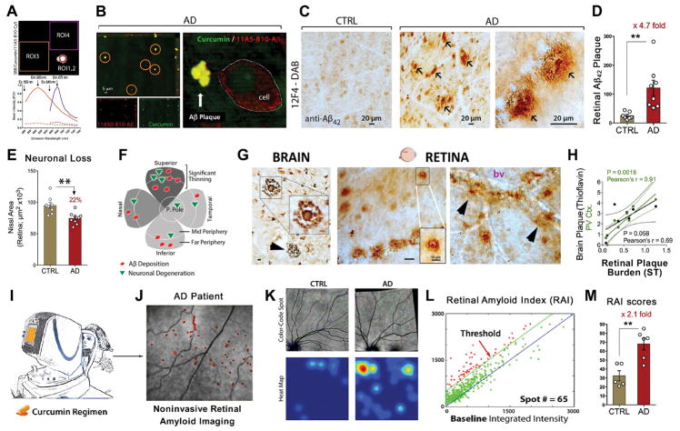
図7
網膜アミロイドイメージング:組織学的検査から臨床試験まで
A. 特定のクルクミン標識を介してアルツハイマー病ヒトフラットマウント網膜のAβプラークのスペクトル解析。550nmの励起波長でクルクミン[関心領域(ROI)1;オレンジ線]と抗Aβ40抗体Cy5コンジュゲート(ROI2;紫線)と対応するバックグラウンド領域(ROI3およびROI4;破線)で二重に標識された網膜Aβプラークの代表的な画像とスペクトル曲線(クルクミンスペクトルのための)と640nmの励起波長(Ab-Cy5コンジュゲートのための)。自家蛍光を消光するためにスーダンブラックB(SBB)を適用した。同じ個々のAβプラーク(Aβプラークに結合した場合のクルクミンは605nm、抗AβAb共役Cy5は675nm)について捕捉されたピーク発光波長は明瞭であり、各蛍光色素に特異的な蛍光シグナルを示し、クルクミンによるAβプラークの検出を意味している。B. アルツハイマー病患者からのフラットマウント網膜の代表的なz軸投影像。クルクミン(緑)と抗Aβ40モノクローナル抗体(11A50-B10;赤)と共標識された網膜Aβプラーク(黄色の斑点)が検出される。解析対象は、確定的アルツハイマー病(n=8)、可能性のある/可能性のあるアルツハイマー病(n=5)、および年齢をマッチさせた対照(n=5)。細胞外Aβプラークを示す高倍率画像(右)。画像A-Bは[490]より引用。C.健康なコントロール個体(CTRL; 71歳)と確定的なアルツハイマー病患者(74歳)のフラットマウント網膜からの代表的な顕微鏡画像は、抗Aβ42 C末端特異的抗体(12F4)で染色し、ペルオキシダーゼベースのラベリングで可視化した。古典的な形態を含む異なるAβ42プラークを示す高倍率画像。解析には、確定的なアルツハイマー病患者(n=5)とマッチした対照(n=5)が含まれている。画像は、[466]と[472]から転載。D.上象限の網膜Aβ42含有斑(12F4-免疫反応領域)の定量的分析は、マッチドコントロール対アルツハイマー病患者の有意な増加を示している。E. 網膜断面における定量的なNissl+ニューロン領域は、網膜ニューロン喪失に関連するCTRLsと比較して、アルツハイマー病患者における有意な減少を示した。D-E。485](n=23 アルツハイマー病患者とn=14コントロール)から転載したデータ。F.神経線維層の菲薄化、神経細胞の変性と網膜Aβ堆積物のより一貫した所見で、象限ごとにアルツハイマー病網膜の病理学の幾何学的分布を示す網膜フラットマウント図は、上の象限の末梢領域にマップされている。472]から採用。G.古典的なプラーク(挿入)を含む異なるAβ42プラークの形態を示す12F4モノクローナル抗体で染色されたアルツハイマー病患者からの前頭皮質切片とフラットマウント網膜の代表的な画像(茶色)。Aβ42を含むプラークのクラスターは血管と関連していることが多い(bv;右画像)。H. アルツハイマー病患者のサブセットとマッチしたCTRLの合計7つの脳領域(Brain;黒)と一次視覚野単独(PV Ctx.;緑)における上側頭(ST)象限における網膜12F4+プラーク負担と脳プラーク負担(チオフラビン-S染色)との間のピアソン係数(r)検定を用いた相関分析。I-J. Longvida®クルクミンおよび修正走査型レーザー検眼器を用いた非侵襲的網膜アミロイドイメージングをヒト試験で行った図。K-M。アルツハイマー病患者および年齢をマッチさせた対照群における生体内網膜イメージング。K-L。アルツハイマー病患者対CTRLにおける上半球のクルクミン蛍光シグナル(赤い点)の増加。色分けされたスポットオーバーレイ画像:赤い斑点が閾値を超えており、クルクミン陽性アミロイド沈着物と考えられ、緑の斑点は1:1基準ではなく、閾値を超えて、青の斑点は基準以下になる。赤色のスポットの中心を持つヒートマップ画像(下のパネル)は、網膜のアミロイド斑が多い関心のある領域を示している。L.網膜アミロイド指数(RAI)の自動計算。青線は1:1の基準であり、緑線は500カウント以上で決定されたしきい値レベルを表し、赤斑はしきい値以上である。全てのヒト被験者(n=16)について、同じ自動画像処理および解析を行った。M. 年齢をマッチさせたCTRLと比較して、アルツハイマー病患者において有意な増加を示すRAIスコア。G-M。485]から米国臨床調査学会の許可を得て転載;許可は、著作権クリアランスセンター株式会社を通じて伝えられた。グループ平均およびSEMを示す。**p < 0.01、 対照なし両側スチューデントのt検定。
上記の知見に沿って、アルツハイマー病のトランスジェニックおよび散発性動物モデルの網膜を調査する多数の研究は、しばしばRGCの変性、局所炎症(すなわちミクログリア活性化)、および網膜構造および機能の障害と関連して、Aβ沈着、血管Aβ、p-tau、およびペアヘリカルフィラメント-tau(PHF-tau)を報告している[472] [485、490、515、516、520-537]。これらの研究は、様々なトランスジェニックラットおよびマウスモデル(アルツハイマー病tg)、ならびに散発的なアルツハイマー病の齧歯類モデルであるO. degusを含むもので、主にGCLおよびNFLにおける豊富なAβ沈着を実証した[490、 516、 521、 525、 528、 530、 533]。さらに、いくつかの出版物では、アルツハイマー病tgマウスの網膜Aβプラーク負担を減少させる治療に対する肯定的な反応が記載されており、多くの場合、それぞれの脳で観察された反応を反映している[490、 524、 527、 528、 532、 536]。
生きた被験者の網膜Aβ病理を可視化するために、非侵襲的な網膜アミロイドイメージングアプローチが最初にアルツハイマー病tgマウスで開発され、蛍光プローブとしてクルクミンを利用した[490、 527]。クルクミンは、血液-脳-網膜のバリアを横断し、高親和性でAβフィブリルとオリゴマーに結合する天然で安全なフルオロクロームである[490、 527、 538-551]が、網膜Aβプラーク(図7A-B)に特異的に結合した場合、ex vivoおよび生体内試験(in vivo)での可視化が可能である[485、 490、 527]。このアプローチは、個々のプラークの動的な外観とクリアランス、およびグラチラマー酢酸塩(GA)免疫療法後のそれらの実質的な減少を追跡する能力を含む、アルツハイマー病の生きた動物モデルにおける脱糞網膜Aβ沈着物の非侵襲的な検出およびモニタリングを可能にした[490] [527、552、553]。
概念実証臨床試験では、変更された走査型レーザー眼鏡とバイオアベイラビリティを高めた独自の経口クルクミン製剤(Longvida®)を用いて、生きたヒト患者の網膜アミロイド沈着物を非侵襲的に検出し、定量化する安全性と実行可能性が実証された(図7I-M)[485]。組織学的検査で報告されたパターンに対応して、生きているアルツハイマー病患者の網膜アミロイド沈着は、頻繁に上半球の中間および遠縁部に集中していた(図7K)。生きている患者の網膜のアミロイド負担の数値を評価するために開発された定量的な尺度である網膜アミロイド指数(RAI)の有意な2.1倍の増加が、対照群と比較してアルツハイマー病患者で明らかになった(図7L-M)[485]。生きたアルツハイマー病患者の非侵襲的網膜イメージングを適用した最近の研究では、NFLの菲薄化[466、 477]、包接体の増加[554、 555]、血流の減少、微小血管の変化、動脈や静脈の酸素飽和度[479、 556、 557]、そして重要なことに、ホールマークAβ沈着[485]を検出し、病気のリスクと進行を予測するための実用的なツールの開発に向けた心強い第一歩となっている。多発性硬化症、虚血性脳卒中、およびパーキンソン病などの他の神経変性疾患の網膜はまた、脳で検出されたものと同様の病態生理学的プロセスを示すので[501、 558-561]、網膜イメージングはまた、異なるタンパク病、神経変性疾患および神経学的疾患の鑑別診断を容易にする可能性がある。
脳内のアルツハイマー病を探求する研究として、容易にアクセス可能な網膜がアルツハイマー病神経病理を忠実に反映する可能性があるという可能性は、さらなる調査を保証するものである。早期症例における網膜Aβ蓄積の予備的証拠は、アルツハイマー病網膜におけるアミロイド関連の神経変性の徴候と共に[466、 485、 490]、アルツハイマー病が脳と眼の両方の疾患であることを示唆しており、無症状のリスク段階であってもスクリーニングツールとして網膜イメージングをサポートする可能性がある。今後の研究は、より大きなコホートおよび特定の解剖学的領域における脳アミロイドと網膜アミロイド負担の関係の性質を評価し、おそらく脳アミロイド血管症と網膜血管アミロイドの間の潜在的な関連性を決定するために必要である。網膜アミロイド病理学が脳疾患や認知機能の低下を予言する可能性があることを考えると、アルツハイマー病の早期発見、疾患の進行予測、治療への反応のモニタリングに不可欠であることが証明されるかもしれない。
さらに、光に対する瞳孔反応性の非侵襲的機能検査は、画像技術を用いた網膜異常の特徴付けを補完する可能性がある[562]。実際、光刺激に対する瞳孔反応はアルツハイマー病患者では異常であり[563]、アセチルコリン受容体拮抗薬であるトロピカミドに対して過敏な瞳孔拡張を示し、瞳孔光反射の低下も示している[564、565]。上述の網膜異常がこれらの瞳孔効果を説明することができるが、アルツハイマー病の初期徴候(細胞消失とアミロイド斑)も観察されている瞳孔制御に関与する主要なリレーであるエジンジャー・ウェストファル核もまた、瞳孔異常に寄与する可能性がある。瞳孔反応を調べるために、視野の異なる領域で焦点検査を実施することは、網膜アミロイドイメージングの結果の機能的な影響を特定するのに役立つ。網膜画像検査と機能検査の結果が強く相関していれば、瞳孔反応性はアルツハイマー病の重症度の代理として使用することができ、瞳孔反応性の機能検査は簡単で安価で迅速に実施でき、患者の強い関与を必要とせず、日常的に実施してアルツハイマー病の進展を検出し、追跡することができ、治療への反応と同様にアルツハイマー病の反応を追跡することができるという利点がある。
この点に関して、前述のソルボンヌ大学GRC-アルツハイマー精密医学(GRC n° 21)に属する「VISION」パイロットトランスレーショナル神経科学研究プログラムが開発され、初期の無症候性前臨床集団で網膜アミロイドイメージングを評価するために開始された1)アミロイドのスクリーニングとその進行を追跡するだけでなく、2)病態生理学的疾患の進行、認知機能の低下、および進行性アルツハイマー病への転換を予測する。非侵襲的な性質、容易なアクセス性と一般化可能性は、使用の潜在的なコンテキストに関する魅力的な機能である。
マルチモーダルlongitudinalデータ解析の空間的モデル化
現在、アルツハイマー病の病態生理の理解を深めるためには、対象者から生体内試験(in vivo)で得られる以下のようなバイオマーカーが必要である。”血液(遺伝的危険因子など)や脳脊髄液(Aβ42やp-tauの異常投与など)からの「体液」、MRIからの「構造」(神経変性の徴候としての脳萎縮など)や「機能」(脳断絶症候群など)、PETからの「分子」(脳の代謝低下やAβ42やp-tauの沈着など)、そして「神経生理学的」(皮質神経の同期や結合の異常など)である。
さらに、細かい神経心理学的・臨床的尺度により、認知障害、セルフケア、地域での生活自立、精神障害(不安、気分、精神病、行動など)を詳細に測定することができる。これらの測定はいずれも、記録セッションの繰り返しにより、経時的な脳の残存能力や機能を個別に評価することができる。
このような前提を念頭に置きつつ、主要な課題は、早期診断(認知症の前臨床段階や前駆段階であっても)、モニタリング、治療反応、疾患の進展予測のために、上記のバイオマーカーや臨床指標の情報価値を重み付けして、計算神経科学から最適な統計的・数学的手法を特定することである。
この目的のために、近年、被験者の解剖学的不変量をまとめた3D幾何学的モデルを合成する方法として、デジタル脳モデルが開発されている[566-569]。このモデルは最近、機能データにも拡張されている[570、 571]。
このようなモデルの主な関心事は、グループレベルでの脳構造と機能に対するアルツハイマー病の影響を説明するだけでなく、個人のばらつきに関する情報を含むことで、ある患者と健常者や他のディメンティング障害を持つ患者の基準群との間の差を計算して、感度(アルツハイマー病患者の検出)、特異度(健常者や他の疾患を持つ患者の検出)、およびグローバルな分類精度としての診断情報を提供することができることである。
これらの診断モデルは、生物統計学で一般的に使用される通常の線形混合効果モデルを補完する非線形混合効果モデルのベイズ推論に基づいている[569、 572]。統計的アプローチと幾何学的アプローチのこの組み合わせは、事前知識としての脳解剖学の特定の組織のようなデータに内在する構造を考慮している。
これにより、3Dモデルの現実的で解釈可能な変化としての個体間変動をレンダリングすることができる。個体の特徴は多変量記述子によって要約され、これを順番に使用して、異なるクラスタ内の個体の分布を探索したり、外部要因と相関させたり、あるいは機械学習アルゴリズムの入力として使用して個体の予測を行ったりすることができる[568]。
理想的には、そのような静的モデルは、時間の経過とともに病気の進行を考慮し、個々のアルツハイマー病患者の臨床的進化の予後を提供するために適応されるべきである。脳老化のデジタルモデルは、疾患が進行する間の上記バイオマーカーの変化の複雑な時空間パターンを示す動的モデルとして構築されている。
個体間変動は、個々の時空間的軌跡の変化の観点から表現される。疾患進行のこのようなモデルの構築は、いくつかの重要な要素から成り立っている [570、 571、 573-576]。2)異なるデータモダリティを共通の要約数学空間(リーマン多様体と呼ばれる)に変換してモデルに統合することで、時空間軌道の統計的分布を厳密に定義することができる。
ここでは、多変量記述子が軌道の方向の変動性をコード化し、力学的パラメータが発症年齢や病気の進行ペースの変動性をコード化している。1つまたはいくつかの時点で新しい被験者が観察されると、モデルパラメータを調整することにより、疾患進行のシナリオをパーソナライズすることができ、その結果、縦断的なデータセットの自動分析から得られた知識をこの新しい個人に転送することができる。
このパーソナライズされたモデルは、被験者の将来の状態、例えば特定の症状の発症までの時間を予測するために利用することができる。我々は、神経心理学的評価からの認知機能低下モデルを用いて軽度認知障害者の診断までの時間を予測し[577]、構造イメージング[571]を用いて同じ被験者の将来の皮質厚さのマップを予測するために、このようなアプローチを採用してきた。
このアプローチは、疾患の進行をモニタリングし、特定の疾患ステージ(例えば、前臨床、前駆性、顕在性認知症)で、進行の予想されるパターンで、特定のバイオマーカーに基づいたアルツハイマー病の診断を受けた臨床試験の患者を選択するための効率的な意思決定支援システムを構築する方法を切り開く。
さらに、このような個別化されたシナリオは、治療効果を評価するための新しい方法を提供する可能性があり、病気の軌跡、すなわち複雑な非線形の時空間的変化パターンをどの程度変化させるかを評価することによって、治療効果を評価することができる。
このアプローチは、1)すべての病期における転帰の線形変化を想定せず、病期間の変化の非線形ダイナミクスを考慮していること、2)一変量の転帰指標だけではなく、多変量の転帰指標を用いていること、などから、転帰指標の年率に基づく標準的な手順を発展させたものである。
アルツハイマー病におけるシステム薬理学の発展分野
アルツハイマー病の病態が非常に複雑であることの帰結は、同疾患の薬物開発パイプラインの結果にはっきりと表れている:2002年から 2012年にかけて実施された413件の臨床試験のうち、99.6%が失敗している[578]。さらに、2016年に行われたアルツハイマー病治療薬開発パイプラインのレビューでは、パイプラインの規模は大きくなったものの、がん領域と比較して著しく小さく、最も一般的なターゲット(76%)は依然としてアミロイドであることが示されており、疾患の病態生理の理解を深めることが急務であることが反映されている[579]。
実際、抗アミロイド薬候補の残念な結果は、創薬と開発に関連した3つの大きな要因、すなわち、
- 1)動物モデルとヒトの間の種間メカニズムの違い、
- 2)病期分類に関連したアミロイドβの複雑な生物学、
- 3)非アミロイド経路の無知、
に起因すると考えられる。このように、システムバイオロジーに基づいたアプローチを用いて、アルツハイマー病の病態生理の複雑さを明らかにすることが不可欠である。
システム生物学的手法の目的は、研究者が疾患システムに関する仮説を立て、複数の生物学的スケールと時間を 越えて疾患の病態生理と進行についてのより良い機械論的洞察を得ることを支援することにある。メカニズム的システムモデルには、病態生理学的プロセスを数学的に表現したものと、計算可能な細胞ネット ワークを用いたものがあるが、後者の方が薬効解析のために注目されている[580]。
これらのモデルは単一の伝達経路ではなくネットワークを使用するため、標的となる生物学的文脈内での薬物作用の複雑なパターンをより詳細に研究することができ、システム薬理学として浮上してきた分野である。
米国薬剤科学者協会(AAPS)によると、システム薬理学は「分子、細胞、組織、臓器、器官、集団レベルでの薬物作用に関する知識を深める科学」(http://www.aaps.org/Systems_Pharmacology/)とされている。システムレベルでの薬物作用の完全な理解を得るためには、疾患メカニズム、薬力学、薬物動態のデータを一つのモデルにまとめる必要がある。
しかし、定量的なパラメータや測定値を組み込むとモデルが複雑になるため、システムの挙動に影響を与えずにパラメータの数を減らすための特別な数学的手法が必要となる。疾患メカニズムモデルは、疾患条件下で障害された生物学的機能に対する治療薬や新薬候補の影響を解明することを目的とした分子・細胞ネットワークである。疾患モデルの有用性の鍵は文脈感受性であり、疾患ネットワークモデルは、細胞および組織のタイプ(空間的次元)、疾患サブタイプ(機能的次元)、および進行段階(時間的次元)の観点から、現実世界の文脈を表すべきであることを意味している。
正しい文脈があってこそ、モデルから正しい推論、解釈、予測ができるのである。初期のモデルの焦点は、薬物とタンパク質を薬物標的ネットワークの形で関連付けることであり、タンパク質-タンパク質相互作用ネットワークは、薬物の作用機序を解釈するための基本的なモデルとして使用されていた[582]。
興味深いことに、これらのモデルはまた、システム薬理学のパラダイムの重要な側面も明らかにした。この概念は、ネットワークモデルにおける薬物標的のトポロジカル解析により、化合物が複数の標的に結合することを実証したため、創薬段階での新薬設計における単一標的アプローチを変えた。
その結果、薬剤はオフターゲットとして知られる追加のターゲットにヒットし、副作用を引き起こすことになる。Campillosら(2008)は、多くの疾患適応症にまたがるすべての承認済み医薬品の副作用表現型情報が豊富な薬物-薬物および薬物-標的ネットワークを使用し、副作用の類似性に基づいて新規の薬物-標的関係を予測し、実験的に検証した[584]。このアプローチにより、研究者は前臨床環境において候補薬のオフターゲットとそれに伴う可能性のある副作用を予測することが可能となる。
いわゆる構造系薬理学は、薬物候補によるタンパク質、DNA、RNAを含むゲノム高分子のエネルギー的、動的な修飾をモデル化することを目的としている[585]。この戦略は、Nikolicら(2016)によって実施され、その化学構造に基づいていくつかの抗神経変性化合物のプライマリーターゲットとオフターゲットの両方のプロファイルを予測した[586]。
彼らの分析は、複数のターゲットにヒットし、アセチルコリンエステラーゼ、ブチリルコリンエステラーゼ、モノアミン酸化酵素AおよびBを阻害する新規化合物を、アルツハイマー病の病態生理の文脈で同定する結果となった。
さらに、中枢神経系薬剤が他の薬剤とどのような特性を持っているかを知ることで、薬剤設計者は、副作用が少なく、最高の効果をもたらす新薬候補の中から、それらの特性を選択することができるようになる。この目的のために、Shahidら(2013)は、80%の精度で非神経変性医薬品から神経変性医薬品を識別し分類する計算手法を開発した[587]。
DrugGenEx-Netは、薬物-標的、疾患-標的、経路-標的、標的-標的相互作用の多層ネットワーク解析に基づいて、疾患特異的な薬物ポリファーマコロジーを予測する計算プラットフォームである[588];このモデルにより、腎細胞がんの承認薬であるスニチニブが、アルツハイマー病経路に関連する複数の標的にヒットするため、再利用を検討できることが明らかになった。
システムバイオロジー・マークアップ言語(SBML)やオープン・バイオロジカル表現言語(Open Biological Expression Language)などのシステムバイオロジー・モデリング言語の進歩により、遺伝子型から表現型のスケールまでをカバーする様々なタイプの生物学的実体を含むことで、単純なタンパク質-タンパク質相互作用の表現を超えて、薬物の作用機序を文脈に応じた豊かな環境で調べることができるようになった。
例えば、藤田ら(2014)は、パーキンソン病の主要なシグナル伝達経路を含むパーキンソン病の包括的な分子相互作用マップを開発し、SBML形式でモデル化して提示したが、彼らのモデルには薬物情報は含まれていなかった[589]。AlzPathwayは、文献からアルツハイマー病関連のシグナル伝達経路を系統的に収集し、SBMLで表現された細胞性アルツハイマー病シグナル伝達経路の最初のマップにそれらをまとめようとした初期の取り組みの結果である[590]。
最近、Iyappanら(2016)は、ヒト神経変性疾患に関与していると報告されているすべてのシグナル伝達経路を同定し、それらをヒト脳上の対応する解剖学的部位にマップし直し、アルツハイマー病承認薬であるラサギリンの作用機序を説明するためにこれらの経路を使用した[591]。
過去数年の間に、一方では大量のデータや知識が利用可能になり、他方では新たな計算生物学的手法が登場したことで、IDMのフレームワークは学術研究グループや製薬研究グループによってますます注目されるようになってきている。このアプローチによって生成されたモデルは、データ駆動型モデルと知識駆動型モデルを一つの統合モデルに統合し、原因と結果の関係を持つシグナル伝達経路を表現するものである[23]。
しかし、このアプローチの大きな課題は、様々なデータソースから得られる異種データセットや情報の統合である。例えば、アルツハイマー病NIは、アルツハイマー病およびMCI被験者からの遺伝学的およびバイオマーカーデータと共に大きな神経画像データを提供している[592]。
予測モデルに統合された場合、アルツハイマー病NIのデータはアルツハイマー病治療薬の研究に最大の影響を与える。しかし、IDMへの最初のステップは、それらが意味的に互換性があるように、異なるデータセットの標準化と調和である。オントロジーは、多様なデータセットの標準化と調和のための参照を提供する意味的なフレームワークである。例えば、アルツハイマー病オントロジー(アルツハイマー病O)は、アルツハイマー病知識領域のためのそのような参照を提供するために開発されてきた[593]。
アルツハイマー病Oは、Kodamullilら(2015)によって、科学的知見を計算可能なアルツハイマー病病理の因果関係モデルで表現するために使用されたが、これはOpen Biological Expression Language(http://openbel.org/ で利用可能)で設計され、コード化されたものである[594]。このモデルは、生体分子、経路、臨床結果の間の因果関係と相関関係を含んでおり、アルツハイマー病と2型糖尿病の併存率分析のための遺伝的変異データのモデルガイド付き解釈に使用された。
同様に、これらのモデルを用いて、薬物-標的相互作用や薬物の作用機序を調査し、予測することができる。実際、ゲノムからフェノームまでのデータを、細胞から臨床結果に至るまでの生物学的スケールで網羅した統合モデルは、適切な病態生理学的文脈の中で、またヒト生物学の多次元空間の中で、候補薬の作用様式を予測することを可能にしている。
おそらく、この分野で最も基礎的な研究の一つは、脳の化学空間を系統的に分析し、アルツハイマー病におけるリポジショニングのための薬物候補を同定したEmonら(2017)の研究である[595]。
彼らはまず、神経変性の文脈で遺伝子、タンパク質、薬物や化学物質、生物学的プロセス、疾患概念を含む大規模なモデルをBELで生成した。そして、このモデルのメカニズム解析により、ドネペジルを筋萎縮性側索硬化症の再利用候補として提案しただけでなく、筋萎縮性側索硬化症で使用される薬剤であるリルゾールが、アルツハイマー病におけるいくつかの生理的経路を阻害することが予測できる作用機序を発見した。
さらに、このモデルを用いたアルツハイマー病における他の薬剤の作用機序解析により、承認されている5種類のアルツハイマー病治療薬と共通の標的を持つ関節リウマチ治療薬であるシクロスポリンが神経保護効果を発揮することが予測された。抗アルツハイマー病作用を実験的に証明したいくつかの証拠が、この予測を裏付けていた。
現在、いくつかのイニシアチブが、一般的な神経変性疾患と特にアルツハイマー病の分野でのシステム薬理学的研究を促進するための努力を引き受けている。イノベーティブ・メディシン・イニシアティブ(Innovative Medicine Initiative)の資金提供を受けたAETIONOMYプロジェクト(http://www.imi.europa.eu/)では、すでにアルツハイマー病とパーキンソン病に焦点を当てた神経変性疾患の専門知識ベースを構築し、統合的なモデル化アプローチにより、アルツハイマー病とパーキンソン病患者を層別化するメカニズムのシグネチャーを計算で予測し、臨床的に検証している(http://www.aetionomy.eu/)。
このプロジェクトの使命は、患者のサブグループをターゲットとした新薬開発の基礎を築き、個別化医療を推進することである。Brain Health Modeling Initiative (BHMI) は、統合的なメカニズムベースの計算モデルとビッグデータを用いたシミュレーションを活用したもう一つのプロジェクトで、アルツハイマー病における最適な薬物設計のために適切なターゲットとバイオマーカーをマッチングさせることを目的としている[596]。
欧州委員会が資金を提供しているプロジェクトSysPharmアルツハイマー病は、「オミックス」データと病期別の臨床データを組み合わせた統合的ネットワークモデルを使用して、アルツハイマー病における新規治療薬の発見にシステム薬理学的アプローチを提案している。
このプロジェクトの目的は、研究者が疾患経路を修飾する相乗効果のあるマルチターゲティング化合物を同定するのに役立つアルツハイマー病ステージングに基づくシステムファーマコロジー戦略を設計し、検証することである(http://cordis.europa.eu/project/rcn/185567_en.html)。
結論
アルツハイマー病を含むすべての神経変性疾患の多次元的な性質は、その発症と進行が細胞内と細胞外の両方のレベルで進行する制御異常プロセスから生じるという事実とともに、これまでに十分に確立されている。
細胞レベルでは、神経変性疾患は機能の喪失と最終的には細胞死につながるジストロフィー性の神経細胞の構造変化によって特徴づけられる。これらの現象は「細胞間」で広がり、神経細胞内のタンパク質の誤形成が、病原性タンパク質の凝集体を自己増殖させることで、近くのニューロンの構造可塑性に影響を与える。この結果、樹状突起やシナプス部位の密度が低下し、最終的には脳の接続が失われる。
細胞レベルおよび分子レベルでは、中核となる病態生理学的現象は、タンパク質のミスフォールディングおよび凝集から、クリアランスの減少、ミトコンドリア機能不全、細胞恒常性の喪失、およびその結果として、アポトーシスに関連する細胞シグナル伝達経路の増強に至るまでの、プロテオスタシス細胞経路の障害[597、 598]によって表される。したがって、神経変性疾患は最初に、ニューロンやグリア細胞の解剖学的・生理学的基盤となる細胞内フレームワークのいくつかの変化を特徴としている。
ゲノムは、内因性因子と外因性因子との相互作用を通じて、プロテオームとメタボロームのレベルで、細胞内と細胞外の両方の完全性を説明していることは疑いの余地のないほどの幅広い変動をもたらする。
その結果、システム生物学とシステム神経生理学のパラダイムは、構造的・機能的ネットワークが異次元レベルで動的に相互接続され、健康や疾患における自律神経系のような末梢枝にも顕在化することがすでに確認されているマルチスケールの動的システムを説明する概念モデルを提供することができる[599、 600]。
現在、神経変性疾患を特徴づける上述の相互作用する多次元レベルを生体内試験(in vivo)で同定するために、信頼性の高いバイオマーカーを多数同定することが急務となっている。このようなバイオマーカーは、複雑な脳の病態生理学的メカニズムの時空間の軌跡をチャート化し、同時に個人間の変数を考慮に入れる必要がある。
複雑で時間的に変化する高次の統計量や構造モデルもまた、システム神経生理学的なモデリングアプローチの中で考慮されるべきである[601-604]。神経変性疾患の基礎となる病態生理学的メカニズムを追跡するためには、病態生理学的バイオマーカーが必要である(図8)。例えば、脳アミロイド-PETは、神経炎プラークの新皮質沈着の従来のバイオマーカーではなく、Aβ代謝障害の分子プロキシとして一般的に考えられている。
この文脈では、バイオマーカーは、既に実証され、現在、腫瘍学の分野で実践されているように、受容体仕立ての薬剤を開発するための適切なツールである。構造的な脳マーカーと機能的な脳マーカーの両方が、臨床表現型と分子的な病態生理学的メカニズムの間のリンクを解明することが期待されている。
図8
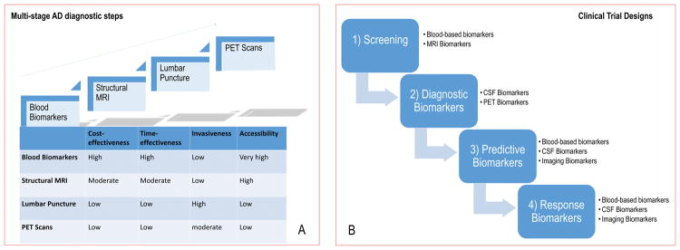
進化するバイオマーカーとモダリティのスペクトル
A. 理想的なバイオマーカーは、低侵襲、非侵襲、実用的、迅速、信頼性が高く、必要とされる専門知識のレベルが低いものでなければならない。したがって、臨床現場では、4つのステップ(血液バイオマーカー、構造的MRI、腰椎穿刺、PETスキャン)に沿った多段階の診断ワークアウトで、費用対効果、時間対効果、侵襲性、アクセス性の総合的なバランスに応じて、バイオマーカーを評価する必要がある。B. バイオマーカーは治療を調整するための一つの戦略である。神経変性疾患の理想的なマーカーは、スクリーニング、診断、疾患の進行、治療に対する反応のモニタリングに導入することができる。したがって、臨床試験では、バイオマーカーはいくつかの目的で使用することができる。
1) 試験の対象となる人、すなわち神経変性疾患のリスクが高いと考えられる人を特定すること(スクリーニング・バイオマーカー)。
2)臨床診断(診断マーカー)を導くためのもの。
3) 治療の意思決定を最適化するために、与えられた薬剤に対する反応の可能性に関する情報を提供する(予測的バイオマーカー)。
4)を検出し、治療に対する反応率(反応マーカー)を定量化する。
略語。MRI、磁気共鳴画像法、PET、ポジトロン断層撮影法、神経変性疾患、神経変性疾患。
特に、脳18F-FDG-PETは、アルツハイマー病やその他の神経変性疾患の臨床試験で予後の指標として一般的に使用されている。実際、特定の脳機能またはネットワークの早期回復は、臨床的利益を測定する前であっても、疾患治療の下流効果を識別するために非常に重要である。
別の例として、非侵襲的イメージングから脳のバイオマーカーをより個別に調整した精密医療ベースのアプローチで特定するという文脈では、最近の開発で「個々の脳の密なサンプリング」の概念と付加価値が指摘されている[605-607]。この興味深い発展は、研究の大部分が個人間の神経画像データを平均化することに慣れており、したがって、暗黙のうちに高度な機能的相同性を前提としているが、定義上は、この相同性が分解されるより細かいスケールが存在しなければならないという認識に基づいている。
比較的少数の脳を数時間サンプリングすることで、著者らは、よく知られているネットワーク、例えばデフォルトモードやサリエンスネットワークにおける個人差がどのように明確に見えるかを実証している。したがって、今後のニューロイメージングの開発は、個々の脳や患者のサンプリングをより長く(数時間/日)行う方向にシフトしていく可能性があり、それによって神経変性疾患を理解するために必要とされるであろう「精密神経科学」のパラダイムを実装するためのより強固な基盤を提供することができる。
興味深いことに、機能的および地形的バイオマーカーもまた、適切な標的を特定するために使用することができる。特に、これらのバイオマーカーは、標的とする神経調節の試験の可能性がある特定の脳領域を検出する上で有用であり、その結果、局所的な萎縮、接続性の低下、代謝変化、および脳血流の局所的な低下に関する包括的な情報を提供することができる。
最後に、臨床検査と完全な心理学的評価の両方が、診断ワークアウト全体をサポートする病理学的表現型を識別するための第一のアプローチであることに変わりはない。例えば、現在までのところ、海馬様無気力障害の同定は、アルツハイマー病の臨床診断をサポートし、抗コリンエステラーゼ阻害剤をベースとした治療を正当化している。
注目すべきは、システム生物学およびシステム神経生理学に基づいた神経変性疾患表現型の解釈の文脈では、臨床マーカーは疾患の最高レベルの「記述子」とみなされるべきであり、効果的な治療法を特定するための究極の手段である。
要約すると、システム生物学とシステム神経生理学のパラダイムの将来の実装-ビッグでディープな異種データソースの統合的な分析に基づいて-は、アルツハイマー病や他の神経変性疾患の病態生理のより深い理解に到達するために非常に重要になる。
今後の主な課題は、保存された大量の実験室や臨床データを処理することができる分析アプリケーションの開発にあることは間違いないであろう。このような背景から、前臨床および臨床記録から抽出できる情報を最大限に活用し、最終的にはアルツハイマー病発症の基礎となる分子、細胞、およびシステムのプロセスに関する我々の知識を増強するために、ビッグデータアプローチを活用する必要がある。アルツハイマー病におけるバイオマーカーの動態と縦断的な変化を解明することで、疾患の自然経過の全体的な理解に向けてさらなる一歩を踏み出すことができるであろう。
さまざまな情報源を統合することで、研究者は、分子変化から認知症状に至るまでの疾患の病態生理学的プロセスの新たな統合的な画像を得ることができるようになる。このシナリオでは、オバマ前政権が「ビッグデータはビッグディール」をモットーに推進した「ビッグデータ研究開発イニシアティブ」(https://obamawhitehouse.archives.gov/blog/2012/03/29/big-data-big-deal)が、アルツハイマー病の精密医療新時代に向けて進展を加速させることが期待されている。この究極のミッションは、ビッグデータを集め、リンクさせ、調和させることで、インパクトの高い、学際的、共同研究の取り組みを促進することで達成される。
アルツハイマー病における10年間の臨床試験の失敗を経て、国際的なアルツハイマー精密医療イニシアチブによるIDMの理論的枠組みの中での「ビッグデータサイエンス」の採用により、私たちは変革的な研究シナリオに入ることができた。現在、精密医療は、すべてではないにしても、今後の予防と治療の進歩のほとんどを支えるものと期待されている。
アルツハイマー病やその他の神経変性疾患の初期段階の理解における重要なブレークスルーと、新しい検査技術の急速な出現は、最も早い前臨床無症状段階でのアルツハイマー病の自然史に大きな影響を与える前例のない機会を提供している[608]。
我々は現在、認知症状が明らかになる前に疾患の発症を促進する分子および細胞イベントを徹底的に探求する新たなフロンティアの端に立っている。精密医療を通じて開発された新しい予防的アプローチや治療法は、すべての利害関係者のコンプライアンスや信頼度の向上につながり、失敗の数を減らすことができるかもしれない。このような中で、従来の「ワンサイズフィット-魔法の弾丸療法」というシナリオから、個別化された精密医療をベースとしたアプローチへの迅速な移行が期待されている。
アルツハイマー精密医療イニシアチブによって推進された前例のない努力は、最終的には、大規模な、国際的な、学際的な共同学術、民間、産業界のネットワークに支えられたアルツハイマー病研究のパラダイムシフトを実装するために調整されている。
精密医療の分野は、臨床導入に向けて迅速に前進している熱心で献身的なパイオニアに欠けているわけではない。アルツハイマー精密医療イニシアチブによってサポートされているエビデンスベースが拡大するにつれ、個々の患者、医療システム、社会全体の利益のために、このプロセスを加速させるために、より多くのことができるようになり、また、そうすべきである。
略語
18F-FDG-PET 18F-2-フルオロ-2-デオキシ-D-グルコースPET
Aβ42 42-アミノ酸長アミロイドβペプチド
アルツハイマー病 アルツハイマー病
ADD アルツハイマー病 認知症
アルツハイマー病NIアルツハイマー病神経イメージング・イニシアチブ
アルツハイマー病O アルツハイマー病オントロジー
アルツハイマー精密医療イニシアチブ アルツハイマー精密医療イニシアチブ
アルツハイマー精密医療イニシアチブ-CP Alzheimer Precision Medicine Initiative コホートプログラム
APPアミロイド前駆体蛋白質
BFCS 前脳基底部コリン作動系
脳脊髄液
DBS深層脳刺激
DLB レビー小体を伴う認知症
ディフュージョンテンソルイメージング
脳波脳波検査
EHRs 電子カルテ
EPAD病 European Prevention of Alzheimer’s Dementia consortium.
EPAD病 LCS EPAD病縦断的コホート研究
EPIエコープレーナーイメージング
FAフラクショナル異方性
FMRI機能的磁気共鳴画像法
FTD 前頭側頭型認知症
ICNs 内在的コヒーレントネットワーク
IDM 統合的疾患モデル化
エムシーアイ
MD平均拡散率
MEG脳磁図法
MMNミスマッチネガティブ
エムアールアイ
神経変性疾患神経変性疾患
NFL神経線維層
ピータウ高リン酸化タウ
ノルド正常高齢者対象
パーキンソン病によるPDD認知症
PET陽電子放射トモグラフィー
精密医療 精密医療
精密医療I プレシジョン・メディスン・イニシアチブ
PoC概念実証
RGC網膜神経節細胞
関心領域
RTMS反復性経頭蓋磁気刺激
SBMLシステム生物学マークアップ言語
SPECT 単一光子放出計算トモグラフィー
t-タウ総タウ
TACSS経頭蓋交流刺激法
TDCS経頭蓋直流刺激
WB-MRI 全身磁気共鳴イメージング
WES全ゲノムシークエンシング
WGS全ゲノムシークエンシング
WM白質。
ソルボンヌ大学臨床研究グループ(GRC n° 21
“アルツハイマー精密医学(アルツハイマー精密医学)”
科学技術分野の公共機関 (E.P.S.T.)
アルツハイマー病精密医療イニシアチブ(アルツハイマー精密医療イニシアチブ)
