Contents
Potential Interplay between Nrf2, TRPA1, and TRPV1 in Nutrients for the Control of COVID-19
pubmed.ncbi.nlm.nih.gov/33567446/
2021年2月10日
要約
本論文では、COVID-19の罹患率の違いは、一過性受容体電位アンキリン1(TRPA1)および/または一過性受容体電位バニロイド1(TRPV1)の活性化および脱感作と関連している可能性を示唆している。
TRPA1およびTRPV1は炎症を誘発し、ほとんどすべての臓器の生理学において重要な役割を果たしている。これらは、痛みおよび咳、鼻閉、嘔吐、下痢、および少なくとも部分的には、突然の重度の嗅覚および味覚の喪失を含むCOVID-19のいくつかの症状を誘発するために、感覚神経または迷走神経の放電を増強することがある。
TRPA1は活性酸素種によって活性化され、したがって、COVID-19においてアップレギュレートされている可能性がある。
TRPA1およびTRPV1チャネルは、多くの核内因子(赤血球由来2)(Nrf2)と相互作用する食品を含む刺激性化合物によって活性化され、チャネルの脱感作につながる。Nrf2と関連する栄養素とTRPA1/TRPV1との間の相互作用が、COVID-19の症状の重症度の一部に関与している可能性がある。
TRPA1/TRPV1のNrf2による調節はまだ不明であるが、非常に限られた臨床的証拠から示唆されている。COVID-19では、食品中のいくつかの成分によってTRAP1/TRPV1を迅速に脱感作することで、症状の重症度を軽減し、新たな治療戦略を提供できる可能性が提案されている。
序論
一過性受容体電位(TRP)バニロイド1(TRPV1)とアンキリン1(TRPA1)は、構造的に関連した非選択的なカチオンチャネルであるTRPスーパーファミリーのメンバーである。TRPV1とTRPA1は、感覚ニューロンに頻繁に共局在し、機能を調節するために相互作用している。TRPV1とTRPA1は、サブスタンスP、CGRP、神経成長因子受容体などの神経ペプチドと共局在し、ブラジキニン、ヒスタミン、エイコサノイドなどの様々な炎症性メディエーターに対して低い閾値を持っている。また、血管平滑筋、単球、リンパ球、ケラチノサイト、上皮細胞、内皮など多くの非神経細胞でも発現している[1]。
TRPA1は、もともと感覚ニューロンのマスタードオイルの受容体に関連する興奮性イオンチャネルである[2]が、システイン反応性の刺激物質を検出し、痛みや咳を誘発するための感覚神経または迷走神経の放電を増強する上で重要な役割を果たしている。TRPA1 は炎症を誘導し、ほぼすべての臓器の生理機能に重要な役割を果たしており [3]、酸化物質に対する TRP の感度が最も高いことを示している。TRPA1は、寒さ、熱、刺激性化合物、機械的刺激、炎症の内因性シグナル、酸化ストレスなどによって活性化される[4]。その機能は、Ca2+、微量金属、pH、活性酸素種(ROS)窒素、カルボニル種を含む複数の因子によって調節される。
カプサイシン受容体としても知られるTRPV1は、体温の検出と調節に主要な機能を持っている[5]。TRPV1は、熱と痛みの感覚(侵害受容)を提供する。一次求心性感覚ニューロンでは、TRPV1はTRPA1と協働して有害な環境刺激の検出を媒介する [6]。また、内因性脂質由来分子、PGE2,酸性溶液、刺激性化学物質、カプサイシンなどの食品成分、毒素によっても活性化されることがある[7]。TRPV1は酸化ストレスのセンサーであるが、TRPA1よりも少ない程度である。
COVID-19の罹患率は、共通の評価方法がないため、国をまたいで評価することはできない。しかし、死亡率はCOVID-19の重症度を表す指標になるかもしれない。COVID-19の死亡率には大きな国差がある [8, 9]。死亡率が非常に低い設定の中には、東アジア、中央ヨーロッパ、バルカン半島、アフリカのように、大量の発酵野菜 [10] と、一部の国では香辛料を食べるという共通の特徴を持つものがある。スパイスの消費量とCOVID-19死亡率との間には逆相関があるようであり [11]、同じ国では発酵野菜とスパイスの消費量が多いことが多い [12,13]。
COVID-19に関連するすべての臨床症状に共通する分母は、酸化ストレスストームであるようである[14]。発酵野菜の摂取は、核内因子(赤血球由来2)(Nrf2)様抗酸化転写因子の活性化と関連している[10,15,16]。インスリン抵抗性、内皮障害、肺障害、サイトカインストームを減少させるように同様の作用をする多くのNrf2と相互作用する栄養素[17](ベルベリン、クルクミン、エピガロカテキンガレート、ゲニステイン、ケルセチン、レスベラトロール、およびスルフォラファン)が存在する(Bousquetら[10]、提出された)。Nrf2と相互作用する食品および栄養素がインスリン抵抗性の再バランスをとり、COVID-19重症度に有意な影響を及ぼすことが提案されている[10, 18-20]。しかし、辛味のある食品や香辛料がTRPA1およびTRPV1を介して相互作用することから、他のメカニズムも関与している可能性がある[21]。TRPチャネル(TRPV1,TRPV4,TRPM3,TRPM8,TRPA1)の活性化は、ニューロン、免疫細胞、上皮細胞間のクロストークを可能にし、広範囲の炎症作用を制御する[22]。
本論文では、
- TRPA1および/またはTRPV1がCOVID-19の症状および罹患率と関連している可能性
- (TRPA1および/またはTRPV1がCOVID-19の危険因子(肥満および糖尿病)肺損傷および内皮損傷に関与している可能性
- TRPV1がCOVID-19におけるTRAP1と関連している可能性
- 人体で最も強力な抗酸化系であるNrf2がTRPA1および/またはTRPV1を調節している可能性
- Nrf2と相互作用する栄養素がTRPA1および/またはTRPV1に作用している可能性
- グルコラファニンを含むブロッコリー種子カプセル(ブロッコリー)で治療した3つの臨床例の結果は、TRPA1および/またはTRPV1によって説明される可能性
があるかどうかを検討した。
TRPA1/TRPV1およびCOVID-19
COVID-19 症状
COVID-19のいくつかの症状はTRPA1および/またはTRPV1と関連している
咳はCOVID-19の主要な症状であるが[23]、必ずしも重症度とは関連していない。咳反射は、気道感覚神経とバニロイド(TRPV)ファミリーに関連するTRPイオンチャネル、およびTRPA1の活性化によって誘導される[24-26]。TRPA1は、気道全体の粘膜に豊富に発現している。これらには、三叉神経節および迷走神経節のC線維だけでなく、鼻、気管、気管支、気管支、肺胞上皮細胞、気管支平滑筋細胞およびCD4+ T細胞が含まれる[27]。C線維は、主に、毒性を持つ可能性のある吸入刺激物や毒性物質の存在を「感知」する。TRPA1は、吸入された酸化剤[28]、大気汚染物質、およびタバコの喫煙[29]によって誘導される気道刺激および反射応答へのゲートウェイを表す。カプサイシンは、有害な刺激に反応する感覚神経の気道粘膜TRPV1受容体に関連した咳誘発試験で主に使用されている[24]。TRPA1とTRPV1の両方が、酸化ストレス、炎症、ミトコンドリア損傷の調節を介して気管支および肺胞上皮細胞のタバコの煙草誘発性損傷を媒介する[30]。このことは、急性および慢性気道炎症におけるTRAP1およびTRPV1の複雑な制御的役割を示唆している[31]。
においや味覚障害はCOVID-19では非常に一般的である[32-37]。TRPA1とTRPV1は侵害受容に関与するTRPチャネルの一つであり、刺激臭物質によって興奮する[38]。TRPA1の遺伝子変異と熱痛刺激に対する感受性の増加または嗅覚感受性の増加との間に関連が観察されている[39]。カプサイシンはまた、感覚(嗅覚)と敏感な知覚(三叉神経)が一緒になることで、嗅覚と味覚の知覚にも部分的に関与している[40]。さらに、ほとんどの臭気物質は敏感な(三叉神経)特性を持っており、これは強い臭気物質に対する鼻の過敏反応と関連している(中鼻炎を持つ患者によって「オーバーオスミア」として識別されることもある)。鼻腔内三叉神経系は、嗅覚と味覚に加えて第三の化学感覚である。鼻腔内では、TRPV1およびTRPA1について高レベルの三叉神経受容体発現が認められた[38]。鼻腔内三叉神経系の化学物質に対する感受性は、TRPA1によって部分的に媒介されていることが判明した [41]。哺乳類の味覚系は、口腔内にある味蕾で構成されている。TRPチャネルは味覚処理において重要である [42]。TRPチャネルは温度の変化に非常に敏感で、植物に含まれる多くの化合物によって活性化され、しばしば香辛料として使用される[43]。TRPA1はほとんどが酸を感知する上皮ナトリウムチャネルである[44]が、TRVP1は温度や苦味にも敏感である[45]。
食欲不振は一般的であり[46]、COVID-19では重症化することがある。TRPA1が食物摂取および満腹感に役割を果たしている可能性が示唆されている[47-50]。動物では、TRPA1の活性化は食欲を増加させる[51]。TRPV1は、食欲ホルモンレベルの制御または消化管迷走神経伝達シグナルの変調を通じて食欲に影響を与えうる[52]。
鼻閉塞だけでもCOVID-19では比較的一般的である。2件の研究では、鼻閉塞が頻繁に報告されたが、嗅覚機能障害とは相関しなかった[53,54]。鼻炎では、鼻のかゆみはTRPV1と関連している[55]。鼻炎の患者は、TRPA1アゴニストであるアリルイソチオシアネート(AITC)に対する閾値の低下を示す。これは症状と相関し、動物では、鼻の感覚神経の化学的破壊の後に解決される [56-58]。カプサイシンは、非アレルギー性鼻炎の治療の選択肢の一つであることが判明した[59]。
吐き気、嘔吐、および/または下痢は、COVID-19の比較的一般的な症状である[46]。TRPA1は、胃を支配する背側根神経節および結節神経節ニューロンの両方で発現しているだけでなく、胃壁の神経線維でも発現している。TRPA1アゴニストであるアリシンを含むニンニク粉末を胃に投与すると、健康な被験者において特異的な胃上症状と胃弛緩が誘導される[60]。カプサイシンは、TRPV1を介して胃食道および腹痛、胸やけ、膨満感、および/または消化不良を誘発しうる[61-63]。
COVID-19は、しばしば筋肉痛、腰痛、広範囲の痛覚過敏、および頭痛と関連している[34,64]。TRPA1およびTRPV1は、急性および慢性疼痛および片頭痛に関与している [3, 65, 66]。これらはまた、COVID-19の症状の一部にも関与している可能性がある。発熱や疲労などの他のCOVID-19症状のいくつかは、TRPA1および/またはTRPV1と関連している可能性は低いようである。
COVID-19の危険因子、TRPA1およびTRPV1
肥満および、より少ない程度ではあるが糖尿病は、COVID-19重症化の危険因子である。メタボリックシンドローム、肥満および糖尿病におけるTRPA1の重要性は、通常、TPRA1およびTPRV1を含む複数の作用を有するアゴニストを用いた間接的なものである。そのため、2つのTPRチャネルを区別することは困難である。メカニズムをより正確に評価するためには、動物モデルが重要である[67, 68]。
TRPV1およびTRPA1は、体重、膵臓機能、ホルモン分泌、熱発育、および神経細胞機能の制御と関連している。これは、肥満および糖尿病におけるこれらのチャネルの潜在的な治療的価値を示唆している[69,70]。(シナモンの)シナマルアルデヒドは、糖尿病とその合併症の治療における補助的な将来の潜在的な役割を持っている可能性がある[12]。ニンニクサプリメントは、血糖値、総コレステロール、および糖尿病の管理における高/低密度リポタンパク質の調節において、肯定的かつ持続的な役割を果たしている[71]。しかしながら、これらの効果は、複数の経路によって媒介され得る。一例として、シンナムアルデヒドは、TRPA1-グレリン[72]およびNrf2を含む複数のシグナル伝達経路[70]への作用を通じてその効果を発揮する。
肺損傷
急性呼吸窮迫症候群は、COVID-19に関連した死亡原因の主要なものの一つである。TRPイオンチャネルは肺損傷に関与している。罹患率、疾患の重症度、および死亡率につながる基礎となる生理学的イベントは、肺のTRPV1発現ニューロン系(求心性/求心性ニューロン)と密接に関連していることが提案されている[73]。TRVP1およびTRPV4は、肺の化学的傷害に関与している[74]。マウスの急性肺損傷モデルでは、細菌性エンドトキシンLPSはTRPV1とTRPA1の両方に関与している [31, 73, 75]。人工呼吸器誘発性肺損傷は、炎症を増加させることにより、急性肺損傷患者の死亡率に寄与する。ラットの人工呼吸器誘発性肺損傷モデルでは、TRPA1阻害剤は肺組織の炎症と活性酸素の発生の両方を有意に減少させた [76]。アクロレインなどの不完全燃焼中に生成される不飽和アルデヒドは、肺にとって非常に有毒である。TRPA1はマウスの高レベルのアクロレイン誘発毒性から保護する[77]。TRPA1とTRPV1のそれぞれの選択的アゴニストによる同時活性化は,単独のアゴニストを単独で投与するよりもはるかに効果的である[78].マウスモデルでは、TRPV1とTRPA1の新規阻害剤であるリクイチンが、LPS誘発性急性肺障害から保護している[75]。TRPA1は、心不全、心筋虚血再灌流傷害、心筋線維症、肺損傷を悪化させる不整脈の発生および進行に関与している可能性がある[79]。
TRPA1/TRPV1およびNrf2
TPRA1/TRPV1は複数の酸化ストレス生成物の感覚受容体である
酸化ストレスは、酸化剤と抗酸化剤の間で酸化剤に有利なバランスが崩れることによって特徴づけられ、レドックスシグナルと生理機能の破綻をもたらす。レドックスシグナルによる変化は、活性酸素および反応性窒素種(RNS)によって行われる[80]。活性酸素は、スーパーオキシド(O2∙-)、過酸化水素(H2O2)、ヒドロキシルラジカル(OH∙)、一重項酸素(1O2)、ペルオキシルラジカル(LOO∙)、アルコキシルラジカル(LO∙)、脂質ヒドロペルオキシド(LOOH)、次亜塩素酸(HOCl)、オゾン(O3)などを含む総称である[81]。
TRPA1はまた、活性酸素によって活性化され、酸素レベルの細胞内変化の発生によって調節されるセンサーとして機能する。酸化ストレスの間に生成された複数の薬剤は、感覚ニューロンで発現しているTRPA1を活性化させることができる [82]。活性酸素以外にも、一酸化窒素(NO)を含むRNSによってTRPA1チャネルが活性化される[83]。多くの研究が行われているが、TRPA1活性化と酸化ストレスにおける細胞シグナルとの関連性はまだ不明である[84]。上気道および下気道では、低酸素状態に反応する迷走神経の感覚終末に見られるTRPA1が、異常な酸化状態の際に迅速な警報システムとして機能する可能性がある[84]。
TRPA1およびTRPV1とROS産生との間の潜在的なリンクは、慢性疾患において提案されている。内皮細胞では、TRPV1の刺激は内皮NO合成酵素(eNOS)[85]とNO産生を活性化し、平滑筋の弛緩と血管拡張をもたらし、それに伴って白血球の癒着から内皮細胞を保護する。血管平滑筋細胞では、カプサイシンは、ATP結合カセットトランスポーターA1の発現増加とLDL関連タンパク質1の発現低下を介して、Ca2+、カルシニューリン、プロテインキナーゼA依存性の方法で脂質の蓄積とコレステロールの取り込みを減少させる[86]。生体内試験モデルでは、食事性カプサイシン治療は、動脈硬化性プラーク形成の原因となる炎症性イベントを減少させることにより、動脈硬化を改善する。経口カプサイシン治療では、心臓または血管内のTRPV1受容体に直接作用するために必要なカプサイシンの血中濃度の上昇を引き起こすことができないため、遠隔的な活性化が示唆されるべきであり、これはカプサイシンに感受性のある感覚神経末端に局在するTRPV1受容体が関与している可能性が高い[87]。実際、実験的証拠は、感覚神経ペプチドの放出を介した心筋保護における心臓カプサイシン感受性求心性および感覚TRPV1受容体の保護的役割を提案している[88]。全身にカプサイシンを慢性的に投与すると感覚の脱感作が誘導され [89]、駆出率が保存された心不全(HFpEF)のモデルが導かれる。メカニズム的には、この表現型は、心臓の充填特性の障害を伴う心臓基底部NO、スーパーオキシド、ペルオキシナイトライト(ONOO-)形成の減少によるものである。心機能に対するカプサイシン感受性神経とTRPV1受容体の保護的役割が示唆されている。
炎症性機序や有害物質の吸入に伴う気道の酸化ストレスは、細胞機能障害を引き起こす。酸化ストレスは迷走神経の感覚C線維を活性化し、神経活動電位を開始させ、不快な感覚(咳、呼吸困難、胸の締め付け感など)や反射神経の刺激・変調(咳、気管支収縮、呼吸数、吸気性駆動など)を中枢部に誘導する。TRPV1も役割を果たす可能性があるが、TRPA1には重要な役割がある [83, 90]。
核因子(赤血球由来2)
Nrf2は酸化物質に対する細胞抵抗性の主要な調節因子である。Nrf2は主にKelch-like ECH-associated protein 1によって制御されており、Nrf2の活性化は、構成的なメカニズムを介して、親電子性化合物と酸化ストレスによって行われ、Kelch-like ECH-associated protein 1の一部のシステイン残基が酸化される。この結果、Nrf2のユビキチン化が減少し、核内への移動と活性化が増加する。核内では、Nrf2は抗酸化防御に関与する様々な遺伝子を誘導する[91]。
Nrf2とTRPA1の相互作用
活性酸素によるTRPA1の調節には、Nrf2が大きな役割を果たしている可能性がある。しかし、Nrf2とTRPA1との相互作用を評価した研究はほとんどなく、その結果は時に相反するものである。肺虚血再灌流傷害の特定のシグナル伝達経路は、Nrf2抗酸化反応を障害し、脳幹の酸化ストレスを活性化させ、それにより、活性酸素を介して最も可能性の高いTRPA1の増幅につながる[92]。多硫化物(H2Sn)は脳内で発生し、TRPA1を活性化し、Nrf2の転座を促進する [93]。TRPA1のノックダウンは、マウスの虚血性再灌流傷害後の活性化マクロファージの浸潤、腎炎症、腎障害を悪化させる[94]。さまざまな動物モデルにおいて、神経保護が観察され、抗酸化シグナル伝達経路を介したNrf2経路の活性化と関連していることが示されている[95-98]。ヒト癌で過剰発現している神経細胞のレドックス感知Ca2+流入チャネルは、Ca2+依存性の抗アポトーシス経路をアップレギュレートして活性酸素抵抗性を促進する。Nrf2はTRPA1の発現を直接制御するため、酸化ストレスからの保護のための直交的なメカニズムを、通常のROS中和メカニズムとともに提供している[99]。
Nrf2とTRPV1の相互作用
Nrf2とTRPV1の相互作用を評価した研究はほとんどなく、その結果は時に相反するものである。カプサイシンは活性酸素の産生を誘導し、これはNrf2の活性化とヘムオキシダーゼ-1発現の誘導を誘導する可能性がある[100]。TRPV1の活性化は、Nrf2に反応する抗酸化酵素の発現の増加に関連したカルシウムの流入を誘導する[101]。紫外線照射は細胞の酸化ストレスを引き起こし、12-リポキシゲナーゼとその生成物である12-ヒドロキシエイコサテトラエン酸を刺激し、その後TRPV1を活性化する。TRPV1を介したCa2+の流入は、UVB照射によるNrf2の分解に関与している[102]。
TRPA1とTRPV1の活性化と脱感作
SARS-CoV-2の神経トロピズム
コロナウイルスは神経向性である。ヒト神経細胞におけるACE2の発現は、SARS-CoV-2の神経侵襲性を裏付けるものである[103-105]。ヒトの誘導多能性幹細胞由来の BrainSphere モデルでは、ACE2 が検出され、SARS-CoV-2 が複製されることが確認された [106]。嗅覚障害を評価する動物実験では、嗅上皮のustentacular細胞では ACE2 とプロテアーゼ TMPRSS2 が発現していたが、ほとんどの嗅覚受容体ニューロンではあまり発現していなかった [107]。これらの結果は、ウイルスの直接的な侵入、または上皮/内皮細胞の感染後のバイスタンダー傷害という二重のモデルを提案している[108]。
多くのNrf2と相互作用する栄養素はTRPA1およびTRPV1アゴニストである
TRPチャネルはポリモーダルチャネルであり、スーパーファミリーのメンバーのほとんどは、多数の刺激によって活性化される可能性がある[109]。いくつかのNrf2と相互作用する栄養素は、TRPA1の直接的な活性化因子である[21, 110]。これらには以下のものが含まれる。
- (i) アリルイソチオシアネート(AITC. (i)アリルイソチオシアネート(AITC:マスタード、ワサビ、ワサビの辛味成分 [2])
- (ii)シナモン由来のシナマルアルデヒド[70]、
- (iii)アリシン、ニンニク由来の有機硫黄化合物[111]、
- (iv)緑茶ポリフェノール[112 113]、
- (v)Sisymbrium officinale(イソプロピルイソチオシアネートおよび2-ブチルイソチオシアネート)またはMoringa oleifera(4-[(α-l-ラムノシロキシ)ベンジル]イソチオシアネート)からの3つのグルコシノレート[114, 115]。
などが挙げられる
AITCであり、最も強力な天然Nrf2活性化剤であるスルフォラファンは、TRPA1と相互作用するようには見えない。植物ポリフェノールのレスベラトロール[116]は、アゴニストまたはアンタゴニスト効果を有する可能性がある[117]。間接的なアゴニスト効果[118]は、生体内のN-メチル-D-アスパラギン酸受容体[119]を介して発見された。TRPA1は、N-メチル-D-アスパラギン酸受容体などのプロ侵害受容性イオンチャネルの下流ターゲットとして機能する可能性がある[120](表1)。
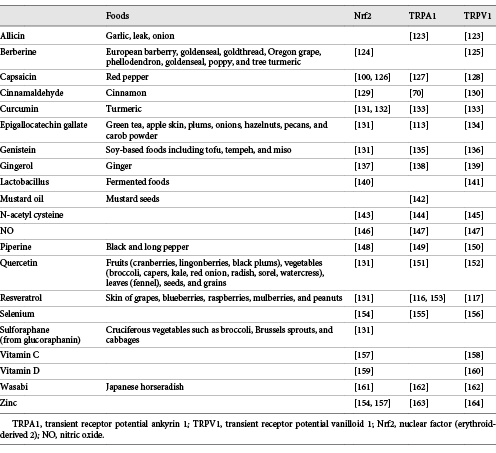
表1 Nrf2-、TRPA1-、およびTRPV1と相互作用する栄養素の例
多くのTRPV1アゴニストは、Nrf2および/またはTRPA1と相互作用する。TRPV1は、カプサイシン(赤唐辛子)ピペリン(黒唐辛子)ジンゲロール、ジンゲロン(生姜)タマネギやニンニクの辛味成分、オイゲノール(クローブ)カンファーなどの香辛料によって刺激されるセンサーである。TRPV1は、マスタード、ワサビ、ワサビに含まれるAITCによっても活性化され[121]、熱帯のユーフォルビア植物の毒素であるレニファーラトキシンによっても活性化される[122]。
TRPA1とNrf2の間には、親電子性リガンドの実質的な重複がある[21]。しかしながら、すべてのNrf2と相互作用する栄養素がTRPA1の活性化剤であるわけではない。例えば、マスタード油はNrf2と相互作用しないが、スルフォラファンはTRPA1またはTRPV1と相互作用しない。
TRPの脱感作
唐辛子や他の香辛料の辛味効果は、高用量または反復投与によって急速に減少する[21]。これは、唐辛子の有効成分であるカプサイシンについて初めて記述された[165]。TRPV1の脱感作がカプサイシンの逆説的な鎮痛効果の根底にある。TRPV1受容体は、一般的に脱感作と呼ばれる難治性の状態を開始し、受容体機能の阻害をもたらす [21]。TRVP1の急性脱感作は、バニロイドが初めて細胞に投与されてから最初の数秒(∼20秒)以内に起こる反応性の低下の大部分を占めている。カルシニューリン、カルモジュリン、またはホスファチジルイノシトール4,5-ビスフォスフェートの減少を含むいくつかのシグナル伝達経路がTRVP1の脱感作に関与している[166]。酸化ストレスはホスファチジルイノシトール4,5-ビスフォスフェート[167]を減少させ、受容体脱感作は、おそらくCOVID-19のアゴニストの低用量で得られるであろう。脱感作の別の形態は、バニロイドの反復適用に対する反応の低下である「タキフィラキシー」である[168]。
TRPA1は、感覚ニューロンにおけるCa2+非依存性およびCa2+依存性経路を介して、ホモログ(マスタードオイル;TRPA1アゴニスト)またはヘテロログ(カプサイシン;TRPV1アゴニスト)アゴニストによって脱感作される[169]。TRPV1経路を介したTRPA1の異種脱感作がある[170,171]。レスベラトロールまたはAITCは、TRPA1チャネルの活性化剤および脱感作剤として作用する[153]。高濃度のパラベンゾキノンを投与すると、TRAP1 の活性化が急速に進み、その後、システイン依存性の脱感作メカニズムで急速に低下した[172]。マウス単離腸におけるTRAP1の収縮効果は、AITCによって誘導される可能性がある。投与を繰り返すと脱感作が誘導される[173]。親電子性脂肪酸NO2-OAはTRPチャネルに作用し、最初に脱分極して感覚ニューロンの発火を誘導し、その後脱感作と発火の抑制が起こる[174]。NO2-OAはNrf2とNADPHオキシダーゼの抑制を介して細胞内酸化ストレスを減衰させる[175]。
データは時に相反するものであるが、TRPA1とTRPV1の間の相互作用は受容体の脱感作を調節することができる。パッチクランプ電気生理学を用いて、TRPA1とTRPV1の共発現と相互作用が、痛みに対する感覚ニューロンの差動感作に最も重要であることが証明された[176]。一方、選択的TRPA1アゴニスト(AITC)は、カプサイシンTRPV1チャネル(再感作TRPV1チャネル)に対する感度の回復をもたらした[177]。カプサゼピンによる実験的大腸炎の減衰(カプサイシン誘発性変性CPZ)は、TRPV1に対する拮抗作用に起因する。それはTRPA1の深い脱感作を介してその抗炎症効果を発揮する[178]。
ニコチンはTRAP1 [179]およびTRPV1 [180]を活性化する。COVID-19入院患者における喫煙の有病率は低い [181]。多くの異なるメカニズムが提案されているが、ニコチンによるTRPA1/TRPV1の脱感作が一つの可能性として考えられる。もしそうであれば、TRPA1/TRPV1が重度のCOVID-19に関与している可能性があることを示すことになる。
TRPA1またはTRPV1のような感覚受容体は、スパイスの摂取量を最適化する際のゲートキーパーとして機能する可能性があり、それによって過剰摂取を回避し、スパイシーな栄養補助食品の感覚的および代謝的相互作用を例示することができる。このシナリオでは、脱感作は、代謝酵素と代謝クリアランスによる実質的に高いおよび/またはより速い不活性化をプライミングしているにもかかわらず、辛味化合物の最適な摂取量を維持するための試みであるかもしれない[21]。我々は、親電子性リガンドがTRPA1またはTRPV1を活性化および減感作する可能性があることを提案する。
TRPA1-TRPV1とアセトアミノフェン
パラセタモール(アセトアミノフェン)は、TRPA1非依存性の解熱作用[182]およびTRPA1依存性の疼痛作用[183]を有する。親電子性代謝物であるN-アセチル-p-ベンゾキノンイミン(NAPQI、肝毒性代謝物)とp-ベンゾキノンはTRPA1を活性化するが、パラセタモール自体は活性化しない[82]。これらはまた、細胞内システインと相互作用することでTRPV1を活性化し、感作する [184, 185]。NAPQIもまた、Nrf2を直接活性化し[186]、ベンゾキノンはTRPA1を脱感作する[172]。
パラセタモールの生理学的および毒性学的反応は、WntおよびNrf2経路によって調整された連続体を形成している。治療用量では、細胞質内で反応性活性酸素とNAPQIを産生するが、永続的な損傷はほとんど生じない [187]。高用量では、パラセタモールは酸化ストレス媒介性の肝毒性を誘導することができ、Nrf2経路を強化することで減少する [188-190]。
結論 Nrf2,TRPA1/TRPV1,およびCOVID-19の仮説的相互作用
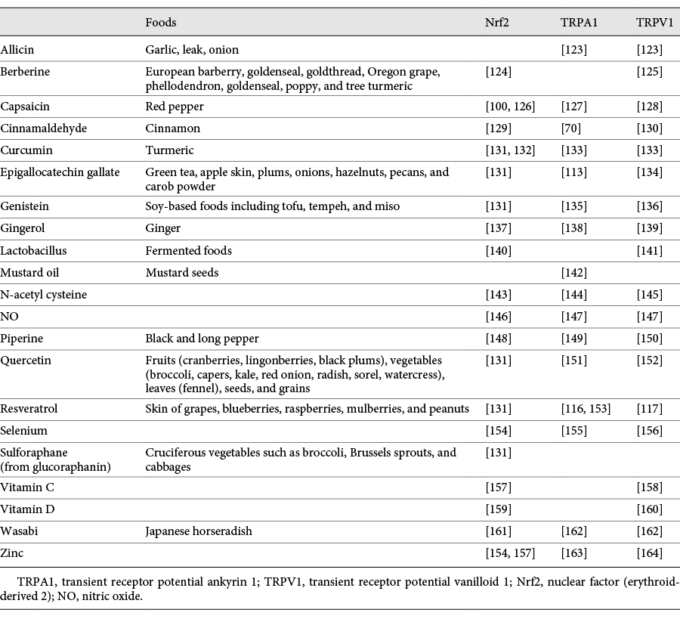
COVID-19に関連する症状に共通する分母は、ROS蓄積の原因となる酸化還元恒常性の障害であるようである [191]。いくつかのメカニズムが提案されているが、特にレニン-アンジオテンシン-アルドステロン系[10]および/または小胞体ストレス[192]が関与している。しかし、TRPA1/TRPV1がCOVID-19に関与している可能性が示唆されたことはなかった(図1)。
図1 COVID-19におけるTRPと酸化ストレスの相互作用([10, 110]より改変)
SARS-CoV-2は、ダウンレギュレートされたACE2を介して細胞に結合する。アンジオテンシンIはアンジオテンシンII AT1R経路でトランスフェクトされ、酸化ストレスを誘導する。SARS-CoV-2が細胞内に侵入すると、小胞体ストレス応答を誘導し、他の経路のうち酸化ストレスを誘導する。酸化ストレスは多くの抗酸化物質によって阻害されるが、最も強力なのはNrf2である。酸化ストレスはTRPA1と、それ以下の程度ではTRPV1を感知する。活性化されたTRPは、様々な自然の刺激によって過剰に活性化されやすい。食品はNrf2を活性化し、TRPを減感作する。TRPA1,一過性受容体電位アンキリン1,TRPV1,一過性受容体電位バニロイド1,Nrf2,核内因子(赤血球由来2)。
Nrf2活性化を誘導する抗酸化剤は、COVID-19を治療するために提案されている[10,18-20]。抗酸化物質は興味を惹かれるかもしれないが、その臨床的効果は数分で見られる可能性は低く、最適な効果は得られないかもしれない。COVID-19が証明された3つの臨床例において、グルコラファニンとパラセタモールを含むブロッコリー種子のカプセルは、咳などのいくつかの症状の急速な改善(数分)を誘発することが明らかになった(投稿、オンライン公開[193])。1人の患者を対象とした二重盲検、プラセボ対照の誘導咳嗽チャレンジでは、10分以内に咳嗽の軽減が認められた。
他の仮説も提案できる。TRPA1/TRPV1は、いくつかの一般的なCOVID-19症状に関与している。TRPV1よりもTRPA1の方が活性化されているため、COVID-19ではTRPV1がアップレギュレーションされている可能性がある。Nrf2による活性酸素の減少は、ほとんどの場合、TRPA1の過剰反応性を減少させ、それによって外因性または内因性の薬剤によるTRPA1の活性化を減少させる。しかし、そのようなメカニズムは時間がかかる可能性が高く、非常に迅速な発症の臨床的利益に関与することはできない。この相乗効果を見出すには、1時間以上かかるかもしれない。
外因性薬剤によるTRPA1/TRPV1の活性化は、急速な用量依存性の脱感作をもたらし、それは数分以内に、そして最大で数時間にわたって効果を発揮し、症状の改善を示唆する。この急速な発症メカニズムは、抗酸化物質または他の生成物によって維持される可能性がある。この提案は、予備的な臨床試験で実証されているようであるが、正式な試験で確認する必要がある。1人の患者を対象とした二重盲検、非盲検の誘導咳嗽チャレンジでは、TRPA1/V1アゴニスト(緑茶、クルクミン、生姜、赤唐辛子)を用いて2分以内に咳嗽が減少し、Nrf2(ブロッコリー)との相乗効果で効果の持続時間が長くなることが示唆された(図2,提出、オンラインで入手可能[194])。
図2 Nrf2,TRPA1および/またはTRPV1アゴニストを用いた誘発性咳嗽チャレンジ([194]より)
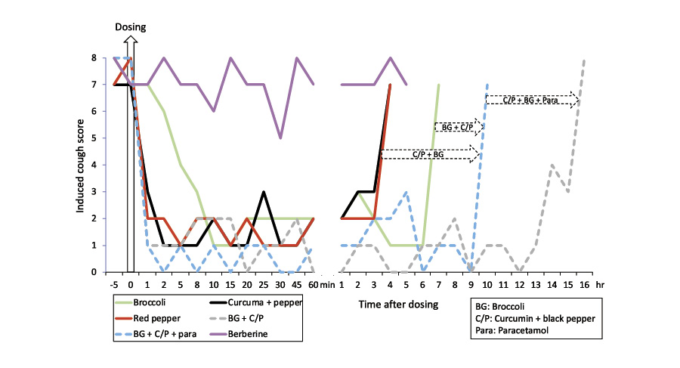
同じ患者において、オープンラベル化された誘導咳チャレンジを、チャレンジ前にアゴニストを投与する前に(-5分)1,2,5,8,10,15,30,25,30,45,60分後および1時間ごとに、咳スコアが≧7になるまで実施した。咳チャレンジは、二重盲検、プラセボ対照試験で検証された [193]。ベルベリン(Nrf2)は効果がなかった。赤唐辛子20mg(Nrf2低+TRPV1高)またはクルクミン100mg+黒唐辛子16mg(Nrf2低+TRPA1高+TRPV1低)は1~2分以内に効果があり、その効果は3時間まで持続した。ブロッコリー300mg(Nrf2 high+TRPA1 low)は10分以内に効果があり、その効果は6時間まで持続した。ブロッコリー150mg+クルクミン50mg+黒胡椒6mgは9時間まで効果があった。ブロッコリー150mg+クルクミン50mg+黒胡椒6mg+パラセタモール250mg(パラセタモール代謝物:TRPA1+TRPV1)は16時間まで有効であった。これらの結果から、TRPA1-TRPV1の非常に速い脱感作と、Nrf2とのクロストークにより効果の持続時間が長くなることが示唆された。TRPA1,一過性受容体電位アンキリン1,TRPV1,一過性受容体電位バニロイド1,Nrf2,核因子(赤血球由来2)。
TRP脱感作のもう一つの形態は「タキフィラキシー」であり、これはアゴニストの繰り返しの適用に対する反応の減少または消失である[168, 195, 196]。アジアまたはサハラ以南の国々では、大量の香辛料が定期的に食べられており、TRPA1/TRPV1受容体が恒久的に脱感作されているか、または数が減少している可能性があり、副作用なしで大量に食べることができるようになっている。このモデルでは、Nrf2と抗酸化物質が活性酸素の減少に重要な付加的役割を果たしている可能性がある。したがって、TRPA1/V1タキフィラキシーは、COVID-19の症状の重症度を低下させ、さらにはSARS-CoV-2による感染を減少させる可能性がある。辛味のある栄養素や発酵キャベツを含むキムチの長期摂取は、その原型となり得る。
これらの限られた臨床試験の結果は、正式な証拠とはなり得ない。しかし、Nrf2-TRPA1食品の併用がCOVID-19の症状の一部に有益である可能性があり、Nrf2とTRPA1アゴニストの間に相乗効果があるという仮説の概念実証に貢献している。いかなる結論も導き出すことができず、COVID-19のために推奨されるこれらの治療法の前に、データは確認を保証するものである。特に、二重盲検プラセボ対照デザインを採用した大規模な研究を通じて、より重度の患者および/または入院患者を対象に、これらの食品の有用性を評価する必要がある。
未知の問題がいくつかある。第一に、脱感作におけるTRPA1とTRPV1の相互作用である。第二に、酸化ストレスによるこれらのチャネルの調節とNrf2の相乗的役割である。カプサイシンパッチによるTRVP1脱感作は、COVID-19にとって有益であるかもしれない。また、ブロッコリーのようなNrf2-potentアゴニストを組み合わせることにも関心があるかもしれない。しかし、繰り返しになるが、これらの仮説は、機械論的研究および正式な臨床試験の結果を得る前に、実際に使用することはできない。