Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC8618927/
2021年11月22日オンライン公開
Marianna Marino,1 Elena Mele,2 Andrea Viggiano,1 Stefania Lucia Nori,3 Rosaria Meccariello,2,* and Antonietta Santoro1,*.
Hye Gwang Jeong(アカデミックエディター)
要旨
グリホサートは、強力な除草剤として世界中で広く使用されている。大気中、水中、食品中に検出され、ヒトの体液や組織中に蓄積し、ヒトの健康に対する深刻なリスクとなり得る。グリホサートは、植物ではシキミ酸経路の阻害剤として作用するが、脊椎動物ではその経路が存在しない。このため、国際的な科学機関は、グリホサートはヒトに対する毒性はないか弱いものと考えてきた。しかし、動物やヒトの細胞・組織におけるグリホサートおよびその製剤の毒性が強調されるエビデンスが増えてきている。このため、欧州ではグリホサートの使用認可が2022年まで延長されたにもかかわらず、いくつかの国ではその拡散を抑えるための予防措置が取られ始めている。グリホサートは尿、血液、母乳から検出され、その代謝物であるアミノメチルホスホン酸(AMPA)を介して直接または間接的に活性酸素種(ROS)の生成、いくつかの細胞毒性および遺伝毒性作用をin vitroおよび動物モデルで誘発することが判明している。本総説は、グリホサートの生物学的効果およびその基礎となる分子メカニズムについて、特にグリホサートが炎症、DNA損傷、遺伝子発現プロファイルの変化、および生殖と発達に対する悪影響を誘発する可能性に焦点を当て、より関連性の高い知見をまとめることを目的としたものである。
キーワード:グリホサート毒性、炎症、がん、生殖と発生
1. はじめに
グリホサート(N-ホスホンメチルグリシン、CAS 登録番号 1071-83-6、分子式 C3-H8-N-O5-P)は、世界で最も広く使用されている除草剤の一つである。1974年にモンサント農薬工業がラウンドアップの商品名で特許を取得した。モンサント社の特許は2001年に切れ、それ以来グリホサートは、ドイツの大手メーカーであるバイエル社をはじめ、多くの企業によって製造されている。グリホサートおよびグリホサート系除草剤(GBH)は、米国では1974年に環境保護庁(EPA)から農業用として認可され、欧州では欧州委員会の認可を経て2002年に商品化された[1]。
グリホサートは、ラウンドアップとして製剤化されており、広域除草剤である。主な用途は、小麦、キャノーラ、大豆などの作物の雑草を除去することであるが、小麦の作物では収穫前の乾燥剤としても使用される[2]。さらに、グリホサートは、都市部や公園、水生植物を駆除するために海洋関係でも使用されている[3]。1990年代半ば、グリホサート耐性遺伝子組み換え作物の開発により、グリホサートとGBHの使用は急速に増加した。2012年には、米国で127,000トン、全世界で700,000トンのグリホサートが使用された[4]。実際,アメリカはグリホサートとGBHが最も多く使用されている国である。アメリカ市場にある750以上の製品がこれを含んでおり、その使用は130カ国以上で承認されている[5,6,7]。その大量使用のため、グリホサートは大気中、水中、食品中に検出され、結果として尿、血液、母乳などの生体液にも検出される[8]。しかし、グリホサートはシキミ酸経路の主要酵素である3-ホスホシキメート1-カルボキシビニルトランスフェラーゼ(EPSPS)の活性を阻害する特異性があり、脊椎動物には存在しないことから、長い間、この農薬は人間の健康に対する深刻なリスクとはならないだろうと考えられてきた[9]。確かに、ヒトに関する疫学的研究では、グリホサート曝露農家における非ホジキンリンパ腫の発生がわずかに増加した可能性が報告されているだけであるが、インビトロ研究では、この物質が遺伝子損傷を起こし、酸化ストレスを増加させ、エストロゲン経路を阻害し、脳機能を損なうことができ、種々の形態の癌と相関していることがわかっている [10,11,12].上記の証拠に言及し、グリホサートの健康への影響は、研究にとって極めて重要なテーマとなっている。国際がん研究機関(IARC)は、ヒトと動物におけるグリホサートの影響に関する研究調査の詳細な分析を実施した。この分析は、2015年に、この農薬をグループ2A(ヒトに対しておそらく発がん性がある)に含めるという決定で、終了した。2015年には、欧州食品安全機関(EFSA)がドイツ連邦リスク評価研究所(BFR)に委託した別の技術評価を行い、これらの評価から、グリホサートはヒトに対する発がん性ハザードを示す可能性は低いことが明らかになった。しかし、この2つの見解には、科学界や社会から批判が寄せられた。そのため、近年、グリホサートの毒性に関する研究が盛んに行われ、専門家によるレビューや意見書もいくつか発表されている。また、BFRはグリホサートの主要生産国の一つであるドイツに本拠地を置いており、BFRの技術委員会にはグリホサート農薬業界からのコンサルタントが3名常駐していた。2017年11月、UEはグリホサート使用の認可を2022年まで延長することを決定した。グリホサートのヒトの健康リスクに関する判断はまだ不確かなままだが、いくつかの国はグリホサートとGBHの不適切な使用を減らすために予防措置を取り始めている[5]。
上記の観察から、グリホサートとGBHsの安全性の低さが現実の緊急事態であることが浮かび上がった。したがって、このレビューの目的は、特に免疫調節作用、変異原性/発癌性の可能性、生殖と発達への影響に言及して、この除草剤の効果に関する知識を更新することだ。グリホサートの毒性全般を批判的に分析することにより、グリホサート使用に対する認識を高めることを目的としている。
2. グリホサートの作用と汚染経路
グリホサートは、植物の芳香族アミノ酸であるアラニン、チロシン、フェニルアラニンの合成に必要なシキミ酸経路の酵素であるEPSPSの活性を阻害する [13] (図1)。芳香族アミノ酸は、調節機能や防御機能を果たす様々な化合物を得るために必要であり、これらのアミノ酸の不足は植物の枯死につながる[9,14]。
図1植物のシキミ酸塩経路
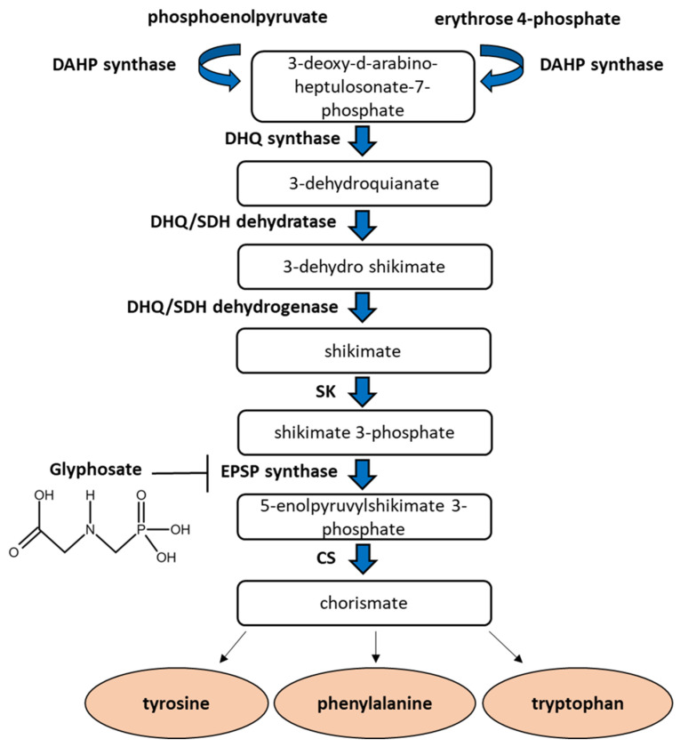
シキミテート経路は、ホスホエノールピルビン酸(PEP)とエリスロース4-リン酸(E 4-P)を、3種類の芳香族アミノ酸の前駆体であるコリスミン酸に変換する。グリホサートは、5-エノールピルビルシキメート3-リン酸(EPSP)合成酵素を阻害し、この合成を妨げる。DAHP:3-deoxy-d-arabino-heptulosonate-7-phosphate synthase; DHQ: 3-デヒドロキアン酸合成酵素;DHQ/SDHデヒドラターゼ:3-デヒドロキアン酸デヒドラターゼ;DHQ/SDHデヒドロゲナーゼ:3-デヒドロキアン酸デヒドラターゼ。3-dehydroquianate dehydrogenase; SK: shikimate kinase; CS: chorismate synthase.
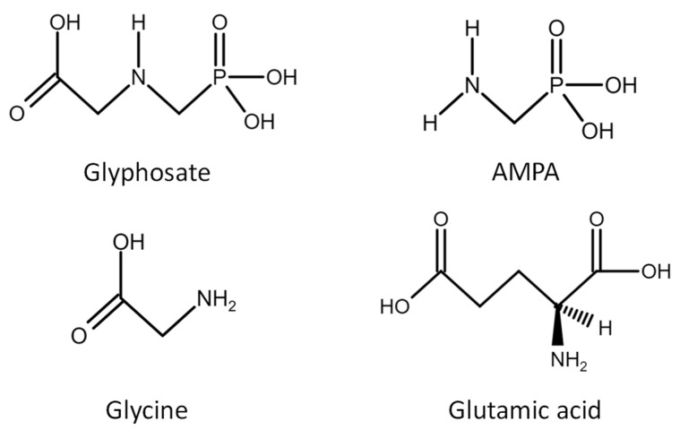
グリホサートは、炭素リン酸結合(図2)が存在するため、分解に対してかなり抵抗性がある。にもかかわらず、グリホサートの分解には炭素-窒素(C-N)結合の分解が伴い、グリホサートの主要代謝物であるアミノメチルホスホン酸(AMPA)が生成される [15,16].しかし、グリホサート自体の毒性は低く、GBHにはグリホサートの植物への侵入を助ける他の物質が含まれており、その毒性を高めている。例えば、ラウンドアップはグリホサート単独よりも毒性が高いことが示されている[17]。ラウンドアップには共配合剤のポリエトロキシル化獣脂アミン(POEA)が含まれており、これが最も毒性が強いと思われる成分である [18,19].
図2グリホサートとその共成分であるアミノメチルホスホン酸(AMPA)、グリシン、グルタミン酸の化学構造
さらに、GBHは雑草の除去や穀物の収穫前の乾燥のために、毎シーズン数回作物に散布される。グリホサートの分解は土壌中だけでなく生きている植物でも行われるため、グリホサートとその代謝物であるAMPAの両方が植物製品中に含まれる可能性がある[2,20]。
グリホサートが広く使用され、環境中に蓄積されることから、この化合物が人間の健康に与える可能性のある副作用についての懸念が高まっている。実際、GBHは土壌、水、植物製品、穀物、果物、穀類を含む食品に蓄積する傾向があり、洗浄しても除去されず、調理しても分解されない[21,22]。最近の研究では、グリホサートが牛の肉や、汚染された食物を摂取した牛の尿中に相当量含まれていることが明らかになっている[23]。実際、脊椎動物におけるグリホサートの薬物動態、様々な組織における輸送と生物濃縮を説明する研究はまだ十分に行われていない。ラットでは、400 mg/kg の農薬を経口摂取すると、血中のグリホサート濃度は 5 μg/mL になることが示されている。投与後5時間でグリホサートは組織内に拡散し、分布と排泄の半減期はそれぞれ4時間と15時間である[24]。
Ramazzini研究所が主導した研究では、Sprague Dawleyラットに、米国一日摂取許容量(US-ADI)と同じレベルのグリホサートまたはラウンドアップを含む水を13週間にわたって経口投与した。その結果、グリホサートは、主代謝物であるAMPA(化学構造は図2参照)に関して修飾されていない化合物として、より多量に尿中に排泄されることが判明した。尿中のグリホサート量は処理期間に関連して増加し、生物濃縮の可能性を示唆している[16]。したがって、他の生体内研究では、グリホサートは体内に入ると腎臓、肝臓、結腸に蓄積する傾向があり、その後便や尿を介して排泄されることが示された [12,16,25].
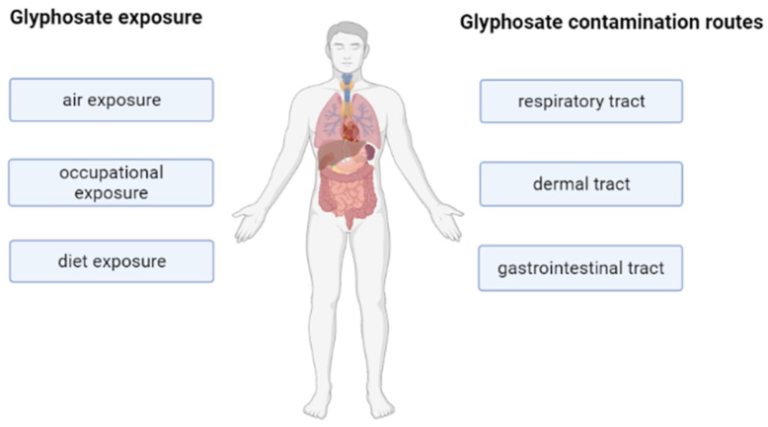
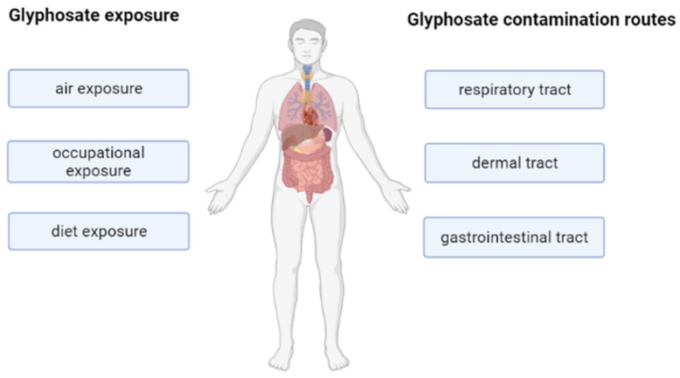
直接の標的ではないが、ヒトは職業上の曝露や食事を通じて汚染される可能性がある [21,26,27]。優先的な侵入経路は経皮的経路である。しかし、グリホサートは、吸入、摂取、汚染された食物を食べることによっても人体に入ることができる [22] (図3)。一方,グリホサートは農家の尿や血液,母乳などの生体液に高い割合で検出されており,子どもを含む一般人口の60-80%にも存在する[2,28].このことは、この農薬に毎日さらされること、および人体内に存在することが、人間の健康を損なう可能性を示唆している。
図3ヒトにおけるグリホサートの主な曝露・汚染経路の模式図
最近のいくつかのレビュー [2,13,14,29] では、様々な慢性疾患の発症とグリホサート使用の増加との間に有意な相関があることが示されているが、現在までのところ、グリホサートとGBHがヒトと動物の代謝をどのように変化させ得るかを説明する十分なデータはなく、グリホサートが標的とする分子経路も完全に解明されてはいない。グリホサートとその代謝物であるAMPAの化学構造は、n-methyl-D-aspartate受容体(NMDAR)の作動物質であるグリシンおよびグルタミン酸と類似している(図2)ことが示唆されている [30,31]- 。さらにグリホサートは、アミノ酸であるグリシンのアナログとして作用し、タンパク質合成時に誤ってポリペプチド鎖に含まれ、代謝や調節の過程で基本的な役割を果たすタンパク質に異常を発生させることがある。グリホサートとグリシン残基の置換は、グリホサートへの曝露と様々な疾患の発症との間に相関関係がある理由の一部を説明するかもしれない[32]。実際、MDA-MB-231乳がん細胞で得られた最近の知見では、グリホサート処理細胞と未処理細胞のグローバルプロテオームの変化に違いは見られなかった。グリホサート処理細胞ではADP/ATPトランスロカーゼとセリン/アルギニンリッチスプライシング因子6だけが統計的に有意な変化を示し、農薬は特定のタンパク質を標的にしていることが示唆されている [33].実際、グリホサートへの曝露は、肥満、糖尿病、肝・腎機能障害、自閉症、認知症、パーキンソン病やアルツハイマー病、白血病、様々な癌や炎症性疾患など、現代の様々な疾患に関与しているようである。
3. グリホサートの免疫調節作用と炎症性作用
3.1. グリホサートによる肝臓、腎臓、肺への影響
多くの研究により、グリホサートは様々な種類の細胞において炎症と酸化ストレスを誘発し、その毒性を発揮することが分かっている [34,35,36,37,38,39,40] 。酸化ストレスは、活性酸素種(ROS)の過剰な生成や抗酸化物質の防御力の低下に起因し、タンパク質や脂質を損傷し、アポトーシス経路や炎症プロセスの発症を活性化させる可能性がある。El-Shenawy ら [35] は、亜致死濃度のラウンドアップまたはグリホサート単独をアルビノ雄ラットに腹腔内投与して、酸化ストレス反応を実証した。彼らは、グリホサートとラウンドアップを投与したラットの両方で、過酸化脂質レベルの上昇を媒介として、肝組織において時間依存的に有意なGSHの枯渇と酸化ストレスの誘発を見いだした。さらに、同じ曝露動物で一酸化窒素(NO)および腫瘍壊死因子α(TNF-α)レベルの増加が観察され、ラウンドアップとその有効成分であるグリホサートが抗酸化物質かく乱剤として作用していることが示唆された。ラウンドアップとグリホサートは、血中尿素の増加を促進する腎臓機能の変化も引き起こす可能性があった[35]。Mensageらは、0.1 ppbの濃度のラウンドアップと0.05 μg/Lのグリホサートを含む水をラットに2年間与え、腎臓と肝臓の機能障害を観察した。その結果、ラウンドアップは機能的な肝臓と腎臓の障害を示す解剖学的な病気の兆候と血液と尿のパラメーターの変化の発生率を増加させることが示された。この調査は、肝臓と腎臓の遺伝子発現プロファイルを分析することによって、分子的なアプローチによっても深められた。ミトコンドリア機能障害や、線維化、壊死、虚血などの病態に典型的な発現パターンの変化が観察された[35]。別のインビボ研究では、エネルギーの恒常性を維持する役割を持つ主な臓器である脂肪組織と肝臓に対するラウンドアップの影響が示された。成熟した雄ラットを、濃度の高いラウンドアップ(5から250 mg/kg体重[bw])に14日間毎日経口曝露した。投与2週間後、100および250 mg/kg bw/dayでインターロイキン(IL)-1β、TNF-α、IL-6などの炎症マーカーの有意な増加が認められ、脂肪症および非アルコール性脂肪肝に相当する肝障害も併発された。同じ用量のラウンドアップで処理した後、微小および巨小小胞脂肪症の形成が観察された[37,38]。これらの用量は、EFSA [41]によって定められた消費者の許容作業者暴露レベル(AOEL、0.1 mg/kg bw/day)および許容一日摂取量(ADI、0.5 mg/kg bw/day)の両方を超えている。しかし、これは、ラウンドアップの低用量慢性暴露でそれらの同様の変化が達成される可能性を排除するものではなく、著者らは純粋なグリホサートの影響に関するいかなる証拠も示していない。注目すべきは、グリホサート散布後の空気サンプルを吸入した農場から採取したマウスモデルによる実験的証拠で、この農薬が職業性喘息発症の危険因子になりうることが指摘されている。実際、グリホサートを多く含む平均17.33μgの空気試料(空気中濃度22.59ng/m3に相当)に暴露したマウスの肺では、好酸球、好中球、マスト細胞の細胞数が増加した。また、IL-5、IL-10、IL-13、インターフェロン-γ(IFN-γ)など、喘息の場合に典型的に産生されるサイトカインのパターンを分析することにより、炎症過程の開始が確認された。この場合、農家が純粋なグリホサートに暴露されたか、GBHに暴露されたかは特定されていないが、これらの結果は、グリホサートへの暴露が、吸入農薬との最初の接触源である気道の上皮バリアに損傷を誘発することを示唆するものであった。上皮の損傷には、特に、炎症反応を増幅することが知られているサイトカインIL-33と胸腺間質リンパポエチン(TSLP)の放出が関与し、気管支の過活動を誘発する[39,40]。
3.2. グリホサートによる腸管への影響
グリホサートは腸の炎症に関係しているようである [42]。実際、腸は農薬の存在に非常に敏感であり、外来物質が接触する最初の障壁の1つである [43]。いくつかの研究では、農薬は腸管バリアの完全性を変化させ、酸化ストレスはこれらの物質が毒性を誘発するメカニズムの一つであると報告されている[44,45]。これらの観察と同様に、35 日間離乳させた豚にグリホサート(10 ~ 40 mg/kg の用量)を投与すると、十二指腸においてスーパーオキシドジスムターゼ(SOD)、グルタチオン(GSH)ペルオキシダーゼ 1(GSH-Px1)、カタラーゼ(CAT)および脂質過酸化の指標であるマロンジアルデヒド(MDA)のレベルが上昇することが確認された。また、十二指腸と空腸の両方で核内因子赤血球2関連因子2(Nfr2)のmRNAレベルの増加も確認された。Nfr2遺伝子は、活性酸素による内因性、外因性ストレスに対する細胞保護応答の主要な制御因子をコードしている。実際、正常な状態では、Nrf2タンパク質はsmall MAFタンパク質(sMAF)と共に標的遺伝子の制御領域にある抗酸化応答要素(ARE)に結合している。したがって、十二指腸と空腸では、グリホサートによって誘導されたNrf2の発現は、GPx1 mRNAの減少およびNF-kB転写因子mRNAの同時誘導とともに、腸の抗酸化能力の低下を強く示唆し、慢性炎症と組織損傷を引き起こす可能性がある [42].Glyphosate は、常在微生物群のアンバランスを作り出すことによって、腸の免疫系に間接的にも干渉してしまうのである。先に説明したように、シキミテート経路は脊椎動物には存在しないが、植物と腸内細菌叢を含む微生物には存在する。グリホサート(75-300 mg/L)およびGBHsであるクロルピリホス(CPF、50-200 µM)は、大腸菌やラクトバチルス・ロイテリスなどの一部の腸内微生物の活動に影響を与え、その結果、免疫系と相互作用する可能性がある。実際、これらの細菌株をグリホサートまたはCPFで処理し、粘膜関連不変性T細胞と培養すると、TNF-αおよびINF-γなどの炎症性サイトカインの放出を刺激する[46]。
3.3. グリホサートによる血球への影響
我々の免疫系は、第一の防御ラインである自然免疫と、その後に発達するより強力な獲得免疫によって病原体から身を守る、生存に不可欠なものであることは注目に値する。しかし、免疫系は諸刃の剣である。後者の損傷は、弱い反応または過剰な反応を引き起こすことによって、様々な疾患の発症を助長する [47]。
免疫不全は一次的なものもあれば、化学物質への曝露に伴って二次的なものになることもある。成長中の研究により、免疫系の変化とグリホサートのような有機リン酸系農薬への曝露との間に相関があることが示されている [48,49]。Lioiら [50,51] は、低濃度の純粋なグリホサート(17~170μM)がヒトや動物のリンパ球の培養において酸化ストレスを誘発し、還元型GSHの細胞内プールを維持するために必要なNADPHを確保するペントースリン酸経路の主要酵素、グルコース6-リン酸脱水素酵素(G6PD)活性を誘発することを初めて報告した [50,51].Pereiraらによって行われたより最近の研究 [52] は、複数の農薬の使用に15日間さらされた農民のグループの免疫学的プロファイルを調査したものである。曝露されたグループは43人(29歳から72歳)で構成され、30人(32歳から66歳)の対照グループと比較された。グリホサート曝露群では、単球、樹状細胞、総T細胞が対照群と比較して有意に増加していることが観察された。白血球数の変化は、暴露農家における炎症性サイトカインIL-6の産生量の増加にも関連していた[52]。Barbaszらによって行われた別のインビトロ研究 [53] では、グリホサートを含む3種の農薬の潜在的毒性効果が、ヒト組織球性リンパ腫細胞株 (U-937) とヒト前骨髄球性細胞株 (HL-60) という二つのヒト免疫細胞株でテストされた。細胞株に処理する農薬の濃度は、農家や一般市民が通常暴露する量に相当するものを選択した。細胞生存率分析から、3600μg/mLのグリホサートで24時間処理した細胞は、対照と比較して20%しか生存しないことが示され、この農薬の細胞毒性に関するこれまでの結果が裏付けられた。脂質過酸化も MDA 濃度を測定することで評価した。U-937 細胞株の MDA 濃度は対照群の 4 倍に増加し、グリホサートの細胞毒性は強い酸化ストレスの誘発に よって媒介されている可能性を示唆している [53].
3.4. 神経変性グリホサート誘発作用
農薬などの環境ストレス因子は、炎症、酸化ストレス、アポトーシスが関与するメカニズムを通じて神経疾患に寄与する可能性がある。したがって、グリホサートの長期暴露は神経変性疾患を引き起こす可能性がある。この観点から、Cattaniら[54]は、飲料水中のグリホサートを0.36%含み、70 mg of glyphosate/kg bw/dayに相当するGBHsに母体が亜慢性的に暴露されると、未熟および成体のラットの子供の海馬のコリン作動性神経伝達およびグルタミン酸神経伝達物質に影響を与えることを明らかにした。15 日齢および 60 日齢のラットで観察されたグルタミン酸の取り込みの減少および Ca2+ の流入の増加は、発育期から成体まで持続的なグルタミン酸興奮毒性を示唆するものであった。これらの事象は、酸化ストレス現象、アストロサイトの機能不全、およびうつ病様行動へと結実した[31,54]。
ヒト神経芽細胞腫細胞株SH-SY5Yを用いた別のインビトロ研究では、グリホサート(5 mM)およびAMPA(10 mM)処理により、MDAレベル、NOおよびROS産生、さらにカスパーゼ(CASP)3/7活性を増加させる細胞毒性作用が誘発された。また、CASP3、CASP9、TNFα、Tumor Protein 53 (TP53) などのプロアポトーシス遺伝子の発現亢進、Wnt経路のアップレギュレーション、成長関連タンパク質43 (GAP43) とTubulin Beta 3 Class III (TUBB3) mRNAのダウンレギュレーションといった神経発生における特徴も明らかにされた。さらに、細胞死経路のいくつかの遺伝子の発現プロファイルに変化が見られたことから、グリホサートとAMPAは酸化ストレスを誘発し、アポトーシス経路、オートファジー経路、ネクローシス経路を介した細胞死によって神経細胞の発達に影響を与えることが示唆された [34](Glyphosate et al. 不十分ではあるが、グリホサートの神経毒性に関するこれらの予備的データは、この農薬およびその製剤への環境暴露が、神経細胞の発生と移動の際に懸念されうることを示唆している。一方、グリホサートによる影響にWnt経路が関与していることから、この農薬は典型的な炎症経路の正常な機能だけでなく、炎症と発がんリスクを関連付ける経路も損ないうるという問題が生じる。
4. グリホサートの発がん性および変異原性作用
有害物質の生体内変換は、活性酸素などの反応性中間体の細胞内産生を引き起こし、DNAを損傷して様々な変異や無秩序な増殖を誘発し、最終的に癌につながる。近年、グリホサートの遺伝毒性作用の可能性について、科学界や国際機関の間で議論が行われている。グリホサートによるDNA損傷に関する結果の食い違いは、主に使用された実験方法の違いによるもので、曖昧でない明確な結論に達することは困難である[11]。
グリホサートのクラストゲン作用は in vitro のウシ末梢リンパ球では検出されていないが [55]、他の研究では、この除草剤が様々な種類の細胞、特に末梢血単核細胞(PBMC)において細胞レベルおよびゲノムレベルで遺伝毒性を有することが示されている [50,51]。Andreotti ら [13] は最近、農薬を使用する 54,251 人のうち 44,932 人がグリホサートを使用し、5779 人ががんを発症したことを示す疫学研究を実施した。また、著者らは、グリホサートに最も多く暴露されたグループにおいて、急性骨髄性白血病(AML)の発症リスクとの特定の相関を示唆した[13]。DNA損傷は多くの細胞プロセスを変化させるため、これらの有害物質の遺伝毒性ポテンシャルを評価することは、ヒトの健康リスクを評価する上で極めて重要であると思われる。DNAに生じる最も頻繁な損傷は、一本鎖切断、二本鎖切断、異なるタイプの染色体異常、窒素塩基の修飾を伴うDNA酸化損傷であるが、いくつかの遺伝子のメチル化プロファイルの変化も、癌発症リスクの増加と関連しているので考慮しなければならない [56,57]- 。この観点から、Santovitoら[58]は、EFSAが定めた一日摂取許容量(ADI)に相当するグリホサート濃度(0.5 μg/mL)とその亜流のヒトリンパ球への影響をin vitroで評価した。彼らは、グリホサートが小核(MNi)および染色体異常(染色体および染色体の切断、二動原体染色体、環状および尖端断片など)を誘発することを観察し、曝露した被験者のがんリスクを示唆した[58]。これらのデータは、グリホサートに暴露されたヒトおよびウシのリンパ球において、染色体異常および姉妹染色分体交換(SCEs)/細胞の観点から、弱いが有意な遺伝毒性作用を示したLioiらによって以前に得られた結果を裏付けるものである [50,51]。SCEs/細胞の増加を示すLioiらの所見は、エピジェネティックに制御されるDNA修復酵素の効率低下も示唆している。Wozniak らによる別の研究 [57] では、グリホサートだけでなく、その製剤であるラウンドアップとその代謝物である AMPA の遺伝毒性ポテンシャルが測定されている。その結果、すべての化合物が一本鎖切断を引き起こし、グリホサート(濃度 1000 μM)とラウンドアップ(濃度 10 μM)はコメットアッセイで同等の DNA 損傷を引き起こすことが判明した。著者は、DNA損傷が酸化ストレスによって引き起こされ、シトシンの代わりにアデニンが取り込まれることでG: C -> T: A転化を引き起こすことが知られている8-oxodGの形成につながったことを示唆した。また、グリホサート単独と比較してラウンドアップの毒性が高いことも実証された[59]。
異種物質がエピジェネティックな変異を誘発することはよく知られている。一般的なメチル化レベルや異なる細胞プロセスに関与する遺伝子のプロモーター領域内の変化は、真核細胞に対して、癌リスクの上昇を含む重要な結果をもたらすことがある [60,61,62] 。この観点から、最近の研究では、低濃度(0.5 から 0.1 mM)のグリホサートが、アポトーシス経路に関与することで有名な P21 および TP53 抑制遺伝子プロモーターのメチル化を低減することが示された [62](Glyphosate et al. これらの知見によると、より高濃度のグリホサート(0.5〜10 mM)で処理したPBMCでは、DNAの低メチル化というグローバルな状態が見られた。しかし、0.25-および0.5 mMで処理するとp53遺伝子のプロモーター領域で高メチル化が観察された[63]。これらの観察結果を総合すると、グリホサートはヒト PBMC における正常なメチル化プロセスと遺伝子発現を乱すことによってエピジェネティック効果を誘発し、おそらく細胞の形質転換につながることが強く示唆される。従って、IARCのワーキンググループは、グリホサートへの曝露と非ホジキンリンパ腫との間に関連があると結論付けている[5,10,64]。
グリホサートとGBHの遺伝毒性活性は、ヒトの肝細胞株HepG2でも実証されている。これらの細胞では、グリホサートと、有効成分の量を増やした4種類のラウンドアップ製剤(7.2~450 g/L)で処理すると、DNA損傷とエストロゲン受容体αとβ(ERα、ERβ)に対する抗エストロゲン活性が誘発された。興味深いことに、その効果はグリホサート濃度よりも製剤に依存しており、GBHは純粋なグリホサートよりも毒性が強い可能性があることが示唆された[65]。Koller ら [66] も同様の結果を得た。彼らは、グリホサートとラウンドアップがヒト由来の頬上皮細胞株 TR146 に対して引き起こす可能性のある有害作用について調査している。この場合、コメットアッセイと MNi 試験により、20 mg/L の濃度の物質が、おそらく一本鎖切断、アプリン部位、MNi および核芽(NB)を誘発することにより DNA 損傷を促進することが示され、この研究では、ラウンドアップがグリホサートよりも活性が高かった [66]。さらに、3 ~ 7.5 mM の濃度範囲でグリホサートに 4 時間暴露した Hep-2 細胞では、コメットアッセイにより DNA 損傷が統計的に有意に増加した [67]。グリホサートとGBHが持ちうる明らかな遺伝毒性効果に加え、ある種のがんにおいては、多剤耐性(MDR)を誘導することで腫瘍の状態を維持しやすくすることが見出されている。がん細胞は、健康な細胞から発生したにもかかわらず、急激な変異を起こし、ストレスに適応するためのさまざまなメカニズムを発達させ、より生存しやすくなる。その一つが、MDRの仕組みである。MDRの獲得は、多形性膠芽腫(GBM)などのさまざまながんの治療で遭遇する主要な問題の一つである。この現象は、ABC膜輸送体(P-糖タンパク質など)[68]、乳がん耐性タンパク質(Bcrp)およびグルタチオンs転移酵素(GST)の過剰発現に関連している[69]。農薬が体内に慢性的に存在することで、MDR機構が活性化される可能性がある。ヒトグリオブラストーマ細胞株U87において、様々な農薬(グリホサートを含む)の複合作用にさらされた結果、細胞が化学療法剤に対して耐性を獲得することが示されている。これらの耐性U87細胞では、MDR機構に関与するすべてのバイオマーカー(GST、P-gp/ABC、MRPなど)の発現が増加し、アポトーシスと酸化ストレスに対する耐性が高まっていた[70]。この観点から、特に農家で起こりうることとして、いくつかの農薬への現代の暴露による悪影響に関する知識を増やすことが必要であろう。
他にも、ヒトのがん細胞株HEC1A(子宮内膜がん細胞株)およびMDA-MB-231(エストロゲン受容体(ER)陰性乳がん細胞株)を用いた研究では、グリホサートおよびその同系統のラウンドアップとワイプアウトの遺伝毒性作用は、エストロゲン受容体の状態とも相関している。これらの効果は、主に短時間処理と中等量(75から500 µg/mL)の用量を用いて見出された。グリホサートは両方の細胞株で有意なDNA損傷を誘発した。実際、その毒性はMDA-MB-231(ER陰性)に比べ、HEC1A(ER陽性)でより高かった。MDA-MB-231は、低レベルのERαおよびERβ受容体を発現するホルモン非依存性細胞と考えられており、したがってこの場合、グリホサートが非エストロゲン性メカニズムを通じて作用する可能性があり、この農薬の内分泌かく乱作用の可能性を示唆している[71]。この仮説に沿って、ヒトのホルモン依存性乳がん細胞株であるT47D細胞において、10-12から10-6 Mの範囲のグリホサート濃度が増殖促進効果を有することが示されている。エストロゲン応答因子(ERE)ルシフェラーゼアッセイ-三重鎖EREプロモータールシフェラーゼレポーター遺伝子構築物をトランスフェクトしたT47D-KBluc細胞株を用いて実施した結果、グリホサートはERE活性化を誘導する異性ホルモンとして作用することが証明された。このメカニズムはエストロゲンアンタゴニストのICI 182,780によって阻害され、グリホサート活性がERによって媒介されていることを裏付けている。したがって、グリホサートがERに結合することはまだ報告されていないが、EREが制御する転写を刺激することから、ER依存的なメカニズムで刺激効果を発揮する可能性が示唆された[72]。これらの観察から、様々な実験モデル系における細胞毒性および遺伝毒性作用に加えて、グリホサートはエストロゲン経路にも干渉することが指摘されているが、そのメカニズムはまだ解明されていない。さらに、次の段落で要約するように、GBHは、アンドロゲン合成の主要な制御酵素の破壊、エストロゲンとテストステロンの血清レベルの変化など、動物の生殖における悪影響を誘発することが報告されている[73]。
5. グリホサートによる生殖と発達への影響
高品質の配偶子の生産は、成功した生殖と種の保全のための最初のステップである。注目すべきは、生殖は視床下部-下垂体-性腺(HPG)軸の制御下にあり、視床下部ゴナドトロピン放出ホルモン(GnRH)、下垂体ゴナドトロピン、性ステロイドに主役を見出すことができる [74].栄養的な合図、薬物乱用、ストレス要因、環境汚染物質など、多くの環境要因がHPG軸に沿って複数のレベルで生殖に影響を与え、配偶子の質、生殖の成功、胚の発達、子孫の健康に影響を与えることは、以前にレビューしたとおりである [75,76,77,78,79].この点で、グリホサートは比較的安全であるにもかかわらず、さまざまな生物および細胞タイプを対象とした in-vivo および in-vitro 研究により、生殖に対するさまざまな悪影響が報告されている(図 4)が、化学組成(グリホサート単独または製剤)、用量および暴露期間に関するいくつかの論争がある。
図4グリホサートおよびグリホサート系除草剤(GBHs)が哺乳類の生殖能力、受胎能力および発育に及ぼす影響の模式図
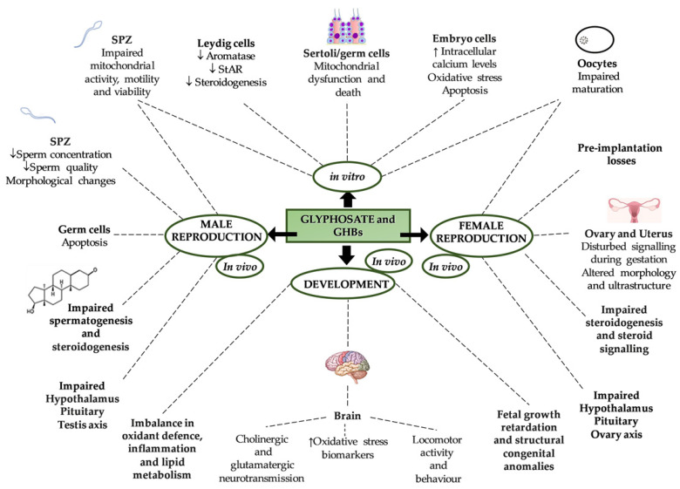
↓:減少、↑:増加
そこで、表1にグリホサートおよびGBHsの単独または組み合わせによるin-vivoおよびin-vitro処理後の哺乳類の生殖における有意な結果をまとめてみた。一般に、新生児期、(思春期前後)あるいは成体期におけるグリホサートあるいはGBHsの暴露は、HPG軸の生理を阻害し、生殖、性ステロイド産生およびシグナル伝達経路に重要なホルモン環境に影響を与える(詳細および参考文献は表1参照)。
表1グリホサートおよびグリホサート系除草剤(GBH)のインビボおよびインビトロ投与:哺乳類の生殖への影響
| 実験 | 種/細胞型 | 処理 | 効果 | 参照 |
|---|---|---|---|---|
| インビボ | 生まれたばかりの雌ラット | 皮下注射: PND1、3、5、および7に2 mg / kg / day GBH(カリウム塩中の66%グリホサート) |
↑脱落膜化反応の変化に関連するGD19の吸収部位の数 移植部位での形態学的変化 ↓エストロゲンおよびプロゲステロン受容体(ERおよびPR) ↓ COUP-TFII(Nr2f2)およびBmp2mRNA ↑ HOXA10 およびKi67 |
[ 80 ] |
| インビボ | 生まれたばかりの雌ラット | 皮下注射: PND1から7で2mg /kg/日のGBH |
妊娠中の子宮内シグナル伝達の乱れ(Wnt5a、β-カテニン、Wnt7a、Dkk1およびsFRP4) | [ 81 ] |
| インビボ | 生まれたばかりの雌ラット | 皮下注射: PND1から7で2mg /kg/日GBH |
↑LE過形成 ↑間質および子宮筋層の厚さ ↑増殖および子宮内膜増殖症 子宮の器官形成分化に関与するタンパク質の発現の変化(すなわち、PRおよびHoxa10、およびERα) |
[ 82 ] |
| インビボ | メスのウィスターラット(子犬) | 皮下注射:エンドスルファン(600μg/ kg体重/日)、GBH(2 mg / kg体重/日)、またはPND1から7までの混合物(混合物) | GBHと混合: ↑管腔上 皮過形成の発生率 ↑ PRとHoxa10の発現 ↑成人期の着床後の損失 エンドスルファン:ERαと Hoxa10の発現の変化。↑着床前の損失 |
[ 83 ] |
| インビボ | 離乳した雌の子豚 | 飼料へのグリホサート濃度10、20、および40 mg / kg | 外陰部のサイズと生殖器官に有意な影響はない 子宮と卵巣の組織形態と超構造の変化 ↑子宮の酸化ストレス ↑LHRH/GnRH ↑テストステロン ↓FSH |
[ 84 ] |
| インビボ | 思春期前の雌の雌羊の子羊 | PND1からPND14までのGBH(2 mg / kg / day)への経口および皮下暴露 | PND45: 卵胞ダイナミクスの変化 ↑顆粒膜細胞と卵胞膜細胞の増殖 ↓ FSHRとGDF9mRNA ↓ 子宮内での増殖 |
[ 85 ] |
| インビボ | 雌のフリージアン羊の子羊 | 皮下からのGBH(2mg / kg /日)。PND1からPND14への注入 | PND45(子宮): ↓細胞増殖 ↑p27 ↑インスリン様成長因子結合タンパク質3 ↓LEとGEおよびSSでのERα↓LEでの PR発現 ↑GEとSSでのPR ↓子宮での遺伝子発現(すなわち、GEのWnt5a、SSのWnt7a、LEとGEのβ-カテニン、SSのHoxa10 、 GEのFoxa2) |
[ 86 ] |
| インビボ | 8週齢の雄昆明マウス | 強制経口投与:切り上げ、60、180、540 mg / kg | 精子形成障害、 ↓精子の運動性と濃度 ↑精子の変形率↑アポトーシス関連因子1(XAF1) のX結合阻害剤の過剰発現を伴うメカニズムを伴う生殖細胞のアポトーシス |
[ 87 ] |
| インビボ | 思春期前のオスのウィスターラット | 強制経口投与:5、50、または250 mg/kg体重のグリホサート-PND23からPND53へのラウンドアップトランスソーブ | 精子形成の進行における用量依存的な変化 ↓精細管上皮の高さ ↓テストステロンの血清レベル |
[ 88 ] |
| インビボ | 4週齢のオスのSprague-Dawleyラット | 強制経口投与:グリホサート(2.5および25 mg / kg体重/日)または除草剤製剤Glyfonovaへの2週間の暴露 | Glyfonova: ステロイド産生遺伝子Cyp11a1およびCyp17a1の発現のわずかな増加 |
[ 89 ] |
| インビボ | オスのウィスターラット(12週齢) | 食事投与:375mg /kg/日グリホサート±20mg/kg/日レスベラトロール | ↓精子の運動性 ↓精子の原形質膜の完全性 ↓グルタチオンレベル ↓スーパーオキシドジスムターゼ ↑異常な精子率 ↑マロンジアルデヒドレベル ↑DNA損傷 すべての効果は、レスベラトロールの同時投与によって逆転した |
[ 90 ] |
| インビボ | オスのSpragueDawleyラット | 強制経口投与によるグリホサート5、50、500 mg / kg | ↓(50mg / kg用量)の用量での1日平均飼料摂取量 ↓精嚢腺および凝固腺(500mg / kg用量)の重量。 ↓総精子数(500mg / kg用量) テストステロン、エストラジオール、プロゲステロンおよび酸化ストレスパラメーターへの影響なし |
[ 91 ] |
| インビボ | 性的に成熟したオスのモルモット | 経口暴露:ウィロセート186、280、560 mg /kgを60日間毎日 | ↓精子の運動性、生存率、濃度 ↑精子の形態変化 |
[ 92 ] |
| 試験管内で | マウス卵母細胞 | 500μMグリホサート | ↓生殖小胞の破壊と最初の極体の押し出し 異常な紡錘体形態とDNA二本鎖切断 ↑酸化ストレス ↑ミトコンドリア凝集 ↓ミトコンドリア膜電位 ↓オートファジー関連遺伝子(lc3、atg14、mTor)とタンパク質(LC3、Atg12)の発現レベル |
[ 93 ] |
| invitroおよびinvivo | マウス卵母細胞 | インビトロ:0.00001%、0.00005%、または0.00025%GBH±メラトニン(10および100μM) インビボ:飲料水中で21日間毎日投与されるGBH(0.0005%ラウンドアップ溶液)±メラトニン(0、0.15、および1.5 mg / kg bw)、胃内投与により1日1回 |
卵母細胞の減数分裂成熟の障害 ↓最初の極体の押し出し、紡錘体の無秩序な形態、 染色体のずれ、ROSの生成 ↑アポトーシス率 ↓精子結合能と初期胚卵割の破壊 GBHの影響は、膜を含むメカニズムによるin vitro /invivoメラトニン処理によって逆転したGPER |
[ 94 ] |
| 試験管内で | ブタ卵母細胞 | 0、5、10、100、200、および360 µg/mLのグリホサートまたは同じグリホサート等価線量でのラウンドアップ | グリホサート: 核成熟および胚卵割への影響なし、胚盤胞率および細胞性の観点からの卵母細胞発達能力の障害総括:純粋な グリホサート よりも毒性が高く、ステロイド産生の変化 ↑ROSレベル |
[ 95 ] |
| 試験管内で | ラットの単離された精巣細胞と生殖細胞の共培養-セルトリ細胞 | グリホサートとラウンドアップ:1〜10,000 ppm、1〜48時間 | Leydig細胞:損傷(ラウンドアップ、1〜48時間) セルトリ細胞:毒性作用(グリホセートのみ) 生殖細胞:壊死(ラウンドアップ、24〜48時間)およびアポトーシス(高用量) 共培養アッセイ:セルトリ細胞および生殖細胞のアポトーシス細胞(高用量) ↓テストステロンレベル(ラウンドアップおよびグリホセート1 ppm) |
[ 96 ] |
| 試験管内で | PND30(prepubertal)Wistarラットのセルトリ細胞 | 低用量(36ppmまたは0.036g / L)での30分間の急性ラウンドアップ曝露 | 小胞体ストレス 抗酸化防御の枯渇 細胞死 |
[ 97 ] |
| 試験管内で | 未成熟セルトリ細胞株(TM4) | 市販のGBH:Genamin T200(732 g / Lポリエトキシル化タロウアミン、60〜80%POE(15)タロウアミン(POE-15)); グリホサート(グリホサート360 g / L); ラウンドアップバイオフォース(グリホサート360 g / L) |
ミトコンドリア機能障害 細胞解毒システムの破壊 脂肪滴の蓄積 農業以外の用量での死亡率 製剤は、グリホサートよりも有害な影響を及す |
[ 98 ] |
| 試験管内で | MA-10ライディッヒ細胞 | ラウンドアップ(180 g / Lグリホサート) | ジブチリル[(Bu)(2)]cAMP刺激プロゲステロン産生の阻害 ↓アロマターゼ活性 3β-HSDの活性に影響なし ↓StARタンパク質発現を破壊することによるステロイド産生 |
[ 99 ] |
| 試験管内で | 豚の精液 | 0〜360 µg/mLグリホサートまたはラウンドアップ | グリフォセート: ↓精子の運動性、生存率、ミトコンドリア活性 ↓精子の完全性まとめ: ↓精子の運動性( ≥5µg / mLグリホセート相当濃度)↓ミトコンドリア活性(25 µg / mLグリフォセート相当濃度) ↓精子の生存率と先体完全性(≥ 100 µg / mLグリホセート相当濃度) |
[ 100 ] |
| 試験管内で | 人間の精子 (n = 66人の健康な男性) |
1 mg/Lまとめ | ↓精子の運動性とミトコンドリア機能障害 | [ 101 ] |
| 試験管内で | 人間の精子 (n = 30人の健康な男性) |
0.36 mg/Lグリホサート | ↓精子の進行性運動性(治療後1時間) | [ 102 ] |
| 試験管内で | ヒト細胞株: (JEG3胎盤細胞株、HUVEC初代新生児臍帯静脈、および293胎児腎臓HEK293) |
ラウンドアップ定式化のGBH | すべての細胞株で24時間以内の細胞死 | [ 18 ] |
| 試験管内で | ヒト細胞株(JEG3胎盤細胞株およびHEK293) | グリホサート単独および14otの製剤 | 毒性作用 ↓アロマターゼの活性 |
[ 103 ] |
| 試験管内で | ヒトJEG3胎盤細胞株 | 0.05〜2%のグリホサートとラウンドアップ(360 g / Lグリホサート) | 農業用途よりも低濃度の毒性作用 ↓アロマターゼ活性 |
[ 104 ] |
| 試験管内で | ウシの着床前胚 | 切り上げ0.01〜2%(36〜7200 ppm、36〜7200 mg / Lグリホサートを含む) | 0.01〜2%の切り上げ用量はウシ胚に毒性がある | [ 105 ] |
| 試験管内で | ウシの着床前胚 | 切り上げ0、0.45、0.9、および1.8 ppm | ↑細胞内カルシウムレベル(2細胞胚) ↑酸化ストレス(2細胞胚) ↑アポトーシス(ウシ胚盤胞) |
[ 105 ] |
AR、アンドロゲン受容体;bw、体重;Cyp11a1、シトクロムP450ファミリー11サブファミリーAメンバー1;Cyp17a1、シトクロムP450ファミリー17サブファミリーAメンバー1;ER、エストロゲン受容体、FSH、卵胞刺激ホルモン。FSHR、卵胞刺激ホルモン受容体;GBHs、グリホサート系除草剤;GD、妊娠日;GE、腺上皮;GnRH、ゴナドトロピン放出ホルモン。GPER、Gタンパク質共役エストロゲン受容体1;3β-HSD、3β-ヒドロキシステロイドデヒドロゲナーゼ;LE、内腔上皮;PND、出生後日;PR、プロゲステロン受容体;ROS、活性酸素種;SS、上皮下間質;StAR、ステロイド生成急性調節タンパク質;↑、統計的に有意な増加;↓、統計的に有意な減少(p<0. 05以上)。
通常、ホルマリンは内分泌および生殖のエンドポイントに累積的な影響を及ぼす可能性があるため、グリホサート単独よりも劇的に影響する[106]。表1にまとめたように、女性の生殖において、グリホサートとGBHsへの暴露は、出生後の卵巣と子宮の発達、思春期の開始、卵母細胞の成熟、精子と卵母細胞の結合能力、初期胚の発達、着床、妊娠の成功に影響を与える。一貫して、生殖細胞の損失、精子形成の障害、および精子の質への悪影響が男性で報告されている。さらに、育児をするセルトリ細胞とステロイドを分泌するライディッヒ細胞の両方に対する毒性も観察されている[98,99]。この点で、グリホサートとその製剤が(胚性ヒト細胞における)P450sccアロマターゼの活性、胎盤細胞株、腫瘍MA-10ライディッヒ細胞に対する直接的阻害効果 [98,103,104] と性ステロイドシグナル伝達に対する広範囲な干渉に特に関心が持たれ、グリホサートとGBHが内分泌かく乱物質(EDC)のリストに加える必要があるという仮説を裏付けるような観察である。酸化ストレス反応の不均衡は、グリホサートとGBHsの男女共通の特徴であるが、その分子機構とヒトの生殖への悪影響の可能性を完全に解明するためには、さらなる研究が必要である。特筆すべきは、前述のグリホサートあるいはGBH曝露による生殖への影響について、異なる用量や製剤を用いた細胞株やげっ歯類ではほぼ解析されているが、ヒトや家畜でのデータは非常に限られていることだ。Anifandisと共同研究者は、2017年と2019年に[101,102]、それぞれn=66とn=30の健康なボランティアから採取したヒト精子におけるラウンドアップとグリホサートの精子運動性とDNA断片化への直接的影響を分析し、彼らの研究は、初めて、試験した除草剤がDNA完全性への影響なしに著しく精子運動性を低下させることを明らかにした[101]。一方、同年、Caiと共同研究者は、ラウンドアップがウシの着床前胚に有害な影響を及ぼすことを報告した[105]。最近、グリホサートとGBHがエピジェネティックな変化を誘発する能力が細胞株とげっ歯類で浮上した[107]が、最近のレビューでは、この点はまだ解明されていない。配偶子のエピミューテーションが初期胚の発達と健康を阻害する可能性を考慮すると、関連する分子機構を解明し、配偶子の質、生殖の健康、子孫の健康を守るために、グリホサートとGBHsの生殖影響に関するさらなる研究が必要であると思われる。
グリホサートは鳥類の卵に蓄積し [108]、線虫、魚類、両生類などにおいて発生と生殖に変化をもたらす [109,110,111,112,113,114,115] し、鳥類のモデルでは抗酸化防御、生殖、微生物腫に影響を与える [116]。同様に、哺乳類動物モデルにおける子宮内、授乳期、離乳期の慢性暴露に関するデータも争奪戦となっている(表2)。
表2妊娠中および授乳期におけるグリホサートおよびグリホサート系除草剤(GBH)への曝露:子孫の発育、生殖、生殖能力への影響
| 種族 | ダムの扱い | 露出ルート | ダムと同腹児数への影響 | F1への影響 (男性) |
F1への影響 (女性) |
参照 |
|---|---|---|---|---|---|---|
| ねずみ | 0.5%グリホサート-授乳期間中のGD4からの切り上げ | 水を飲んでいる | 妊娠中の体重増加の減少 は、同腹児数に影響を与えない |
精巣下降の遅延 PND150: ↓精巣上体尾部のSPZ↓ 精細管内の上皮の高さ ↑血漿中のLH ↑精巣内 テストステロンレベル |
NA | [ 117 ] |
| ねずみ | 0.5、5、および50 mg /kg/日グリホサートまたはラウンドアップ3プラスED10.5から20PND | 水を飲んでいる | NA | PND20: 精巣形態の変化(グリホサート) PND35: ↓血清テストステロンレベル(グリホサート) ↓SPZ、(0.5mg /kg/日ラウンドアップおよび5mg/kg /日グリホサート) ↓未分化精子細胞(5mg / kg /日グリホサート) 8 -生後1か月の動物:↓テストステロン(GBH) |
NA | [ 118 ] |
| マウス | GD1から生後30日までの0.5%グリホサート | 水を飲んでいる | NA | ↑高脂肪食と組み合わせた場合の成人期の空腸の炎症と機能障害のリスク | NA | [ 119 ] |
| ウィスターラット | 妊娠中および授乳中の0、50、150または450 mg/kgグリホサート | 水を飲んでいる | NA | 思春期: ↓血清テストステロンレベル 成人期: ↓精巣上体尾部の精子数 ↓毎日の精子産生 ↑異常な精子 ↑精子変性 |
膣管開口部の遅延 | [ 120 ] |
| ウィスターラット | GD9から離乳まで2mgまたは200mgのグリホサート/kg体重/日 | 食べ物 | NA | NA | F1:体重増加または膣開口部の発症に変化なし ↓着床部位 F2:成長の遅延 ↓胎児の体重と長さ ↑妊娠年齢の胎児の低出生体重児 ↑胎盤の重量と胎盤指数の 構造 ↑結合した胎児や異常に発達した手足などの先天性異常 |
[ 121 ] |
| ラット | GD9から離乳までのGBH(66.2%のグリホサートカリウム塩を含む)またはグリホサート(2mg / kg /日) | 口頭で | NA | NA | ↓着床前 ↑17β-エストラジオール血清レベル ↑子宮内のERα ↓ PRmRNA(グリホサート) ↓着床関連遺伝子(すなわち、Hoxa10とLif) |
[ 122 ] |
| スプラーグドーリーラット | グリホサート単独およびラウンドアップバイオフロー、GD6からPND120まで1.75 mg/kg体重/日 | 水を飲んでいる | NA | PND4: ↑AGD(すべての治療法)成人 : ↑血漿TSH(グリホサート) ↓DHT(ラウンドアップ) ↑BDNF(ラウンドアップ) |
PND4:↑AGD(すべての治療法)成人 : 最初の発疹の年齢が大幅に遅れた(切り上げ) ↑血清テストステロン(切り上げ) |
[ 123 ] |
| ラット | GD9から離乳まで350mgグリホサート/kg体重/日 | 食べ物 | NA | NA | ↑子宮内のERα-OmRNA変異体Esr1 – O プロモーターのエピジェネティックな変化(すなわち、↓DNAメチル化↑ヒストンH4アセチル化↑ヒストンH3リジン9トリメチル化(H3K9me3)↓H3K27me3) |
[ 124 ] |
| ねずみ | GD0からPND21までのGBH(250または500 mg / kg) | 強制経口投与 | 障害のある母親の行動の出生力と生殖 | 先天性反射の全般的発達遅延および運動発達の欠損 行動および認知障害を伴う海馬機能障害 |
[ 125 ] | |
| ウィスターラット | GD0から離乳までのグリホサート0.65または1.30g/ L(PND21) | 水を飲んでいる | NA | 神経行動学的変化(すなわち、崖嫌悪反射の早期発症および外耳道開放の早期、運動活動および不安レベルの低下) | [ 126 ] | |
| ウィスターラット | GD0から離乳までの0.65および1.30g/ Lの純粋なグリホサート(PND21) | 水を飲んでいる | NA | 脳の酸化ストレスバイオマーカーとグルタミン酸作動性およびコリン作動性システムの変化 | [ 127 ] | |
| ウィスターラット | 5および50mg/ kg /日 ラウンドアップ、(経口)GD18からPND5 |
水を飲んでいる | NA | 酸化剤防御、炎症および脂質代謝に関連する遺伝子の発現の変化 | [ 128 ] | |
| ウィスターラット | GD5からPND15またはPND60までの1%GBH(0.36%グリホサート) | 水を飲んでいる | NA | PND60での酸化ストレスと抑うつ様行動 PND15とPND60でのコリン作動性およびグルタミン酸作動性神経伝達の障害PND15とPND60 での星状細胞タンパク質S100Bの血清レベルの変化 |
[ 54 ] | |
| ラット | GBH(カリウム塩中の66.2%グリホサート)3.5または350 mg/kg体重/日GD9離乳まで | 食品を通して経口暴露 | NA | PND21:乳腺の発達またはエストラジオールとテストステロンのレベルに差はない PND60、GBH 3.5 mg / kg /日暴露動物: ↑ARタンパク質発現 PND60、GBH 350 mg / kg /日暴露雄: ↓増殖指数および発達の遅い乳腺 ↑PRL血清レベル 両方の曝露群: ↓ ESR1プロモーターの高メチル化によるESR1発現 |
[ 129 ] | |
| ラット | GBH(カリウム塩中の66.2%グリホサート)GD9から離乳まで3.5または350 mg/kg体重/日 | 食品を通して経口暴露 | NA | ↓GBH3.5曝露動物の増殖指数↓ ESR1、Ccnd1、Areg、IGF1、EGFR、IGF1R のmRNAレベル↓p-Erk1/2タンパク質 |
[ 130 ] | |
| ウィスターラット | 5mg /kg/日または50mg/kg/日GD18からPND5への切り上げ | 強制経口投与 | NA | ↓視床下部内のデヨージナーゼ2(Dio2)と3(Dio3)およびTHトランスポーターSlco1c1とSlc16a2 mRNA ↑ Dio2、甲状腺ホルモン受容体遺伝子(Thra1とThrb1)、および下垂体内のSlc16a2。 ↑肝臓でのThra1およびThrb1mRNA ↑心臓でのDio2、Mb、Myh6およびSlc2a4mRNAの発現 |
[ 131 ] | |
| ウィスターラット | GD5から授乳15日目までの1%ラウンドアップ(0.38%グリホサート) | 水を飲んでいる | NA | ラット海馬における興奮毒性と酸化ストレス | [ 31 ] | |
| ウィスターラット | ED8からED20まで48時間ごと、48時間ごとの純粋なグリホサート(24または35 mg / kg) | 腹腔内注射 | NA | Wnt5a-CaMKIIシグナル伝達経路の阻害を介した、反射神経の発達、運動活動および認知機能の用量依存的変化。 | [ 132 ] | |
AGD, anogenital distance; AR, Androgen Receptor; BDNF, Brain-Derived Neurotrophic Factor; bw, body weight; DHT, Dihydrotestosterone; ED, embryonic day; EGFR, Epidermal Growth Factor Receptor; ER, Estrogen Receptor; ESR, Estrogen Receptor gene; GBHs, glyphosate based-herbicides; GD, pregnancy day; IGF1, Insulin Growth Factor 1.Instructions, Instructions Growth Factor 1.IGF1R, Insulin Growth Factor 1.Instructions Growth Factor 1.IGF1R, Instructions Growth Factor 1.IGF1R, Instructions Growth Factor 1.Instructions Growth Factor 1.IGF1R, Inc; IGF1R, Insulin Growth Factor 1 Receptor; LH, Luteinizing Hormone; NA, not assayed/no information about; PND, post-natal day; PR, Progesterone Receptor; PRL, Prolactin; SPZ, spermatozo; TH, Thyroid Hormone; TSH, Thyroid-Stimulating Hormone; ↑, 統計的に有意に増加; ↓,statistics significant decrease (p < 0.05 at least). 05以上)。
母親の脳の可塑性、舐める行動、マイクロバイオームへの影響[133]とは別に、曝露された子孫は、脳、乳腺、炎症と脂質代謝、酸化ストレス反応、生殖においていくつかの長期的変化を示す(詳細と文献は表2参照)。DNAメチル化状態、ヒストン修飾、およびマイクロRNAやサーキュラーRNAなどのノンコーディングRNAの産生におけるエピジェネティックな変化も、最近レビューされたように、特定の脳領域で報告されている [107](※1) 。
曝露された子孫の生殖表現型に注目すると、グリホサートとGBHsは胎児をプログラムして、成人期に生殖障害を誘発する可能性がある。実際、HPG軸、性ステロイド産生および性ステロイドシグナルの障害、子宮生理の変化(おそらく着床不全に関連)、精子形成および精子の質の低下が、F1子孫における主な結果である。興味深いことに、魚類ではエピジェネティックな機構の変調が報告されており[134]、ラットではERαをコードする遺伝子であるESR1が関与するエピジェネティック機構がF1雌の子孫で報告されている[124]。反対に,Milesi 2018ら[121]は,哺乳類において,低用量のグリホサート製剤の周産期曝露が雌の生殖能力を損ない,F2子孫に胎児成長遅延と構造的先天異常を誘発することを示唆した[121]。
新生児期、思春期周辺、成人期におけるin-vitroおよびin-vivo曝露に関しては、グリホサート単独よりもグリホサート製剤への曝露で前述の影響が強くなる。
哺乳類では、アンドロゲン作用が報告されているが、グリホサートおよびGBHsの影響は雄よりも雌の生殖に強いと思われる。この点で、肛門生殖距離(AGD)は、いくつかの種における胎児期のアンドロゲン暴露の早期バイオマーカーと考えられており、動物実験において化学物質を評価するための生殖毒性エンドポイントである [135]。さらに、複数の疫学的研究により、乳児のAGD測定は、EDCへの胎内曝露に敏感であることが示されている[136]。人間の健康にとって「安全」と考えられる量のグリホサートを妊娠中に曝露すると、雌雄ラットの仔のAGDが著しく増加し、ラウンドアップ処理によって初発情年齢を遅らせ、成体では血清テストステロンが並行して増加した [123]。
最近、これらの可能性のあるアンドロゲン作用が、94人の妊婦を登録したパイロット試験でヒトにおいて調査された。彼らの2021年の研究では、Lesseurと共同研究者[137]は、超高性能液体クロマトグラフィー-タンデム質量分析によって、第2期の母親の尿試料中のグリホサートとその分解物であるAMPAを測定し、95%と93%の試料にグリホサートとAMPAがそれぞれ存在している(中央値は0.22 ng/mL と 0.14 ng/mL )ことが明らかにされた。次に、母親の尿中グリホサートレベルと、女性および男性乳児(それぞれn = 45および49)の肛門性器距離(AGD)の相関を調べた。男性乳児では相関は見られなかったが、女性乳児ではAMPAの増加が肛門器間距離の延長と関連していた。予備的ではあるが、ヒトにおけるデータは、グリホサートの性特異的影響の可能性を示唆し [137]、ラットで以前に報告されたラウンドアップのアンドロゲン作用 [123] を確認するものである。
以上を総合すると、健康リスクの可能性が存在する。グリホサートの発達及び生殖への影響の可能性を評価するため、より大規模な研究が必要である。
6. 結論
農薬への曝露は、環境に不可逆的な損害を与え、人間の健康に深刻な影響を及ぼすことが知られている。グリホサートおよびGBHへの曝露は、ヒトを全身性炎症性疾患、がんおよび神経障害の発症の素因となることが科学的証拠により示されている。しかし、観察された影響の分子メカニズムは完全には解明されていない。グリホサートとその代謝物であるAMPAがグリシンやグルタミン酸に類似していることは、観察された神経毒性および細胞毒性作用の一部を説明するに過ぎないだろう。一方、内分泌撹乱物質としてのグリホサートの作用に関する最近の知見は、特に生殖能力と生殖に悪影響を及ぼすホルモンの不均衡を誘発する能力を説明できる(図 5)。新生児期や思春期、成人期におけるin-vitroおよびin-vivo曝露に関しては、グリホサートおよびGBHsによるすべての影響が、グリホサート単独よりもその製剤で強く現れるようである。哺乳類では、グリホサートおよびGBHsの影響は、雄よりも雌の生殖においてより強いようである。
図5グリホサートとGBHsによる影響の模式図
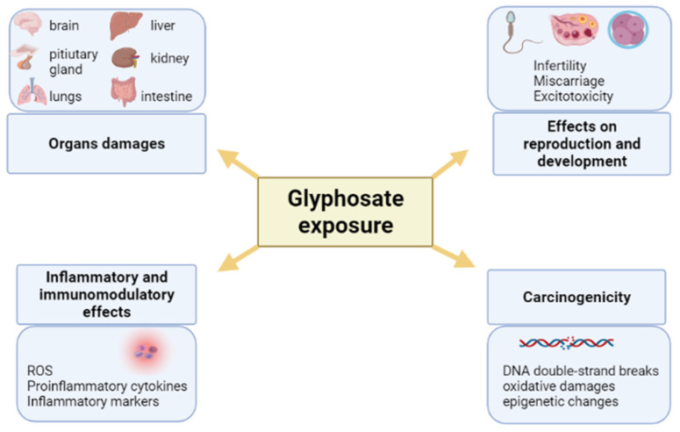
画像はBioRender.comで作成、2021年11月1日閲覧
実際、データ全体から見ると、いくつかの批判が生じる。
- (i) in vivoおよびin vitroで行われた研究は、1日の許容摂取量(ADI)の最終的な指標にはならない。
- (ii) グリホサートの遺伝毒性と細胞毒性に関する既存のデータは、その研究に用いられた実験条件が異なるため、まだ相反する。
- (iii) グリホサートによる一般集団や暴露農家への長期影響に関するデータはない。
- (iv) GBHはグリホサート単独より高い毒性を示すようだが、この問題に関する研究はまだほとんどなされていない。
したがって、現在までのところ、グリホサートの安全性について一義的な意見を持つことはできず、グリホサートに関連する人間の健康リスクはまだ過小評価されている可能性があるようだ。IARC はグリホサートをグループ 2A に分類し、「ヒトに対しておそらく発がん性がある」としたが、EFSA は技術評価を行い、グリホサートはヒトに対する発がん性ハザードを構成しないとしている。IARCとEFSAの分類の相違は、主に2つの専門家グループ間の見解の相違に起因している[41]。これは、一方ではIARCがグリホサートとGBHsの両方の毒性試験を分析したのに対し、EFSAはグリホサートに関するものだけを分析したためである。また、IARC のモノグラフに含まれる疫学研究の数は、EFSA が評価したものに比べて少ない。さらに、IARCは実験動物やin-vivoで得られた発がん作用や遺伝毒性、酸化ストレス、DNA損傷などを信頼できるとしたのに対し、EFSAはこれらの研究の重要性を認めながらも、グリホサート曝露とがんの相関性に関する疫学的証拠は限られていると結論付けている[10,41]。現在、EUにおけるグリホサート使用の承認期間は2022年12月15日までである。その間に、グリホサートやGBHsへの曝露が神経変性疾患や行動障害の発症に及ぼす可能性を調査することが望ましいと思われる。さらに、グリホサートおよびその製剤がヒトのがんの病因や発生に関与している可能性について、より深い知見を得るための研究を行うことも有用であろう。グリホサートは母乳にも含まれることから、ヒトの健康、特に将来の世代の健康を守るために、農薬の薬物動態やエピジェネティックな世代間遺伝を誘発する能力など、他の側面も調査する必要がある。
執筆協力
構想、A.S.およびR.M.、監修、A.S.およびR.M.、可視化、A.S.、M.M、E.M、R.M、執筆-原案、M.M、E.M. R.M., S.L.N.., A.V. and A.S.; Writing-review and editing, A.S., R.M. and A.V.; Funding acquisition, R.M., A.V. and A.S. All authors have read and agree for the published version of the manuscript.
資金提供
本研究は、A.S.へのサレルノ大学ORSA188304, ORSA191889, ORSA203141からのFARB、A.V.へのサレルノ大学ORSA185501, ORSA194321, ORSA203701、PRIN 2017、助成番号20175MT5EMからR.MとA.V. の支援により行われた。