Contents
Opportunities and challenges in using real-world data for health care
www.ncbi.nlm.nih.gov/pmc/articles/PMC6994109/
オンラインで公開2020年2月3日
Vivek A. Rudrapatna1,2およびAtul J. Buttec応答する著者1,3,4
概要
リアルワールドデータ(RWD)は,臨床エビデンスの新たな情報源として登場し続けている。RWDの使用例として最もよく知られているのは医薬品の規制であるが、RWDはバイオ製薬会社、支払者、臨床研究者、医療機関、患者など、多くの関係者によって生成・使用されている。本レビューでは、ヘルスケアの分野における RWD の 21 の潜在的な用途について説明する。また、これらのデータをエビデンスに変換するための重要な課題と限界についても議論する。
はじめに:リアルワールドデータの目的と理由
私たちは現在、データに囲まれた世界で医療を行っている。コンピュータと医療情報技術の進歩により、新しいバイオメディカルデータのソースと種類が生まれた。これらのデータの可用性が高まり、新たな利用法が生まれる可能性があることから、医療提供の領域を超えて多くの関係者が関心を寄せている。米国食品医薬品局(FDA)は、「リアルワールドデータ」(RWD)という言葉を用いて、「様々なソースから日常的に収集された、患者の健康状態および/または医療の提供に関するデータ」を意味している(1)。また、「リアルワールドエビデンス」(RWE)とは、「RWDの分析から得られた、医療製品の使用方法や潜在的な利益またはリスクに関する臨床的証拠」と定義している(1)。
RWDには、症例報告やレトロスペクティブな観察データなどが含まれるが、この定義では、実際にはより広範なデータソースを対象としている。これらには、電子カルテ(電子カルテ)(表1)行政データ、クレームデータ、レジストリー、ウェブサイトやウェアラブルセンサーからの患者生成データ、健康の社会的決定要因の測定値、および環境暴露が含まれる(2)。同様に、観察データから得られたエビデンスは、管理されていない低品質のエビデンスと解釈されることもあるが、RWEは因果推論のための分析デザインをより幅広くカバーしている。その中には、無作為化試験に似た任意の力で対象となる曝露の割り当てを行う自然実験も含まれている(3)。
表1 本レビューで使用した略語と用語

RWDは、医薬品の安全性を規制するために使用されることが最もよく知られているが、バイオ医薬品企業、支払者、提供者、政策立案者、患者など、ヘルスケアのエコシステムを構成する多くの参加者の関心を集めている(図1および表2)。本レビューでは、RWDの潜在的な有用性を評価し、その限界を明らかにする。まず、既存および新規のRWDの7つの大まかなカテゴリーと21の具体的なアプリケーションを紹介する。次に、RWDの使用における進行中の課題について詳細に議論する。私たちは、これらのデータに対する認識が広まることで、あらゆるレベルで人々の健康を向上させるというRWDの可能性を最大限に活かすことができると考えている。
図1 ヘルスケアデータを生成・消費するヘルスケアエコシステムの参加者
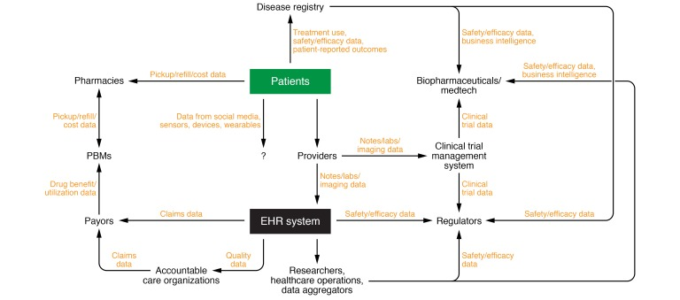
患者さん(および患者さんが構成するコミュニティ)は、すべての臨床データの基本的なソースである。患者さんが作成する臨床データの多くは、医療従事者との面会時に発生する。また、患者さんは、治療薬を購入する薬局、参加している登録機関、ソーシャルメディアやウェアラブルなどの最新/進化した技術の使用によってもデータを生成する。従来の医療現場や遠隔医療の現場では、臨床検査結果、画像、メモなどの臨床データがすべて生成され、電子カルテシステムに格納されている。これらのデータは、償還を促進するために再パッケージ化され、マネージドケア組織や医療費支払者に送信されることがある。また、これらの支払者は、薬局で調剤された薬剤の支払いを交渉する薬局給付管理者(PBM)に薬剤給付に関連するデータを送信する。電子カルテからの品質データは、特定の品質ベースの償還スキームをサポートするために、アカウンタブル・ケア組織(ACO)でも使用される。電子カルテデータは、臨床研究者、医療業務を監督する個人、データアグリゲーターにも利用される。後者は、治療の安全性と有効性のモニタリングなどに必要なデータとして、バイオ製薬会社や規制当局を含むさまざまな関係者が利用できるように、これらのデータを非識別化して再パッケージ化する。ほとんどの患者データはRWDの一形態であるが、一部の患者データは対照試験の設定で収集される。ペースメーカーや除細動器などの心臓機器や血糖値測定器からのデータが電子カルテに取り込まれることはあるが、消費者向けのウェアラブルやセンサー、ソーシャルメディアからのデータは、現在のところ電子カルテシステムに統合されていない。しかし、これらのデータは、ヘルスケアにおける有用性の可能性について研究されるようになってきており、将来的には統合される可能性がある。Datavant社の許可を得て引用している(58)。
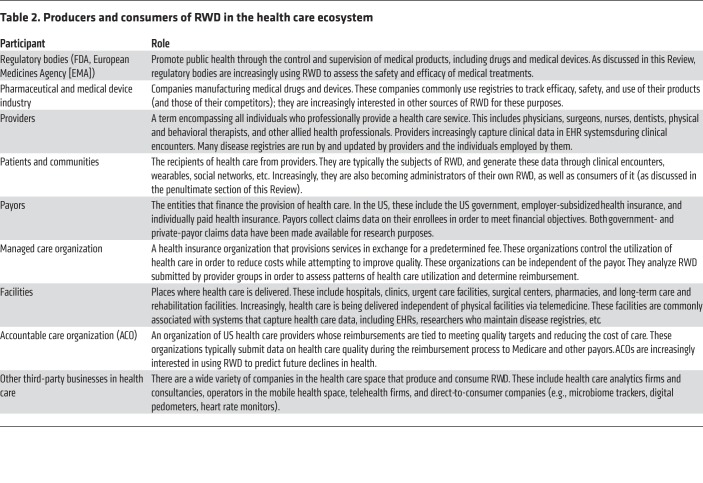
表2 ヘルスケアのエコシステムにおけるRWDの生産者と消費者
承認後の安全性に関するRWD
副作用率の更新
第3相臨床試験では、臨床的に重要な有害事象を検出するのに十分な検出力が得られない可能性があるため、規制機関やバイオ医薬品スポンサーは、承認後の医薬品の安全性を調査するために、別のアプローチに頼っている。FDAが採用している主な方法は、第IV相試験である。これは、第III相試験で一般的に検討されるよりも多くの集団と長い期間を評価する、非盲検かつ非介入の試験である。一方、バイオ医薬品企業は、市販後の安全性と有効性の研究を行うために、主に国内の登録機関に依存していた。これは主に、これらのレジストリが、患者/医師の経験、コンプライアンス、アクセス/利用、償還、競争力のある情報など、商業的に関心のある他のデータを収集しているためである。
RWDを規制当局が採用した最も早い例の1つが、FDAセンチネル・イニシアティブである(4)。Sentinelは 2008年に設立された連合ネットワークで、製品の安全性をモニタリングするために全国のクレームデータ、電子カルテデータ、レジストリデータを統合している。センチネルシステムの主な利用者はFDAであるが、バイオ製薬会社やイベント検出法を開発している研究者など、他の関係者による利用も増えている。SentinelのようなパッシブサーベイランスシステムやMedWatch(5)のような規制当局のプラットフォームは、重要な安全性シグナルを捕捉し確認するための、より効率的で費用対効果の高いリアルタイムな方法として、時間とともに重要性を増していくかもしれない。
新たな副作用の発見。
電子カルテや患者が作成した多くの情報源(ソーシャルメディアなど)に存在する最も価値のあるデータの多くは、構造化されていない自由記述のデータの形で存在している。これらのデータは、構造化されたデータフィールド(診断のためのICDコードなど)に比べて計算処理が難しく、そのためSentinelのようなほとんどのRWDデータベースからは除外されていた(表1)(6)。しかし、フリーテキストデータには、従来のプロトコル化された構造化データの収集に比べて、いくつかの利点がある。第一に、表現力が豊かで、厳密に定義されたカテゴリーを持つ構造化フィールドに邪魔されないことである。第二に、この情報収集は患者が始めたものである可能性があるため、フィルタリングが少ないことである。その結果、これらのデータは、予期しない副作用についてのより詳細な調査を伝える可能性がある。自然言語処理の進歩により、フリーテキストはこの種の分析にますます扱いやすくなっている。
電子カルテデータだけでなく、ソーシャルメディアを含む他のフリーテキストのソースをファーマコビジランスのプラットフォームとして分析することにもメリットがあるかもしれない(7)。例えば、最近のある研究では、抗がん剤に起因する皮膚の副作用が、文献に報告される約7か月前にこれらの情報源から特定できることを示した。
フィルタリングされていない生のRWDに対するデータマイニング技術は、他の種類の副作用を発見する可能性もある。例えば、クローン病におけるブプロピオンの抗TNF効果のような有益な副作用も含まれる(9,10)。また、創薬・開発段階では予測が困難な、2種類以上の薬剤の組み合わせによる予期せぬ副作用も、電子カルテデータを用いてより多くのコホートで確認できる可能性がある(11)。
観察データは有害事象の検出に不可欠な役割を果たしているが、特に先行研究が矛盾している場合には、確認のための無作為化比較試験(RCT)が依然として必要である。例えば、広く使用されている抗糖尿病薬については、骨折(12,13)や切断(14)などの重大なリスクを確認するための試験が必要であった。
規制当局の承認をサポートするRWD
単群の実験的試験
プラセボ対照・二重盲検のRCTは、臨床エビデンスのゴールドスタンダードであることは間違いないが、この理想は現実的でないことが多い。例えば、希少疾患や致死性疾患の場合、一部の被験者を無治療群に振り分けることを倫理的に正当化することが困難な場合がある。また、試験の費用が高すぎたり、被験者の募集が困難であったり、薬事規制の期間が長くなったりすることもある。
このような標準的なエビデンスを得ることが困難なため、多くの研究者は、より迅速で費用のかからない代替手段を模索している。これには、対照群に関連するデータを過去の情報源から得たり、電子カルテなどのRWDの情報源から得たりするシングルアームの実験的研究が含まれる。ここで重要なことは、この試験デザインは、これまでも、そして今も、当局の間で議論の的となっているということである。これは、プラセボ効果が多くのシナリオで実質的かつ予測不可能であることが大きな理由である。そのため、この方法を用いた最近の規制当局の申請は、治療効果が迅速かつ実質的に期待でき、未治療の疾患の自然史が十分に理解されていると考えられる疾患に限定されている(15)。しかし、規制当局の姿勢の変化は、臨床科学の真の進歩というよりも、(21世紀キュアズ法や患者支援団体、バイオ医薬品企業のロビー活動などによる)過度の政治的圧力によるところが大きいという意見もある(16)。
規制の領域を超えて、支払い者の適用決定をサポートするために、歴史的および合成的なコントロールも使用されている。例えば、ALK+非小細胞肺がんに対するALK阻害剤であるアレクチニブ(17)は、2つの単群第II相試験に基づいて米国と欧州で承認されたが、欧州の支払者は、標準治療であるセリチニブに対するアレクチニブの有効性を示す追加証拠を求めた。本製品のスポンサーであるロシュ社は、Flatiron Health社と共同で、要求された適用条件を満たす77名の患者の合成対照コホートを作成した。その後のRCTでは、傾向をマッチさせた合成対照群とセリチニブを投与した群との間で同等の有効性が確認された(18, 19)。
デジタル承認
米国のような規制環境下では、医師が治療法を適応外で処方することは認められているが、ある治療法の規制上のラベルは支払者の適用決定に影響を与え、最終的にはどのくらいの患者が治療を受けるかに影響する。FDAのような規制機関は、RWDに基づいてラベルの拡大を承認することが多くなっている。例えば、CDK4/6阻害剤であるパルボシクリブは、臨床試験では女性(乳がん症例の99%以上を占める)のみを対象としていたため、ER+/HER2乳がんの女性のみに承認されていた。2019年4月、スポンサーのPfizer社は、その集団でのオフラベル使用に関連して電子カルテに取り込まれたアウトカムデータに基づいて、男性への使用の承認を得ることができた(20)。同様に、医療機器の分野では、FDAが最近、経カテーテル心臓弁SAPIEN 3を、大動脈弁または僧帽弁が故障していて手術のリスクが大きい患者のためのバルブ・イン・バルブの処置として使用拡大を承認した。この追加適応の承認は、プロスペクティブに収集された登録データの評価に基づいて行われた(21)。
バイオシミラーの開発
生物学的製剤は、生物由来の医薬品の一種であり、リウマチなどの多くの慢性疾患の経過を変えてきた。しかし、製造が複雑で、製造コストが高い。特許満了時に安価なノンブランドの生物製剤の承認を得るために、FDAはバイオシミラーの迅速な承認経路を確立した。バイオシミラーとは、安全性、純度、効力の点で先発医薬品との実質的な類似性を示す必要がある生物製剤である。バイオシミラー医薬品は、安全性、純度、有効性の点で先発医薬品との実質的な類似性が示されなければならない。迅速な規制措置により、1つの適応症から基準医薬品のすべての適応症への有効性の外挿が可能となることもあり、臨床関係者の多くは当初、バイオシミラー医薬品を大きな懸念材料と考えていた。しかし、複数の実地試験により、適応症やコホートを問わず、バイオシミラーの安全性、有効性、先発品に対する非劣性が繰り返し証明され、これらの懸念を払拭することができた(22,23)。このように、リアルワールドでの実質的な類似性を裏付ける研究により、臨床現場ではこれらの低価格医薬品が受け入れられるようになってきた(24)。
臨床試験デザインに役立つRWD
より良い患者選択
2017,ライフサイエンス企業を対象とした調査では、調査参加者の54%が、臨床試験のデザインと患者募集をサポートするために、RWE能力に投資していることがわかった(25)。臨床初期の段階では、RWD(電子カルテからのデータなど)を利用して、満たされていない臨床ニーズを持ち、新しい治療法の恩恵を受ける可能性が高い臨床コホートを特定することができる。これらのデータは、臨床試験の除外基準を改善し、対象となる患者の獲得を向上させるのに役立つ。さらに、RWDは、最適な試験会場を特定し、臨床現場でのより効率的なリクルートとリテンションを可能にするためにも使用できる。これらの介入は、統計的検出力と一般化可能性を高めつつ、試験期間を短縮する可能性がある。このような可能性の多くは、募集とデータ交換の最適化を期待して、すでに研究ネットワークの形成につながっている。その例としては、公的なNIHのClinical and Translational Science Accrual to Clinical Trials (CTSA ACT)プログラム(26)や民間のTriNetXネットワーク(27)などがある。
電子カルテデータは特に実地臨床試験に関連している(表1)。これらはRCTの一種であり、因果関係を明らかにするというよりも、日常の臨床現場で意思決定者が直面する実際的な疑問に答えることを目的としている。電子カルテデータは、対象となる疾患の典型的な診療パターン(受診頻度、検査・画像診断など)を明らかにすることで、より効率的な試験プロトコルの設計を可能にする。このような臨床現場で行われる試験では、将来的には臨床現場のワークフローに組み込まれた無作為化スキーム(例:チェックイン時の同意、診療中の無作為化など)をより活用することができる。
試験の削減:より効率的なデータ収集
過剰なデータ収集は、臨床試験が医薬品開発プロセスにおける多額の費用、複雑性、および遅延の原因となっていると非難されている(28)。RWDは、臨床的に最も頻繁に使用される変数は何か、どの変数が有益か、どの変数が冗長かもしれないかを臨床試験の設計者に知らせることにより、このデータ収集プロセスの複雑さとコストを削減するのに役立つかもしれない。さらに、複数の介入を動的に評価できるアダプティブプラットフォーム試験など、臨床現場における新しい試験デザインは、試験の効率をさらに高め、コストを削減する可能性のある貴重なRWDの源となるかもしれない(29)。もちろん、試験依頼者は、新たなデータ収集の期待値を規制当局と調整する必要があるであろう。
有効性を継続的に立証するためのRWD
有効性-効果のギャップを評価する。
有効性-効果のギャップとは、RCTで報告された有効性の割合と、日常の臨床現場における有効性との間にある体系的な差異のことである(30)。このギャップが存在する理由として、患者集団の違い、エンドポイント、観察期間、分析方法、治療アドヒアランスの違い、交絡や測定バイアスなど、複数の理由が提案されている。RCTの一般化の問題を解決するために、RWE研究は非常に注目されており、特にリアルワールドの研究をRCTと比較してベンチマークすることを目的とした研究が行われている(31,32)。これらの違いをよりよく理解することは、地域の臨床実践と将来の臨床試験デザインの両方に役立つ可能性がある。
特定の集団における有効性の検索
特に、RCTは対象者が限定されていると批判されている。女性、特に妊娠中の女性や妊娠の可能性のある人は、多くの試験から除外される可能性がある(33)。慢性腎臓病(CKD)患者もまた、この疾患コホートの中で大きな重要な割合を占めているにもかかわらず、多くの心血管試験から除外されている(34)。望ましくない結果の変動を抑制し、試験の効率を最大化したいという願望は、これらの研究の内的妥当性と外部的有用性の間の基本的なトレードオフを反映している。
RCT がこれらの脆弱な集団を十分に捉えていない場合、RCT を除外すると、RWD で埋めなければならない重要なエビデンスのギャップが生じる。例えば、最近の研究では、10年分の電子カルテデータを用いて、炎症性腸疾患やがんを示唆するような警告的な症状(直腸出血など)を報告する妊娠中の患者における下部内視鏡検査の安全性を研究している(35)。同様に、RWDは、慢性腎臓病患者の抗凝固剤の安全性と有効性を明らかにした。この患者集団は、抗凝固剤による治療が必要な状態になりやすいが、対照研究から除外されることが多い患者集団である(36)。
効果修飾因子と精密医療
サブグループにおけるリアルワールドの有効性を具体的に研究することで、効果修飾因子(例えば、グループによる治療の相互作用)や精密医療に関する研究の可能性が広がる。治療効果修飾因子には、遺伝的要因、併用薬、併存疾患、手術歴、食事、その他の生活習慣(運動、喫煙など)など、さまざまな形態がある。RWDを用いて治療効果修飾因子を同定することは、患者の選択(例えば、治療に反応する可能性が最も高い患者の選択)や、患者に合わせた行動修正(例えば、インスリン感受性を増強するための運動[参考文献37]、クローン病に対するNSAIDsと禁煙[参考文献38])の指針となる。しかし、より重要なのは、これらの研究が病態生理や疾患の基本的なメカニズムに重要な光を当ててくれることである(39)。しかし、これらの構成要素の多くは、よく知られている健康の社会的決定要因であっても、臨床電子カルテではまだうまく捉えられていないことに注意する必要がある(40)。全体として、精密医療のサブグループの特定は、複数の仮説検証による偽陽性の影響を受けやすいため、特に困難であることに留意すべきである。
臨床試験後の長期的な結果
対照試験に対するもう一つの批判は、特に慢性疾患のタイムスケールと比較して、試験期間が短すぎることである。継続的かつ膨大なデータ収集に関連する多額の費用に加えて、長期試験は試験参加者の負担を増加させ、彼らはますます脱落しやすくなる。
治験後の長期成績の分析は、治療の有効性と安全性に関する貴重な情報源となっている。例えば、2型糖尿病を対象としたUK Prospective Diabetes Studyと1型糖尿病を対象としたDiabetes Control and Complications Trialの10年および30年の追跡データでは、徹底した血糖コントロールを行った結果、疾患合併症が長期的に減少したことが示されている(41, 42)。電子カルテのようなRWDの情報源は、試験後の登録ではまだ追跡されていない元試験参加者を特定し、有効性と安全性の観点から彼らの転帰をさらに追跡することができるかもしれない。
さらに、臨床試験からの個々の参加者のデータ共有の出現により、リンケージ法によって、重要な長期的アウトカムのより完全な理解が促進されるかもしれない。しかし、これを実現するためには、電子カルテにおける臨床試験参加の表現を改善する必要があり(例えば、後に試験の盲検化を解除した後、患者がどの治験薬やプラセボで治療を受けたかを後から記録する方法)また、患者が報告したアウトカムの記録(例えば、HealthMeasures、PROMIS)も必要である。
比較効果のためのRWD
コストと比較効果の統合
合理的でコストを意識した意思決定をクリニックに持ち込むための全体的な取り組みの中で、比較効果研究は、リアルワールド効果研究の次の論理的なステップを表している。比較効果試験は、複数の薬効分類があり、1つの薬効分類の中に複数の薬剤が存在する慢性疾患に特に関連している。臨床試験における薬剤の直接比較は、費用がかかることや産業界からの資金提供がないことが主な理由で、まれにしか行われていない。比較が行われる場合は、優越性の評価ではなく、非劣性の研究として行われることが多い。
比較効果の研究を促進するために、米国議会は2010年にAffordable Care Act (ACA)の一環として、相対的な効果を調査し、メディケア適用の意思決定に役立てるためのPatient-Centered Outcomes Research Institute (PCORI)を設立した。PCORIは、そのデータネットワークであるPCORnetを利用して、多くの重要な集団研究に資金を提供していたが、従来の指標である質調整生存年(43)を用いた費用対効果の研究に資金を提供することは法律で禁止されている。法案成立時にこのような制限が設けられた理由は、イノベーションが阻害され、保険適用の決定が滑りやすくなるのではないかという懸念や、米国ではコストのばらつきが大きいため、このような研究は誤解を招く恐れがあるということ、また、ACAの成立に関連した政治的な理由など、複雑なものであった。これに加えて、メディケアが薬価を集中的に交渉することが禁止されていることも、米国の医療費の悪化につながっていると考えられる。
これらの制限は、RWDがこの重要なエビデンスギャップに対処し、コストを考慮したフレームワークに配置する可能性を強調している。具体的には、料金データは、電子カルテまたはクレームデータに一致する形で取得することができる。RWDを用いて患者の平均的な使用状況やコンプライアンスを組み込んだパフォーマンス指標とコストを統合することで、受益者や支払者が高品質なケアを受けられるようにすることができる(簡単な例として、1ドルあたりのヘモグロビンA1cの低下量によって糖尿病治療薬をランク付けすることができる)。電子カルテデータの収集量が増えれば、このような研究をより多く実施するための効率性が向上し、PCORI自身が支援を求めている比較費用効果研究が可能になると思われる(44)。
薬剤師の業務が医療利用に与える影響を理解する
高額な医療費を理解し、抑制することは明らかに重要である。現在、規制の可能性が検討されている行為の一つに、医薬品メーカーと薬局給付管理者(支払者に代わって処方箋給付の交渉と管理を行う仲介者)の間で行われるリベートの使用がある。薬剤のリベートは、薬剤費を削減するものとして一般的に宣伝されているが、リベートのうち実際にどの程度が受益者に還元されているかなど、この慣行の透明性が低いことに批判的な意見がある(45)。同様に、これらの慣行が医薬品の「定価」にどのような影響を与えるのか(例えば、定価を実際に上昇させたり、逆説的に受益者の安価な医薬品へのアクセスを低下させたりする可能性があるかどうか)も不明である(45)。
RWDは、医療費請求データであれ、その他の行政上の請求データであれ、この不透明な慣行に重要な透明性を与える可能性がある。特に、異なる支払者の患者間での処方パターンの系統的な違いを明らかにすることにより、RWDはこれらの市場要因が医療利用や転帰に及ぼす影響を明らかにすることができるかもしれない。
新規のオンラベル医薬品と旧来のオフラベル医薬品の比較研究
旧来の安価な医薬品を適応外で使用することにより、適応内の医薬品と同様の有効性と安全性が得られることがある。しかし、適応症に対する正式な規制当局の評価を受けていないため、保険会社から保険適用を拒否されることがよくある。例えば、ocrelizumabは最近、多発性硬化症の治療薬として承認されたが、類似性の高い旧薬であるrituximabは多発性硬化症に適応外で使用されていた。ジェネンテック社はこの2つの薬剤を製造しているが、私たちの知る限り、リツキシマブについては特許満了が近いこともあり、FDAの承認を求めなかった。これらの薬剤を直接比較する臨床試験が少なくとも1件進行中であるが(NCT02980042,ClinicalTrials.gov、参考文献46)この質問は、RWDがこれらの薬剤をコスト、有効性、安全性、および薬剤の免疫原性のような他のエンドポイントで比較するための例示的な機会となるかもしれない。製薬会社にはこのような研究を行うインセンティブがないかもしれないが、支払者や医療機関などがRWDを使用して費用対効果を研究し、将来の保険適用の決定に役立てることができるであろう。
医療行為の研究のためのRWD
診療の質と医療過誤
RWDの分析は、医療従事者レベルでの医療行為の質の測定に役立つ。医療行為に関連する医療グループは、RWDを使用して、パフォーマンスの低いプロバイダーと高いプロバイダーの両方を具体的に特定し、これをベストプラクティスを普及させる戦略の基礎として使用することができる。また、RWDは、人種、性別、その他の社会経済的な層を超えた医療提供の公平性を批判的に評価する可能性もある。この種の質問は、今でもサンプルの記録を確認しながら手作業で行われているが、自動化されたシステムを使えば、より包括的で一貫性のある質の評価が可能になる。規制機関や支払者は、提供されたケアの質を評価するために、一般的に臨床データを使用するが、これらの報告書は、より詳細な情報が提供されることから、請求データよりも電子カルテデータを使用して作成されることが多くなると予測している。
内部データに基づくダッシュボードや医師の「スコアカード」は、これまで支払者や患者から厳重に守られていたが、規制の変更やデータの相互運用性の実践により、これらのデータがインターネット上の既存の医師評価プラットフォームと統合されていくにつれて、時間の経過とともに変化していく可能性がある。
ケアとケアデリバリーの標準化
米国のような医療システムでは、過剰な医療費と転帰の悪化の主な原因として、診療の過度な変動が関係している(47)。望ましくないばらつき(例:エビデンスに基づく診療から逸脱したばらつき)を減らすための重要な第一歩は、システム、コミュニティ、診療所、プロバイダのいずれのレベルであっても、現在の診療を正確に把握してモデル化し、実行可能な変更を特定することである。コストとアウトカムの観点から、変動の現状と介入への反応を測定する分析プラットフォームは、支払者とアカウンタブル・ケア組織の両方にとって、RWDのもう一つの使用例となる。
医療に対する支払者の影響
米国では、支払者は、アクセス、コスト、アウトカムなど、医療のさまざまな側面に大きな影響力を持っている。支払者の実務のばらつきを理解することは、重要な医療アウトカムに及ぼす影響について重要な洞察をもたらすだけでなく、市場規制やベストプラクティスに関連する知識を広めるのにも役立つ。
事前承認や拒否を含む支払者の決定は電子カルテに記録されており、その効果を理解するために回帰不連続や道具変数分析などの因果推論技術を用いて分析することができるかもしれない。高価な医薬品や機器の多くは、支払者による事前承認が得られないと使用できない。医師(またはそのスタッフ)は、承認申請と拒否または承認のサイクルを繰り返すことがある。これらの取引に関連するデータは、実際の拒否通知を含め、電子カルテシステムに取り込まれることが多くなっている。支払者と薬剤ごとの承認・拒否率を系統的に検討することは、特にそのようなデータが公表されたり公開されたりしている場合には、参考になるかもしれない。例えば、ある薬を処方されるはずだったが、支払者が拒否した結果、別の治療を受けることになった患者を、意図した通りに治療を受けることができた同様の患者とのマッチドコホート研究の設定で分析することができる。
新世代の診断法は治療成績を向上させるか?
遺伝情報が初めて臨床に登場したのは、腫瘍や希少疾患の分野であったが、ゲノム検査は増加しており、新しい多遺伝子リスクスコア検査が開発され、プライマリーケアの現場でも提案されている(48)。しかし、このような高価な検査が普及すると、「それだけの価値があるのか」という重要な疑問が生じてく。初期の研究では、コスト面と実施の実用性についての検討が始まっている(49,50)。しかし、まだほとんど解決されていない大きな問題は、ゲノムデータが医療の成果にプラスの影響を与えているかどうかということである。支払者が価値のある高品質なエビデンスを要求し、規制当局が診断薬の消費者への直接販売に対する管理を強化するまでは、検査の有無、検査結果、臨床結果、コストを把握するRWDプラットフォームがこの疑問に答え始めるための最適な位置にあるのかもしれない。
データ駆動型意思決定支援のためのRWD
臨床意思決定支援:プロバイダーの視点から
ほとんどの臨床医は、キャリア全体の中で、急性ポルフィリン症や腸間膜炎の症例を1例しか見たことがないかもしれない。しかし、1,000人の医療従事者を抱える医療機関では、これらの疾患に何十回も遭遇している確率の方がはるかに高いのである。この考えは、RWDと臨床意思決定支援の未来にとって最もエキサイティングな展望の1つである、「グリーンボタン」と呼ばれる概念の核心をなすものである(51)。このコンセプトは、臨床家がデータと経験に基づいて行動できるようにすることで、臨床上の意思決定を強化することを提案している。
「グリーンボタン」コンセプトの最も直接的な実装方法は、類似した患者のアウトカムに関するデータを提供することや、依頼を受けた臨床医を、彼らの経験や学んだ教訓を語ることができる以前のプロバイダーにつなぐことなどである。このアイデアの別のエキサイティングなバージョンは、臨床コンサルテーションサービスとしてのインフォマティクスであり、既存の臨床診療報酬の枠組みの中で、電子カルテを利用したデータや推奨事項をプロバイダーが利用できるようにするものである(52)。より洗練されたバージョンでは、次元削減/クラスター化、教師付き学習、強化学習などの機械学習手法を利用して、組み込み型のレコメンデーションシステムを構築することができる。
このコンセプトがもたらす潜在的な影響は非常に大きい。第一に、人口統計や手術の専門知識などの地域的な要因を考慮することで、真に個別化された医療を実現できる可能性がある。第二に、臨床データ共有プロトコル(FHIR対応のアプリケーション・プログラミング・インターフェースなど)や連携学習手法により、最終的にはシステム間で何百万年もの患者から得られた知見を活用することが可能になるかもしれない。第三に、システム間での同じ患者に対する推奨事項の違いを注意深く研究することで、医療システムが相互に学ぶための重要な新しい洞察が得られるかもしれない。
臨床決定支援:患者の視点
医療情報技術の進歩により、患者はケアコーディネーションのために複数のシステム間で自分の臨床データを統合することができるようになってきているが、患者が自分のデータをして自分に合った使い方をすることはそれほど容易ではなかった。「ブルーボタン」のようなツールの登場により、患者が自分の医療データにアクセスできる機会が増えている(53)。
一般的なユーザーは、自分の健康状態を把握したり、将来の医療費支出の計画を立てたり、家族や介護者と健康情報を共有したりする目的で、ブルーボタンのツールを活用するかもしれないが、医療データの自由化によって、未来の患者はもっと多くのことができるようになるかもしれない。自分のデータをもっとコントロールできるようになれば、患者は自分の健康記録を追加・修正することができる(54)。患者は、質問に答えてくれるアプリを使うのに最も適した立場にいるかもしれない。患者は、「あなたのデータがあれば、私たちは次に何をすべきだと思うか?
このような未来のツールは、臨床研究者がこれまで未開拓だった参加者にアプローチするのにも役立つであろう。例えば、マンモグラムの深層学習など、クラウドソースによる臨床研究の試みに、患者が自分の臨床データを貸すことができるようになるかもしれない(55)。
臨床意思決定支援:コミュニティの視点
RWDの情報源は、病院と診療所の間だけでなく、幅広い範囲に及んでいることから(例えば、大気汚染物質や水質汚染物質、薬物乱用、銃による暴力、職業上の暴露、社会経済的地位、気候や天候パターンなど)ヘルスケアの取り組みを方向付けるために、コミュニティレベルでの関与が増える可能性がある。データの中には、政府機関やその他の公的機関からすでに提供されているものもあるが、地域社会の要望や地域の法律に合わせて提供されるものもある。これらのデータが利用可能になれば、コミュニティ自身がデータ監査を行い、ヘルスケアの優先事項を主張したり、世界のデータサイエンスコミュニティに活動への参加を呼びかけたりするためのリソースとなるかもしれない。データに基づいた取り組みは、最高の発明品を適切な都市の適切な家庭に適切な時期に正確に提供するために利用できるかもしれない。
RWDの利用における課題
このレビューでは、RWDの複数のユースケースを簡単に紹介した。進行中のものもあれば、まだ見ぬものもある。RWDの可能性に期待する理由はたくさんあるが、多くの課題も横たわっている。それは、疫学的課題と生物医学情報学的課題である。
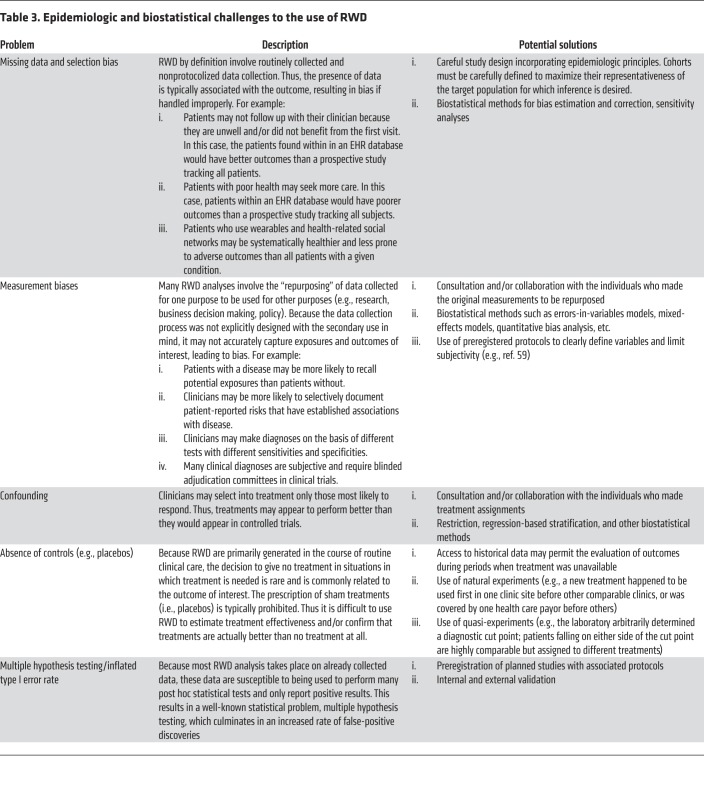
疫学的な課題は、主にデータの質とバイアスの問題である(表3)。これらの問題は、一般的に、その場限りのデータ収集や、適切にデザインされコントロールされた実験から得られる品質管理の欠如から生じるものである。ほとんどのRWD分析の基本的な前提は、これらのバイアスを分析段階で特定し軽減することができるということであるが、そのためには、疫学、臨床領域や医療システム自体に関する知識、生物統計学、臨床情報学など、かなりの専門知識が必要となる。
表3 RWDの使用における疫学的および生物統計学的な課題
データを「ノイズ除去」し、分析を「偏りなく」行うための専門知識があったとしても、そのプロセスの成功は、データ自体の範囲内では評価できない。それには、独立した証拠による外部からの検証が必要である。このように、RWEは単独では頼りにならず、対照試験の代わりにもならないというのが私たちの見解である。それどころか、学習する医療システムを実現するために、医療システムの利害関係者と実際的な臨床試験者の両方と深く関わっている。
また、バイオメディカルインフォマティクスのレベルでも多くの課題がある。実際の現場でのデータ収集は、しばしば行き当たりばったりで標準化されていない。自然言語処理を用いたフリーテキストの分析は、手法や計算機の進歩により進化しているが、これらの技術の使用は、ほとんどが方法論の開発レベルにとどまり、一般の研究者には手の届かないものである。構造化データは、ほとんどの分析に欠かせないものであるが、データソース間の標準化や調和が取れていないなど、独自の課題がある。
また、データへのアクセスも大きな課題である。RWEが期待されているのは、母集団レベルのデータセットを統合することで統計的有意性が得られる可能性があるからである。米国では、プライバシー保護の文化が根強く、デジタルプライバシーに対する社会的な関心が高まっているが、重要な知見を得るために臨床データを共有することは困難である。データの窃盗、操作、その他の悪意ある利用のリスクは、ニュースが流れるたびに明らかになってきている。識別情報の削除が試みられているが、すべての種類のデータについて根本的に不可能な場合がある。合成コホートやフェデレーテッド・ラーニングなど、実際のデータの移転を避けるための戦略も検討されているが、ほとんどが初期段階のものである。データへのアクセスの階層化は避けられないと思われ、完全な非公開と広く公開されたアクセスの間には、許可されたアクセスの多くの段階が存在すると考えられる。
また、競争の激しい米国の医療システムは、データ交換の妨げにもなっている。国内で提携している医療機関は、隣接する(つまり競合する)医療機関よりも、お互いに臨床データを共有する可能性が高いと考えられる。競合していない “友好的 “な医療機関が、それぞれの地域でデータを共有しているという、いわば “交差点 “のような状態になっているのではないであろうか。しかし、この規模でデータを共有するための一貫した説得力のあるビジネス上の理由は、まだ実現していない。臨床データの相互運用にはリソースが必要であり、予算を持っている人は、研究者がより良い論文を発表したり、助成金を獲得したりするのに役立つ以上の、相互運用するための経済的な理由が必要になるだろう。上に挙げたいくつかの用途は、その理由付けに役立つかもしれない。
かなりのハードルがあるにもかかわらず、私たちはRWDがあらゆるレベルのヘルスケアを変革する可能性について楽観的であり続けている。このようなデータを取得するに至った人間の創意工夫は、これらの課題を克服し、人権を保護し、世界中の人々がより健康で生産的な生活を送るための洞察を解き放つ可能性をも秘めていると信じている。
