Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7329662/
要旨
21世紀の最初の20年間で,高病原性コロナウイルス(CoV)による重症呼吸器感染症が世界各地で3回発生している.2002年~2003年のSARS-CoVによる重症急性呼吸器症候群(SARS)、2012年6月のMERS-CoVによる中東呼吸器症候群(MERS)、そして現在ほとんどの国に影響を及ぼしているSARS-CoV-2によるコロナウイルス疾患2019(COVID-19)である。これらすべてにおいて、死亡者は肺、腎、心、循環器の障害による多臓器不全の結果として生じている。
しかし、COVID患者は、頭痛、吐き気、嘔吐、感覚障害などの重大な神経学的徴候や症状を示すことがあり、その中でも特に顕著なのが無呼吸や老衰である。CoVの神経侵襲性がこれらの症状の少なくとも一部に関与している可能性があり、患者で観察される呼吸不全に寄与している可能性がある。
そこで、本稿では、CoVsが誘発する中枢神経系の損傷のメカニズムと結果について、前臨床で得られた証拠をレビューし、感染者の急性および長期の神経疾患を決定したり、悪化させたりする上でのCoVsの潜在的な役割を強調した。我々は、CoVsの重要な神経毒性を広く認識することは、ウイルス誘発性の中枢神経障害の徴候や症状をより早く認識することに貢献すると考えている。
さらに、CoVが中枢神経系の機能に影響を与え、中枢神経系に障害を引き起こす細胞・分子機構をよりよく理解することは、予後評価や標的治療介入のための新たな戦略の立案に役立つと考えられる。
1. はじめに
コロナウイルス(CoVs)は、ニドウイルス目(Nidovirales)、コロナウイルス科(Coronaviridae)に属するRNAエンベローププラス鎖ウイルスの亜科であり、最近、進行中のコロナウイルス病2019(COVID-19)のパンデミックの原因物質として世界的に悪評を得ており、すでに何十万人もの死者を出している(https://www.who.int/emergencies/diseases/novel-coronavirus-2019)。
系統的クラスタリングに基づいて4つの属(α-、β-、γ-、δ-CoV)に分類される50種類以上のCoVが現在知られている(de Groot et al. ほとんどのCoVは動物の病気を引き起こすが、最近まで、ヒトの病気、通常は自己限局的な呼吸器感染症を引き起こすことが知られていたのは、2つのα-CoV(HCoV-229Eと-NL63)と2つのβ-CoV(HCoV-OC43と-HKU1)の4つだけであった。
新しい千年紀の初めに、ヒトに対して高病原性の3つの新しいβ-CoVが、重症急性呼吸器症候群(SARS; SARS-CoV)および中東呼吸器症候群(MERS; MERS-CoV)のパンデミック、さらに最近ではCOVID-19パンデミック(SARS-CoV-2)の原因となっていることが証明された。
3つのウイルスはいずれも、もともと拡散したと考えられている下等動物種に感染するCoVと厳密に関連している。
最近の研究では、頭痛、吐き気、嘔吐、および感覚障害などの有意な神経学的徴候および症状(最も顕著なものは、無神経症および老衰である)がCOVID-19患者において発生する可能性があることが示されている。さらに、CoVIDの神経侵襲性がこれらの症状の少なくとも一部に関与している可能性があり、患者で観察される呼吸不全に寄与している可能性があるとの仮説が立てられている。
そこで、本稿では、CoVsによる中枢神経障害のメカニズムとその結果に関する前臨床的証拠をレビューし、感染者の急性および長期的な神経疾患の決定または悪化におけるCoVsの潜在的な役割を明らかにした。
この目的のために、以下の研究用語を用いて、査読付き国際学術誌に英語で発表された研究(日付制限なし)の論文リポジトリ(PubMed; pubmed.ncbi.nlm.nih.gov/)を検索した。
コロナウイルス、SARS、MERS、COVID-19、MERS-CoV、SARS-CoV、SARS-CoV-2、神経ウイルス性・神経感染機構、神経疾患、免疫介在性神経障害、動物モデル。
さらに、本明細書に記載されている病態生理学的メカニズムのいくつかを含むCOVID-19に対する潜在的な治療法を研究している進行中の臨床試験データベース(https://clinicaltrials.gov/)を検索した。タイトルと要旨のスクリーニングは全著者が行い、本レビューの目的に関連すると思われるものを検索し、解析し、その主な知見を本原稿に報告した。
2. コロナウイルスの神経ウイルス性:動物モデルからのエビデンス
実験動物におけるβ-CoVsの高い神経毒性は数十年前から知られている。実際、CoVが中枢神経系に感染する可能性があるという最初の証拠は、微生物学者ジョン・ハワード・ミューラー(Pappenheimer)に敬意を表して命名されたJHMウイルス(JHMV)であるβ-CoVsマウス肝炎ウイルス-4(MHV-4)の神経栄養株が1940年代末に収集された。
自然に後肢麻痺を発症したマウスから分離され、マウスに接種すると、脱髄がパッチ状に広がるびまん性脳脊髄炎を誘発することが示された。新生児および離乳ラットにおいて、JHMVは、通常数日で致死的な急性全脳筋炎、または数ヶ月にわたって進行する亜急性麻痺性疾患、またはウイルス接種後6〜8ヶ月後に現れる慢性進行性麻痺のいずれかを誘発する。
これらの病態は、急性型では広範な神経細胞死、壊死および多形核酸浸潤、亜急性型では血漿細胞およびマクロファージからなる血管周囲カフィングおよび軸索が大部分保存された大規模な脱髄性病変、慢性型ではびまん性の脊髄軟化症、大脳皮質の菲薄化および水頭症など、総体的および顕微鏡的病理学的に大きく異なる。亜急性麻痺性疾患の脱髄病変は、多発性硬化症(MS)の脱髄病変と病理組織学的にかなり類似していた。
JHMVはげっ歯類における唯一の神経ウイルス性CoVではない。実際、その同定から数年後、Dickらは、マウス肝炎ウイルス-3(MHV-3)の変異神経栄養株を分離したが、これは肝炎を引き起こさないが、マウスの脳内注射で致死的な髄膜脳炎を誘発した。
その後、CH3マウスやAG2マウスのようないくつかの感受性の高いマウス株では、野生型のMHV-3変異体もまた、脳血管炎や髄膜独立膜炎の組織学的証拠に関連した協調性の欠如や四肢麻痺などの神経学的症状を誘発することが報告された。
興味深いことに、CoVはげっ歯類とは異なる種においても神経疾患を誘発する可能性があり、子豚の脳脊髄炎を引き起こすVW572株のβ-CoVブタ血球凝集性脳脊髄炎ウイルスや、猫の著しい中枢神経系障害を引き起こすネコのα-CoVに見られるように、CoVは神経疾患を誘発する可能性がある。
前述したように、過去20年間のヒトにおける劇的なアウトブレイクの原因となったCoVは、おそらく動物種に由来し、後にヒトに伝播したものと考えられる。したがって、CoVsの神経ウイルス性が種特異的であるかどうかを理解することが重要である。
利用可能な証拠は非常に限られているが、CoVは元々の宿主とは異なる種の脳に感染するように容易に適応することができる。実際、神経栄養性MHVは、ラットおよびサルにおいても脳炎を誘発する可能性がある。
そして驚くべきことに、HCoV-OC43はマウスに急性脳炎を誘発し、臨床徴候および脳病理組織学的変化はJHMVで報告されたものと非常によく似ている。これらの知見は、CoVが自然宿主とは異なる種で脳障害を引き起こす可能性があることを確認し、ヒトの病原性CoVもまた、重要な神経ウイルス性の潜在能力を有していることを示唆している。
マウス、フェレット、ハムスター、サルなどの異なる動物種がSARS-CoVに感染したことがあるが、ヒトの感染とは異なり、これらの動物は軽度の感染症しか発症しなかった。特に、C57BL/6マウスにSARS-CoVを経鼻投与しても、肺でのウイルスの一過性の複製が起こるだけで、症状はほとんど起こらない。
興味深いことに、これらのマウスでは、SARS-CoVは脳に広がり、主に海馬を標的とする。C57BL/6マウスにおけるSARS-CoVの病原性が低いのは、ウイルス(その受容体はヒトACE2に代表され、以下を参照)のマウスACEに対する親和性が低いためと考えられている。
実際、ヒトACE2酵素を過剰発現するトランスジェニックマウス(K18-hACE2マウス)にSARS-CoVを経鼻的に接種したところ、大脳、視床、脳幹の神経細胞で高いウイルス力価を示し、嗅球、小脳では相対的にウイルス力価が低下し、致死的な感染が誘導された。しかしながら、ヒトACE2を過剰発現するトランスジェニックマウス(ACE2-HB-01マウス)をSARS-CoV-2に経鼻感染させた場合、肺の炎症を伴う軽度の疾患経過しか示さなかったが、脳への関与は認められなかった。
MERS-CoV受容体hCD26/DPP4を過剰発現させたトランスジェニックマウスを用いた戦略もまた、ヒトMERSの重症度を再現するために必要であった。hCD26/DPP4マウスをMERS-CoVの中等度負荷で感染させると、主に脳幹に局所的に有意な脳損傷が発生し、血管周囲カフ、アポトーシス体、および活性化ミクログリアが観察された。逆に、大脳皮質では軽度の髄膜炎のみが発生した。
3. CoVsの神経侵入のメカニズム
CoVは、血行性と神経原性の2つの方法で中枢神経系に侵入することができる(図1)。血行性侵入は、一過性のウイルス性エピソードの後に神経ウイルスが脳内に侵入し、血液脳関門(BBB)を通過することで起こる。CoVによる血行性神経浸潤は、ヒト呼吸器合胞性神経向性ウイルス(hRSV)と同様に、2つの非変異的に除外されたメカニズムによって起こる可能性がある。
一つは、遊離ウイルス粒子がBBBの内皮細胞を介して直接侵入することによるもの、もう一つは、急性期に気道で感染した末梢血細胞(主に単球/マクロファージ)をハイジャックして、血液からBBBの内皮細胞間の傍細胞ルートを介して脳に移行することによるものである。
実際、好中球、マクロファージ、およびナチュラルキラー(NK)リンパ球は、感染の初期段階でMHV複製をサポートする可能性があり、MHVに感染した脳組織にリクルートされ得る。さらに、SARS-CoVを含むCoVの異なる株は、呼吸器感染時に末梢性骨髄細胞に感染し、感染した白血球は、中枢神経系への侵入のためのリザーバーとして機能し得る。
一方、CoVはまた、脳に直接侵入することができ、炎症性メディエーターの放出を介して髄膜の炎症およびBBBの完全性への損傷を引き起こす。リンパ節は、CoVs感染の初期段階でしばしばコロニー化しており、血行性浸潤のための追加の中間部位である可能性がある。
図1
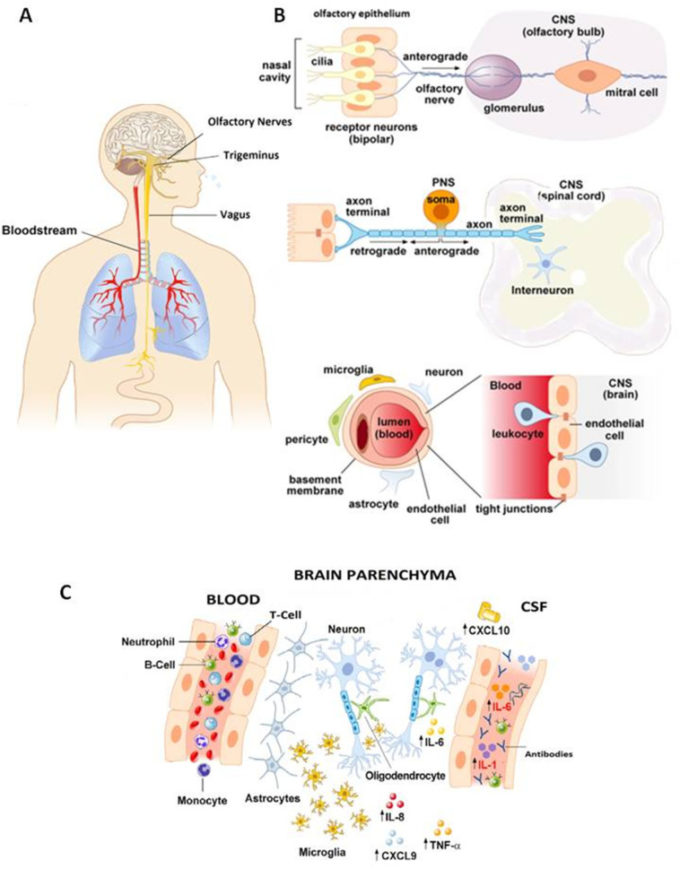
CoVsの神経浸潤の潜在的な解剖学的(A)、細胞(B)、および分子(C)メカニズムの模式図。
各パネルの説明は本文を参照のこと。
一方、神経原性侵襲では、ウイルスは感染部位に応じて特定の末梢神経に沿って逆行性の軸索輸送を介して中枢神経系に侵入する。例えば、嗅上皮を植民地化する呼吸器ウイルスは、嗅神経線維を用いて中枢神経系に侵入することがある。この侵入機構は、とりわけ、単純ヘルペスウイルス-1、小水疱性口内炎ウイルス、ボルナ病ウイルス、ラビアーウイルス、インフルエンザAウイルス。
鼻腔および上気道を司る三叉神経および迷走神経などの他の神経は、神経栄養性IAVなどの呼吸器ウイルスのための追加の主要な侵入経路であるが、CoVの神経侵入においてはわずかな役割しか果たしていないようである。
迷走神経は消化管粘膜に感染するCoVの中枢神経系へのゲートウェイとして機能する可能性があり、PHEV-67 Nのように、経鼻接種後に豚の小腸粘膜の上皮細胞に感染し、その後、末梢神経を介して消化管の蠕動機能を担当する中枢神経細胞に逆行性に輸送され、いわゆる嘔吐症を引き起こす。
3.1. CoV受容体
CoVが一次感染部位に侵入し、後に中枢神経系を含む遠隔部位に拡散する能力は、宿主細胞上に位置する特定の受容体との相互作用に依存している。多くの実験的研究は、スパイク(S)タンパク質が、CoVsの細胞トロピズムおよび病原性の主な決定因子であることをしっかりと指摘している。
ウイルスエンベロープ中で重度のグリコシル化された膜貫通三量体を形成するSタンパク質は、α-CoV HCoV-229EのアミノペプチダーゼN(APN)に代表される特定の細胞受容体との相互作用を介して、感受性宿主細胞へのCoVsの侵入を媒介する。
SARS-CoVおよびSARS-CoV-2の場合のアンジオテンシン変換酵素2の場合のジペプチジルペプチダーゼ4(DPP4)。代わりに、免疫グロブリン様CEACAM1aタンパク質は、MHVsの受容体である。これらの受容体はまた、中枢神経系ニューロン、グリア細胞および内皮細胞においても発現しており、これらの受容体が細胞特異的標的化を媒介し得ることに留意することが重要である。
Sタンパク質は、クラスI融合タンパク質の構造を有し、同じタンパク質に含まれる2つの機能的サブユニット、受容体結合を担うN末端表面サブユニット(S1)と、ウイルスの内部化を媒介するC末端膜貫通サブユニット。受容体に結合すると、Sタンパク質は特定のプロテアーゼによって切断され、それによってS2サブユニットが放出され、膜融合およびウイルスの内部化が開始される。
SARS-CoVおよびSARS-CoV-2のSタンパク質の切断は、膜貫通セリンプロテアーゼ2(TMPRSS2)によって媒介される;TMPRSS2の薬理学的阻害は、SARS-CoV-2への感染を有意に減少させ、したがって、COVID-19の治療のための潜在的な戦略を表す。
3.2. 神経栄養性MHVによる神経侵入
神経強壮性超高ウイルスは、投与経路によって異なる神経侵入メカニズムを利用している。静脈内または腹腔内経路によるMHVの全身投与は、脳内での血行性伝播に続いて行われ、このプロセスは、脳微小血管内皮細胞(BMEC)に感染し、BBBを緩めるCoVの能力によって促進される。
肝原性MHV-3ウイルスは、炎症性サイトカインの放出を誘発することなく、タイトジャンクションを障害し、BBBを緩めることによって脳に侵入するが、それでも感染したBMECによるIFNβ産生を減少させる。
逆に、MHV-A59ウイルスは、グリア-ピアギャップジャンクションの重要な決定因子であるコンネキシン43(Cx43)の発現および形質膜局在を減少させることにより、BBBを直接的に緩める。最後に、JHMV誘発BBB損傷は、サイトカイン放出およびメタロプロテイナーゼ活性化に依存する。
神経原性ルートで中枢神経系に侵入するMHVの能力は、マウスの鼻腔内接種後、JHMVが最初に鼻粘膜に感染し、その後、嗅覚線維を介して脳内に進行して脳の前部に到達し、少なくとも4日後に後領域に侵入することを示す逐次免疫化学分析によって実証された。
このモデルでは、三叉神経もJHMVに感染する可能性があるが、嗅球を除去したマウスでは脳への感染は起こらないので、三叉神経経路が主要な侵入経路ではないことは明らかである。嗅覚線維を介した脳への侵入は、MHV-A59ウイルスでも実証されている。
3.3. HCoV-OC43による神経浸潤
HCoV-OC43 は神経原性ルートを介して中枢神経系に侵入することができる。
マウスへの経鼻接種後、HCoV-OC43は、感染から3日後に嗅覚ニューロンの細胞体および樹状突起に最初に現れ、その後、海馬、呼吸核を損傷することができる脳幹、そして最終的には大脳皮質および脊髄を含む他の脳領域に伝播する。
硫酸亜鉛を用いた嗅覚上皮の破壊は、脳への浸潤を消失させ、神経浸潤に対する嗅覚繊維の重要な役割をさらに支持した;対照的に、経鼻ウイルス接種後にウイルス粒子が一般循環に見られなかったため、血行性の浸潤は除外された。
最後に、HCoV-OC43はヒトで胃腸炎を引き起こす可能性があるが、迷走神経経路を介した中枢神経系への伝播を示す証拠は今のところ報告されていない。
3.4. SARS-CoVおよびMERS-CoVによる神経侵入
SARS-CoVによる神経侵入のメカニズムは、ヒトSARSの貴重な実験モデルであるヒトACE2を過剰発現させた上記のK18-hACE2トランスジェニックマウスを用いて検討されている。
これらのトランスジェニックマウスにウイルスを接種した後、連続して採取した脳を解析したところ、ウイルスは嗅球から脳内に侵入し、嗅球の神経細胞から急速に除去され、その後、より遠位の領域に拡散することが明らかになった。
驚くべきことに、嗅球に直接接続している領域(海綿状皮質、大脳基底核、中脳を含む)だけでなく、シナプスに直接接続していない領域にも急速に侵入していることから、経シナプス伝播以外の別の侵入経路が関与している可能性が示唆されている。
背側迷走神経複合体は、嗅球と直接接続していない脳構造のうち、疾患の初期に侵襲されるものの一つである。その損傷は、このように心肺不全による動物の死に寄与する可能性がある。
SARS-CoVが迷走神経背側核に侵入するために用いた経路はまだ明らかになっていないが、経鼻投与後の腸内ではウイルスが発見されていないため、迷走神経線維を介した腸からの伝播は関与していないと考えられる。
重要なことは、経鼻投与後、SARS-CoV-2は神経細胞でのみ検出され、グリアのコロニー化や炎症性細胞の浸潤は認められず、血行性ルートを介した中枢神経系への伝播は除外されていることである(Netland et al. 特筆すべきは、K18-hACE2トランスジェニックマウスでの研究から明らかになったSARS-CoVによる神経浸潤のパターンは、Glassらが野生型C57マウスで観察したパターンとは異なっていることである。
この研究では、嗅球の関与の証拠は見られず、ウイルスの場所は、トランスジェニックマウスでは頻繁に感染しないか、またはわずかに、そして最近感染した領域である海馬に優勢であった。
このような異なる神経侵入パターンは、SARS-CoVが高親和性のhACE2受容体が存在しない場合に、別の経路で脳に侵入するためなのか、あるいは野生型マウスでは脳感染の進行が遅かったためなのかは、現在のところ不明である。
MERS-CoVによる神経浸潤のメカニズムは、これまでのところ研究されていない。しかしながら、hCD26/DPP4トランスジェニックマウスの脳幹における血管周囲浸潤および大脳皮質における髄膜炎の発生は、神経原性感染パターンとはほとんど適合せず、血行性浸潤とよりよく適合する。
3.5. CoV誘発中枢神経障害の細胞および分子機構
JHMV、HCoV-OC43、またはSARS-CoVに曝露したマウスまたはヒトの細胞培養物を用いた試験管内試験(in vitro)実験では、CoVがニューロン、グリア細胞、およびBMECに感染することが示されている。
重要なことに、試験管内試験(in vitro)または生体内試験(in vivo)で感染した神経細胞およびグリア細胞は、非常に長い間CoVを保有している可能性がある。非神経細胞は、組織の損傷や治癒に関与している可能性があるため、中枢神経系におけるCoV感染の神経生物学的な役割を担っていると考えられる。
さらに、それらの機能不全は、CoVによる重度の脳感染を複雑にし得る脳卒中または発作(Devinsky et al 2013;Ravizza et al 2013;Vezzani et al 2008)などの関連する神経学的障害の病因に寄与する。
JHMVがアポトーシスを促進することにより培養オリゴデンドロサイトを死滅させる可能性があることを示す証拠が報告されておりまたはヒトにおいて限定的な組織炎症を伴って起こるCoV誘発性中枢神経系損傷の急性または超急性型において役割を果たしている可能性がある。
しかし、大多数の場合、CoVの神経侵入は、ウイルスを除去して感染の解消を助けるか、免疫介在性の中枢神経系損傷を引き起こすかのいずれかの組織炎症を伴う大規模な免疫応答を誘発する。重要なことは、CoVが検出できなくなった場合でも、ウイルスは潜伏した状態で脳内に残存するため、真の免疫が達成されることはほとんどないということである。
3.6. 急性感染時のCoV誘発中枢神経障害とCoVクリアランスのメカニズム
特定のCoV誘発性神経感染症が解決、進行、または慢性化へと進展するかどうかは、炎症反応を促進または抑制する因子間の絶妙なバランスに依存する。
自然免疫応答と適応免疫応答の両方の活性化は、CoVsクリアランスと感染治癒のために極めて重要であるが、炎症性メディエーターの放出は、中枢神経系に深刻なダメージを与える可能性がある。
マウスにおけるJHMV誘発神経感染に関する研究は、免疫応答の特定の時間的シーケンスを明らかにした:一旦中枢神経系内に入ると、ウイルスは、有意な多形核酸、マクロファージおよびNK細胞の浸潤を伴う自然免疫を誘発する。
サイトカインおよびケモカインの放出は組織の損傷を引き起こし、最終的には長期的な適応免疫が確立され、感染を根絶したり、中枢神経系の自己免疫攻撃を開始したりする。
自然免疫の早期活性化は、ミクログリア細胞によるINFα/βの放出と関連している。強いINF応答は感染の解決を予測し、一方、弱い応答はウイルスの持続および慢性中枢神経系感染のより高いリスクに関連する。
Wheelerらは最近、重度のJHMVバリアント誘発性脳炎を有するマウスの生存にミクログリア活性化が必須であることを報告した。
IL-1α、IL-1β、IL-6、IFN-γ、TNF-α、およびCXCL10を含む炎症性サイトカインおよびケモカインは、自然免疫応答の一部として中枢神経系常駐細胞(マクロファージ、グリアおよび内皮)および浸潤細胞によって放出され、神経組織の損傷およびその後の適応免疫の活性化の両方において重要な役割を果たしている。
実際、前述の自然免疫応答のメディエーター(TNF-α、IL-12 p40、IL-6、IL-15、およびIL-1など)のmRNAレベルと異なるMHV株の神経ウイルス性との間に相関があることが実証されており、CoV神経ウイルス性のマスターレギュレーターとしてのこれらのサイトカインの役割がさらに強化されている(Li et al. 実際、神経ウイルス性のJHMVに感染したマウスの脳では、IL-1およびIL-6 mRNAの転写が強力に活性化されているが、より減衰したMHV-A59株では活性化されていない。
さらに、MHVに頭蓋内感染したマウスの脳由来CD11+細胞、ミクログリア、マクロファージには高レベルのIL-1βが認められた。これらのマウスの生存率は、IL-1受容体アンタゴニスト(IL-Ra)アナキンラでの処置により増加した。
これらのメカニズムのいくつかの病態生理学的関連性もまた、ヒトにおける研究から支持を受けている。IL-1β、IL-6、IL-8、およびTNF-αのようなプロ炎症性サイトカインのレベル、およびIL-RaおよびIL-10のような抗炎症性サイトカインとのそれらの比率は、多くの中枢神経系炎症性疾患における損傷の進行と相関している。
視神経脊髄炎、横隔膜炎、急性播種性脳脊髄炎(ADEM)、筋萎縮性側索硬化症、単純ヘルペス脳炎、パーキンソン病、外傷性脳損傷、てんかん、および脳卒中を含む。
実際のところ、高レベルのIL-6、IL-8、MCP-1、およびGM-脳脊髄液が、急性脳炎様症候群を有する入院小児からの血清および脳脊髄液(脳脊髄液)サンプルの両方において、および最近のCoV誘発性呼吸器感染症の血清学的証拠において見出された。
CoV神経感染の初期段階で放出されるケモカインのうち、IFN-γによって誘導されるCXCL9およびCXCL10の両方は、SARSに罹患した患者の末梢血中の最も初期の炎症性マーカーの一つである。
SARS感染患者の脳サンプルでは、CXCL9とCXCL10の両方のレベルが異常に上昇していた(Xu et al. マウスのHCoV-OC43によって誘発される直接的な細胞毒性と間接的な免疫介在性の神経ウイルス性メカニズムの間には、IL-6がグルタミン酸依存性の体外毒性を促進すること、およびNMDAグルタミン酸受容体拮抗薬メマンチンがHCoV-OC43感染マウスにおいて有意な神経保護をもたらすことが実証されたことから、潜在的な関連性があるとの仮説が立てられてきた。
最後に、全身循環におけるサイトカインの大量放出(サイトカインストーム)と血管内播種性凝固および多臓器不全をもたらす過活動性免疫反応は、COVID-19患者の主要な死因である。このことは、COV誘発性疾患の進行における免疫系の重要な役割をさらに強調している。
3.7. 潜在感染時のCoV誘発性中枢神経障害のメカニズム
前述したように、CoVに対する免疫応答は必ずしも真の免疫をもたらすとは限らず、CoVは神経細胞またはグリア細胞に潜伏したままである。これは、JHMV感染後に亜急性脱髄性疾患を発症するマウスにおいて示されている。同様に、MHV-A59の持続性は、C57BL/6マウスの中枢神経系において、脳および脊髄の脱髄性病変を示すことが示されている。
また、霊長類に神経ウイルス性のJHM株OMP1ウイルスを静脈注射したフクロウザルの脳内では、215日後までにウイルス粒子とRNAが検出された(Cabirac et al)。さらに、生後8日目にHCoV-OC43を脳内注射したBALB/cマウスでは、感染後少なくとも5ヶ月間、ウイルスRNAが中枢神経系に持続した。
中枢神経系におけるウイルスの持続は、亜急性および慢性型のMHVや、おそらくHCoV-OC43によって誘発される脱髄性疾患の発症に重要である。これらの感染症では、病理組織学的な損傷は主に免疫介在性であり、直接的な細胞病理学的影響はほとんどないようである。
実際、B細胞およびT細胞の成熟に欠陥のあるマウスではJHMV感染後の脱髄は起こらないが、正常マウスからウイルス感染した脾臓細胞を移植した場合には脱髄性病変が観察される。JHMVウイルス感染は自己反応性T細胞クローンの発生を誘発する可能性があるが、これは脱髄の主要なメカニズムではないようである。
むしろ、オリゴデンドロサイトを損傷する可能性のある炎症性細胞の持続的な活性化が主要な役割を果たしているように思われる。実際、JHMV潜伏感染は、CD4+およびCD8+ Tリンパ球の中枢神経系の維持に好都合である。
病変部におけるマクロファージおよびリンパ球のリクルートに重要な役割を果たすのは、常駐グリア細胞によるCXCL10の放出でもある。
実際のところ、CCL5またはCXCL10のいずれかの免疫無力化は、JHMVに慢性的に感染したマウスの脱髄の重症度を有意に減少させる。
脱髄病変を浸潤する異なる細胞型における遺伝子発現の時間経過解析は、長期にわたる損傷はおそらくミクログリア細胞によるものであるのに対し、マクロファージはおそらく早期の段階でより重要であることを示した。
グリア細胞は、化学吸引性分子を放出するだけでなく、一酸化窒素およびTNF-α、IL-1β、IL-6などのサイトカインを放出することによっても組織損傷を促しうる。
潜在感染中のさらなる損傷のメカニズムは、JHMVによる直接的またはCXCL10刺激下でのIFNγ放出による間接的のいずれかによって引き起こされるオリゴデンドロサイト前駆体の分化障害である。
脱髄に関与するが、免疫応答は、潜在的な中枢神経系 CoV感染の再活性化を防ぐためにも不可欠である。実際、JHMV感染の再活性化は、体液性免疫が障害されたマウスモデルにおいて起こることが示されている。
例えば、成熟B細胞を欠損したμMTマウスでは、野生型マウスのように中枢神経系からJHMVが持続的にクリアされることはなく、細胞免疫による一過性のクリアランスを経て、主にオリゴデンドロサイトに再浸潤し、脳炎や動物死を引き起こすことが示されている。
4. CoVs神経ウイルス性はヒトの急性中枢神経系疾患の原因となる可能性がある
30年以上前に、血清学的にHCoV-OC43感染が証明された患者における発作や髄膜炎や根膜炎の徴候が初めて報告された。それにもかかわらず、ヒトの急性脳炎におけるCoVの病因的関与は、免疫抑制患者においてのみ証明されている。
重度の複合免疫不全と脳炎の徴候および症状を有する11ヶ月の男児の脳生検サンプルにおけるHCoV-OC43の存在は、RNAシークエンシングを用いて実証され、リアルタイムPCRおよび免疫細胞化学によって確認された。この小児の放射線学的所見は脱髄ではなく、脳容積の喪失を伴う広範な灰白質損傷を示した。
非常に最近、HCoV-OC43ゲノムの存在が、化学療法中に持続性気道疾患を発症し、その後致死的な脳炎を発症したB型以前の急性リンパ芽球性白血病に罹患した19ヶ月の小児の脳生検サンプルに記録された。
CoVはまた、通常、感染またはワクチン接種の数日後に小児に発生する単相性自己免疫性脱髄性疾患である急性播種性脳脊髄炎(ADEM)の発生にも役割を果たしている可能性がある。ADEMの病理組織学的特徴は、ラットのJHMV誘発性脳炎の亜急性型で観察されるものと類似しており、脱髄の血管周囲袖はT細胞によって豊富に浸潤しているが、多形核酸塩によっては浸潤していない。
さらに、風邪の1週間後に下肢のしびれを伴うADEMを発症し、その脳脊髄液がRT-PCR分析でHCoV-OC43に陽性であった15歳の少年の例は、CoVs感染とヒトの亜急性脱髄性疾患との間の潜在的な関連性をさらに支持している。
興味深いことに、ADEM患者における一般的な実験室での所見は、いくつかのサイトカインおよびケモカインの脳脊髄液レベルの有意な増加であり、IL-6、IFN-γ、TNF-α、CXCL9、およびCXCL10などの実験動物におけるCoV感染時に誘導されたものも含まれる。
しかしながら、高病原性SARS-CoVおよびMERS-CoVがヒトでも脳炎を引き起こすかどうかは現在のところ不明であり、これは、おそらく、機械換気中に深く鎮静化している患者では、脳への症状および徴候を特定することが困難であるため、また、オートプティーク材料の入手可能性が限られているためであろう。
それにもかかわらず、Guらが報告した8人のSARS感染患者のすべての脳サンプルからSARS-CoVのゲノム配列が検出されており、そのうち6人の患者では病理組織学的に神経細胞死と壊死が認められた。
さらに、全身性強直間代発作を発症した 32 歳女性の SARS 感染者の 脳脊髄液 から SARS-CoV ゲノムが RT-PCR で同定され、SARS で死亡し、脳炎を示唆する神経学的症状を示した 39 歳の患者の脳の剖検サンプルからも SARS-CoV ゲノムが同定された。
さらに、MERS-CoV感染の3人の患者は、錯乱から昏睡までの精神状態の変化、運動失調や焦点性運動障害、進行中の脳炎を示唆するMRI所見などを多様に含む重度の神経学的障害を示した。
SARS-CoV-2感染時の中枢神経系の関与に関しては、COVID-19の発症時に頻発する神経学的症状が、本疾患の早期警告徴候を表す可能性が示唆されている。
中国・武漢の3つの病院に入院したCOVID-19患者214人のレトロスペクティブ分析では、36%以上の症例で神経学的徴候が観察された。大多数の症例では、これらの神経学的症状は軽度で、頭痛、めまい、めまい、低呼吸などであったが、意識変化や脳卒中も認められた。
COVID-19患者における重篤な神経学的合併症を記録した追加の報告がその後発表されている。例えば、びまん性脳波鈍化を伴う重篤な脳症が、精神状態の変化を呈し、後にCOVID-19の影響を受けることが示された74歳の男性に報告された。
呈示時の精神状態の変化は、CTスキャンで急性出血性壊死性脳症(ANE)の診断が下された中年女性でも報告されている。これは、インフルエンザや他のウイルス感染症のまれな合併症であり、BBBの破壊を引き起こすが、ウイルスの直接的な侵入や麻痺性脱髄。
発作は、髄膜脳炎の24歳男性で報告されているように、脳脊髄液中のSARS-CoV-2陽性が見つかったが、鼻咽頭スワブ中には認められなかったように、COVID-19の発症時に発生するか、または疾患の経過を複雑にする可能性がある。精神状態の変化および発作もまた、COVID-19患者で観察されており、急性MHV感染症で観察されたものに類似した脳および脊髄の脱髄性病変が観察されている。
また、SARS-CoV-2によって誘発された脳幹呼吸中枢の急性脳症性障害が、重症化したCOVID-19患者で観察された呼吸不全に寄与しているのではないかという仮説も立てられている(ただし、正式には証明されていない)
SARS-CoV-2の急性神経学的合併症の中で特筆すべきものは脳卒中であり、その有病率はCOVID-19ではSARSと同様に非常に高くなっている。レトロスペクティブなシリーズでは、脳卒中は重症COVID-19患者の約5.7%に発生したが、ミラノの大学病院に入院したCOVID-19患者388人の有病率は2.5%であった。
驚くべきことに、COVID-19患者における脳卒中は、一般集団よりもはるかに若い年齢で発生することがあり、古典的な危険因子がない場合が多い。これらのCOVID-19関連の脳卒中の多くは皮質下または皮質遠位であるが、大血管閉塞も観察される。
COVID-19患者における脳卒中は、脳症に先行する亜急性経過および微妙な臨床症状を有する場合があり、または急性脳血管事故として提示される場合があり、この疾患で観察される血栓リスクの増加の臨床的結果の1つに過ぎない可能性が高い。
この血栓性状態は、固定化、低酸素、びまん性内皮損傷および重度の凝固障害を含む複数の因子に依存し、ダイマー、フィブリン、フィブリノーゲン、またはフィブリノーゲン分解産物のレベルが増加した、いわゆるCOVID-19関連凝固障害(CAC)の形で、またはこれらのタンパク質のレベルが減少した古典的な播種性血管内凝固(DIC)の形で起こり得る。
さらに、SARS-CoV-2受容体ACE2が発現している脳内皮細胞への直接ウイルス感染が、これらの患者の神経血管障害に関与している可能性があるという仮説も立てられている。
重要なことに、COVID-19患者において、脳卒中は、米国血液学会が推奨する薬理学的血栓予防にもかかわらず発生することから、COVID-19に特異的に適合した抗凝固戦略が開発されるべきであることが示唆されている。
SARS-CoV-2ヒト感染は、急性神経学的合併症だけでなく、ADEMにおけるHCoV-OC43の想定される関与を想起させる亜急性神経学的障害を誘発する可能性がある。より具体的には、COVID-19患者において、最初の呼吸器症状から5〜10日後に神経学的症状が出現するギランバレー症候群のいくつかの症例が記載されている。これらの患者の大部分が重症であったにもかかわらず、ギラン・バレー症候群のより軽い形態もCOVID-19において観察される。
最後に、失調、無表情、および眼瞼下垂のトライアドを特徴とするギラン=バレッ症候群の変種であるミラー=フィッシャー症候群の発生もまた、2人のCOVID-19患者で報告されている。
5. CoVは慢性ヒト神経変性疾患において何らかの役割を果たすか?
神経ウイルス剤としてのCoVsのプロファイルは、速効性の殺傷剤だけでなく、遅効性のサボタージュでもある。前述したように、CoVは急性感染後、実験動物の中枢神経系に非常に長い間残存し、免疫学的メカニズムによりゆっくりと進行する組織障害を誘発する可能性がある。
げっ歯類における実験的なCoV感染と、MSのようなヒトの脱髄性疾患との間の病理組織学的および病理学的類似性は、すでに強調されている。MSの病因におけるCoVの役割を支持する最初の証拠の一つは、MSで亡くなった若い女性の脳の活動性病変にドーナツ型のCoV様粒子を電子顕微鏡で確認したことに由来する。
数年後、HCoV-OC43に類似した2つのCoV。これら2つのウイルスは、非ヒト霊長類の脳内注射で脱髄を伴う脳炎を誘発した。しかし、これらの患者におけるMSにおけるSKおよびSDウイルスの病因学的役割はしっかりと確立されておらず、これらのウイルスがマウスの汚染物質である可能性が排除されたことはない。
HCoV-OC43およびHCoV-229EのRNAおよび/または抗原もまた、MS患者の脳サンプルから検出されている。さらに、ミエリン塩基性タンパク質およびヒトCoVs抗原と交差反応するT細胞が末梢血から単離され、MS患者においてHCoV-OC43およびHCoV-229Eに対する抗体の髄腔内合成が記録されている。
神経変性疾患の中で、CoVはパーキンソン病(PD)の発症にも関与している可能性があることに言及すべきである。しかしながら、正常な年齢の対照者と比較して、PD患者の脳脊髄液中のJHMVおよびHCoV-OC43に対する抗体の力価が高いことを示したヒトの研究は1件のみである。
IL-1およびIL-6のようなサイトカインの局所放出を促進することにより、CoVは実際に、MS、アルツハイマー、パーキンソン病、およびてんかんを含む多くの慢性神経変性疾患において活性化される中枢神経系損傷のより一般的な病原性メカニズムを、文書化されたウイルス感染の非存在下でも誘発し得ることに注目すべきである。しかし、この仮説を支持する直接的な知見は現在のところ得られていない。
6. 結論と今後の展望
しかし、CoVの神経ウイルス性に関する我々の知見のほとんどは、MHVやHCoV-OC43に感染した齧歯類を用いた研究に由来している。一方、新しいヒトのCoVに関する情報ははるかに限られている。
これらの新しいウイルスの神経生物学に関する多くの基本的な疑問は、実験動物を用いて解決する必要があり、また、現在進行中のCOVID-19パンデミックによる壊滅的な健康被害を考慮すると、SARS-CoV-2については、ヒト患者におけるCoVs感染に関する主要な臨床的ポイントが緊急に明らかにされなければならない。これらの問題にうまく対処するためには、信頼できる動物モデルが不可欠である。
実際には、MERSおよびSARSの両方ともげっ歯類ではほとんど複製することができず、それらの原因ウイルスの受容体を過剰発現させたトランスジェニック動物は、これらのウイルスの神経生物学を忠実に複製しない中枢神経系におけるCoV受容体の非生理学的分布パターンを表示する。
さらに、hACE2過剰発現マウスにおいても、SARS-CoV-2への実験的感染時に中枢神経系浸潤の証拠は検出されなかった;したがって、SARS-CoV-2の神経浸潤のより良い動物モデルおよび/または神経感染のための異なる実験条件も必要である。
ヒトにおけるCOVID-19の神経学的帰結に関する多くの疑問は、いまだに解答されていない。例えば、COVID-19患者に記載された神経学的徴候が、SARS-CoV-2 中枢神経系の直接感染の結果であるかどうかは現在のところ不明である;しかしながら、SARS-CoV-2ゲノムがCOVID-19患者の脳脊髄液から単離されたという事実は、ウイルスの直接神経侵入を示唆している。
脳脊髄液からSARS-CoV-2を単離するさらなる試み、およびCOVID-19患者の剖検は、いくつかの光を当てるかもしれない。
さらに、急性期に発生した脳症が慢性てんかんや認知障害などの長期にわたる後遺症をもたらすかどうかを知ることは、厳密な予後評価を行う上で重要である。神経学的関与のリスクが高いCOVID-19患者を早期に同定するための共通の手順が不可欠である。
中枢神経系の障害の程度と病態をより明確にするためには、脳幹の障害を示唆する徴候や症状に特別な注意が払われるべきである。これらの症状は、最近示唆されたように、聴覚脳幹反応、神経画像診断ツール、またはCFS解析を用いた更なる診断的調査を促す可能性がある。
疾患発症の原因となる免疫学的機序をよりよく明らかにする ことを目的とした研究は、さらに、抗IFN-γエマパルマブ、 IL-1拮抗薬アナキンラ、IL-6経路を標的とする2つのモノクローナル 抗体、サリルマブ、トシリズマブなどの免疫調節薬を合理的に使用 するための確固たる概念的基盤を提供することになるであろう。
これらの薬剤はすべて、COVID-19患者の神経炎症を予防または抑制するための標的治療的介入の可能性があり、現在、積極的な研究が行われている

