Ivermectin for Prevention and Treatment of COVID-19 Infection: A Systematic Review, Meta-analysis, and Trial Sequential Analysis to Inform Clinical Guidelines
アメリカン・ジャーナル・オブ・セラピューティクス 0, e1-e27 ()
Andrew Bryant, MSc,1* Theresa A. ローリー, MBBCh, PhD,2 Therese Dowswell, PhD,2 Edmund J. Fordham, PhD,2 Scott Mitchell, MBChB, MRCS,3 Sarah R. Hill, PhD,1 and Tony C. Tham, MD, FRCP4
背景
SARS-CoV-2ウイルスに対して、再利用された医薬品が役割を果たす可能性がある。抗ウイルス作用と抗炎症作用を持つ抗寄生虫剤イベルメクチンは、現在、多くの臨床試験が行われている。
不確実性のある分野 COVID-19 に感染している、またはそのリスクが高い人を対象に、死亡率の低下、二次的転帰、および化学予防におけるイベルメクチン治療の有効性を評価した。
データソース
2021 年 4 月 25 日までの書誌データベースを検索した。2人のレビュー著者が研究をふるいにかけ,データを抽出し,バイアスのリスクを評価した。メタアナリシスを行い,GRADE 法を用いてエビデンスの確実性を評価し,さらに死亡率に関する試験の逐次解析を行った。3406人の参加者を対象とした24の無作為化比較試験がレビューの対象となった。
治療上の進歩
15試験のメタアナリシスでは、イベルメクチンはイベルメクチンを投与しない場合と比較して、死亡リスクを減少させることが明らかになった(平均リスク比0.38,95%信頼区間0.19-0.73,n 5 2438,I2 5 49%、中程度の確実性のエビデンス)。この結果は、非調整後の解析を支えたのと同じDerSimonian-Laird法を用いた試験逐次解析でも確認された。この結果は、Biggerstaff-Tweedie法を用いた試験の逐次解析でも確認された。確信度の低いエビデンスでは、イベルメクチンの予防投与によりCOVID-19感染が平均86%(95%信頼区間79%~91%)減少した。副次評価項目では、確実性の低いエビデンスが得られた。確実性の低いエビデンスによると、「人工呼吸の必要性」についてはイベルメクチンの有益性がない可能性が示唆されたが、「改善」と「悪化」についての効果推定値は明らかにイベルメクチンの使用を支持した。重篤な有害事象は治療試験ではまれであり、差がないという証拠は確実性が低いと評価された。その他の副次的アウトカムに関するエビデンスは、確実性が非常に低かった。
結論
中程度の確実性のエビデンスによると、イベルメクチンを使用することでCOVID-19による死亡数を大幅に減少させることが可能である。臨床経過の早い段階でイベルメクチンを使用することで、重症化する人数を減らすことができる。安全性が高く、安価であることから、イベルメクチンは世界的なSARS-CoV-2パンデミックに大きな影響を与える可能性があると考えられる。
1英国ニューカッスル大学Population Health Sciences Institute消化器内科,2英国バースEvidence-based Medicine Consultancy消化器内科,3英国ガーンジー島Princess Elizabeth Hospital救急部,4英国北アイルランドベルファストのアルスター病院Dundonald消化器内科。
このレビューのプレプリントは、資金提供を受けていない。この最新版は,クラウドファンディング・イニシアチブ(https://www.gofundme)から資金提供を受けた。
著者には申告すべき利益相反はない。
T. A. ローリーとA. Bryantはレビューの共同執筆者であり,検索のふるい分けと研究の分類を行い,RevManへのデータの入力とチェック,分析を行った。データの抽出は、T. A. ローリー、A. Bryant、T. Dowswellが分担して行った。T. DowswellとA. Bryantがエビデンスを評価した。E. J. Fordhamは,イベルメクチンのメカニズム,妊娠中および高齢者の使用に関する文章を作成した。S. R. Hillは、簡単な経済的解説を作成した。臨床医のS. MitchellとT. C. Thamは,議論と結論におけるエビデンスの解釈に貢献した。著者全員が最終版の原稿を確認し、承認した。この論文では、COVID-19に対するFDA承認薬イベルメクチンの適応外使用について述べている。
*通信欄のアドレス Population Health Sciences Institute, Newcastle University, Baddiley-Clark Building, Richardson Road,
Newcastle Upon Tyne NE2 4AX, United Kingdom. E-mail: andy.bryant@ncl.ac.uk
This is an open-access article distributed under the terms of the Creative Commons Attribution-Non Commercial-No Derivatives License 4. 0 (CCBY-NC-ND) の下で配布されており,適切に引用されていることを条件に,作品をして共有することが許可されている。本誌の許可なく、著作物をいかなる形でも変更したり、商業的に利用することはできない。
キーワード:イベルメクチン,予防,治療,COVID-19,SARS-CoV-2
はじめに
現在までに、COVID-19による罹患率や死亡率の負担を軽減することが実証されている治療法は非常に少ない。コルチコステロイドは重篤な疾患における死亡率を低下させることが証明されているが、1 疾患を予防し、入院を減らし、重篤な疾患に進行して死亡する人の数を減らす可能性のある介入については、説得力のある証拠はほとんどない。
イベルメクチンは、世界保健機関(WHO)や米国食品医薬品局(FDA)から抗寄生虫薬として承認されている有名な医薬品である。また、疥癬やシラミの治療にも使用されており、世界保健機関(WHO)の必須医薬品の1つとなっている4。イベルメクチンの総投与量は、現在の世界人口の3分の1に相当すると言われており5,通常の投与量(0.2~0.4mg/kg)であれば、ヒトに対する安全性は極めて高いと考えられている6,7。また、抗寄生虫作用に加えて、抗ウイルス作用や抗炎症作用も指摘されており、その適応症はますます拡大している8。
SARS-CoV-2のパンデミックが始まって以来、COVID-19感染症の治療薬および予防薬としてのイベルメクチンが、観察研究および無作為化研究の両方で評価されている。Front Line COVID-19 Critical Care Alliance」によるレビューでは、COVID-19感染症の予防と治療に対するイベルメクチンの効果に関する27件の研究結果がまとめられており、イベルメクチンはCOVID-19に対して「治療効果の強いシグナルを示す」と結論づけられている9。 10 こうした結果にもかかわらず、米国国立衛生研究所は最近、「COVID-19の治療にイベルメクチンを使用することを推奨するにはデータが不十分である」と述べており11,世界保健機関も臨床試験以外での使用を推奨している12。
Caly et al 14は、試験管内試験においてSARS-CoV-2に特異的な作用を示し、正常な免疫反応を抑制するウイルスタンパク質14,15の核内への取り込みを阻害することで、宿主主導の作用機序が示唆されている。その他の作用機序としては、SARS-CoV-2の3CLPro活性17,18(ウイルスの複製に不可欠なプロテアーゼ)の阻害、様々な抗炎症作用19,複数のin silico研究で示されたイベルメクチンとウイルスのSタンパク質との競合的結合20などが考えられており、後者はウイルスとACE-2受容体との結合を阻害し、感染を抑制すると考えられている。赤血球上のシアル酸受容体へのウイルスの結合による血球凝集も、最近提唱された経路論的メカニズムであり21,同様に阻害されると考えられる。このように、宿主主導型のメカニズムとウイルス主導型のメカニズムの両方が提案されており、臨床的なメカニズムは多面的で、病期に依存する可能性があり、作用メカニズムの包括的なレビューが必要である。
新薬の開発には何年もかかる。そのため、COVID-19に対して再利用できる既存の薬剤で、数十年にわたって使用されて安全性が確立されているものを特定することは、SARS-CoV-2のパンデミックを抑制し、さらには終息させるために重要な役割を果たす可能性がある。世界の人口の多くがワクチン接種を受けるまでに数カ月、場合によっては数年かかる可能性があるため、再利用可能な薬剤を使用することは特に重要であると考えられる。
現在、イベルメクチンは世界の多くの国で市販されており、手頃な価格で購入することができる6。2018年に発表された疥癬に対するイベルメクチンの使用に関するアプリケーションでは、12mgの錠剤100個の直接費用が2.90ドルとなっている22。また、バングラデシュでの最近の試算23では、イベルメクチンの5日間の投与で0.60~1.80ドルと報告されている。これらの理由から、SARS-CoV-2に対するイベルメクチンの有効性を検討することは、資源が限られている環境では特に重要であると考えられる24。COVID-19の治療薬として有効であることが証明された場合、既存の治療薬や予防薬と比較して、イベルメクチンの費用対効果を検討する必要がある。
本レビューの目的は、COVID-19感染者におけるイベルメクチン治療の有効性、およびCOVID-19感染のリスクが高い人々における予防薬としての有効性を評価することであった。さらに、COVID-19の治療および予防としてのイベルメクチンの簡潔な経済的解説(BEC)を作成することを目的とした25。
研究方法
このレビューの実施は、最初にコクランのラピッドレビューテンプレートを使用して作成され、その後、包括的なレビューのための完全なプロトコルに拡張されたプロトコルに基づいて行われた26。
検索戦略と選択基準
2人の審査員が独立して、2021年4月25日までの無作為化比較試験(RCT)をMedline、Embase、CENTRAL、Cochrane COVID-19 Study Register、および中国のデータベースで検索した(付録1-3,Supplemental digital con-tent 1,…links.lww.com/AJT/A95)。経済評価の補足検索は、BECの現行ガイドライン25に従った。言語の制限はなく,必要に応じて翻訳�
収録された研究の参考文献リスト、およびイベルメクチンに関する2021年の他の2つの文献レビュー9,およびイベルメクチンの分析を含む最近のWHO報告書12を検索した。さらに,臨床試験登録機関に登録されているすべての試験を確認し,進行中の試験や分類されていない39件の試験の担当者に連絡を取り,試験の状況やデータがある場合はその情報を提供してもらった。また,プレプリントサーバーであるMedRxivとResearch Square,およびInternational Clinical Trials Registry Platformから,多くのプレプリント出版物や未発表の論文を確認した。これは急速に拡大している情報基盤であるため、試験の数は急速に増加している。フルテキストレビューの後に除外されたすべての研究について、除外理由を記録した。
データ解析
研究デザイン(方法、場所、施設、資金、研究著者の利益宣言、除外基準を含む)設定、参加者の特性(疾患の重症度、年齢、性別、併存疾患、喫煙、職業リスク)介入および比較対象の特性(イベルメクチン/比較対象の投与量と頻度)に関する情報またはデータを抽出した。本レビューの介入群の主要アウトカムは、あらゆる原因による死亡と、イベルメクチン予防のためのCOVID-19感染(治験責任医師が定義)の有無であった。副次評価項目は、ポリメラーゼ連鎖反応(PCR)陰性化までの時間、臨床的回復、入院期間、(外来治療のための)入院、ICUへの入室または機械的人工呼吸が必要な状態、機械的人工呼吸の期間、重度または重篤な有害事象、および改善と悪化の事後評価であった。これらのデータはすべて、治験責任医師が測定・報告したものを抽出した。興味のあるアウトカムの数値データはintention to treatに従って抽出した。
1つの研究で複数の情報源から報告されたデータの間に矛盾がある場合(例えば、出版された論文と試験登録記録の間)著者に連絡して説明を求めた。評価は,2人のレビュアー(T.L.,T.D.,A.B.,またはG.G.)が,Cochrane RCT risk-of-biasツールを用いて行った27.
連続的な結果は平均差と95%信頼区間ss(CI)で、二分的な結果はリスク比(RR)と95%CIで測定した。
いずれの結果についても,欠損データの帰属は行わなかった。欠落している結果データについては著者に連絡し,可能であれば試験方法について説明を求め,進行中の試験については試験状況を確認した。
研究間の異質性は,フォレスト・プロットの目視検査,I2 統計量の推定(I2 60%はかなりの異質性と考えられた)28,統計的に有意な異質性を示す正式な統計的検定29,可能であればサブグループ解析(下記参照)によって評価した。実質的な異質性が確認された場合には,その理由となり得るものを調査し,報告した。また,メタ解析に10件以上の研究が寄与している場合は,ファネルプロットを用いて報告バイアスを評価した。
27,31 結果の重み付けには逆分散法を用いた。27 いくつかの感度分析には以下に示す別の方法を用い、いくつかの計算は netmeta パッケージのインターフェース33 を介して R32 で行った34。また,バイアスのリスクが高い試験を除外して感度解析を行った。さらに、多くの試験で両群ともにイベントがゼロだった場合の結果の頑健性を検証するために、代替法を用いたpost hoc感度分析を行い35,固定効果モデルを用いてオッズ比(Mantel-Haenszel(MH)法ではさらにRR)を推定した。このモデルでは、連続性の補正に頼ることなく、シングルゼロ試験のエビデンスが組み込まれている。しかし、ダブルゼロの試験は解析から除外されている。そこで、ダブルゼロのイベントを含む試験を適切に組み込めるMH法を用いて、リスク差も評価した。この方法では、ランダム効果成分を用いることもできる。治療群間」の連続性補正を行い、両群でイベントがゼロと報告された試験では,0.01,0.1,0.25の値を加えた。非固定の連続性補正は、通常の0.5よりも好ましいことが示されている35。他の方法もあるが、解釈の難しさ、仮定の感度、または実際にはほとんど使用されていないことから、検討しなかった36-40。
試験の逐次解析
メタアナリシスが繰り返し統計的な評価を受ける場合、「素朴な」点推定値や信頼区間が誤った推論をもたらすという誇張されたリスクがある。メタアナリシスでは,偽陽性または偽陰性の結論を出すリスクを最小限に抑えることが重要である。そのためには,偽陽性のリスク(タイプIエラー)と偽陰性のリスク(タイプIIエラー)がトレードオフの関係にある。また、従来のメタアナリシス手法(RevManなど)では、利用可能なエビデンスの量を考慮していない。また、DerSimonian-Laird(DL)法は、メタ解析の現場で最もよく用いられている方法であり、pri-maryメタ解析でも用いられていたため、この方法を用いた。
TSA法は、一次メタ解析で認められたイベルメクチン群における死亡リスクの相対的減少(RRR)を実証または否定するために必要な情報サイズ(IS)を算出するために用いられた。対照群のイベント発生率は、メタ解析で得られた推定値が最も良く、代表的な推定値であるため、これを前提とした。推奨されるタイプ I エラー率とタイプ II エラー率をそれぞれ 5%と 10%とし(検出力 90%)43 プライマリーメタアナリシスで観察された効果に対する結果の検出力を高めた。全死因死亡率で検出された大規模なCOVID-19トライアルはなかったため、外部の有意差で検出することはできなかった。パンデミックの規模を考えると、RRRが小さいことは意味のあることであるが、小さな差でパワーを出すと、必要なISはこの分析では実現不可能なほど高くなる。COVID-19に対する治療に再利用されるイベルメクチンに関する唯一の信頼できるデータは、主要なメタアナリシスによるものである。そのため、他の発表されたシステマティックレビューから大きく逸脱しないことを前提に、全死因死亡率のプールされたメタ分析の効果測定値でパワーを算出するという実用的な決定が先に下された。これは、真の意味での差をより反映していると考えられる。異質性を補正するために、モデル分散に基づく推定値を用いた。片方または両方のアームでイベントがゼロと報告された試験では,0.01の連続性補正を行った。必要とされるISは、信頼性のある決定的なメタアナリシスに必要なサンプルサイズであり、少なくとも単一の動力RCTで必要とされるサンプルサイズと同じである。異質性を補正した必要なISは、累積zスコアのO’Brien-Fleming型α-spending関数(累積メタアナリシスに対応)43に基づいて逐次モニタリング境界を構築するために使用され、RCTの中間モニタリングと同様に、十分なエビデンスが得られた時点を決定した。これらのモニタリングの境界は、反復有意差検定の回数にはほとんど影響されない。この境界線は,元のメタアナリシスの文脈をさらに深め,その結論の確実性を高めるために用いることができる。我々は両側検定を使用したので、無益境界(有意差がないことを検定する)とイベルメクチンが有害である可能性も考慮した。感度解析では、異質性の原因となった Fonseca 試験44 を除外して解析を行った。この試験を除外すると,I2とD2(多様性)の推定値が劇的に減少し,異質性を補正するためのモデルの分散に基づく推定値が減少した。さらに、2つの代替ランダム効果モデル、すなわちBiggerstaff-Tweedie(BT)法とSidik-Jonkman(SJ)法を用いて、2つの感度分析を行った43。
すべての結果は、2人のレビュー著者(T.D.とA.B.)が、エビデンスの質と確実性をランク付けするGRADE法45を用いて独立して評価した。TSAの結果は、主要な全死因死亡率の判定の一部にもなる。その結果は、所見の要約の表に示されている。判定の違いは、より広いグループでの議論によって解決された。エビデンスの解釈には、Cochrane Effective Practice and Organisation of Care(コクランの効果的な実践とケアの組織化)ガイダンスを使用した46。
結果
検索結果と偏りのリスク評価
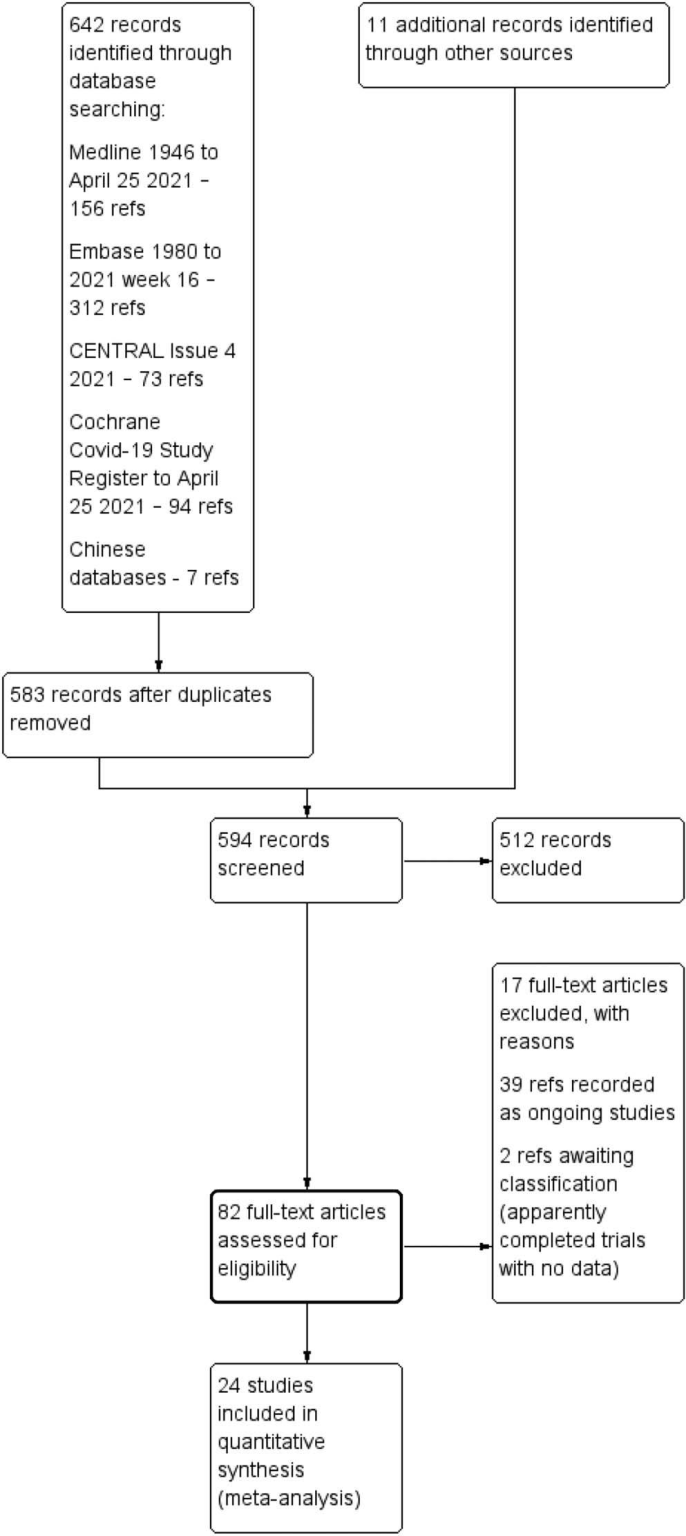
検索結果とバイアスのリスク評価 検索結果とバイアスのリスク評価 検索結果とバイアスのリスク評価 検索結果とバイアスのリスク評価 また、他の情報源(参考文献リストなど)から 11件の記録を確認した。これらの文献の包含・除外の詳細については、PRISMAのフロー図を参照してほしい(図1)。
COVID-19の予防と治療のためのイベルメクチン
BEC の補足検索では 17 件の研究が確認され、そのうち 4 件は完全な形で検索された。完全な試験またはモデルに基づく経済評価(費用便益分析、費用効果分析、または費用便益分析)は確認されなかった。
COVID-19の治療に関する21件の試験と予防に関する2件の試験がレビューの対象となった。さらに1つの研究47 では、治療と予防のコンポーネントが別々に報告されている。この研究を両方の質問で「Elgazzar」と表示している。実際には、治療に関する試験が22件、予防に関する試験が3件あった。これらの試験はすべて、少なくとも1つのレビュー結果とメタアナリシスにデータを提供した。15の試験がイベルメクチン治療の主要アウトカム(死亡)のデータを提供し、3つの試験が予防の主要アウトカム(COVID-19感染)を報告した。対象となった研究の特徴を表1に示す。17件の研究47~63はRCTではないため除外し、39件の進行中の研究64~102と2件の研究103,104が分類待ちであることを確認した。
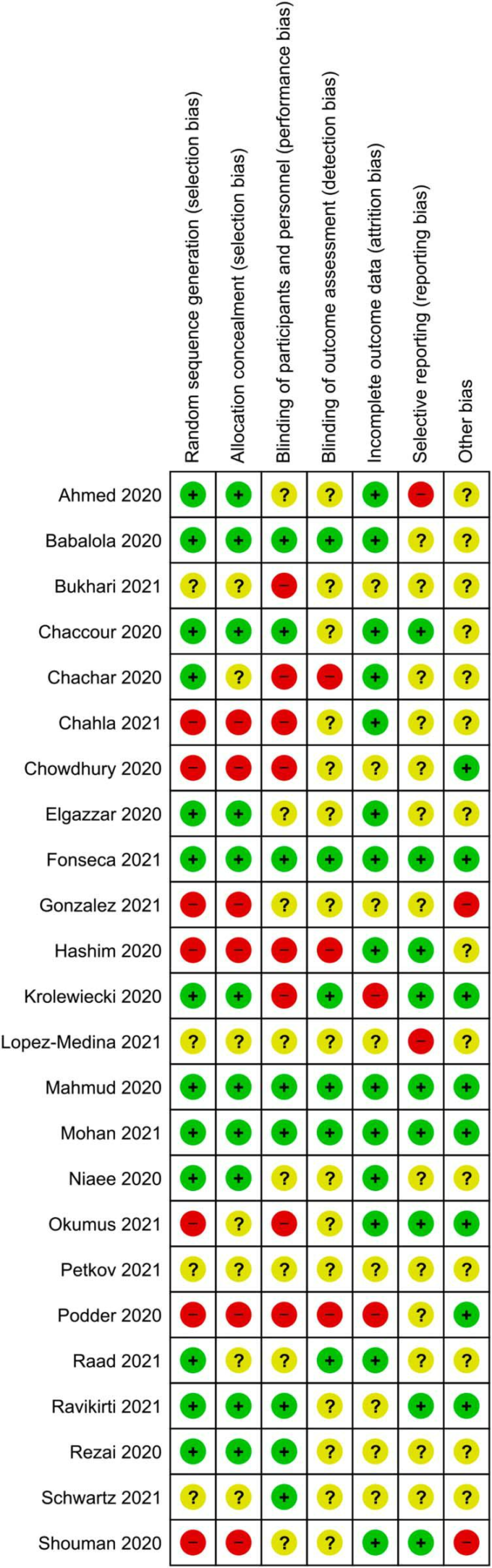
リスクオブバイアスの要約グラフを図2に示す。23,24,44,47,105,106-111の11件の研究では、ran-dom sequence generationとallocation concealmentが十分に行われていた。2つの試験では、シーケンス生成は十分であったが、割り付けが隠されていたかどうかは不明であった112,113。
10件の試験では、参加者/スタッフおよび/または結果評価者の盲検化が適切に行われたと報告している。
23,24,44,105,107,109,110,111,113,114 その他の試験は、盲検化が不明確であったり、盲検化のリスクが高かったりした。本レビューの主要アウトカムである客観的アウトカムである死亡および実験室で確認されたCOVID-19感染に関するエビデンスを評価する上で、盲検化はそれほど重要な基準ではないと考えた。
すべての研究はレビューの過程で我々が精査・査読し、追加情報が必要な場合は著者に連絡して明確にしたため、プレプリントサイトでの発表はバイアスのリスクとはみなされなかった。
主な調査結果
3406人の参加者を対象とした24のRCT(3つの準RCTを含む)が含まれ、サンプルサイズは24人から476人であった。治療に関する22件の試験と予防に関する3件の試験がレビューの対象となり、両方の要素を報告したElgazzarらの試験も含まれていた。COVID-19治療に関する試験では、16件が軽度から中等度のCOVID-19患者のみを対象にイベルメクチンを評価しており、6件は重度のCOVID-19患者を対象としていた。ほとんどの試験では,イベルメクチンとプラセボまたはイベルメクチンを含まないものとを比較していたが,3つの試験では有効な比較対照薬が含まれていた(表1)。予防試験には3つのRCTが含まれ、738人が参加した。ほとんどの試験は登録されており、自己資金で行われ、現場で働く医師によって行われた。2つの試験を除いて、明らかな利益相反は認められなかった85,139。
図1.2021年4月25日の検索による研究フロー図
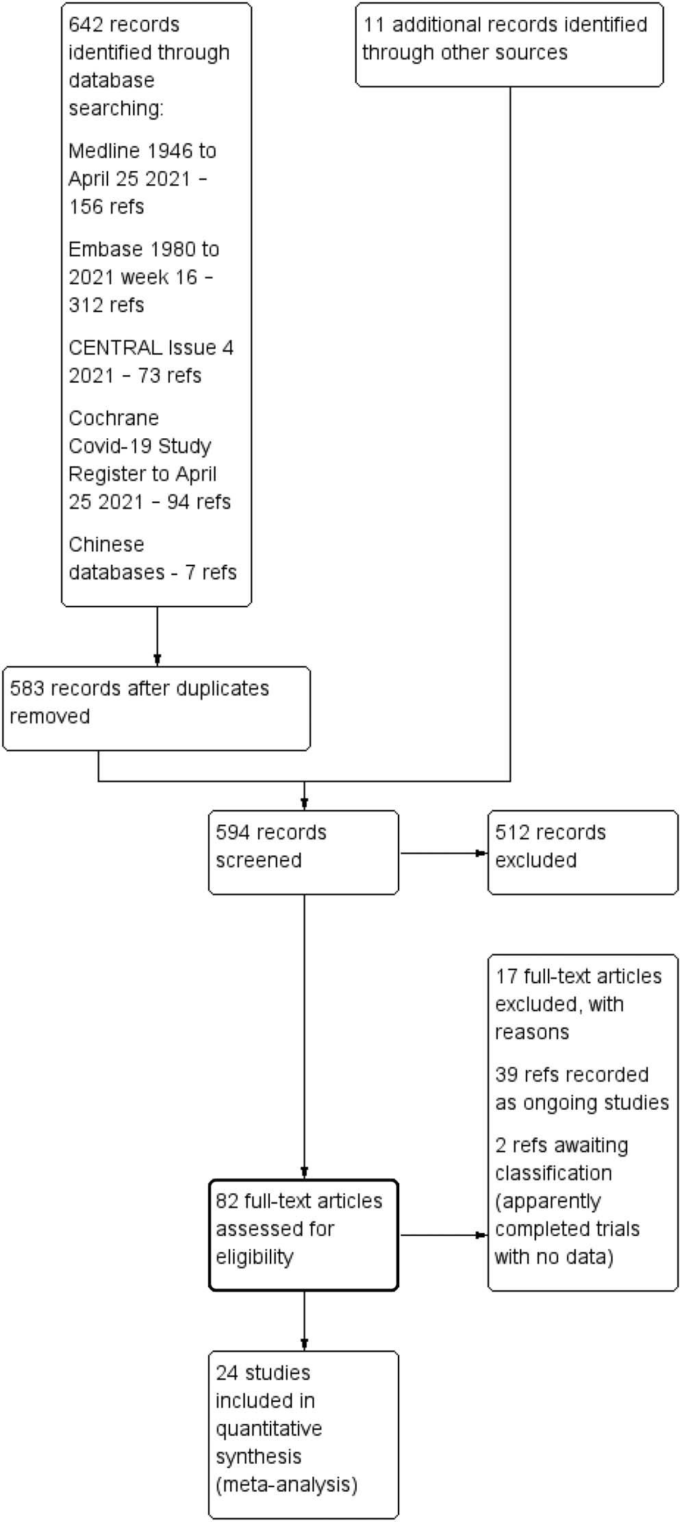
表 1. 試験の特徴をまとめたもの
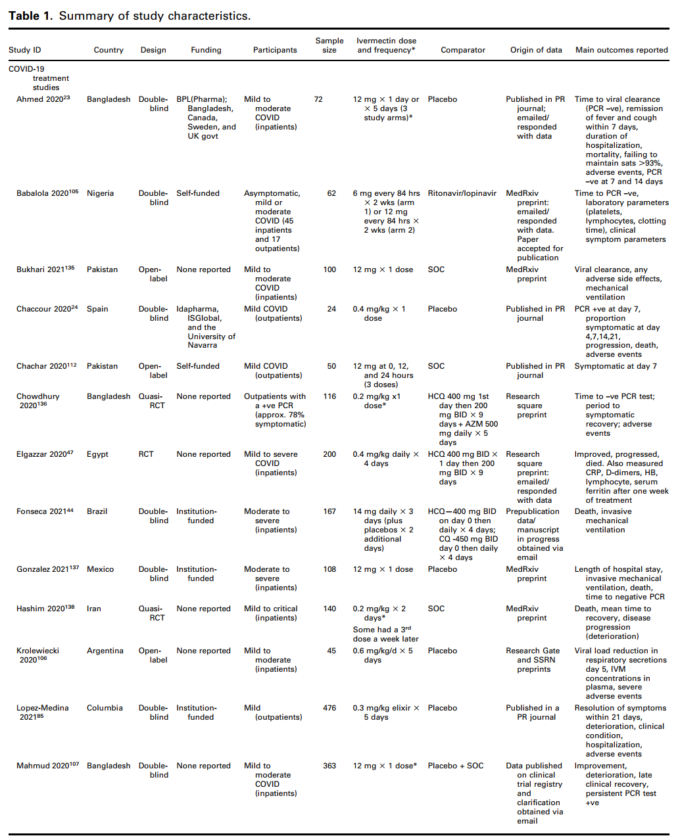
表1(続き)試験の特徴のまとめ
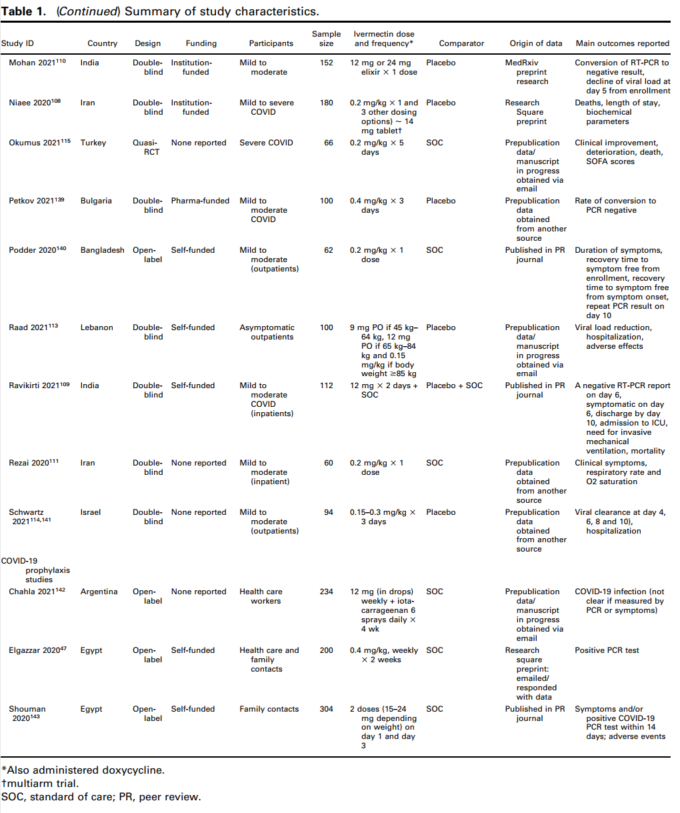
図2 Risk-of-bias Summary(偏りのリスクの要約):レビュー著者が含まれる各研究の偏りのリスク項目について判断したもの
イベルメクチン治療対イベルメクチン治療なし
COVID-19治療におけるイベルメクチン治療対イベルメクチン治療なしの比較には、22件の試験(2668名)がデータを提供した。
全死亡率
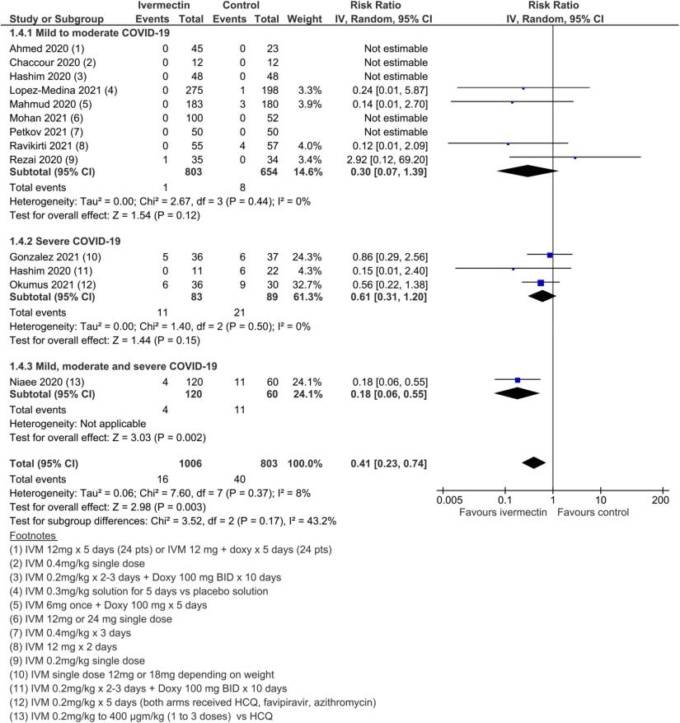
15試験、2438名の参加者を対象としたメタ解析の結果、イベルメクチンはイベルメクチン未投与と比較して死亡リスクを平均62%(95%CI 27%~81%)減少させることが判明した(平均RR(aRR)0.38,95%CI 0.19~0.73,I2 5 49%);本解析における入院患者の死亡リスクはそれぞれ2.3%対7.8%であった(SoF表2および図3)。異質性の多くは、感度分析で1つの試験44が除外されたことで説明されたが(平均RR 0.31,95%CI 0.17-0.58,n 5 2196,I2 5 22%)この試験はバイアスのリスクが低かったため、主要な分析に残された。異質性の原因は、試験デザインにアクティブコンパレータを使用したことによるものと考えられる。結果は、能動的な治療法の比較対象とした他の2つの試験を除外した感度分析に対しても頑健であった(平均RR 0.41,95%CI 0.23-0.74,n 5 1809,I2 5 8%)。また、バイアスのリスクが高い可能性のある研究を除外しても結果は影響を受けなかったが(平均RR 0.29,95%CI 0.10-0.80,12件、n 5 2095,I2 5 61%)サブグループ分析では、1回の投与で十分かどうかは不明であった。死亡数の減少効果は、軽症から中等症、重症のサブグループで一致していた。この重大な結果を報告した外来患者の研究はほとんどなかったため、入院患者と外来患者の試験によるデータのサブグループ化は参考にならなかった。また、主要評価項目の結論は、どちらの群でも死亡例が報告されていない多数の試験の影響を検討した一連の代替的な事後分析に対しても強固なものであった。0.01から0.5の間の治療群連続性補正を用いた極端な感度分析を行っても、エビデンス判断の確実性は変わらなかった(表3)。
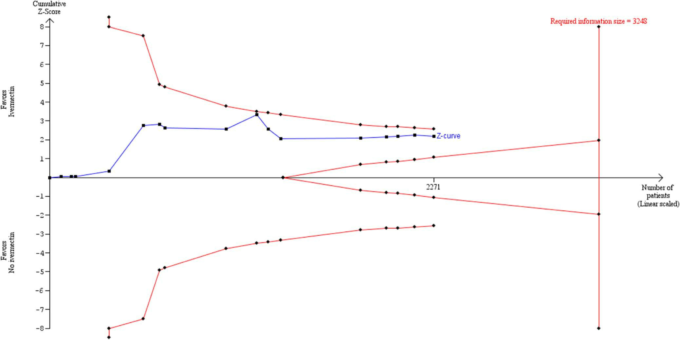
試験の逐次解析
DLランダム効果法を用いたTSAでは 2020年末までにイベルメクチンの全死亡率に対する対照群に対する有意なベネフィットを示す十分なエビデンスが蓄積されている可能性が示された。図8の累積Z曲線は、必要なISに達した後、試験の逐次モニタリング境界を越えており、主に軽度から中等度のCOVID-19感染の入院患者において、イベルメクチンの使用がイベルメクチンの未使用に対する有益性を示す確固たるエビデンスがあることを示唆している。
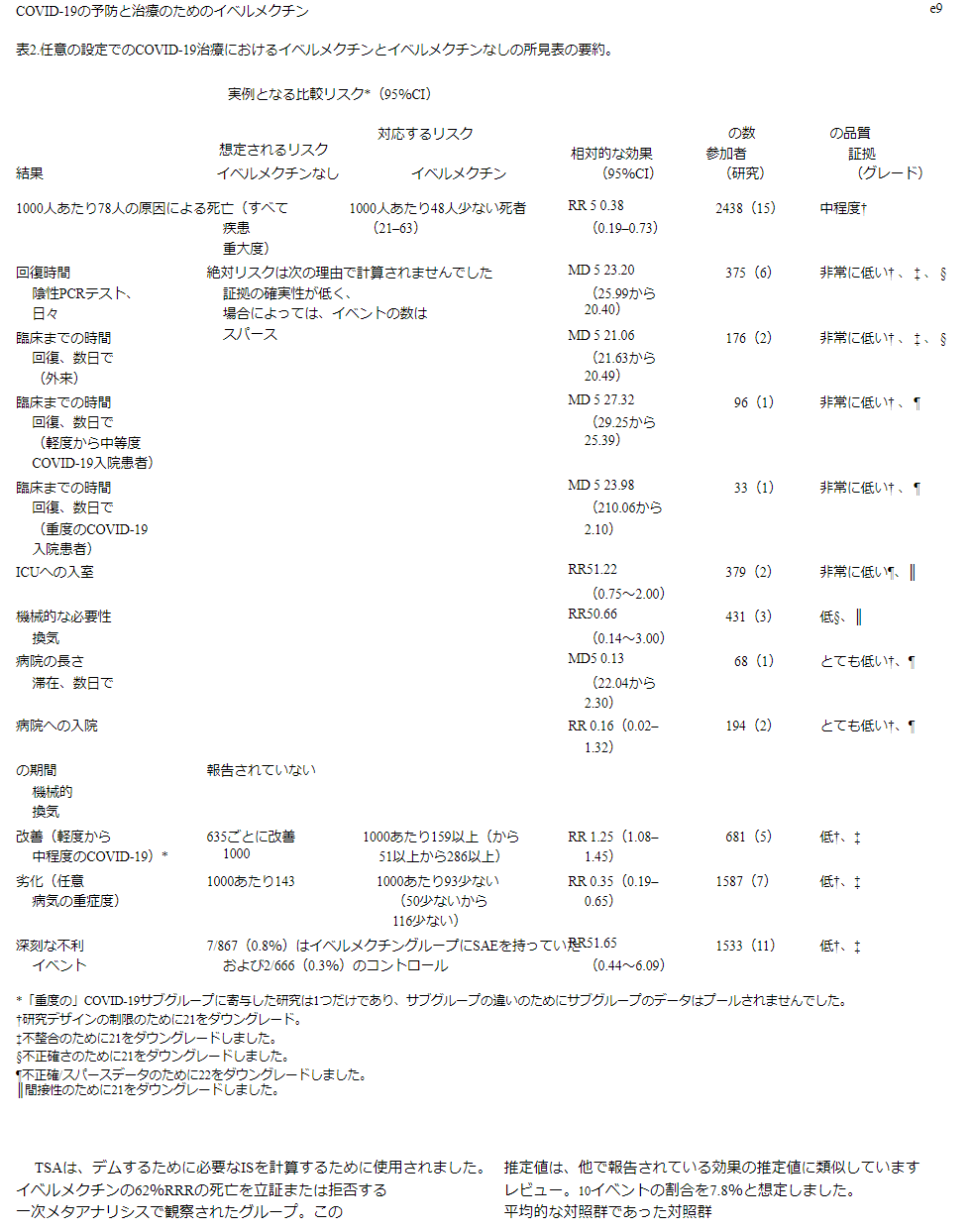
表2 あらゆる環境下でのCOVID-19治療におけるイベルメクチンとイベルメクチン未使用の結果のまとめ表
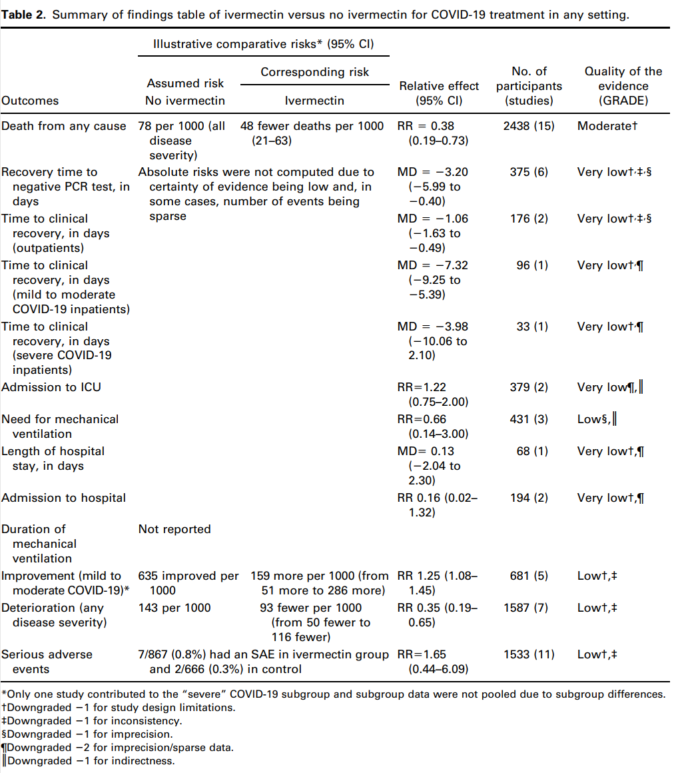
表3 試験におけるゼロイベントへの対処法を考慮した、あらゆる原因による死亡に関する感度分析
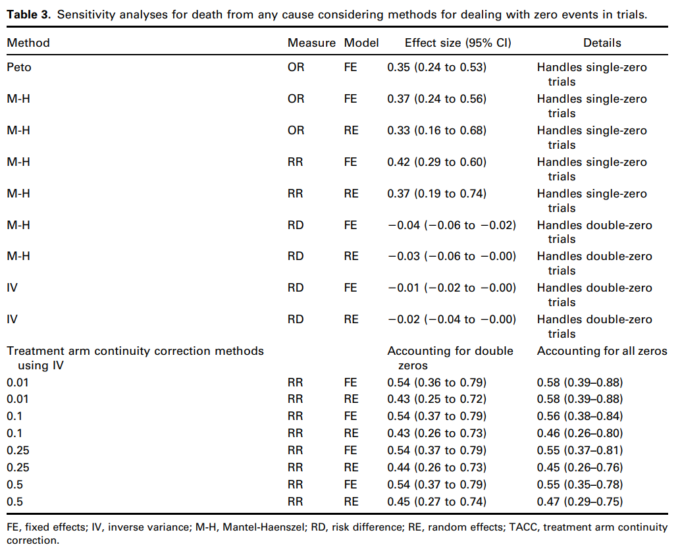
TSAを用いて、主要なメタ分析で観察されたイベルメクチン群における死亡のRRRが62%であることを実証または否定するために必要なISを算出した。この推定値は、他のレビューで報告されている効果推定値と同様である。10 対照群のイベント発生率を7.8%と仮定したが、これは主要メタアナリシスにおける対照群のイベント発生率の平均値であった。異質性を補正するために、モデル分散に基づく推定値49.1%(Diversity esti-mate)を用いた。必要なISは1810人で(図8),メタ解析で観察された参加者の総数(n 5 2438人)を上回った。TSAプロットでは,図8の赤い破線がO’Brien-Fleming α-spending関数を用いた試験逐次モニタリング境界を表している。青の実線は累積zカーブで、累積メタアナリシスで観察された試験を表している。累積zカーブの調整済み有意差境界は、メタ分析に新しい試験が追加されるたびに有意差検定が行われている可能性があるという仮定の下で構築された。図8では、必要なISに到達した後にzカーブが境界を越えていることから、RevMan 5.4.131でDL法を用いて「イベルメクチンは対照薬よりも死亡リスクの低減に優れている」と結論づけたことが裏付けられた。
感度解析
Fonseca44 の試験を除外した感度分析では、メタ分析の不均一性が有意に減少し、DL モデルを用いた TSA の多様性推定値も減少した。これにより、必要とされるISに達しているというプライマリー・コア・アナリシスの示唆が強まった(図9)。DL推定値は試験間の分散を過小評価する可能性があるため、43我々は2つの代替ランダム効果モデルのアプローチを用いてさらなる感度分析を行った。一次TSA解析の結果は、同じパラメータでBT法を用いた感度解析でもロバストであったが、実質的な異質性の原因となったFonseca44試験は除外された(図10)。TSA は、招集されたメタアナリシスの結果を包括的に確認するものである。必要なISは1064であった。
SJ法を用いたTSAでは、モデルからの多様性が高かったことが主な理由で、必要なISに達しなかった(図11)。SJ推定値は、異質性が軽度のメタアナリシスでは試験間の分散を過大評価する可能性があり、その結果、信頼区間が人為的に広くなる43。どのシナリオにおいても、SJ法の無益性を示す証拠はなかった。
図3. あらゆる原因による死亡
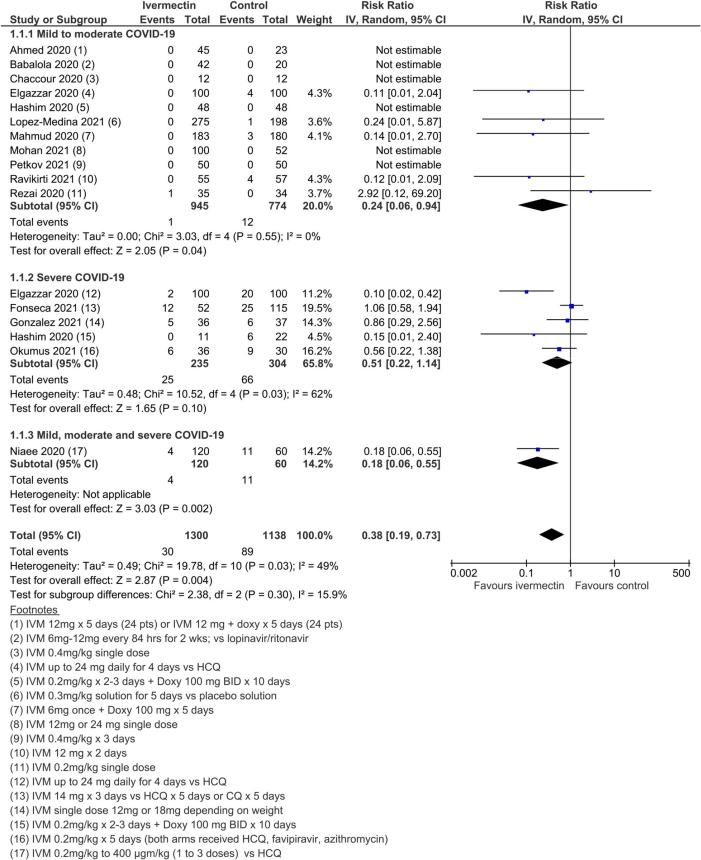
図4.異質性の原因となった外れ値の研究を除いた,あらゆる原因による死亡
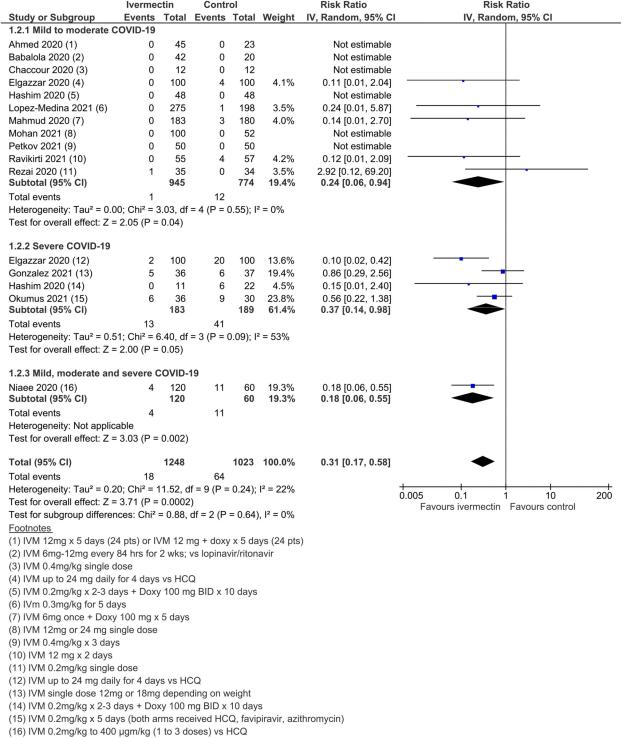
図5 高リスクのバイアス研究を除いた、あらゆる原因による死亡
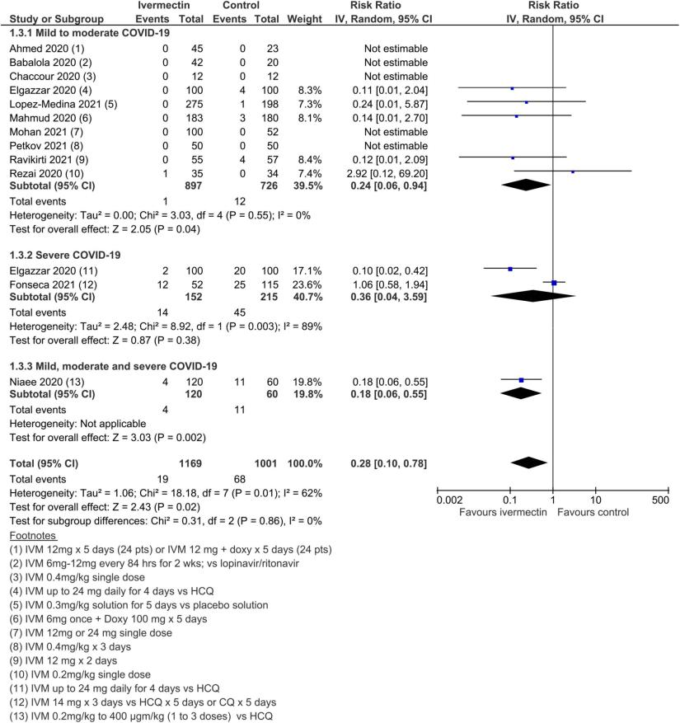
図6 あらゆる原因による死亡、アクティブコントロールのある研究を除く。
全死因死亡に関するエビデンスの確実性
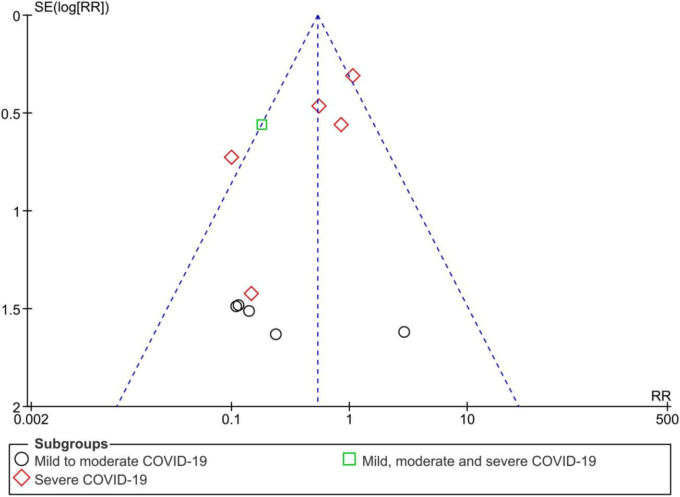
全般的に、あらゆる原因による死亡については、すべての複合解析を考慮して、中程度の確実性のエビデンスがあると判断された(SoF表2および図4-11)。主要評価項目である「あらゆる原因による死亡」に対応するファネルプロットは、出版バイアスの証拠を示唆するものではなかった(図7)。さらに、試験報告書がプレプリントとして簡単にアップロードできるようになったことで、このリスクは軽減されるはずである。
図7 COVID-19治療における全死因死亡に対するイベルメクチン対対照のファネルプロット(重症度でサブグループ化)
副次評価項目
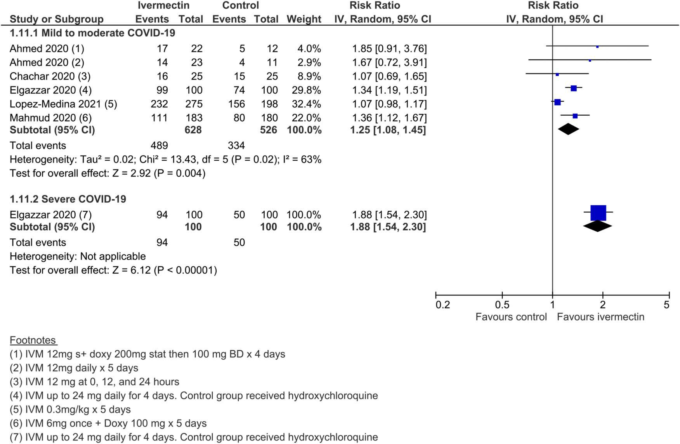
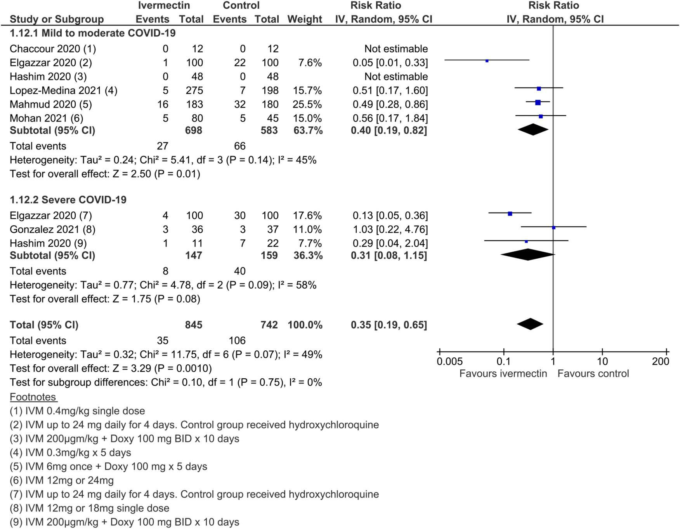
副次的アウトカムでは、確実性が低い~非常に低いエビデンスが得られた(SoF表2)。確実性の低い所見では、「人工呼吸の必要性」についてはアイベルメクチンの有益性がない可能性が示唆され、「改善」と「悪化」についてはアイベルメクチンが有利な効果推定値が得られたが、研究デザインの限界と不整合性のために確実性は低いと評価された(図12-14)。その他の副次的な結果は、すべて確実性が非常に低いと評価された。
図8 a 5 0.05,b 5 0.1,対照率 5 7.8%、RRR 5 62%、多様性 5 49.5%のパラメータ推定値を持つ、DLランダム効果法を用いた試験の逐次解析
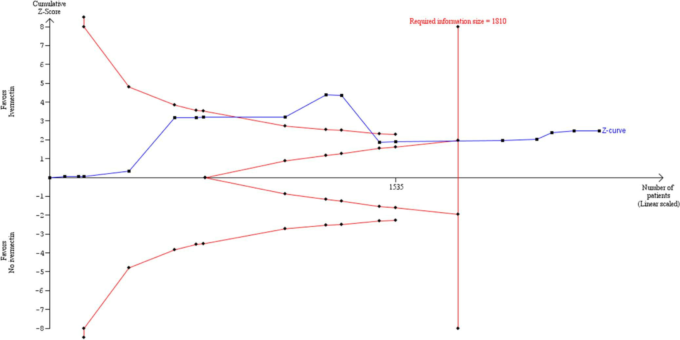
図9.異質性の原因となる外れ値の研究を除外した感度分析。パラメータ推定値をa 5 0.05,b 5 0.1,対照率5 7.8%、5 62%、多様性5 0%としたDLランダム効果法による試験の逐次分析を示す
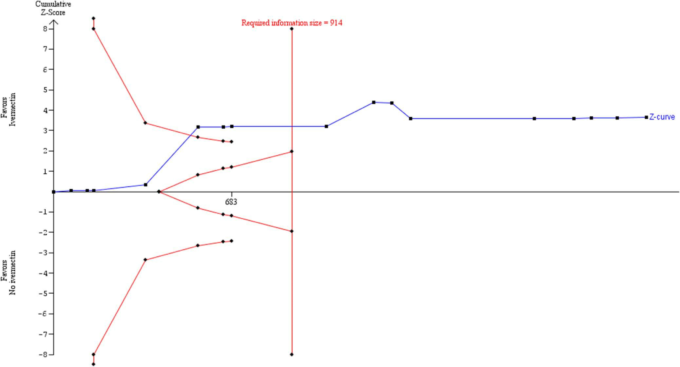
図10. 異質性の原因となった外れ値の研究を除外した感度分析。パラメータ推定値が a 5 0.05,b 5 0.1,対照率 5 7.8%、RRR 5 62%、多様性 5 14.2%の Biggerstaff-Tweedie 乱数効果法を用いた試験順序分析を示す
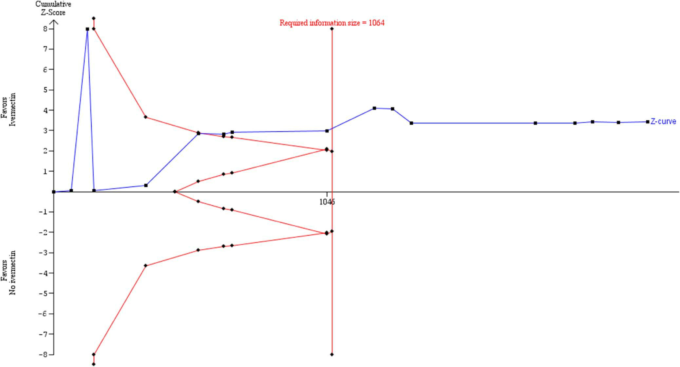
図11. 異質性の原因となった外れ値の研究を除外した感度分析。パラメータ推定値がa 5 0.05,b 5 0.1,対照率5 7.8%、RRR 5 62%、多様性5 71.9%のSidik-Jonkmanランダム効果法による試験の逐次分析を示す
1533人の被験者を対象とした11の試験のメタアナリシスでは、重度の有害事象のリスクについて、イベルメクチンと対照との間に有意な差は認められなかった(aRR 1.65,95%CI 0.44-6.09,I2 5 0%、低い確実性のエビデンス、不正確さと試験デザインの制限のためにダウングレードされた)。重篤な有害事象は,イベルメクチン群で7件,対照群で2件報告された。SAEは以下の通りであった。Mahmud試験107では食道炎が2名(この試験でイベルメクチンと共同投与されたドキシシクリンの既知の副作用である)Krolewiecki et al 106の試験では低ナトリウム血症が1名(この試験では高用量のイベルメクチンを5日間使用した)。また、トルコの研究115では2名の患者に重篤な「せん妄様行動、興奮、攻撃的態度、意識変容」が認められたが、著者らは、MDR-1/ABCB1遺伝子またはCYP3A4遺伝子の代謝不全が原因であるとしており、これらの遺伝子のスクリーニングが本試験の特徴であった。Lopez-Medinaら85の試験では、各群で2件のSAEが発生した(SoF表2)。
イベルメクチンの予防投与とイベルメクチンの予防投与なしの比較
738 名の参加者を含む 3 つの試験で、医療従事者および COVID-19 接触者の COVID-19 予防のためのイベルメクチンが評価された。738人の参加者を対象としたこれら3つの試験のメタアナリシスでは、医療従事者とCOVID-19接触者におけるイベルメクチンの予防は、COVID-19感染のリスクを平均86%(79%~91%)減少させる可能性があることがわかった(3試験、738人、RR 0.14,95%CI 0.09~0.21,COVID-19感染者はそれぞれ5.0%対29.6%、確実性の低いエビデンス、研究デザインの限界と組み入れられた試験数の少なさのために格下げ)(図15)。538人が参加した2つの試験では、重篤な有害事象は記録されなかった(SoF表4)。
図12. 人工呼吸の必要性
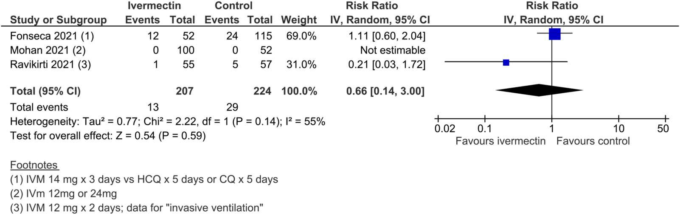
図13. 改善
考察
COVID-19におけるイベルメクチン治療は、中程度の確実性をもって、有意な生存利益をもたらすことが示された。エビデンスの確実性の判断は、試験の逐次解析の結果によって強化され、要求されたISがすでにほぼ満たされていることが示された。改善と悪化に関する確実性の低いエビデンスも、イベルメクチンの臨床的有用性の可能性を支持している。確信度の低いエビデンスでは、予防における有意な効果が示唆されている。全体として、イベルメクチンの早期使用がCOVID-19による罹患率および死亡率を減少させる可能性があることも、エビデンスは示唆している。これは、(1)イベルメクチンを予防薬として使用した場合のCOVID-19感染の減少、(2)あらゆる原因による死亡について、重度の疾患に比べて軽度から中等度の疾患でより良好な効果推定値、(3)悪化の減少を示すエビデンスに基づいている。
このレビューにおける重篤な有害事象に関するエビデンスは、統計的有意性を得るには事象が少なすぎたこともあり、確実性は低いと評価された。疥癬に対するイベルメクチンの使用に関する最近の世界保健機関(WHO)の文書によると、イベルメクチンの有害事象は主に軽度で一過性のものであることが示されている。
方針として、含まれる研究を最高レベルのエビデンス、すなわちRCTに限定した。これは、イベルメクチンについては、緊急時に考慮される可能性のある多数の観察試験(非ランダム化試験)があるにもかかわらず、である。117 結果の選択的報告や出版バイアスの可能性はあるものの、結果の解釈や結論の形成にはこれらの考慮事項を織り込んでいる。PRIS-MAのガイドラインおよび公衆衛生上の緊急事態におけるデータと結果の共有に関する世界的な規範の策定に関するWHOの声明を遵守した117。
図14.劣化
このレビューにはいくつかの限界がある。データを提供してくれた研究の中には、方法について完全に説明していないものもあり、バイアスのリスクを評価することは困難であった。研究方法の記述が希薄または不明確な場合、著者に連絡して方法を明確にしようとしたが、情報が不足していたため、いくつかの例では所見を低く評価した。調査結果の全体的な解釈は、募集した参加者、治療レジメン、対照群の人々に提供されたケアにばらつきがあったため、妨げられた。我々は、サブグループ分析および感度分析により、このばらつきを考慮するよう努めた。とはいえ、投与量と治療法、および「標準治療」の他の構成要素とイベルメクチンの併用については、さらなる研究が必要である。我々は、ウイルスクリアランスのような実験結果の指標を含めなかった。10,47,105,108 いくつかの試験では、入院期間などの連続したデータが中央値と四分位範囲で報告されているため、これらのデータをメタ解析に含めることができなかった。我々のプロトコルではナルレイティブなエビデンス統合を行わなかったため、また、これらのデータはイベルメクチンに有利な傾向があるため、これらの連続したアウトカムに対するイベルメクチンの効果の確実性は過小評価されている可能性がある。
COVID-19に対するイベルメクチンの使用については、イベルメクチンの発見者であるノーベル賞受賞者の大村智教授との共著を含め、他に少なくとも5つのレビューが発表されているが9,10,118,119,120,ピアレビューされたものは3つしかなく9,118,120,完全なシステム・テマティック・レビューを試みたものは2つしかなかった。我々は、医療介入のシステマティックレビューのための批判的評価ツールであるAMSTAR 2,121を、2つの非査読付きシステマティックレビュー10,119に適用したところ、どちらも質が低いと判断された(表5)。しかし、これらのレビューでは、イベルメクチンがCOVID-19の治療における死亡リスクを減少させたとの指摘もあった。
最近更新されたWHOの治療ガイドライン12では、7つの試験と1419人が死亡率の分析に含まれている。81%のリスク減少(オッズ比0.19,95%CI 0.09-0.36)が報告され、イベルメクチンを支持する効果推定値は、正確性を期すために2段階引き下げられたが、報告されたCIが正確(64%-91%)であることから、その正当性は不明であるとしている。
表4 健康な集団(COVID-19感染のない人)におけるCOVID-19予防のためのイベルメクチンとイベルメクチンなしの結果のまとめ表

システマティックレビューからのエビデンスに加えて、いくつかの対照観察研究の結果は既存のエビデンスと一致しており、イベルメクチン治療による転帰の改善を示唆している55,57,59。55,57,59 同様に、第一線で働く労働者やリスクのある人々へのイベルメクチン予防に関しては、バングラデシュとアルゼンチン(後者は1195人の医療従事者を対象とした)で行われた対照観察研究で、イベルメクチン予防によるCOVID-19感染の明らかな減少が示されており、中には対照群の感染率が50%を超えていたにもかかわらず、完全な防御(感染ゼロ)を行ったという報告もある。 122,123 インドの医療従事者を対象としたイベルメクチンの予防投与に関する非常に大規模な試験124では、3532人の参加者を対象とし、本メタアナリシスと有意な差のないリスク比が報告されている(予防投与の結果)。
妊娠中のイベルメクチンの安全性を明らかにすることは、COVID-19に罹患している妊婦の患者受容性において重要な問題である。最近のメタアナリシス5では、異常妊娠のリスクが高まるという証拠はほとんどないが、リスクがないという証拠も同様に弱い。安全性と相対的な有効性に加えて、予防(曝露前と曝露後)と治療について異なるリスク・ベネフィットの判断が示されることがあり、COVID-19にとって妊娠前は高リスクの状態である。
図15. COVID-19感染症(予防試験)。
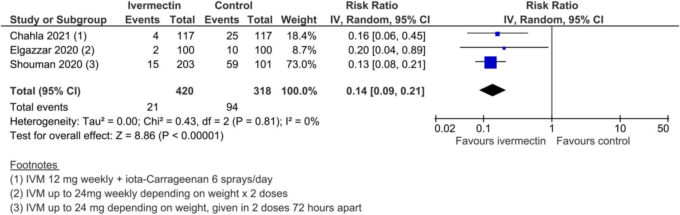
表5 他のシステマティックレビューの方法論的品質(AMSTAR 2)

AMSTAR 2121を用いて評価した。+は十分に評価されている、2は不十分に評価されている、 ? は評価が不明、NAは該当しない(メタアナリシスに含まれる研究が10件未満)。
*文書化されていない、または報告が不十分。
†参加者集団、比較対照となる介入の記述、追跡調査の期間が記述されていないか、不十分であった。
4.バイアスのリスク評価については、レビューの本文では、試験の質が低い、まあまあ、あるいは高いと書かれているだけで、その概要は示されていなかった。議論の中でバイアスに関する詳細がいくつかあったが、それらはほとんど一般的なもので、RCTのバイアスのリスクを評価するために使用される推奨されたコクランのツールに従っていなかった。
§全死亡に関するメタアナリシスが提示されたが、著者は、同じ比較と結果を報告した少なくとも2つの試験を含む他のアウトカムについてメタアナリシスが行われなかった理由を、考察の一部を除いて明示しなかった。例えば、ほとんどの試験でウイルスクリアランスが報告されているのであれば、サブグループ解析を行う余地があったはずですし、試験によって追跡期間が異なることを考慮して、各比較対象の時点を分割することもできたはずである。その代わりに、システマティックレビュー報告ガイドラインのSWiM(Synthesis without meta-analysis)に従わない、票数型の結果説明が行われた144。
議論の中でバイアスについての詳細な説明があったが、これはほとんど一般的なもので、RCTのバイアスのリスクを評価するために推奨されているコクランツールに従っていなかった。同様に、エビデンスの確実性/質に関しても、著者は要約表の中で、説明や正当性を示すことなく、「良い」、「まあまあ」、「限定的」などの用語を使用している。
結果は報告されているが、定義が不十分であった。
#かなりの数の適切なRCTがレビューに含まれていない。レビュープロセスの十分なデューデリジェンスを考慮すると、検索戦略の包括的な性質には疑問がある。
††様々な情報源から入手したRCTのデータを著者が報告しておらず、観察されたデータを反映していない結論もあった。バイアスのリスクが高い4つのプレプリントのレトロスペクティブ研究の分析では、イベルメクチンは死亡率の低下と関連していないことが報告された(logRR 0.89,95%CI 0.09-1.70,P 5 0.04)。どのような解釈をするにしても、バイアスのリスクが高い研究や統計的不均一性があるという注意点を加える必要があるが、観察された結果に基づいて、これらの結果が潜在的な関連性を示さないと解釈するのは正しくない。さらに、バイアスのリスクが高いという判断は、十分に正当化されていない。
4.交絡の調整を行っていない研究を除外して感度分析を行ったが、詳細は記載されていない。4件のレトロスペクティブ研究において、イベルメクチン投与と生存率との潜在的な関連性を示すいくつかのエビデンスがあったことを考えると、感度分析を行っても関連性を示唆する結果が得られないというのは非常に不可解である。
本レビューのRCTでは、高齢者におけるイベルメクチンの使用については特に検討されていないが、高齢者は重度のCOVID-19のハイリスクグループであることが知られている。介護施設では、急速に感染が拡大することでも知られている。高齢者におけるイベルメクチンの標準的な適応症は疥癬である。50,127 バージニア州の7つの高齢者施設で309人の患者を対象にしたポジティブな経験に関する手紙がNIH127に送られ、最近出版物として提出された。
また、イベルメクチンが導入されている国からもエビデンスが出てきている。例えば、ペルーでは、パンデミックの初期にCOVID-19による死亡者数が非常に多かった128。観察的証拠に基づいて、ペルー政府は2020年5月にCOVID-19に対するイベルメクチンの使用を承認した128。また、早期にイベルメクチンを導入した24州のペルーのデータを分析した結果、過剰死亡率が30日以上で59%、45日以上で75%低下したことが報告されている129。ただし、この減少には、行動の変化、社会的距離の取り方、フェイスマスクの使用などの要因が影響している可能性がある。
COVID-19 パンデミックにおけるイベルメクチン治療の使用に関するその他の検討事項には、人々の価値観や嗜好、衡平性への影響、受容性、実現可能性などがある130。しかし、医療の意思決定においては、これらの要素を考慮せずに有効性に関するエビデンスを等閑視することはほとんどない。最終的に、イベルメクチンをより広く普及させるためには、GRADE-DECIDEフレームワークで指定されているこれらの意思決定基準に関連して、何らかの検討が必要である130。
COVID-19に対してイベルメクチンを評価している進行中の臨床試験が数多く登場している。130 COVID-19 に対するイベルメクチンの評価については、現在進行中の臨床試験が多数あるが、エビデンスに基 づく総合的なレビューや RCT に基づく政策や実施の可能性とのトレードオフは、国によって大きく異なる。129,131,132,133,134 最近の世界動向調査118 では、世界中で使用されていることが示されている。イベルメクチンは世界の多くの国で低コストの医薬品であるにもかかわらず、経済評価が明らかに不足していることから、SARS-CoV-2の治療および予防のためのイベルメクチンの経済的エビデンスは現在のところ不足していると考えられる。このことは、WHOのような組織からのガイドラインを待っている可能性のあるLMICに、より大きな影響を与えるかもしれない。
有効性、安全性、低コスト、そして現在の死亡率の証拠を考慮すると、イベルメクチンは多くの国でのパンデミックの健康および経済的成果に影響を与えると思われる。イベルメクチンは、安全性が不明な実験的新薬ではない。イベルメクチンは、安全性が不明な実験的新薬ではなく、WHOの「必須医薬品」であり、すでに7つの異なる適応症で膨大な量が使用されている。COVID-19では、デキサメタゾンの1回のRCTに基づいて、コルチコステロイドが標準治療として受け入れられている1。デキサメタゾンの採用が1回のRCTで十分であるならば、イベルメクチンの採用も2ダースのRCTのエビデンスがあれば、当然のことながら支持される。
イベルメクチンは、COVID-19に対する世界的な介入として、公平で受け入れられやすく、実現可能なものであると考えられる。医療従事者は、治療と予防の両方において、その使用を強く考慮すべきである。
謝辞
本研究は、ピエール・コーリー博士の先行文献レビューに触発されたものである。
著者らは、検索戦略の立案と検索の実行を行ったコクラン婦人科・神経腫瘍学・希少がん(CGNOC)グループの情報専門家であるJo Platt氏と、戦略のレビューを行ったAnna Noel Storr氏に感謝する。また、参考文献リストの作成に自発的に協力してくれたIsabella Rushforthにも感謝している。
また,詳細なコメントやフィードバックをいただき,本レビューに関わっていただいたGill Gyte氏,投稿前に有益な査読コメントをいただいたMichael Grayling氏とDavid Tovey氏にも感謝している。また、外部の査読者の方々には有益なコメントをいただき、Peter Manu氏には研究成果を発表する機会を与えていただいたことに感謝している。
文献
1. Horby P, Lim WS, Emberson J, et al. Dexamethasone in hospitalized patients with covid-19. NEJM. 2021;384: 693–704.
2. Barrows NJ, Campos RK, Powell ST, et al. A screen of FDA-approved drugs for inhibitors of zika virus infec-tion. Cell Host Microbe. 2016;20:259–270.
3. Conterno LO, Turchi MD, Corrêa I, et al. Anthelmintic drugs for treating ascariasis. Cochrane Database Syst Rev. 2020;1. doi: 10.1002/14651858.CD010599.pub2.
4. World Health Organization. 21st Model List of Essential Medicines. Geneva, Switzerland; 2019. Available at: www.who.int/publications/i/item/ WHOMVPEMPIAU2019.06. Accessed January 26, 2021.
5. Nicolas P, Maia MF, Bassat Q, et al. Safety of oral iver-mectin during pregnancy: a systematic review and meta-analysis. Lancet Glob Health. 2020;8:e92–e100.
6. Banerjee K, Nandy M, Dalai CK, et al. The battle against covid 19 pandemic: what we need to know before we “test fire” ivermectin. Drug Res (Stuttg). 2020;70:337–340.
7. Navarro M, Camprubí D, Requena-Mendez A, et al. Safety of high-dose ivermectin: a systematic review and meta-analysis. J Antimicrob Chemother. 2020;75: 827–834.
8. Kircik LH, Del Rosso JQ, Layton AM, et al. Over 25 Years of clinical experience with ivermectin: an over-view of safety for an increasing number of indications. J Drugs Dermatol. 2016;15:325–332.
9. Kory P, GU M, Varon J, et al. Review of the emerging evidence demonstrating the efficacy of ivermectin in the prophylaxis and treatment of COVID-19. Am J Ther. 2021;28:e299–e318.
10. Hill A, Abdulamir A, Ahmed S, et al. Meta-analysis of randomized trials of ivermectin to treat SARS-CoV-2 infection, 19. Res Square. 2021. doi: 10.21203/rs.3.rs-148845/v1.Preprint.
11. National Institute of Health. The Covid-19 Treatment Guidelines Panel’s Statement on the Use of Ivermectin for the Treatment of Covid-19. 2021.
12. World Health Organization. Therapeutics and COVID-
19: Living Guideline. Geneva, Switzerland: WHO; 2021. Available at: www.who.int/publications/i/ item/WHO-2019-nCoV-therapeutics-2021.1. Accessed April 8, 2021.
13. Heidary H, Gharebaghi R. Ivermectin: a systematic review from antiviral effects to COVID-19 complemen-tary regimen. J Antibiot. 2020;73:593–602.
14. Caly L, Druce JD, Catton MG, et al. The FDA-approved drug ivermectin inhibits the replication of SARS-CoV-2 in vitro. Antivir Res. 2020;178:104787.
15. Jans DA, Wagstaff KM. Ivermectin as a broad-spectrum host-directed anti-viral: the real deal? Cells. 2020;9:2100.
16. Schmith VD, Zhou J, Lohmer LRL. The approved dose of ivermectin alone is not the ideal dose for the treatment of Covid-19. Clin Pharmacol Ther. 2020;108:762–765.
17. Anand K, Ziebuhr J, Wadhwani P, et al. Coronavirus main proteinase (3CLpro) structure: basis for design of anti-SARS drugs. Science. 2003;300:1763–1767.
18. Mody V, Ho J, Wills S, et al. Identification of 3-chymotrypsin like protease (3CLPro) inhibitors as potential anti-SARS-CoV-2 agents. Nat Commun Biol. 2021;4:93.
19. DiNicolantonio JJ, Barroso J, McCarty. Ivermectin may be a clinically useful anti-inflammatory agent for late-stage covid-19. Open Heart. 2020;7:e001350–e.
20. Lehrer A, Rheinstein PH. Ivermectin docks to the SARS-CoV-2 spike receptor binding domain attached to ACE2. vivo. 2020;34:3023–3026.
21. Scheim D. From cold to killer: how SARS-CoV-2 evolved without hemagglutinin esterase to agglutinate, then clot blood Cells in pulmonary and systemic micro-vasculature. SSRN. 2020. doi: 10.2139/ssrn.3706347. Preprint.
22. WHO Expert Committee on the Selection and Use of Essential Medicines. Application for Inclusion of Ivermectin on the WHO Model List of Essential Medicines (EML) and Model List of Essential Medicines for Children (EMLc) for the Indi-cation of Scabies. 2018. Available at: www.who. int/selection_medicines/committees/expert/22/ applications/s6.6_ivermectin.pdf. Accessed February 21, 2021.
23. Ahmed S, Karim MM, Ross AG, et al. A five day course of ivermectin for the treatment of covid-19 may reduce the duration of illness. Int J Infect Dis. 2020;103:214–216.
24. Chaccour C, Casellas A, Blanco-Di Matteo A, et al. The effect of early treatment with ivermectin on viral load, symptoms and humoral response in patients with non-severe COVID-19: a pilot, double-blind, placebo-controlled, randomized clinical trial. EClinical Med. 2021;32:100720. doi: 10.1016/j.eclinm.2020.100720
25. Aluko P, Graybill E, Craig D, et al. Chapter 20: eco-nomic evidence. In: Higgins J, Thomas J, Chandler J, et al, eds. Cochrane Handbook for Systematic Reviews of Interventions (Version 61). Cochrane; 2020.
26. Bryant A, Lawrie T, Dowsell T, et al. Ivermectin for Pre-vention and Treatment of Covid-19 (Protocol). The Evidence-Based Medical Consultancy Ltd; 2021. Avail-able at: tinyurl.com/cx7pnaxa. Accessed Feb-ruary 27, 2021.
27. Higgins JPT, Thomas J, Chandler J, et al. Cochrane Hand-book for Systematic Reviews of Interventions Version 6. 0 Co-chrane. 2019.
28. Higgins JP, Thompson SG, Deeks JJ, et al. Measuring inconsistency in meta-analyses. BMJ. 2003;327:557–560.
29. Deeks JJ, Altman DG, Bradburn MJ. Chapter 15: statisti-cal methods for examining heterogeneity and combining results from several studies in meta-analysis. In: System-atic Reviews in Health Care: Meta-Analysis in Context. Lon-don, United Kingdom: BMJ Publication Group; 2001.
30. DerSimonian R, Laird N. Meta-analysis in clinical trials. Controlled Clin Trials. 1986;7:177–188.
31. RevMan. Review Manager 5. The Cochrane Collabora-tion; 2020.
32. R: A Language and Environment for Statistical Computing. R Foundation for Statistical Computing V, Austria. R Foun-dation for Statistical Computing. Vienna, Austria; 2021.
33. Owen RK, Bradbury N, Xin Y, et al. MetaInsight: an interactive web-based tool for analyzing, interrogating, and visualizing network meta-analyses using R-shiny and netmeta. Res Syn Meth. 2019;10:569–581.
34. Rücker G, Schwarzer G, Krahn U, et al. Network Meta-Analysis Using Frequentist Methods; 2017.
35. Efthimiou O. Practical guide to the meta-analysis of rare events. Evid Based Ment Health. 2018;21:72–76.
36. Stijnen T, Hamza TH, Ozdemir P. Random effects meta-analysis of event outcome in the framework of the gen-eralized linear mixed model with applications in sparse data. Stat Med. 2010;29:3046–3067.
37. Chen Y, Chu H, Luo S, et al. Bayesian analysis on meta-analysis of casecontrol studies accounting for within-study correlation. Stat Methods Med Res. 2015;24:836–855.
38. Rücker G, Schwarzer G, Carpenter J, et al. Why add anything to nothing? The arcsine difference as a measure of treatment effect in meta-analysis with zero cells. Stat Med. 2009;28:721–738.
39. Tian L, Cai T, Pfeffer MA, et al. Exact and efficient inference procedure for meta-analysis and its applica-tion to the analysis of independent 2 x 2 tables with all available data but without artificial continuity correc-tion. Biostatistics. 2009;10:275–281.
40. Cai T, Parast L, Ryan L. Meta-analysis for rare events. Stat Med. 2010;29:2078–2089.
41. Brok J, Thorlund K, Gluud C, et al. Trial sequential analysis reveals insufficient information size and poten-tially false positive results in many meta-analyses. J Clin Epidemiol. 2008;61:763–769.
42. Wetterslev J, Thorlund K, Brok J, et al. Estimating required information size by quantifying diversity in random-effects model meta-analyses. BMC Med Res Methodol. 2009;9:86.
43. Thorlund K, Engstrøm J, Wetterslev J, et al. User Manual for Trial Sequential Analysis (TSA). 2011. Available at: www.ctu.dk/tsa. Accessed April 8, 2021.
44. Fonseca AJ. The Effect of Chloroquine, Hydroxychloroquine OR Ivermectin in Patients with Severe Manifestations of Co-ronavirus. 2021. Available at: ensaiosclinicos.gov. br/rg/RBR-8h7q82/. Accessed January 20, 2021.
45. Schünemann H, Vist G, Higgins J, et al. Chapter 15: interpreting results and drawing conclusions. In: Hig-gins J, Thomas J, Chandler J, et al., eds. Cochrane Hand-book for Systematic Reviews of Interventions Version 61. Cochrane; 2020.updated September 2020.
46. Cochrane Effective Practice and Organisation of Care (EPOC). EPOC Resources for Review Authors; 2017. Avail-
able at: www.epoc.cochrane.org/epoc-specific-resources-review-authors. Accessed February 1, 2021.
47. Elgazzar A, Eltaweel A, Youssef SA, et al. Efficacy and safety of ivermectin for treatment and prophylaxis of covid-19 pandemic. Res Square. 2020. doi: 10.21203/rs. 3.rs-100956/v2.Preprint.
48. Alam MT, Murshe R, Bhiuyan E, et al. A case series of 100 covid-19 positive patients treatedwith combination of ivermectin and doxycycline. J Bangladesh Coll Physi-cians Surgeons. 2020;38:10–15.
49. Behera P, Patro BK, Singh AK, et al. Role of ivermectin in the prevention of covid-19 infection among health-care workers in India: a matched case-control study. PLoS One. 2020;16:e0247163.
50. Bernigaud C, Guillemot D, Ahmed Belkacem A, et al. Oral ivermectin for a scabies outbreak in a long term– care facility: potential value in preventing COVID 19 and associated mortality? Br J Dermatol. 2021. doi: 10. 1111/bjd.19821.
51. Budhiraja S, Soni A, Jha V, et al. Clinical Profile of First 1000 Covid-19 Cases Admitted at Tertiary Care Hospi-tals and the Correlates of Their Mortality: An Indian Experience. medRxiv. 2020. doi: 10.1101/2020.11.16. 20232223.Preprint.
52. Cadegiani FA, Goren A, Wambier CG, et al. Early covid-19 therapy with azithromycin plus nitazoxanide, ivermectin orHydroxychloroquine in outpatient settings significantly reduced SymptomsCompared to known outcomes in untreated patients. medRxiv. 2020. doi: 10.1101/2020.10.31.20223883.Preprint.
53. Camprubí D, Almuedo-Riera A, Martí-Soler H, et al. Lack of efficacy of standard doses of ivermectin in severe covid-19 patients. PLoS One. 2020;15:e0242184.
54. Carvallo H, Hirsch R, Farinella M. Safety and efficacy of the combined use of ivermectin, dexamethasone, enox-aparin and aspirin against covid 19. medRxiv. 2020. doi: 10.1101/2020.09.10.20191619.Preprint.
55. Rajter JC, Sherman MS, Fatteh N, et al. Use of ivermec-tin is associated with lower mortality in hospitalized patients with coronavirus disease 2019. CHEST. 2021; 159:85–92.
56. Espitia-Hernandez G, Munguia L, Diaz-Chiguer D, et al. Effects of Ivermectin-azithromycin-cholecalciferol combined therapy on COVID-19 infected patients: a proof of concept study. Biomed Res. 2020;31:129–133.
57. Gorial FI, Mashhadani S, Sayaly HM, et al. Effectiveness of ivermectin as add-on therapy in covid-19 manage-ment (pilot trial). medRxiv. 2020. doi: 10.1101/2020.07. 07.20145979.Preprint.
58. Hellwig MD, Maia A. A covid-19 Prophylaxis? Lower incidence associated withprophylactic administration of Ivermectin. Int J Antimicrob Agent. 2021;57:106248.
59. Khan M, Khan M, Debnath C, et al. Ivermectin treat-ment may improve the prognosis of patients with cov-id-19. Archivos de Bronconeumología. 2020;56:832.
60. Morgenstern J, Redondo JN, De León A, et al. The use of compassionate ivermectin in the management of symp-tomatic outpatients and hospitalized patients with clin-ical diagnosis of covid-19 at the medical center bournigal and the medical center punta cana, rescue group, Dominican Republic. medRxiv. 2020. doi: 10. 1101/2020.10.29.20222505.Preprint.
61. Portmann-Baracco A, Bryce-Alberti M, Accinelli RA. Antiviral and anti-inflammatory properties ofivermec-tin and its potential use in Covid-19. Arch Bronconeumol. 2020;56:831.
62. Shokati Z. A Randomized Clinical Trial Study, Comparison of the Therapeutic Effects of Ivermectin, Kaletra and Chloro-quine with Kaletra and Chloroquine in the Treatment of Patients with Coronavirus [Protocol]. 2019. Available at: en.irct.ir/trial/48444. Accessed January 2021.
63. Spoorthi V, Sasank S. Utility of ivermectin and doxycy-cline combination for the treatment of SARS- CoV-2. Int Arch Integrated Med. 2020;7:177–182.
64. Abd-Elsalam S. The Efficacy of Ivermectin and Nitazoxa-nide in Covid-19 Treatment. 2020. Available at: https:// clinicaltrials.gov/ct2/show/NCT04351347. Accessed January 2021.
65. Abd-Elsalam S. Ivermectin as a Novel Therapy in Covid-19 Treatment. 2020. Available at: clinicaltrials.gov/ ct2/show/NCT04403555. Accessed January 2021.
66. Alam MT. Safety and Efficacy of Ivermectin and Doxycy-cline in Treatment of Covid-19; 2020. Available at: clinicaltrials.gov/ct2/show/NCT04551755.
Accessed January 2021.
67. Arnold S. Novel Agents for Treatment of High-Risk Covid-19 Positive Patients; 2020. Available at: https:// clinicaltrials.gov/ct2/show/NCT04374019. Accessed January 2021.
68. Centenario Hospital Miguel Hidalgo. Hydroxychloro-quine and Ivermectin for the Treatment of Covid-19 Infec-tion; 2020. Available at: clinicaltrials.gov/ct2/ show/NCT04391127. Accessed January 2021.
69. Ashraf S. Efficacy of Subcutaneous Ivermectin with or with-out Zinc and Nigella Sativa in Covid-19 Patients (SINZ-Covid-PK); 2020. Available at: clinicaltrials. gov/ct2/show/NCT04472585. Accessed January 2021.
70. Ataee Z. Evaluation of the Effect of Ivermectin in Hospital-ized Patients with Covid-19 in Imam Reza Hospital in Mash-had; 2020. Available at: en.irct.ir/trial/49180. Accessed January 2021.
71. Bisoffi Z. COVidIVERmectin: Ivermectin for Treatment of Covid-19 (COVER). 2020. Available at: clinicaltrials.gov/ ct2/show/NCT04438850. Accessed January 2021.
72. ProgenaBiom. Trial of Combination Therapy to Treat Covid-19 Infection; 2020. Available at: https:// clinicaltrials.gov/ct2/show/NCT04482686. Accessed January 2021.
73. Perez A. Efficacy, Safety and Tolerability of Ivermectin in Subjects Infected with SARS-CoV-2 with or without Symp-toms (SILVERBULLET); 2020. Available at: https:// clinicaltrials.gov/ct2/show/NCT04407507. Accessed January 2021.
74. Echeverri E. Effectiveness and Safety of Ivermectin for the Prevention of Covid-19 Infection in Colombian Health Per-sonnel (IveprofCovid19); 2020. Available at: https:// clinicaltrials.gov/ct2/show/NCT04527211. Accessed January 2021.
75. Elalfy H. New Antiviral Drugs for Treatment of Covid-19; 2020. Available at: clinicaltrials.gov/ct2/ show/NCT04392427. Accessed January 2021.
76. Exman P. Early Treatment with Ivermectin and LosarTAN for Cancer Patients with Covid-19 Infection (TITAN); 2020. Available at: clinicaltrials.gov/ct2/show/ NCT04447235. Accessed January 2021.
77. Fathalipour M. The Efficacy and Safety of Ivermectin in Patients with Covid-19: A Randomized Clinical Trial; 2020. Available at: www.irct.ir/trial/49501. Accessed January 2021.
78. George B. A Phase IIB Open Label Randomized Controlled Trial to Evaluate the Efficacy and Safety of Ivermectin in Reducing Viral Loads in Patients with Hematological Disor-ders Who Are Admitted with Covid 19 Infection; 2020. Available at: www.ctri.nic.in/Clinicaltrials/ pmaindet2.php?trialid543449. Accessed January 2021.
79. Gheibi N. Dose-Finding Study of Ivermectin Treatment on Patients Infected with Covid-19:A Clinical Trial; 2020. Available at: en.irct.ir/trial/47012. Accessed January 2021.
80. Gheibi N. Determination the Therapeutic Effect of Ivermec-tin and Sovodak on Patients Infected with Covid-19: A Clin-ical Trial; 2020. Available at: en.irct.ir/trial/ 51007. Accessed January 2021.
81. Temple University. Outpatient Use of Ivermectin in Covid-19; 2020. Available at: clinicaltrials.gov/ct2/ show/NCT04530474. Accessed January 2021.
82. Pott Junior H, Bastos Paoliello MM, Miguel AQC, et al. Use of ivermectin in the treatment of Covid-19: a pilot trial. Toxicol Rep. 2021;8:505–510.
83. Kamal E. Ivermectin in Treatment of Covid 19 Patients; 2020. Available at: clinicaltrials.gov/ct2/ show/NCT04425707. Accessed January 2021.
84. Saibannavar A. An Open Label, Prospective Comparative Study to Evaluate the Proposed Therapy in Adults with Mild Symptomatic Covid-19 Patients Receiving the Standard Treatment of Covid Infection; 2020. Available at: http:// www.ctri.nic.in/Clinicaltrials/pmaindet2.php? trialid546392. Accessed January 2021.
85. López-Medina E, López P, Hurtado IC. Effect of iver-mectin on time to resolution of symptoms among adults with mild COVID-19: a randomized clinical trial. J Am Med Assoc. 2021;325:1426–1435.
86. García Funegra P. Randomized Phase IIA Clinical Trial to Evaluate the Efficacy of Ivermectin to Obtain Negative PCR Results in Patients with Early Phase Covid-19 (SAINT-PE-RU); 2020. Available at: clinicaltrials.gov/ct2/ show/NCT04635943. Accessed January 2021.
87. Okasha K. Ivermectin and Nitazoxanide Combination Therapy for Covid-19; 2020. Available at: clinicaltrials.gov/ ct2/show/NCT04360356. Accessed January 2021.
88. Okasha K. Ivermectin Nasal Spray for Covid19 Patients; 2020. Available at: clinicaltrials.gov/ct2/ show/NCT04510233. Accessed January 2021.
89. Rathi S. Study to Efficacy of Ivermectin in Patients of Covid-19; 2020. Available at: www.ctri.nic.in/ Clinicaltrials/pmaindet2.php?trialid543728. Accessed January 2021.
90. Pathak R. Effectiveness of Ivermectin in Preventing Devel-opment of Symptomatic Covid-19 Among Primary Contacts of Newly Diagnosed Covid-19 Positive Patients at a Tertiary Care Hospital in North India—an Interventional Study; 2020. Available at: www.ctri.nic.in/ Clinicaltrials/pmaindet2.php?trialid546676. Accessed January 2021.
91. Prakash A. A Clinical Trial to Study the Effects of Hydrox-ychloroquine, Ciclesonide and Ivermectin in Treatment of Moderate Covid-19 Illness. 2020. Available at: http:// www.ctri.nic.in/Clinicaltrials/pmaindet2.php? trialid543364. Accessed January 2021.
92. Ochoa-Jaramillo F. Ivermectin in Adults with Severe Cov-id-19; 2020. Available at: clinicaltrials.gov/ct2/ show/NCT04602507. Accessed January 2021.
93. Saxena R. Assessment of Response of Ivermectin on Viro-logical Clearance in Covid 19 Patients; 2020. Available at: www.ctri.nic.in/Clinicaltrials/pmaindet2.php? trialid546873. Accessed January 2021.
94. Hidalgo C. Pragmatic Study “CORIVER”: Ivermectin as Antiviral Treatment for Patients Infected by SARS-COV2 (Covid-19); 2020. Available at: www. clinicaltrialsregister.eu/ctr-search/trial/2020-001971-33/. Accessed January 2021.
95. Shahbazi F. Evaluation Effects of the Standard Regimen along with Ivermectin on Treatment of Corona Virus Type 2 Pneumonia; 2020. Available at: www.irct.ir/ trial/49280. Accessed January 2021.
96. Stein M. A Randomized Double-Blind Placebo-Controlled Trial of Oral Ivermectin for Outpatient Treatment of Those at High Risk for Hospitalization Due to Covid-19; 2020. Available at: anzctr.org.au/Trial/ Registration/TrialReview.aspx? id5380506&isReview5true. Accessed January 2021.
97. Suputtamongkol Y. Ivermectin vs Combined Hydroxy-chloroquine and Antiretroviral Drugs (ART) Among Asymptomatic Covid-19 Infection (IDRA-Covid19); 2020. Available at: clinicaltrials.gov/ct2/show/ NCT04435587. Accessed January 2021.
98. Fundació Assistencial Mútua Terrassa. Randomised Clin-ical Trial of Ivermectin for Treatment and Prophylaxis of Covid-19; 2020. Available at: www. clinicaltrialsregister.eu/ctr-search/search? query5eudract_number:2020-001994-66. Accessed Jan-uary 2021.
99. Ghandali M. Evaluating the Efficacy and Safety of Ivermec-tin in the Treatment of Covid-19 Patients: A Double-Blind Randomized Controlled Trial, Phase II; 2020. Available at: en.irct.ir/trial/49935. Accessed January 2021.
100. Yamaoka K. Placebo-controlled Randomized, Double-Blind (Evaluator, Patient) Multicenter, Parallel-Group Compara-tive Study Investigating the Efficacy and Safety of Ivermec-tin in Patients with Covid-19; 2020. Available at: https:// jrct.niph.go.jp/en-latest-detail/jRCT2031200120. Ac-cessed January 2021.
101. Zendehdel A. Evaluation of the Effect of Oral Ivermectin on the Outcome of Patients with Covid-19 and Compare it with the Effect of Conucntional Therapics in Patients Admitted to Ziaeian, Baharloo, Imam Khomeini in the Spring and Sum-mer 2020; 2020. Available at: en.irct.ir/trial/ 50305. Acessed January 2021.
102. Instituto de Cardiología de Corrientes. Ivermectin to Pre-vent Hospitalizations in Covid-19 (IVERCORcovid19); 2020. Available at: clinicaltrials.gov/ct2/ show/NCT04529525. Accessed January 2021.
103. Asghar A. Efficacy of Ivermectin in COVID-19; 2020. Available at: clinicaltrials.gov/ct2/show/ NCT04392713. Accessed January 2021.
104. National University Hospital Singapore. A Preventive Treatment for Migrant Workers at High-Risk of Covid-19; 2020. Available at: clinicaltrials.gov/ct2/ show/NCT04446104. Accessed January 2021.
105. Babalola OE, Bode CO, Ajayi AA, et al. Ivermectin shows clinical benefits in mild to moderate COV-ID19: a randomised controlled double blind dose response study in Lagos. Int J Med. 2021. doi: 10. 1093/qjmed/hcab035.
106. Krolewiecki A, Lifschitz A, Moragas M, et al. Antiviral effect of high-dose ivermectin in adults with COVID-19: a pilot randomised, controlled, open label, multicentre trial. SSRN. 2020. doi: 10.2139/ssrn.3714649.Preprint.
107. Mahmud R. Clinical Trial of Ivermectin Plus Doxycycline for the Treatment of Confirmed Covid-19 Infection; 2020. Available at: clinicaltrials.gov/ct2/show/ NCT04523831. Accessed January 2021).
108. Niaee MS, Gheibi N, Namdar P, et al. Ivermectin as an adjunct treatment for hospitalized adult COVID-19 patients: a randomized multi-center clinical trial. Res Square. 2020. doi: 10.21203/rs.3.rs-109670/v1. Preprint.
109. Ravikirti, Roy R, Pattadar C, et al. Ivermectin as a potential treatment for mild to moderate COVID-19 – a double blind randomized placebo-controlled trial. medRxiv. 2021. doi: 10.1101/2021.01.05.21249310. Preprint.
110. Mohan A, Tiwari P, Suri T, et al. Ivermectin in mild and moderate COVID-19 (RIVET-COV): a randomized, placebo-controlled trial. Res Square. 2021. doi: 10. 21203/rs.3.rs-191648/v1.Preprint.
111. Rezai M. Effectiveness of Ivermectin in the Treatment of Coronavirus Infection in Patients Admitted to Educational Hospitals of Mazandaran in 2020. 2020. Available at: en.irct.ir/trial/49174. Accessed January 2021.
112. Chachar AZK, Khan KA, Asif M, et al. Effectiveness of ivermectin in SARS-CoV-2/COVID-19 patients. Int J Sci. 2020;9:31–35.
113. Raad H. In Vivo Use of Ivermectin (IVR) for Treatment for Corona Virus Infected Patients (Covid-19): A Randomized Controlled Trial; 2021. Available at: www.chictr. org.cn/showproj.aspx?proj554707. Accessed January 2021.
114. Schwartz E. Ivermectin vs. Placebo for the Treatment of Patients with Mild to Moderate Covid-19; 2020. Available at: clinicaltrials.gov/ct2/show/NCT04429711. Accessed January 2021.
115. Okumus N, Demirtürk N, Çetinkaya RA, et al. Evalua-tion of the Effectiveness and Safety of Adding Ivermectin to Treatment in Severe COVID-19 Patients. Research Square; 2021. doi: 10.21203/rs.3.rs-224203/v1.Preprint.
116. Guzzo C, Furtek C, Porras AC, et al. Safety, tolerability, and pharmacokinetics of escalating high doses of iver-mectin in healthy adult subjects. J Clin Pharmacol. 2002; 42:1122–1133.
117. World Health Organization. Developing Global Norms for Sharing Data and Results during Public Health Emergen-cies; 2015. Available at: www.who.int/ medicines/ebola-treatment/blueprint_phe_data-share-results/en/. Accessed January 2021.
118. Yagisawa M, Foster PJ, Hanaki H, et al. Global trends in clinical studies of ivermectin in COVID-19. Jpn J Anti-biot. 2021;74:44–95.
119. Castañeda-Sabogal A, Chambergo-Michilot D, Toro-Huamanchumo CJ, et al. Outcomes of Ivermectin in the treatment of covid-19: a systematic review and meta-analysis. medRxiv. 2021. doi: 10.1101/2021.01.26. 21250420. Preprint.
120. Nardelli P, Zangrillo A, Sanchini G, et al. Crying wolf in time of Corona: the strange case of ivermectin and hy-droxychloroquine. Is the fear of failure withholding
potential life-saving treatment from clinical use? Signa Vitae. 2021;17:3–4.
121. Shea BJ, Reeves BC, Wells G, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include rand-omised or non-randomised studies of healthcare inter-ventions, or both. BMJ. 2017;358:j4008.
122. Alam MT, Murshed R, Gomes PF, et al. Ivermectin as pre-exposure prophylaxis for COVID-19 among health-care providers in a selected tertiary hospital in dhaka – an observational study. Eur J Med Health Sci. 2020;2. doi: 10.24018/ejmed.2020.2.6.599.
123. Carvallo H, Hirsch R, Alkis P, et al. Study of the efficacy and safety of topical ivermectin + iona-Carrageenan in the prophylaxis against COVID-19 in health personnel. J Biomed Res Clin Invest. 2020;2:1007.
124. Behera P, Patro BK, Padhy BM, et al. Prophylactic role of ivermectin in SARS-CoV-2 infection among health-care workers. Res Square. 2021. doi: 10.21203/rs.3.rs-208785/v1.Preprint.
125. Fesler ML, Stricker RB. Pre-exposure prophylaxis for covid-19 in pregnant women. Int J Gen Med. 2021;14: 279–284.
126. Stricker RB, Fesler ML. Flattening the risk: pre-exposure prophylaxis for COVID-19. Infect Drug Resist. 2020;13: 3689–3694.
127. Chesler DL. Letter to Dr Bray at the National Institutes of Health. 2021. Available at: tinyurl.com/ dnemehxn. Accessed March 16, 2021.
128. Chamie J. Real-world evidence: the case of Peru. In: Causality between Ivermectin and COVID-19 Infection Fatality Rate. ResearchGate; 2020. Available at: www.researchgate.net/publication/ 344469305. Accessed March 8, 2021.
129. Chamie-Quintero J, Hibberd J, Scheim DE. Sharp reduc-tions in COVID-19 case fatalities and excess deaths in Peru in close time conjunction, state-by-state, with iver-mectin treatments. SSRN. 2021. doi: 10.2139/ssrn. 3765018.Preprint.
130. GRADE-DECIDE. The DECIDE Project. 2016. Available at: www.decide-collaboration.eu/. Accessed Jan-uary 2021.
131. Roguski J. Ivermectin; 2020. Available at: www. thecompleteguidetohealth.com/Ivermectin.html#. Ac-cessed January 2021.
132. Ministerio de Salud y Deportes. Ministry of Health Autho-rizes the Use of Ivermectin against COVID-19 under Protocol; 2020. Available at: www.minsalud.gob.bo/4157-ministerio-de-salud-autoriza-uso-de-ivermectina-contra-el-covid-19-bajo-protocolo. Accessed January 2021.
133. Despacho de Comunicaciones y Estrategia Presidencial. Coronavirus COVID-19 in Honduras; 2021. Available at: covid19honduras.org/. Accessed January 2021.
134. TrialSiteNews. Slovakia Becomes the First EU Nation to Formally Approve Ivermectin for Both Prophylaxis and Treatment for COVID-19 Patients. 2021. Available at: trialsitenews.com/slovakia-becomes-the-first-eu-nation-to-formally-approve-ivermectin-for-both-prophylaxis-and-treatment-for-covid-19-patients/. Ac-cessed February 2021.
135. Bukhari KHS, Asghar A, Perveen N, et al. Efficacy of Ivermectin in COVID-19 Patients with Mild to Moder-ate Disease. medRxiv. 2021. doi: 10.1101/2021.02.02. 21250840.Preprint.
136. Chowdhury ATMM, Shahbaz M, Karim R, et al. A ran-domized trial of ivermectin-doxycycline and hydroxychloroquine-azithromycin therapy on COV-ID19 patients. Res Square. 2020. doi: 10.21203/rs.3.rs-38896/v1.Preprint.
137. Gonzalez JLB, González Gámez M, Enciso EAM, et al. Efficacy and safety of Ivermectin and Hydroxychloro-quine in patients with severe COVID-19. A randomized controlled trial. medRxiv. 2021. doi: 10.1101/2021.02.18. 21252037.Preprint.
138. Hashim HA, Maulood MF, Rasheed AM, et al. Con-trolled randomized clinical trial on using Ivermectin with Doxycycline for treating covid-19 patients in Bagh-dad, Iraq. medRxiv. 2020. doi: 10.1101/2020.10.26. 20219345.Preprint.
139. Petkov S. Multicenter, Randomized, Double-Blind, Placebo-Controlled Study Investigating Efficacy, Safety and Tolera-bility of Ivermectin HUVE-19 in Patients with Proven SARS-CoV-2 Infection (Covid-19) and Manifested Clinical Symptoms. 2021. Available at: www. clinicaltrialsregister.eu/ctr-search/trial/2020-002091-12/BG. Accessed January 2021.
140. Podder CS, Chowdhury N, Mohim IS, et al. Outcome of ivermectin treated mild to moderate covid-19 cases: a single-centre, open-label, randomised controlled study. IMC J Med Sci. 2020;14:2.
141. Schwartz E. Viral load and culture viability in mild COVID-19 patients treated with Ivermectin. New Eng-land J Med. 2021.Submitted.
142. Chahla RE, Ruiz LM, Ortega ES, et al. A randomized trial: intensive treatment based in Ivermectin and iota-Carageenan as pre-exposure prophylaxis for COVID-19 in healthcare agents. medRxiv. 2021. doi: 10.1101/2021. 03.26.21254398.Preprint.
143. Shouman W, Hegazy AA, Nafae RM, et al. Use of iver-mectin as a potential chemoprophylaxis for COVID-19 in Egypt: a randomized clinical trial. J Clin Diagn Res. 2021;15:OC27–OC32.
144. Campbell M, McKenzie JE, Sowden A, et al. Synthesis without meta-analysis (SWiM) in systematic reviews: reporting guideline. BMJ. 2020;16:l6890.