Contents
Intestinal Barrier Function in Health and Disease—Any Role of SARS-CoV-2?
www.mdpi.com/2076-2607/8/11/1744/htm
要旨
腸管バリアの構造と機能の変化は、多数の疾患の発症に役割を果たしている。
最近の継続中のコロナウイルス病(COVID-19)パンデミックでは、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)ウイルスによって消化管系および腸管バリアが影響を受けている可能性があることが明らかになっており、バリア機能の障害または腸内微生物異常が、この新しい病気の進行および重症度に影響を与えている可能性がある。
本レビューでは、COVID-19を含むヒト疾患における腸管の変化の関与に関する現在のエビデンスを概観し、腸管バリア機能を回復させ、これらの患者の臨床改善を促進する可能性のある支持療法戦略について前向きに検討することを目的としている。
キーワード
消化管;COVID-19;SARS-CoV-2;マイクロバイオータ;腸管バリア;腸管透過性;腸肝軸;免疫;FMT;プロバイオティクス
1. 序論
SARS-CoV-2 への感染は、世界保健機関(WHO)によってパンデミックと分類されている COVID-19 の原因となっている。SARS-CoV-2は主に呼吸器系に影響を与えることが示されているが、SARS-CoV-2は腸との相互作用も可能である。しかし、これらの相互作用と疾患の発症や重症度との関連性はまだ明らかにされていない。
腸管バリアは腸の恒常性を維持するために不可欠であり、損傷を受けると病理学的な発症につながる。腸管バリアの損傷と様々な疾患状態との間には関連性があることが知られている。その結果、損傷した腸管バリアを回復させることを目的とした治療法が提案されている。
2. 解剖学と生理学
腸は異なる解剖学的な層に組織されており、それぞれの層は病原体や他の有害な刺激などの異物に対するバリアとして機能するために重要な役割を果たしている。
2.1. 粘液とマイクロバイオーム
粘液は、腸管上皮に存在する杯細胞によって産生される高度に糖化されたムチン蛋白質の比較的厚い層で構成されている。粘液層の厚さは小腸と大腸の間で増加しており[1]、これが腸管に沿った保護機能の鍵を握っている。この粘液層は、物理的なバリアとして機能することで、細菌や食物粒子などの大きな分子による損傷から上皮細胞を保護している[2]。また、粘液層には免疫グロブリンA(IgA)や自己共生細菌も含まれており、これらはいずれも病原性細菌の過剰増殖を防ぐのに有益である。
特に、常在菌は腸管バリアの維持に重要な役割を果たしていると考えられている。これは、病原性生物と競合し、その結果、病原性生物による腸内の植民地化を制限する能力によるものである[3]。また、常在菌の発酵の製品はまた、腸のバリアを維持するために関与している。そのような酪酸などの短鎖脂肪酸(SCFAs)は、多くの方法で腸のバリア機能をサポートすることができる[4]。提案されているメカニズムの1つは、酪酸がタイトジャンクション[5]を調節し、上皮透過性の低下につながることである。
粘液層の下には、高度に糖化されたタンパク質の第二層であるグリコカリックスが上皮細胞の表面に並んでいる。粘液層と同様に、これらの細胞膜結合型糖タンパク質は、病原性微生物が腸上皮細胞単層と相互作用するのを防ぐ物理的バリアを提供する [6]。
2.2. 上皮とタイトジャンクション
粘膜上皮層で最も一般的な細胞型は腸細胞(または腸管上皮細胞、IEC)であり、この単層の細胞の90%を形成している[7]。腸細胞は吸収部位であるが、腸管バリアの重要な構成要素としても機能する。
図1 主要な腸管バリア層の説明
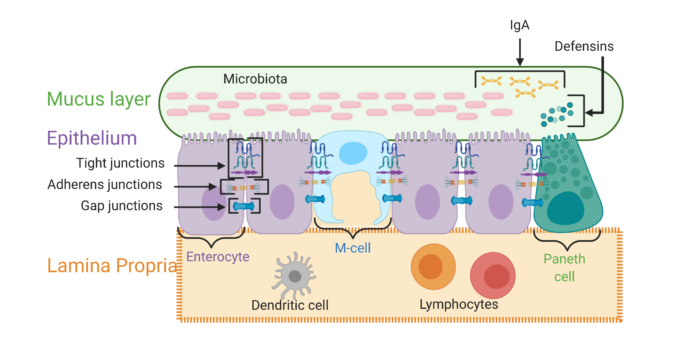
図1。この図は、腸管バリアの主要な層の概要を示している。粘液層はムチン蛋白質で構成されているが、この層にはIgA抗体、ディフェンシン、および腸内微生物の割合も含まれている。
上皮層には、腸細胞、マイクロフォールド細胞(M細胞)パネス細胞など、多くの特殊な細胞が含まれている。この層の細胞は、膜貫通型のタンパク質複合体によって連結されている。
前伸膜は、免疫細胞、血管、リンパ管を含む結合組織層である。BioRender.comで作成した図(2020年8月アクセス)。
タイトジャンクション(TJ)や接着結合(AJ)などの膜貫通型タンパク質複合体は、腸管上皮の単層構造を維持することを可能にしている。タイトジャンクションは、細胞間ジャンクションの中で最も先端に位置するタイプであり、非常に動的であり、腸内の細胞間輸送を決定する。
タイトジャンクションと接着結合の両方は、細胞間の実際の接触を媒介する膜貫通型の「接着性」タンパク質と、細胞内環境と細胞骨格に接合体を固定する細胞質性の「近位」タンパク質から構成されている[8,9,10]。タイトジャンクションsでは、主な接着性タンパク質はオクルーディンとクラウディンであり、主な近位タンパク質は「zonula occludens」タンパク質(ZO-1,ZO-2,ZO-3)[8,9,10,11]である。接着結合では、主な接着性タンパク質は上皮(E)カドヘリンなどのカドヘリンであり、主な近位タンパク質はカテニン(α、β、δ)である[8,9,10]。
タイトジャンクションは、細胞間の接触を媒介する主要な複合体として、大きく制御されている。例えば、ゾヌリンは、確立されたタイトジャンクションモジュレーターである。ゾヌリン濃度の上昇は、「zonula occludens」タンパク質の解離を引き起こし[12]、したがって、タイトジャンクション複合体を混乱させると考えられている。この変化は、傍細胞透過性の増加につながると考えられている。腫瘍壊死因子(TNF)やインターロイキン-13(IL-13)などの炎症性サイトカインを含む、他の様々なタイトジャンクション調節因子も同定されている[13]。これらのサイトカインはミオシン軽鎖キナーゼ(MLCK)に作用してタイトジャンクションの機能を制御できると考えられている。他のメカニズムも示唆されているが、MLCKの活性化がタイトジャンクション調節、特に急性期における一般的な最終経路であることが広く提案されている[14]。
2.3. 粘膜関連免疫システム
上皮細胞と腸内に存在する様々な免疫細胞の両方が、移動した病原体や代謝物からの局所的な保護を提供する。
専門化された上皮細胞は、上皮層の保護に顕著な貢献をしている。上皮細胞の一種であるパネス細胞は、ディフェンシンおよびその他の抗菌ペプチドを産生する。ディフェンシンは粘液層に存在し、病原体から腸を守る働きをしている。パニーズ細胞は、上皮層の他の細胞とともに、腸管バリアの重要な部分を形成していると考えられている[15]。
パイエルのパッチは腸関連リンパ組織(GALT)の一部を形成し、マイクロフォールド細胞(M細胞)を含む。M細胞は抗原サンプリングに重要な細胞の一つである[16]が、最終的にTおよびBリンパ球の活性化につながる経路を開始することができる。活性化されると、前葉扁桃腺の血漿細胞はIgAsを分泌することができ、このIgAsは腸管腔[17]に積極的に輸送され、粘液層に存在することができる。
腸管免疫系の構成要素は、パイエルパッチのような集中した別個の構造物に見られるが、他のタイプの常駐免疫細胞もまた、前頭葉に沿って散在して見られる。これらの細胞には、例えば、粘膜関連不変性T細胞(MAIT)が含まれ、これらの細胞は直接抗菌性であり、バイスタンダー免疫調節にも関与することができる[18,19,20,21]。調節性T細胞(Tregs)は、無差別免疫および炎症性活性化の制限に関与し、病原体および食物抗原に対する免疫寛容性の維持に役割を果たしている[20,22,23];および自然免疫リンパ球(ILC)は、T細胞の影に独自の自然類似の機能を持ち、局所的な腸管免疫の形成に積極的に協力している[20,24,25,26,27]。
3. 病理のメカニズム
病理は、腸管バリア層のいずれかで生じ得る。これらの層の変化は、腸管透過性の増加を引き起こす可能性がある。図2は、腸管バリアの変化の原因となるメカニズムを要約し、治療戦略がバリア機能障害を改善する可能性がある領域を示している。
図2
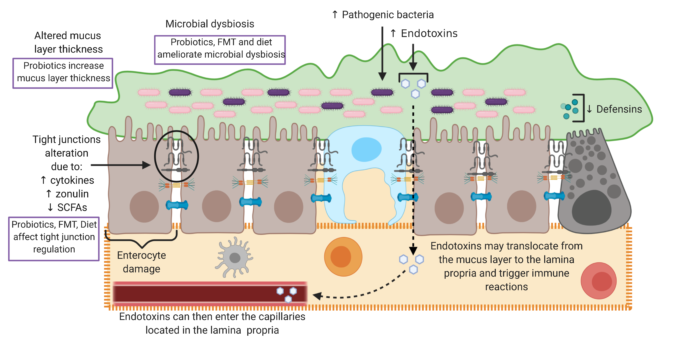
この図は、病理学が腸管バリアの異なる層でどのように発生するかを示しており、治療戦略の例は、これらの病理学的変化を改善することができる方法を強調している。病理では、粘液層の厚さの変化があり得る。プロバイオティクスは粘液層の厚さを増加させることが示されている。微生物異常症は疾患で起こりうるものであり、プロバイオティクス、糞便性微生物移植(FMT)および食事療法はこの異常症を是正することができると考えられている。
疾患ではタイトジャンクションの変化も起こる可能性があり、サイトカインの増加、ゾヌリンの増加、短鎖脂肪酸(SCFAs)の減少と関連している。プロバイオティクス、FMTおよび食事療法は、SCFAの濃度を増加させることで、これらの変化を逆転させる可能性がある。図では、小さな矢印は増加または減少を示し、点線の矢印は、それが腸管バリアを横切って移動する際の細菌の動きを示している。図はBioRender.comで作成したもの(2020年8月にアクセス)。
3.1. 粘液とマイクロバイオーム
杯細胞によるムチン分泌の変化は、腸管粘液層の異常につながる可能性がある。特定の病原体は、ムチン分泌を混乱させ、粘液層の一貫性に影響を与えることができる[28]。例えば、特定の細菌およびウイルスは、ムチン分解酵素の分泌につながる可能性がある[29]。これは、バリアとしての粘液の機能性を制限することができ、その結果、腸管透過性の増加に対する感受性を増加させる。
さらに、ムチンの疎水性の低下は、バリア機能障害のマーカーとなりうる[30]。この粘液層の変化は腸虚血と関連していることが示唆されている[31]。このことは、粘液層の変化が腸管バリアの透過性に影響を与えうることを改めて示唆している。
腸管バリアの不可欠な側面としてコメンサル細菌がますます考慮されるようになってきており[7]、粘液層とマイクロバイオームは密接に関連している。したがって、一方の変化は他方の病理学につながる可能性がある[32]。例えば、マイクロバイオームの構成の変化(dysbiosis)は、酪酸などのSCFAsの産生を変化させることができる。これは、障害されたタイトジャンクション調節をもたらし、従って腸管透過性の増加につながる可能性がある[4]。例えば、腸内微生物異常症のよく知られた原因である慢性的なアルコール消費は、血清エンドトキシンや細菌の転座の他のサロゲートマーカー[18,33,34]の上昇と相関していることが示されており、アルコール消費後の微生物異常症と透過性の増加との間のリンクを実証している。さらに、アルコール消費は、粘液層の厚さの減少を引き起こすことにより、粘液層自体にも影響を与える[35]。
3.2. 上皮とタイトジャンクション
粘膜上皮細胞は腸管バリアの不可欠な部分を形成しており、これらの細胞の間に存在するタイトジャンクションと同様に、腸管バリアの病理学的な影響を主に受けている。機能的なタイトジャンクションは、傍細胞および細胞間透過性の効果的なレベルを維持するために必要である[14]。したがって、タイトジャンクションの調節に影響を与えることができるいくつかの病態生理学的メカニズムが、腸管透過性の上昇を引き起こすと考えられている[36]。タイトジャンクションや上皮細胞層に影響を与えて透過性の上昇を引き起こすメカニズムを採用していると考えられる要因の例としては、病原性生物、アルコール、非ステロイド性抗炎症薬(NSAIDs)などが挙げられる。
3.2.1. 病原性生物
病原性細菌はタイトジャンクションを妨害し、腸管透過性の亢進を引き起こす可能性がある。前述したように、腸管の生理不順は、SCFA/酪酸代謝の変化およびタイトジャンクションの調節障害につながる可能性がある。これに加えて、病原体は、提案されている様々なメカニズム[37]を介して、上皮性タイトジャンクションと直接相互作用し、腸管バリア機能障害を引き起こすことができる。例えば、ビブリオ・コレラエによる’zonula occludens’毒素の分泌は、タイトジャンクションオクルーディンの変化とそれに続く上皮透過性の増加と関連している[38]。
さらに、上皮細胞は、病原性細菌種による感染後にアポトーシスを受けることがある。これが起こるメカニズムは、細菌感染に応答してTNFが増加することと関連していると考えられている[39]。この上皮損傷は細胞透過性の増加をもたらすであろうが、実際に、脂肪酸結合タンパク質2(FABP2)[40,41,42]またはクラウディン-3[42,43,44]のような上皮細胞および接合部マーカーの全身循環への転座が、腸管損傷時に増加することが実証されている。
前述のように、細菌(病原性または常在菌)およびその代謝物は、腸管透過性が上昇している時期に全身循環に入ることがある[45]。生理的ストレス状態の上昇と血清エンドトキシンレベルの上昇との間に関連があることが示されている[46]。しかしながら、細菌とエンドトキシンの転座が起こる正確な分子メカニズムはまだ不明であり、一部では論争の的になっていることに注意することが重要である[47,48]。
病原性細菌と同様に、ウイルスもまた、腸管上皮を破壊する役割を果たしている可能性がある。例えば、コロナウイルスの中でも、中東呼吸器症候群関連コロナウイルス(MERS-CoV)は、動物モデルにおいて腸管上皮細胞の機能を破壊することが示されており[49]、これは腸細胞損傷による腸管透過性の増加のリスクを増加させる可能性がある。さらに、SARSコロナウイルス(SARS-CoV)は、腸および肺上皮に見られるタイトジャンクションタンパク質であるPALS1に影響を与えることが示されている[50]。最近では、SARS-CoV-2が腸細胞および上皮層にダメージを与えることで、腸管透過性を高める可能性があることが提案されている[51]。このことはコロナウイルスがタイトジャンクションに影響を与える可能性を示唆しているが、決定的な証拠はまだ限られており、さらなる分子研究を行う必要がある。
3.2.2. アルコール
アルコール摂取と上皮損傷の増加との間には相関関係があることが確認されている[52]。アセトアルデヒドなどのアルコール代謝物は、活性酸素種を介して上皮細胞に直接ダメージを与える効果を持つことができるが[52]、タイトジャンクションタンパク質の発現を変化させることもある[53]。アルコールによって生じる腸管障害は、細胞間透過性の亢進をもたらす可能性がある。
3.2.3. NSAIDs
NSAIDsが上皮層の損傷を引き起こすメカニズムはまだ完全には確立されていないが、病原性細菌やアルコールと同様に、多面的なものである可能性が高い。研究では、NSAIDsが腸管上皮細胞におけるオートファジーを阻害する可能性が示唆されている[54]が、これは細胞小器官のリサイクルを阻害し、最終的に腸症を引き起こすことになるだろう。
さらに、NSAIDsが腸管上皮細胞に与える影響は、NSAIDsが介在する透過性の増加を導くもう一つの可能性のあるメカニズムとして研究されているが[55]、具体的な作用の分子メカニズムは決定的には確認されていない。
3.3. 免疫活性化と変化
様々な外部刺激および内部刺激は、粘膜免疫系と相互作用し、腸管透過性の増加を引き起こす可能性があり、逆に、腸管透過性の変化および細菌の転座の増加は、粘膜および全身の免疫機能障害を引き起こす可能性がある。
粘膜免疫系に影響を及ぼす可能性のあるよく知られた物質は、アルコールである。他のメカニズムに加えて、アルコールは、パネス細胞によるディフェンシンの産生を抑制することにより、腸管透過性を増加させると考えられている[52]。これは、病原性細菌と闘うための腸管バリアの能力を低下させ、過剰なエンドトキシンの産生を促進する。これらのエンドトキシンは、その後、免疫反応を引き起こす可能性のある前葉扁桃腺に移動して侵入する可能性がある。この反応の一部として、炎症性サイトカインが循環に放出され、全身的な効果を発揮することがある [56,57]。実際、アルコール関連の肝硬変およびアルコール性肝炎では、腸管透過性の亢進と関連していることが知られており、細菌転座のマーカーおよびプロ炎症性サイトカインが全身循環で増加する[18,34,58]。これは急性の分解性肝硬変でも見られ、これらのマーカーは全身的にも腸管内腔の局所的にも上昇しているようであり、局所的な腸管の変化と全身的な免疫の不均衡との関連性を強化している[57]。さらに、アルコール関連肝疾患の間、損傷した腸管バリアを横切る細菌の転座は、(i)抑制性免疫チェックポイント受容体(PD-1およびTIM3)のアップレギュレーションおよび循環T細胞からの抗炎症性IL-10の分泌を促進することにより、全身免疫に強く影響を与えうることが以前に実証されている[34];(ii)抗菌性IFN-gのT細胞産生を抑制することにより[34];および(iii)好中球およびMAIT細胞における抗菌機能を直接阻害することにより[18,34]。
アルコールや細菌以外にも、ウイルスは腸内の局所的な免疫変化にも関与している。例えば、ヒト免疫不全ウイルス(HIV)への感染は、腸管バリアの損傷と関連している[59,60]。この理由として考えられるのは、HIVに感染した患者のGALTにおけるTh17細胞の枯渇により、損傷した腸管バリアを効果的に修復することができない可能性があるということである[61]。
4. 疾患との関連
腸管バリアの乱れと腸管透過性の亢進は、さまざまな疾患と関連している。腸管透過性の変化と疾患のメカニズムは多岐にわたっている。しかし、腸管透過性の亢進と疾患との因果関係を決定的に立証することは困難であることに留意すべきである[2]。
4.1. 腸の病気
潰瘍性大腸炎(UC)では、粘液層の変化が大腸の透過性を高める役割を果たしていると考えられている。ゴブレット細胞はムチンの産生に関与しているため、ゴブレット細胞の変化がムチン発現の変化に寄与していると考えられ、UCおよびクローン病患者ではゴブレット細胞の割合が有意に減少していることが示されている[62]。活動的なUCを持つ患者は、複合糖鎖の減少とより小さな糖鎖の増加を含む、ムチンの一種であるMUC2に質的な変化があることが発見されている[63]。また、UCとクローン病患者の両方において、ムチン産生量の変化が示唆されている[64]。粘液層におけるこれらの変化の結果として、ディフェンシンが粘液に効果的に固定されないことが提案されている[65]。
さらに、パネス細胞の機能の低下はクローン病の発症にも関連している[66]。パネス細胞はディフェンシンの産生に関与しているため、パネス細胞濃度の低下はその後のディフェンシン産生の低下につながる可能性がある。これは、病原体と戦うための装備が弱くなった腸管バリアの弱体化につながる可能性がある。
クローン病で起こるTNF-αなどの炎症性サイトカインの増加は、上皮細胞およびタイトジャンクションの完全性に影響を与える可能性がある。TNF-αの増加は、腸細胞アポトーシスを誘導し、不適切な細胞脱落につながると考えられている[67]が、これは細胞間透過性を増加させる可能性がある。In vitroでの研究では、TNF-αの増加はタイトジャンクションタンパク質、例えばクローン病におけるクラウディン-2などの調節の変化にも関連している可能性があることが示されている[68,69]。最終的に、クローン病が腸管透過性の増加と関連している正確なメカニズムは不明であるが、粘液層の変化、パネス細胞の枯渇、上皮障害およびタイトジャンクションの変化が疾患の発症に関与していると考えられている。
また、活動性セリアック病の患者では、タイトジャンクションタンパク質の発現にも変化があると考えられている。セリアック病患者のグルテン暴露後の腸管透過性の増加は、ヒトのex-vivo試験で実証されている[70]。この透過性の変化は、グルテンの成分であるグリアジン[71]への暴露後のゾヌリン放出の増加の結果であると考えられている。前述のように、ゾヌリンは確立されたタイトジャンクションモジュレーターであり[72]、活動性セリアック病患者におけるその増加したレベルは、傍細胞透過性の増加を促進する可能性がある。さらに、タイトジャンクション遺伝子、PARD3とMAGI2の変異とセリアック病との関連性も明らかにされている[73]。このことは、タイトジャンクション遺伝子の変異がセリアック病の病態に関与しているという考えをさらに支持している。
4.2. 腸肝軸と胆道疾患
腸管透過性の亢進は、腸-肝臓軸の障害の結果として、肝臓疾患との関連があると考えられている[74]。非アルコール性脂肪性肝疾患(NAFLD)の患者は、健康な対照群と比較して腸管透過性が有意に増加していることが示されており、これはタイトジャンクション近位蛋白質zonula occludens-1(ZO-1)の発現の変化と関連している[75]。腸管透過性のこの増加は、非アルコール性脂肪肝炎(NASH)を発症した患者ではさらに顕著であると考えられている[76]。実際、腸管透過性、細菌転座およびその後の免疫活性化の血清マーカーは、これらの患者において全身的に検出可能である[77,78,79,80,81,82,83]。さらに、肝硬変患者ではタイトジャンクションタンパク質の発現が変化していることが示されており、ある研究では特にオクルーディンとクラウディン-1の発現が有意に低下していることが示されている[84]。慢性肝疾患で見られるタイトジャンクションタンパク質発現の変化は、傍細胞性腸管透過性の増加につながる可能性がある。壊死性肝硬変では、安定した疾患と比較して、細菌の転座、上皮細胞の損傷および免疫活性化のマーカーが増加し、全身循環および腸管内腔の両方で検出可能である[57]。アルコール関連肝疾患(ALD)では、腸管透過性および細菌転座の増加は疾患進行の特徴であり[58]、我々および他の研究者は、ALD患者の複数のコホートにおいて、全身性腸管マーカーの増加を実証している[18,34]。
さらに、腸内細菌叢の異常な構成は、NAFLD、肝硬変、アルコール性肝疾患(ALD)の重要な特徴である[35,85]。エンドトキシンなどの二次胆汁酸および病原体関連分子パターン(PAMPs)の増加、およびSCFAsの減少は、この変化した細菌組成が腸管バリアの欠陥につながり、これらの肝疾患の病因に寄与すると考えられているメカニズムとして提案されている[86]。
腸管バリアの変化は、慢性胆汁性肝疾患、原発性胆管炎(PBC)および原発性硬化性胆管炎(PSC)に関しても議論されている [87,88]。PBCとの関連では、腸管透過性の上昇と有意な内毒素血症の存在が認められており[89]、ある研究ではPSC患者では腸管透過性の有意な上昇は認められなかったが[90]、PSCと腸疾患との間には明らかな関連がある[91]ので、この分野のさらなる研究を行うことは、PSCに対する腸管透過性の影響についての理解を深めるのに役立つかもしれない。
4.3. 代謝性疾患
肥満や糖尿病などの代謝状態は、腸管透過性の上昇と関連している[92,93,94,95]。減量療法は、肥満者の腸管透過性を正常レベルまで低下させることができることが判明しており[96]、肥満と腸管透過性との間に関連がある可能性が示唆されている。微生物異常症が肥満患者のタイトジャンクション発現に影響を与えることにより、腸管透過性の増加につながる可能性があると推測されている[97]。
同様に、2型糖尿病(2型糖尿病)と腸管透過性の増加との相関関係を示唆する証拠がある[98,99]。これに加えて、血糖コントロールが悪い2型糖尿病患者は、腸管バリアが損傷しているリスクが高いことが示唆されている[100]。肥満と同様に、微生物異常症もまた、SCFAsの減少の結果として、2型糖尿病における透過性の亢進の病態に影響を及ぼすと考えられている[37]。1型糖尿病(1型糖尿病)患者はまた、ゾヌリン濃度と微生物叢の変化に潜在的に関与する可能性がある不明瞭なメカニズムのために、腸管透過性の増加を経験すると考えられている[7]。
4.4. 腸-脳軸
脳と腸内マイクロバイオームの間には常に相互作用がある。腸管透過性を変化させる因子は、同様の方法で血液脳関門の透過性に影響を与えると考えられている[101]。例えば、Camara-Lemarroyはそのレビューの中で、腸内マイクロバイオームの変化が腸管透過性の増加とSCFA産生の減少をもたらし、それが血液脳関門の透過性に影響を与え、神経細胞の免疫関連機能障害を引き起こす可能性があることを強調している[102]。著者らは、腸管透過性と多発性硬化症との関連に特に関心を持っていた。彼らは、この分野のさらなる研究が、多発性硬化症の多面的な発症経路への洞察を得るのに役立つだろうと示唆した。腸管透過性と神経学的状態との関係についてのさらなる研究を求める声は、このトピックに関する現在利用可能な研究の欠点を強調したObrenovichによって反響された[103]。
4.5. 腸の機能障害
「リーキーガット症候群」という概念は広く議論されていた。「リーキーガット症候群」の一般的な前提である、腸管バリアが損傷するとエンドトキシンなどのPAMPsが循環に入るというのは正確であると思われるが、これが傍細胞透過性のルートを介して起こることはあり得ないことが示唆されている[48]。さらに、「リーキーガット症候群」の提唱者たちは、それを様々な疾患の原因として特定している。「リーキーガット症候群」に関連する疾患の多くは、機能障害であったり、食物不耐症、線維筋痛症、慢性疲労症候群、自閉症などの複雑で不明瞭な発症経路を有するものである[104]。「リーキーガット症候群」とこれらの疾患との間の因果関係を示唆するデータは限られていることに留意すべきである。さらに、「リーキーガット症候群」を解決することで、それが関連している病気を治すことができると主張されていた。腸管透過性の低下が疾患の進行に影響を及ぼすことを示す決定的な証拠は現在のところ限られている [105]。しかし、腸管透過性を低下させることを目的とした治療法はますます探求されており、特にこれらの治療法が病気の症状に及ぼす効果に注目が集まっている。
5. 治療法
腸管バリアの損傷と関連する疾患は多岐にわたることから、腸管バリア機能を回復させるための治療法の可能性を探る努力がなされていた。これらの治療法の多くは、腸管透過性の増加を抑えることを目的としている(図2)。
5.1. 糞便性微生物移植
糞便性微生物移植(FMT)は、ある個人から別の個人への糞便性細菌の移植を伴う治療法である。FMTと腸管バリア機能との関連性が検討されている。複数の動物実験により、FMTによる治療は腸管透過性の低下と相関があることが明らかにされている[106,107]。
FMTは現在、主にClostridioides difficile感染症や潰瘍性大腸炎などの他の疾患に関連した下痢症状の治療に使用されている。しかし、FMTは肝臓疾患にも使用されており、治療後の症状改善を示す結果が得られている[92]。非アルコール性脂肪性肝疾患(NAFLD)の患者を対象に実施された無作為化対照試験では、透過性レベルが上昇したNAFLD患者の腸管透過性をFMTで治療することで有意に減少させることができることが実証された[108]。これは、FMT治療が腸管透過性を有意に低下させることをヒトで実証した最初の研究の一つである。
FMTが腸管透過性を低下させるメカニズムは明らかにされていない。1つの可能性のあるメカニズムは、FMT治療後の短鎖脂肪酸(SCFAs)の増加、特に酪酸の増加に関連していると考えられ、DuttaらがClostridioides difficile感染症の再発患者で実証したように、タイトジャンクションタンパク質の発現を変化させることで腸管透過性を調節する。これは、タイトジャンクションタンパク質zonula occludens-1(ZO-1)に対するFMTの効果を評価した動物実験では、介入後にその発現が変化しなかったことを発見したと言われている[109]。したがって、FMTに関連した腸管透過性の低下と直接的なタイトジャンクション調節との関連を確認するためには、より多くの研究が必要である。また、FMTは免疫グロブリンの産生を誘導することで腸管免疫系に影響を与えることも示唆されている[110]。したがって、FMTが腸管透過性を低下させるメカニズムには、腸管免疫系も関与している可能性がある。
他の研究では、FMTと併用したプロバイオティクス治療を使用することで、微生物SCFAの産生へのより強い刷り込みを与えることで、腸管バリアにさらなる有益な効果をもたらす可能性があることが提案されている[111]。
5.2. プロバイオティクスとプレバイオティクス
世界保健機関(WHO)および国連食糧農業機関(FAO)の定義によると、プロバイオティクスは「適切な量を投与した場合、宿主に健康上の利益を与える生きた微生物」[112,113,114,115]である。腸管バリアに対するプロバイオティクス治療の影響は、これまで徹底的に調査されてきたが、一貫して確認されていない。多くの研究では、プロバイオティクスが腸管透過性を低下させることができることが示されているが[116,117,118]、他の研究では、プロバイオティクス治療後の透過性に有意な変化がないことが示されている[119,120,121,122]。しかしながら、我々の知る限りでは、プロバイオティクスによる治療後の腸管透過性の有意な増加を示した研究はないことが強調されるべきである。
プロバイオティクスが腸管バリアを強化し、それによって腸管透過性を有意に低下させることができるかどうかを決定的に確認し、この効果が潜在的に起こりうるメカニズムをさらに理解するためには、さらなる研究が必要である。様々な研究がこれを深く調査しようとしてきた。
まず、プロバイオティクスは粘液層を修飾することで腸管バリア機能を改善すると考えられている。プロバイオティクスのAkkermansia muciniphila(A. muciniphila)は、粘液層の厚みを増すことで透過性を低下させると考えられている[123]。
第二に、プロバイオティクスはタイトジャンクション調節に影響を与えると考えられている。ある研究では、プロバイオティクスを投与すると、タイトジャンクション調節因子であるゾヌリンの血清中濃度と腸管透過性が共に低下することが明らかになった[116]。さらに、共焦点レーザー走査顕微鏡は、プロバイオティクスが接合タンパク質であるオクルーディン、クラウディン-1,JAM-1の発現を安定化させることを示している[118]。さらに、マイクロアレイは、TIFN101のようなプロバイオティクスのラクトバチルス・プランタラム(L. plantarum)の特定の株が、タイトジャンクションの機能に関連する遺伝子の転写に関与する経路を調節できることを実証している[124]。
全体的に、様々な研究は、プロバイオティクス治療後のタイトジャンクション調節の変化を実証しており、したがって、プロバイオティクスが腸管バリアおよび腸管透過性の調節に直接的な影響を与えうることを示している。
プロバイオティクスとは異なり、プレバイオティクスは肝臓の生物ではないが、有益な細菌の成長をサポートすることによって、または有益な代謝物の生産を促進することによって、宿主(例えば、フルクタンス、ガラクタンス、イヌリンおよび繊維のいくつかのタイプ)に “健康上の利益を与える宿主微生物によって選択的に利用される “化合物または基質として定義されている[115,125]。腸管バリアに対するプレバイオティクスの効果を評価する様々な研究が行われていることに留意すべきである;しかしながら、その多くは治療後の腸管透過性の有意な変化を示すことができなかった[126,127]。
これに続いて、Krumbeckらによる研究では、プロバイオティクスとプレバイオティクスを併用した治療が腸管透過性に及ぼす効果を評価した。彼らは、両方の治療法が個別に高用量アスピリンを投与されている肥満患者の腸管透過性を減少させる効果を持っていたが、共生物質が使用された場合には有意な追加的な減少はなかったことを発見した[128]。
表1は、FMT、プロバイオティクス、プレバイオティクスの腸管バリアへの効果に関するランダム化対照試験の例を示している。
表1. 腸管バリアに対する非食事療法の効果を研究した最近の無作為化対照試験の例
| 参照 | 治療研究 | 研究した生物 | 関連する結果の結果 | 腸透過性への影響 |
|---|---|---|---|---|
| Craven L et al。、Am。J. Gastroenterol。、2020 [ 108 ] | FMT | 該当なし | 治療群におけるラクツロース-マンニトール比の有意な減少 | 減少 |
| Macnaughtan J et al。、Nutrients、2020 [ 119 ] | プロバイオティクス | ラクトバチルス・カゼイ代田 | 治療群と対照群の血清エンドトキシン濃度に有意差はありません | 無効 |
| Pugh JN et al。、Eur。J.Appl。生理。、2019 [ 121 ] | プロバイオティクス | Lactobacillus acidophilus、Bifidobacterium bifidum、Bifidobacterium animalis | 治療群と対照群のラクツロース-ラムノース比に有意差はありません | 無効 |
| Mokkala K et al。、Benef。微生物、2018 [ 122 ] | プロバイオティクス | ビフィズス菌、ラクトバチルスラムノサス | 治療群の血清ゾヌリン濃度に有意な変化はない | 無効 |
| Krumbeck JA et al。、Microbiome、2018 [ 128 ] | プロバイオティクス | ビフィズス菌 | 一部の治療群では、スクラロースとラクツロースの比率が大幅に低下しています。 | 減少 |
| Mujagic Z et al。、Sci。担当者2017 [ 124 ] | プロバイオティクス | ラクトバチルスプランタルム | 治療中のラクツロース-ラムノース比に有意な変化はありません | 無効 |
| De Roos NM et al。、Eur。J.Clin。Nutr。、2017 [ 120 ] | プロバイオティクス | 複数種のプロバイオティクス | 治療群におけるラクツロース-マンニトール比、糞便中ゾヌリン濃度または血清ゾヌリン濃度に有意な変化はない | 無効 |
| Liu ZH et al。、Am。J.Clin。Nutr。、2013 [ 116 ] | プロバイオティクス | Lactobacillus plantarum、Lactobacillus acidophilus、Bifidobacterium longum | 治療群における血清ゾヌリン濃度の有意な低下 | 減少 |
| Liu Z et al。、Aliment。Pharmacol。Ther。、2011 [ 118 ] | プロバイオティクス | Lactobacillus plantarum、Lactobacillus acidophilus、Bifidobacterium longum | 治療群におけるラクツロース-マンニトール比および細菌転座の有意な減少 | 減少 |
| ラモスCIら、ネフロール。ダイヤルします。移植。、2019 [ 126 ] | プレバイオティクス | 該当なし | 治療群と対照群の血清ゾヌリン濃度に有意差はない | 無効 |
| Ho J et al。、J.Clin。エンドクリノール。メタブ。、2019 [ 127 ] | プレバイオティクス | 該当なし | 治療群と対照群のラクツロース-マンニトール比に有意差はありません | 無効 |
| Krumbeck JA et al。、Microbiome、2018 [ 128 ] | プレバイオティクス | 該当なし | 一部の治療群では、スクラロースとラクツロースの比率が大幅に低下しています。 | 減少 |
5.3. 食事療法
腸管透過性に及ぼす食事と生活様式の因子が果たす役割を調べることに関心が集まっている。表2は、過去10年間に発表された腸管バリアに対する食事療法の効果に関する無作為化対照試験の例を示している。食事療法と腸管透過性との間に明確な因果関係は確立されていないが、食物繊維やペプチドが腸管バリアを強化する経路についての提案がなされている。
表2. 過去10年間に発表された、腸管バリアに対する食事療法の効果を研究したランダム化比較試験の例
| 参照 | 治療研究 | 関連する結果の結果 | 腸透過性への影響 |
|---|---|---|---|
| Wilms E et al。、Nutrients、2019 [ 129 ] | 食物繊維 | 治療群ではラクツロース-マンニトール比に有意な変化はありません | 無効 |
| Krawczyk M et al。、Nutrients、2018 [ 130 ] | 食物繊維 | 治療群における血清ゾヌリン濃度の有意な低下 | 減少 |
| Zhou QQ et al。、Gut、2019 [ 131 ] | グルタミン | 治療群におけるラクツロース-マンニトール比の有意な減少 | 減少 |
| Benjamin J et al。、Dig。Dis。Sci。、2012 [ 132 ] | グルタミン | 治療群ではラクツロース-マンニトール比の有意な低下が見られましたが、対照群でも有意な低下が見られました。 | 減少 |
| Lamprecht M et al。、J.Int。Soc。スポーツ栄養素。、2015 [ 133 ] | ゼオライトサプリメント | 治療群における便ゾヌリン濃度の有意な減少 | 減少 |
腸内マイクロバイオームは、食物繊維[134]に含まれる微生物アクセス可能な炭水化物の発酵を介してSCFAsの生産を増加させることができる。以前に議論したように、SCFAsの増加は、タイトジャンクションの調節と関連しているため、傍細胞の「漏出性」を低下させることにより、上皮バリア機能を高めるために働くことができる。実際には、腸管透過性に対する食物繊維の効果を評価した研究では、様々な結果が得られている[129,130]。
特定のペプチドおよびアミノ酸もまた、腸管透過性の変化と関連している。カゼインペプチドは、腸管透過性の低下につながると考えられているオクルーディン[135]の発現を増加させることにより、タイトジャンクションを調節できることが提案されている。さらに、グルタミンなどのアミノ酸は、いくつかの研究[131,132,136]で腸管透過性の低下につながることが明らかにされている。グルタミンはまた、IgA産生に影響を与え、潜在的には腸管関連リンパ組織に作用することで、粘膜免疫系の混乱を防ぐと考えられている[138]。前述の研究でグルタミンが腸管透過性を低下させうることが明らかになっているにもかかわらず、グルタミンを透過性亢進症の支持療法の選択肢として使用することを公式に推奨していないことに注意することが重要である。
栄養補助食品もまた、腸管バリア機能を改善することが示されており、いくつかは、過透水性の潜在的な治療法として提案されている。Lamprechtらは、ゼオライトサプリメントの腸管バリアへの影響を試験し、ゾヌリン濃度の対応する減少を発見した[133]。ゾヌリンはタイトジャンクションの主要な調節因子であるため、ゾヌリン濃度の低下は、傍細胞性腸管透過性の低下と関連している可能性が高い。腸管透過性の測定値に変化が見られたのは、亜鉛の補給でも見られ[139]、腸管バリア機能の改善を示唆しているが、この研究の妥当性とその結論は争われている[140]。
これまで、食事と腸管バリア機能との間に有意な因果関係を確立することは困難であった。この主な理由の1つは、食事療法を評価する研究が外来で行われることが多く、その場合、異なる対照変数を調整することが困難になることがあるということである。したがって、食事療法を補助的なものとして検討し、腸管透過性を高めるための一次治療として他の領域に焦点を当てる価値があるかもしれない。
6. SARS-CoV-2と腸
腸管透過性は何十年も前から文献[141]で探求されており、腸の病理学は非常に現在の問題である。実際、SARS-CoV-2は腸と相互作用することが示されている。SARS-CoV-2と腸との関係を考慮することは、腸管バリアに関連した治療がCOVID-19患者に与える影響を理解する上で有益である。図3は、SARS-CoV-2,腸の変化、および腸-肺軸の間の関連性を示しており、COVID-19患者にとって有益な治療介入の支持が得られる可能性のある領域を示している。
微生物 08 01744 g003 550図3。この図は、SARS-CoV-2に関連した腸の病理学と腸-肺軸の破壊に関連した病理学との間の関連性を明確に示している。腸管バリアの変化を修正するための支持的治療戦略は、COVID-19患者の腸-肺軸のリバランスに有益な効果をもたらす可能性がある。図はBioRender.comを使用して作成した。
6.1. 腸管細胞の感染
SARS-CoV-2が腸内器官に感染することが示されている [142]。ウイルスはアンジオテンシンI変換酵素2(ACE2)受容体を利用して細胞内に侵入し[143]、腸細胞ではACE2の発現が高い[144,145]ことから、SARS-CoV-2はこれを利用して腸内腸細胞に感染することが示唆されている。さらに、同じく回腸および大腸の腸細胞で高発現している膜貫通型セリンプロテアーゼ2(TMPRSS2)は、SARS-CoV-2のスパイクタンパク質をプライム化し、細胞内へのウイルスの侵入を促進することができると考えられている[145,146]。
ACE2およびTMPRSS2がSARS-CoV-2の細胞感染を可能にすると考えられているため、ACE2融合タンパク質やTMPRSS2阻害剤など、ACE2およびTMPRSS2タンパク質を標的とした治療法が注目されているが[147]、これらの治療法の有効性に関する利用可能なデータは現在のところ限られている[148]。
6.2. 消化器症状および臨床的考察
SARS-CoV-2ウイルスに感染した患者における胃腸症状(GI)の有病率を評価した研究では、幅広い結果が報告されている [149] が、GI症状の大部分が軽度であるという事実にはある程度のコンセンサスがあるようである [150]。
GI症状とCOVID-19の疾患進行との関係については対照的なデータがある。いくつかの研究では、下痢や吐き気および/または嘔吐などのGI症状を有する患者では入院や臨床的衰退のリスクが高まることが明らかにされている[151]。対照的に、他の研究では、GI症状の重症度は疾患の臨床経過の重症度とは相関しないと結論づけている[152,153,154,155]。実際、ある研究では、GI症状の存在は、より遅く、より重症度の低い臨床疾患の進行と関連していることが明らかにされている[156]。さらに、一部の著者は、炎症性腸疾患(IBD)などの既往の腸疾患を持つ人が必ずしも感染症を発症するリスクが高いとは限らないことを示唆している[157,158]。これは、IBDの重症度は様々であり、IBDを有するすべての患者が重症のCOVID-19を発症するリスクが同じレベルであるとは限らないということを意味している[159]。
GI症状が疾患経過に影響を与えると断言することはできないが、それでも患者は注意深く観察しなければならない。SARS-CoV-2に感染した患者の中には、GI症状が主症状である場合があることがわかっている [160,161]。したがって、非定型症状を見逃さないように、SARS-CoV-2感染に関連してGI症状を考慮することには価値がある。さらに、持続的なGI症状が原因で、肺炎の治療が終了した後に再入院を余儀なくされたという報告がある[162]が、GI症状を無視すべきではないことをさらに強調している。
SARS-CoV-2は、腸内のウイルスRNAの脱落により、糞便-経口感染経路を持つのではないかという懸念が高まっている。ウイルス性RNAは、SARS-CoV-2に感染した患者の便サンプルから発見されている[163]。いくつかの研究では、便中のウイルスRNAは、GI症状がある場合に検出されやすいことがわかっている[164,165]。しかし、他の研究では、ウイルス性RNAとGI症状の重症度の増加との間に統計学的に有意な関連は見出されていない[163,166]。このことから、呼吸器検体からウイルスが検出できなくても、便のウイルス性RNAが陽性であることが示唆されている[164,167]ことから、SARS-CoV-2ウイルスへの感染を評価する方法として、便のサンプリングを検討することに価値があるのではないかという提案がなされている。全体的に、便に感染性ウイルスが含まれている可能性は低いといういくつかの示唆にもかかわらず [168]、便-口腔感染による感染のリスクと、全体的な感染の文脈におけるその重要性の程度を確認するためには、さらなる研究が必要であるように思われる [169]。
6.3. マイクロバイオーム
COVID-19患者の腸内マイクロバイオームは、ストレプトコッカス(Streptococcus spp.)ロートシア(Rothia spp.)ヴェイロネラ(Veillonella spp.)アクチノミセス(Actinomyces spp.)などの日和見病原体を含む、健康な対照群と比較して、細菌の多様性が著しく低く、日和見病原体の相対的な多さが高いことが示されている [170]。本研究の著者は、これらのマイクロバイオームの変化を診断バイオマーカーとして使用できることを提案したが、治療のターゲットとしての価値も強調した。続いて議論するように、COVID-19患者の管理における補助療法としての使用のために、糞便性マイクロバイオータ移植、プロバイオティクス、食事療法などのマイクロバイオームに影響を与える治療法に関心が示されている[171,172]。
ある研究では、糞便マイクロバイオームの変化とCOVID-19の重症度の上昇との間に相関関係があることが明らかになった。しかし、この関係の因果関係は、COVID-19患者が重畳性細菌性肺炎の疑いのある細菌性肺炎の治療を受けることが多いために、COVID-19患者が抗生物質治療にさらされていることなど、腸内マイクロバイオームに影響を及ぼすことが知られている交絡因子に起因することもあって、はっきりとしたものではない。腸内マイクロバイオームは、ウイルスに対する免疫応答において重要であり、微生物異常は不十分な免疫応答につながる可能性があることが示唆されている[173]。さらに、動物モデルでは、マイクロバイオームが大腸ACE2発現に影響を与えることが示されている[174]。このことは、マイクロバイオームの構成がSARS-CoV-2の腸細胞感染能力に影響を与えうることを示していると思われる。したがって、腸の微生物異常は、個人がCOVID-19のより重篤な症例を発症する素因となる可能性がある。現在、これを支持するプレプリント研究が行われている[175]。
腸内マイクロバイオームの変化に加えて、COVID-19患者では気道のマイクロバイオームも障害されることが示されている[176]。これは、次に述べるように、腸-肺軸と潜在的に関連している可能性がある。
表3. SARS-CoV-2とCOVID-19患者で観察された消化器症状(マイクロバイオームの変化を含む)との関連を調査した研究の例
| 参照 | 研究トピック | 研究の関連する結論 |
|---|---|---|
| Lamers MM et al。、Science、2020 [ 142 ] | SARS-CoV-2感染腸細胞 | SARS-CoV-2が腸細胞で複製できることがわかりました。これが実証された1つの方法は、電子顕微鏡を使用して、SARS-CoV-2に感染したヒト小腸オルガノイドの画像を生成することでした。 |
| Lee JJ et al。、Genes 2020 [ 145 ] | SARS-CoV-2感染腸細胞 | 7人の患者の結腸サンプルを使用して、TMPRSS2およびACE2が下部消化管で高度に発現していると結論付けました。 |
| Burgueno JF et al。、Inflamm。Bowel Dis。、 2020 [ 146 ] | SARS-CoV-2感染腸細胞 | ACE2およびTMPRSS2は、動物モデルの腸上皮細胞で発現しています。 |
| Zang R et al。、Sci。Immunol。、 2020 [ 168 ] | SARS-CoV-2感染腸細胞 | TMPRSS2とTMPRSS4がSARS-CoV-2の細胞への侵入を促進することがわかった。SARS-CoV-2が腸液によって不活化されることがわかりました。便サンプルは、感染性SARS-CoV-2の存在を示さなかった。 |
| Cholankeril G et al。、Gastroenterology、2020 [ 150 ] | 消化管の症状 | SARS-CoV-2感染患者の胃腸症状の有病率は31.9%であり、これらの患者の89.2%が胃腸症状を軽度であると述べています。ASTレベルは疾患活動性と相関していることがわかった。 |
| Zheng T et al。、J.Med。ビロル。、2020 [ 151 ] | 消化管の症状 | 臨床的衰退の割合は、胃腸症状のない患者と比較して、胃腸症状のあるSARS-CoV-2感染患者の方が大きかった。 |
| Zhou Z et al。、Gastroenterology、2020 [ 153 ] | 消化管の症状 | 肺炎を発症したSARS-CoV-2感染症の患者における胃腸症状の有病率は26%でした。ただし、GI症状の存在は、臨床および治療の結果とは関連していませんでした。 |
| Redd WD et al。、Gastroenterology、2020 [ 154 ] | 消化管の症状 | 胃腸症状は、SARS-CoV-2感染症の患者の20.3%で主訴であり、研究の患者の61.3%は最低1つのGI症状を経験していると報告しました。 |
| Ferm S et al。、Clin。ガストロエンテロール。ヘパトール。、2020 [ 155 ] | GIの症状 | SARS-CoV-2感染症の患者における胃腸症状の有病率は25%でした。高レベルのASTは健康状態の悪化と関連していることがわかった。 |
| Nobel YR et al。、Gastroenterology、2020 [ 156 ] | 消化管の症状 | SARS-CoV-2感染症の患者における胃腸症状の有病率は35%でした。消化管症状を呈した患者は、SARS-CoV-2の検査で陽性となる可能性が70%高いことがわかりました。 |
| Chen Y et al。、J.Med。ビロル。、2020 [ 163 ] | 消化管の症状 | SARS-CoV-2感染症の患者における胃腸症状の有病率は19.05%でした。SARS-CoV-2 RNAは便サンプルに存在しましたが、消化管症状や疾患の重症度の存在とは相関していませんでした。 |
| Lin L et al。、Gut、2020 [ 166 ] | 消化管の症状 | SARS-CoV-2感染症の患者における胃腸症状の有病率は61.1%でした。入院患者の便サンプルが分析され、47.7%がSARS-CoV-2の存在について陽性であるとテストされました。 |
| Gu S et al。、Clin。感染する。Dis。、2020 [ 170 ] | マイクロバイオーム | COVID-19患者の腸内細菌叢は、H1N1感染患者および健常対照者の腸内細菌叢とは異なります。COVID-19患者は健康な対照よりも細菌の多様性が低く、H1N1患者はCOVID-19患者よりも細菌の多様性が低かった。 |
| ヤンTら、高血圧、2020 [ 174 ] | マイクロバイオーム | 腸内細菌叢は、結腸でのACE-2発現の調節に役割を果たしています。これは、無菌ラットおよび従来の無菌ラットから収集された糞便サンプルの遺伝子配列決定を実施することによって示されました。 |
| Zhang H et al。、Clin。感染する。Dis。、2020 [ 176 ] | マイクロバイオーム | 非COVID-19肺炎の患者と比較して、COVID-19患者は、頻繁に潜在的な同時感染を伴う、より破壊された気道マイクロバイオームを持っているように見えました。 |
| Effenberger M et al。、Gut、2020 [ 177 ] | マイクロバイオーム | COVID-19の患者は、COIVD-19のない肺炎患者よりも気道マイクロバイオームが破壊されている可能性が高くなります。 |
6.4. 腸肺軸
上述したように、腸と肺の両方には病原体の浸潤を防ぐバリア層がある。腸と肺のマイクロバイオームは、免疫応答を調節することでこのバリアを維持する上で重要な役割を果たしていると考えられている[178]。
マイクロバイオームの多様性の低下は慢性呼吸器疾患と関連している。例えば、嚢胞性線維症患者では、肺マイクロバイオームと腸マイクロバイオームの両方に変化があることが示されている[179]。リンパ球遊走は、腸内マイクロバイオームと肺マイクロバイオームが相互作用する可能性のあるメカニズムであり、これは全身の免疫と炎症に影響を与える可能性がある[178]。腸管透過性の亢進が、COVID-19の全身性炎症性傷害の病因において役割を果たしている可能性が示唆されている[180]。
さらに、腸内の常在菌によって産生されるSCFAsは、潜在的に全身性免疫に影響を与える可能性がある。SCFAsは、SCFAsが相互作用するGタンパク質共役型受容体に依存して、抗炎症反応または抗炎症反応を刺激すると考えられている[181]。これに関連して、免疫恒常性の維持にはマイクロバイオームが不可欠であることが提案されており、これはCOVID-19患者において考慮することが重要であるかもしれない[182]。
SARS-CoV-2感染に対する炎症反応は、疾患の進行およびGI症状の変動を決定する因子である可能性がある。初期の研究では、SARS-CoV-2感染後の有意な炎症反応の変化は認められなかったが [154]、その後の研究では、SARS-CoV-2感染患者において、糞便カルプロテチンやIL-6などの炎症マーカーの増加が観察されている [177]。さらに、COVID-19患者の腸内炎症性環境に焦点を当てた最近の研究では、SARS-CoV-2への腸内感染は実際に腸特異的な炎症反応を変化させ、局所的な抗ウイルス免疫を阻害し、同時にプロ炎症性サイトカインの増加分泌を促進することが実証されている;これらの患者の一部の糞便サンプルで検出可能であることに加えて、この炎症反応の増強は全身的な免疫調節と相関している可能性がある[183,184,185]。このことを考慮すると、腸内マイクロバイオーム、SARS-CoV-2による腸内感染、局所および全身炎症の調節との間の関連をより詳細に調査することは、COVID-19疾患の発症および転帰において重要な役割を果たすと考えられているため、貴重なものとなるであろう[186]。
6.5. 腸管バリア治療とSARS-CoV-2
損傷した腸管バリアを治療するために使用されてきた治療法の多くは、SARS-CoV-2感染症における補助療法としても提案されている。
例えば、SARS-CoV-2と腸との間で観察された相互作用に基づいて、GI症状の発現および微生物学的ジスビオシスに基づいて、COVID-19患者の治療ツールとしてFMTが検討され得ることが示唆されている[171]。
さらに、特定のプロバイオティクスがウイルス感染症のコントロールに使用できることを示す証拠がいくつかある[180]。このことから、プロバイオティクスがCOVID-19患者の治療における補助療法として考えられることを示唆するものもある[172]。実際、ある研究では、SARS-CoV-2感染症患者において、プロバイオティクスによる補助的治療は呼吸不全を発症するリスクの有意な減少と関連していることが明らかになった[187]。この臨床転帰の改善は、プロバイオティクスが持つと考えられている抗ウイルス効果と抗炎症効果によるものである可能性がある[188,189]。さらに、プロバイオティクスは脆弱な患者であっても安全であると考えられていることが多く、これは他の実用的な利点と相まって、COVID-19患者における補助的または支持療法としての使用に適していると考えられる [190]。
COVID-19患者の管理において、補助的および予防的な食事療法の使用も促進されている[182]。以前に議論したように、腸内マイクロバイオームは腸-肺軸を介して呼吸機能に影響を与えることができ、食事は腸内マイクロバイオームの構成にかなりの影響を与えることができる[191]。さらに、ビタミンCや亜鉛などの特定の栄養素の摂取は抗炎症作用と関連しており、これはCOVID-19患者の管理に有用である可能性がある[180,192]。このことはまた、食生活の地理的な違いが国によってCOVID-19の死亡率が異なることの原因になるのではないかという仮説を導くものでもある [193]。
しかしながら、SARS-CoV-2感染症患者において、FMT、プロバイオティクス、食事療法を臨床的にどのように使用すべきかを判断することは難しいことを再確認しておく必要がある。COVID-19の補助治療としての使用について具体的な推奨を行うには、さらなる臨床試験が必要である。
6.6. 未解決の研究分野
SARS-CoV-2 の腸管への影響についてはまだ多くのことが解明されていないが、この分野では多くの研究が行われており、表 4 にはまだ答えが出ていない主要な研究課題をまとめている。今後の研究では、SARS-CoV-2が糞便から口腔内への感染経路を持っているかどうか、そしてそれが全体の感染率にどのような影響を与えるかを明らかにすることが重要な課題の一つとなる。さらに、微生物異常症がCOVID-19の疾患進行をより重症化させる要因となるかどうかについて、さらなるエビデンスが必要である。さらに、COVID-19の潜在的な治療法が呼吸器症状だけでなく、消化器症状に及ぼす影響を測定することは有益であろう。逆に、どのCOVID-19患者が腸を標的とした治療法から最も恩恵を受けるかは現在のところ明らかではなく、様々な治療法の有効性を確認するだけでなく、どのグループの患者が最も恩恵を受けるかを層別化する必要性を満たすために、さらなる研究が必要である。
表 4.SARS-CoV-2と腸についての理解を深めるために重要な質問に答えるためにさらなる研究が必要ないくつかの分野
| さらなる研究が必要な分野 | 答える必要のある質問 |
|---|---|
| 糞口感染 |
|
| マイクロバイオームと免疫 |
|
| 治療と消化管症状 |
|
7. 結論
腸管バリアの機能は腸の恒常性維持に不可欠な役割を果たしており、このバリアの損傷は病理や疾患と関連している。腸管透過性の改善を目的とした複数の治療法が検討されてきた。これらの治療法の多くは、タイトジャンクションの調節を伴う作用機序を持っていると考えられている。腸とCOVID-19との関連は、腸の病理学的治療法の研究を継続することの重要性を強調している。