Contents
Incomplete humoral response including neutralizing antibodies in asymptomatic to mild COVID-19 patients in Japan
www.ncbi.nlm.nih.gov/pmc/articles/PMC7787511/
要旨
COVID-19のパンデミックは現在も進行中であり、血清抗体に関する研究は多く報告されているが、無症状・軽症患者に関する研究は少ない。本研究では、比較的軽症のCOVID-19患者44例とパンデミック前の対照48例を登録した。SpikeおよびNタンパク質の細胞外ドメイン、S1ドメイン、受容体結合ドメインに対する血清抗体を測定し、本物のウイルス中和アッセイおよび新開発のビーズ/細胞ベースのSpike-ACE2阻害アッセイによる中和力価を調べ、臨床的特徴と比較した。中和力価を含む抗体の多くは相互に相関しており,抗体産生はPCR検査の低Ct値,重症度,症状(特に肺炎,リンパ球減少症),CRP,LD,D-ダイマー,プロカルシトニンなどの血清学的検査と関連していた。その結果,無症状患者の87.5%,軽症患者の23.5%はSARS-CoV-2に対する抗体を有していなかった。これらの結果から,無症候性患者と軽症COVID-19患者では体液性免疫の獲得が不十分であることが明らかになった。
キーワード
COVID-19,SARS-CoV-2,抗体、中和力価、中和アッセイ、臨床的特徴、重症度、無症候性、血清学的検査、免疫反応
1. はじめに
SARS-CoV-2のパンデミックは世界的に続いているが,東アジアを中心とした一部の国では,他の地域に比べて患者数が少ない傾向にある.その原因として、遺伝的背景の違い、社会行動の違い、SARS-CoV-2ゲノムの変異、類似ウイルスに対する交差反応性免疫を持っている可能性など、いくつかの仮説が推測されているが、特定されていない(Yamamoto er al)。 日本では感染者数が増加し始めているが、強制的な政策を用いずに大規模なアウトブレイクを回避してきた。
様々なSARS-CoV-2由来抗原に対する抗体価が測定され、Spikeタンパク質およびNucleocapsidタンパク質(N)に対して高い特異性を有することが報告されており(Jiang et al 2020)Spikeおよび/またはNを抗原として用いた抗体検査が多く開発されている。血清抗体価は、発症後10日から 14日目に上昇し、3週目にピークを迎えることが報告されている(Wellinghausen et al 2020; Liu et al 2020; Lau et al 2020; Shaw et al 2020; Caturegli et al 2020)。中和力価を測定するために、生きたウイルスまたは疑似ウイルスを用いたいくつかの手順が開発されており、中和抗体の力価がSpikeおよびNタンパク質に対する抗体とある程度相関することも知られている(Wu et al 2020; Robbiani et al 2020; Okba et al 2020; Wang et al 2020)。日本では、発症2週間後にラテラルフローキットを用いて87%、96%の患者で血清転換が認められたという報告が2つのグループからなされているが(金子 et al 2020;今井 et al 2020年)血清抗体と臨床パラメーターとの関連についての詳細な研究はほとんどない。
当院では、無症状から重症まで様々な患者さんをケアし、臨床症状を報告していた(中川原 et al 2020)。本研究では、それらの血清学的特徴を調べることを目的とした。ここでは、本格的なウイルス中和アッセイに加えて、Spike由来タンパク質とNに対する血清抗体を測定するビーズベースのアッセイ、および血清Spike-ACE2阻害率を調べるためのビーズベースおよび細胞ベースの手順を確立した。本研究では、比較的軽症の日本人患者における体液性免疫応答と詳細な臨床所見との関連について報告した。
2. 材料と方法
2.1. 臨床サンプル
患者は2020年4月から7月まで慶應義塾大学病院で募集した。入院時にPCR検査を実施し、その後は3~5日に1回実施した。患者からの血清サンプルは、退院時または最初の外来受診時に採取した。健康な対照者からの血清サンプルは 2019 年 11 月までに収集し、保存した。徴候および症状;好中球数およびリンパ球数;乳酸脱水素酵素(LD)C反応性蛋白(CRP)フェリチン、Dダイマー、プロカルシトニン、シアル化糖質抗原KL-6,および推定糸球体濾過率(eGFR)の血清パラメータ;および投薬歴をカルテから収集した。肺CTをもとに肺炎と診断した。本研究は、本学医学部倫理委員会の承認を得て、ヘルシンキ宣言の教義を遵守して実施した。参加者全員からインフォームドコンセントを得た。
2.2. SARS-CoV-2のPCR検査
鼻咽頭スワブからのリアルタイムRT-PCRによるSARS-CoV-2検出は、潜在的感染者の検査のためのルーチン診断で、BD-MAX(BD, NJ, USA)を用いて、プライマーN_Sarbeco_F1を用いて行った。CACATTGGCACCCGCAATC、N_Sarbeco_R1:GAGGAACGAGAAGGCTTG、N_Sarbeco_P1:ACTTCCTCAAGGAACAACATTGCCA、NIID_2019-nCOV_N_F2:AAATTTTGGGGACCAGGAAC、NIID_2019-nCOV_N_R2。TGGCAGCTGTGTAGGTCAAC、NIID_2019-nCOV_N_P2:ATGTCGCGCATTGGCATGGA(白戸 et al 2020)。
2.3. 組換えACE2およびSARS-CoV-2タンパク質の作製
ACE2の細胞外ドメイン(NCBI、NM_021804.3,1-708 AA)を、ヒトPBMCのcDNAから、C末端にストレプトアビジン結合ペプチド(SBP)タグまたはFLAGタグを有するpcDNA3.4発現ベクター(Thermo Fisher Scientific、MA、USA)にクローニングした。SARS-COV-2 SpikeおよびNをコードするコドン最適化二本鎖DNA断片(NCBI、MN908947.3)をGenewiz(NJ、米国)から購入した。Spikeタンパク質およびNの細胞外ドメイン(SECD)、S1ドメインおよび受容体結合ドメイン(RBD)をC末端にSBPタグを付けてpcDNA3.4に挿入した。Spike由来のタンパク質およびACE2は、製造業者の指示に従ってExpi293 Expression System(Thermo)を用いて作製した。上清を濃縮し、アミコンウルトラフィルター(メルク、ダルムシュタット、ドイツ)を用いてPBSにバッファー交換し、ストレプトアビジンセファロースハイパフォーマンスビーズ(サイティバ、東京、日本)を用いて4℃で一晩、振とうしながらインキュベートした。その後、ストレプトアビジンビーズをPBSで5回洗浄し、1x Buffer BXT(IBA、ゲッティンゲン、ドイツ)でタンパク質を溶出した。
Nは、ポリエチレンイミン(Polysciences, PA, USA)を用いた一過性発現により、293T細胞により産生された。トランスフェクションの2日後、Nを発現した細胞を、プロテアーゼ阻害剤カクテル(富士フイルム和光、大阪、日本)を添加した1%トリトンX-100(TBSTx)を含むトリス緩衝生理食塩水中で溶解した。細胞ライセートを16,000 g、4℃で15分間遠心分離することにより清澄化し、上清をストレプトアビジンビーズを用いて上記のように精製した。
これらの溶出物を濃縮し、Amicon Ultraフィルターを用いて再びPBSに緩衝液を交換した。タンパク質の純度は、12.5% SupersepプレキャストゲルおよびQuick CBB Plus(富士フイルム和光)を用いたSDS-PAGEおよびCoomassie Brilliant Blue(CBB)染色により決定し、濃度はBCA Protein Assay Kit(Thermo)により決定した。蛋白質の純度は、補足図1Aに示すとおりである。
2.4. 抗原結合ビーズアッセイによるウイルスタンパク質に対する抗体の測定
SECD、S1,RBD、およびNに対する抗体を、以前に記載されたように抗原結合ビーズアッセイによって測定した(Takeshita er al)。 詳細には、20μlのDynabeads M280ストレプトアビジン(Thermo)を、4μgのRBD-SBP、16μgのS1-SBP、32μgのSECD-SBP、または10μgのN-SBPを100μlのTBSTx中で一晩、振とうしながら4℃でインキュベートした。0.05% Tween-20(PBS-T)を含むPBSで洗浄した後、RBD-、S1-、SECD-、およびN-結合ビーズを96ウェルプレートに移し、1:100希釈血清50μlで4℃で20分間インキュベートした。洗浄後、ビーズを、ヒトIgG-Fc、IgA-Fc、またはIgM-Fcに対するアロフィコシアニン(APC)-共役抗体の30μlでインキュベートした。最終洗浄後、ビーズをFACS Verse(BD)で分析した。シングルレットゲートビーズ間のAPCの平均蛍光強度(MFI)を、抗RBD抗体、S1抗体、SECD抗体、またはN抗体の力価の指標として使用した。代表的なFACSプロットを補足図1Bに示す。血清希釈倍率の最適化の代表的な結果を補足図1Cに示す。測定手順を図1Aに示す。
図1に示す。
図1 測定手順の概略図。
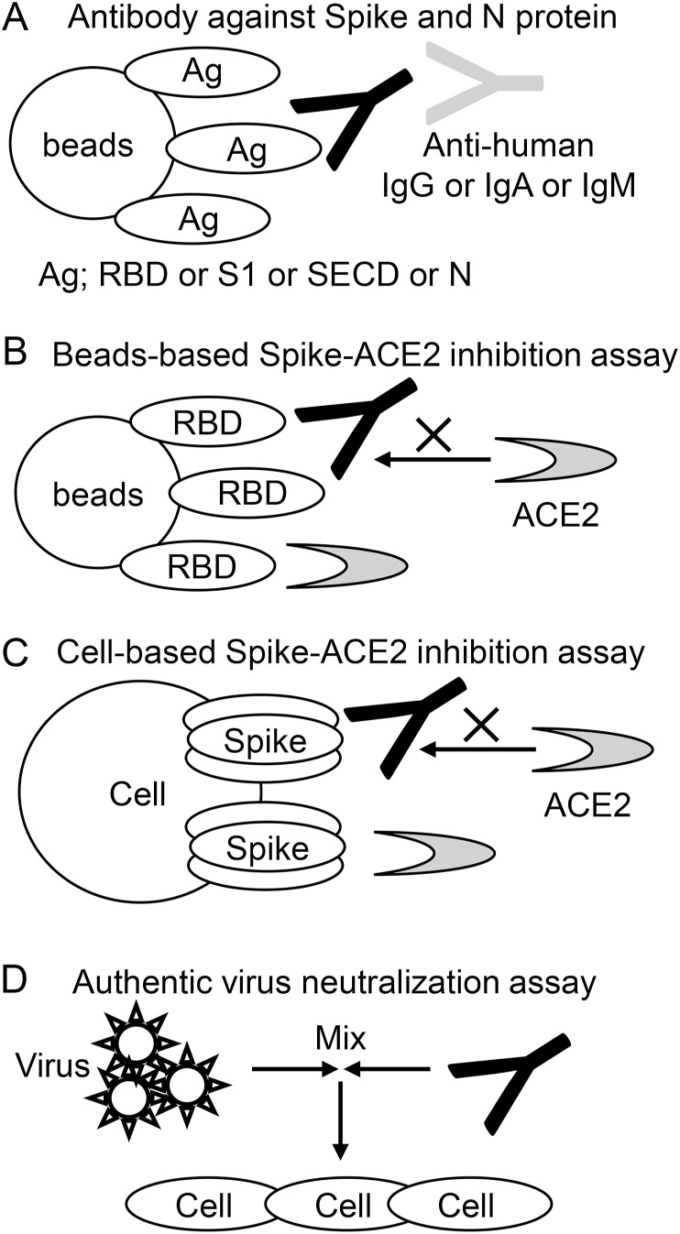
A)SECD、S1,RBD、Nタンパク質に対する抗体を測定した。抗原結合ビーズを血清とインキュベートし、ビーズに結合した抗体(黒)を、IgG、IgA、またはIgMに対する二次抗体(灰色)で検出した。B)ビーズベースのSpike-ACE2阻害アッセイ。RBD結合ビーズを、阻害抗体(ブラック)を含む血清とインキュベートし、次いで可溶性ACE2(グレー)とインキュベートした。ビーズに結合したACE2の量を測定した。C)細胞ベースのSpike-ACE2阻害アッセイ。スパイクを導入した細胞を、阻害抗体を含む血清(ブラック)でインキュベートした後、可溶性ACE2(グレー)でインキュベートした。ビーズに結合したACE2の量を測定した。D)真性ウイルス中和アッセイ。SARS-CoV-2ウイルスを、連続的に希釈した血清と混合した。混合物をVeroE6/TMRRSS2細胞上に置き、培養した。100%のCPE阻害を有する最高の血清希釈倍率を真正ウイルス中和力価と定義した。
2.5. ビーズベースのSpike-ACE2阻害アッセイ
RBD結合ビーズを上記のように調製し、1:20-、1:100-、または1:500-で希釈した血清で4℃で20分間インキュベートし、洗浄し、ACE2-FLAGで4℃で20分間インキュベートし、洗浄し、抗DYKDDDK抗体で4℃で20分間インキュベートした。最終洗浄後、ビーズをFACS Verseで分析した。血清なしでインキュベートしたビーズのMFIをネガティブコントロール(阻害率0%)とし、ACE2-FLAGなしでインキュベートしたビーズをポジティブコントロール(阻害率100%)とした。阻害率は、阻害率=1-(試料のMFI-陽性対照のMFI)/(陰性対照のMFI-陽性対照のMFI)として算出した。測定手順を図1Bに示す。
2.6. 細胞ベースのSpike-ACE2阻害アッセイ
発現ベクター(全長スパイクタンパク質12μgおよびpMX-GFP 6μg)をPolyethylenimine Max(Polyscience, PA, USA) 43.2μgを用いて100mmディッシュ上の293T細胞に共トランスフェクトした。日後、細胞を0.5%BSAおよび2mM EDTA(染色バッファー)を補充したPBSで洗浄し、希釈した血清サンプルで4℃で20分間インキュベートし、再度洗浄し、予混合したACE2-SBPおよびAPC共役ストレプトアビジン(それぞれ0.6μg/mlおよび0.4μg/ml)で4℃で20分間インキュベートした。最終洗浄後、細胞をFACS Verseで分析した。GFP+細胞間のMFIをFlowJo(BD)を用いて計算し、Spike-ACE2結合の指標として使用した。血清を含まない細胞およびACE2-SBPを含まない細胞を、それぞれ陰性および陽性対照として使用した。代表的なプロットを補足図1Dに示す。測定手順を図1Cに示す。
2.7. 本物のウイルス中和アッセイ
熱不活化した血清を、2%ウシ胎児血清(Biowest, Nuaillé, France)と100 unit/mlペニシリン、100 μg/mlストレプトマイシン(Thermo)を補充したDulbecco modified Eagle培地(FUJIFILM Wako)で連続的に希釈した。希釈した血清を100 TCID50 SARS-CoV-2 JPN/TY/WK-521株(Matsuyama et al 2020)と混合し、37℃で1時間培養した。 混合物をVeroE6/TMRRSS2細胞(JCRB1819, JCRB Cell Bank, Osaka, Japan)上に置き、37℃で5%CO2で5日間培養した。細胞病理効果(CPE)の評価は、プレートを20%ホルマリン(FUJIFILM和光)で固定し、クリスタルバイオレット溶液(Sigma-Aldrich,MO,USA)で染色した。CPEを100%阻害した最高の血清希釈係数を、真性ウイルス中和力価と定義した。測定手順を図1Dに示す。
2.8. 抗体
使用した抗体は以下の通りである。抗ヒトIgG-Fc(APC、ヤギ-F(ab’)2フラグメント)抗ヒトIgM-Fc(APC、ヤギ-F(ab’)2フラグメント)および抗ヒトIgA-Fc(APC、ヤギ-F(ab’)2フラグメント)をJackson ImmunoResearch(PA、米国)から入手した。抗ヒトIgG1ヒンジ(AF647,4E3)抗ヒトIgG2-Fc(AF647,HP6002)抗ヒトIgG3ヒンジ(AF647,HP6050)抗ヒトIgG4-Fc(AF647,HP6025)をサザンバイオテック(AL、米国)から;および抗DYKDDDK抗体(AF647,FLA1)をMBL(名古屋、日本)から入手した。
2.9. 統計情報
連続データは、中央値と四分位間距離(IQR)またはパーセンテージ値を持つ数値として示されている。カイ二乗検定を範疇変数の調査に使用し、Wilcoxon 位相和検定を連続変数の調査に使用した。つの連続変数間の相関は、スピアマンの順位相関係数を用いて分析した。重回帰分析を用いて、真正ウイルス中和力価のモデルを作成した。健常者でも変動する最高LD値と最低リンパ球数以外の中和力価に関連する変数を、閾値p値0.05の前方選択を用いてモデルに入力した。P値<0.05は統計的に有意であると考えられた。すべての統計解析はJMP 15(SAS Institute, NC, USA)を用いて行った。
3. 結果
3.1. 患者のコホート
当院では 2020年4月に無症状患者からの院内感染を経験し、感染の可能性のある者を対象にPCR検査を広範囲に実施するようになった。そのため、症状が軽度または無症状であってもSARS-CoV-2のPCR検査で陽性と診断された患者さんに加え、COVID-19と診断された患者さんも多数発見し、治療を行った。SARS-CoV-2に対する抗体は発症から 10~14日後に出現し、ほとんどの血清転換が3週目までに発症することが報告されているため、PCR検査陽性から3週間後に主に横断的に血清を採取した。参加者の特徴を表1
に示す.
表1 患者の臨床的特徴。
| HC(N = 48) | PT(N = 44) | |
|---|---|---|
| 性別(男性) | 6(40) | 22(50) |
| 年齢(年) | 36(30–60) | 30(26–46) |
| 喫煙:決して/元/現在 | 34/7/3 | |
| 最初のポジティブPCRから数日後 | 55(34–69) | |
| 以前の併存疾患 | 30(68) | |
| <兆候と症状> | ||
| 疾患重症度A | ||
| 無症候性 | 16 | |
| 軽度 | 17 | |
| 中程度 | 9 | |
| 重度 | 1 | |
| クリティカル | 1 | |
| 発熱(≥37.5°) | 22(50) | |
| 肺炎 | 11(25) | |
| 上気道症状b | 21(48) | |
| 下気道症状c | 15(34) | |
| <実験データ> | ||
| 最小のPCRCt値d | 30.0(19.0–40.6) | |
| 好中球数(/μl)e | 2905(2018–4935) | |
| 最小リンパ球数(/μl) | 1464(968–1961) | |
| 最高LDレベル(U / l) | 189(158–234) | |
| 最高のCRPレベル(mg / dl) | 0.18(0.03–0.74) | |
| 最高のフェリチンレベル(ng / ml)f | 172(69–255) | |
| 最高のD-ダイマーレベル(μg/ ml)g | <0.5(<0.5–0.8) | |
| 最高のプロカルシトニンレベル(ng / ml)f | <0.02(<0.02–0.04) | |
| 最高のKL-6レベル(U / ml)h | 277(169–67) | |
| eGFR(ml / min)g | 84(76–97) | |
| <治療> | ||
| 全身性コルチコステロイド | 3(7) | |
| 吸入コルチコステロイド | 5(11) | |
| ファビピラビル | 7(16) | |
| ヒドロキシクロロキン | 4(9) | |
データは適宜、数値、数値(%)または中央値(四分位の範囲)で示す。
a重症度は、世界保健機関(WHO)が編集した「COVID-19の臨床管理」(2020年5月27日)による。
b上段の呼吸器症状には、鼻漏、咽頭痛、嗅覚障害、味覚障害が含まれる。
c下部呼吸器症状には、咳や痰の分泌などがある。
dN=40,発症から 10日以内。
eリンパ球数最少時の好中球数。
fN=38。
gN=40。
h入院時のeGFRを示す。CRP、C反応性蛋白質;Ct、閾値サイクル;PCR、ポリメラーゼ連鎖反応;LD、乳酸脱水素酵素;CRP、C反応性蛋白質;KL-6,Krebs von den Lungen-6;eGFR、推定糸球体濾過率。
3.2. SECD、S1,RBD、およびN
まず、各アイソタイプについて、SECD、S1,RBD、Nに対する血清抗体を測定した。図2Aに示すように、患者の中には各抗原に対する抗体を有する者もいたが、健常者ではいずれの抗原に対してもほとんど反応しなかった。3つのアイソタイプの中では、IgGが最も明確に陽性と陰性に分かれ、次いでIgA、IgMの順となり、4つの検査抗原の中では、SECDとS1の結果が最も明確に分かれた。Nに対するIgAとIgMは、患者群の中では他の抗原に比べて陽性率が低かった。全体の陽性率は図2Bに示されており、報告されている80〜100%(Wellinghausen et al 2020;Liu et al 2020;Lau et al 2020;Shaw et al 2020;Caturegli et al 2020)よりも有意に低かった。また、10の代表的な血清サンプルを用いて、これらの抗原に対するIgGサブクラスを調べた。図2Cに示すように、IgG1はすべての抗原に対して最も豊富であり、IgG2,IgG3,およびIgG4が続いた。
図2 各アイソタイプのSECD、S1,RBD、Nに対する抗体。

A)44人の患者(PT)と48人の健常対照者(HC)を対象に、各タンパク質に対する血清IgG、IgA、IgM抗体を測定した。破線は、2つの異なるグループの中心(SECDおよびS1の場合はIgG)または他のグループの場合は75%クォンタイル+5×(75%クォンタイル-25%クォンタイル)として決定されたカットオフを示す。B)HCおよびPTにおける各抗体の陽性率を示す。C)代表的な患者10人からの各IgGサブクラスの血清抗体を測定した。合計は総IgGを示し、線は各個体を示す。
次に、各抗原に対する抗体量と各アイソタイプとの相関を調べた。図3Aに示すように、各アイソタイプ間では、SECD、S1に対する抗体が最も相関が強く、次いでRBD、Nの順であった。スパイク由来抗原(SECD、S1,RBD)については、全てのアイソタイプにおいて高い相関が認められたが、スパイク由来抗原に対する抗体とNに対する抗体との間には若干のばらつきが認められた。
図3 異なる標的および異なるアイソタイプに対する抗体の相関

(A) SECD、S1,RBD、Nに対する各アイソタイプの量の相関を示す。B)各抗原に対するIgG-抗体、IgA-抗体、IgM-抗体の量の相関を示す。スピアマンの検定。
3.3. 血清中和抗体価
次に、スパイクとACE2の結合を阻害する血清抗体を2つの手順で測定した。完全長スパイク発現細胞およびRBD結合ビーズを調製し、20倍、100倍、または500倍に希釈した血清でインキュベートして、その後の可溶性ACE2の結合がどの程度阻害されるかを調べた。図4Aに示すように、濃度依存的な阻害効果は、患者からの血清では観察されたが、対照の血清のほとんどでは観察されなかった。健康なコントロールからの1つのサンプルのみがRBDビーズと弱い反応を示した。これらの測定ではIC50を指標として用いることが多いが、我々のコホートでは20倍希釈でも50%の阻害率に達しないサンプルが多かったため、20倍希釈時の阻害率を指標とした。これらに加えて、血清のウイルス中和能を直接測定するために、全患者の検体と一部の健常対照検体について、本物のSARS-CoV-2を用いた中和試験を行った(図4B)。中和力価は、患者検体の約半数と健常対照検体のすべてで検出できず、SpikeやNに対する抗体の結果と同様の結果が得られた。
図4 血清細胞およびビーズベースのSpike-ACE2阻害率および真性ウイルス中和力価。

A)血清Spike-ACE2阻害率を、細胞およびビーズベースの阻害アッセイによって測定した。1:20,1:100,および1:500希釈における患者(PT)および健常対照(HC)からの血清の阻害率を示す。線は各個体を示す。B)全患者(PT)および一部の健常対照(HC)の血清真性ウイルス中和力価を示す。C)正真正銘のウイルス中和力価と細胞およびビーズベースのSpike-ACE2阻害アッセイとの間の相関を示す。D)細胞ベースの阻害アッセイとビーズベースの阻害アッセイとの間の相関を示す。E)中和力価およびSECD、S1およびRBDに対する抗体の間の相関を示す。スピアマンの検定を示す。
次に、Spike-ACE2阻害アッセイと本物のウイルス中和アッセイの結果を比較した。図4Cに示すように、両手順の阻害率は、正真正銘のウイルス中和力価と高い相関を示し、さらに、2つの阻害アッセイの結果もまた、高い相関を示した(図4D)。これらの複数の測定により、我々のコホートにはSARS-CoV-2に対する血清中和抗体を持たない患者が含まれていることが確認された。次に、Spike由来のタンパク質に対する血清抗体と本物のウイルス中和力価との関係を調べた。予想通り、中和力価はSpike由来のタンパク質に対する抗体と強く相関していた(図4E)。これらの結果は、本研究の患者の約半数がSARS-CoV-2に対する血清抗体を持っていなかったことを意味している。
3.4. 中和力価と相関性の高い臨床パラメータ
最後に、血清抗体と臨床情報/パラメータとの関係を調べ、どのような因子が抗体産生に影響を与えるかを調べた。図5は、臨床的特徴と真性ウイルス中和力価との相関関係を示したものである。PCR Ct値の最低値、重症度、肺炎、リンパ球減少、CRP値の最高値、Dダイマー値の最高値など多くのパラメータが中和力価と明確かつ有意に相関しており、無症状患者の15/16(93.8%)軽症患者の6/17(35.3%)では中和力価が検出されなかったことが明らかになった。SpikeとNに対する血清抗体の結果を合わせると、無症状患者の87.5%、軽症患者の23.5%ではSARS-CoV-2に対する抗体は検出されなかった。
図5 臨床パラメータと真性ウイルス中和力価との関連。

各種臨床パラメータと中和力価との関連を示す。カテゴリカルパラメータについては、中和力価を順序変数として使用し、連続変数については、中和力価を連続変数として使用した(<1:5=0)。スピアマンの検定およびWilcoxon順位和検定を用いた。
これらの因子のうち、どの因子が体液性免疫の獲得に強い影響を及ぼすかを調べるために、次に重回帰分析を行った。表2に示すように、CRP値の最高値、肺炎の有無、PCR Ct値の最低値の3つの変数が中和力価に統計的に有意な効果を示し、調整R2は0.90であった。
表2 正真正銘のウイルス中和力価(%)の重回帰モデル。
| 特徴 | 係数(95%信頼区間) | t値 | P値 |
|---|---|---|---|
| 最高のCRPレベル(1mg / dlあたり) | 0.97(0.57–1.37) | 4.97 | <0.0001 |
| 肺炎 | 8.12(5.60–10.64) | 6.54 | <0.0001 |
| 最小のPCRCt値(サイクルあたり) | −0.28(−0.40–−0.16) | −4.84 | <0.0001 |
CRP、C反応性タンパク質;PCR、ポリメラーゼ連鎖反応;Ct、閾値サイクル;PCR、ポリメラーゼ連鎖反応。
4. 議論
本研究では、比較的軽症の日本人COVID-19患者の血清抗体を調べた。我々のコホートでは,ウイルス蛋白に対する抗体量,Spike-ACE2 阻害率,真性ウイルス中和力価は相互に相関していた。抗体の産生は,重症度や肺炎などの臨床症状,低い PCR Ct 値,リンパ球減少,CRP,LD,D-ダイマー,プロカルシトニン値などの血清学的検査結果と関連していた。重回帰分析の結果,CRP値の高値,肺炎の有無,PCR Ct値の低値が中和力価に強く影響していた。また,無症状患者では約87.5%,軽症患者では約23.5%が体液性免疫を獲得していないことが明らかになった。これらの結果から,血清を用いた疫学研究を行う際には慎重な検討が必要であることが示唆された。
多くの先行研究では、発症3週間後に80~100%の抗体有病率を示した(Robbiani et al 2020)(Wolfel et al 2020)我々のコホートよりも症状が強く重症化したコホートが報告されている。中国の軽症例を対象とした研究でも、94%の患者で中和抗体が検出された(Wu et al 2020)。これらの抗体は、年齢、性別、症状の有無、重症度、リンパ球減少症、血清CRP値と相関することが報告されていた(Wu et al 2020; Robbiani et al 2020; Yan et al 2020)が、我々の結果では抗体の有病率ははるかに低かった。この差は、抗体を持たない無症候性の患者が多いことによると考えられる。多くの無症候性患者を含む研究は少ないが、PCR検査陽性の無症候性患者を調べたドイツの報告(Wellinghausen et al 2020)では、これらの患者の85%が抗体陰性であり、血清陽性はCt値と負の相関があり、我々の結果と一致した。これらの結果は、日本や欧米諸国の知見と同様に、高ウイルス負荷、肺炎、強い全身反応が抗体産生に重要な役割を果たしていることを示している。問題の一つは、体液性免疫のない無症候性や軽症の患者ではどうなるかということである。ほとんどの患者でPCRが繰り返し陽性であることから、これらの患者にウイルスが存在していたことは間違いない。最近では、一部の抗体陰性患者でT細胞反応が観察されることが報告されている(Sekine er al)。 このような患者で免疫反応がどのように起こるのか、また、そのような患者が再感染のリスクが高いのかどうかは、今後の研究の重要な課題である。
本研究の強みは、複数のアッセイを用いてウイルス抗原に対する抗体と中和能を検出したことである。結果はよく相関しており、アッセイシステムが信頼できることを示していた。この研究にも限界がある。一つは、患者数が比較的少なく、特に重症患者が多いことである。もう一つは、無症状患者や軽症患者ではPCR Ct値が高く、偽陽性やコンタミネーションの可能性が残っていることである。しかし、その中でも44人中42人の患者が少なくとも2回のPCR検査で陽性と診断された。2例は1回のPCR検査のみで診断されたが、検体不足のため再検査ができなかった。
5. 結論
まとめると、SARS-CoV-2に対する抗体産生には、ウイルス負荷、肺炎、全身性炎症反応が重要であることが示された。その結果、重症度の異なる患者では、体液性免疫の記憶が大きく異なることが明らかになった。今後、これらの抗体の臨床的意義を含めたさらなる網羅的な研究が望まれる。
