Contents
Hyperinflammation and Immune Response Generation in COVID-19
pubmed.ncbi.nlm.nih.gov/33341814/
2020年12月18日
要旨
コロナウイルス病2019(COVID-19)パンデミックを引き起こす重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)は、世界中で何百万人もの人々に影響を与えている。このウイルスの病態生理はあまり明確にはわかっていないため、その回避機構を解明するために科学者の間で莫大な努力がなされている。
本稿では、SARS-CoV-2ウイルスに感染した後、ヒトの体内で発生する炎症反応と体液性・細胞性免疫応答についてまとめた。感染後にプロ炎症性サイトカインやケモカインの増加、補体タンパク質の活性化によって生じる炎症反応は、疾患の重症化に寄与している可能性が高いと考えられる。また、免疫に影響を及ぼす可能性があり、疾患の重症度や転帰において重要な併存因子となりうる他の因子についても議論した。
序論
COVID-19の原因となる重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2)が中国・武漢から出現したことは、かつてない健康危機をもたらしている。2020年3月11日にWHOによりパンデミック宣言された。コロナウイルスは、アルファコロナウイルス、ベータコロナウイルス、ガンマコロナウイルス、デルタコロナウイルスの4属から構成されている。SARS-CoV-2はβコロナウイルス属に属する。ヒトコロナウイルスの中で最も近い親類はSARS-CoVであり,遺伝子的類似度は79%である。しかし、既知のコロナウイルス配列の中では、SARS-CoV-2はコウモリコロナウイルスRaTG13との類似度が約96%と最も高く、パンゴリン(うろこ状の脊椎動物)のコロナウイルス配列との類似度は約91.02%となっている[1]。パンゴリンCoVとSARS-COV-2のスパイクタンパク質の受容体結合ドメインは、アンジオテンシン変換酵素2受容体と相互作用する6つのアミノ酸が同じであるのに対し、SARS-CoV-2とSARS-CoVではこの6つのアミノ酸のうち5つの残基が異なっている。しかし、スパイク蛋白質の多塩基切断部位が異なるため、SARS-CoV-2はヒトの細胞感染に対してより攻撃的であると考えられている[1]。
SARS-CoV-2は、約29,903ヌクレオチドの塩基配列を持つ+センス一本鎖RNAウイルスで、約14の遺伝子からなる約27個のタンパク質を構成している[1,2]。非構造タンパク質(nsp 1-16)を含み、nsp 12はRNA依存性RNAポリメラーゼ(RdRp)として知られており、COVID-19の治療薬として期待されているレムデシビルの標的となるウイルスのRNAコピーを増やす役割を果たしている。構造タンパク質には、スパイク(S)エンベロープ(E)膜タンパク質(M)ヌクレオカプシド(N)タンパク質がある(図1)。Sタンパク質は、コロナウイルスの名前の由来となった王冠状のスパイクを作る。その他のタンパク質は付属タンパク質である。
図1. SARS-CoV-2タンパク質のアノテーション
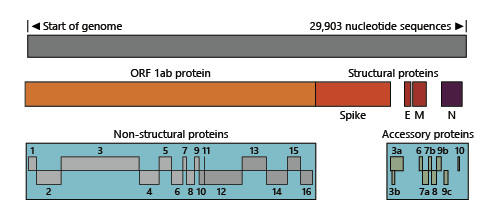
SARSは重症急性呼吸器症候群、CoVはコロナウイルス
SARS-CoV-2によって誘発された免疫応答や免疫原性の理解については、過去4~5ヶ月の間に膨大な科学的文献が作成されてきた。ここでは、COVID-19患者における自然免疫と適応免疫、そして免疫調節に寄与する可能性のある他の因子について検討した。
軽度と重度のCOVID-19患者における免疫応答生成の違い
COVID-19における免疫応答生成の模式図を図2に示す。軽度のCOVID-19症例と重度のCOVID-19症例における免疫の差が生じる要因は多く存在する。それらのいくつかは以下のように記載されている。
図2 COVID-19における免疫応答生成 COVID-19,コロナウイルス病
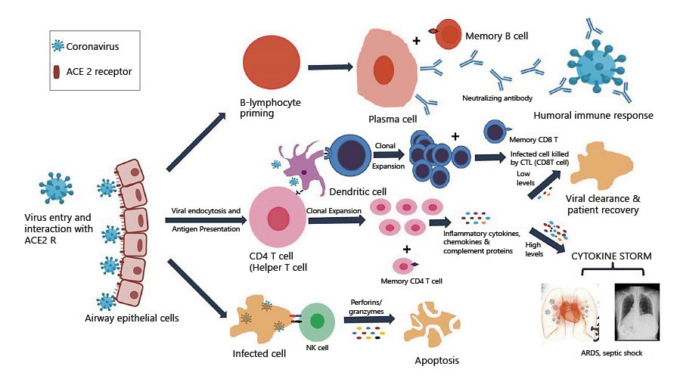
ウイルスクリアランスにおける自然免疫の役割
SARS-CoV-2は主に上・下気道細胞のII型肺細胞に感染する。スパイクタンパク質の受容体結合ドメインは、宿主細胞の膜結合型アンジオテンシン変換酵素2と相互作用し、宿主細胞内への侵入を促進する[3]。細胞内に侵入した後、ウイルスは複製し、より多くの細胞に感染する。ウイルスの数が増加すると、宿主細胞はピロプトーシスを起こし、核酸やASCオリゴマーなどの損傷関連分子パターン(DAMP)を放出する。これらのDAMPは、肺上皮細胞、内皮細胞、肺胞マクロファージ上に存在するパターン認識受容体によって認識され、炎症性サイトカインやケモカインの生成を誘発する。RIG-1,MDA-5,およびTLR3によるウイルスRNAの認識は、あらゆるウイルス感染から保護するタイプIインターフェロン産生(IFN-αおよびIFN-β)を誘発する。試験管内試験研究において、Lokugamageら[4]およびMantloら[5]は、SARS-CoV-2がIFN-I前処理に敏感であることを実証した[4,5]。しかし、SARS-CoV-2感染の場合、インターフェロン刺激遺伝子の役割を解明する必要がある。
若い個体では、ウイルスDAMPを認識した後、直ちにI型インターフェロンが分泌され、ウイルスの複製が抑制される[6]。おそらく、陽性例の大半が無症状である理由はこれにあると思われる。しかし、併存疾患を持つ高齢者では、免疫の老化により、IFN-I産生が遅れると、単球、マクロファージ、好中球などの炎症性細胞のさらなるリクルートを引き起こす可能性がある。これらの細胞は、重度の急性呼吸器症候群を引き起こす肺胞を損傷するサイトカインストームとして知られている巨大な炎症性サイトカインを分泌する。それはその後、危険な低血圧を引き起こす敗血症に変わり、複数の臓器システムを損傷させることができる[7]。ニューヨークのPetrilliら[8]が4,103人の患者を対象に行った研究では、炎症性マーカーであるC反応性タンパク質とDダイマーの初期上昇が見られ、これらの上昇は患者の人工呼吸器サポートの必要性や死亡と最も強い関連性を持っていた[8]。
ナチュラルキラー細胞
ナチュラルキラー(NK)細胞は、ウイルスに感染した細胞を殺す大きな粒状のリンパ球である。重症COVID-19患者では、末梢血単核球中のNK細胞の数が、年齢が一致しない重症COVID-19患者と比較して有意に減少していることが報告されている[9-12]。NK細胞は非居住性の肺細胞であるが、COVID-19患者の肺では、ケモカイン受容体CXCR3を介して、単球やマクロファージから分泌される化学吸引性リガンドに向かって末梢血から肺に浸潤することができる[13, 14]。Wilkら[15]は、NK細胞における細胞内グランザイムBレベルの低下を報告しており、重度のCOVID-19患者ではNK細胞の細胞毒性が低下していることを示している。
補体の活性化と高炎症
補体系は自然免疫応答の一部であり、細菌感染から保護する炎症反応の開始に関与し、しばしば侵入したウイルスを中和する。共通経路に収束する3つの経路を持つ[16]。古典的な経路の活性化は、免疫複合体、特定の表面抗原と病原体表面上のマンノース残基の結合によって誘導されるレクチン経路によって引き起こされる代替経路によって起こる。共通経路には、炎症反応を誘発するC3aおよびC5aの産生が含まれる。SARS-CoV-2関連ARDSの発症における補体活性化の役割に関する臨床データは非常に限られている。最近の研究では、重度のCOVID-19患者からの肺生検サンプルが補体レクチン経路の活性化を示し、異常なC3a生成およびC3-フラグメント沈着を示したことが報告されている。また、血清C5aレベルの有意な上昇も観察された。重要なことに、抗C5a抗体で患者を治療すると、肺酸素量の増加および全身性炎症の減少によって測定されるように、臨床的な改善が即座にもたらされた[17]。COVID-19の重症患者の中には血栓塞栓症を示した患者もおり、これは血栓性炎症過程に起因していると考えられる[18, 19]。SARS患者の剖検報告では、病原性補体の活性化を含む多くの異なる臨床シナリオで起こりうるウイルスの浸潤を伴わない凝固症も示されている[20]。SARS-CoV-2によって誘導される補体経路の抑制されない活性化は、急性および慢性炎症、内皮細胞機能不全、血栓形成、血管内凝固に大きな役割を果たし、最終的には多臓器不全および死に寄与する。Risitanoら[21]は、補体カスケードの活性化が不適応な炎症反応を引き起こす可能性があることを報告している;したがって、補体C3およびC5の阻害は、重症COVID-19患者のSARS-CoV-2誘発性高炎症に対して治療の可能性があると考えられる。
適応免疫とT細胞およびB細胞応答
適応免疫応答にはTリンパ球とBリンパ球が関与している。細胞を介した免疫はTリンパ球によって、体液性免疫はBリンパ球によって駆動される。ウイルスが細胞に感染すると、ウイルスペプチドは上皮細胞、単球、樹状細胞などの核細胞のMHCクラスIに担持される。これらのウイルスペプチドは、細胞傷害性Tリンパ球(CD8 T細胞)によって認識され、感染した細胞はその後、アポトーシスによって細胞傷害性Tリンパ球によって死滅する。また、ウイルスの分泌タンパク質はクラスIIのMHC分子に担持され、CD4 T細胞(ヘルパーT細胞)のT細胞受容体と相互作用する。CD4 T細胞はIL-2やIL-6などのサイトカインを分泌し、ウイルス特異的なB細胞の増殖を助ける。B細胞は血漿細胞と呼ばれる分泌細胞となり、記憶細胞や血漿細胞はウイルスを中和するために特異的にIgM、IgG、IgA抗体を分泌する[16]。これらの過程は少し時間がかかる。COVID-19の場合、SARS-CoV-2に対する急性抗体反応は、症状発症後19日以内に発現することが示唆されている[22]。IgGとIgMの血清転換は同時にまたは順次起こった[22]。
Juら[23]は、COVID-19患者の血漿中にSARS-CoV-1 SおよびNタンパク質とMERS-CoV Sタンパク質との交差反応性がある程度認められたが、SARS-CoV-1およびMERS-CoVのRBDとの交差反応性は認められなかったと報告している。また、COVID-19患者の血漿はSARS-CoV-1やMERS-CoVを中和しなかった[23]ことから、SARS-CoV-2とSARS-CoVは免疫学的に区別されていると考えられる。SARS-CoV-2のさらなる感染を防ぐためには、メモリーB細胞応答が重要である。Baoらによるアカゲザルを対象とした研究[24]では、一次感染を解消したマカクはSARS-CoV-2に対する免疫を獲得し、再チャレンジから 28日後にはCOVID-19の症状が現れなかったことが示されている[24]。この研究は、COVID-19に対する試験中のワクチンから保護免疫が生成される可能性があることを示唆するものである。しかし、時期の関係で長期記憶反応はまだ研究されていない。
COVID-19におけるCD4およびCD8 T細胞
いくつかの研究で、COVID-19患者のCD4およびCD8 T細胞数の有意な減少に伴うリンパ球数の減少が報告されている[24-27]。重度のCOVID-19症例では、CD8 T細胞が大幅に減少していたが[24, 26, 27]、軽度のCOVID-19症例では、CD4およびCD8 T細胞数は正常またはわずかに増加していた[28, 29]。現在のデータは、COVID-19患者におけるCD8+ T細胞応答のパターンが多様である可能性を示唆している。回復した患者におけるSARS-CoV-2特異的CD8 T細胞が、多くの回復期患者におけるCD8 T細胞記憶の証拠を提供することを示唆する報告はほとんどない[30,31]。
Zhengら[12]は、細胞障害性T細胞およびNK細胞においてNKG2Aの発現が増加したが、グランザイムb産生のレベルが低下したことを報告している。また、回復したSARS-CoV-2感染者ではNKG2A+細胞障害性リンパ球の割合が減少しており、COVID-19の初期段階ではNKG2Aの発現が細胞障害性リンパ球の機能的枯渇や疾患の進行と相関している可能性を示唆している[12]。これまでに発表された報告では、COVID-19はT細胞の減少だけでなく、機能的疲弊の両方と関連していることが示されている。
SARS-CoV-2に対する実際のCD4およびCD8 T細胞応答、中枢性、エフェクターメモリーT細胞生成を明らかにする研究は限られており、COVID-19患者における正確なT細胞応答を明らかにするためには、より多くの研究が必要である。ウイルス特異的CD8 T細胞応答は、測定が困難なSARS-CoV-2の細胞介在性破壊を理解する上で重要である。
免疫力と疾患の重症度に影響を与える可能性のあるその他の要因
年齢
若年者と老年者では免疫力に差があることはよく知られている。そのため、年齢もリスク要因の一つと考えられている。高齢者や慢性疾患のある人はリスクが高い。中国のデータによると、COVID-19の高齢者は若年者に比べてリスクが高いとされている[32]。中国のデータの最近の分析では、COVID-19患者の死亡確率は80歳以上の患者では13%以上であるのに対し、30代の患者では約0.15%、20代以下の患者では実質的に0%であったと報告されている[32]。
民族性
COVID-19に対する民族性の影響はまだ確立されていないが、米国の新たなデータによると、黒人/アフリカ系アメリカ人(人口10万人あたり92.3人)およびヒスパニック/ラテンアメリカ人(74.3人)の死亡率は、白人(45.2人)やアジア人(34.5人)よりも実質的に高いことが示唆されている[33]。英国のプレプリント研究では、年齢/性/合併症を調整したCOVID-19患者の重症度転帰には、民族性自体の有意な影響は認められなかった[34]。いくつかの民族グループで観察されたより高い罹患率と重症度は、社会経済的、文化的、またはライフスタイルの要因、遺伝的素因、または感染に対する感受性または反応における病態生理学的差異と関連している可能性がある [35]。
併存疾患
重症または致死的なCOVID-19を発症したCOVID-19患者は、高血圧、肥満、糖尿病、喘息、腎臓病、慢性閉塞性肺疾患、または慢性炎症性疾患など、少なくとも1つの主要な基礎疾患を有する可能性が不均衡に高いというデータが出てきている[8]。肥満は、これらの併存疾患の主な危険因子であり、より一般的には代謝性健康障害の危険因子であり、肺炎のリスク増加にも関連している[36]。COVID-19患者における合併症のリスクをよりよく推定するためには、BMIや代謝パラメータなどの体格特性の測定が極めて重要である。肥満は、若年者にもリスクを高める危険因子である。一方、肥満は修正可能なリスクパラメータである。それにもかかわらず、ほとんどの場合、大量の減量は困難である。この点では、肥満でメタボリックヘルスを達成することは、心血管疾患のリスクを低下させるだけでなく、COVID-19の重症化コースのリスクも低下させることが期待されることに言及しておくことが重要であろう[37]。
食事
免疫力を高めるためには、正しい食事も同様に重要である。そのため、バランスのとれた食事が常に推奨されている。食物繊維を多く含む食事は、腸内微生物を強化して免疫力を強化し、免疫力を高めることが証明されているので、よく眠るのに役立つ。ビタミンDもまた、免疫力を高めるのに役立つ。ビタミンDは日光に反応して体内で生成され、健康に大きな効果を発揮する。ビタミンDの欠乏は、感染症のリスクを高める可能性がある。世界の人口の大半はビタミンDが不足している。したがって、一日の必要量を満たすためには、ビタミンDを豊富に含む食品が必要である[38-40]。ヨガや適度な運動も免疫力の強化に役立つ[41]ので、ヨガや適度な運動を定期的に行うことで免疫力が強化される。ストレスは免疫力を低下させるので、パニックになったり、ストレスを感じたりしてはいけない。免疫力が強いと、感染の初期段階でウイルスを殺すことができる。
集団免疫力
大多数の集団がある感染因子に対して免疫を持っている場合、感染しやすい個体が感染している個体に接触する可能性は非常に低く、感染しやすい個体が感染する可能性は低い。これは集団免疫として知られている[16, 42-45]。SARS-CoV-2の広範な免疫を構築する方法としては、
(a)全世界の集団に時間をかけてウイルスを自然に免疫化する方法と、(b)全世界の集団に効果的で安全なワクチンを接種する方法が考えられる。前者の方法では、ウイルスの自然感染により何百万人もの人々が死亡する可能性があり、ICUでの治療を必要とする病人が急増して病院を圧迫することになる。制限を課すことによってそれを遅らせることは、医療システムが免れ、命が救われることを意味する。したがって、ワクチンがない場合には、集団免疫の確立を最終目標とすべきではない。
結論
SARS-CoV-2の中国武漢から6大陸への急速な感染拡大は、基礎科学と臨床研究の両面で急務となっており、日々生み出される膨大な情報量に目を見張るものがある。SARS-CoV-2感染症の免疫学的理解については、短期間で大きな知見が得られている。世界の疫学的データから、SARS-CoV-2の感染は、SARSやMERSなどの従来のコロナウイルスに比べて感染率が高いことが示唆されている。ここでは,COVID-19感染者のNK細胞機能,補体活性化,インターフェロン産生などの自然免疫をレビューし,体液性免疫や細胞介在性免疫の観点から適応免疫反応を明らかにした。しかし、重症COVID-19患者と軽症COVID-19患者の免疫応答生成の違いについては、より多くの研究が必要である。世界中でSARS-CoV-2を対象に実施されている研究の成果は、このアンメットニーズを満たすための強固な枠組みを提供するものと思われる。
利益相反に関する声明
著者らには申告すべき利害関係はない。
