Contents
Evaluating the link between Paraoxonase-1 levels and Alzheimer’s disease development
www.ncbi.nlm.nih.gov/pmc/articles/PMC7451062/
オンラインで公開2018年10月11日
要旨
認知症の中で最も一般的なアルツハイマー病の病因は、現在のところ完全には解明されていない。近年では、アミロイドβペプチドが神経変性疾患の病因における中心的な役割を果たしているのではないかとの疑念も浮上してきており、他の仮説も浮上している。特に、これらの理論モデルの多くに共通しているのは、酸化ストレスであり、このストレスが疾患の発症および/または進行に関与していることが広く提案されている。
パラオキソナーゼ1(PON1)は、高密度リポタンパク質(HDL)に関連する酵素であり、リポタンパク質および細胞の脂質成分に対する酸化的損傷を対比し、特定の有機リン系殺虫剤の毒性から保護する能力を含む、複数の生物学的機能を担体に付与する。PON1の特異的な多機能性の性質は、血清PON1活性の低さと心血管疾患や神経変性疾患、特にアルツハイマー病を含むいくつかの疾患のリスクとの間の密接な関連性を示す膨大な疫学的データを説明するための鍵となるかもしれない。
このレビューでは、PON1とアルツハイマー病の発症との関連性について議論し、疫学的観察から説明しうる最終的な機序的経路を仮説化する。また、PON1がアルツハイマー病を含む人間の健康に及ぼす影響を明確に把握するには、方法論的な限界があることを明らかにした。
キーワード
パラオキソナーゼ1,酸化ストレス、アルツハイマー病
序論
ヒトパラオキソナーゼ1(PON1)は、基本的には肝臓で発現し、血液中に分泌されるカルシウム依存性の酵素で、主に高密度リポ蛋白質(HDL)と結合する1 。この酵素活性が低下すると、酸化ストレス(OxS)や炎症の悪化による悪影響を打ち消す能力が低下する可能性がある。Ex vivoおよび試験管内試験での研究では、PON1がマクロファージからのコレステロール排出を媒介していることが示唆されており、これは逆コレステロール輸送の第一段階となっている。
現在のところ、この酵素の生理的役割は完全には解明されていない。PON1 は、特定の有機リン(OP)化合物の有害代謝物の加水分解における役割について最初に研究された。1991年、Macknessらは、低密度リポタンパク質(LDL)の酸化を防ぐPON1の能力を実証した3。これを裏付けるように、多くの疫学研究やコホート研究により、心血管疾患患者はこの酵素の血清活性が低いことが示され、動脈保護におけるPON1の役割について説得力のある議論がなされていた4-8 興味深いことに、同様の関連性は、糖尿病、メタボリックシンドローム、家族性高コレステロール血症、炎症性関節炎など、血管障害、全身性炎症および/または酸化ストレスが病原体となっている他のいくつかの病状においても見出されている9-12。
血管系の問題は、高齢者に最も多い神経変性疾患の一形態であるアルツハイマー病13,14の発症に寄与する可能性がある。脳血管(および末梢)の動脈硬化、および神経病理学的異常[アミロイドβペプチド(アミロイドβ)および神経原線維のもつれ(NFT)]は、相互に相互作用してアルツハイマー病の発症と進行を促進する。一方で、脳血管の動脈硬化に伴う低灌流・低酸素は、アミロイドβオリゴマーの産生を促進する可能性がある。一方、アミロイドβは血管の酸化ストレスや炎症過程を介して動脈硬化性病変の形成を促進する可能性がある。
我々の研究15,16や他の研究17-20では、アルツハイマー病患者における血清PON1活性の低下が報告されており、この酵素がアルツハイマー病の病態形成に関与している可能性が示唆されている。PON1の抗酸化機能はアルツハイマー病予防に重要であるだけでなく、有機リン農薬の特定の代謝物を無害化する能力も重要である。実際、これらの毒性物質への高暴露と アルツハイマー病 の発症との関連性を記述した科学的証拠がある21 。
本レビューでは、アルツハイマー病におけるPON1の意義について、現在の知見を要約し、批判的に検討する。
2. PON1:酵素の生化学と生理機能の主な特徴
2.1. PON1の非生理的基質と(仮説的な)生理的基質
PON1とパラオキソナーゼファミリーの他の2つのメンバー、細胞内PON2と細胞外および細胞内PON3は、3つの連続した遺伝子によってコード化されており、かなりの配列同一性(〜60%)と同様の触媒機構を共有している。それらの名前は、有機リン殺虫剤パラチオンのオキソン代謝物であるパラオキソンを加水分解するPON1の試験管内試験能力に由来している。しかし、PON2とPON3はパラオキソンを加水分解することができず、PON1は生体内でパラオキソンを無害化するのに効率的ではない22 。
24,25 リポ蛋白質を構成する脂質やタンパク質は、PON1の単なるアンカーとしての役割だけでなく、その活性を触媒する役割も果たしている。特に、リン脂質、アポリポ蛋白質A1(ApoAI)およびマイナーな範囲では、ApoE、ApoJおよびApoMは、PON1の触媒活性のための最適な環境を維持するために不可欠である26。
PON1の触媒過程には、まだ解明されなければならない重要な側面がたくさんあるが、最も重要な問題は、生理的基質の真の性質に関係している。解決したPON1は、芳香族エステル、好ましくは酢酸のエステル、有機リン殺虫剤や神経剤の特定の代謝物、芳香族および脂肪族ラクトンに至るまで、非常に多様な分子を加水分解することができる。この特異な特性は、深部疎水性活性部位の顕著な構造適応性によるものである。有機リンと芳香族エステル(およびそれぞれの誘導体)はいずれも人工物であるため、これら2つの化学物質のいずれも酵素の天然基質となりうるものとは考えられなかった。一方、PON1の基質であるラクトン類には、生理的・病理学的条件で細胞内で産生される分子が含まれている。PON1 の暫定的な結晶構造と部位特異的進化のような高度な技術を用いて、PON1 が他にも様々な酵素活性を持つリポラクトナーゼ酵素であることが確認された1,26,27,28。
2.2. PON1の生物学的機能
2.2.1. 人工毒性物質からの保護
PON1は、有機リン農薬や神経剤の酸化的脱硫に由来する有害代謝物を肝チトクロムP450系で加水分解することにより、特定の有機リン曝露から保護する。
PON1遺伝子は、広範囲に研究されてきたコーディング領域に2つの共通の一塩基多型(SNP)を有する。22,23,29 L55M SNP は酵素の濃度に影響を与えるが、Q192R はパラオキソン、クロルピリホスオキソン、神経剤サリンとソマンの加水分解における PON1 の触媒効率に顕著かつ選択的に影響を与える。
現時点では、有機リン感受性の駆動におけるPON1の役割のための最も説得力のある証拠は、動物実験から来ている23,30 低いPON1血清活性を持つ動物種は、高い活性レベルを持つ種(例えばウサギやラット)よりも有機リン曝露(例えば鳥類)に敏感である。一貫して、Pon1ノックアウト(KO)マウスは、野生型マウスと比較して、クロルピリホスオキソンおよびジアゾゾンへの曝露にはるかに敏感であった26, 22 Pon1 KOマウスにおける精製ヒトPON1の注入は、これらの有機リンsに対する保護を可能にした23. さらに、Pon1 KOマウスに高純度ヒトPON1192アリフォームを注入したところ、生理的条件下では、各アリフォームの触媒効率が特定の有機リンsに対して異なる保護効果を示すことが示された27。興味深いことに、PON1R192オールフォームがより効率的にパラオキソンを加水分解したとしても、どのオールフォームもパラオキソン曝露に対する保護を提供しなかった。マウスPon1をノックアウトしたが、ヒトPON1192のいずれかのアロフォームを発現するトランスジェニックマウスを用いた実験の結果は、Pon1 KOマウスに精製PON1192アロフォームを注入して得られた結果と一致していた31。
PON1と有機リンへの曝露については、ヒトでの研究が数多く行われている。Mackness らは、PON1R192 アロフォームを持つ農家では、羊のディッピング中に 有機リン(ジアジノン)に曝露された場合、PON1Q192 を持つ農家よりも慢性疾患を報告するリスクが高いことを報告している。
ヒト集団における PON1 活性の初期の研究では、同じ PON1192 遺伝子型内の個体間で高いばらつきがあることが示された。2つの異なる基質を使用してPON1活性値をプロットすると、3つのPON1192表現型(QQ、QRおよびRR)からの個体を解決することができる。ヒトの疫学研究では、SNPを調べるよりも、有機リン曝露に対する感受性を決定する最も重要な因子である個々のPON1活性レベルまたはPON1の状態を決定することが最も重要である。
PON1の発現は年齢によって調節され、ヒトでは6ヶ月から24ヶ月後に成人レベルに達することに留意すべきである。したがって、乳児は胎内及び産後の曝露に対してより敏感である37。
2.2.2. LDL、マクロファージ、および内皮細胞に対する酸化的挑戦からの保護
いくつかの重要な前提条件と用語の定義は、現在PON1の生理学的な役割であると考えられているものを概説する前に行われなければならない。
生体分子に対する慢性および/または急性の酸化的挑戦は、生化学、生理学、臨床病理学ではあまり定義されておらず乱用されている用語の一つである「酸化ストレス」と呼ばれることが多い「負の」影響である。最も使用されている定義の一つによると、酸化ストレスは、反対する力の間の生理的酸化還元平衡状態を維持するために失敗した結果とみなすことができる38;フィールドでの選手の名前を与える。酸化ストレスは、外因性(栄養素、喫煙、汚染など)または内因性(例えば炎症)因子によって引き起こされる活性酸素(または他の反応性種)の過剰な生成が、抗酸化物質によって効果的に打ち消されない場合に発生する。脂質過酸化は、酸化ストレスを生物学的損傷/疾患に橋渡しするため、この「壊れたバランス」の最悪の結果の一つである。細胞膜およびリポタンパク質中の多価不飽和脂肪酸(PUFA)は、活性酸素攻撃の主要な標的である。過酸化鎖プロセスが停止または遅延されない場合、生物学的標的の劇的な構造変化を引き起こし、その結果、機能障害(膜)または有害因子(例:LDL)の変換につながる。39 抗酸化物質は、様々なレベルで、異なるメカニズム(多くのレビューに網羅的に記載されている)によって、この有害なプロセスを対比させることができる。
生体内試験での影響はまだ明らかになっていないが、PON1は考えられるように修復抗酸化物質に分類される可能性がある1,43。過酸化生成物であるリポラクトンの加水分解は、脂質層全体の酸化損傷の伝播を遅らせる。特筆すべきことに、PON1 は、プロオキシダントであるホモシステインの細胞毒性代謝物であるホモシステインチオラクトンを加水分解することもできる。
現在、PON1の抗酸化プロパティーは、LDLの酸化を抑制する能力など、HDLの抗動脈硬化機能に大きく貢献していると考えられている。酸化LDL(ox-LDL)は、内皮細胞の活性化、機能不全、死、動脈硬化プロセスの原因の発症と進行を促進することはよく知られている。
内皮の損傷は、接着分子や化学活性化サイトカインの発現を引き起こし、それによって免疫細胞の活性化と遊走を刺激し、炎症過程を悪化させ、最終的には動脈硬化性プラークの形成につながる46。
注目すべきは、PON1の血管保護作用はLDLに対する作用に限定されないことである。HDL関連酵素はまた、免疫細胞、プライマリ常駐マクロファージ、内皮に対する酸化的障害に対する抗酸化シールドとしても機能する。特に、PON1の抗酸化活性を介して、HDLは単球/マクロファージの分化、移行、炎症反応を抑制し、マクロファージのコレステロール生合成を阻害し、これらの細胞からのコレステロールの排出を刺激する。
3. アルツハイマー病におけるPON1
PON1 の多面性は、多発性硬化症48,49 自閉症50,51 血管性痴呆48,52 や アルツハイマー病 などの神経疾患を含む複数の疾患におけるこの酵素の関与を説明する可能性がある16,18,53。
わかりやすくするために、以下の段落は3つのテーマ別に構成されている。
1)に関する現在利用可能な主な情報:疫学、病態生理学、病因発生のメカニズム、
2)PON1とアルツハイマー病の関係を探求する(ほとんどが疫学的)研究からの最も強調された証拠の選択、
3)トピックに関する研究の限界と課題、および
4)PON1と疾患の間のリンクを説明するための可能性のある機序論的仮説。
3.1. アルツハイマー病:疫学、病態生理、病因発生のメカニズム
認知症は、記憶、言語、行動などの認知機能の低下が進行し、日常生活動作を行う能力が失われることを特徴とする臨床症候群である。
2015年の世界の認知症患者数は4,600万人以上と推定され、2050年には1億3,150万人に達すると予測されている。アルツハイマー病の最も初期の最も顕著な症状は記憶力の低下であり、海馬と隣接する皮質構造の病理学的変化に起因している55,56 。これらの異常は他の脳領域にも広がり、認知機能と身体機能の漸進的かつ不可逆的な低下につながる57 。
認知症には2つの主要な形態があり、家族性の早期発症型(65歳以前に発症)と、全認知症症例の95%以上を占める散発性の後期発症型がある58 。10%~15%の年換算率が広く報告されている。
現在、アルツハイマー病の確定診断は死後にのみ達成することができ、疾患の臨床的評価と病理組織学的な脳の検査の組み合わせを必要とする
アルツハイマー病の病因はほとんど不明のままである。アルツハイマー病は明らかに複雑な障害であり、多遺伝性(APOE-ε4対立遺伝子は唯一の独立した遺伝的危険因子として知られている)であり、様々な環境因子、脳血管機能障害、およびエピジェネティックな現象がその発症と進行に関与している多因子性および多面的な臨床的実体である13,14,41,55,59。
アルツハイマー病脳の神経病理学的特徴は、ミスフォールドされたタンパク質、すなわちアミロイドβペプチド(アミロイドβ1-40とアミロイドβ1-42)の沈着を伴うアミロイド斑と細胞内NFTを形成し、主に異常で高リン酸化されたタウタンパク質で構成されている60。現在のところ、アミロイドβの沈着と凝集がアルツハイマー病の主要な病原性イベントであるという仮説が最も広く支持されている14,56 。しかしながら、この「アミロイドカスケード」仮説の信頼性についてはいくつかの懸念が提起されており、他の仮説も提唱されている41,55,61 。1)ミトコンドリア機能不全、2)タウタンパク質、3)血管異常(エネルギー危機)などの仮説も立てられている。41,62 成長している実験的および疫学的証拠は、酸化的損傷が局所的(脳)に限定されたものではなく、全身レベルで反響することを明確に示唆している13,14 アルツハイマー病における末梢と脳の間のこの有害なクロストークは、糖尿病、メタボリックシンドローム、炎症を含む他の酸化ストレス関連の病態にも関与している可能性があり、これらは単に共存するだけでなく、神経変性を駆動する(および/または駆動される)可能性がある13,63-65。
3.2. PON1とアルツハイマー病の関係に関する疫学的証拠
PON1とアルツハイマー病との関係を調査している既存の疫学研究を見直すと、明らかな矛盾が浮かび上がってく。17-20,48 一方で、PON1 多型(Q192R, L55M)と アルツハイマー病 の関連性に関する所見は、非常に対照的に見える66 。このセクションの最後の部分で議論するように、この矛盾の根底にある理由は、PON1 の 3 つの活性(パラオキソナーゼ、アリールエステラーゼ、ラクトナーゼ)に対するこれらの多型の多様な影響にある。
表I 選ばれた研究で報告された軽度認知障害(MCI)またはアルツハイマー病患者におけるPON1の血清パラオキソナーゼ、アリルエステラーゼ、またはラクトナーゼ活性
| 研究-PON1活動(n) | AD | MCI |
|---|---|---|
| –Saeidi etal。2017(n = 150)20 | ||
| パラオキソナーゼ | ↓ | |
| アリールエステラーゼ | ↓ | |
| –Bednarska-Makaruk etal。2017(n = 425)* 67 | ||
| アリールエステラーゼ | ↔ | ↔ |
| -カステラッツィ他 2016(n = 724)* 48 | ||
| パラオキソナーゼ | ↔ | ↔ |
| アリールエステラーゼ | ↓ | ↓ |
| -Arslan etal。2016(n = 50)68 | ||
| パラオキソナーゼ | ↓ | |
| -アラム他 2014(n = 241)17 | ||
| パラオキソナーゼ | ↔ | |
| –Bacchetti etal。2015(n = 83)18 | ||
| パラオキソナーゼ | ↓ | |
| アリールエステラーゼ | ↓ | |
| –Cervellati etal。2015(n = 593)* 52 | ||
| パラオキソナーゼ | ↔ | ↔ |
| アリールエステラーゼ | ↓ | ↓ |
| –Wehr etal。2009(n = 226)* 53 | ||
| パラオキソナーゼ | ↔ | ↔ |
| –Bednarska-Makaruk etal。2013(n = 433)69 | ||
| アリールエステラーゼ | ↓ | |
| Erlich etal。2012(n = 632)19 | ||
| アリールエステラーゼ | ↓ | |
| ラクトナーゼ | ↓ | |
| –Paragh etal。2002(n = 110)70 | ||
| パラオキソナーゼ | ↓ | |
| -ダントイン他 2002(n = 334)71 | ||
| パラオキソナーゼ | ↔ | ↔ |
↑ : 患者では対照群と比較してPON1活性値が有意に高かった;↔ : 患者と対照群でPON1活性値に有意差はなかった
*調査対象集団には、他の認知症の患者さんも含まれている。
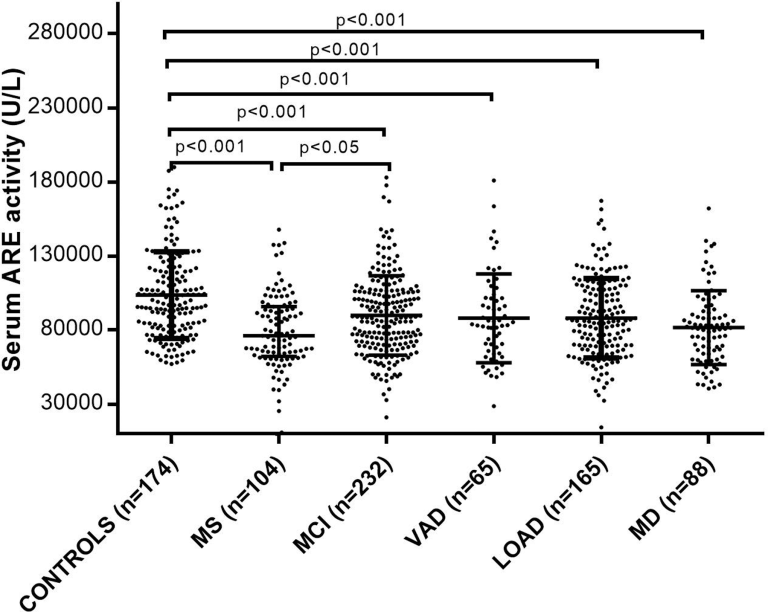
表Iに示されているように、他の同様の発表された研究18-20,69と同様に、高齢者59316と72448を対象とした最近の2つの研究では、低アリルエステラーゼはパラオキソナーゼではなく、アルツハイマー病だけでなく、MCIと血管性痴呆(血管性認知症、痴呆の2番目に一般的な形態)にも関連していることが明らかになった。図1は、この特定の研究ファイルの最大の研究に含まれている50が、異なる患者群間でのPON1活性の変動性を強調している:対照群と比較して、血清アリレスエステラーゼ活性はMCIで11%、血管性認知症とアルツハイマー病の両方で13%、アルツハイマー病とアルツハイマー病の混合型認知症で18%低下した。
図1
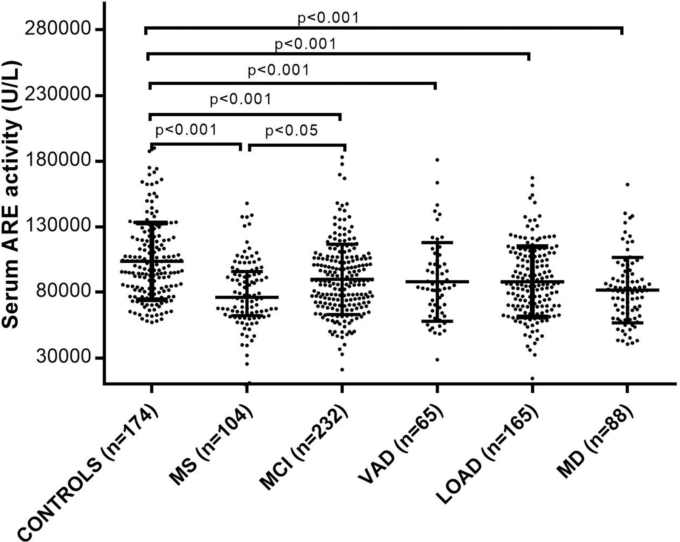
多発性硬化症(MS)軽度認知障害(MCI)混合型認知症(MD)血管性認知症(血管性認知症)遅発性アルツハイマー病(高齢発症型アルツハイマー病)の患者の血清アリールエステラーゼ(ARE)値は、対照集団と比較して有意に低かった。
横棒は中央値を示し、エラーバーは四分位間距離を示す。ペアワイズ比較の確率(p)はBonferroni post-hoc testにより算出した。
図1に表示された結果は、266人のアルツハイマー病症例と366人の兄弟非ディメンテッドコントロールでアリルエステラーゼとラクトナーゼ活性を調べたErlich et al 19によって報告されたものと一致していた。結果はまた、49 アルツハイマー病と34歳の年齢をマッチさせた対照群との間で3つの活動(パラオキソナーゼを含む)のすべてのレベルを比較したBacchettiら,18によって報告されたデータと一致していた。我々の16,48,52および他の人の53,67,71の調査とは異なるが、これらの著者はMCI患者を調査していない。我々は、アルツハイマー病に関する集団ベースの研究には、このカテゴリーの被験者を含めることが必須であると確信している。MCI状態は、ほぼ一般的に正常老化とアルツハイマー病(または血管性認知症)の中間的な状態と考えられており、これらの影響を受けた患者の50%近くがアルツハイマー病に移行する。この点から、MCI患者でアリールエステラーゼレベルが有意に低下していたことは、PON1活性レベルの変化が認知症発症の初期イベントである可能性を示唆している。MCI患者を対象とした他の研究でも、同様の傾向でアリレスエステラーゼレベルが低下していることが示されている53,67,71。最近の研究では、MCI患者におけるアリレスエステラーゼまたはパラオキソナーゼ活性のいずれかの低レベルは、年齢、性別、喫煙、高血圧、糖尿病、心血管疾患などの潜在的な影響因子に関係なく、2年以内に血管性認知症を発症するリスクが高いが、アルツハイマー病は発症しないことが示されている52。
これらの肯定的な結果とは対照的に 2012 年のメタ解析(n=10 研究)では、PON1 多型(Q192R と L55M)と アルツハイマー病 有病率との関連について一貫性のない結果が示された66 。また、疫学的研究のためには、2つのPON1192アロフォームは特定の基質の加水分解率が全く異なるため、単に遺伝子型を解析するのではなく、機能的な遺伝子型を別々に解析するか、あるいは解析においてそれらを調整することが重要である。最近のメタアナリシス(n=15研究)で示唆されたように、この役割のための最良の候補SNPはPON1遺伝子のプロモーター領域に位置している72。著者らは、これらの遺伝的変異の1つであるrs705379が白人集団におけるアルツハイマー病と正の関係があることを報告した(オッズ比=1.21,95%信頼区間:1.05-1.39)。驚くべきことではないが、このSNPは、PON1の発現とアリールエステラーゼ(パラオキソナーゼではない)活性のレベルで観察された変動のほぼ4分の1を占めており、それは他のPON1多型に起因するものよりもはるかに大きかった73このデータは、少なくとも部分的には、いくつかの例外を除いて68,70,パラオキソナーゼ活性を採用した研究のほとんどは、これとアルツハイマー病16,17,48,71との関連を見つけることができなかったという観察を説明する。
3.2.1. 発表された研究の方法論とデザインの問題
41,74 しかし、いくつかの対照的なデータもまた、この文献群から生じた。例えば、すべての研究がコントロールとMCI間のPON1活性レベルに有意な差を報告したわけではない。さらに、パラオキソナーゼ活性に関するデータは非常に可変的であり、対照群と比較してアルツハイマー病患者のレベルが変化していないか、または低下していることを示す報告がある。
これらの不一致は、この分野の研究のいくつかに影響を与えている方法論の限界に起因している可能性がある。
いくつかの研究のサンプルサイズはかなり小さい。
血清PON1活性に影響を与えるいくつかの重要な因子は、被験者登録のための除外/除外基準の定義、および/または多変量解析に含める共変量の選択において、しばしば先験的に無視されてきた。PON1研究で考慮すべき最も重要な潜在的交絡因子は、
遺伝的多型、併存疾患(例:糖尿病、高血圧、慢性腎不全、炎症性疾患、慢性肝疾患、全身性疾患、自己免疫疾患など)不顕性疾患(例:低悪性度炎症)肥満、栄養補助食品の使用(例:ビタミン、微量元素など)薬物やホルモン、年齢、性別、およびHDL-Cレベル
である。これら2つの最後の生理的因子(SNPと一緒に)がPON1の個人間変動の最大の原因である。健康そうな男性(n=90)と女性(n=341)の血清ラクトナーゼ活性とアリレスターゼ活性を比較したところ、後者の方が両方とも有意に高いことがわかった(それぞれ14%と24%、未発表の結果)。52,67 観察されたPON1活性の変化が単に反映されているだけであり、その主なキャリアのパラレルに依存している可能性があることを示す多くの報告があるため、これは重要な問題である15,78。
PON1活性の評価を行う際に念頭に置くべき最も重要な概念は、アリレスエステラーゼ活性よりもパラオキソナーゼ活性と、それ以下の範囲ではラクトナーゼ活性の方が個人間変動が大きい(主にQ192R多型による)ということである79。
MCI患者を対象とした我々の研究52を除いて、エビデンスの全容は横断的な調査から得られている。このタイプのアプローチでは、PON1活性の変化とアルツハイマー病または血管性認知症の発生との間の因果関係を定義する能力がない。
3.3. アルツハイマー病発症におけるPON1の役割
PON1 の多面的な性質は、アルツハイマー病 の発症機序における役割を説明することができる。神経変性疾患におけるPON1の意味合いは、Marsillachら80が脳を含む複数のマウス組織におけるPON1タンパク質の存在を実証したときに、より信憑性が高くなった。肝臓はPON1 mRNAを含む唯一の臓器であることを考慮すると、HDLがPON1を肝臓からその活性が必要とされる組織に移動させるためのベクターとして機能している可能性が高いことを示唆していると考えられる。興味深いことに、測定可能なPON1活性の存在が脳脊髄液で報告されている。
3.3.1. 酸化ストレスおよび有機リン毒性の全身性センチネルとしてのPON1
この時点で生じる疑問は、血液中のタンパク質がアルツハイマー病のような脳疾患の経過にどのように影響を与えるのかということである。
この疑問に対する答えの手がかりは、アルツハイマー病が全身レベルで発生している代謝/生化学的異常と密接に関連していることを示唆する最近のデータから得られるかもしれない。これらの末梢の変化は、単に二次的な中枢神経系の病理学的変化ではなく、アルツハイマー病リスクに影響を与える(または影響を受ける)可能性があり、そして/または疾患に関連した基礎的なプロセスを反映している可能性がある。この有害な脳-末梢のクロストークは、2つの、最も可能性の高い自己永続的な方法で起こる可能性がある。
脳に転送する広範な全身的な効果。例えば、糖尿病、高コレステロール血症、炎症、中年期に経験したメタボリックシンドロームは、アルツハイマー病.13を持つことのリスクを増加させる。
中枢神経系の機能不全は、全身の変化を駆動する。例えば、アルツハイマー病は身体機能の低下と体組成13,81の変化に関連付けられている
注目すべきことに、上述したすべての全身性因子は、実際に、アルツハイマー病41,74,82の患者の末梢と脳の両方を特徴づけることが示されている酸化ストレスと関連している。利用可能な証拠によれば、脳内への過剰で制御不能な活性酸素の上昇は、アルツハイマー病41,60におけるアミロイドβの蓄積とNFTの形成に先行し、寄与している可能性がある。我々のグループや他の人たちが示したように、この酸化還元不均衡は全身循環にも反映され、全身疾患としてのアルツハイマー病の仮説を支持している13,41。実際、タンパク質や脂質に対する酸化的損傷のマーカーの血清/血漿中濃度が高いことは、疾患との関連で一貫して見出されている41,74,83,84。
しかし、酸化ストレスのように、PON1レベルの低下はアルツハイマー病特有の特徴ではなく、完全に進行した、または不顕性の併存疾患を反映している可能性がある13,85。PON1は確かに広範囲に糖尿病、動脈硬化、低悪性度の炎症と逆に関連していることが判明している。遺伝的素因、生活習慣、栄養だけでなく、酸化ストレス自体(PON1はROS 86の高レベルで不活性化されている)は、PON1の活性レベルとアルツハイマー病間の観察された疫学的リンクの可能な原因として主張されている。
それは現在、原因因子とは無関係に、PON1の触媒効率の低下は、有機リン農薬へのより高い感受性の結果であることがよく受け入れられている。試験管内試験や動物モデル、疫学研究からの証拠は、長期の累積的な農薬曝露が中枢神経系への毒性効果をもたらし、アルツハイマー病や他の形態の認知症の発症に寄与する可能性を示唆している87 。しかし、これらの化合物の毒性の古典的な機構的経路は、コリンエステラーゼ酵素というユビキタス酵素群が関与している88 。
3.3.2. PON1障害は脳内コレステロール代謝に影響を及ぼす
89,90 脳内では、コレステロールは様々なレベルで アミロイドβの形成に影響を与え、可溶性異常オリゴマーの凝集と沈着を増加させ、これは アルツハイマー病 に関連した神経変性過程において重要な役割を果たす。脳内コレステロールは、特にアストロサイトとオリゴデンドロサイトによってin situで合成され、全身プールによってほぼ完全に分離されている。92 24S-ヒドロキシルコレストロール(脳内で合成される)や27-ヒドロキシルコレストロール(常在的に産生される)のようなこの脂質のヒドロキシル誘導体のみがBBBを越えることができる91,92。この多機能でほぼユビキタスな膜受容体は肝臓で主要な役割を果たしており、循環HDLからのコレステロールの選択的な取り込みを媒介している93 。重要なことに、SR-B1は肝細胞におけるHDLによるPON1の獲得94 と、マクロファージに対するタンパク質の抗炎症および抗酸化作用を媒介しているようである95 。
PON1が脳で発現していることを最近の観察80とその活性(アリルエステラーゼ)がヒト脳脊髄液で検出可能であること48は、アルツハイマー病の病因におけるPON1のより直接的な役割のための手がかりを提供している。脳内に存在する唯一のリポ蛋白質、そしてPON1の唯一の可能なキャリアは、修復とリモデリングのためのニューロンや他の細胞へのコレステロールの輸送と再分配を担当しているいわゆるHDL様粒子である92サイズ、密度、タンパク質とこれらの脳リポ蛋白質の脂質組成は、実質的に血漿HDLs.89のものとは異なる。ApoA1はHDL機能の主な決定因子であり、血清中のPON1の結合と活性に不可欠である。96 したがって、全身的に酸化されたApoA1は、効率の悪い脳内PON1に反映され、ドミノ効果によってHDL様粒子に反映され、コレステロール代謝の異常につながるという仮説が考えられる。この仮説については、アルツハイマー病患者の脳脊髄液を用いた確認的な知見が必要である。
4. 結論と今後の展望
今日に至るまで、アルツハイマー病の病因や病態についての知識にはまだ大きなギャップがある。この複雑な状況の中で数少ない確実性の一つは、この形態の認知症の多因子性と多面的な性質である。中枢神経系と末梢神経系の両方に特徴的ないくつかの代謝異常や生化学的異常が、初期の前臨床段階からアルツハイマー病の経過に影響を与えることが提案されている13,41。
コレステロール、酸化剤/抗酸化種、プロ/抗炎症性メディエーターの恒常性の乱れは、アルツハイマー病との関連で繰り返し観察されている41 。中枢神経系と末梢神経系のダイナミックなクロストークの可能性は、診断・予後バイオマーカーや予防・治療ターゲットとなる薬理学的ターゲットの研究に新たな道を開く13。
理論的には、PON1はこの両方のニーズに対応する良い候補と考えられる(図2)。
図2 PON1活性の変化とアルツハイマー病発症の関連性
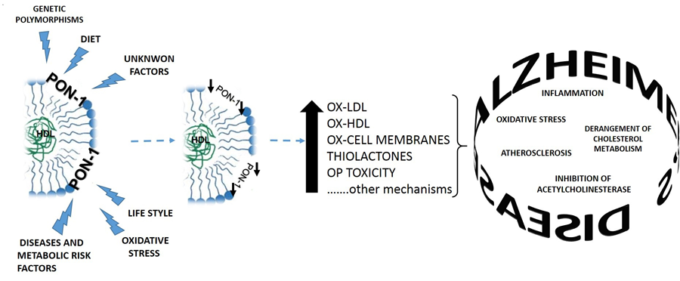
このHDL関連タンパク質は、コレステロールの逆輸送を促進することでコレステロールの代謝に関与し、酸化的課題や炎症性課題から保護する役割を果たしていると考えられている1,23。PON1はまた、脳内で発現していることの発見は、さらにアルツハイマー病の病態80と私たちとPON1活性の減少した血清レベルがどのようにリンクされているかを示している他の研究者の仕事とのこの並列は、アルツハイマー病、およびMCIを開発するリスクの増加、すなわち病気.19,48,67,71のいわゆるprodromal段階でPON1の含意のアイデアをサポートしている。
残念ながら、PON1の臨床的有用性をいまだに妨げている重要な問題もある。第一に、PON1に関する縦断的研究が不足しているため、この酵素レベルとアルツハイマー病との因果関係についての結論は不確かなままである。
第二に、心血管疾患、代謝性疾患、その他の認知症におけるPON1の役割を研究している複数の研究から示唆されているように、5,48,51,98の酵素はアルツハイマー病に対する臨床的特異性は高くないかもしれない。しかし、我々の最近の予備的なデータが示唆しているように、PON1アリールエステラーゼ活性を他の末梢性炎症マーカーや酸化ストレス99と組み合わせることで、少なくとも部分的にはこの問題に対処できる可能性がある。
第三に、PON1の生化学の理解における最近の進歩にもかかわらず、人間の健康に対する酵素の真の有益な影響はまだ不確実であり、将来的にはより多くの機能がこの酵素に帰属する可能性があり、実際に、PON1と酸化ストレス/炎症レベルとの間の逆相関、またはアルツハイマー病リスクの低下を示したヒト研究はまだないことを裏付けるのは公平である。
アルツハイマー病分野におけるPON1の正確な病原性の意義、薬理学的な可能性、診断・予後の価値を解明するためには、今後の実験的・疫学的・臨床的研究が必須である。
遺伝的素因、生活習慣(例:喫煙、アルコール乱用など)栄養素(例:ビタミンの低摂取など)併存疾患(例:糖尿病、心血管疾患など)代謝危険因子(例:インスリン抵抗性、肥満など)酸化ストレスなどがPON1活性の低下を引き起こす要因の一つである。一方、PON1活性が低下すると、次のようなことが起こる。
1)HDL、LDL、内皮細胞および免疫細胞への過酸化的損傷、
2)細胞毒性チオラクトンの形成、
3)有機リン誘発毒性膜への感受性。
最後に、これらの現象のそれぞれは、アルツハイマー病発症に関連する全身および/または脳の異常の配列を引き金にしたり、悪化させたりすることに貢献している可能性がある。