Dietary Plant Lectins Appear to Be Transported from the Gut to Gain Access to and Alter Dopaminergic Neurons of Caenorhabditis elegans, a Potential Etiology of Parkinson’s Disease
要旨
食餌植物からのレクチンは、ラットの消化管における薬物吸収を促進し、軸索および樹状突起の経路を追跡することによって示されるようにトランスシナプス的に輸送され、遺伝子送達を促進することが示されている。他の炭水化物結合性タンパク質毒素は、イヌではそのまま腸を通過することが知られている。ロダミンまたはTRITCタグ付きの食事用レクチンを給餌した後、レクチンは、トランスジェニックCaenorhabditis elegans(C. elegans)[egIs1(Pdat-1:GFP)]変異体がDAergic-Nを標識するドーパミン輸送タンパク質遺伝子に融合した緑色蛍光タンパク質(GFP)遺伝子を有する場合には、腸からドーパミンニューロン(DAergic-N)まで追跡した。このレクチンは、食用生物である大腸菌(OP50)と共に補充した。試験した9種類のロダミン/TRITCタグ付きレクチンのうち、Phaseolus vulgaris erythroagglutinin(PHA-EBandeiraea simplicifolia(BS-IDolichos biflorus agglutin(DBAArachis hypogaea agglutin(PNA)を含む4種類のレクチンは、腸からGFP-DAergic-Nに輸送されるようであった。グリフォニア・シンプリシティフォリアとPHA-Eは、GFP-DAergic-Nの数を減少させ、毒性活性を示唆していた。PHA-E、BS-I、Pisum sativum(PSATriticum vulgaris agglutinin(Succinylated)は、GFP-DAergic-Nの蛍光強度を減少させた。PHA-E、PSA、コンカナバリンA、トリチウム・バルガリス・アグルチニンはGFP-DAergic-Nのサイズを減少させ、BS-Iはニューロンのサイズを増加させた。これらの観察は、食事性植物レクチンがC. elegansのDAergic-Nに輸送され、影響を与えることを示唆しており、これはBraakとHawkesの仮説をサポートし、パーキンソン病(PD)の1つの代替の潜在的な食事病因を示唆している。最近のデンマークの研究では、膣切開により、20年間でパーキンソン病の発症率が40%低下したことが示されている。この概念的な病因モデルでは、腸や神経細胞表面の糖構造の違いが、一部の個人をより感受性の高いものにしている可能性がある。
キーワード
線虫、ドーパミン神経細胞、ドーパミントランスポーター、蛍光、植物レクチン
序論
パーキンソン病(PD)の一つの病因として、レクチンなどの食物植物性タンパク質は、小胞性の移動を伴って腸内を無傷で通過し、軸索に沿って無傷で輸送され、ドーパミンニューロン(DAergic-N)に影響を与える可能性があるのだろうか?最近のデンマークの研究では、20年前に迷走神経を切除した患者ではパーキンソン病の発症率が40%も低かったという結果が出ている(1)。菜食主義者の方がパーキンソン病の発症率が高いと主張する報告もある(2,3)。本研究では、線虫をモデルとして、食事性レクチンのDAergic-Nへの輸送を調べている。
植物レクチンは100年以上前に発見された(4)。いくつかのレクチンの毒性は、最初にBruylantsとVennemann(5)によって、独立して、認識された; WardenとWaddell(6)[Oppenheimer(7)とDixson(8)によって記述されている]。レクチンの血球凝集性は Stillmark (9) によって発見され、 レクチンによる抗原性の一般的な認識は 1890 年に Paul Ehrlich によって明らかにされた (10) 。 その後、レクチンの「免疫認識」は免疫学的研究に利用されるようになった [ 軍医の教科書 (11) 参照]。1919年、サムナーは(カナバリア・アンシフォルミス、コンカナバリンA)を結晶化させた(12)。半世紀後、研究者たちは、その糖結合特性に起因するABO血液のサブタイプを決定し始め、「レクチン」という名前が正式に作られた(13,14)。最近の研究では、レクチンが植物の防御(15)やマメ科植物と根粒菌の相互作用(16)に重要な役割を果たしていることが報告されている。
植物は種子、果実、ナッツ類に糖タンパク質-レクチン(「非免疫性糖結合タンパク質」)を含有しており(2特定の糖質を認識し可逆的に結合する(17)。これらは、植物の防御(15)とマメ根粒菌(16)に関与している。動物によって消費されると、それらは腸のタンパク質分解酵素に抵抗し、不利な消化管(GI)条件の下で機能を維持する(18,19)。それらはエンドサイトーシス(20)によって、おそらく最初に炭水化物レクチン受容体(21)に結合することによって、GI管壁を貫通することができる。驚くべきことに、無傷のレクチンは、神経線維に沿って、経シナプス的に、反行性および/または逆行性の方法で移動することができる(17, 22)。その医学的重要性は、消化管からの薬物吸収を改善するために薬物と結合されることでますます認識されるようになってきている(21,23-25)。特に現在の研究に関連して、レクチンは神経細胞の追跡研究に広く利用されている[レビュー(22, 26)を参照]。リシン(Ricinus communis)は非常に細胞毒性の高いレクチンとして、酵素的に活性で毒性のある A 鎖がエンドソームからゴルジ装置に移動した後、ガラクトース結合β鎖を介したエンドサイトーシスを介して逆行性輸送に関与することが広く研究されてきた(27, 28)。この性質は、低用量での悪性腫瘍の治療に利用されている(29, 30)。レクチンは DNA と結合して神経系の遺伝子導入を強化することも可能である(31)。ほとんどの食用植物レクチンは、腸内タンパク質分解酵素に抵抗し、通常はタンパク質にとって不利な条件下でも機能を維持している(18, 19)。トマトレクチンや小麦胚芽アグルチニンなどの非毒性のレクチンは、GI管内で成長因子活性を示すことが示唆されている(18)。細菌または寄生原虫は、それら自身のレクチンを介して、上皮細胞上の炭水化物受容体に付着し、GIおよび生殖器-尿路を植民地化する。いくつかのレクチンは、実験動物に対して局所的にも全身的にも相乗的に毒性を示す(18)。例えば、インゲン豆レクチン(PHA)は、腸管上皮細胞を損傷し、細菌の過剰増殖を引き起こし、栄養障害を誘発するが、これらの効果は、類似の末端構造を共有することでレクチンへの競合的な結合能を持つ特定の糖で阻害することで防ぐことができる(18, 32)。同様に、プロバイオティクス剤やミルクオリゴ糖などの食物糖類や糖質複合体は、レクチンの結合を選択的かつ競合的に減少させるための受容体アナログまたはデコイとして作用する可能性がある(18,33,34)。大豆レクチンは潜在的な抗がん作用を示している(35)。
複雑な環境因子は、PD を含む神経発達障害や神経変性疾患に重要な役割を果たしている(36,37)。議論の余地のある報告では、パーキンソン病の有病率が雑食者に比べて菜食者の方が高いことが示唆されている(3,38)。馬のパーキンソン病では、イエロースターアザミ(Centaurea solstitialis)やロシアンクズメ(Acroptilon repens)を摂取すると、DAergic-Nを破壊して網目状黒質部と掌蹠球に液体壊死を引き起こし、黒点脳軟化症(NPE)を発症し、ヒトの特発性パーキンソン病に類似した病理組織学的特徴を形成する(39)。これらの観察は、馬の腸から脳神経細胞への有害物質の輸送を示唆している。しかし、これまでのところ、ヒトの場合、疫学的には、食事性レクチンが神経変性疾患に大きな影響を与えることは証明されていない。中枢神経系(中枢神経系)のニューロンに加えて、消化管壁の腸管神経系のニューロンでも、レビー小体やα-SYN(α-SYN)の凝集など、パーキンソン病の特徴的な病態が見られる(40)。 α-SYNはミクログリアでも凝集し、詳細なメカニズムは明らかになっていないがパーキンソン病の原因となる(41, 42)。今回報告された知見は、消化管が「未知の病因物質」による神経細胞侵襲の潜在的な部位である可能性があり、パーキンソン病の原因となる可能性があるというBraakとHawkesの仮説を支持するものである(40, 44-47)。ここでは、1つの可能性のある病因因子が食事性レクチンである可能性が示唆されている。
線虫は、ヒトの疾患関連遺伝子の保存性が高い(65%以上)(48, 49)。線虫の八つのDAergic-Nは、環境のメカノ感覚刺激(例えば、食料の枯渇など)からのシグナルに反応し、ヒトの疾患研究を助ける分子、遺伝子、行動学的ツールを提供している(53-57)。線虫は、ドーパミンとセロトニンを用いて化学シナプス、ギャップジャンクション、神経筋ジャンクションの運動回路を仲介することで、運動行動を調節している(58-60)。腸管筋細胞は、咽頭運動ニューロンと肛門前神経節を介したバイオアミン作動性ニューロンによって神経支配されている。構造、感覚-運動シナプス、ギャップジャンクション接触、および活動はすべて哺乳類の消化管に類似している(61, 62)。
緑色蛍光タンパク質(GFP)-ドパミントランスポーター(DAT)融合タンパク質C. elegans [egIs1(Pdat-1:GFP)]の特徴は、本研究ではGFP-DAergic-Nの数、蛍光強度、大きさで評価した。一方、TRITCで標識したレクチンも給餌後に追跡し、レクチンがGI壁や神経細胞に結合または浸透する能力を確立した。問題は、食事性植物レクチンが輸送され、見かけ上DAergic-Nに障害を与えたり、変化させることができるかどうかであった。腸や神経細胞表面の糖構造の遺伝的な違いが、この概念的な疾患モデルでは、一部の個体をより感受性が高くなる可能性がある。
材料と方法
8つのDAergic-N(63,64)および標準餌のEscherichia coli(大腸菌)でGFPを発現するCaenorhabditis elegans(egIs1[Pdat-1:GFP])を、C. elegans Genetics Center(CGC、MN)から入手した。C. elegansモデルは、Institutional Animal Care and Use Committee (IACUC)の規制を必要としない。
線虫の培養
Caenorhabditis elegansを卵同期化し、OP50 5×108-5×1011 cfu/ml(65)を含むLBブロス(200μl/寒天プレートまたは250μl/ウェル)でアドリビトゥム給餌し、線虫増殖培地(NGM)寒天プレート(∅35 mm、3 ml)で増殖させ、一日おきに新しいプレートに輸送した(n = 20)。あるいは、フルオロデオキシウリジン(FUDR,0.6mM/30μl)を補充した液体培養物中で成長させた96ウェルプレート(n = 10-15/well)に播種した(66)。プレートをテープで密封し、袋に入れ、アルミ箔で覆い、実験中は20℃の低温インキュベーター(Revco Tech.、Nashville, NC, USA)で保存した。
すべての処理は、孵化後3日目に適用した。暗室での培養条件ごとに9種類のレクチンの4つの用量反応を得た。対照動物にはOP50を給与した。実験群にはTRITC/ロダミン共役レクチンを給与した。このレクチンをOP50を添加した飼料培地に組み込んだ。液体培養に移す前に、200μlの処理物を各新鮮な寒天皿に添加したか、または5μl/ウェル/週の液体培養を行った。線虫の各群は、液体培養のための最初の週の後に、前記(67)のように寒天皿培養のための15〜20日までに収集され、固定された。
大腸菌(OP50)の培養
OP50(10μl)とストレプトマイシン(10μl/ml)をLBブロス(100ml、下記参照)と混合し、インキュベーター中で37℃で16時間、4℃で最大3ヶ月間保存した。
レクチンの選択
TRITCまたはロダミンに共役した市販の植物レクチンは、EY labs(米国カリフォルニア州サンマテオVector Labs(米国カリフォルニア州バーリンガムまたはSigma-Aldrich(米国ミズーリ州セントルイス)から入手したものを使用した。使用したレクチンの用量(ミリモル)は、神経細胞のトレース(17,22,26)で発表された研究で使用されたものと同程度であった。
平均生存確率アッセイ
すべての平均生存確率(APS)アッセイは、液体培養(96ウェルプレート)で実施した。動物を同期化し、プレートの各ウェル(n=10〜15)に播種し、OP50を各ウェルに添加した。各ウェルに30マイクロリットル(0.6mM)のFUDRを添加し、動物を滅菌した。4種類のレクチン処理(50μl/処理、n = 6列)を添加した。次いで、プレートをアルミホイルで覆った。全体の手順は、蛍光体の漂白を防ぐために暗室で行った。生存動物は、すべてが死ぬまで一日おきにカウントした。
蛍光顕微鏡
FTICフィルター(480Ex/520Em)を用いてGFP-DAergic-Nを同定し、GFP-DAergic-Nの数をカウントした。GFP-DAergic-Nの蛍光強度とその平均サイズ(平方マイクロメートル)をNIS-Elements Advanced Research(バージョン3.22.11)を用いて測定し、対照群とレクチン群の間で比較した。ロダミン-レクチンの蛍光強度は、共局在化を評価するためにTRITCフィルター(580Ex/620Em)を用いて決定した。レクチンのDAergic-Nに対する効果の大きさ、GFP-DAergic-Nの数、蛍光強度(任意の単位およびサイズ(平方マイクロメートル)を決定し、各グループ間で比較した。共局在化は、最初に倒立顕微鏡(ニコン、エクリプスTi-S、日本)で同定し、その後、レーザー走査型顕微鏡(ライカ、TCS SP5,ドイツ)を用いてZ軸で確認した。
溶液と薬品
標準NGM寒天プレート(g)。NaCl 3.0 g、バクトアガー(Becton, MD, USA) 20 g、バクトペプトン 2.5 g(Becton, MN, USA)、コレステロール溶液0.1%(0.005/ml 95%エタノール)、dH2O 975mlを混合した。オートクレーブ処理した溶液(M)に添加した。CaCl2 1.0 1ml、MgSO4 1.0 1ml、KPO4 pH6 1.0 25ml。LBブロス:25.0 g、dH2O 1 l(オートクレーブ)。S塩基性溶液(M)。NaCl 0.1,KPO4 pH6 0.05,コレステロール0.1%をオートクレーブに入れた。PBS(ミリモル):NaCl115,Na2HPO4-7H2O 75,KH2PO4 pH7.
統計的解析
解析は、SAS/STAT® ソフトウェア、SAS System for Windows (Cary, NC, USA)のバージョン9.4を使用して実施した。すべての結果は、平均±SEMとして表された。生存曲線は、生存確率のサロゲートとしてロジスティック回帰モデルから得られた二項確率で表示し、平均寿命はKaplan-Meier(対数ランク)で推定した。蛍光強度データの解析には、ANOVAモデルを用いた。各群について、20匹の動物を寒天培養で分析し、10〜15匹の動物を液体培養で分析した。統計的有意性は、P<0.05と定義した。
結果
ロダミン標識レクチンPhaseolus vulgaris erythroagglutinin (PHA-E), Bandeiraea simplicifolia (BS-I), or Dolichos biflorus agglutinin (DBA)を寒天皿に、または液体培養のTRITC共役Arachis hypogaea agglutinin (PNA)を様々な濃度で添加した飼料をC. elegansに与え、その後、GFP-DAergic-Nに関連した蛍光顕微鏡で検出した(表(表1)1.1)。この観察の唯一の説明は、ロダミンまたはTRITCで標識されたレクチンが何らかの方法で腸から神経細胞に移動したということである。我々は、いくつかのレクチンが以下の効果を有することを観察した。(a)DAergic-Nの数を減少させる、(b)GFP発現ニューロンの蛍光強度を減少させる(GFP-DATを減少させるまたは(c)ニューロンの大きさを変化させることが観察された。GSL-I、Con A、Pisum sativum(PSAWGA、またはS-WGAは、ニューロンに輸送されるように検出されなかったが、それにもかかわらず、いくつかは、ニューロン測定に有意な効果を有し、これらのレクチンの未検出量が効果を引き起こしたこと、またはレクチンの何らかの原因不明の副次的効果が病理学的効果を引き起こしたことを示唆している可能性がある。
表 1 共局在化により神経細胞内で検出されたレクチン
原文参照
GFP-DAergicニューロンと共局在化したレクチン
Phaseolus vulgaris erythroagglutinin-rhodamineは、給餌後2週間以内にGFP-DAergic-Nと共局在化した(図1.1)。GFP-DAergic-Nの数は用量依存的に減少した(P<0.01,図1D)。PHA-E-rhodamineは、GFP-DAergic-Nのサブグループに共局在した(図(図1B).1B)。GFP-DAergic-Nの蛍光強度は、用量依存的に減少した(P < 0.01,図1E),1E)が、GFP-DAergic-Nの減少を示唆していた。また、GFP-DAergic-Nの平均サイズは、最高用量で減少した(P < 0.01,図1F).1F)。PHA-E-rhodamine蛍光画像サイズは、GFP-DAergic-Nの数、平均強度、および平均サイズに反比例した。APSは用量依存的に増加した(図(Figure1G).1G)。平均寿命は、中間用量(5.4×10-5 mM)で17日から23日まで増加した(39%、P<0.05,図11H)。
図1 PHA-E-ロダミンの共局在化とGFP-DAergicニューロンの減少。
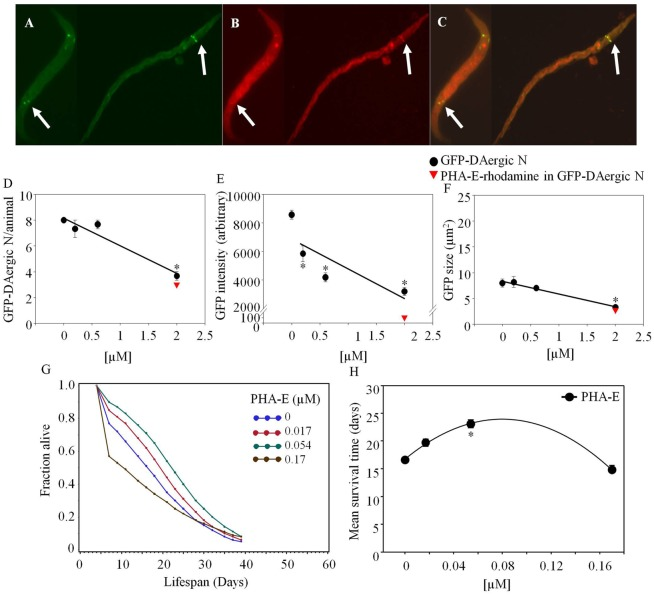
(A) GFP-DAergicニューロン。(B)いくつかのGFP-DAergicニューロンのPHA-E-ローダミン。(C) GFP-DAergicニューロンとPHA-E-rhodamineの共局在化を示すMerged (A,B)。D)動物あたりのGFP-DAergicニューロンの数の用量依存性の減少:4.4±0.3(2×10-3 mM、n = 3,P < 0.01)。E)GFP-DAergicニューロンあたりの蛍光強度の用量依存的な減少:5,837±556(2×10-4-2×10-3mM、n = 3,P < 0.01)。F)GFP-DAergicニューロンのサイズ減少:3.3±0.4μm2(2×10-3mM、n = 3,P < 0.01)。G)APSは用量依存的に増加した。H)各群の平均生存時間。*は統計的有意性を示す。
Bandeiraea simplicifolia-TRITC(Sigma-Aldrich)は、GFP-DAergic-Nと共局在化した(図(図2).GFP-DAergic-Nは用量依存的な傾向で減少した(P>0.05,図2D).2D)。DAergic-NにおけるGFP-DATタンパク質の蛍光強度は、用量依存的に減少した(P<0.01,図2E).2E)。GFP-DAergic-Nのサイズは上昇した(P < 0.01,図2F).2F)。APSはすべての用量で用量依存的に減少した(図(図2G).2G)。平均寿命は、最高用量(1.8×10-4 mM)で17日から10日に減少した(-37%、P < 0.05,図22H)。
図2 Bandeiraea simplicifolia (BS-I)-ロダミンはGFP-DAergicニューロンと共局在している。
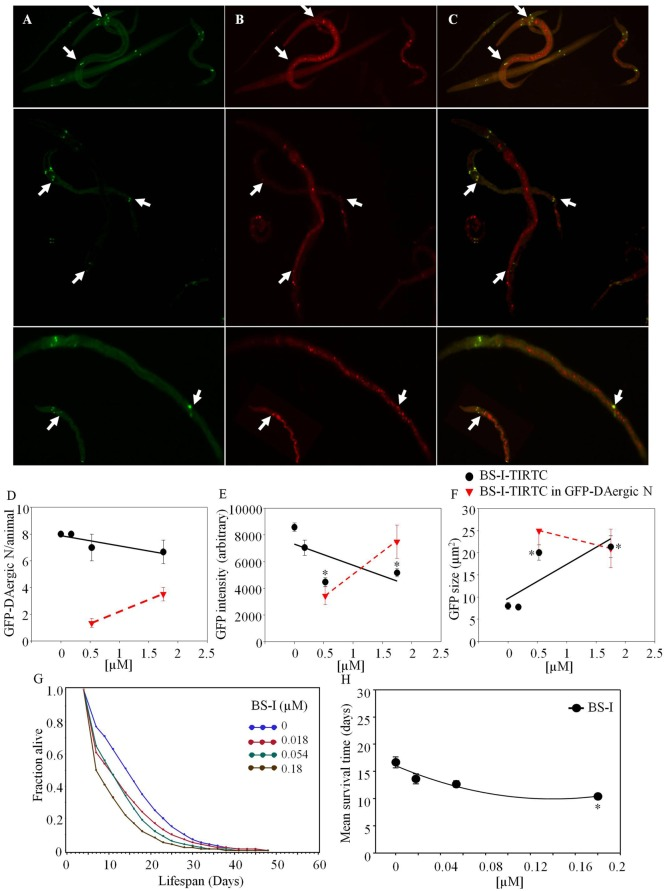
A)GFP-DAergicニューロン。B)GFP-DAergicニューロンにおけるBS-I-ロダミン(5.26×10-4または1.75×10-3 mM)。C)GFP-DAergicニューロンとBS-I-ロダミンの共局在化を示すマージされた(A,B)。D)動物あたりのGFP-DAergicニューロンの用量依存性の減少:7.0±1.0(1.75×10-4 mM)または6.7(1.75×10-3 mM)(n = 3,P > 0.05)。E)GFP-DAergicニューロンあたりの蛍光強度の減少(60%まで):4,468±332または5,166±300(5.3×10-4または1.75×10-3mM、n = 3,P < 0.01)。F)GFP-DAergicニューロンのサイズは、8.0±0.8から 20.1±1.7μm2(5.26×10-4)または21.4±2.5μm2(1.57×10-4)(n = 3,P < 0.01)まで用量依存的に上昇した。G)APSはすべての用量で用量依存的に減少した。H)各群の平均生存時間。*は統計的有意性を示す。
グリフォニア・シンプリシフォリアI(GSL-I)-ロダミン(ベクター)は、蛍光共局在化を示さず、GFP-DAergic-Nの数または大きさに影響を与えなかった(図(図3A,C)3A,C)。ニューロンの蛍光強度は、すべての用量で増加した(図(図33B))。
図3 グリフォニア・シンプリシフィコリアI(GSL-I)-ロダミンは、GFP-DAergicニューロンに影響を与えるように見える
A)GSL-Iは、GFP-DAergicニューロンの数に影響を与えなかった。B)GSL-Iは、すべての用量でニューロンの蛍光強度を増加させた(P < 0.05)。C)GSL-Iはニューロンの大きさに影響を与えなかった。*は統計的有意性を示す。
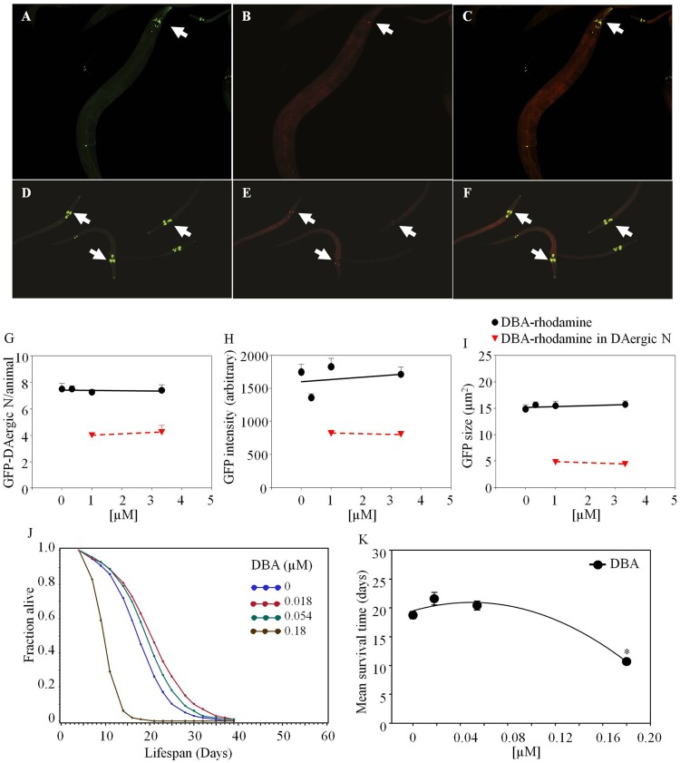
Dolichos biflorus agglutinin-rhodamineは、給餌後3日以内にGFP-DAergic-Nと共局在化した。高齢化した線虫では、高用量で50%のニューロンがDBA-ローダミンと共局在化した(図4)。DAergic-Nの数(図(図4G),4G)、蛍光強度(図(図4H),4H)、または大きさ(図(図4I)4I)は変化しなかった(P > 0.05)。2日齢の動物では、GFP-DAergic-Nの数は老化した動物と同様であり、65〜80%がDBA-rhodamineと共局在していた(図(図(図4E,G).4E,G)。) GFP-DAergic-Nのサイズは、DBA-ローダミンのより高い用量で用量依存的な傾向で減少した(P > 0.05)(データは示されていない)。日齢動物におけるGFP-DAergic-Nの蛍光強度およびサイズは、老化動物と同様であった(図(図4E,F).APSは、DBAの低用量で増加し、高用量で減少した(図(図4J).4J)。平均寿命は、最高用量(1.8×10-4 mM)で19日から11日まで減少した(-43%、P<0.05,図4K).4K)。いくつかの実験では、レクチン効果の緩和のために培地にレクチン特異的阻害糖を添加したが、効果を示すためには200 mMまでの非常に高い濃度が必要であり、高量で給餌されたこれらの糖の多元的効果が懸念された。例えば、動物はGalNAc(50 mM)の存在下で2日以内に死亡したが、これはおそらくウリジン二リン酸(UDP)の枯渇が原因である(68)。レクチン効果を相殺するために、生きた動物に食物糖を投与することの問題の別の例は、平均寿命がガラクトース(200 mM)によって19日から12日に減少したことであった(-36%, P < 0.05, 図5H).5H)。全動物に高濃度の糖類を使用することは、それ自体の効果を有していた。したがって、レクチン阻害性糖類を用いたデータは本明細書には記載していない。
図4 線虫のドリコス・ビフロラス・アグルチニン(DBA)-ロダミンは、老齢線虫と若齢線虫のGFP-DAergicニューロン(L3)に共局在
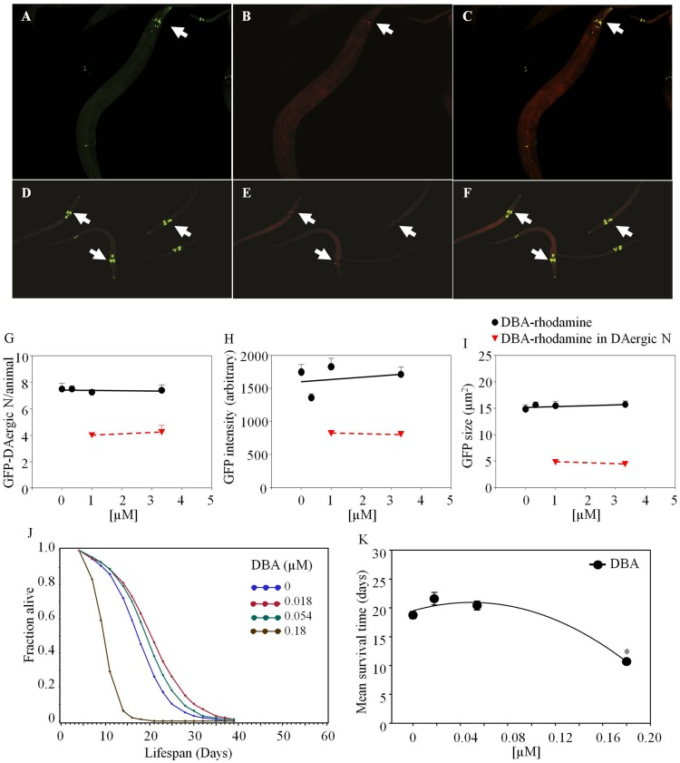
老齢動物(A)または若齢動物(D)のGFP-DAergicニューロン。老齢動物(B)または若齢動物(E)のGFP-DAergicニューロン(1.0×10-3または3.33×10-3 mM)のDBA-ローダミン。老齢動物(C)または若齢動物(F)におけるGFP-DAergicニューロンとDBA-ローダミンの共局在化を示すマージド(A,B)。(G) DAergicニューロンの数は変化しておらず(7.5,n = 5,P > 0.2)、老齢動物ではその50%がDBA-rb(1.0×10-3または3.33×10-3 mM、n = 3)と共局在化していた。(H) GFP-DAergicニューロンあたりの蛍光強度。I)GFP-DAergicニューロンの大きさは変化しなかった。これらの観察は、若齢動物でも同様に見られた。J)APSは、DBAの低用量で増加し、高用量で減少した。K)各群の平均生存時間。*は統計的有意性を示す。
図5 Arachis hypogaea agglutinin (PNA)-TRITCは、GFP-DAergicニューロン(ライカ、TCS SP5,ドイツ)と共局在化したC.elegansの給餌後
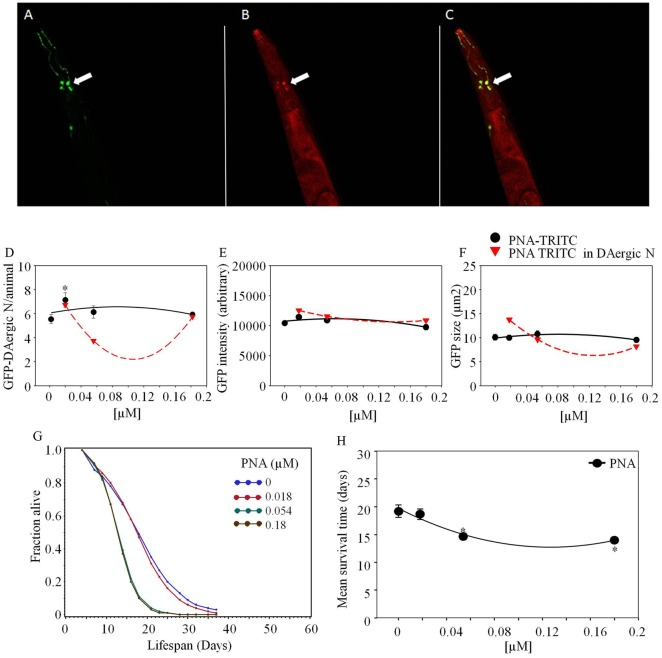
A)GFP-DAergicニューロン(緑(B)ニューロン内のPNA-TRITC(赤(C)合体した(A,B)(黄色)のGFP-DAergicニューロンの共局在。(D) 低用量でGFP-DAergicニューロン数が増加した(P < 0.05)。E)GFP-DAergicニューロンの強度は変化しなかった。F)GFP-DAergicニューロンの大きさは変化しなかった。G)APSはすべての用量で用量依存的に減少した。H)各群の平均生存時間。*は統計的有意性を示す。
Arachis hypogaea agglutininin (PNA)-TRITCは、1週間の投与後にGFP-GAergicニューロンと共局在化した(1.8×10-5,5.4×10-5,1.8×10-4 mM、図5)。GFP-GAergicニューロンの大きさや強度は変化しなかった。GFP-GAergicニューロンの数は低用量(1.8×10-5 mM, P < 0.05)で増加し、高用量で減少した。APSはすべての用量で用量依存的に減少した(図(Figure5G).5G)。平均寿命は、19から15および14日(-24および-27%、P < 0.05,図5H),5H12から16日(33%、P < 0.05)から最高用量(1.8×10-4 mM)で増加して、より高い用量(5.4×10-5 mMおよび1.8×10-4 mM)によって減少した。
レクチンは、共局在化せずにGFP-DAergicニューロンを変化させた
観察された共局在化を伴わずに、ニューロンの数、GFP強度、またはサイズを変化させるレクチンを表2に示す。
表2
原文参照
Pisum sativum-rhodamine給餌は、GFP-DAergic-Nの数を減少させなかった(P > 0.05,図6A).6A)。しかし、DAergic-NにおけるGFP-DATの蛍光強度(P < 0.001)およびサイズ(P > 0.05)は、PSA給餌により用量依存的に減少した(P = 0.8,図6B,C).6B,C)。液体培養では、GFP-DAergic-Nの数は変化せず(図(Figure6D),6D)、高用量で強度が低下し(4.3×10-4 mM, P < 0.05, 図(Figure6E),6E)、低用量でサイズが縮小した(4.3×10-5 mM, P < 0.05, 図(Figure6F),6F).6F)。APSは全ての用量で増加した(図(Figure6G).6G)。平均寿命は、より低い用量(4.3×10-5 mMおよび4.3×10-4 mM)で22日から27日まで増加した(22および23%、P<0.05,図(図66H))。
図6 Pisum sativum (PSA)-rhodamineは線虫のGFP-DAergicニューロンに影響を与えた

(A) 動物あたりのGFP-DAergicニューロン数は全体的には減少しなかった(8.70×10-4-8.7×10-3 mM, n = 6, P > 0.05)。B)GFP-DAergicニューロンの蛍光強度は高用量で減少した(651±61,8.7×10-3 mM)。C)GFP-DAergicニューロンのサイズは、高用量で18.4±0.9μm2(コントロール)から12.9μm2(8.70×10-4 mM、n = 3,P > 0.05)まで、用量依存的な傾向で減少しているように見えた。PSA-ローダミンのGFP-DAergicニューロンとの直接的な共局在化は検出されなかった。D)PSA単独では、ニューロンの数に影響を与えなかった。(E) PSAは最高用量でDAergicニューロンの強度を減少させた(P < 0.05)。(F) PSAは最低用量でDAergicニューロンの大きさを減少させた(P < 0.05)が、高用量では緩和された(P > 0.05)。G)APSはすべての用量で増加した。H)各群の平均生存時間。*は統計的有意性を示す。
コンカナバリンA(Con A)-TRITCは、用量依存的な傾向でGFP-DAergic-Nの数を減少させる軽度の効果を有するようであった(図(図7A).7A)。DAergic-NにおけるGFP-DAergic-NのGFP-DATタンパク質像の蛍光強度は、Con A給餌によって用量依存的に増加した(P < 0.05,図7B).7B)。GFP-DAergic-Nの見かけのサイズは有意に減少した(P < 0.05,図7C).7C)。Con A-TRITCは、液体培養におけるGFP-DAergic-Nの数を変化させず(P>0.05,図7D),7D)、高用量で強度を増加させ(1.9×10-4 mM、P<0.05,図7E),7E)、中間用量でニューロンのサイズを減少させ(5.7×10-5 mM、P<0.05,図7F).7F)、また、高用量では、ニューロンのサイズを減少させた(5.7×10-5 mM、P<0.05,図7F).7F)。APSは全ての用量で増加した(図(Figure7G).7G)。コンAは平均寿命に影響を与えなかった(図(図77H))。
図7 線虫のコンカナバリンA(Con A)-TRITCは、GFP-DAergicニューロンに軽度の効果があるように見えた。
(A) 高用量では、1匹あたりのGFP-DAergicニューロン数がわずかに減少した(7±0.4,P > 0.05)。B)GFP-DAergicニューロンあたりの蛍光強度は、691±45(対照、n = 3)から942±118(3.84×10-3 mM、n = 4,P < 0.05)へと用量依存的に増加した。C)GFP-DAergicニューロンのサイズは、21.4±1.8μm2(コントロール)から15.1±0.7μm2(1.15×10-3 mM、n = 4,P < 0.05)に有意に減少した。GFP-DAergicニューロンとのCon A-TRITCの直接的な共局在化は検出されなかった。液体培養では、C. elegansのCon A-TRITCは、GFP-DAergicニューロンに対して軽度の効果を有するように見えた。(D) GFP-DAergicニューロンの数は影響を受けなかった(P > 0.05)。E)DAergicニューロンの蛍光強度は、最高用量で増加した(P<0.05)。F)GFP-DAergicニューロンの面積は中用量で減少した(P<0.05)。(G) APSは全用量で増加した。H)各群の平均生存時間。*は統計的有意性を示す。
Triticum vulgaris (WGA)-rhodamineまたはWGA-TRITCは、輸送されたものとして検出されなかった(図(図8).8)。DAergic-Nの強度は増加した(P < 0.05,図8A),8A)が、ニューロンのサイズは最高用量(4.6×10-4 mM、図8B),8B)で減少した(P < 0.05)。APSはすべての用量で増加した(図(Figure8D).8D)。平均寿命は、最高用量(4.6×10-4 mM)で20日から24日まで増加した(22%, P < 0.05, 図88E)。
図8 Triticum vulgaris (WGA)-ロダミンは液体培養におけるDAergicニューロンの強度と面積に影響を与えた。

A)WGAはDAergicニューロン数に影響を与えなかった(B)WGAはGFP-DAergicニューロンの強度を増加させた。C)DAergicニューロンの面積はすべての用量で減少した(P < 0.05)。D)APSは全用量で増加した。E)各群の平均生存時間。*は統計的有意性を示す。
Triticum vulgaris (Succinylated) S-WGA-TRITC給餌は、WGA-rhodamineと同様の効果を示した。DAergic-Nの数は有意な変化を示さなかった(図(図9A),9A)が、GFP-DAergic-Nの蛍光強度は低下した(P < 0.05, 図9B).9B)。また、GFP-DAergic-Nの大きさは、用量依存的な傾向でわずかに減少した(P = 0.4,図9C).9C)。これらの場合、レクチンが何らかの定義されていない間接的な効果を持っているのか、または検出不可能な量のレクチンによる直接的な効果があるのかは明らかではない。S-WGA-TRITCを給餌したC.elegansは、液体培養において共局在化を示さなかった。GFP-DAergic-Nの数は、より低い用量(4.6×10-5 mMおよび1.4×10-4 mM、P<0.05,図9D)で減少した。GFP-DAergic-Nの蛍光強度は、すべての用量で増加した(P < 0.05,図9E).9E)。GFP-DAergic-Nの大きさは、すべての用量で減少した(P < 0.05,図9F).9F)。APSは低用量で増加し、高用量ではDO依存的に減少した(図(Figure9G).9G)。平均寿命は低用量(4.6×10-5 mM)で21日から23日(9%、P<0.05)に増加し、最高用量(4.6×10-4 mM)で12日(-43%、P<0.05,図99H)に減少した。
図9 Triticum vulgaris (Succinylated) S-WGA-TRITCは、C. elegansのGFP-DAergicニューロンに影響を与えた

(A) 動物あたりのGFP-DAergicニューロン数は、WGA-TRITCの効果と同様であった(7.3-7.0,n = 4,P > 0.5)。B)蛍光強度は、735±26(コントロール)から667±25(1.11×10-2および11.12×10-3,n = 4,P < 0.05)に減少した。C)GFP-DAergicニューロンのサイズは、高用量のみで9.2±0.6μm2(11.12×10-2,n = 4,P < 0.4)とわずかに減少した。WGA-TRITCとGFP-DAergicニューロンとの直接的な共局在化は検出されなかった。S-WGA-TRITCは、液体培養においてGFP-DAergicニューロンに影響を与えた。(D) 低用量ではGFP-DAergicニューロンの数が減少した。(E) GFP-DAergicニューロンの蛍光強度が増加した。F)GFP-DAergicニューロンのサイズが減少した。(G) APSは低用量で増加し、高用量ではドーズ依存的に減少した。H)各群の平均生存時間。* は統計的有意性を示す。
考察
9種類の植物性食物レクチンをTRITCまたはローダミンに結合させた。レクチンは、生体内試験のC. elegans(egIs1[Pdat-1:GFP])モデルで試験した。DAT遺伝子プロモーターの制御下で発現する上昇したGFP-DATは、プロモーター、転写因子、および核内受容体による増強されたDAT発現およびトラフィッキングを示す(69)。
炭水化物結合タンパク質毒素は、急性毒性物質として腸内を無傷で生存して横断することが知られており、ヒトおよび動物において重篤な生命を脅かす疾患を誘発することができる。ボツリヌス毒素の遠隔病原性は、コレラ毒素と同様に中枢神経系に障害を与える(70)。本研究では、レクチンは腸管吸収によって局所ニューロンに直接輸送され、軸索的に遠位ニューロンに輸送され、そこでは解剖学的、生理学的な病態生理学的効果を持つ可能性があるという仮説に基づいて、レクチンの新たな驚くべき特性に着目した。蛍光強度とレクチンの共局在化は、GFP-DAergic-Nへの輸送を示唆することが観察された。DAergic-NにおけるGFP-ドパミン受容体の蛍光の数と面積の変化は、レクチンの効果であることが観察された。多系統萎縮症ではグリア細胞質内包物にα-SYN が蓄積することが特徴であることから(71-73DAergic-N に影響を与えたグリア細胞とレクチンの相互作用による間接的な効果など、他の経路の関与が考えられる。レクチンは、組織化学と神経細胞のトレースにのみ使用されてきたが、以前は神経細胞毒性とは関連していなかった(26, 74, 75)。
共局在化によって検出されたGFP-DAergic-Nにおける個々の蛍光標識されたレクチンの出現と強度
4 種類のレクチン(PHA-E、BS-I、PNA、DBA)は GFP-DAergic-N のサブグループと共局在しているように見えたが、他のいくつかのレクチンは共局在が観察されない効果を示した。レクチンが検出されなかったニューロンにも効果が見られたことから、輸送されたレクチンの量が検出されなかったことや、何らかの原因不明の間接的な効果が考えられる。このように、給餌したレクチンがニューロンに検出されなかった場合でも、ニューロンの数やGFP-DAT像を評価した。他の給餌レクチンを用いたニューロンで蛍光が観察されなかった(しかし、これらのニューロンに影響を与えているように思われた)のは、様々な特性に起因すると考えられる。例えば、レクチンが検出可能な臨界点を見逃したか、レクチンが部分的に分解され、蛍光体を失ったが、ニューロンに有効な活性を保持しているか、あるいはより可能性が高い、検出不可能なレベルのレクチンが観察可能な活性を持っているかなどが考えられる。今後、ELISA、その他の免疫細胞化学的研究、または放射性標識を用いた研究により、蛍光の共局在化を伴わずに効果が観察される少量のレクチンの輸送が確認される可能性がある。
レクチンによるGFP-DAergicニューロン数の違い
4 種類のレクチン[GSL-I(BSL IPHA-E、Con A、PSA]は DAergic-N を減少させ、GSL-I が最大の効果を示した。一部のレクチンの毒性や、新たに発見されたPHAやWGAレクチンのヒトや動物への摂取による副作用が観察されており、ショ糖給餌により緩和されている(76-78)。今回の研究では、PHA-E-ローダミンは、摂取後に軸索輸送により細胞内に輸送され、C. elegansのGFP-DAergic-Nに輸送され、その数を減少させるようであった。この減少は、ニューロンと共局在したPHA-E-ローダミン蛍光の観察画像の大きさに反比例していた。このように、PHA-E-ローダミンの最大面積は、GFP-DAergic-Nの観察された数が最も少ないものと共染色している。さらに、GFP-DAergic-Nの蛍光強度とサイズの両方が有意に減少し、細胞質PHA-Eの毒性効果の可能性を示唆していた。この観察は、PHAが腸管上皮細胞を損傷することができることを示す他の研究(32,78)と一致しており、PHA-E阻害剤スクロース(78)によって防止または逆転された。興味深いことに、PHA-Eは、C. elegansのGFPニューロンの数とサイズの有意な減少を示さなかったが、GFP-DAT蛍光強度の発現の減少を示した。PSAは、いくつかの研究で、マウスの生体内試験と試験管内試験の両方で本質的に無毒であることが示されている(79)。しかし、これらの研究における短期的な毒性の測定には、神経細胞の損傷によるより微妙な長期的な影響の可能性は含まれていない。
GFP-DAergicニューロンの蛍光強度に対するレクチン供給の効果
3 種類のレクチン(PHA-E、PSA、S-WGA)は DAergic-N の GFP-DAT 蛍光を減少させ、DAT の損傷を示唆したが、BS-I、GSL-I、または Con A は DAergic-N での DAT の促進を示唆する増加を誘導した。WGAはDAergic-NにおけるGFP-DATの蛍光強度をわずかに低下させたが、DBAは不活性であった。WGAは、本研究ではGFP-DAergic-Nの数に影響を与えなかったが、他の研究室では、生体内試験のラット腸管腔では、上皮細胞の保護を低下させ、より高い透過性をもたらすヒートショックプロテインの発現を減少させた。また、WGA はヒト血小板のトロンビンを増加させ、未知の機序でマウス四肢芽細胞の間葉系細胞の脂肪形成を試験管内試験でエスカレートさせる(25, 77, 80, 81)。
液体培養では、個々のレクチンは、異なる方法でGFP-DAergic-Nの数と強度に影響を与える。GSL-I、Con A、WGA、PSA は GFP-DAergic-N の数に軽度の影響を与えた。GFP-DAergic-Nの強度は、GSL-I、Con A、WGAによって増加し、PSAによって減少した。GFP-DAergic-Nの数は減少し、GFP-DAergic-Nの強度は低用量ではS-WGAによって増加した。PNAはGFP-DAergic-Nの強度に影響を与えなかったが、低用量では神経細胞数が増加した。
GFP-DAergicニューロンの大きさ
PHA-EまたはCon AはGFP-DAergic-Nのサイズを有意に減少させ、BS-I、PSA、またはS-WGAはわずかにサイズを減少させた。これらの効果がニューロンの損傷を意味するかどうかは不明である。一方、GFP-DAergic-N のサブグループでは、DBA や WGA でニューロンサイズの増加が見られたが、これは DAT 発現を促進した可能性があるが、見かけ上のニューロンサイズの減少や増加が生理的な影響なのか、レクチンが介在する損傷を示しているのかは不明である。
GFP-DAergic-N の数に対するレクチンの効果は、PHA-E > GSL-I > BS-I > Con A > PSA > S-WGA の順に現れた。レクチンの上昇効果は、PHA-E>BS-I>WGA>GSL-I>ConAの順であった。O-linked β-N-アセチルグルコサミン(O-GlcNAc)は、細胞質および一部の核内タンパク質に共通のエピトープであり、タンパク質のリン酸化と共通の特徴を持っていることがよく知られている[レビュー(82)参照]。サブソイ量のため検出が非常に困難であるが、O-GlcNAcは、細胞の核および細胞質コンパートメント内にのみ存在し、マイトジェンや抗原活性化などの外部シグナル伝達に応答し、SerおよびThr-リン酸化タンパク質のプロファイルを変化させる(83-84)。タンパク質の修飾は、O-GlcNAcaseとO-GlcNAcトランスフェラーゼによって調節され、グルコースレベルでさえもO-GlcNAcサイクル速度を調節する。O-GlcNAcサイクリングの半減期(≦1分)の特徴は、糖尿病、心血管疾患、神経変性疾患、および癌と密接に関連している。多くのタンパク質O-GlcNAc修飾は、ヒトを含む植物および動物種全体で核細胞質コンパートメントで起こる[レビュー(82)を参照]。WGAおよび他のGlcNAc結合レクチンは、細胞質に存在する場合、このバランスに影響を与える可能性がある(我々の仮説)。PNAは、試験管内試験でのマウス軟骨細胞におけるプロテオグリカンの産生を促進することにより、細胞外マトリックスを強化する(81)。PNAと同様に、Con Aもまた、試験管内試験でマウス軟骨細胞の細胞外マトリックスを強化することが報告されている(81)。我々の研究では、Con Aは、GFP-DAergic-Nを、GFP-DAT蛍光の面積を減少させることによって変化させた。
様々なレクチンの特異的な有益な活性が報告されている(81, 85)。我々の研究では、DBAはGFP-DAergic-Nにおいて、GFP標識されたDAトランスポーターの面積を増加させる効果が観察された。この増加は、GFPがDATプロモーターの下で発現しているDATの発現およびトラフィッキングが強化されたことを示唆している可能性がある(69,86)。DBAレクチンの主要な副作用は、他の場所では報告されていない。実際、DBAは試験管内試験でマウス四肢芽間葉系細胞の軟骨形成と骨形成を有意に促進している(81)。
BS-I と GSL-I も同様の活性を示した。BS-IはGFP-DAergic-Nの強度を用量依存的に低下させた。機能的には、カテコラミン神経伝達物質である5-ヒドロキシトリプトファン(5-HTP)を含むBS-Iは、C-侵害受容体タイプ(C-繊維侵害受容体または無反応)のニューロンである小さな後根神経節ニューロンのサブグループにのみ結合する。これらのC-侵害受容体ニューロンは内臓痛を媒介し、BS-I isolectin-B4 (IB4)に対する受容体を発現する(87-89)。BS-Iはヒト血小板中のトロンビンを増加させる可能性がある(80)。関連している可能性のあるメカニズムの1つは、過剰なグルタミン酸神経伝達が神経毒性を持つことによって引き起こされるニューロンの過剰興奮であり、これはニューロンの死を引き起こす可能性がある(90)。実際、グルタミン酸刺激は、試験管内試験または生体内試験において、カルシウムのホメオスタシスの不均衡と酸化ストレスを介して間接的にDAergic神経細胞死を誘発する可能性がある(91)。これらのシステムのいくつかは、レクチンの糖結合または他の未踏の特性のいずれかによって変化する可能性がある。
液体培養では、PSA、Con A、WGAおよびS-WGAは、GFP-DAergic-Nの面積を減少させた。GSL-IとPNAは有意な変化を示さなかった。
DAergicニューロンの蛍光強度と大きさの上昇
これらの変化は、インスリン受容体とDATとの関係を反映していると考えられる。ブドウ糖は脳に不可欠なエネルギー源を提供し、神経細胞の機能を明らかに調節する(92, 93)。線虫では、高血糖はAPSを減少させ、ヒトの糖尿病に関係している。しかし、我々の研究におけるこれらの関係は、血糖/インスリン血症とDATの何らかのシグナル伝達相互作用を表している可能性がある。他のカテコラミン神経伝達物質と同様に、抑制性神経伝達物質はグリセミアに反比例しており、DAキネティクスは複雑な方法で低血糖に敏感である(94)。げっ歯類では、インスリン受容体とDATが黒質に密に存在し、インスリンはDATのmRNA発現を増加させ、血糖指数はパーキンソン病のリスクと逆に関連している(95, 96)。
レクチンはC. elegansの平均生存確率に影響を与える
レクチンは、線虫のAPSへの影響により3つのグループに分類される。(1) PHA-E, DBA, S-WGAは、低用量では増加し、高用量では減少するJ字型の効果を示した。(2) PSA, Con A, WGAは、APSに対して用量依存的に増加する効果を示した。(3) GSL-I、PNAは用量依存的にAPSを減少させた。
ボツリヌス毒素やリシンなどの神経毒は、細胞膜上の特定の受容体に結合して内部に取り込まれ、毒性を発揮する(97, 98)。同様に、レクチンは、標的とする細胞の糖質リガンドに結合して機能的になり、効果を発揮する。特定の糖質が競合的に結合し、レクチンの取り込みを阻害することもある(99)。構造的に類似したレクチンは、類似の結合受容体を共有し、お互いの結合部位を競い合う可能性がある。栄養素や細胞環境を含む複雑なGI環境は、特定のレクチンの吸収とその潜在的な生物学的影響を変化させる可能性がある(100)。
最近のデンマークの報告では、20年前に迷走神経を切除した患者は、対照集団に比べてパーキンソン病の発症率が40%低かった。食事性タンパク質が腸からニューロンへの輸送によってパーキンソン病の病因となる可能性があるとすれば、ここで仮説を立てたように迷走神経を切除することで、この病因経路を予防または減少させることができたであろう。運動障害の症状はパーキンソン病患者の典型的なものであり、自律神経系の側面の機能障害はしばしば過小評価され、例えば、消化管運動(101)、急速な眼球運動(102)などである。今回の研究では、いくつかの食用植物レクチンがGI管から線虫のDAergic-Nへと輸送される可能性があり、これらのニューロンへの直接的または間接的な影響とAPSへの多様な影響があることが示された。この観察は、BraakおよびHawkesの仮説されたパーキンソン病の未知の病因因子と関連しているか、または、例えば、パーキンソン病で発見された損傷したDAergic-Nと関連しているかもしれない(40, 47)。関連している場合、そのプロセスは、段階的であるかもしれず、相加的であるかもしれず、特定のレクチンの消費頻度に関連しているかもじれず、レクチンと他の因子との関連性によって決定されいるかもしれない。確かに、個々の遺伝的感受性、異なる細胞膜における糖構造プロファイルの変化、エンドサイトーシスへの受容性、GI内膜の障害または漏出、および食事内容からの入力の可能性がある。私たちの観察は、食用植物がなぜPD発症のリスクにリンクされているかについて、興味をそそる可能性のある説明である。
