Contents
Determining the relationship between SARS-CoV-2 infection, dopamine, and COVID-19 complications
www.ncbi.nlm.nih.gov/pmc/articles/PMC7646371/
要旨
目的
高齢者、免疫抑制症、慢性疾患患者は、新型重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)に感染すると死亡率が上昇するリスクの高いグループであることが、説得力のある証拠として示されている。本研究では、COVID-19に関連した死亡率への病的疾患および関連する処方薬の寄与を検討した。
方法
最近報告された様々な臨床シナリオに基づいて、SARS-CoV-2による中枢神経系の感染様式とその管理方法について理論的な枠組みを構築した。
結果
中枢神経系のドーパミン放出機構はコロナウイルスの侵入と伝播に大きな役割を果たしている可能性がある。
結論
この研究は、中枢神経系におけるドーパミン放出経路の徹底した緊急調査の必要性を強調している。これらの努力は、パンデミックコロナウイルス病(COVID-19)の決定的な治療法を見つけるのに役立つであろう。
キーワード
中枢神経系感染症、COVID-19,ドーパミン、SARS-CoV-2
序論
新しい重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、間違いなく地球全体を変えてしまった興味深いウイルスである。世界中の政府や組織があらゆる手段を使ってこのウイルスと闘おうとしているが、まだ決定的な治療法は報告されていない。いくつかの研究は、現在、コロナウイルス疾患2019(COVID-19)に関連する神経症状の臨床報告にSARS-CoV-2の潜在的な神経学的影響に取り組んでいる。注目すべきは、重度のCOVID-19を有する患者はまた、血液-脳バリアの破壊の重要な徴候であるサイトカインストーム症候群を経験する可能性があることである。これらの神経学的症状は、通常のウイルス感染症ではまれであると考えられている。それにもかかわらず、コロナウイルスの侵入と神経症状との関連は明らかにされていない1, 2, 3。
本研究では、ヒトにおけるSARS-CoV-2の代替的な結合機構を明らかにすることを目的とした。一般的なアンジオテンシン変換酵素2(ACE2)受容体以外にも、他の細胞内受容体の研究が必要である。最初に疑われる受容体または共受容体はドーパミンである。今日まで、SARS-CoV-2感染およびCOVID-19に対するドーパミンおよびドーパミン作動性受容体の潜在的な役割についての調査は行われていない。それにもかかわらず、ドーパミンは感染時に免疫応答をダウンレギュレートし、それによってSARS-CoV-2のライフサイクルを促進する可能性があり、これはドーパミンアゴニストを含む薬剤を投与されている患者において特に関連している可能性がある。
COVID-19を有する高齢者の死亡率は、糖尿病や認知症などの全身状態が存在する場合、または通常ドーパミンアゴニスト含有薬を使用している免疫抑制患者において増加する。したがって、SARS-CoV-2は、ドーパミン受容体がウイルスの病原性をサポートしており、体内への侵入経路としてドーパミンを悪用している可能性がある。
ドーパミンとウイルス
ドーパミン受容体は、様々なウイルスの侵入に関与していることが知られている4 , 5 。例えば、ドーパミンの上昇は、ヒト免疫不全ウイルス(HIV)および関連する中枢神経系(中枢神経系)感染症の発症を著しく促進し、HIV侵入共受容体の発現をアップレギュレートして、感染初期の段階でウイルスがマクロファージを回避することを可能にする。日本脳炎ウイルス(JEV)は、血液脳関門を破壊し、ウイルス性脳炎を引き起こす可能性がある。JEVはドーパミンシグナルを利用してドーパミンレベルを大幅に上昇させ、感染プロセスを促進するが、この増加はドーパミン受容体D2(D2DR)の刺激を介して近隣の細胞がJEVに感受性を持つことに関係している可能性がある4。
これらの知見に基づき、SARS-CoV-2はCOVID-19の初期段階におけるJEVとHIVの行動的中枢神経系の病原メカニズムを模倣している可能性がある。
前提条件
1 SARS-CoV-2はドーパミン受容体を利用してそのライフサイクルを改善し、ウイルスの侵入機会を増加させる可能性がある。
2 ドーパミンアゴニスト系薬剤は頸動脈体化学感受性に影響を与えて呼吸器系を混乱させ、その結果、酸素濃度が低下し、換気反応を悪化させる可能性がある。
3 SARS-CoV-2は、ドーパミンを介した細胞内生合成の阻害を介して、自然免疫応答および適応免疫応答を阻害する(図1参照)。
図1
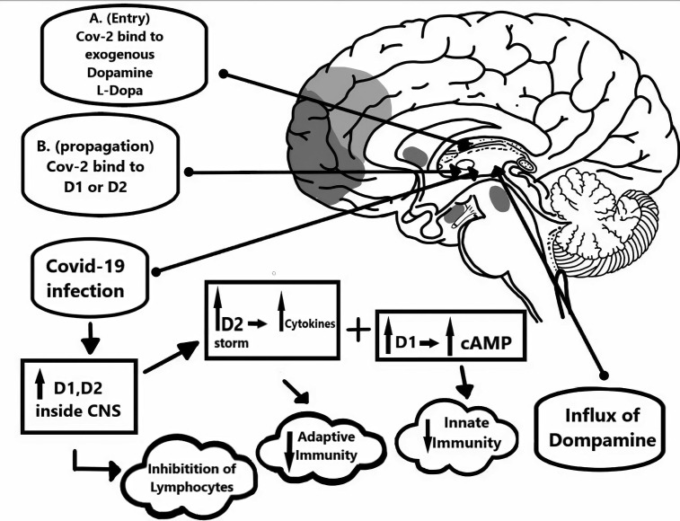
図1 A. ウイルスの侵入相:SARS-CoV-2のACE2受容体への初期結合の後、ウイルスのスパイク様タンパク質が隣接細胞のドーパミン受容体に結合する可能性がある。脳内のドーパミン受容体の存在は、局所免疫(例えば、リンパ球、サイトカイン)において不可欠な制御的役割を果たしている。サイトカインまたはニューロカインは、神経系および免疫系の両方において調節機能を有する。さらに、特定の濃度のドーパミンは、リンパ球の機能を阻害することができる7B。ドーパミンの流入は、ウイルス負荷の増加を助ける自然免疫と適応免疫の両方をさらに減少させる。これは、脳症、疲労、めまい、意識不明など、より多くの神経症状を引き起こす。D1様受容体(D1)の産生が増加すると、自然免疫応答の低下を引き起こすcAMPの発現が増加し、一方、D2様受容体(D2)の発現が高いと、適応免疫応答の低下につながるサイトカインストームが発生する。
この仮説を支持する臨床観察がいくつかある。9 , 10 ドーパミン作動性受容体は、ウイルス感染の初期段階でウイルス性脳炎を開始させるために、いくつかのウイルスの中枢神経系への結合の可能性を高めることができる。4 , 5 さらに、SARS-CoV-2のウイルスのライフサイクルは、高レベルのカテコラミンの存在下では、おそらくドーパミン受容体に結合してウイルスの侵入の機会を増加させることによって、増強される可能性がある。
第二に、ドーパミンの増加は、特にCOVID-19に関連する「ハッピー低酸素血症」を考慮した場合、酸素レベルを低下させる11 、12 。13 したがって、SARS-CoV-2とドーパミンは換気障害の原因を共有している可能性がある。いくつかの薬物(ハロペリドールなど)は、外因性ドーパミンに対する反応をブロックするが、正常時や低酸素時の換気反応は変化しない。
第三に、ドーパミンは免疫機能の調節因子である。ウイルスは、ウイルスの侵入の可能性を高めるためにドーパミンのレベルを増加させることで、免疫系を操作することができる。ドーパミンなどのD1様受容体アゴニストの増加は、一般的に自然免疫機能を抑制するcAMP産生を刺激することができる1516。一方、D2様受容体の増加は、適応免疫応答の抑制をもたらす5。したがって、生得的応答と適応的応答の両方において、SARS-CoV-2感染の存在は、高いインターロイキン(IL)-6レベルをもたらすことになる10.ケラチノサイトでは、「ドーパミンは濃度依存的にIL-6とIL-8の産生を刺激した」17.このように、これらの知見は、ドーパミンが宿主免疫を低下させ、重篤な合併症の可能性を高めるための主要な役割を果たしていることを示唆している。
最後に、最近の研究では、SARS-CoV-2と相互作用するさまざまな薬剤について検討した。試験した10種類の薬剤のうち、上位3種類の薬剤がドーパミンの分泌に直接影響を与えていることがわかった。これらの薬剤のうちの1つは、非常に最近の中国の研究で、2,000種類以上の薬剤を試験管内試験で試験した結果、最も有益な結果が得られた薬剤として同定された。ドーパミン拮抗薬として作用するすべての薬剤は、SARS-CoV-2.18 , 19 と相互作用する可能性が高いことが示された。
結論として、COVID-19に伴う重篤な合併症を回避するためには、慢性疾患に使用される薬剤の構成の見直しが早急に行われなければならない。我々の仮定によれば、これらの薬剤によって制御されるドーパミンの量とCOVID-19の合併症の重症度との間には強い関連性がある。
