Contents
- Canonical and Noncanonical Autophagy as Potential Targets for COVID-19
- 要旨
- 1. このウイルス(および他の多くのウイルス)のための薬はまだない
- 2. SARS-CoV-2の対照ウイルスの研究から治療標的が明らかになるかもしれない
- 3. オートファジーと複数のウイルス群の複製サイクルとの相互作用
- 4. オートファジーとコロナウイルスは類似の小胞構造を形成する
- 5. コロナウイルスはオートファジーとアポトーシスの主要なイニシエーターを調節するように思われる。
- 6. コロナウイルスは NSP6 といくつかの付属タンパク質を介してオートファジーを制御している。
- 7. 代替オートファジー経路はコロナウイルス感染に関与しているかもしれない
- 8. オートファジーモジュレーターは有望な抗コロナウイルス薬である
- 9. 今後の展望と課題
Canonical and Noncanonical Autophagy as Potential Targets for COVID-19
www.mdpi.com/2073-4409/9/7/1619/htm
要旨
SARS-CoV-2パンデミックは、関連する新しい疾患(COVID-19)に対する潜在的な治療標的を特定するために、コロナウイルスによる細胞感染の根底にある分子機構の見直しを必要としている。
コロナウイルスとオートファジーとの間には、複雑で共存する相互作用があることが、これまでの研究で証明されている。この経路の正確な操作により、これらのウイルスは、その保護的なアポトーシスドリフトおよび細胞の自然免疫応答を回避しながら、オートファジー分子機械を悪用することができる。
ターンでは、そのようなハイジャックの操縦性マージンは、誘導剤または阻害剤(その多くは、他の疾患の治療のためにFDA承認されている)を使用するかどうかにかかわらず、オートファジーの変調は、通常、SARS-CoV-2を含むウイルスの複製に有害であるように、非常に狭いように見える。
最近の発見は、これらの相互作用が、まだ十分に探索されていない非カノニカルなオートファジー経路にまで及んでいることを示しており、コロナウイルスの複製に重要な役割を果たしている可能性がある。
しかし、RAB9やその相互作用タンパク質のような、この経路内のいくつかの潜在的な治療ターゲットは、現在の知識を考慮すると有望であると思われる。
このように、COVID-19とオートファジー経路の両方に作用する薬剤との併用療法は、コロナウイルスや他のウイルス感染症との戦いにおける転機となる可能性があり、長期的な保護の可能性を示唆している。
キーワード:抗ウイルス薬、オートファジー、カノニカルオートファジー、コロナウイルス、COVID-19、非カノニカルオートファジー、SARS-CoV-2
1. このウイルス(および他の多くのウイルス)のための薬はまだない
2020年1月30日、世界保健機関(WHO)の緊急委員会は、2019年後半に中国湖北省で発生した重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)[1]と呼ばれ、コロナウイルス病2019(COVID-19)と呼ばれる致命的な疾患の原因物質であるコロナウイルスが発生したことを理由に、「国際的に懸念される公衆衛生上の緊急事態」(PHEIC)を宣言した。
3月11日、世界数百カ国への感染拡大を確認した後、WHOは世界的なパンデミックとして発表した。国際保健規則2005(IHR 2005)[2]は、2005年5月23日の第58回世界保健総会で194カ国が署名した(2007年6月15日発効)。
以来、WHOがPHEICを宣言したのは6回目、パンデミックの宣言は2回目である。
この規定の策定に寄与したと思われる2002年か et al 2003年のSARSコロナウイルス(SARS-CoV)による重症急性呼吸器症候群(SARS)のパンデミックを含めると、20年足らずの間にWHOが宣言したPHEICは7件にのぼり、そのすべてがウイルスによるものと考えられる。
さらに、季節性インフルエンザ、エイズ、肝炎など、すでに世界的に蔓延しているウイルス性疾患や、コロナウイルス(MERS-CoV)による中東呼吸器症候群(MERS)、デングフラビウイルス(DENV)によるデング熱など、致死的ではあるが世界的にはそれほど拡大していない新興の疾患の自然発生を加えれば、一般的な状況はさらに悲惨なものになる。
このシナリオは、究極の技術的・生物医学的進歩があるにもかかわらず、ワクチンが利用できず、先進国でさえも罹患率や死亡率が大きな懸念材料となっている新興のウイルス感染症の増加に対して有効な治療法が一般的に欠如していることを浮き彫りにしている[3,4]。
現在のように、機関はどのようなアウトブレイクに対してもワクチンの作成に向けて資源を動員しているが、その開発はすぐにできるものではない。
したがって、抗ウイルス剤の開発への物質的・人的投資は、感染症が発生したときに迅速に対応するだけでなく、ワクチン接種プログラムが実施されなかったり、集団免疫が発生しなかったり、あるいはいずれの場合もウイルスが十分に変異したりした場合には、その後の感染症の発生にも対応するために緊急に必要とされている[4,5]。
2. SARS-CoV-2の対照ウイルスの研究から治療標的が明らかになるかもしれない
抗ウイルス薬開発における「一ウイルス一薬」のアプローチは、いくつかの成功例やキャッチーなスローガンがあるにもかかわらず、現在のように数が非常に多く危険な状況に対応するには不十分であることが証明されている。
病原性ウイルス種に対する抗ウイルス治療薬の標的を同定するためには、最も近いウイルスファミリーの研究から知識を得る必要がある。
SARS-CoV-2はOrthocoronavirinae亜科(ニドビラ目;科名:Coronaviridae)[1]に属し,一般的にコロナウイルスとして知られている(表1).このエンベロープされたウイルスの一本鎖ポジティブRNAゲノムは30kbの長さであり,既知のRNAウイルスゲノムの中では最大のものである.ゲノムの5’末端3分の2は、重複する2つのオープンリーディングフレーム(ORF)、ORF1aと1bを含み、これらはウイルスのゲノム複製とサブゲノムmRNA合成に関与する16の非構造タンパク質(NSP)をコードしている。
ゲノムの3’末端3分の1は、4つの主要な構造タンパク質、すなわちスパイク(S)、メンブレン(M)、エンベロープ(E)、ヌクレオカプシド(N)、およびいくつかの属特異的な付属タンパク質をコードしている。
これらのタンパク質は複製には必須ではないが、主に自然免疫応答を調節することで病原性に寄与している[6,7,8]
HCoV-229E(ヒトコロナウイルス229E)、HCoV-OC43(ヒトコロナウイルスOC43)、伝染性気管支炎ウイルス(IBV)(感染性気管支炎ウイルス)、MHV(マウス肝炎ウイルス)、PDCoV(豚デルタコロナウイルス)、PEDV(豚伝染性下痢ウイルス)、TGEV(伝染性胃腸炎ウイルス)。
コロナウイルスは、ゲノムの特徴に基づいて4つの属に分類される。ヒトを含む哺乳類に感染するアルファコロナウイルスとベータコロナウイルス、鳥類を中心に哺乳類にも感染するガンマコロナウイルスとデルタコロナウイルスである。
ベータコロナウイルス属の5つの亜属のうち、SARS-CoV-2はSARS-CoVとともにサルベコウイルス亜属[1,5]に属し、ヒトへの感染率が高く致死性が高いことから研究が進められてきた。
SARS-CoV-2は、系統的にはコウモリSARS様コロナウイルス[10,11]に近いが、SARS-CoV[6,11]とゲノム同一性や相同遺伝子構成を約80%共有していることから、SARS-CoVは同一種のSARS関連コロナウイルスに分類されることになった[1]。したがって、従来のSARS-CoVに関する我々の知見は、ある程度、この新しいウイルスにも適用できる可能性がある。
SARS-CoVとSARS-CoVは、ウイルスが侵入する際に、表面糖タンパク質Sが受容体の結合と膜の融合を仲介している[7]。SARS-CoVおよびSARS-CoV-2のSタンパク質(以下、それぞれScovおよびScov2と呼ぶ)は、76%のアミノ酸配列同一性を共有しており、これは、ウイルスファミリーの中で最も曝露されやすく、したがって変動性のあるタンパク質の一つであることを考えると、高い値を示している[6,11,12]。
さらに、Scov2は、サブユニット1(S1)の受容体結合ドメイン(RBD)、融合ペプチド(FP)、ヘプタドリピート(HR)1および2、膜貫通ドメイン(TM)およびS2の細胞質ドメイン(CP)など、機能に必要な典型的な要素を保存しているため、このような同一性は、関連する機能領域においてもはるかに高くなっている。
さらに、わずかな違いにもかかわらず、ScovとScov2の分子構造、および融合適合型コンフォメーションを採用するためのそれらの変化は相同であり、Scov2の22個のN-グリコシル化のうち20個はScovに保存されている[12,13]。
実際、初期の研究では、ScovおよびScov2(Scov2の方が少し親和性が高いとはいえ[12,13])の両方が、ウイルスの宿主への侵入を媒介する細胞表面受容体としてアンジオテンシン変換酵素2(ACE2)を認識していることが報告されている[11,12,13]。
したがって、SARS-CoV-2は、SARS-CoVと高い相同性を有していることから、SARS-CoV-2もまた、クラスリン依存性のエンドサイトーシス経路、およびクラスリンおよびカベオラエ依存性のエンドサイトーシス経路を介して細胞内に侵入し、エンドサイトーシス経路に関与している可能性があると考えられる[14,15,16]。
両SARS-CoV間の16個のコロナウイルスNSPについても、タンパク質配列の同一性が高い比率で認められた。これらの値は68(NSP2)から100%(NSP13)の間で変化し、その半分は95%以上であった(NSP5、7-10、12-14)。本研究で広く取り上げられているNSP6は、両ウイルス間で88%の同一性を共有している[6]。
すべてのNSPは、ウイルスの複製および転写過程において重要な役割を果たしている(例えば、NSP5、プロテアーゼ、NSP7、プライマーゼ、NSP12、RNA依存性RNAポリメラーゼおよびNSP13、ヘリカーゼ)。特に、NSP6は、NSP3およびNSP4と複合体を形成する膜貫通型タンパク質であり、コロナウイルス複製中のER由来の二重膜小胞(二重膜小胞)の形成に関与している[17]。
SARS-CoVとSARS-CoV-2のほとんどのNSPにこのような高いレベルの保存性があることは、分子構造と相同機能が近いことを示唆しており、したがって、平行/比較可能な複製サイクルが存在することを示唆している。
このような観察は、特定のウイルス感染症と相互作用し応答する分子経路を特定する上で非常に重要であり、その制御に関するこれまでに得られた知識は、戦略的に重要な治療上の利点をもたらす可能性がある。
実際、稀に知られていない、あるいはほとんど研究されていない分子経路を除いて、関心のある各経路を調節することを目的とした薬理学的に特徴づけられた薬剤の配列が、特定の疾患の治療のために承認されており、これらの薬剤は、対応するリポジショニングによって拡張することができる。
3. オートファジーと複数のウイルス群の複製サイクルとの相互作用
これまでの文献から、マクロオートファジー(以下、オートファジー)経路は、SARS-CoV-2感染症対策の有望なターゲットとなる可能性がある。オートファジーは、真核生物の高度に保存された細胞質分解のプロセスであり、特に飢餓状態や小胞体(ER)ストレス下で活性化される [18,19]。
このメカニズムは細胞の恒常性を維持し、完全なオートファジーのフラックスを達成するために、様々な分子と動的な膜再配列のオーケストレーションを必要とする。簡単に言えば、飢餓誘発オートファジーの正統的な経路(グラフィカルな説明と略語については図1を参照)では、プロセスは、隔離コンパートメントの生成から始まる。
このプロセスは、ファゴフォアを形成するために進化するER膜のオメガ型サブドメイン(オメガソームと呼ばれる)の誘導を伴う。後者は、二重膜シートからなる一過性の構造であり、それがそれ自身にロックダウンるまで膨張し、リサイクル可能な細胞材料を包み込み、オートファゴソームを形成する。
オートファゴソームはまだ二重膜に囲まれているが、酸性の後期エンドソームと融合して一枚膜のアンフィソームを形成することもある。最後に、オートファゴソームまたはアンフィソームはリソソームと融合してオートリソソームを形成し、その内部では、酸性条件下で貨物の酵素分解が行われる。
予想されるように、このプロセスの各段階は、通常オートファジー関連(ATG)と呼ばれる多数のタンパク質(図1)の連続的なリクルートと作用によってサポートされ、制御されている。
オートファジーの開始は、ULK1およびクラスIIIホスファチジルイノシトール3-キナーゼ(PtdIns3K)複合体(MTORの負の調節下)によって調節され、脂質PtdIns3Pに富むドメインを形成する。これらのドメインは、MAP1LC3/LC3のタンパク質分解的に処理された形態(LC3-Iと呼ばれる)を含む様々なタンパク質をリクルートし、その脂質ホスファチジルエタノールアミンへのコンジュゲーションを媒介する(LC3-IIを生成する)。
このリクルートは、ファゴフォア閉鎖のために不可欠であり、したがって、定型的なオートファジー経路におけるオートファゴソームの形成に不可欠である。
ATG16L1を含む複合体は、LC3脂質化の部位を特定する[18,19,20,21,22]。
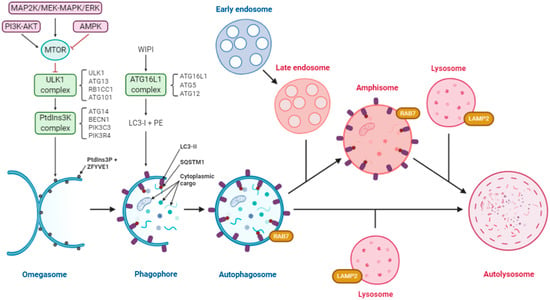
細胞 09 01619 g001 550図1. 内細胞経路の収束を含むオートファジー経路の図。
オートファジーは3つのタンパク質複合体によって制御されている。ULK1、ATG13、RB1CC1/FIP200およびATG101からなるULK1、ATG14、BECN1、PIK3R4/VPS15およびPIK3C3/VPS34からなるクラスIIIのPtdIns3K、およびATG16L1、ATG5およびATG12からなるATG16L1である。
飢餓状態では、MTORは不活性化され、ULK1複合体が形成され、PtdIns3Kが活性化され、オメガスソームの表面にPtdIns3Pに富んだ領域が形成される。
WIPIタンパク質はこれらのドメインを認識し、ATG16L1複合体をリクルートし、LC3-Iの脂質化を促進してLC3-IIを形成する。
SQSTM1/p62などの受容体は、ユビキチン化されたカーゴとLC3-IIに結合し、選択的なオートファジーを促進する。
細胞質のカーゴは、損傷したミトコンドリア、小器官、タンパク質、核酸、細胞内細菌などを含む。膜添加によるファゴフォアの拡張は、細胞質の一部を隔離し、閉鎖時にオートファゴソームを形成する。
このオートファゴソームはRAB7で装飾されており、これがリソソソームと融合してオートリソソームを形成し、ここで貨物が分解される。エンドサイトーシス経路(一部のウイルスが使用)とオートファジーが収束して、アンフィソームが形成され、このアンフィソームもリソソームと融合してオートリソソームを形成する。ピンク色は酸性のコンパートメントを示す。
略語。
AMPK、AMP活性化プロテインキナーゼ、BCL2、BCL2アポトーシスレギュレーター、BECN1、ベクリン1、LAMP2、リソソソーム関連膜タンパク質2、MAP1LC3/LC3、微小管関連タンパク質1軽鎖3。
MTOR、ラパマイシンキナーゼの機械的標的;PE、ホスホエタノールアミン;PIK3C3/VPS34、ホスファチジルイノシトール3-キナーゼ触媒サブユニットタイプ3;PIK3R4/VPS15、ホスホイノシトール3-キナーゼ調節サブユニット4。
PtdIns3K、ホスファチジルイノシトール3キナーゼ;Ptdins3P、ホスファチジルイノシトール-3-リン酸;PTK2/FAK、タンパク質チロシンキナーゼ2;RAB7、RAB7、メンバーRAS癌遺伝子ファミリー;RB1CC1/FIP200、RB誘導性コイルドコイル1。
SQSTM1/p62, sequestosome 1; ULK1, unc-51 like autophagy activating kinase 1; WIPI1/2, WD repeat domain, phosphoinositide interacting 1/2; ZFYVE1/DFCP1, zinc finger FYVE-type containing 1。
オートファジープロセスはまた、ファゴフォアの凹面側のLC3への受容体結合を介して、様々なリガンドをオートファジー機械に連結する特定の受容体の使用を介して選択的であることを管理する。
微生物の場合、これはしばしば、E3リガーゼファミリータンパク質のグループの作用を介して、ユビキチンタグ付けすることによって達成される。選択的オートファジーの他のタイプの中でも、キセノファジーは、細胞内の病原体を特異的に標的とし、その分解と、自然免疫応答と適応免疫応答の両方へのさらなる統合を目指している[21,23,24,25,26]。
逆に、この細胞保護的オートファジーに応答して、コロナウイルスを含むいくつかの異なるウイルスファミリーは、プロセスの異なる段階でオートファジーの阻害および/または刺激を介して、脱出および/または利益を得るために、多種多様な戦略を進化させることによって適応してきた[23,27,28,29]。
このように、これらの相互作用点の同定は、オートファジーの選択されたステップを標的とすることにより、特定の段階でウイルスの複製サイクルを混乱させる機会をもたらすかもしれない。
4. オートファジーとコロナウイルスは類似の小胞構造を形成する
オートファジーとコロナウイルスの複製サイクルとの関連性を示唆する最も明白なヒントは、両方のケースで二重膜小胞が存在することである[23,27,28]。
コロナウイルスは、連結した二重膜小胞と複雑な膜の生成に向けて、ER膜の特徴的な再配列を誘導する。全体として、この細胞質網状体システムは、ウイルスRNA合成のための足場として機能し、おそらく宿主の防御機構からウイルス要素を保護している[17,30]。
これらの構造の正確な機能および動態は完全には理解されていないが、いくつかのウイルスNSPが関与していることが示唆されている[30]。
その中でも、様々な試験管内試験(in vitro)研究では、ウイルスのレプリカーゼタンパク質の一つであるNSP6が、二重膜小胞の生成のためのオートファジー機構を破壊するという重要な役割を果たしていることが明らかにされている[31]。証拠は、コロナウイルスNSP6がERからこれらの膜再配列の形成を誘導することを示している[31,32]。
これまでのところ、SARS-CoV NSP6のみが、放出されたLC3陽性二重膜小胞と部分的にコロケーションすることが報告されている[31]。
伝染性気管支炎ウイルス(IBV) NSP6については、最近のPEDV NSP6に関する研究[34]とは対照的に、MTOR(主要なオートファジーサプレッサー[33])のシグナル伝達経路の阻害を介さないことが示されているが[31]、このような活性化の初期メカニズムは未だ不明である。どちらも、NAD依存性脱アセチル化酵素SIRT1(サーチュイン1;オートファジーのMTOR非依存性誘導因子[35])[31]の活性化に起因するものではない。
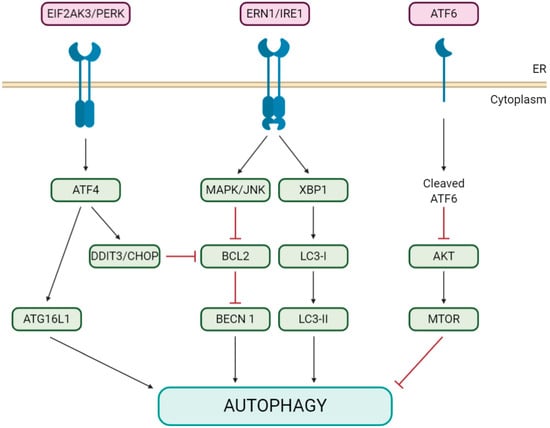
あるいは、アンフォールドタンパク応答(UPR;図示的な説明および略語については図2を参照のこと)[19,36]が関与するオートファジープロセスも誘発するERストレスは、UPRシグナル伝達経路における3つのアンフォールドタンパクセンサーの1つであるERN1/IRE1[37]を介して伝染性気管支炎ウイルス(IBV)感染によって誘導され、ERストレスの生存促進機構として報告されている細胞オートファジー応答[38]も誘発する。
興味深いことに、そのサイレンシングは伝染性気管支炎ウイルス(IBV)複製を阻害しないが、下流のエフェクターであるXBP1とMAPK/JNKではなく、ERN1だけが伝染性気管支炎ウイルス(IBV)感染細胞におけるオートファジーの誘導に必要とされている[39]。
細胞 09 01619 g002 550図2. オートファジーを誘発するERストレスアンフォールドタンパク応答(UPR)経路の図。
ERストレスは3つの異なるUPR分岐を介してオートファジーを活性化することができる。
EIF2AK3/PERK、ERN/IRE1、ATF6シグナル伝達経路。
EIF2AK3/PERKは、ATF4を介してATG16L1複合体を活性化することにより、またはDDIT3/CHOP発現を誘導することによりオートファジーを誘導し、これは間接的にBCL2からBECN1の解離を引き起こす。
ERN/IRE1はMAPK/JNKを介してBCL2のリン酸化を仲介し、BCN1からの解離を引き起こする。XBP1分岐はLC3-IIの形成を促進する。また、ATF6経路は、AKT-MTOR経路でのリン酸化を阻害することでオートファジーを誘導する。
略語。
AKT/PKB、AKTセリン-スレオニンキナーゼ;ATF4/6、活性化転写因子4/6;DDIT3/CHOP/GADD153、DNA損傷誘導性転写因子3;EIF2AK3/PERK、真核生物翻訳開始因子2αキナーゼ3;ERN/IRE1、小胞体から核へのシグナル伝達1;MAPK/JNK、マイトジェン活性化タンパク質キナーゼおよびXBP1、X-box結合タンパク質1。
UPRの他の2つの既知の経路(図2)については、対応する主要な調節因子であるATF6とEIF2AK3/PERKは伝染性気管支炎ウイルス(IBV)感染によって調節されず、それらのサイレンシングは伝染性気管支炎ウイルス(IBV)誘発オートファジーに影響を与えなかった[39]。
これらの結果と一致して、Cottamら(2011)[31]はまた、伝染性気管支炎ウイルス(IBV)、MHVおよびSARS-CoVのNSP6は、IRE1シグナル伝達経路からのXBP1の活性化またはEIF2AK3/PERK経路からのプロアポトーシス転写因子DDIT3/CHOP/GADD153の発現のいずれにも有意な影響を及ぼさないことを示した。
5. コロナウイルスはオートファジーとアポトーシスの主要なイニシエーターを調節するように思われる。
前述の結果に関連して、ERストレスに応答してERN1-MAPKシグナル伝達経路が活性化されると、オートファジー[38]と細胞死[40]の両方を誘導することが報告されていることに注目すべきである。
この意味で、UPRのEIF2AK3/PERK経路は、コロナウイルス誘導オートファジーには無関係のように見えるにもかかわらず、伝染性気管支炎ウイルス(IBV)は、DDIT3/CHOPのEIF2AK3/PERKおよびEIF2AK2/PKR活性化を介してアポトーシスを誘導し、その恩恵を受け、それによりMAPK/ERK経路が抑制される[41]。
このMAPK/ERK経路は、MAPK/JNK経路とともに、BCL2相互作用タンパク質BECN1(ベクリン1)の制御を介して非カノニカルオートファジーを媒介している[42]。
さらに、MERS-CoV細胞の培養感染は、MAPK/ERK経路(RAS-RAF-MAP2K/MEK-MAPK/ERK経路としても知られている)だけでなく、アポトーシスプロセスにも関与するクラスIホスホイノシチド3-キナーゼ(PI3K)-AKT-MTOR経路[43]の関連要素のリン酸化における実質的な変化を誘導することが報告されている[40,44]。
驚くべきことに、これら2つの経路の特異的阻害剤と、オートファジーを調節することも報告されているEIF2AK2/PKRを投与すると、MERS-CoV感染が抑制される[43]。また、AKT1によって活性化されたSKP2(S-phase kinase associated protein 2)がBECN1の分解とオートファジーの阻害を促進し、SKP2を抑制することでオートファジーが活性化され、MERS-CoV感染が抑制されることも最近明らかになっている[45]。
この文脈の中で、いくつかのコロナウイルスは、宿主のI型インターフェロン(IFN)免疫応答と同様に、アポトーシスを防ぐための付加的なメカニズムを進化させてきた。それは、IFN誘導性OAS(2′-5′-オリゴアダデニル酸合成酵素)-RNASEL(リボヌクレアーゼL)経路に拮抗し、その結果、RNASEL活性、すなわちウイルスおよび宿主の一本鎖RNAの切断およびその後の細胞死をブロックすることからなる。
この目的のために、RNASEL活性化剤である2′,5′-オリゴアデニル酸は、いくつかのベタコロロナウイルスアクセサリータンパク質の環状ホスホジエステラーゼ活性によって分解される[46,47]。逆説的であるが、RNASELはMAPK/JNK経路を介してウイルス感染に応答してオートファジーを誘発することが報告されている[48]。
6. コロナウイルスは NSP6 といくつかの付属タンパク質を介してオートファジーを制御している。
伝染性気管支炎ウイルス(IBV) [31,39,50]、MHV [31,50,51]、MERS-CoV [45]、SARS-CoV [31,50]、およびPEDV [34]の感染中に誘導されるLC3含有小胞が実際にオートファゴソームであるかどうかについては大きな論争がある。
このような効果は、これらの症例のいくつかにおいて、ウイルスNSP6によって媒介されることが実証されており[31,34,41,50]、また、通常の飢餓誘発オートファジー[52]で見られるものと同様に、オムガソーム中間体[31,50]を介して駆動されているようである。
これに沿って、これらのコロナウイルス誘導オートファゴソームの生成は、ER膜外葉のPtdIns3P濃縮、およびZFYVE1/DFCP1(オメガスソーム形成の鍵となるタンパク質)、WIPI1/2、ATG5およびLC3-II(オートファジー機械のすべてのコンポーネント)、およびSQSTM1/p62(選択的オートファジーのための受容体タンパク質)のリクルートを必要とする[31,50,51]。
逆に、NSP6発現細胞におけるオメガスソーム、オートファゴソームおよびオートリゾソームは、例えば、単に飢餓によって誘導されるものとは異なる成熟過程を経る。Cottamら(2014)[50]は、伝染性気管支炎ウイルス(IBV)、MHVおよびSARS-CoV NSP6、ならびに伝染性気管支炎ウイルス(IBV)感染により、通常のもの(Ø:約1μm)と比較して有意に小さい直径のオートファゴソーム(Ø≦0.5μm)が生成されることを説明した。
この点で伝染性気管支炎ウイルス(IBV) NSP6を用いて行った更なるアッセイは、その発現が、飢餓またはMTORキナーゼの阻害のいずれかによって誘導された場合であっても、オメガスソームおよびファゴフォアの両方の拡張を制限することを示している。
この研究では、伝染性気管支炎ウイルス(IBV) NSP6がオートファゴソームとリソソームの融合を妨げないことを示しているので(最近伝染性気管支炎ウイルス(IBV)感染でも報告されている[39])、これらのオートファゴソームのサイズが小さくなることで、複数のリソソームと融合する能力が制限され、結果としてより小さなオートリソームが生成されることが示唆されている。
興味深いことに、NSP6がリソソソーム表面へのMTORのリクルートを阻害することも示されており、これは最終的なオートリソソームの活性に影響を与える可能性がある。最近の収束研究では、MERS-CoV感染は、NSP6と付属タンパク質4bと5を介して、オートリソソーム形成段階で実際にオートファジーを阻害することが報告されている。この知見は以前のデータと一致している。
結果として、このブロックは初期段階のオートファジー小胞の総数を増加させ、その中のオートリソソームの比率を低下させる[45]ので、後期オートファジー遮断薬であるクロロキンやバフィロマイシンA1を投与した後でも同様の結果が得られる[53,54,55]。
このような効果は、いくつかの方法でウイルスの複製に利益をもたらすであろう:エンドソームおよびオートファジー小胞の成熟を防止し、したがって、基本的にすべての複製サイクルの段階でウイルス要素に関してそれらの潜在的に過剰な分解能力を防止し、安全な条件でそれらの複製のためのすべてのこの新しい機械を提供することによって、[14,15,17,30,56]。
7. 代替オートファジー経路はコロナウイルス感染に関与しているかもしれない
このシナリオと一致するように、コロナウイルスまたはそのNSP6(特に他のもの)は、宿主におけるオートファジープロセスの開始だけでなく、プロセスの後期の段階でそのブロックも誘発するといういくつかの裏付けとなる証拠がある。
例えば、コロナウイルス感染細胞またはNSP6発現細胞の小胞構造には、共通のオートファジーマーカーが存在する(表2)。LC3の蓄積およびLC3-IIへの変換の増加[34,39,57,58]、BECN1の蓄積[58]、およびSQSTM1/p62の分解の増加[57,58]もまた起こる。
蛋白分解的切断のような本質的なオートファジー要素がブロックされたときに、これらのイベントの減少または廃止が、LC3-IからLC3-IIへの変換を可能にすることは、その後、驚くべきことではない。
そのような要素が化学的に阻害されている場合、そのようなオメガスソームの形成を廃止し、したがって、LC3の募集と変換[31,57]のような次のオートファジープロセスを廃止するために、ワルトマニンとPIK3C3のような場合、またはAtg5の例で見られるように、サイレンシングされている場合はどちらもない[31,34,39]。
表2. コロナウイルスによって誘導された小胞中に検出されたオートファジーマーカーおよびコロケーションウイルス要素。
表 原文参照
しかしながら、オートファジーの標準的な経路の制御は、使用されたすべての実験系間に存在する可能性のある大きな違い、すなわち、異なるコロナウイルスのジェネラ/系統や細胞株を考慮しても、他の広範な観点からの観察を説明することはできない。
コロナウイルスの複製とオートファジー経路との密接な相互作用を考えると、最も矛盾する事実は、ATG5、ATG7、BECN1、LC3 のようなオートファジー必須タンパク質をコードする遺伝子をノックアウトしても、実験したコロナウイルスの細胞培養での複製を廃止しなかったことである。
これらの要素の欠如もまた、ウイルスの複製に必要なER多形相互接続小胞構造の生成を妨げるものではないが、これらの要素はMHVに関するこれらの研究のうちのいくつかの研究でのみ解析されているにすぎない[51,59,61]。
もう一つの驚くべき発見は、オートファゴソーム(ほとんどの研究ではLC3標識)が感染細胞に大量に蓄積するウイルス複製要素と部分的にしかコロケーションしていないことである(表2)。この意味で、Snijderら(2006)[62]は、Vero-E6感染細胞においてLC3とSARS-CoVのNSP3サブユニットが完全に分離していることを報告している。
これらの事実はすべて、コロナウイルスの複製に関与する代替的なオートファジー経路を示唆している。
表3. オートファジー必須要素のサイレンシングがコロナウイルス複製に及ぼす影響。
表 原文参照
この意味で、Reggioriら(2010)[59]は、コロナウイルスは、代替的なER関連分解経路、特にER分解促進アルファマンノシダーゼ様タンパク質1(EDEM1)の選択的クリアプロセスを操作することにより、ER膜再配列を誘導することを提案している。
EDEM1は、おそらく他のERシャペロンと一緒にEDEMosomeと呼ばれる小胞に貯蔵され、COPII複合体のコートに依存しないメカニズムによってERから誘導され、廃棄のためにエンドソームコンパートメントに運ばれる。
この研究では、MHVがこの経路をハイジャックして、ウイルスの複製に不可欠な非脂質化LC3(LC3-I)でコーティングされたEDEM1に依存しないウイルス二重膜小胞の形成を促進していることが示唆された。このアプローチにより、LC3-IをLC3-IIへの処理に関与するATG5 [31,39,45,51,57,58,60,61]およびATG7 [57,59]が、このようなタスクには不向きであることが分かった。
しかし、本研究の著者らによって議論されているように、これらの特徴を持つ別の経路が明らかにされたばかりで、ATG5およびATG7に依存しないオートファジー[63]が関与している可能性があると考えられている。2009年、西田ら[63]は、ある種のオートファゴソームは、ATG5、ATG7およびLC3変換の参加なしに、後期エンドソームおよびトランスゴルジから生じる可能性があることを記述した。
さらに、ブレフェルディンA(BFA)による化学的遮断は、この代替的なオートファジー経路の初期段階で、ER/シスゴルジ領域での小胞の融合が関与している可能性を示唆している[64]。
このように、ATG5およびATG7に依存しないオートファジーは、複数の段階/プロセスで(ほとんどがエンベロープされた)ウイルスの複製サイクルと潜在的に相互作用することができる内分泌経路-ゴルジ経路を確立する。
(1)ウイルスと宿主の膜のエンドサイトーシスと融合によるウイルスの侵入、(2)ウイルス糖タンパク質の糖質の処理は、ERからシスゴルジへの移行を必要とし、(3)それらの細胞内輸送、(4)複製、(5)アセンブリまたは(6)宿主小胞の足場を介しての脱出。
我々が他の多くのウイルスから知っているように、通常のオートファジー経路だけでなく、代替的なオートファジー経路(またはその要素の一部)も複製のためにハイジャックされたり破壊されたりしており[23,66]、BFAはコロナウイルスを含む多くのケースで抗ウイルス活性を有している[67,68,69,70] [71]。
コロナウイルスの複製サイクルに対する各オートファジー経路の特定の寄与を解明するためには、一価不飽和脂肪酸オレイン酸[64]と一緒にBFAのようなモジュレーターを使用することを含めて、さらなる研究が必要である。
BFAは通常のオートファジーには影響を与えないが、ATG5およびATG7非依存性[63,72]およびBECN1非依存性プロセス[73,74]の両方を阻害するのに対し、BECN1非依存性経路はオレイン酸によってのみ誘導される[74]。
さらに、トランスゴルジへの後期エンドソームのトラフィッキングを媒介するATG5-およびATG7-非依存性経路[63]の活性を評価するためのRAB9のようなオートファジーマーカーのリストに新しいメンバーを追加する必要があるだろう[75]。
8. オートファジーモジュレーターは有望な抗コロナウイルス薬である
コロナウイルスとオートファジーの相互作用は非常に複雑であり、完全には理解されていない。
コロナウイルス感染時には、オートファジーは細胞応答機構であると同時に、ウイルスの複製ツールでもある。実際、コロナウイルスは、アポトーシスおよびIFN応答によって制限された狭い作用領域内の複数のレベルで相互作用しながら、オートファジーを誘導および阻害することができる。
この複雑さの他の代表的な例は、オートファジー活性化はTGEV複製を阻害するが[57]、TGEV感染細胞においてプロウイルスのミトコンドリア選択的オートファジーが誘導される[76]、またはPEDVがオートファジーを誘導し、その恩恵を受ける[58]が、ラパマイシン誘導オートファジーによっても阻害される[60]というものである。
これらすべてについて、また、異なる実験系を使用していることによる研究間の違いがあるにもかかわらず、オートファジーの調節は通常、コロナウイルスの複製に影響を与えるため、抗コロナウイルス薬の探索において有望な治療標的となる。
表4と表5は、それぞれオートファジー誘導剤と阻害剤の細胞培養における異なるコロナウイルスの感染に対する効果をまとめたものである。これらのうち半数は他の疾患・疾患に対するFDA承認済みの薬剤であり、いくつかの薬剤はSARS-CoV-2に対する阻害活性を示している。
観察されるように、ラパマイシン、3-メチルアデニン(3-MA)またはクロロキンのような古典的な調節剤でさえ、通常、コロナウイルスの複製に対して効果を発揮する。一般的に、試験されたすべてのオートファジーモジュレーターの中で、オートファジー誘導剤であるか阻害剤であるかにかかわらず、結果は通常、抗ウイルス活性であった。
この事実は、オートファジー経路に対するウイルスの正確な制御だけでなく、このようなバランスを維持することの難しさと、この前後のゲームで調節障害がある場合、ウイルスの複製に有害な影響を反映している可能性がある。
表4. 細胞培養物中のコロナウイルスの複製レベルに対するオートファジー誘導剤の効果。
表4に示すように、オートファジー誘導剤は一般的にコロナウイルスの複製に拮抗する。オートファジー阻害剤(表5)の中で、クロロキン(最も試験されたもの)は幅広い抗コロナウイルス活性を示しており、これはそのマルチモーダルな作用によるものと考えられる。
簡単に説明すると、クロロキンはゴルジ体を混乱させることとは別に、リソソソームのアルカリ化を誘導し、これはアンフィソーム/オートファゴソーム-リソソーム融合を阻害し、小胞輸送システムを阻害する[53,54,55,93]が、コロナウイルスの全身的な複製サイクルに影響を与える可能性があり、これはpH依存性エンドサイトーシスによって媒介され、その膜融合活性をトリガーするためにSタンパク質のために低pHを必要とするそれらのエントリを含む[94,95]。
ニタゾキサニドは、細胞培養において高い抗SARS-CoV-2活性(IC50:2.12μM)を示す別の後期オートファジーブロッカーである[96] [97]が、その主要代謝物であるチゾキサニドは、PI3K-AKT-MTOR経路を阻害することによりオートファジーを誘導することを考慮すべきである[98]。
現在,科学界では,様々なアプローチでこの病原体に対する有効な薬剤の探索に力を入れており,オートファジー調節因子の発見が続いている[99,100,101].
表5. 細胞培養物中のコロナウイルスの複製レベルに対するオートファジーモジュレーターの効果。
9. 今後の展望と課題
ここで示されているように、オートファジーを標的とする薬剤、および内分泌系経路の調節に関与する薬剤[110]は、コロナウイルス感染症に対する化合物のアーセナルに追加される可能性がある(広範なリストについては、Zumlaら(2016)[111]を参照のこと)。
結果として、新しいオートファジー調節薬の発見は、この目的のために試験する価値のある新しい抗ウイルス剤の源となり得る。この意味で、我々は、代替的なオートファジー経路は、この分野ではまだほとんど探索されておらず、ウイルス、特にコロナウイルスとの戦いにおいて予想外のポジティブな結果を提供し得ることを提案する。
今後の前向きな取り組みとして、これらの経路の重要な要素であるRAB9活性への干渉が有望なアプローチであると考えている。
この意味で、細胞質でRAB9と複合体を形成し、エンドソーム-トランスゴルジネットワークでその活性を媒介するGDI/RabGDI(GDP解離阻害剤)、およびRABAC1/Yip3(Rabアクセプター1)のような特異的な「GDI-変位因子」のターゲティングも、この目的のためにテストする価値がある候補である[112,113]。
結論として、レビューされたほとんどの研究では、関与するメカニズムを正確に解明するために、それぞれのオートファジーモジュレーターの抗コロナウイルス効果を個別に試験していることが観察された。
このように、オートファジーとコロナウイルスの複製サイクルは、いくつかの異なる段階で収束することが示されていることから、オートファジー修飾薬の組み合わせを含む治療戦略は、相乗効果をもたらす可能性があり、研究する価値がある。この意味で、現在の併用療法の中では、(ヒドロキシ)クロロキンとアジスロマイシンの併用療法がよく行われている[114,115]。
考慮すべきもう一つの重要な要因は、この分野での生体内試験(in vivo)研究の数が少ないことである[118]。しかし、複雑なバイオシステム内での結果は、細胞内培養試験とは大きく異なる可能性があるため、これらの研究は、臨床導入に向けたこれらの薬剤の真の可能性を評価するために不可欠である。
この意味で、試験管内試験(in vitro)で観察された阻害効果にもかかわらず、(ヒドロキシ)クロロキンの単独またはアジスロマイシンとの併用による治療は、臨床試験においてSARS-CoV-2感染症に対する有益性を示していない[119,120]。
さらに、生体内試験(in vivo)では副作用の可能性だけでなく、コロナウイルスは同じような複製レベルを示していても病原性が異なる可能性があるという逆説的な問題も明らかにされている[8]。
最後に、オートファジーは適応免疫応答においても重要な役割を果たしており[24,25,26]、実験的治療にオートファジーモジュレーターを使用する際には、長期的には有害であったり有益であったりする可能性があるため、生体内試験(in vivo)での試験はこの意味での意味合いを決定するために不可欠である。

