Contents
COVID-19 and obesity: fighting two pandemics with intermittent fasting
www.ncbi.nlm.nih.gov/pmc/articles/PMC8226104/
オンラインで2021年6月25日公開
Kafi N. Ealey,1,3,⁎ Joy Phillips,1,3 and Hoon-Ki Sung1,2,⁎
概要
肥満は、新型コロナウイルス019(COVID-19)による重症化や死亡のリスク増加と強く、かつ独立して関連している。体重増加に伴う病態生理の変化は、代謝機能障害、慢性炎症、免疫応答の低下、多臓器障害を引き起こし、COVID-19による重症化への脆弱性を高めている。世界中で予防接種戦略が進められているが、パンデミックの第2波、第3波に加え、新規の重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)株の出現により、世界中の医療システムの安定性が脅かされ続けている。さらに、これまでのパンデミックの経験から、肥満の人は健康な人に比べて長期的なワクチンの効果が低いことが示唆されている。したがって、ウイルス感染による合併症や重症化のリスクを低減するためには、代謝と免疫力を高めることができるライフスタイルの改善を検討することが重要だ。この総説では、体重超過とCOVID-19の罹患率を結びつける潜在的なメカニズムについて論じている。また、近年注目されている食事プログラムである断続的断食(IF)が、代謝の健康と免疫力を向上させ、COVID-19の罹患率や死亡率に対する肥満の影響を軽減するための有効な戦略である可能性を示す証拠を紹介する。
キーワード:肥満、COVID-19,糖尿病、断続的断食、免疫反応
2つのパンデミックの交錯
COVID-19のパンデミックは、社会的・経済的に壊滅的な影響を及ぼす大きな健康危機をもたらした。複数の臨床コホートによる研究で、肥満はSARS-CoV-2感染時の合併症、疾患の重症度、死亡率の増加と関連することが示されている[1., 2., 3.]。米国内でのCOVID-19による90万件以上の入院を対象としたリスク評価分析では、これらの入院の約3分の2が心血管疾患、すなわち肥満、糖尿病(DM)高血圧、心不全に起因するものであり、肥満は入院の30%を占めてた[4]。肥満度の高いCOVID-19患者は、年齢、性別、糖尿病、高血圧とは無関係に、非肥満患者(BMI 25kg/m2未満)と比較して、重症肺炎を発症しやすく、肺の病理学的変化や損傷がより重篤で、死亡リスクが高いことが報告されている[1,2,5,6]。
COVID-19の急速な広がりとは異なり、肥満のパンデミックは数十年にわたってゆっくりと勢いを増している。肥満の世界的な有病率は1975年から 2016年の間に3倍に増加し、世界保健機関によると 2016年には世界の18歳以上の成人のうち6億5千万人以上が肥満であったとされている(https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight)。過剰な脂肪組織は、慢性的な全身性の炎症や2型糖尿病(2型糖尿病)を含む多くの代謝障害の原因となる炎症性因子の主要な供給源である[7]。SARS-CoV-2に感染すると、さまざまな臨床反応が起こる(囲み記事1)。COVID-19の感染とサイトカインストームによる重篤な合併症は、BMIが高く、糖尿病を患っている人でより顕著に見られる[2,8]。このことは、肥満に伴う炎症と代謝障害が病気の重症度を高め、2つの世界的なパンデミックが交錯する危険な状態に陥っていることを示唆している。
BOX 1 SARS-CoV-2感染症の臨床的特徴
現在、多くのCOVID-19ワクチン候補が規制当局の承認を受け、ワクチン接種に使用されている。しかし、人口の60~70%が免疫を獲得する必要があると推定されている集団免疫の達成には、依然として障壁がある[9]。ワクチンのためらい、製造の遅れ、流通の格差、ワクチンに耐性を持つ可能性のある、より伝達性の高い新たなSARS-CoV-2の変異株の出現などの要因により、パンデミックが継続する可能性が高まっている[9]。さらに、肥満の人たちは、ワクチン接種に対する反応が悪いことが知られている[10,11]。炎症性サイトカインのベースラインレベルの上昇や高血糖などの不健康な代謝プロファイルは、COVID-19に対する免疫応答の機能不全と有意な相関関係がある[12,13]。したがって、COVID-19の影響を軽減するために、代謝と免疫の健康を促進するライフスタイルの改善を実施することは、これまで以上に世界にとって有益であると考えられる。
この総説では、肥満、脂肪率、DM、COVID-19の重症度の関係を概観する。また、代謝機能と免疫機能を向上させ、COVID-19による重症化のリスクを低減できる可能性のある戦略として、断続的断食を取り入れた生活習慣を提案する(囲み記事2)。最後に、世界的なパンデミックの際に断続的断食を導入することの利点と課題について、我々の見解を述べる。
BOX2 食事と運動による肥満の管理
エネルギー摂取量の制限は、長寿、疾病予防、老化防止など、人間の健康に有益な効果をもたらす [74,98]。従来のカロリー制限された減量法を遵守することの難しさに対処するために、断続的断食は効果的かつ実用的な代替手段として人気を博している。近年、断続的断食は多くの前臨床および臨床研究において、体重調節および血糖値コントロールのための効果的な介入であることが示されている[59., 60., 61., 64, 65]。食事の頻度やタイミングを変えずに総カロリー摂取量を慢性的に20〜40%削減すると定義されるCRとは異なり[74]、断続的断食はAL食と交互に断食期間を繰り返す[56]。断続的断食のサブタイプを図Iに示す。
図I 健康的なライフスタイルの比較
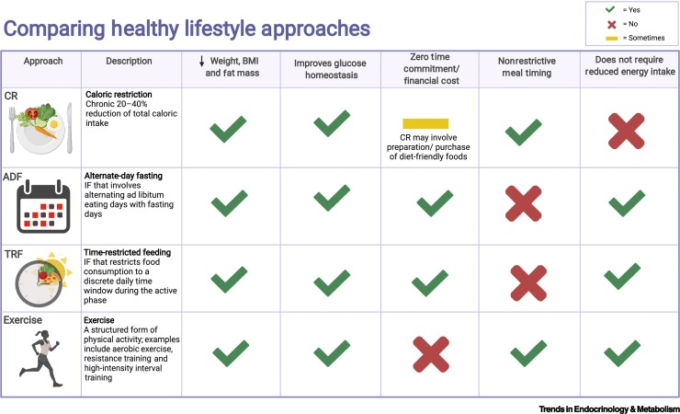
肥満の管理をサポートし、メタボリックヘルスを促進する生活習慣の介入には、カロリー制限(CR)交互断食(ADF)時間制限付き摂食(TRF)および身体運動が含まれる。これらの介入はすべて、体組成およびグルコースのホメオスタシスを改善することが示されている[56,63,98,99]。ADFやTRF(断続的絶食(断続的断食)の変異株)とは異なり、運動レジメンは実施するために時間と、多くの場合、財源を必要とする。状況にもよるが、これはCRレジメンにも関連する負担となりうる。さらに、CRではエネルギー摂取量が慢性的に制限されるため、長期的なアドヒアランスには独自の課題がある。ADFとTRFの主な利点は、全体のエネルギー摂取量が制限されないことであるが、これはしばしばこれらのレジメンの意図しない結果である[59]。しかし、断続的断食では食事のタイミングが制限されるため、アドヒアランスには独特の課題がある。図はBioRender.comで作成した。略語BMIはbody mass indexの略。
中等度から高強度の定期的な運動は、体重および脂肪量を減少させることが示されているが、運動のみでは一般的に体重減少がわずかであるか、臨床的に重要でないことを示唆する証拠がある[99]。1件の試験では、肥満の成人を対象に、週3日、12週間にわたって断続的断食と持久運動を組み合わせることの効果が評価された [100]。体重およびBMIは両群ともに減少したが、両介入の組み合わせにより、これらのパラメーターの優れた減少が得られた [100]。興味深いことに、断続的断食と併用群では脂肪量が有意に減少したが、運動群では減少しなかったため、抗肥満アプローチとしての運動単独の限界が浮き彫りになった可能性がある[100]。これとは対照的に、あるメタアナリシスでは、断続的断食とレジスタンストレーニングを組み合わせた場合、レジスタンストレーニングのみの場合と比較して、体脂肪量の減少に対する効果は小さいか一貫性がないことが明らかにされており [101]、運動と断続的断食の組み合わせの利点を検証するためにさらなる研究が必要であることを示している。
身体活動がCOVID-19の重篤な転帰に対して保護的であることを示唆する最近の証拠があるため[102]、身体活動と食事介入の両方を取り入れたライフスタイルは、COVID-19の影響を軽減するための理想的なアプローチであると考えられる。しかし、COVID-19がパンデミックしている間、社会的距離を置くことで身体活動への参加に対する障壁が高まっていることを示唆する証拠がある[83]。断続的断食の利点の1つは、コストと時間をかけずに体重を管理できることである。一方、運動は一般的に時間、資源、施設へのアクセスを必要とし、運動不足に関連する障壁となる [103]。したがって、運動も断続的断食も体重管理のための魅力的な選択肢であるが、特に世界的な大パンデミックの際には、断続的断食がより現実的なアプローチとなる場合がある。体重減少のアプローチの説明と比較については、図I
高血糖とCOVID-19の病因
COVID-19の一般的な併存疾患である糖尿病は、他の併存疾患(例えば、年齢、性別、高血圧、心血管疾患)を調整した後でも、過度にコントロールされない炎症反応のリスクが高く、SARS-CoV-2肺炎を示すコンピュータ断層撮影(CT)画像のスコアが高く、機械的換気の可能性が高く、生存期間が短いことと関連している[14., 15., 16.]。COVID-19の進行と予後不良の要因として、血糖コントロール不良による高血糖が指摘されている[17., 18., 19.]。中国・武漢で行われた7000人以上のCOVID-19患者を対象としたある大規模なレトロスペクティブな多施設共同研究では、COVID-19と2型糖尿病を合併したコホートのうち、血糖値が十分にコントロールされている人は、血糖値のコントロールが不十分な人に比べて、有害な転帰、主要臓器損傷、全死亡、全併存疾患が有意に減少した[18]。他の研究では、入院時の空腹時血糖値の上昇は、入院期間の延長、院内合併症および死亡率の上昇と関連していた[20., 21., 22.]。このように、入院時の空腹時血糖値は、SARS-CoV-2のX線画像診断の最も優れた予測因子であることが報告されており[21]、過去の糖尿病の病歴にかかわらず、死亡率の独立した予測因子であった[20., 21., 22.]。
グルコース代謝障害とCOVID-19の重症度を結びつける機序
細胞内のグルコース代謝の亢進は,COVID-19の重症化につながる重要なメカニズムであると考えられる(図1).ある研究では、インフルエンザ感染によって活性化されるグルコース代謝経路であるヘキソサミン生合成の増加が、ウイルス感染時のサイトカインストームの誘導に重要なインターフェロン制御因子-5(IRF-5)のO-GlcNAシル化につながることが示された[23]。同様に、インフルエンザ患者では、IRF-5のO-GlcNAcylationが多く、血糖値が高く、これらは循環する炎症性サイトカインのレベルと密接に相関していた[23]。したがって、グルコース代謝および/またはグルコース利用経路を阻害することで、致命的なサイトカインストームを防ぐことができるかもしれない。IRF-5とそれに関連する炎症性サイトカインの発現は、市中肺炎インフルエンザウイルス感染症の重症度と予後に関連していた[24]。さらに、代謝性炎症のマーカーであるIRF-5は、糖尿病性肥満患者の皮下脂肪組織において、糖尿病性痩せ型/過体重者と比較して有意に上昇していることが報告されており[25]、炎症性M1表現型へのマクロファージの分極に関与していることが明らかになっている[25,26](図1)。IRF-5シグナル伝達経路の阻害は,重度のCOVID-19に対する潜在的な治療法として提案されている[27].
図1 高血糖症が媒介するコロナウイルス感染症2019(COVID-19)の病態
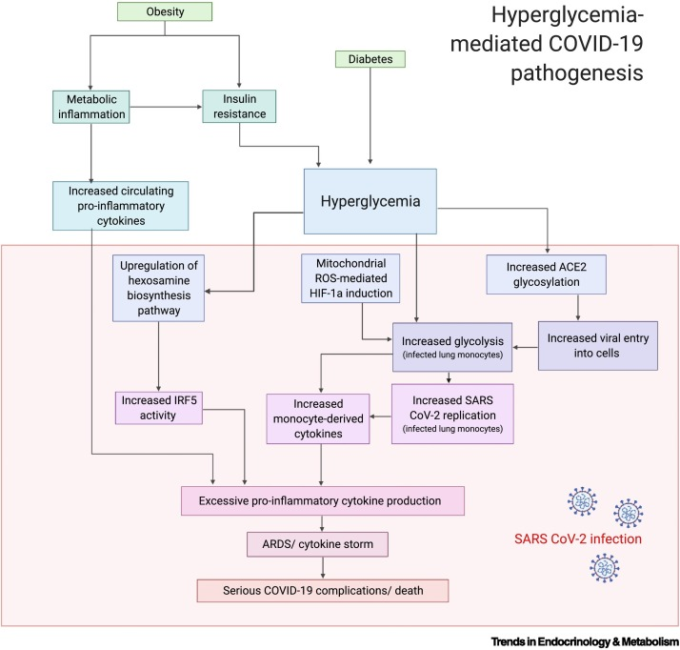 高血糖と血糖コントロール不良は、COVID-19の重症度と独立して関連しており、死亡リスクを高める[17., 18., 19.,21,22]。この関連性の病態生理学的メカニズムは、グルコース代謝経路の活性化の増加に関連していると考えられる。ウイルス感染によるヘキソサミン生合成の増加は、肥満者の脂肪組織で上昇している代謝性炎症のマーカーであるインターフェロン制御因子5(IRF5)のアップレギュレーションを通じてサイトカインストームに寄与している[23,24]。高血糖は、ヒト肥満糖尿病患者の単球における重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)複製の増加と関連しており、ウイルスの持続的な増殖、サイトカインストームの誘導、T細胞の機能障害につながってた[8]。さらに,高血糖は,SARS-CoV-2の受容体であるアンジオテンシン変換酵素2(ACE2)のグリコシル化を促進する可能性がある[28,29].図はBioRender.comで作成した。
高血糖と血糖コントロール不良は、COVID-19の重症度と独立して関連しており、死亡リスクを高める[17., 18., 19.,21,22]。この関連性の病態生理学的メカニズムは、グルコース代謝経路の活性化の増加に関連していると考えられる。ウイルス感染によるヘキソサミン生合成の増加は、肥満者の脂肪組織で上昇している代謝性炎症のマーカーであるインターフェロン制御因子5(IRF5)のアップレギュレーションを通じてサイトカインストームに寄与している[23,24]。高血糖は、ヒト肥満糖尿病患者の単球における重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)複製の増加と関連しており、ウイルスの持続的な増殖、サイトカインストームの誘導、T細胞の機能障害につながってた[8]。さらに,高血糖は,SARS-CoV-2の受容体であるアンジオテンシン変換酵素2(ACE2)のグリコシル化を促進する可能性がある[28,29].図はBioRender.comで作成した。
略語の説明 ARDSは急性呼吸窮迫症候群、H断続的断食-1aは低酸素誘導性因子-1α、ROSは活性酸素種。
グルコース濃度の上昇によって悪化した解糖系の増加は,単球におけるSARS-CoV-2の複製と炎症性サイトカインの分泌を促進することが示された[8]。SARS-CoV-2に感染した肥満の糖尿病患者から分離された単球は、健常者の単球と比較してウイルス量が増加したことから、高血糖の人は重篤なCOVID-19に罹患しやすい可能性があることがさらに証明された[8]。さらに、SARS-CoV-2の感染によって誘発されたミトコンドリアの活性酸素種の産生は、解糖系遺伝子をアップレギュレートする低酸素誘導因子-1α(H断続的断食-1α)の安定化をもたらした。したがって、制御されていない高血糖は、解糖系フラックスを増加させることで、SARS-CoV-2にとって許容範囲の環境を作り出す可能性がある[8]。
SARS-CoV-2の受容体であるアンジオテンシン変換酵素2(ACE2)の発現とCOVID-19の病態との関係は不明であるが(囲み記事3)高血糖状態ではACE2の機能に重要と考えられるグリコシル化が進み、ウイルスの侵入が容易になる可能性がある[28,29]。全ACE2ではなく、グリコシル化したACE2の発現は、肺におけるウイルスの結合と融合に関連している[30]。
BOX3 組織におけるACE2の発現とCOVID-19の病因との関係
SARS-CoV-2は、そのエンベロープのスパイクタンパク質がヒトの細胞受容体であるACE2に結合することで、宿主の細胞内に侵入する[104]。セリンプロテアーゼである膜貫通型セリンプロテアーゼ2(TMPRSS2)は、ACE2-受容体を介した結合とウイルスの侵入に不可欠である[104]。ACE2はユビキタスに発現しており、その発現は消化器系、特に回腸上皮細胞で最も高く、また、肺、腎臓、心臓、膀胱、脂肪組織でも発現している[48]。肺では、肺胞II型肺細胞(AT2細胞)と一過性の気管支分泌細胞集団がACE2とTMPRSS2を共発現しており、SARS-CoV-2感染の主な標的となることが疑われている[105]。
ACE2は、レニン・アンジオテンシン系(RAS)の重要な負の制御因子である[106]。AngIIタイプ1受容体を介したアンジオテンシンII(AngII)のシグナル伝達は、血管収縮反応を促進する[106]。ACE2は、AngIIの切断を触媒し、血圧の恒常性維持に有益な血管拡張剤であるアンジオテンシン1-7を生成する[106]。
脂肪組織は、ACE2が高発現しており、肥満ではさらに高発現していることから、SARS-CoV-2のリザーバーとなることが報告されている[107]。しかし、脂肪細胞におけるACE2の発現とCOVID-19の病態との関係は不明である。肥満マウスの肺組織では、痩せ型マウスに比べてACE2の発現が有意に増加しており、肥満者のヒト肺上皮細胞では、非肥満者に比べてACE2とTMPRSS2の両方が増加していた[108]。このことは、SARS-CoV-2の細胞内への侵入を促進する可能性がある。しかし、SARS-CoV-2の感染は、ACE2の発現をダウンレギュレートし、このプロセスが肺の損傷に寄与し、疾患の重症度を高めると理論づけられている[104,109]。COVID-19感染症の重篤な症状に強く関連すると報告されている病態には、ある程度のACE2欠損が見られるという観察結果に基づき、SARS-CoV-2が宿主細胞に侵入することで誘発されるACE2のダウンレギュレーションは、ベースラインでACE2が欠損しており、RAS系のバランスがより顕著に崩れている人に特に悪影響を及ぼす可能性が示唆されている[104]。ベースラインのACE2の発現を増加させることができる治療法は、COVID-19感染時のRASシステムの誇張された不均衡を軽減する可能性がある。特に、マウスでは、4週間の断続的断食治療により、HFDによる収縮期血圧の上昇が緩和され、ACE2の左心室での発現が増加し、心臓組織の有益なリモデリングと関連していた[110]。さらに、ヒトの研究でも、高血圧に対する断続的断食の効果が報告されている[58,63]。明らかに、組織内のACE2の発現とSARS-CoV-2感染に対する感受性およびCOVID-19の病態との関係は複雑であり、さらなる調査が必要である。
肥満、免疫、COVID-19
過剰な脂肪組織の蓄積は、抗炎症性代謝環境から抗炎症性代謝環境への表現型の変化を特徴とする慢性炎症の状態をもたらし、抗炎症性サイトカインの分泌が増加し、免疫反応が機能不全に陥り、COVID-19の重症化に大きな役割を果たしている可能性がある[7,31](図2)。インターロイキン(IL)-6は、炎症の中心的な原動力であり、COVID-19感染による疾患の重症度と死亡率の強力な臨床的予測因子であるが、循環するインターロイキン(IL)-6の少なくとも3分の1は、脂肪組織に由来すると推定されている[32,33]。非重症のCOVID-19患者と比較して、重症のCOVID-19患者は、入院時のベースラインの血中IL-6濃度が有意に高く、疾患の経過とともに上昇したことから、ベースラインの血中IL-6がCOVID-19の予後マーカーとなる可能性が示唆された[13]。同様に、ベースライン(すなわち、入院時)の血清IL-6,IL-8,および腫瘍壊死因子α(TNF-α)の高値は、患者の生存を強くかつ独立して予測するものである[12]。
図2 肥満が代謝および免疫機能に与える影響
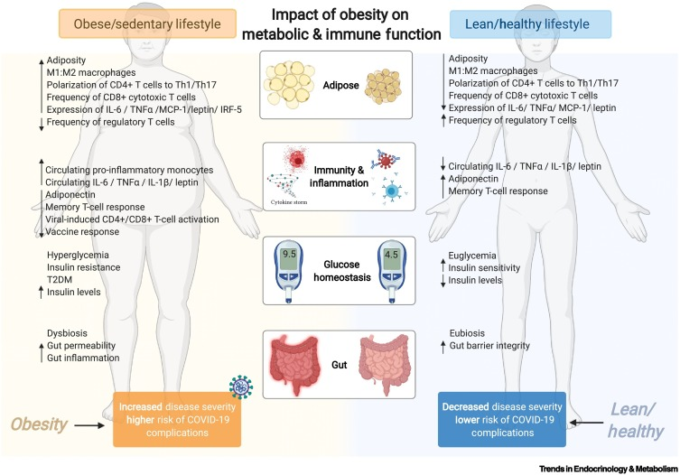
過剰な脂肪の蓄積は、組織の微小環境が抗炎症性から抗炎症性へと表現型が変化することを特徴としている。この変化には、抗炎症性(M1様)マクロファージと抗炎症性(M2様)マクロファージの比率の増加、Tヘルパー1(Th1)Th17,CD8+細胞傷害性T細胞への偏りの強化、制御性T細胞の減少などが含まれる[7]。これらの変化により、ベースラインの炎症性サイトカイン(インターロイキン-6(IL-6)腫瘍壊死因子α(TNF-α)IL-1β、レプチンなど)の循環レベルが上昇し[7,33] 、また頻度も増加する。[7,33]、単球の頻度も増加した。炎症性サイトカインの増加は、ウイルスによるサイトカインストームのリスクを悪化させ、組織傷害を促進し、急性呼吸窮迫症候群(ARDS)多臓器不全、そして最終的には死に至る可能性がある[12,97]。肥満の人々では、免疫細胞の活性化が弱まり、メモリーT細胞の反応が低下しているため、ウイルス感染による転帰が悪くなり、ワクチンの効果も低下する[10]。肥満になると、バリアー伝染性の増加やマイクロバイオームの異常など、腸の生理機能が低下する[51]。胃腸系(GI)は重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の侵入ターゲットと考えられていることから、腸内環境の悪化は重症コロナウイルス感染症2019(COVID-19)の発症の素因となる可能性がある。図はBioRender.comで作成。略語を使用している。2型糖尿病、2型糖尿病。
COVID-19の病因におけるレプチン
循環レプチンは、肥満の人で上昇することがよく知られている[7,31]。高レベルの循環レプチンおよび選択的レプチン抵抗性は、ウイルス感染に対する免疫応答の低下、ワクチン応答の低下、および慢性低級炎症に関与しているとされている[34]。レプチンは、COVID-19の進行段階において、急性呼吸窮迫症候群(ARDS)やサイトカインストームの重要な原因となる可能性がある。H1N1感染にチャレンジした肥満マウスは、痩せたマウスに比べて、より広範な肺の炎症と損傷を起こし、炎症性サイトカインの発現が亢進した[35]。重要なことは、抗レプチン抗体を用いてレプチンを阻害すると、これらの肥満マウスのサイトカインプロファイルと生存率が改善されたことである[35]。オランダの集中治療室(ICU)患者を対象としたある横断研究では、COVID-19を有する患者は、BMIを一致させた対照群(COVID-19を有していない)と比較して、血清レプチンレベルが有意に高かったという結果が出ている[36]。血中レプチンは、IL-6,CXCL10,TNF-αとともに、COVID-19の重症度や炎症性単球の活性化と有意に関連することが報告されている[37]。
肥満はワクチンの反応を損なう
最近の研究では,ヒトインフルエンザウイルスを接種した肥満マウスは,病気の重症度とウイルスの拡散の増加を示した[38]。さらに、肥満の宿主から得られたウイルスは、複製能力、遺伝子の多様性、病原性が増加していた[38]。免疫学的記憶の付与に重要であり、ワクチン接種戦略の主要な要素となる記憶T細胞反応は、肥満者では低下している[39,40]。インフルエンザワクチンを接種した成人のうち、肥満の人は、インフルエンザワクチン接種1カ月後の抗体価が同程度であるにもかかわらず、インフルエンザまたはインフルエンザ様疾患を発症する可能性が健康な体重の人の2倍あった[10]。さらに、病気の予防に関係するCD4+およびCD8+ T細胞の活性化と細胞傷害性は、肥満の人から採取した細胞では、健康な人から採取した細胞に比べて欠陥があった[10,11]。肥満はまた、インフルエンザワクチン応答の減衰、循環スイッチメモリーB細胞の減少、および炎症性の後期/疲弊した機能不全B細胞の増加と関連していた[41]。これらの反応には、レプチン抵抗性が関与している可能性がある。レプチン抵抗性に寄与するレプチン受容体(LEPR)のダウンレギュレーションとサイトカインシグナル伝達のサプレッサー(SOCS1,SOCS3など)のアップレギュレーションにより、食事誘発性肥満マウスモデルの肺では、インフルエンザ感染後84日目にインフルエンザ特異的CD8+エフェクターメモリーT細胞の維持が低下した[39]。
COVID-19ワクチンが世界的に広く承認されつつある中、これらのデータはCOVID-19ワクチン戦略の長期的な成功に大きく関わっている。公表されている臨床試験結果によると、ファイザー・バイオエヌテック社のCOVID-19ワクチンは、臨床試験参加者の3分の1を占める肥満の人(BMI≧30kg/m2)を含めて、COVID-19疾患の予防に95%の効果があった[42]。同様に、Modernaワクチンの臨床試験では、重度の肥満(BMI≧40kg/m2)を有する参加者におけるワクチンの有効性は、低リスクの他の参加者における有効性と同等(90%以上)であった[43]。このように、この高リスク群は、短期的にはワクチンに極めてよく反応することが示唆されている。しかし、肥満者が長期的にSARS-CoV-2ワクチンによる免疫をどの程度維持できるかは、まだ不明である(図2)。プレプリントとして発表されたある最近の研究では、肥満のある医療従事者は、正常体重に分類される人に比べて、ワクチン接種に対する抗体価が有意に低かったことから、ファイザー社のワクチンは肥満のある人では効果が低いと報告されている[44]。さらに、痩せ型のCOVID-19患者と比較して、肥満の患者はSARS-CoV-2特異的IgG抗体の血清レベルが有意に低く、BMIおよび炎症性マーカーの血清レベルと負の相関があることが報告されている[45]。これらのデータは、予備的なものではあるが、肥満における免疫反応の機能不全がCOVID-19にも及ぶ可能性を示している。
腸の健康とCOVID-19
COVID-19患者におけるGI症状の臨床症状はよく知られており[46]、COVID-19患者のかなりの割合でウイルスの糞便RNAが存在することが知られていることから、肺以外では、胃腸(GI)系がSARS-CoV-2のもう一つの標的となる可能性が高い[47]。ヒトの他の組織と比較して、ACE2は小腸の腸管細胞で高発現している[48]。SARS-CoV-2の直接侵入口として腸が果たす役割の可能性に加えて、腸の健康状態が悪いとCOVID-19の重症度や転帰に重要な影響を及ぼす可能性がある。腸管バリアー機能不全と腸内細菌叢の変化は、肥満に関連する特徴的な変化である[49]。腸内細菌叢の構成の変化は、異常な免疫反応やCOVID-19の重症化に関与すると推測されているが [50,51]、これを示す実質的な証拠はまだ得られていない。哺乳類の宿主とその常在菌である腸内細菌との間の絶え間ない相互作用は、適切な免疫系の発達、維持、および機能に不可欠である[52]。腸内細菌の異常は、肥満をはじめとする多くの慢性炎症疾患で広く観察されているが、重症患者においても劇的な異常が観察されており、ARDSや敗血症の病因に関与しているという仮説が立てられている[53]。その結果、COVID-19陽性の患者は、腸内細菌叢の多様性が低下し、日和見病原体が増加するなど、著しい腸内細菌叢の異常を示し、その状態はウイルスの除去後も持続した[50,54]。また、別の研究では、COVID-19患者は、COVID-19ではない対照群と比較して、マイクロバイオームが有意に変化しており、マイクロバイオータの組成が疾患の重症度と関連していることがわかった[51]。COVID-19患者では持続的な微生物異常が頻繁に認められることから、腸内細菌叢のパラメータを改善することで、長期的な合併症を改善し、COVID-19からの回復を早めることができる可能性がある[51]。
肥満および2型糖尿病患者における腸管バリア伝染性の増加は、細菌および細菌生成物の循環への漏出と関連しており、これは、炎症の主要な原因である代謝性エンドトキシン血症につながる[49,55]。細菌やウイルスの病原体が相乗的に作用することで、肺の損傷が増強されることが推測されており、肥満や2型糖尿病における腸管バリア機能不全がCOVID-19の重症度を悪化させるメカニズムが示唆されている[49]。
断続的断食はメタボリックヘルスを改善する
ヒトおよび動物実験から得られた説得力のある証拠は、断続的断食レジメン(囲み記事2)が、体重減少、脂肪率の低下、グルコースホメオスタシスの改善など、数多くの代謝上の利点を促進することを示している(図3)[56]。あるグループは、携帯電話のアプリケーションを使って健康な成人の食事パターンを追跡し、半数以上の人が平均15時間/日の食事をしているという不規則な食事パターンを示していることを発見した [57]。過体重の人を,1日10~11時間以内に食事を摂る時間制限給餌(TRF)レジメンに移行させると,体重が減少した [57].さらに、1日の食物摂取を8~10時間に制限すると、過体重/肥満の成人において、体重および脂肪率が有意に減少し、耐糖能が改善された[58,59]。この介入は、メタボリックシンドロームの1つ以上の構成要素を示す個人の腹部脂肪率も減少させた[60]。同様に、4時間および6時間のTRFレジメンは、肥満の人のグループにおいて、体重、脂肪量、酸化ストレスのマーカー、空腹時インスリンの減少、およびインスリン感受性の改善に対応することが明らかになった [61]。短期間の4日間、6時間の早朝TRFを行うと、過体重の成人の24時間平均血糖値が低下した [62] 。ある研究では、体重減少とは無関係に、断続的断食のポジティブな代謝効果が報告された。2型糖尿病のリスクがある男性を対象に、6時間の早期TRF(1日の早い段階ですべてのカロリーを消費する)を5週間行ったところ、12時間かけてカロリーを消費した人と比較して、体重が減少せず、総エネルギー消費量に変化がなくても、インスリン感受性の改善、酸化ストレスのマーカーの減少、血圧の低下がみられた [63]。同様に,等カロリー断続的断食は,遺伝的に肥満のマウスにおいて,体重や脂肪量の減少を伴わずに耐糖能を改善した [64].
図3 断続的絶食(断続的断食)とグルコースのホメオスタシス
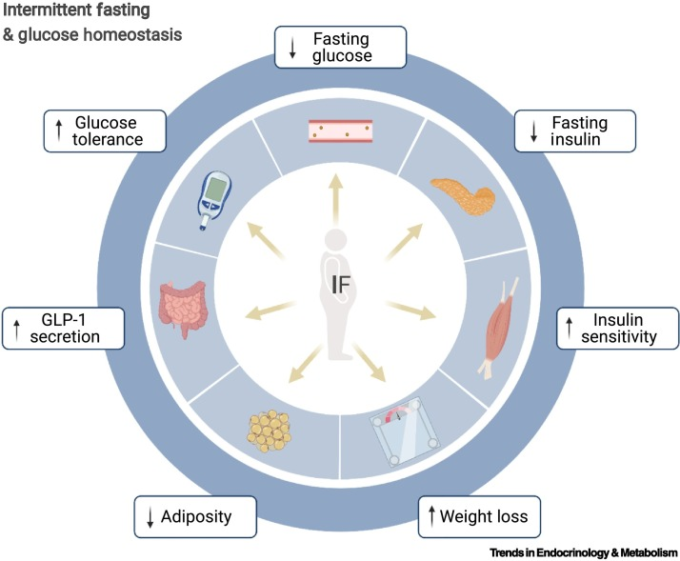
前臨床試験と臨床試験の両方から得られた証拠によると、様々な断続的断食レジメンは、体重が減少しなくても、あるいは全エネルギー消費量に変化がなくても、グルコースのホメオスタシスとインスリン感受性を改善することが示されている [63,65]。我々は、断続的断食による血糖コントロールが、コロナウイルス感染症2019(COVID-19)による重篤な合併症のリスクを低下させることに貢献できると提案する。図はBioRender.comで作成。略語の説明 GLP-1,グルカゴン様ペプチド1。
等カロリーの2:1の断続的断食食(2日給餌、1日絶食)を16週間摂取したマウスは、アドリビタム(AL)給餌マウスと比較して、食事誘発性肥満から保護され、グルコースホメオスタシスの改善とインスリン感受性の増加を示した[65]。様々な肥満の原因となる食餌を摂取したマウスにおいて,活動期に食物へのアクセスを8~9時間に制限すると,食餌やカロリー摂取量に関わらず,体重増加や脂肪蓄積を防ぎ,既存の肥満や耐糖能異常を回復させ,肥満マウスの脂肪組織の炎症マーカーを減少させた[66].
2型糖尿病の治療に広く用いられているグルコース低下作用のあるジペプチジルペプチダーゼ-4(DPP4)阻害剤は、COVID-19感染症の重症度を相殺する戦略として提案されている[67,68]。しかし、この適用に関するエビデンスは乏しく、この介入に関するさらなる研究が必要である。注目すべきは、DPP4がグルコースおよびインスリン代謝において役割を果たしており、脂肪細胞の炎症およびインスリン抵抗性と正の相関関係にあることである[69]。DPP4阻害剤は、腸内ホルモンであるグルカゴン様ペプチド1(GLP-1)受容体のアゴニストとして作用し、循環GLP-1濃度の上昇、膵島の反応の改善、グルコースホメオスタシスの向上をもたらす[69](図3)。肥満マウスでは,断続的断食がGLP-1の分泌を増加させており[64],DPP4阻害剤の機能を実質的に模倣することで,インスリン感受性を改善できる可能性がある。これらの知見を総合すると、グルコースホメオスタシスと脂肪率の改善を通じて、断続的断食とTRFの食事療法がCOVID-19の重篤な合併症のリスクを低下させる可能性が示唆される。
断続的断食は炎症を抑える
SARS-CoV-2感染に対する反応の低下に炎症因子や欠陥のある免疫細胞が予後に影響を与えるという証拠から、これらの循環因子を調節したり、記憶T細胞を増加させる戦略がCOVID-19に対する免疫反応を改善する可能性があると考えられる。グルコースホメオスタシスの改善と同時に、断続的断食による炎症性サイトカインの減少を報告した研究もあるが[70,71]、他の代謝改善にもかかわらず、これらのマーカーに変化がないと報告した研究もある[58,61,63]。世界中で何百万人ものイスラム教徒が行っているラマダン断食では、毎日12〜19時間の昼間の断続的断食を行う。ラマダン月中およびラマダン月外の両方において、断続的断食は、非断食時のベースラインレベルと比較して、循環TNF-α、IL-1β、およびIL-6レベルを低下させることが示されており、有意な体重減少およびグルコース代謝の改善を伴っている [71,72]。同様に、げっ歯類における断続的なカロリー制限(CR)は、ALを与えたマウスと比較して、IL-6,TNF-α、インスリン様成長因子1(IGF-1)およびレプチンの循環および脂肪組織レベルを有意に低下させた[70]。絶食や断続的断食戦略は、レプチンレベルを低下させ[66,70]、老化や、肥満、メタボリックシンドローム、自己免疫など、レプチンシグナルの調節不全を特徴とする他の状態に関連する免疫欠陥を修正することが示されている[65,73,74]。
慢性炎症疾患モデルマウスでは,発症前に6週間の交互断食(ADF)を行うことで,発症時の炎症性単球数が減少し,単球における炎症性遺伝子TNF-α,IL-1β,CXCL2,CXCL10の発現がAL飼料投与群に比べて低下した[75].さらに,ヒトとマウスでは,短期間の絶食により,単球の数が減少し,循環している炎症性単球と組織に留まっている炎症性単球の頻度がそれぞれ減少した[75].
マウスにCR食を与えると、記憶T細胞が骨髄(BM)のニッチにホーミングされ、二次感染時にこれらの細胞が迅速に動員され、AL食マウスと比較して、その後の微生物チャレンジに対する保護が強化され、宿主の生存期間が延長された[76]。CRと断続的断食で同様の反応が見られたことから、断続的断食でもメモリーT細胞のBMへの蓄積が促進される可能性が考えられる。48時間の長期絶食を複数回繰り返すと、造血幹細胞が更新・再生され、循環IGF-1レベルが低下することから、絶食と再摂食を繰り返すことで、末梢組織に浸潤する循環免疫細胞の頻度と構成が変化し、免疫系のリセットにつながることが示唆された[77]。これらの知見から、断続的断食は肥満者の免疫不全を回復させる可能性があり、その結果、COVID-19の合併症のリスクを低下させ、ワクチンの成功率を高める可能性のある、予防的、疾患軽減的なアプローチとして役立つ可能性があると考えられる(図2)。
オートファジーに対する断続的断食の効果
最近レビューされたように、断続的断食はオートファジーに関わる経路を活性化することで、宿主の免疫系を高める可能性もある[78]。肥満、低栄養、およびそれに伴う脂肪毒性は、オートファジープロセスの減衰と関連しているが [79] 、CRレジメンは、AMP活性化プロテインキナーゼによる哺乳類ラパマイシン標的(mTOR)の負の制御を通じてオートファジーを促進する [78] 。オートファジーは、細胞ストレスへの対処能力を向上させ、T細胞、B細胞、抗原提示細胞の生存と反応を強化することで宿主の免疫系を準備し、SARS-CoV-2感染による重篤な合併症を予防することができる[78]。TRFは太った人でオートファジーのマーカーを増加させ[62]、酸化ストレスを減少させることが報告されている[61,63]。
断続的断食は腸の健康を改善する
腸に対する断続的断食の効果についてわかっていることの多くは、動物実験から得られている。AL飼料を与えた対照群と比較して、空腹時模倣食(FMD)は、腸内細菌叢の多様性を増加させ、ファーミキューテス:バクテロイデテスの比率を低下させることが示されており、その結果として得られる表現型は、健康で痩せた腸の表現型と一致している [80]。属レベルでは、FMDグループは、空腹時血糖値と正の相関を示すいくつかの属の減少と、空腹時血糖値と負の相関を示す属の増加を示した[80]。HFD誘発肥満マウスを対象とした別の研究では、AL飼料を与えた対照群と比較して、ADF飼料を与えたマウスでは、腸内細菌叢の組成に有意な変化が見られ、微生物叢を枯渇させたマウスでは消失した有意な代謝の改善が見られた[81]。最後に、断続的断食は腸管依存的に広範な全身性の炎症を抑えることが示されている[73]。これらの研究を総合すると、断続的断食が腸の健康に役立つことで、代謝と免疫の健康が改善され、COVID-19患者の転帰が改善される可能性が示唆される。
結語と今後の展望
これまで述べてきたように、肥満と2型糖尿病は、COVID-19による重篤な合併症、サイトカインストーム、死亡率の発生率を高める。ワクチン流通の格差、ワクチンへの躊躇、SARS-CoV-2変異株の出現は、集団免疫を獲得する上での障壁となっており、COVID-19による病気の発生、入院、死亡が継続する可能性が高くなっている[9]。肥満が増加し、世界的にCOVID-19が継続的に発生する可能性がある中、炎症を抑え、血糖値をコントロールし、免疫力を高める戦略を開発することがこれまで以上に重要になっている。もちろん、そのためには、栄養過多や不適応な食習慣を抑制し、代謝機能の低下を防ぐ必要がある。我々は、脂肪率、メタボリックヘルス、グルコースホメオスタシス、抗ウイルス免疫反応、長期免疫、炎症性マーカー、腸に対する断続的断食の数多くの有益な効果を紹介してきた。肥満の人では、メモリーT細胞の活性化とワクチン接種に対する反応が鈍化するため、COVID-19ワクチン接種の長期的な有効性をめぐる重要な問題が残っている(「未解決の問題」を参照)[10,11,44]。最近の研究では、マウスの肥満に関連した微小環境が、より病原性の高いインフルエンザウイルス株の出現を促進し、痩せた宿主でより重篤な疾患を引き起こすことがわかった[38]。このことから、肥満の代謝表現型が将来の新しいCOVID-19変異株に影響を与える可能性があるという興味深い可能性が考えられる。
疑問点
COVID-19ワクチンの開発、試験、承認が比較的迅速に行われたため、現在のところ、肥満集団における有効性に関する長期的なデータはない。他のワクチンで観察されているように、COVID-19 ワクチン接種による長期免疫は、肥満の人では妨げられるのであろうか?肥満の人は、痩せている人に比べてワクチンによる免疫の低下が早いため、この集団は感染のリスクが高くなり、世界中で行われているCOVID-19ワクチン接種プログラムの全体的な成功に悪影響を及ぼすことが予想される。
断続的断食の臨床試験の多くは、比較的短期間に少数の参加者を対象に行われている。アドヒアランスが長期的に維持できるかどうかについての証拠はこれからである。さらに、抗ウイルス免疫の重要なパラメータである適応免疫、記憶T細胞、免疫系のリセット、腸の健康に対する断続的断食やCRの影響に関する証拠の多くは、前臨床研究から得られたものである。このことから、断続的断食戦略がSARS-CoV-2に特有の免疫病理学的メカニズムに影響を与えるかどうかという疑問が生じる。抗ウイルス免疫を向上させ、COVID-19の重症度を低下させる上で、断続的断食を含む食事療法の役割を検証する研究が非常に必要である。
この総説では、肥満、糖尿病、代謝不良の人において、断続的断食がCOVID-19の重症化リスクの低減に役立つ可能性があることを示している。しかし、これらの推定される効果が、痩せていて代謝の良い健康な人にも及ぶかどうかは、あまり明らかになっていない。COVID-19の症状が重症化するリスクは、高齢者、免疫力の低下した人、既往症のある人で大幅に増加することを考えると、断続的断食は、すでに体が弱く栄養不足に陥りやすいこれらの人の病状を悪化させる可能性があると考えられる。最終的には、断続的断食の有益性と安全性のプロファイルが、宿主のカロリー摂取量やベースラインの脂肪量および代謝の健康状態に依存するかどうかを明らかにするために、さらなる調査が必要である。
COVIDの時代に断続的断食を?
COVID-19パンデミックの結果、何十億もの人々が、社会的に距離を置いたり、強制的に閉じこもったりする様々な方法を実践し続けている。その結果、座りっぱなしのライフスタイルが増え、社会的孤立の期間が長くなり、身体的・精神的健康に悪影響を及ぼすことが報告されている[82,83]。世界的に見ると、パンデミックの間、食習慣は大きく変化した[84., 85., 86.]。一般的に、自宅で料理や食事をする時間が増え、運動する時間が減り、退屈し、ストレスを感じることで、過食や無意識の間食が生じている[85., 86., 87.]。また、パンデミックによるライフスタイルの変化により、健康的な食事を重視したり、免疫力や健康を高めるための戦略を模索したりする人もいる[84,87]。体を動かす機会が限られている現在の社会情勢を考えると、断続的断食レジメンのような食生活の変化は、パンデミック中の不健康な食習慣を抑制し、メタボリックヘルスを最大限に高めるための現実的な方法であると考えられる。特に、TRFレジメンは、1日中の空腹感の減少と関連しており、空腹感を伴わない間食や心置きなく食べることを抑制する[57,63]。さらに、断続的断食は、気分や感情の向上とも関連している[88,89](図4,主要図)。我々は、TRFまたは断続的断食は、食事の継続時間が短くても通常の食生活を維持できるため、従来の食生活よりも持続可能である可能性を提案する。多くの研究では、毎日の食事時間を短くすることで、意図せずに摂取カロリーが減少し、体重減少とそれに伴う代謝上のメリットが得られた[57,59]。しかし、断続的断食は、体重が減少しなくても、また全体のエネルギー消費量に変化がなくても、グルコースのホメオスタシスの改善など、代謝面でプラスの効果があることが示されている[63., 64., 65.]。ただし、これらの知見のほとんどは小規模な対照臨床試験から得られたものであり、体重や代謝パラメータに対するTRFの有意な効果がないことも報告されていることに注意しなければならない[90]。重要なのは、COVID-19 の疾患に関連して 断続的断食 レジメンが扱われていないことである(「未解決の問題」を参照)。最終的には、囲み記事2に概説されているように、栄養的なライフスタイルと身体活動の組み合わせが最も効果的であると考えられる。
図4 重要な図。コロナウイルス感染症2019(COVID-19)の時の断続的な断食(断続的断食)の様子
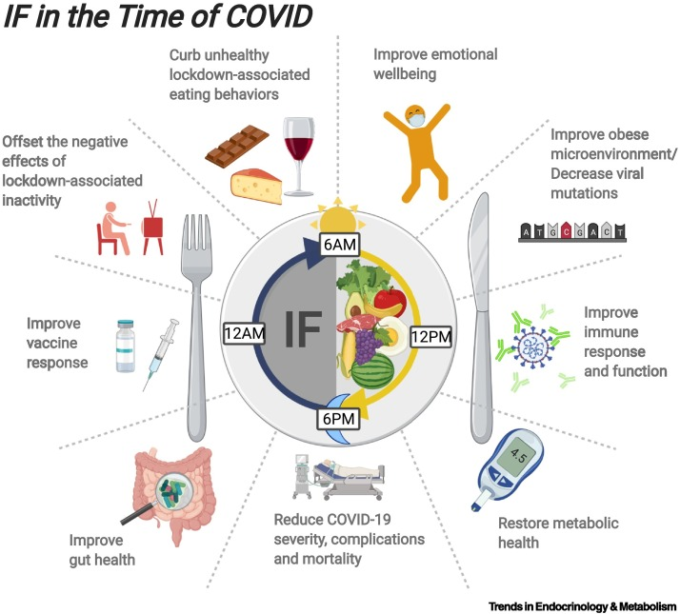
COVID-19のワクチン候補の数は増え続けているが、世界的な流通、アクセス、ワクチンの躊躇をめぐる多くのハードルが存在する[9]。そのため、この世界的なパンデミックに取り組み、集団での免疫を獲得することができるかどうかは依然として不明である。これらの課題に加えて、第2次および第3次感染の波によって、世界中の何十億人もの人々に自宅待機命令や外出禁止令が出されている。広範囲にわたる社会的孤立の代償として、座りっぱなしの生活への移行、食習慣や生活習慣の大幅な変化、ストレスの増大などが生じ、心身の健康が損なわれている[82,84,86,87]。我々は、免疫力を高め、代謝機能を回復させ、グルコースのホメオスタシスを改善することが報告されている断続的断食などの健康的な食事戦略を取り入れることが、この時期、特に肥満の人にとって特に重要であることを提案する。断続的断食戦略は、食事の構成を大きく変える必要はなく、食事の時間帯を個別に制限することができるため、専業主婦というユニークな社会環境に特に適している。図はBioRender.comで作成。
最後に、断続的断食戦略がすべての人に適しているかどうかについて、いくつかの懸念がある。摂取カロリーの減少を伴うある種の食事療法は、免疫抑制効果を利用して、抗SARS-CoV-2免疫反応を弱めてしまう可能性がある[91]。また、高齢者における断続的断食の効果についての報告は限られている。断続的断食は高齢者(65歳以上)に身体的・精神的なメリットをもたらすことが示されているが [92]、高齢者や免疫力が低下している人の健康増進のために断食戦略を推奨する場合は注意が必要である(「未解決の問題」を参照)。
結論として、断続的断食はエキサイティングで成長している研究分野であるが、特にCOVID-19の文脈において、抗ウイルス免疫に対する断続的断食の効果を確立するためには、さらなる研究努力が必要である。断続的断食がメタボリックヘルスの改善に大きな期待を寄せていることを考えると、この健康的なライフスタイル戦略を採用するには、今がこれまで以上に良い時期であると我々は主張する(図4)。
