Contents
COVID-19 and autoimmune diseases
www.ncbi.nlm.nih.gov/pmc/articles/PMC7880581/
オンラインで2020年12月15日に公開
要旨
レビューの目的
本研究の目的は,SARS-CoV-2への感染と自己免疫の関係を評価することである.
最近の知見
コロナウイルス感染症2019(COVID-19)は、重症急性呼吸器症候群(SARS)関連新型コロナウイルス(SARS-CoV-2)によって引き起こされる感染症である。感染者の多くは無症状であるが、COVID-19の患者の一部は多臓器損傷を伴う重症化する。自己免疫性リウマチ疾患の治療に用いられている薬剤の中には、重症のCOVID-19感染者に対して治療効果を発揮するものがあることが示唆されており、COVID-19と自己免疫疾患との関係が注目されている。COVID-19は、臨床症状、免疫反応、発症メカニズムにおいて自己免疫疾患と類似している。両疾患の病因には、強力な免疫反応が関与している。自己免疫疾患の特徴である自己抗体は、COVID-19の患者にも検出される。さらに、COVID-19感染後にギラン・バレー症候群や全身性エリテマトーデスなどの自己免疫疾患を発症した患者も報告されている。SARS-CoV-2は、宿主細胞との交差反応によって自己寛容を乱し、自己免疫反応を引き起こす可能性があると推測されている。自己免疫疾患患者におけるCOVID-19の感染リスクと予後についてはまだ議論の余地があるが、自己免疫疾患の再燃を防ぐために患者が投薬レジメンを遵守することが強く推奨される。
概要
COVID-19と自己免疫疾患との関連について、免疫反応の類似性、SARS-CoV-2の交差反応性、COVID-19患者の自己免疫疾患の発症、自己免疫疾患の既往症を持つ患者のCOVID-19感染のリスクに焦点を当てたレビューを紹介する。
キーワード:自己免疫疾患、COVID-19,交差反応性、分子擬態、SARS-CoV-2
序論
(イントロダクション
2019年12月以降、新型コロナウイルス感染症(COVID-19)と名付けられた新規感染症が中国の武漢で発生し、世界中を席巻している。COVID-19は 2020年3月11日にWHOによって正式にパンデミックと宣言された[1]。この病気は、新たに確認された重症急性呼吸器症候群(SARS)関連コロナウイルスの株が原因であり 2002年にSARSのパンデミックを引き起こしたSARS-CoVにちなんでSARS-CoV-2と名付けられた[2]。
SARS-CoV-2は,コロナウイルス科に属し,球形の形態と一本鎖RNA(ssRNA)のゲノムを持つエンベロープ型ウイルスである[3]。スパイク糖タンパク質(Sタンパク質)は、ウイルスのペプロスを横断し、王冠のような表面を形成している[4]。Sタンパク質のS1サブユニットに位置する受容体結合ドメイン(RBD)を介して,ウイルスは宿主細胞の受容体であるアンジオテンシン変換酵素2(ACE2)に合体し,細胞内に侵入することができる[5-7]。
SARS-CoV-2に感染した宿主は、多くの場合、発熱、疲労、乾いた咳などのインフルエンザ様の症状を呈する。また、COVID-19に感染すると、頭痛、筋肉痛、喉の痛み、吐き気、下痢などの症状が見られる [8,9]。重症例では息切れや低酸素血症が起こる。重症の場合、病気は急速に進行し、患者は敗血症性ショックや多臓器不全を起こすことがある[10]。このように、COVID-19は、皮膚、腎臓、呼吸器系、心臓血管系、消化器系、神経系、血液系などの多臓器に影響を及ぼす全身性疾患となり得ます[11]。SARS-CoV-2によって誘導された免疫反応の異常と炎症性サイトカインの増加は、疾患の病因と臓器障害に寄与しており、COVID-19の治療において免疫調節療法が注目された[12]。自己免疫疾患の治療に用いられる薬剤は、COVID-19の重症例に広く使用されている[13]。さらに、COVID-19の患者では、いくつかの自己抗体が検出されることがある[14]。これらの観察結果は、自己免疫疾患の発症に寄与することが知られている経路を調べることで、COVID-19をよりよく理解し、治療するための手がかりが得られるかもしれないことを示唆している。

SARS-COV-2感染と自己免疫疾患の間の免疫反応の類似性
自己免疫疾患は、免疫寛容性の喪失と免疫系の調節不全による自己抗体の存在と永続的な炎症反応を特徴とし、標的臓器の損傷や機能不全を引き起こす[15]。このような免疫介在性の傷害は、COVID-19にも存在する(図(1).1)。SARS-CoV-2に感染すると、免疫反応が誘発されるが、これはこのウイルスに対するワクチン戦略の開発に重要な意味を持つかもしれない[16]。T細胞免疫は、SARS-CoV-2感染の制御に中心的な役割を果たしている。抗原特異的なCD4+およびCD8+ T細胞と中和抗体反応は、SARS-CoV-2に対して保護的な役割を果たしているが、一方で、ナイーブT細胞の不足など適応免疫反応の低下は、病気の転帰を悪くする可能性がある[17]。
図1 SARS-CoV-2感染症と自己免疫疾患における類似した免疫反応
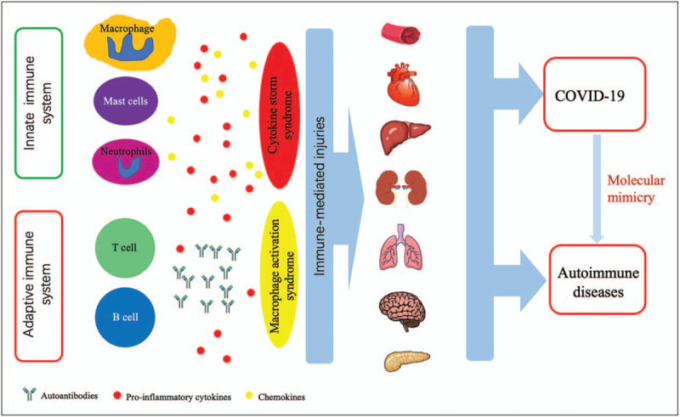
COVID-19も自己免疫疾患も、血液系、循環器系、消化器系、腎臓、肺、神経系、膵臓など、異なる臓器やシステムに関わるさまざまな臨床症状を呈する。臓器障害は、サイトカインの過剰産生と免疫細胞の過剰活性化を特徴とする制御不能な免疫反応と、自己抗体の産生につながる免疫寛容の破壊によって引き起こされる。SARS-CoV-2感染は、分子模倣による交差反応を引き起こし、COVID-19患者の自己免疫を引き起こす可能性がある。
臨床検査では、リンパ球減少(リンパ球数≦1.0 x 109 /l)はCOVID-19患者の重症化と関連しており、病気の重症度や死亡率の予後因子となる可能性がある[18-21]。もう一つの注目すべき血液細胞学的変化は、好中球増加症とそれに伴う好中球細胞外トラップの過剰であり、これは重症のCOVID-19患者の肺損傷と並行していた[12]。したがって、COVID-19では、免疫反応は両刃の剣であり、サイトカインの不均衡と免疫細胞の活性化の程度によって転帰が左右される。炎症性サイトカインやケモカインが過剰に産生・放出されると、重篤な場合には重篤な臓器障害を引き起こす可能性があり、これは自己免疫疾患でも観察される。COVID-19患者では、インターロイキン(IL)-1,IL-2,IL-6,IL-8,IL-10,IL-17,IL-18,CXCL10,CCL2などの炎症性サイトカインおよびケモカインが有意に増加しており、これらのサイトカインのうち、IL-1,IL-6,IL-10,IL-18などの一部の発現レベルは、疾患の重症度と関連することが実証されている[22-25]。自己免疫疾患と同様に、損傷関連分子パターン(DAMP)もCOVID-19の病因に関与し、疾患の転帰に関係している。Chenら[26]は、重症のCOVID-19患者では、S100A8/A9とHMGB1の血清レベルが有意に上昇し、この2つのDAMPsの有意な上昇が高い死亡率と関連していることを明らかにした。
COVID-19患者の臓器障害の病態には、免疫細胞の活性化と浸潤が関与している。マクロファージ活性化症候群(MAS)は、COVID-19において生命を脅かす合併症を引き起こすサイトカインストーム症候群の連続体である可能性がある[27]。この状態では、活性化されたマクロファージは過剰な炎症性サイトカインを産生し、炎症性のM1表現型に分極し、細胞傷害性の機能障害を示する[28]。最近、Contiら[29]は、SARS-CoV-2で活性化したマスト細胞がヒスタミンを放出してIL-1レベルを上昇させ、サイトカインストームを起こして肺傷害を悪化させると提唱した。Woodruffら[30]は、COVID-19を発症した重篤な患者において、自己免疫で観察されているのと同様の、濾胞外B細胞の活性化を発見した。さらに、濾胞外B細胞の活性化は、高濃度のSARS-CoV-2特異的中和抗体の産生や疾患の転帰の悪さと強く相関していた[30]。COVID-19では、末梢血B細胞亜集団が変化する。COVID-19患者では、非定型メモリーB細胞(CD21lo/CD27-/CD10-)が有意に拡大する一方で、定型メモリーB細胞(CD21+/CD27+/CD10-)は有意に減少した[31]。重症のCOVID-19患者の免疫プロファイルを分析したところ、成熟したナチュラルキラー(NK)細胞の割合が増加し、T細胞の数の割合が減少していることが明らかになった[32]。
全身性エリテマトーデス、抗リン脂質症候群、ANCA関連血管炎など、いくつかの自己免疫疾患や免疫介在性血栓炎症疾患と同様に、COVID-19では好中球の活性化と好中球細胞外トラップ産生(NETosis)が病原的な役割を担っているようである。Zuoら[33▪]は、COVID-19患者の血清中のNETsのマーカーが増加し、機械的換気を必要とする患者では有意に多いことを報告した。試験管内試験実験では、COVID-19患者からの血清が、抗リン脂質症候群患者からの血清と同様に、正常な好中球のNETosisを誘発することが示された[33▪,34]。
重症・重篤な症例では、COVID-19の強固な免疫反応を抑制するために、炎症性サイトカインを標的とした免疫調節薬や生物学的薬剤が適用されてきた。コルチコステロイド、JAK阻害剤、IL-1遮断剤、IL-6受容体拮抗剤など、リウマチ専門医にはおなじみの薬剤が、COVID-19患者の治療に用いられている[35-38]。COVID-19と自己免疫疾患の免疫病因の類似性を表表11にまとめた。
表1 COVID-19 と自己免疫疾患の免疫病学的特徴の類似性
分子ミミクリーとSARS-COV-2
自己抗体の産生は、自己免疫疾患の重要な特徴である。しかし、その根本的なメカニズムは複雑で、いまだ完全には解明されていない。感染性病原体による分子模倣は,そのメカニズムの一つであると考えられている[39]。ウイルス感染は、交差反応性の抗体を誘発する抗原エピトープの暴露によって、免疫寛容を乱すことがある。ウイルスとヒトのタンパク質の間には、抗原性の擬態を示す報告が数多くある。おそらく、自己免疫における分子模倣の最も確立された例の一つは、全身性エリテマトーデス患者のエプスタインバーウイルス(EBV)に対する免疫反応であろう[40]。エプスタインバーウイルス核抗原-1 (EBNA-1)に対する異常な免疫反応は、SmおよびRo自己抗原システムを標的とした自己免疫反応を誘発することがある[41]。多発性硬化症の患者における抗EBNA-1抗体とミエリン塩基性タンパク質との間の交差反応性も示されている[42]。さらに、EBNA-1は、多発性硬化症に関与する脳タンパク質であるβシヌクレインと構造的な類似性を示し、HLAクラスII DR2b (HLA-DRB1∗15 : 01) と結合することが予測されている[43]。また,ヒト内在性レトロウイルス(HERV)のエンベロープタンパク質が,多発性硬化症で自己免疫反応を引き起こす3つのミエリンタンパク質と類似した配列を持ち,HLA-DRB1∗15 : 01と結合することがin silico解析で明らかになった。 Basavalingappaら[44]は,コクサッキーウイルスB3(CVB3)の感染が,複数の抗原に対する自己反応性T細胞の生成を誘導することを示した。
SARS-CoV-2 のエピトープの中には、自己抗原との交差反応性を示すものがあることが明らかになった。Anandら[45]は,SARS-CoV-2のユニークなS1/S2切断部位が,気道表面の液体の恒常性維持に重要な役割を果たしているヒト上皮性ナトリウムチャネルαサブユニット(ENaC-α)のFURIN切断可能なペプチドと同一であることを報告している。SARS-CoV-2と,ヒト脳幹前ベッツィンガー複合体(preBötC)に存在する3つのタンパク質,すなわちDAB1,AIFM,SURF1との間の模倣が,COVID-19の呼吸不全の原因となっている可能性がある[46].さらに、SARS-CoV-2の感染は、分子模倣によって自己免疫反応を誘発する可能性がある。Marino Gammazzaら[47]は、ウイルスタンパク質とヒトの分子シャペロンを比較し、そのほとんどが熱ショックタンパク質であるシャペロンが、SARS-CoV-2感染後の分子模倣現象に関与している可能性を推測している。さらに、LuccheseとFlöel[48]は、ウイルスのアミノ酸配列と免疫介在性多発神経炎に関連するヒト自己抗原を比較し、SARS-CoV-2の免疫反応性エピトープに埋め込まれたペプチドが、ギラン・バレー症候群やその他の自己免疫疾患に関連するヒト熱ショックタンパク質90および60と同じ配列を持つことを示した。Venkatakrishnanら[49▪]は、SARS-CoV-2とヒトの参照プロテオームとの間に交差反応の可能性がある33個の異なる8merまたは9merペプチドを報告し、そのうち20個のヒトペプチドは以前のコロナウイルス株では観察されなかった。さらに、SARS-CoV-2に模倣されたこれらのヒト8-mer/9-merペプチドのうち4つは、宿主の肺動脈ペプチドとの類似性を示し、HLA-B∗40 : 01,HLA-B∗40 : 02,HLA-B∗35 : 01と結合することが予測された[49▪]。最近の研究では、ウイルスの最小エピトープ配列を定義するヘキサペプチドとヒトのプロテオームとの共有を分析し、ヒトのタンパク質と共有する多数の免疫反応性エピトープを記録した[50]。本研究の結果は、SARS-CoV-2が宿主の自己抗原との交差反応を引き起こす可能性を示唆しており、SARS-CoV-2感染後の様々な臨床症状や、様々な臓器や器官を含む病態を説明するヒントになると考えられる。
COVID-19患者における自己抗体
多くの自己免疫疾患で生じることが知られている自己抗体が、COVID-19の患者から検出されている(表.2)。Pascoliniら[14]は、連続したCOVID-19患者33名を対象に、抗核抗体(ANA)、抗血小板好中球抗体(ANCA)、抗抗抗リン脂質(APL)抗体の有無を判定した。その結果、45%の患者が少なくとも1つの自己抗体を陽性とし、自己抗体が陽性の患者は予後が悪く、入院時の呼吸数が有意に多い傾向が見られた。ANAの陽性率は33%、抗カルジオリピン抗体(IgGおよび/またはIgM)の陽性率は24%、抗β2糖蛋白質I抗体(IgGおよび/またはIgM)の陽性率は3名(9%)であった。しかし、ANCAはすべての患者で陰性であった[14]。凝固障害は、SARS-CoV-2感染症の脅威的な合併症である。最近、モンテフィオーレ医療センターで、COVID-19患者の全身性エリテマトーデスアンチコアグラント陽性を評価するコホート研究が行われた。その結果、COVID-19患者は、COVID-19逆転写酵素PCR法で陰性と判定された対照群と比較して、全身性エリテマトーデスアンチコアグラント陽性の発生率が高いことがわかった。さらに、全身性エリテマトーデスアンチコアグラント陽性のCOVID-19患者は、血栓症の発生率が増加していた[51▪]。また、Amezcua-Guerraら[52▪]は、重症・重篤なCOVID-19患者ではAPL抗体の頻度が高いことを示し、APL抗体の存在は、フェリチン、C反応性タンパク質、IL-6が極めて高い炎症性亢進状態や、肺血栓塞栓症と関連しているようだと述べている。以上のデータは、COVID-19の重症・重篤な症例における凝固性亢進状態を説明する可能性を示し、SARS-CoV-2が自己免疫反応を誘発することを示している。
表2 COVID-19患者で検出された自己抗体
| 自己抗体 | 臨床的な意義 | 参照。 |
| ANA | 予後不良と有意に高い呼吸数 | [ 14 ] |
| APL | 予後不良および有意に高い呼吸率過炎症状態および血栓症および血栓塞栓症との関連の可能性 | [ 14、52▪ ] |
| ループス抗凝固因子 | 血栓症の発生率が高い | [ 51■ ] |
| 寒冷凝集素 | 溶血性貧血。複雑な検査室評価と腎代替療法 | [ 55、58 ] |
| 抗Ro / SSA抗体 | 重度の肺炎との関連の可能性 | [ 56 ] |
| 抗Caspr2抗体 | 不明 | [ 54■ ] |
| 抗GD1b抗体 | 不明 | [ 54■ ] |
| 抗MOG抗体 | 不明 | [ 53 ] |
| 赤血球結合抗体 | 貧血の重症度に関連する | [ 57 ] |
神経学的症状を呈するCOVID-19患者では、コンタクチン関連タンパク質2(抗Caspr2)ガングリオシドGD1b(抗GD1b)ミエリンオリゴデンドロサイト糖タンパク質(抗MOG)に対する自己抗体の存在が、症例報告やレトロスペクティブ・スタディで示されている[53,54]。しかし、これらの抗体の臨床的意義はまだ不明である。さらに、COVID-19を発症した重症患者に寒冷凝集素と赤血球抗原に対する自己抗体の存在を示した症例報告があり[55]、COVID-19肺炎を悪化させた患者に抗Ro/SSA抗体の存在を示した症例報告がある[56]。113検体を対象とした研究では、直接・間接抗グロブリン試験(DATまたはIAT)により赤血球抗体を調べた。COVID-19患者の46%にDATの陽性が認められ、非COVID-19対照者よりも有意に高かった。赤血球膜に結合した免疫グロブリンの存在は、溶血性貧血に寄与し、COVID-19では貧血の重症度に関係しているとされている[57]。
SARS-CoV-2感染後の自己免疫疾患の発症
SARS-CoV-2感染は、免疫寛容を破壊し、自己免疫反応を誘発するため、臨床的な自己免疫を誘発する可能性も高い。実際、SARS-CoV-2感染後に自己免疫疾患の発症が確認された報告は多い。COVID-19の合併症として、寒冷凝集素症候群(CAS)や自己免疫性溶血性貧血が報告されている[55,58,59]。一方、ギラン・バレー症候群(GBS)もCOVID-19患者に発症する可能性のある自己免疫疾患として登場している。COVID-19に関連したGBSのほとんどの症例では、脳脊髄液(脳脊髄液)中にSARS-CoV-2抗体が検出されないが、Gigliら[60]は最近、脳脊髄液中のSARS-CoV-2抗体の検査で陽性となったGBSの症例を報告した[61,62]。SARS-CoV-2がどのようにしてGBSを誘発するのか、そのメカニズムは議論されている。しかし、エピトープと宿主の抗原との間の免疫的な交差反応は、可能な説明であるかもしれない[62]。最近では、SARS-CoV-2が引き金となって全身性エリテマトーデスを発症した例も報告されている[63▪]。今後、SARS-CoV-2によって誘発される自己免疫疾患がさらに報告される可能性がある。
COVID-19パンデミックにおける自己免疫疾患患者のリスク
自己免疫疾患は不均一で、免疫系の調節不全と関連している。自己免疫疾患の患者のほとんどは、免疫調整剤や生物学的製剤の投与を受けているか、または受けている。COVID-19のパンデミックの際には、自己免疫疾患患者の一部が、薬の免疫抑制効果を恐れたり、利用できないことを理由に投薬を中断し[64]、SARS-CoV-2の伝染性を懸念して医療機関の受診を減らした[65]。しかし、医療の継続性の乱れや服薬不遵守は、リウマチ疾患の再燃や疾患活動性の悪化と関連している[66]。そのため、信頼性の高い遠隔医療プラットフォームを構築し、服薬アドヒアランスに関する教育を行うことが強く推奨される。
このパンデミックが始まって以来、自己免疫疾患患者の感染リスクは関心の対象となっている[67▪,68,69]。イタリア北東部で実施された横断研究の結果によると、自己免疫疾患患者のSARS-CoV-2感染率は、一般人口と比較して同程度であることが示された[70]。ミラノで実施された別のイタリアの研究でも、自己免疫疾患はCOVID-19陽性の危険因子ではないことが確認されている[71]。一方、中国の湖北省で実施された多施設共同レトロスペクティブ研究の結果では、自己免疫疾患の患者は対照群と比較してSARS-CoV-2に感染しやすい可能性が指摘されている。さらにこの研究では、発生時に同じ環境に住んでいた患者の家族を対照として調べている[72]。興味深いことに、ミラノの研究では、自己免疫疾患の患者は非自己免疫疾患の患者と比べて予後が悪くないことが示されている[71]。しかし、スペインの研究では、自己免疫疾患の入院患者は、COVID-19の経過がより重篤であることが明らかになった[73]。現時点では、より多くのデータが得られるまで、すべての人、特に自己免疫疾患の患者に対して、物理的な距離を置くこと、マスクを着用すること、頻繁に手を洗うことの重要性を強調することが極めて重要だ。また、臓器障害を引き起こす可能性のある自己免疫疾患の再燃を防ぐためには、投薬を遵守することが非常に重要だ。
結論
COVID-19は、世界の健康に重大な影響を与えた新しいパンデミックである。全身性自己免疫疾患と同様に、COVID-19も不均一で全身性の臨床症状を呈することがある。両疾患の病態における免疫反応にはある程度の類似性があり、COVID-19の臓器障害は自己免疫疾患と同様に免疫を介したものが多いようである。SARS-CoV-2ウイルスは、少なくとも部分的には分子模倣によって宿主抗原の自己寛容を乱すことができる。実際、COVID-19では、自己抗体や、時には臓器特異的(GBSなど)または全身性(SLE様疾患など)の自己免疫の発現が観察されている。全体として、COVID-19と自己免疫の関係をさらに理解し、既存の自己免疫疾患を持つ患者におけるCOVID-19のリスクと重症度を特徴づけるためには、さらなるデータが必要である。

