Contents
ACE・ACE2 RAS 覚書
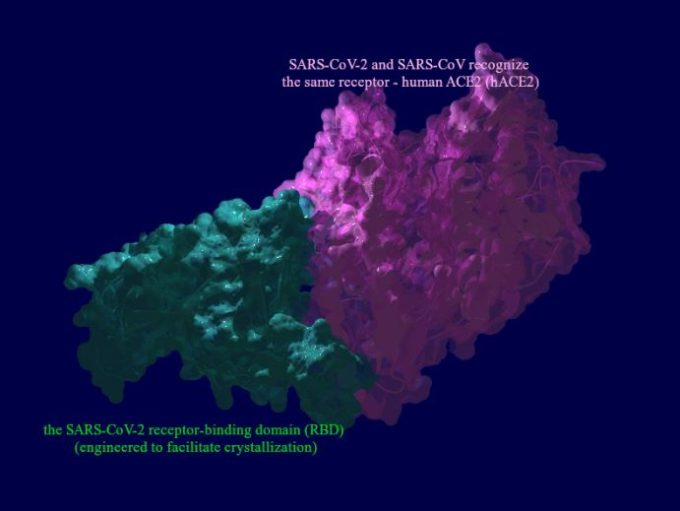
アンジオテンシン変換酵素2を用いたSARS-CoV-2の複製のための細胞内への進入機構の概要:レニン-アンジオテンシン系に関連した治療法の可能性
academic.oup.com/ehjcvp/advance-article/doi/10.1093/ehjcvp/pvaa053/5848372
抄訳
SARS-CoV-2はアンジオテンシン変換酵素2(ACE2)と結合して細胞内に侵入するため、ACE2を標的にしてそのような結合を防ぐことは、感染と闘うための明白な戦略であると思われる。しかし、ACE2は細胞外で機能しており、アンジオテンシンII型1型受容体(AT1R)によるエンドサイトーシスによってのみ細胞内に侵入し、その後ACE2は破壊されることが明らかになった。
このことから、AT1Rを阻害してACE2の細胞内への取り込みを阻止することは、SARS-CoV-2の細胞内への侵入を制限するためのより論理的なアプローチであると考えられる。
ACE2は重要な生物学的プロセスを維持する上で重要な防御的役割を果たしているので、感染の悪影響を相殺するために、治療法はACE2の機能的能力を破壊してはならない。
既知のメカニズムとSARS-CoVの特徴に関する知識に基づいて、免疫系がSARS-CoV-2の複製を促進し、それが免疫制御機構を混乱させるという仮説を提案する。
提案されたSARS-CoV-2が病気を引き起こすメカニズムは、AT1Rがこのプロセス全体の鍵を握っていることから、直ちに治療法の可能性を示唆するものである。
AT1Rアンタゴニストは、SARS-CoV-2感染症の治療に理想的な候補であると考えられる。AT1Rアンタゴニストは、アンギオテスニンIIの負の結果を相殺し、さらに、ACE2の機能を阻害することなく、ウイルスの細胞内への取り込みを防ぐことに関与している可能性がある。
AT1Rアンタゴニストは広く入手可能であり、安価で安全である。したがって、SARS-CoV-2の治療にAT1Rアンタゴニストを使用することを検討することを提案する。
感染症に対する免疫応答におけるRASの機能
AngⅡ活性化による一酸化窒素産生の阻害
以前に遭遇したことのないウイルスに感染すると、宿主からの最初の免疫反応は自然免疫的で非特異的だ。適応的でウイルス特異的な反応は、かなり後に起こる。10,18 活性化したAngIIは一酸化窒素(NO)の産生を阻害し、顕著な炎症反応を引き起こす19 。NOの欠乏は血管収縮と血管透過性の亢進を誘導し、低酸素を防ぎ、活性化した感染部位へのサイトカインの侵入を促進する。
AngIIはT細胞で内因性に産生され、T細胞の活性化と作用部位への移行に重要な役割を果たしている20 。SARS-CoVやMERS-CoVの感染では、ウイルス特異的なT細胞のプライミングが低下し、コロナウイルスを認識するT細胞の数が制限されている21 。このような状況では、AngIIの活性化は非特異的な自然免疫反応を維持し、ウイルスが細胞内に入って複製し、ACE2が破壊されるまでの期間を延長する。
AT1RとAT2R
AngIIは、AT1RとAT2Rという2つの異なる受容体に関与することがあり、これらは逆の役割を果たしている。AT1Rは、細胞表面で膜結合したACE2のエンドサイトーシスを促進し、分解のためにリソソームに送達する。対照的に、AT2Rは機能性ACE2の活性化を誘導し、AngIIをAng(1-7)に変換する。
SARS-CoV-2をACE2に結合させてウイルスをエンドサイトースし、複合体をリソソームに誘導して破壊することは、ウイルス負荷を制限するための代替戦略と考えられている14 。しかしながら、特定のpHに達すると、ウイルスエンベロープはリソソームに到達する前にエンドソームと融合し、その後の複製のためにウイルスを細胞質に放出する可能性がある23 。
ACE2がリソソームに到達する前に、SARS-CoV-2はエンドソーム膜と融合して脱出し、細胞質に移動して複製する。AT2Rはその後、ACE2の産生を誘導し、ACE2はAngIIをAng(1-7)に変換し、さらに適応免疫応答に必要なNOの産生を誘導する27(図2)。これと並行して、炎症が減少し、ウイルス特異的免疫が非特異的炎症反応に取って代わるようになる27。
SARS-CoV-2の複製機構の仮説と治療は、ウイルスの複製を防ぎ、適応免疫応答の活性化を開始することを目的としている。
炎症時、NOが存在しない場合、AngIIはAT1Rを活性化する。AT1RはACE2が結合したSARS-CoV-2の細胞内取り込みを誘導する。AT1Rの阻害は、ウイルスの取り込みを阻害し、AT2R誘導ACE2発現およびその後の適応免疫応答の活性化を促進する。
スーパーオキシドの産生による細胞ストレスシグナル
残念なことに、SARS-CoV、そしておそらくSARS-CoV-2は、活性酸素種(ROS)、特にスーパーオキシドの産生を誘導するが、これは細胞ストレスシグナルの機能を果たしている28。
NOが存在しない場合、AngIIはAT1R経路を促進し30、その結果、膜結合したACE2のエンドサイトーシスを誘導し、炎症反応を悪化させる。したがって、活動的なSARS-CoV-2感染時には、AT1Rを介したACE2の破壊が有害な役割を果たし、ウイルスの取り込みとAngIIによる炎症の両方を促進していることが示唆される。また、スーパーオキシドラジカルによるNOの破壊は、AngIIによる炎症の悪化をさらに誘導し、肺障害や肺水腫を引き起こする。
ACE2障害による他臓器への影響
ACE2は肺胞上皮のほか、腸、腎臓、心臓などの他の臓器にも発現している31 。SARS-CoV-2感染は、発症時に活動性心筋損傷、心筋ストレス、心筋症と関連していることが示されています32 。AngII値の上昇に関しては、SARS-CoV-2感染によりACE2が破壊されたことにより、凝固および線溶の増加と関連していることが最近明らかになり、Dダイマーおよび心血管血栓症イベントの高値が観察された。
AT1RアンタゴニストによるSARS-CoV-2感染症の治療
以上のように、ACE2 に結合した SARS-CoV-2 感染は、正常な AngII:ACE2 のバランスを崩し、過剰な炎症反応を引き起こし、最終的には一部の患者に見られる「サイトカインの嵐」を引き起こす可能性がある。実際、AT1R アンタゴニストは、サイトカインの放出を媒介する肺の NF-κB および AP-1 の活性化を阻害し、急性肺障害に寄与することが報告されている36 。
AT1受容体を阻害する
病理学につながる最も重要なメカニズムは、制御されていない AngII 活性であり、ウイルスの取り込みに関与していると考えられる AT1R の活性化を増加させることにつながるので、治療行為は、これを防止または阻害することを目的とするべきだ。37 AT1Rアンタゴニストは、ACE2の機能を維持しながら、AngII活性を低下させ、ACE2結合型SARS-CoV-2のAT1R誘発性取り込みを減少させることが期待されている。
AT1R受容体アンタゴニスト
AT1Rアンタゴニストは,降圧薬としてすでに数種類が長年にわたって市場に出回っており,安価で広く使用されており,副作用もほとんどなく,SARS-CoV-2感染症の理想的な治療選択肢となっている。この仮説を示唆しているのは我々だけではなく、他の研究者も同じ結論に達している。
参考
ja.wikipedia.org/wiki/アンジオテンシンⅡ受容体拮抗薬
初期フェーズで有効である可能性
上記の仮説が正しいと仮定すると、AT1R阻害剤(ARB)による治療は、ウイルスの取り込みを制限し、ACE2の機能を維持する可能性があると考えられる。一方、期待される治療効果は、治療が開始される疾患の段階に依存すると考えられる。
初期段階では、AT1Rアンタゴニストによる治療により、ACE2の機能を回復させ、ウイルス負荷の蓄積を防ぐことで、SARS-CoV-2感染に伴う過剰な炎症を完全に抑制することが期待される。一方、ウイルスの複製が細胞の代謝物を使い果たし、炎症反応が過剰なダメージを与えてしまった場合には、AT1Rアンタゴニストではそれ以上の悪化を防ぐことができない可能性がある。
また、SARS-CoV-2感染におけるRAS系の遮断にも害があるのではないかと示唆されている40 。しかし、すでに言及したように、もしアップレギュレーションが起こるならば、他の人も示唆しているように、アップレギュレーションが起こった方が重症化を防ぐ可能性が高い。
結論
SARS-CoV-2はACE2と結合して細胞内に侵入し、細胞膜でACE2欠乏症を引き起こすため、AngIIは持続的に活性化される。AngIIの増加はAT1Rの活性化を誘導し、SARS-CoV-2の取り込みを増加させ、ACE2欠損を増加させ、このようにしてサイトカイン誘導性炎症からなる非特異的免疫応答を維持し、悪化させる。この非特異的免疫応答は、特異的免疫応答がマウントされている間に、ウイルス負荷を低減させようとする試みである。
放置されたAngIIは、最終的には、過剰な炎症によって誘導される呼吸窮迫と、他の臓器へのその劇症的な影響によって死を引き起こす。したがって、SARS-CoV-2誘導性死亡は、以下の3つのメカニズムによって促進される。(i)AngIIの増加は、ACE2が結合したSARS-CoV-2のエンドサイトーシスを誘導し、ACE2欠乏とウイルスの複製を引き起こす。したがって、治療法は、感染の初期段階でのAngIIの「ストーム」を防ぎ、一酸化窒素NOの調節を回復させ、SARS-CoV-2の細胞内への侵入を防ぐことを目的とすべきである。
これらのメカニズムはすべてAT1Rアンタゴニストの標的となる。それらは病的な炎症性苦痛を減少させ、効果的なウイルス特異的な適応免疫応答を促進する環境を提供する可能性がある。
COVID-19におけるsFLT1 / PlGF比の増加:アンジオテンシンIIを介した内皮機能障害への新しいリンク
pubmed.ncbi.nlm.nih.gov/32472588/
COVID-19では、ACE2を介した直接感染による内皮の損傷がs-Flt1/PlGF比の増加をもたらしており、これはAngIIとAng1-7の間の病理学的なアンバランスによるものと考えられる。
我々のデータは、ACE2のダウンレギュレーションとAngII/s-Flt-1を介したED(子癇前症に厳密に似たモデル)との関連性を示唆している。これらの結果は、前述のようにACE2は内皮細胞によってユビキタスに発現していることから、急性のグローバルな血管障害の病態を説明することも可能である。 これらのデータはまた、AngIIを標的とした治療や、sFlt1産生を減少させ、COVID-19に関連した凝固障害に対抗するためのアスピリン13の使用の根拠を提供する。
したがって、COVID-19におけるs-Flt1/PlGF比は、EDの強さを層別化するための簡単な臨床ツールとなり得る。
sFlt-1は内皮細胞または単球によってのみ産生されるので、これらの細胞がCOVID-19に直接感染しているのか、またはそれらの過剰なsFlt-1産生が他の場所で産生されるAngIIのレベルの上昇または炎症性メディエーターへの反応であるのかは、まだ実証されていない。
ACE2の作用
ACE2は肺で多く発現しており、肺線維症、急性肺損傷、急性呼吸窮迫症候群、肺高血圧症(PH)、喘息、慢性閉塞性肺疾患などのさまざまな肺疾患に対して保護作用を示す。
pubmed.ncbi.nlm.nih.gov/27082314/
ACE2は、肺以外では小腸で最も多く発現している。 抗菌性ペプチドおよび微生物の調節と関連しており、レニンアンギオテンシンシステム(RAS)に依存せず食事性アミノ酸ホメオスタシスの調節因子としての役割を有する。
pubmed.ncbi.nlm.nih.gov/22837003/
ACE2の活性化は、ラットの肺内皮機能障害を改善する。
pubmed.ncbi.nlm.nih.gov/29146157/
ACE2の相反する作用
ACE2はSARS-CoV-2が体内に侵入する経路を提供するため、ウイルス感染の可能性が高まる。ただし、ACE阻害剤は直接にはACE2の活動に影響しない。
COVID-19の予後は年齢と性別に関連している。ACE2の発現は加齢とともに減少し、高齢者よりも若者で高く、男性よりも女性で高くなる。このパターンは、COVID-19の重症患者のほとんどが高齢の男性である特徴と一致しない。ACE2の発現レベルが高いか低いかは、COVID-19患者の予後に影響を与える主要な要因ではないと考えられる。
ACE2の枯渇による重症化
COVID-19の重症患者の予後は、慢性基礎疾患を有する高齢患者のACE2活性の低下と関連している可能性がある。SARS-CoV-2感染はACE2受容体を消費し活性を減少させ、Ang II / ACE2調節不均衡などの病態生理学的メカニズムをさらに悪化させる。
onlinelibrary.wiley.com/doi/full/10.1002/jmv.25785
SARSコロナウイルス誘発性肺損傷におけるACE2とレニンアンギオテンシン系の重要な役割 ACE2は重要なSARS-CoV受容体であるため、ACE2に結合するSARS-CoVスパイクタンパク質はACE2発現を低下させ、ACE2発現の喪失は重症急性呼吸不全を引き起こす。
pubmed.ncbi.nlm.nih.gov/16007097/
SARS-Cov2の強いACE2との親和性
doi.org/10.1126/science.abb2507
ステロイドホルモンがACE2の発現を調節
実験動物に関するデータは、17β-エストラジオールが脂肪組織と腎臓の両方でACE2の発現と活性を増加させることを示している。
オスのマウスが、同年齢のメスよりもSARS-CoV感染の影響を受けやすいことが示されている。この高い感受性は、高いウイルス力価、増加した血管漏出および肺胞浮腫と関連していた。
これらの変化は、雄マウスの肺における炎症性単球/マクロファージおよび好中球の蓄積の増加を伴い、単球/マクロファージの枯渇はこれらのマウスを致死的なSARSから部分的に保護した。さらに、自然免疫における性関連の本質的な違いのために、性別の違いはT細胞とB細胞の反応とは無関係であった。
卵巣切除またはエストロゲン受容体拮抗薬によるメスのマウスの治療は、死亡率を増加させた。したがって、SARS-CoV感染マウスにおけるエストロゲン受容体シグナル伝達経路の保護効果を示唆する。。
高脂肪食を与えられた雄マウスは腎臓でのACE2発現の低下を示し、アンジオテンシン(1-7)の低下とアンジオテンシン(1-8)のレベルの上昇をもたらした。
www.mdpi.com/1422-0067/21/8/2948/htm
アンジオテンシン受容体拮抗薬(ARB)
www.sciencedirect.com/science/article/pii/S1043661820312664
ARBがすべての併存症に罹患したCOVID-19患者を保護することを示した主要な前臨床および臨床証拠が最近報告されており、ここに要約する。
- アンジオテンシンII AT1受容体(AT1R)作用の増加によるRAS活動の強化は、心血管系、腎臓、代謝および免疫系に悪影響を及ぼす。
- RASは、COVID-19患者の病気の初期フェーズでさらに刺激される。
- ARBはAT1R受容体を遮断し、すべての臓器の炎症を効果的に軽減する。
- ARBは、高血圧症だけでなく、COVID-19と併存するすべての疾患でも治療的に有効であり、高齢者では忍容性が高く、これらの疾患に一般的に処方されている。
- ARBは、ミトコンドリア機能、インスリンに対する感受性、および凝固カスケードを保護する。
- AT1Rの過剰活動は炎症性肺疾患を促進する。
- ARBは、肺の健康を改善し、SARS CoVによって引き起こされるものを含む細菌やウイルスの損傷から保護し、肺炎関連の死亡率を減らし、肺線維症を改善する。
- ARBは、肺や他の臓器に保護作用をもつ酵素であるACE2をアップレギュレートする。
- 最近のいくつかの出版物は、COVID-19患者におけるARBの有益な効果を報告し、合併症を減らし、死亡率を低下させた。
ACE2阻害?
COVID-19におけるACE2とは何か?
コロナウイルスのACE2を介した細胞内侵入
SARS-CoVはACE2(angiotensin converting enzyme-2)に結合した後、エンドソームに輸送され,酸性環境下で活性のあるプロテアーゼ、カテプシンL により S 蛋白の解裂及び細胞融合活性が誘導され細胞質内へと侵入する。
jsv.umin.jp/journal/v56-2pdf/virus56-2_165-172.pdf
www.ncbi.nlm.nih.gov/pmc/articles/PMC3700180/
ACE2受容体と結合するSARS-CoV2スパイクタンパク質の生物物理学的特性は、COVID-19の病因の増加を説明する
ACE2は、アルツハイマー病ではアミロイドβおよびタウ病理の増加に関連して減少する。
www.ncbi.nlm.nih.gov/pmc/articles/PMC5123239/
ACE阻害薬とアンジオテンシン受容体拮抗薬による重症COVID-19病のリスク:830万人を含むコホート研究
heart.bmj.com/content/early/2020/07/31/heartjnl-2020-317393
背景 アンジオテンシン降圧酵素(ACE)阻害薬やアンジオテンシン受容体拮抗薬(ARB)と COVID-19 疾患との関連性については不明な点が多い。我々は、これらの薬剤を処方された患者が重度のCOVID-19病に罹患し、それに伴う集中治療室(ICU)への入院を受けるリスクに変化があるかどうかを検討した。
方法 英国の一般診療所1205施設から日常的に収集したデータを用いたプロスペクティブコホート研究で、20~99歳の828万人が参加した。Cox比例ハザードモデルを用いて、ACE阻害薬およびARB薬への曝露について、社会統計学的因子、併用薬、地域を調整した調整HRを導出した。主要アウトカムは以下の通りであった。(a) COVID-19 RT-PCRで診断された疾患、および(b) COVID-19でICUケアを受けた疾患。
所見 COVID-19病変を有する患者19人486人のうち、1286人がICU治療を受けた。ACE阻害薬はCOVID-19病のリスクを有意に減少させたが(調整後HR 0.71、95%CI 0.67~0.74)、ICU治療のリスクの増加はなかった(調整後HR 0.89、95%CI 0.75~1.06)、幅広い交絡因子を調整してもCOVID-19病のリスクは増加しなかった。ARBの調整HRはCOVID-19疾患で0.63(95%CI 0.59~0.67)、ICUケアで1.02(95%CI 0.83~1.25)であった。
COVID-19病に対する民族性とACE阻害薬およびARBとの間には有意な相互作用があった。ACE阻害薬と関連したCOVID-19疾患のリスクは、白人群(調整HR 1.05、95%CI 0.87~1.28)および黒人アフリカ人群(調整HR 1.31、95%CI 1.08~1.59)よりもカリブ人群(調整HR 0.66、95%CI 0.63~0.70)の方が高かった。ARBを伴うCOVID-19のリスクは、白人群(調整HR 0.56、95%CI 0.52~0.62)よりも黒人アフリカ人群(調整HR 1.24、95%CI 0.99~1.58)の方が高かった。
解釈 ACE阻害薬とARBは、幅広い変数を調整した後のCOVID-19疾患のリスク低下と関連している。ACE阻害薬もARBもICUケアを受けるリスクの有意な増加とは関連していない。異なる民族間でのばらつきは、COVID-19病の感受性と重症度に対するACE阻害薬/ARBの民族特異的な効果の可能性を示唆しており、さらなる研究が必要である。
ACE2の次は?
pubmed.ncbi.nlm.nih.gov/32442259/
ADAM17
急性肺損傷の病態におけるRAASの役割は、アンジオテンシンII 1型受容体(AT1R)を介したシグナル伝達を中心にしているようである。これまでの研究では、AT1Rのノックアウトおよび低分子阻害により、酸誘発性肺障害が緩和されることが示されている[11]。
AT1Rによって制御される主要な酵素は、ジシンテグリン・メタロプロテアーゼ17(ADAM17)[17]であり、この酵素は、膜結合したACE2を切断し、可溶性ACE2(sACE2)を放出することでアンジオテンシンIIを阻害しないように導くことが知られている。
ADAM17はさらに、膜結合した腫瘍壊死因子アルファ(TNF-)とインターロイキン-6受容体を切断することができる。それらを血漿中に放出し、プロ炎症性環境を刺激する[18]。
ブラジキニンB1・B2受容体
炎症性サイトカインはさらに、ブラジキニンB1およびB2受容体を増加させることでカリクレイン-キニン系に影響を与え、血管透過性を低下させて炎症性細胞の移動を可能にし、肺水腫を増加させる。
ACE2はB1受容体のリガンドであるdes-Arg9-ブラジキニン[19]を処理し、ACEはB2受容体のリガンドであるブラジキニンを処理するため、ACE2とACE活性を調節することで、SARS-CoV-2感染症に対する有害反応を制御することが可能である。
自然免疫や血管生理に関わるシグナル伝達カスケードとACE2との相互作用については、ヒトにおけるACE2レベルの定量的な測定が行われていないため、その理解が妨げられてきた。
可溶性ACE2
最近の研究では、心不全患者の可溶性ACE2レベルを評価したところ、男性では有意に可溶性ACE2レベルが高いことが明らかになった。この研究では、指標コホートではACE阻害剤とARBの可溶性ACE2レベルへの影響は認められなかったが、検証的コホート研究では両クラスの薬剤で可溶性ACE2レベルが低下していることが明らかになった[20]。
このことは、SARS-CoV-2の発症に影響を与えるさまざまな経路のACE2調節には空間的な特異性が高いことから、可溶性と組織結合型のACE2発現を理解することの重要性を強調している。
ACE2増幅とその治療可能性に関する最新情報
onlinelibrary.wiley.com/doi/abs/10.1111/apha.13513
レニンアンジオテンシン系(RAS)は、様々な疾患の発症に重要な役割を果たしている。RAS の主要なペプチドであるアンジオテンシン II (Ang II) の形成と作用を標的とした治療は、過去 30 年にわたり重要な治療標的とされてきた。
20年前に発見されたモノカルボキシペプチダーゼであるACE-related carboxypeptidase (ACE2)は、Ang IIをAng-(1-7)に分解する触媒的に最も強力な酵素の一つであり、Ang IIとは対照的に臓器保護作用を持つことがますます認められている。RAS酵素としての役割に加えて、ACE2はSARS-CoV-2の主要な受容体である。
このレビューでは、可溶性組換えACE2タンパク質と新規の短いACE2バリアントの潜在的な治療の可能性を含むACE2活性の増幅を達成するために使用されてきた様々な戦略を議論する。
はじめに
その伝統的なビューのレニン-アンジオテンシン系(RAS)は、アンジオテンシンII(Ang II)の生成につながる反応の酵素カスケード、生物学的効果の様々な1-9を持っているRASの主なペプチドを伴う。アンジオテンシンIIは強力な血管収縮剤であり、また、腎臓のナトリウム保持、血圧を維持するアクションを促進し、生存率が出血や他の低血糖状態7-9によって脅かされているときに循環量を維持するためにトリガされたストレス応答の一部である。さらに、アンゴンIIは、腎循環を維持するための鍵となる血行動態作用を持っている。
このペプチドは、しかし、特に慢性的に持続されたときに10-12を維持する場合は、悪影響を与えることができる組織レベルでのアクションの無数を発揮する。このような有害なアクションは、全身血圧と腎血行動態作用13-17に及ぼす影響とは無関係であるプロ炎症性、増殖性、プロアテローム性動脈硬化作用が含まれている。
アンジオテンシンIIはまた、活性酸素種(ROS)の産生を増加させる。この作用は、ニコチンアミド・アデニン・ジヌクレオチド・リン酸(NADPH)の活性化に起因する。
活性酸素の増加は、このペプチド18,19.RAS遮断は、ACE阻害剤とアンゴンIIの形成を阻害したり、アンゴンII型1(AT1)受容体の活性化を阻害することに基づいて、腎臓や心血管疾患のために広く使用されている治療法だ。また、Ang IIの分解を調節する経路も、特に組織レベルでのAng IIのレベルを決定する上で重要である可能性がある20。
しかし、最近まで、糖尿病性腎疾患の実験モデルの腎臓に通常存在し、CKDの多くの原因を持つ患者に存在する可能性が高いRASの過剰活性化に対抗する方法として、Ang II分解を増強することにはほとんど注目されていませんだった。Ang IIの分解にはいくつかの酵素が関与している(図1)。
ACE2
ここでは、2000年に報告されたACEのホモログであるACE関連カルボキシペプチダーゼ(ACE2)に注目する21,22。ACE2 は、ACE22 のメタロプロテアーゼ触媒ドメインと 42%の相同性を有している。ACE2は、ACEとは異なり、唯一の活性ドメイン21,22が含まれている。
ACE2 の可溶性形態が 740 アミノ酸のみであるのに対し、ACE2 の全長形態では 805 アミノ酸を持っている。ACE2は、既存のACE阻害剤のいずれかによって阻害されていない。
そのペプチド基質23,24のC末端から単一アミノ酸を除去する。それは、血管収縮剤のAng IIをAng-(1-7)に変換するために知られているより触媒的に強力な酵素の一つ21,23,25 Ang 1-7はますます血管拡張と酸化ストレスなどのAng IIのものに対抗し、カウンターバランスをとる血管保護とレノ保護特性を持っていることが受け入れられている26-29。
レニンアンジオテンシン系では、ACE2切断のための他の既知の標的ペプチドは、Ang-(1-9) 22-24,30の後続の形成を伴うAng Iである。
ACE2受容体
最近のACE2への関心は、ACE2が現在のCOVID19パンデミックの原因となっているコロナウイルスであるSARS-CoV2の主要な受容体であることを認識した結果、飛躍的に高まっている。遺伝的または薬理学的に誘導されたACE2アブレーションの実験モデルの研究では、一般的に様々な臓器での劇症的な効果が報告されている。
そのため、過去数年の間に、ACE2活性の増強を目的としたアプローチが、様々な病態における治療の可能性について、大きな関心を集めてきたことは驚くに値しない。ACE2/Ang II/Ang (1-7) Axis Two 2000年の研究では、ACE2 21,22と呼ばれる新しい酵素の存在が報告された。この発見は20年前にACE2/Ang-(1-7)軸への関心を生み出した。
臓器保護作用
一般的に、ACE2とAng(1-7)は、臓器保護21,22,27である有益な作用を発揮すると考えられている。ACE2 と他の 2 つのペプチダーゼ、プロリルカルボキシペプチダーゼ(PRCP)とプロリレンドペプチダーゼ(POP)は、Ang II(1-8)から Ang 1-7 を形成する酵素として知られています31-34 。
臓器によって異なる重要性
相対的な重要性は組織によって異なる。例えば、肺や全身循環ではPOPが支配的な酵素であるのに対し、腎臓ではACE2がこの作用に非常に重要である33 。
ANG IからAng 1-7 Iへの変換は、ネプリリジンによって産生される。28,35,36 ACE2は、Ang (1-7)の形成を促進するだけでなく、Ang (1-7)の形成にも寄与する。アンジオテンシン(1-9)は、その後、ACE22,32、ネプリリシン37またはカテプシンA 38によってAng 1-7に変換される可能性がある。興味深いことに、このペプチドはAT2R 39(図2)を活性化することが提案されているので、Ang(1-9)はまた、保護効果に寄与し得る。
このレビューは、ACE2によるAng IIからのAng-(1-7)の形成に限定されていますが、ACE2は他のいくつかのペプチド基質を加水分解することに注意すべきだ。それらは、アペリン (すなわちアペリン-13 とアペリン-36)、オピオイド ペプチド ダイノルフィン A、カリクレイン-キニン系ペプチド des-9Arg ブラジキニン、グレリン、成長ホルモン分泌促進剤23 が含まれる。ACE2の触媒特性に加えて、このタンパク質はまた、非酵素的機能40を発揮する可能性がある。
膜結合型ACE2
大きな関心事として、膜結合型ACE2は、重症急性呼吸器症候群関連コロナウイルス(SARS-CoV)41の受容体であることが知られており、最近ではCOVID-19 42,43の原因となったコロナウイルスであるSARS-COV2の受容体であることが知られている(図2)。
循環ACE2
この酵素は、循環の中で少量しか存在しないが、腎臓や腸33などの特定の臓器で激しく発現している。これらの臓器と比較して、肺のACE2の発現は低い33だが、肺胞II型肺炎細胞44に存在している。
理論的には、COVID-19のスパイクタンパク質に結合することにより、十分な量の可溶性ACE2タンパク質を投与することで、血漿膜中の全長ACE2への付着を減少させることができる45 。
これは、COVID-19治療を受けた患者の感染性を減少させる方法として治療的に使用することができる。ACE2は、アミノ酸トランスポーター46およびインテグリン47と相互作用する。
Ang IIのAng(1-7)への変換
したがって、以下に述べるACE2増幅の前臨床的利益のいくつかは、Ang IIの消散および/またはAngの形成を超えたものである可能性がある(1-7)。しかし、そのような他のメカニズムについてのより多くの証拠が利用可能になるまで、我々は、Ang IIのAng(1-7)への変換が作用機序上の重要なステップであると仮定している25。言い換えれば、Ang IIを低下させ、Ang (1-7)を増加させることは、図に描かれているように、ほとんどの生物学的作用の治療目標である(図 Accepted Article2)。
これまでの研究のほとんどは、健康なボランティアを対象とした実験動物を用いて行われてきた。
ACE2/Ang 1-7/Mas受容体軸の保護効果
最後に、ACE2/Ang 1-7/Mas受容体軸は、様々な臓器やシステムに対して保護効果を発揮することは間違いないと思われる。
心臓線維症の悪化
最後に、ACE2/Ang 1-7/MAS受容体軸は、異なる臓器やシステムを保護する効果があることは間違いないようだが、興味深いことに、別の研究では、心臓ACE活性の増加に関連して、亜全腎摘出ラット腎臓病モデルにおいて、Ang(1-7)が血圧を上昇させ、心臓線維症を悪化させるという劇症的な効果を持つことが報告されている51。52
ACE2活性化方法
ACE2 増幅法 ACE2 活性を高めるためには、レンチウイルス、アデノウイルス、アデノウイルスを介した ACE2 遺伝子の導入、トランスジェニックげっ歯類モデルの作成、ミニサークル DNA の導入、組換え ACE2 タンパク質の投与、ACE2 活性化剤の使用など、実験的にいくつかのアプローチが可能である(表 1)これらのアプローチはいずれもげっ歯類モデルで試みられており、ヒトへの組換えACE2タンパク質の安全な投与が確認されている。以下では、これらの研究と、これまでに研究されてきた前臨床の実体をまとめている。
ACE2の過剰発現
コントロールラットにアンジオテンシンIIを4週間投与したところ、予想されていた収縮期血圧の上昇、体重対体重比の増加、心筋線維症の増加が見られた。54 lenti-mACE2を用いたトランスダクションは、アンジオテンシンIIの注入による心筋線維症の減少と体重比の減少をもたらした。54 この心肥大の改善は、心臓組織におけるACE2の発現増加と関連していた。
アンジオテンシンⅡ誘発性高血圧と同様に、レンチウイルス導入を用いた自然発症高血圧ラット(SHR)の心臓へのACE2遺伝子導入は、高血圧とそれに伴う左室壁厚や血管周囲線維化などの病理学的変化を減衰させた54。
さらに、ACE2過剰発現後のSHRラットでは、左室拡張末期および収縮末期の左室径が増加することで証明されるような心機能の改善が観察された54。
レンチウイルスとアデノ随伴ウイルスシステムの使用はまた、成人動物における心臓特異的なACE2増幅の影響を調べる研究のためのACE2過剰発現トランスジェニック動物を生成することができた。これらのウイルス系は、条件付きトランスジェニックモデルに類似しており、成人期に「オン」にすることができ、したがって発生期のACE2過剰発現の影響による干渉を避けることができる、長期的なin vivoでのACE2過剰発現の利点を有する。
トランスジェニックマウスは健康そうに見えても、早死にした。その生存率の低下は、2つのトランスジェニック系統のACE2過剰発現の程度と相関しており、トランスジェニック遺伝子の用量効果を示唆している55。しかし、両方のトランスジェニックから得られた心臓は基本的に正常であった。
また、トランスジェニックと非トランスジェニックの子孫は、心エコー検査でも似たような結果が得られた。さらに、心臓カテーテル検査による心室性能も同様であった55。トランスジェニックマウスの死亡率は、最終的にはhACE2トランスジェニックマウスの伝導障害と致死的な心室性不整脈を明らかにした電気生理学的解析によって説明できる。
成人動物におけるウイルス性ACE2過剰発現による心機能とACE2トランスジェニックマウスで報告されている心機能との間には、発達上の問題があるのかどうかについては、今後も検討が必要である。血圧Yamazato Mら56は、ACE2の長期的な血圧への影響を示している。
この研究では、SHRラットは、正常血圧のWistar-Kyotoラットと比較して、吻側ベントロ側髄質(RVLM)の心血管系調節ニューロン内のACE2タンパク質の発現が相対的に不足しいた。
RVLMへのレンチウイルス注射によるACE2の過剰発現によるSHRラットのこの欠乏の試みられた補正は、血圧の長期的な減少をもたらした56.These中央ACE2過剰発現は、SHRラットの実質的な血圧の低下につながる、RVLMと、上記の議論心臓ACE2過剰発現54と同様に、その本質的な減少を修正することができた56.Lessian ACE2。
肺肺では、肺高血圧症(PH)などの特定の病態の発症におけるRASの関与は、肺血管系におけるACEの豊富な量から推測されている57,58 高ACEレベルは、おそらくAng IIの過剰な生成に寄与している59 肺高血圧症(PH)。肺動脈圧と抵抗が時間の経過とともに持続的に増加することを特徴とする疾患である59… 肺内ACE2のレンチウイルス過剰発現は、モノクロタリン(MCT)によって誘導されたPHのマウスモデルで試みられた。このモデルでは、レンチウイルスベクターは、持続的かつ効率的にPHの顕著な減衰とPHの逆転と関連していた肺組織の多種多様な細胞にACE2を導入した。
PH誘発性肺損傷は、この疾患の治療のためのアップレギュレーション戦略の可能性のあるターゲットとしてACE2を支持することを示唆している 59 神経系ACE2の神経系における保護的役割についても言及しておくことが重要である。Fengら60は、脳内にhACE2タンパク質を高発現させたトランスジェニックマウスを用いてACE2の効果を研究している。
高血圧の低下、神経虚血後の神経障害の改善や脳梗塞の縮小
この研究では、ACE2の過剰発現は副交感神経緊張と自発的な圧反射感受性の減衰の結果として、神経学的高血圧症の発症を減衰させると結論づけている。特に、神経虚血後の神経障害の改善や脳梗塞の縮小は、ACE2/Ang(1-7)/Mas軸の抗酸化・抗炎症作用に起因すると考えられている。
61 したがって、ACE2は将来的には虚血性脳卒中の予防と治療のターゲットになる可能性がある。
腎臓病
腎臓腎臓病におけるACE2の役割は様々な研究で示されている。Nadarajahらは、ポッドサイト特異的ACE2トランスジェニックマウスを用いて糸球体ACE2過剰発現モデルを作成し、アルブミン尿の早期発症に対する部分的な保護を示した62。ヒトACE2タンパク質を過剰発現させたSTZ誘発糖尿病トランスジェニックマウスでは、中足球タンパク質と中足球数が保存されていた62。
腎臓で過剰発現したACE2が糖尿病動物の糸球体損傷を改善することは、STZラットでのアデノウイルス腎ACE2(Ad-ACE2)過剰発現を用いた研究でも示唆されている63。Ad-ACE2を投与した群では、対照群と比較して収縮期血圧の低下、尿中アルブミン排泄、クレアチニンクリアランス、糸球体硬化指数の改善が認められた。また、Ad-ACE2投与群では、血管内皮増殖因子およびコラーゲンIVタンパク質の発現が低下しいた。
63 Ad-ACE2とACEI63の併用では、ACE阻害の追加的な有益性は認められなかった。これらの研究は全体的に、腎臓のACE2増幅が糖尿病性腎疾患における糸球体損傷の治療における治療標的となりうることを示唆している。
腎臓のACE2ターゲット
ミニサークルDNAデリバリーミニサークルDNAベクターは、細菌プラスミドDNAバックボーンを除去した円形の発現カセットで構成されており、静止状態の細胞/組織での持続的なトランスジェーン発現を提供します64 。我々は、マウスのストレプトゾトシン誘発糖尿病におけるマウス組換えACE2の効果、およびミニサークルDNAベクターを用いた循環ACE2の増加効果を研究した。
65 このアプローチは、血清ACE2活性の持続的な増加と、注入されたアンジオテンシンIIを分解する能力の向上をもたらした(1-8)。64. ACE2で前処理ストレプトゾトシン誘発糖尿病を持つマウスでは、ミニサークル、血漿ACE2タンパク質は、ウエスタンブロットで示されるように増加し、ACE2血清活性は100倍以上増加した65尿中ACE2活性と腎臓ACE2は、しかし、血漿中のACE2の深遠な増強にもかかわらず増加しなかった。さらに、この実験的腎臓病の糖尿病モデルで見られた糸球体病変や過濾過は、全く影響を受けていなかった。
これらの知見から、STZモデルに見られるような初期の糖尿病性腎疾患を効果的に治療するためには、血漿中のACE2ではなく、腎臓のACE2を標的とすることが必要ではないかと結論づけた。
組み換えACE2
組換えACE2.ACE2.ACE2の全長形態は、805アミノ酸(aa)からなる110-120kDaのタンパク質である。それは、主要な細胞外ドメイン(aa 1-740)、およびはるかに小さい:膜貫通領域(aa 741-768)、および細胞内テール(769-805)66,67を含むタイプI膜貫通タンパク質だ。ACE2の細胞外ドメイン(1-740 aa)は、完全で機能的な触媒ドメインを含むため、酵素的に活性である。ヒト組換えACE2これまでのところ、細胞外740 N末端アミノ酸(aa)からなる可溶性組換えACE2の形態は、前臨床研究と臨床研究の両方で主に使用されている。
Wysockiら25は、Ang II輸液中にACE2を投与するとAng IIが効果的に分解され、その過程で血圧が正常化することをマウスモデルで示した。
今井ら68はhrACE2を用いて実験的に急性肺損傷に対する効果を検討した。今井ら68は、誤嚥誘発性急性肺損傷マウスモデルを用いて、酸処理したAce2ノックアウトマウスにヒト組換えACE2(hrACE2)を注入し、急性肺損傷の程度の低下と肺水腫形成を観察した。
また、健康なヒトのボランティアにおけるアンジオテンシンIIのレベルを低下させることが示されている。上記のすべては、心不全のためにhrACE2を使用した治療法が有望と思われることを示唆している。本試験は無作為化、二重盲検、プラセボ対照で行われた。-健康なヒトを対象にhrACE2(1-740 AA)の良好な忍容性が示されたことに加え、本試験ではhrACE271の単回投与および反復投与の両方で全身のAng IIレベルが抑制されることが明らかになった。
ACE2は急性肺損傷の動物モデルに関与している68,72。急性呼吸窮迫症候群(ARDS)患者において、hrACE2(GSK2586881)は良好な忍容性を示した73。ヒトのrACE2は循環中のAng IIレベルの低下を引き起こした73一方、アンジオテンシン(1-5)およびアンジオテンシン(1-7)レベルは上昇し、48時間上昇し続けた73。
ClinicalTrials.gov(NCT01597635)に登録されたこの探索的試験では、正常な界面活性剤の構造と炎症反応の抑制に寄与する有益なバイオマーカーと考えられている界面活性剤プロテインD(SP-D)がhrACE2投与群でプラセボ群と比較して増加した。
しかし、この小規模試験では、hrACE2投与はARDSの他の生理的・臨床的指標の改善には至らず、この試験は早期に終了した73.Accepted Article
肺動脈性肺高血圧症におけるhrACE2の治療的役割の可能性を示唆した最近の第IIa相、非盲検パイロット試験から、励みになるが、まだ非常に予備的な知見が引き出された74。この研究では、肺動脈性肺高血圧症の被験者において血漿中ACE2活性の低下が認められた。これは、血漿中のAng IIとAng(1-7)の比率が高いことから推測されたが、Ang IIからAng(1-7)への変換に影響を与える他の酵素の変化によって影響を受ける可能性があるため、この比率は特異的なものではない。
PH 被験者のベースラインでは、対照群と比較して、9 種類のサイトカイン(インターロイキン(IL)-10、腫瘍壊死因子 IL-13、IL-8、IL-4)のうち 6 種類のサイトカインの発現が増加した。抗酸化酵素と考えられている血漿スーパーオキシドジスムターゼ2(SOD2)の減少、および酸化ストレスパラメータの増加も観察された74。hrACE2投与後、IL-10、IL-2などのサイトカインは投与2時間後に減少した。
ヒトrACE2投与はSOD2レベルにも有益な影響を与え、血漿酸化ストレスを減少させることが報告されている。これらの知見は限られた被験者数に基づいている。肺炎の治療薬としてのhrACE2のさらなる評価には、より大規模な研究が必要であることは確かである。
表2にヒト可溶性組換えACE2を用いたこれまでの研究の概要を示す。
げっ歯類組換えACE2ヒトrACE2は臨床研究で使用できる蛋白質の最終形態であるが、げっ歯類を用いた前臨床研究にはいくつかの限界がある。ヒトrACE2はげっ歯類を用いた急性試験では確かに使用可能である。
しかし、マウスモデルへの投与2週間後にACE2の酵素活性を低下させる抗体が開発されているため、慢性研究での価値は限られている25,75。
実際、我々は、マウスのrACE2投与後の血清ACE2活性の持続的な上昇を文書化した75、それによって、マウスでの慢性研究におけるACE2増幅のための適切な戦略を提供しているマウスrACE2を投与した場合、そのような中和抗体の形成を引き出すべきではあらない。
しかし、マウスとヒトのrACE2は、RASペプチドに対する酵素的効果の点で同一ではないことに留意しなければならない。
マウスとヒトの両方の組換えACE2が受け入れられた記事
promoteはAng IIの分解を促進し、Ang(1-7)75,76の形成を誘導するが、ヒト組換えACE2のみがAng Iを分解してAng-(1-9)75,76を形成する。実験的には、マウスのインタクト(1-740)のrACE2を用いて、Ang IIによってマウスに誘導された高血圧への効果を評価した。
この点では、可溶性rACE2の単回注射は、循環ACE2活性の顕著な増加を引き起こし、Ang IIの超生理的用量(1ug/g体重)の後、数分以内にこのペプチドの循環レベルが正常化し、血圧はACE2を注入していない動物よりも急速に低下した75 ヒト組換えACE2のインタクト(1-740)も同様の結果を示す同様の実験に使用されている。
75 rACE2の効果が循環に制限されていることは、その投与が健康なマウスの心臓25,65、腎臓25,65、または尿中のACE2活性の顕著な増加をもたらさなかったという観察によって示唆された25,65,77。軽度のアルブミン尿のみの糖尿病マウスでは、rACE2も尿中に現れなかった65,77。
対照的に、糸球体ろ過障壁が重症化したアルポートマウスモデルでは、可溶性rACE2投与後に尿中ACE2が大量に増加していることがわかった65。
可溶性rACE2の分子サイズが大きい(100-110 kDa)65,77は、無傷またはわずかに損傷した糸球体のバリアを通過することができない。
さらに、可溶性ACE2 1-740はホモ二量体を形成する傾向があり、実際のサイズがさらに大きくなるため、糸球体の基底膜通過の可能性をさらに低下させる76,77.rACE2投与により可溶性ACE2の循環レベルが著しく上昇し、Ang II誘発性高血圧25,75,78またはレニン過剰発現マウスモデルに起因する高血圧を効果的に消滅させることができる。79 したがって、可溶性ACE2の使用は、二次的に腎障害を引き起こす可能性のある全身性RAS活性化に関連した状態の治療に応用できる可能性があると考えられる。
対照的に、糖尿病性腎疾患80 のような局所的な腎臓RASの過剰活性化が予想される状態では、可溶性rACE2の使用は、腎臓障害を二次的に引き起こす可能性のある全身性RAS活性化に関連する状態の治療に応用できると考えられる。rACE2の1-740 AAは有効ではないかもしれない。
この考え方と一致するように、我々は、局所腎臓ではあるが全身性のRAS過剰活性を示さない糖尿病マウスモデルであるSTZ処理マウスにおいて、循環ACE2活性の長期増強は、アルブミン尿、GFRまたは腎臓組織学を有益に変化させるのに十分ではないことを見出した65。生物学的製剤の腎標的化は複雑であり、分子サイズを含む多くの要因によって影響を受ける可能性がある81。
腎臓内で過剰に活性化した RAS を有する腎臓病の形態65,82 では、ACE2 の増幅には、糸球体濾過障壁を通過できるほどの短さを持ち、腎臓で再吸収可能な組換え型 ACE2 が必要であり、腎臓特異的な治療効果を直接発揮できると考えた。
これらの考察に基づき、我々は、酵素活性を保持したままの短い分子サイズのACE2バリアントを生成した(以下を参照)。より短い分子サイズのACE2の新規変異体を作製しました我々は、元の可溶性ACE2(100-110 kD)よりもはるかに短い分子サイズ(〜69-71 kD)の2つの新規組換えマウスACE2タンパク質を生成し、試験を行いた。
2つの短いACE2変異体1-605と1-619 AAは、全身的に活性であり、腎臓の糸球体濾過障壁を介して濾過可能にするのに十分短い分子サイズであることがわかっている65,80。さらに、我々は、これらの短いバリアントは、腎臓の尿細管によって可能性があり、したがって、腎臓のACE2活性を増幅し、アンジュIIからアンジュ(1-7)の形成を促進することができることを発見した。この特徴は、急性腎障害のようなRASが過剰に活性化されている腎臓病の広大な配列において、RAS活性化と闘うために魅力的なものとなるはずである。
マウスを用いて、2つの活性を持つ短いACE2タンパク質1-619と1-605の薬物動態を、発蛍光基質であるMca-APK-Dnp65,80に対する血清ACE2活性の測定値に基づいて、静脈内投与後および静脈内投与後のマウスの薬物動態を調べた。
静脈内投与後、ACE2 1-619および1-605は、元の可溶性ACE2の排泄半減期(~1.4時間)と比較して、大幅に延長した循環排泄半減期(~4時間)を示した。また、i.p.投与後の元の可溶性rACE2の排泄半減期は、同程度か、わずかに延長した。ACE2 1-619および1-605変異体のそれよりも長い。
しかし、静脈内注射後と輸液後の両方の短いACE2タンパク質の曲線下面積とピーク血漿中ACE2活性は、元の可溶性ACE2よりもかなり高い値を示し、元の可溶性ACE2と比較して全体的に薬物動態プロファイルが改善されたことを示唆している。
薬物動態データは、元の可溶性rACE2と比較して短いrACE2バリアントの明らかな優位性を示しているが、この効果はACE2活性を測定するために使用される人工基質に依存している可能性があることに注意する必要がある65,80.フッ素原性基質Mca-APK-(Dnp)に対する触媒効率は、元の可溶性rACE2よりも短いrACE2バリアントの両方ではるかに高いことが判明したが、これは一部、この人工基質に対する高い親和性を反映している可能性があります65,80. 天然基質であるAng IIに対しては、短いACE2の変異体と元の可溶性ACE2では触媒効率は類似した。
同様に、生体内での 2 つの短い ACE2 バリアント 1-605 と 1-619 は、元の可溶性 ACE265,80 と同様に、急性の Ang II 誘発性高血圧に対して全身的に同様の効果を示した。このことから、両バリアントは、元の可溶性ACE265,80と同様に、全身循環中の過剰なAng IIを分解し、Ang II投与時の血圧回復を促進していると考えられる。
全身的な効果に加えて、両方の小さなACE2バリアントは、元の可溶性ACE265,80とは対照的に、局所の尿および腎臓のACE2活性の増強にも追加の効果を持っている。これは最近、ACE2欠損マウスに短いACE2変異体と元の可溶性ACE2を投与した実験で実証された。元の可溶性ACE2とは対照的に、両方の小さな組換え変異体は、尿中ACE2活性の増加をもたらした。尿細管再吸収阻害剤であるL-リジン83,84は、尿中のACE2活性をさらに増加させた。
) さらに、短いACE2タンパク質バリアント1-619は、酵素活性状態で腎臓に取り込まれることが実証された。これは、以前にACE2 1-619を注射したACE2欠損マウスから分離された腎臓ではACE2活性の存在によって示されたが、同等量の原著論文を注射した腎臓からは認められなかった。
可溶性 rACE2. さらに、ACE2 1-619を注射したマウスからのex vivoの腎臓皮質溶解物は、PBSまたは元の可溶性rACE2を注射したマウスからの腎臓溶解物よりも有意に多くのAng IIからのAng(1-7)を形成することができた)。これらのデータを総合すると、短いACE2バリアントが活性であり、腎臓でろ過されるのに十分に小さく、さらには、Ang IIからのAng(1-7)形成が増加する程度まで腎臓のACE2活性を増加させることができることを示している。
XNT、ナフタレイン
ACE2 活性化剤 ACE2 の結晶構造は Hernández Prada ら 85 によって解明され、3 つの仮説的な低分子結合ポケットが同定された。これらの研究者は、低分子ライブラリーのインシリコスクリーニングとインビトロ研究を行い、3つのサイトのうち2つは阻害部位であり、3つ目は活性化部位と推定されることを発見した。
同じ研究者85は、その後2つの低分子化合物をACE2活性化剤として同定した。XNTとレゾルシノールナフタレインである。3年後、一般的に動物のいくつかの寄生虫を治療するために使用される薬剤86と呼ばれるDiminazene(DIZE)は、ACE2活性化剤87として提案された。XNTとDIZEの両方が実験的に使用され、ある種の高血圧85-88、肺高血圧89-91のような様々な状態の治療に役立つ可能性がある。
しかし、これらの研究の多くの注意点の一つは、ACE2活性への影響が通常in vivoでは報告されていないことである85,87,89-91,93-100。さらにこれらの研究では、これらの推定されるACE2活性化剤の使用が、Ang IIからAngへの変換の亢進を示すことによって行われたことは示されていない(1-7)。我々のグループは、ビヒクルとXNTを注入したマウスの両方で低レベルの血漿中ACE2活性を報告している65,80。
さらに、Ang II注入後の血漿中のAng(1-7)、Ang IIの切断により生成されるペプチド、およびACE2の基質であるAng IIの血漿中濃度は、XNTの投与によって影響を受けなかった。
したがって、XNTのAng II-Accepted Articleへの影響が示唆された。誘発された高血圧はACE2の活性化によって引き起こされなかった。この仮説を立証するために、ACE2 KOマウスを用いた実験を行った。
ACE2を欠失させたにもかかわらず、XNTはWTマウスで見られた回復と同様に、Ang II注入によって誘発された高血圧からの回復を増強することができた(45)。さらに、XNTおよびDIZEは、マウスおよびラットの腎臓組織を用いたin vitroおよびex vivoでは、マウスまたはヒトのrACE2のいずれかのACE2酵素活性を増加させることができなかった。
この知見と一致して、Ang II分解ex vivoおよびin vitroは、XNTおよびDIZE78によって影響を受けなかった。また、XNTとDIZEは、ACE2 mRNA発現99,101,102の有意な増加を引き起こすことが報告されていることを、しかし、注意する必要がある。
このことは、これら2つの化合物がACE2遺伝子の発現をアップレギュレートし、慢性的にACE2活性を増強させる可能性を示唆している。
Haber ら78 が Ang II 輸液後の ACE2 リプリートマウスで報告した血圧に対する XNT の急性(数分)効果は、このような ACE2 mRNA 発現のアップレギュレーションによって説明されることはないと思われるが、最近では、卵白脱皮マウスでは、ACE2 遺伝子の発現が有意に増加することが報告されている。最近、卵白由来のトリペプチドIRW(Ile-Arg-Trp)は、無細胞系でhrACE2のACE2活性を増加させ、また培養細胞103のACE2 mRNA発現をアップレギュレートすることが報告された。
我々の知る限りでは、IRW化合物のACE2活性化剤としての有効性を独立して評価できるようなフォローアップ試験は行われていない。現在のところ、研究されていると考えられるACE2活性化剤が、主な作用機序としてACE2を活性化することで、他に疑いの余地のない生物学的効果を発揮しているという説得力のある証拠は、私たちの見解ではない。
ACE2増幅の潜在的な治療作用 以上のことから、腎臓内でのACE2増幅は、Ang IIの代謝を促進し、その有害な作用を軽減するための非常に魅力的な治療アプローチであると仮定するのが論理的だ。ACE2増幅から利益を得られる可能性のある疾患のいくつかは、ACE2活性を増加させることを試みるための方法を議論しながら、すでに述べた。
先に述べたように、STZ誘発糖尿病性腎臓病に対する腎臓の部分的な保護は、ACE2の過剰発現が糸球体ポッドサイトに限定されているトランスジェニックモデルで示された可能性がある62。1つの研究では、ヒト組換えACE2は、秋田マウス104の糖尿病性腎疾患を改善することが示された。これらのマウスにhrACE2を4週間注射したところ、hrACE2は血圧を正常化し、アルブミン尿を減少させた。
また、Ye et al.105、Mizuiri et al.106のマウスを用いた先行研究と同様に、糖尿病性腎臓病患者ではACEとACE2の発現が変化していることが明らかになっている。この研究では、ACE2の発現が低下する一方で糸球体ではACEの発現が増加し、ACE/ACE2比が有意に増加した。
Reichら107は、2型糖尿病とそれに伴う腎臓病患者と対照群から採取した腎生検でACE2とACE m RNAの発現を測定した。糖尿病患者では、対照群と比較して糸球体と近位尿細管のACE2 mRNA発現が半分以上減少したが、ACE mRNAは両コンパートメントで増加した。
Wysockiら65は、STZ誘発糖尿病性腎症マウスにおけるmrACE2の腎臓への影響を調べるとともに、実験的糖尿病誘発前のミニサークルDNA送達を用いた循環ACE2の増幅を検討した。
4週間投与された組換えマウスACE2は、このモデルでは進行した腎臓病理とアルブミン尿を停止することができなかった。ACE2活性の顕著な増加だけでなく、Ang IIの急性負荷を代謝する能力の強化は、ACE2ミニサークルの配信に起因するが、この技術によって達成されたこの増強されたACE2活性は、尿中のACE2活性には影響を与えませんだった。
また、アルブミン尿、糸球体拡張、糸球体細胞数、糸球体サイズの改善は、ビヒクル処理した糖尿病対照群と比較して認められませんだった(図 4)。
(図4) したがって、本研究は、糖尿病性腎症の治療には、循環するRASではなく腎臓を標的とすることが重要であることを強調している。
効果的な治療アプローチを達成するためには、循環ACE2レベルを増加させるだけでは十分ではない可能性があり、糸球体に到達することができる分子を使用してACE2/Ang(1-7)/MasR軸を調節する他の戦略を検討すべきであることを私たち65と他の109によって指摘したように 。
我々は、腎臓でろ過することができ、Ang II80からAng(1-7)の形成を増加させることができる短い分子サイズの新しいACE2バリアントの開発に励まされている。この短いACE2バリアントの治療可能性は、現在、急性および慢性腎障害に対する前臨床試験で検討されている。
ACE2保護のメカニズム仮説
ACE2はコロナウイルスにとってバランスと力学的な問題なのか?
矛盾する事実の1つは、肺のACE-2レベルが高い子供、青年、女性では、低い高齢者、男性よりもCOVID-19感染の予後が良いことである。
考えられる説明のひとつは、予後良好な患者の気道表面液(ASL)において、可溶性ACE-2レベルの増加と組み合わせたACE2に対して、SARS-Cov2が高い親和性をもつこと。 これにより、ウイルス粒子がASLのACE2に結合し、細胞表面に到達する前に封鎖できる可能性が高まる。
ACE1阻害剤の保護作用
COVID-19に感染した肺炎患者へのアンジオテンシン受容体1(AT1R)阻害剤が有益である可能性が示唆されている。
rs.yiigle.com/yufabiao/1181342.htm
コロナウイルスのスパイクタンパク質が細胞結合部位であるACE2に結合すると、ACE2のダウンレギュレーションが起こり、関連する酵素であるACEによるアンジオテンシンの過剰な生成がもたらされる。
アンジオテンシン1受容体の刺激は肺血管透過性の増加をもたらし、それにより肺病変の増加を媒介するため、肺損傷の一因につながる可能性がある。
pubmed.ncbi.nlm.nih.gov/16001071/
pubmed.ncbi.nlm.nih.gov/16007097/
AT1Rブロッカーを慢性的に投薬しているSARS-CoV-2感染患者に続くACE2の発現は、逆説的であるように見えるが、SARSを発症するリスクが高いのではなく、急性肺損傷から保護する可能性がある。
onlinelibrary.wiley.com/doi/pdf/10.1002/ddr.21656
ACE阻害剤/ ARBはACE2を増加させない
これまでのヒトの研究データからは、ACEI / ARBの投与がACE2発現を増加させないことが圧倒的に示唆されている。
pubmed.ncbi.nlm.nih.gov/32320478/
マクロファージ活性化症候群
www.sciencedirect.com/science/article/pii/S002432052030655X