COVID 19:自然免疫からのヒント
pubmed.ncbi.nlm.nih.gov/32524333/
要旨
近年のCOVID-19パンデミックは、私たちの生活に大きな影響を与え、2020年5月までに世界で400万人以上の症例に達するまでに急速に拡大している。これらの症例は、数日間持続する軽度または無症状のものから、人工呼吸療法を必要とし、患者の死に至る可能性のある重度の間質性肺炎まで、極めて多様であることが特徴である。
間質性肺炎の発症と最も重篤な型の発症における感染症と免疫系の相互作用の役割を理解するために、いくつかの仮説が立てられているが、サイトカインストームの役割が重要であると考えられている。
自然免疫は、異なる感染因子とのゲスト相互作用の最初の要素の一つとして、サイトカインストームの発達に重要な役割を果たし、より重篤な形態を後押しする責任がある可能性がある。したがって、この病気の病態を十分に理解するためには、免疫系のこの重要な部分も研究することが重要であると考えられる。また、この病気の治療法を開発するためにも、このテーマの研究が必要とされている。
序論
COVID-19は、2019年後半に中国の武漢地方で出現した重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)[1、2]と呼ばれる新型コロナウイルスの感染症で、世界的に急速に広がり、2020年3月に世界保健機関(WHO)によりパンデミック宣言され、現在では400万人以上の患者が報告されている。
SARS-CoV2ウイルスはコロナウイルス科に属し、ポジティブセンス一本鎖RNAウイルスである[3]。ウイルスのスパイク蛋白質を用いた試験管内試験(in vitro)実験では、アンジオテンシン変換酵素受容体2(ACE2)との親和性が仮定されている [4, 5];これはウイルスへのゲートウェイとして作用し、ウイルスはその後、循環流を介して分布し、いくつかの炎症性疾患と比較されている高炎症を伴う全身反応を誘発する [6]。中国人集団を対象としたいくつかの研究では、予後不良の主な予測因子はIL-6とフィブリノーゲンレベルの上昇と、死亡率に寄与する全身性炎症であることが示されている[7]。
さまざまな研究では、炎症をブロックすることがこの病理学的治療にどのように役立つかを調査しようとしている[8]。研究者たちはエフェクターのメカニズムに注目しているが、微生物に対する最初の防御障壁として機能する自然免疫が免疫反応の活性化を決定する引き金となる役割を理解することが重要である。
被験者の中には、この反応が異常をきたし、免疫が介在することで、ウイルスによるダメージそのものよりもさらに有害なダメージを患者に与える場合もあるようである。これらのメカニズムがどのように作用するかを理解することは、将来的にはこの病気の治療のための更なるアプローチを生み出すのに役立つかもしれない。
トール様受容体
Toll様受容体(TLR)は、自然免疫の発達と活性化に関与するタンパク質であり、病原体関連分子パターン(PAMP)を認識する11種類の膜貫通型受容体タンパク質のファミリーである[9]。コロナウイルスは、免疫応答の活性化につながる急性期のサイトカイン放出、主にIL-6および他のすべてのタンパク質を体内で有意に誘発するようである[10]。
TLR3
感染に対する人体の防御の第一のメカニズムは自然免疫であり、特に、ウイルスは特異的なTLRによって認識される。SARS-CoVやMERSを対象としたいくつかの研究では、コロナウイルスに対する防御反応の発現におけるTLR3の役割が示されている[11]。
TLR3は樹状細胞、胎盤、膵臓に高発現しており、その活性化はTRIF(TIR-domain-containing adapter-inducing interferon-β)経路を介してIRF3(インターフェロン調節因子3)やNF-kBの活性化を決定している[12, 13](図1)。
図1
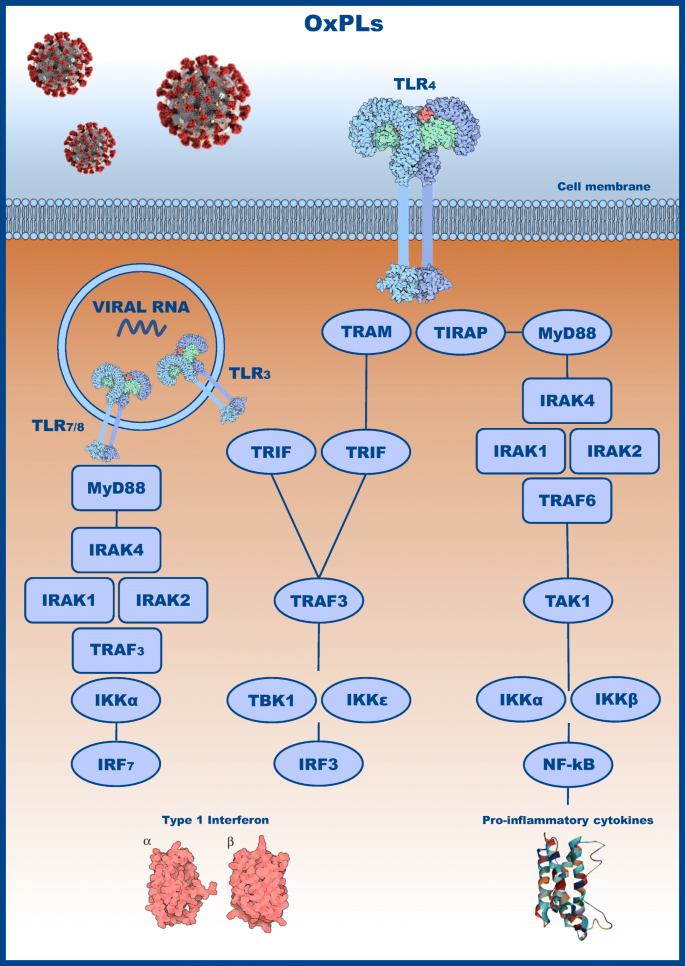
図1に示すように、IRF3とNF-κBの活性化は、IRF3の活性化とNF-κBの活性化に大きく影響を与える。
コロナウイルス感染への応答における、トール様受容体の役割。TLR4は、SARS-CoV2感染によって誘導される酸化リン脂質(OxPL)によって誘発される応答に関与しており、MyD88およびTRIFを介して、I型インターフェロンおよびIL-6およびTNFなどの炎症性サイトカインの産生を活性化する。TLR3およびTLR7/8はエンドソームでウイルスRNAを認識し、MyD88およびTRIFを介してインターフェロン調節因子(IRF3およびIRF7)を活性化する。
マウスモデルでは、Toturaらは、感染後2日目にすでにコロナウイルス感染後のTLR3の転写レベルの増加を実証している;これは、IRF3やNF-kBなどの転写因子の活性化を決定するTRIFなどの下流分子の活性化を決定し、I型インターフェロン(IFNαおよびβ)、炎症性サイトカイン(IL-6、TNF)、およびIFN-γの産生の増加に関連している[11]。
炎症性サイトカインの産生における役割にもかかわらず、TLR3のノックアウトマウスは、IL-6、IFNβ、TNF、および炎症性サイトカインの発現を低下させない。したがって、TLRシグナル伝達に連結されたいくつかの経路が、同じ炎症性カスケード上で下流に伝達されるサイトカインの産生に寄与し、その結果として増幅される可能性がある[12,13,14,15]。
TRIFとMyD-88
一方、アダプター蛋白質の中和は異なる結果をもたらす:コロナウイルス感染におけるTLR経路に関与する主なアダプター蛋白質はTRIFとMyD-88(ミエロイド分化一次応答88)である。TRIFはTLR 3と関連し、IFR3およびNK-kBの活性化を決定し、一方、Myd-88はTLR4およびIRAK1-2およびインターロイキン1(IL1)受容体などのIL1機能に関与するいくつかのタンパク質と相互作用する。
TRIFノックアウトマウスでは、コロナウイルス感染後2日目に炎症性サイトカインとケモカインの産生が減少し、その後IFNβ産生が増加し、4日目には炎症性サイトカインが著しく増加した。
通常、この受容体はグラム陰性菌の LPS に対する応答に重要な役割を果たしており、TLR3 と同様に NF-kB や IRF3 などの転写因子の活性化と関連しており、TLR3 の炎症性カスケードを増幅させる効果がある [16, 17]。Zhouは、マウスモデルを用いて呼吸器ウイルスによって媒介される急性肺損傷を研究し、SARS、H1N1、および他の肺ウイルスに感染した実験動物は、酸化リン脂質の産生によって特徴づけられる肺損傷を有することを示した。
細菌性LPS、TLR4
これらのリン脂質は、細菌性LPSと同様にTLR4の活性化を引き起こし、MyD88とTRIFの活性化を決定し、その結果、炎症性サイトカインの過剰産生を引き起こし、そのうちIL-6は肺損傷の主な決定因子の一つである;IL-6-/-マウスは、コントロールと比較して、炎症性浸潤が減少し、肺損傷が減少した[18]。
これらの観察結果は、COVID-19患者ではIL-6レベルが上昇しているという証拠と相まって、IL-6の重要な病原性の役割があるのではないかという仮説につながった。その結果、IL-6をブロックし、このサイトカインのレベルを調節することは、重症患者の治療法として可能性があると考えられる[19, 20]。
IL-6阻害剤
Tocilizumab(TCZ)は、関節リウマチの治療に使用されるIL-6受容体に拮抗する効果を有する組換えヒト化モノクローナル抗体であり、COVID-19を有する重症患者の治療において重要な役割を果たす可能性がある[21]。トシリズマブの使用に関する最初のパイロット試験では、中国で重症コロナウイルス肺炎患者21人が登録された。この試験では、トシリズマブ投与により体温、動脈性酸素飽和度(SpO2)、C-RP(C-反応性蛋白質)の低下、および酸素要求量の減少が改善されることが示された[21]。
これらの予備的な結果は、トシリズマブと別のIL-6阻害剤であるサリルズマブをCOVID-19の治療に使用する臨床試験のさらなる発展につながった。これらの予備的な心強いデータは、最も重篤な形態の治療戦略の開発につながる可能性があり、有望であると思われる。
TLR7、8
TLR7および8のような他のTLRは、コロナウイルス応答において意味を示すことを示した。通常、TLR7はエンドソーム中の一本鎖RNAを認識し、コロナウイルス、HIV、HCVなどのウイルスのRNAを認識する。
TLR7は、ヒト形質細胞樹状細胞(pDC)やB細胞で高発現しているが、上皮細胞、ケラチノサイト、肝細胞では低レベルで発現している。TLR7はssRNAと結合してMyD88経路を活性化し、その結果、マイトジェン活性化プロテインキナーゼ(MAPK)カスケード、NF-kBなどの経路を活性化する。この活性化により、TNF-アルファ、IL1β、IL-6、IL12、IFN-アルファの発現が増加する。
TLR8はミエロイド細胞で発現し、pDCsでは低レベルであり、TLR7と同様にエンドソームに局在する。エンドソームでの RNA 分解は、TLR8 との結合を引き起こし、その結果、TLR7 と同様の下流の経路で構造変化と MyD88 の活性化を引き起こす [22,23,24,25]。[22,23,24,25].
同じファミリーの別のウイルスであるSARS-CoVに関する研究は、バイオインフォマティクスモデルにおいて、ウイルスゲノムのいくつかの領域が、TLR7および8を介したTNF-a、IL-6、およびIL-12産生の免疫刺激活性とどのように関連していたかを実証しており、他の一本鎖RNAウイルスよりもほぼ2倍高い[26]。これらの要素はすべて、自然免疫のさまざまなメカニズムの相互リンクと相まって、コロナウイルス誘発性肺炎を免疫介在性疾患とする炎症反応の過剰活性化につながっている。
補体システム
補体系は、血液中に不活性な前駆体の形で存在するタンパク質のグループであり、細菌やウイルスからの防御機構に関与している。補体系は、免疫系のさまざまな要素を活性化するために、古典的経路、代替経路、レクチン経路という3つの異なる経路を介して作用する [27]。
補体系はコロナウイルス感染において重要な役割を果たしているようである。SARS-CoVやMERSなどの他のコロナウイルスに関するいくつかの研究では、C3-/-マウスは正常マウスと比較してウイルスレベルに差がないため、補体系がウイルスのクリアランスに直接関与していないことが示されている;しかしながら、より減衰した形態の肺損傷が存在する。
SARSに似た疾患を持つマウスの肺では、リンパ球、好中球、マクロファージ、樹状細胞などの炎症性浸潤を伴う補体が豊富に存在していた。C3-/-マウスでは、リンパ球浸潤に差はなかったが、炎症性表現型で浸潤する好中球やマクロファージに顕著な差があり、明らかに減少していた。
このことは、それらの存在が補体の局所的な活性化に関係している可能性を示唆している[28, 29]。これらの知見は重要であると思われる。好中球とマクロファージは、いくつかのコロナウイルス媒介型のSARSにおいて、肺胞損傷において病原性の役割を果たしており、その局在は肺組織の最も損傷した部位と相関している。
C5a、C5b阻害剤
最近の予備的データでは、COVID-19患者における補体系の重要性が強調されている[32]。小規模な研究では、COVID-19患者の妊娠中の5例で胎盤補体沈着の存在を示し、組織学的には補体沈着に関連した血管絨毛と胎児血管内血栓症の証拠を示した[33]。
これらの理由から、COVID-19の治療に補体系阻害薬の使用が開始された。最初に使用された薬剤は、膜攻撃複合体の生成に関与するC5a、C5bへの切断を阻害するヒトモノクローナル抗体であるエクリズマブであった。この構造は、補体系が活性化した結果、細胞膜を破壊して細胞を死滅に導く膜貫通チャネルを生成する[27]。
エクリズマブによるこの経路の阻害は、現在、様々な血液疾患の治療のターゲットとなっている。[34]COVID-19におけるエクリズマブの使用に関する最初のデータは、4人の患者の症例シリーズから得られたものである;治療後、すべての患者は最初の48時間以内に臨床的に改善し、炎症性マーカー(ESRとC-RPの両方)が減少した。[35]
エクリズマブに加えて、小型ペプチジン系C3阻害薬のAMY-101がCOVID-19肺炎の1例に使用された。この薬剤は血液疾患を対象に開発中であり、未承認である[36]。投与後、患者の病状は48時間後に急速に改善したが、白血球減少およびリンパ球減少はより緩やかに改善した;これらの臨床検査値は呼吸器性能の改善および酸素要求量の減少と関連していた。[37]
単球とマクロファージ
マクロファージなどの免疫細胞の関与は重要であるように思われる;COVID-19患者の剖検における最初の研究では、主にマクロファージと単球からなる広範な免疫浸潤が認められ、好中球、好酸球、CD4リンパ球を伴っていることが明らかにされた[38]。
マクロファージの役割は、他のコロナウイルス感染症で観察される免疫応答から推測することができる。SARS-CoVは、付属タンパク質であるオープンリードフレーム8(ORF-8)を有する[39]。このタンパク質は、細胞内ストレス機構の活性化、リソソーム損傷、オートファジーの活性化を決定する。
ORF-8
具体的には、マクロファージレベルでは、ORF-8は、インフラマソームの構造タンパク質であるクライオピリンとも呼ばれるNLRP3と相互作用する細胞内凝集体を引き起こし、その活性化を決定する[40]。インフラマソームは多タンパク質複合体であり、自然免疫系の一部であり、炎症反応の活性化に関与している。
インフラマソームの活性化は、プロ-IL-1 βやプロ-IL18などのプロ炎症性サイトカインを切断するタンパク質分解酵素であるプロ-カスパーゼ-1をリクルートして活性化させる。これは、細胞内病原体の認識に続いて、細胞が炎症性サイトカイン、ケモカイン、およびその後の炎症性細胞の走化性の排出に関連したプログラムされた細胞死を経る、ピロプトーシスと呼ばれる特定の形態のプログラムされた細胞死を導く。特に、IL18の放出はIFNγの産生を刺激し、これはTH1分極の発達を決定し、適応免疫の発達に寄与する[41,42,43,44,45,46]。
SARS-CoV-2ゲノムの研究では、SARS-CoV ORF-8領域との類似性が高いことが証明されているため、SARS-CoV-2感染症でも同様の現象が起こると考えられ、マクロファージによるインフルマソームの活性化が、より重篤な感染症患者で観察される重要な炎症反応を決定する重要な役割を果たしていると推測される[47, 48]。
IL-1
マクロファージによるインターロイキン1放出は、インフルファゾームを介したマクロファージによるインターロイキン1放出が、血球貪食細胞性リンパ組織球症(sHLH)感染症の二次的な形態に類似した免疫系の過活動化の症状を伴う、COVID-19の最も攻撃的な形態の原因となるサイトカインストームに寄与している[49]。
IL1の病因的役割は、重要な治療上の意味合いにつながる可能性がある。イ ンフラナソームによって誘導される炎症性シグナル伝達経路に作用する組換えIL-1受容体アンタゴニストであるアナキンラは、様々な二次性HLH状態と同様に、サイトカインストームをブロックすることができる[50]。いくつかの症例報告では、COVID-19肺炎の難治性形態におけるアナキンラの有効性が評価されている。
アナキンラを皮下投与された9人の患者の症例シリーズでは、失敗例は1例のみで、他の8人は臨床状態の改善、酸素流量および血液炎症マーカーの低下が認められた[51]。現在、ClinicalTrials.govにはすでに13件の臨床試験が登録されており、IL-1-RA Anakinraの阻害剤単独または他の薬剤と比較してその有効性を検討している[52]。
好中球
COVID-19感染時の全血球計数が頻繁に行われ、リンパ球減少を伴う好中球の増加が認められる。しかし、この細胞集団が肺疾患レベルでどのような病理学的役割を果たしているのかは未だ不明である[1]。解剖学的には、COVID-19で死亡した患者のいくつかの症例シリーズでは、患者の肺に好中球の著しい浸潤が認められている[28]。しかしながら、好中球の病原性役割に関するデータは、他の形態のコロナウイルスによる生体内試験(in vivo)および試験管内試験(in vitro)感染から得られる。
多形核細胞(PMN)
マウスでは、肺出血性病変は多形核細胞(PMN)による炎症性浸潤の同じ分布をたどる。PMNはまた、ウイルスのクリアランスや治癒や損傷部位の再上皮化に関与する成長因子の産生を介して治癒過程にも寄与している[29]。
Channappanavarら[53]によると、ウイルス感染は、ウイルスタンパク質の発現と上皮細胞の局所的な損傷をもたらし、PMN細胞の浸潤を導く。PMN細胞はサイトカインやケモカインの局所的な産生に寄与しており、特に肺細胞とPMN細胞の相互作用はこの効果を増幅させる。試験管内試験(in vitro)での研究では、PMN細胞がコロナウイルスに感染したI型上皮性肺胞細胞(AT1)と連結されると、炎症性サイトカイン(IL-18)のmRNAレベルの発現が増加したことが実証されている。
IL-1a、IL-1b、およびTNF-a)、CXCケモカイン(CXCL-1、CXCL-2、IP-10、およびCXCL-11)、およびCCケモカイン(CCL-2、CCL-4、CCL-7、CCL-9、CCL-12、およびCCL-22) [54]。
したがって、それらの役割は二項対立的に見えるであろう;一方では、好中球は炎症細胞の初期リクルートにおけるアクターとしての役割を果たすことができる;他方では、それらの作用が十分に相殺されているように見えない場合には、それらは組織損傷に寄与することができる[55]。
インターフェロン
三つのインターフェロン
インターフェロン(IFN)は、自然免疫応答および適応免疫応答に関与するシグナル伝達タンパク質のファミリーであり、異なるエフェクタータンパク質を介して、ウイルス複製の阻害に重要な役割を持つ[56, 57]。インターフェロンには、I型(インターフェロンαβ)、II型(インターフェロンγ)、III型(インターフェロンλ)の3種類がある。
I型IFN
3つすべてがコロナウイルス感染からの防御に関与している可能性が高いが、I型IFNはこの分野で最も研究されており、彼の役割は特に感染の初期段階で優勢に見える[58]。I型IFNの産生は、2つの細胞質タンパク質を介してウイルスRNAによって増強される。RIG-1(レチノイン酸誘導遺伝子I)およびMDA5(メラノーマ分化関連タンパク質5)である。これらの細胞質受容体によるウイルスRNAの認識は、IRF3の活性化につながり、I型IFの転写開始を決定し、感染症の解決に寄与する[59]。
コロナウイルス感染症におけるインターフェロンの重要性は、健康なボランティアで観察されている;1980年代のHigginsら[60]は、83名の健康なボランティアを対象とした研究で、組換えIFNαの経鼻投与がコロナウイルス感染症に対する保護効果と関連していることを強調している。特に、IFNα投与群では、症状の重症度と鼻腔内ウイルス負荷の両方が有意に低いことが観察され、呼吸器系コロナウイルスに対する顕著な保護効果が示された。
IFN産生阻害
コロナウイルスファミリーの様々なメンバーは、異なる方法でIFN産生を阻害することができる。SARS-CoV-2は、他のコロナウイルスのタンパク質と同様に、転写を阻害することによって、またはエフェクター機構に作用することによって、タイプIFN経路に作用する、nsp1、nsp3、nsp16、ORF3b、ORF6、およびMおよびNタンパク質を含むいくつかのタンパク質を有する[58, 61, 62, 63]。
特に、IFNシグナルを阻害する能力は、異なるファミリーメンバーの間で異なる;MERS-CoVやSARS-CoVのようなより攻撃的なファミリーメンバーは、インターフェロン活性のより顕著な阻害を有する一方で、軽度のインフルエンザ感染を担当するヒトコロナウイルスHKU1は軽度のIFN阻害を有しており、したがって、IFNがどのようにしてウイルスの複製を減衰させ、その結果として病原性を減少させるかという仮説に貢献している[64]。
IFNの重要性の実証として、Trouillet Assantらは、26人の重症患者におけるCOVID-19のI型IFN免疫プロファイリングを評価した。彼らは、症状発症から8〜10日後にIFNα2産生のピークを観察した。少数の患者群ではIFN-I産生が抑制されており、特にIFN-α産生のない患者では予後が悪く、集中治療室での入院期間が長くなっていた [65]。
この観察から、COVID-19疾患におけるIFNの使用を比較するさまざまな臨床試験が行われている。これらの試験のうち、1つはすでに登録段階を終えている(An investigation into beneficial effects of interferon beta 1a, compared to interferon beta 1b and the base therapeutic regiment in moderate to severe COVID-19: a randomized clinical trial; ClinicalTrials.gov Identifier. NCT04343768)、
その他は現在も登録中(ClinicalTrials.gov Identifier. NCT04320238、NCT04350671、NCT04343976、NCT04254874)[66]。また、感染リスクの高い医師へのIFNα-1bの単独またはチモシンα皮下投与の効果を評価するために開発された臨床試験(NCT04320238)では、IFNの保護的役割が探求されている[66,67,68]。
結論
COVID-19に関する知識は徐々に増えてきているが、その病態生理学的・疫学的側面を理解するためには、さらなる研究が必要である。多くの知見は、試験管内試験(in vitro)実験や他のコロナウイルスから得られたものである[47, 48]。
現在のところ、無症状型と重度の肺障害を伴う全身型との間で適切な予測を可能にする要素がまだ不足している。免疫系の過剰活性化は、患者の死につながる肺および全身の損傷に大きく寄与している[62、63]。防衛の第一の要素として作用する自然免疫は、他のメカニズムと合わせて、患者の治療や少なくとも疾患の病態をよりよく理解するための有望なターゲットとなり得る。

